Contenu non disponible en français
 Este texto consolidado es de carácter informativo y no tiene valor jurídico.
Este texto consolidado es de carácter informativo y no tiene valor jurídico.Incluye la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 2: #pr]
I
La Constitución española reconoce en su artículo 43 el derecho a la protección de la salud, y encomienda a los poderes públicos la organización y tutela de la salud pública a través de la adopción de las medidas preventivas que se consideren necesarias.
La Ley 14/1986, de 25 de abril, General de Sanidad, estableció la obligación de las Administraciones públicas sanitarias de orientar sus actuaciones prioritariamente a la promoción de la salud y la prevención de las enfermedades, evitar las actividades y productos que, directa o indirectamente, puedan tener consecuencias negativas para la salud y regular su publicidad y propaganda comercial.
El consumo de tabaco representa el principal factor de riesgo de enfermedad y de mortalidad en los países desarrollados, por lo que su regulación y el control de su consumo debe ser una prioridad en salud pública. La vigente regulación de los productos del tabaco, desde el punto de vista de la salud pública, está contenida, fundamentalmente, en dos normas.
Por un lado, la Ley 28/2005, de 26 de diciembre, de medidas sanitarias frente al tabaquismo y reguladora de la venta, el suministro, el consumo y la publicidad de los productos del tabaco, que constituye la norma general básica del Estado sobre el tabaco, desde el punto de vista de la salud pública.
Por otro lado, el Real Decreto 1079/2002, de 18 de octubre, por el que se regulan los contenidos máximos de nicotina, alquitrán y monóxido de carbono de los cigarrillos, el etiquetado de los productos del tabaco, así como las medidas relativas a ingredientes y denominaciones de los productos del tabaco, que recoge en nuestro ordenamiento jurídico el contenido de la Directiva 2001/37/CE, de 5 de junio de 2001, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros en materia de fabricación, presentación y venta de los productos del tabaco. Mediante el Real Decreto 639/2010, de 14 de mayo, se modificó el Real Decreto 1079/2002, de 18 de octubre, para adaptar su contenido a lo dispuesto en la Ley 28/2005, de 26 de diciembre.
Posteriormente, se han aprobado diversas normas comunitarias que han dado forma a un nuevo marco jurídico regulador del tabaco a nivel europeo que hace necesario la adaptación al mismo de nuestro ordenamiento jurídico.
En primer lugar, la Directiva 2014/40/UE del Parlamento Europeo y del Consejo, de 3 de abril de 2014, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros en materia de fabricación, presentación y venta de los productos del tabaco y de los productos relacionados, y por la que se deroga la Directiva 2001/37/CE, aprobada con la finalidad de facilitar el buen funcionamiento del mercado interior del tabaco y los productos relacionados en la Unión Europea, sobre la base de un nivel elevado de protección de la salud humana, y para cumplir las obligaciones contraídas en el Convenio Marco de la OMS para el Control del Tabaco.
En segundo lugar, la Directiva Delegada 2014/109/UE de la Comisión, de 10 de octubre de 2014, que modifica el anexo II de la Directiva 2014/40/UE, estableciendo la biblioteca de advertencias gráficas que han de utilizarse en los productos del tabaco, así como diversas decisiones de ejecución que desarrollan diversos aspectos de su contenido y que se pueden agrupar en tres bloques.
Por un lado, las decisiones relacionadas con la ubicación de las advertencias sanitarias, como son la Decisión de Ejecución (UE) 2015/1735 de la Comisión, de 24 de septiembre de 2015, sobre la posición exacta de la advertencia general y del mensaje informativo en el tabaco para liar en petaca, y la Decisión de Ejecución (UE) 2015/1842 de la Comisión, de 9 de octubre de 2015, relativa a las especificaciones técnicas sobre la presentación, el diseño y la forma de las advertencias sanitarias combinadas de los productos del tabaco para fumar.
Por otro lado, las decisiones relacionadas con el formato electrónico común para las notificaciones, como son la Decisión de Ejecución (UE) 2015/2183 de la Comisión, de 24 de noviembre de 2015, por la que se establece un formato común para la notificación de cigarrillos electrónicos y envases de recarga, la Decisión de Ejecución (UE) 2015/2186 de la Comisión, de 25 de noviembre de 2015, por la que se establece un formato para la presentación y la puesta a disposición de información sobre los productos del tabaco, y la Decisión de Ejecución (UE) 2016/586 de la Comisión, de 14 de abril de 2016, relativa a las normas técnicas para el mecanismo de recarga de los cigarrillos electrónicos.
Finalmente, las decisiones y el reglamento de ejecución relativos a ingredientes, como son la Decisión de Ejecución (UE) 2016/787 de la Comisión, de 18 de mayo de 2016, por la que se establece una lista prioritaria de aditivos contenidos en los cigarrillos y el tabaco para liar sujetos a obligaciones de notificación reforzadas, el Reglamento de Ejecución (UE) 2016/779 de la Comisión, de 18 de mayo de 2016, por el que se adoptan normas uniformes relativas a los procedimientos para determinar si un producto del tabaco presenta un aroma característico, y la Decisión de Ejecución (UE) 2016/786 de la Comisión, de 18 de mayo de 2016, por la que se adopta el procedimiento relativo a la creación y al funcionamiento de un grupo consultivo independiente que asista a los Estados miembros y a la Comisión al determinar si los productos del tabaco tienen un aroma característico.
En tercer y último lugar, se debe tener en cuenta también lo dispuesto en el Reglamento (CE) n.° 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) n. º 1907/2006.
II
El objeto de este real decreto es la transposición parcial de la Directiva 2014/40/UE del Parlamento Europeo y del Consejo, de 3 de abril de 2014, en los aspectos relativos a la fabricación, presentación y comercialización de los productos del tabaco y de los productos relacionados, incluyendo la trazabilidad y las medidas de seguridad de los productos del tabaco, sustituyendo la regulación contenida en el Real Decreto 1079/2002, de 18 de octubre, que queda derogado.
El real decreto regula determinados aspectos relacionados con la fabricación y la comercialización de los productos del tabaco, los productos novedosos, los dispositivos susceptibles de liberación de nicotina y envases de recarga y los productos a base de hierbas para fumar. Hay que destacar que se regulan por primera vez, desde el punto de vista de salud pública, los productos novedosos del tabaco y los productos a base de hierbas para fumar.
También se incorporan las disposiciones de la citada directiva en materia de etiquetado y envasado de los productos del tabaco, como la obligatoriedad de incluir determinadas advertencias sanitarias en todas las unidades de envasado, así como en todo embalaje exterior. Además, la norma desarrolla la habilitación contemplada en el artículo 3.7 de la Ley 28/2005, de 26 de diciembre, y regula los contenidos y componentes de los productos del tabaco.
La norma recoge también la regulación de los laboratorios de verificación, así como el procedimiento para su autorización.
Por último, la norma crea tres nuevos registros como son el de fabricantes, importadores y distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga, el de fabricantes, importadores y distribuidores de productos a base de hierbas para fumar, y el de laboratorios de verificación.
III
El real decreto se estructura en cinco títulos, dos disposiciones adicionales, tres disposiciones transitorias, una disposición derogatoria, cinco disposiciones finales y dos anexos.
El título preliminar, «Disposiciones generales», establece el objeto del real decreto, su ámbito de aplicación y las definiciones de los términos expresados a lo largo del articulado.
El título I, «Productos del tabaco», consta de tres capítulos. El capítulo I, dedicado a «Ingredientes y emisiones», fija los niveles máximos de emisiones para los cigarrillos comercializados o fabricados en España, así como los métodos de medición, y los ingredientes de los productos del tabaco.
El capítulo II, dedicado a «Etiquetado y envasado», recoge las novedades introducidas por la directiva en materia de etiquetado y envasado de productos del tabaco. Se actualizan requisitos sobre el etiquetado y el envasado de los productos del tabaco mediante la obligatoriedad de la inclusión de advertencias sanitarias combinadas en todas las unidades de envasado, así como todo embalaje exterior, de los productos del tabaco para fumar, además de otras advertencias de texto y de mensajes informativos. Estas medidas están en línea con el Convenio Marco de la OMS para el Control del Tabaco, ratificado por España el 30 de diciembre de 2004, que contempla en su artículo 11 que las advertencias sanitarias en el etiquetado de los productos del tabaco, en forma de imágenes o pictogramas, suponen un instrumento adecuado para reducir la demanda de tabaco. Además, se prevé que las unidades de envasado de los productos del tabaco se etiqueten de forma única y segura, y se registren sus movimientos a fin de facilitar el seguimiento y rastreo de estos productos en la Unión. Se prevé también la introducción de medidas de seguridad que faciliten la verificación de la autenticidad de los productos del tabaco, si bien, en principio, solo quedan sujetos al sistema de seguimiento y rastreo y a las medidas de seguridad los cigarrillos y el tabaco para liar.
El capítulo III, dedicado a los «Productos del tabaco novedosos y tabaco de uso oral», regula las obligaciones de comunicación previas a la comercialización de los primeros, que debe incluir los estudios científicos disponibles y los de investigación de mercado, y sigue prohibiendo la comercialización en España del tabaco de uso oral, como ya hiciera el Real Decreto 1079/2002, de 18 de octubre, que ahora se deroga.
El título II, «Dispositivos susceptibles de liberación de nicotina y envases de recarga», se divide en tres capítulos. El capítulo I contiene «Disposiciones relativas a la comercialización» de estos productos. Su regulación, además de la incorporación del derecho comunitario, viene dada por su creciente importancia, debido a los recientes desarrollos del mercado a nivel europeo que han hecho necesaria su inclusión al ser productos relacionados con el tabaco. Se regulan las obligaciones de comunicación en relación con estos productos, los ensayos y los requisitos de control y verificación.
El capítulo II crea y regula el Registro de Fabricantes, Importadores y Distribuidores de estos productos, y su funcionamiento.
El capítulo III se dedica a los efectos adversos que pueden producir estos productos, a las actuaciones que se deben llevar a cabo y a su vigilancia.
En el título III, bajo el epígrafe «Productos a base de hierbas para fumar», se regulan los requisitos de estos productos, como las obligaciones de comunicación o su etiquetado. Además, se crea y regula el Registro de Fabricantes, Importadores y Distribuidores de estos productos, y su funcionamiento.
El título IV se dedica a la «Verificación y control» y regula el Plan anual de verificación, el procedimiento para autorizar los laboratorios de verificación y crea un registro con la finalidad de recopilar y ordenar la información sobre éstos.
La norma concluye con dos disposiciones adicionales, tres disposiciones transitorias, una disposición derogatoria, cinco disposiciones finales y dos anexos.
La disposición final segunda modifica el Decreto 2484/1967, de 21 de septiembre, por el que se aprueba el texto del Código Alimentario Español, para suprimir el apartado 3.25.80 de la sección 8.ª del capítulo XXV de la Tercera Parte del Código Alimentario Español, dando cumplimiento así a determinadas exigencias específicas para componentes del papel de fumar impuestas a nivel europeo.
IV
En el proceso de elaboración de este real decreto se han recabado los informes de las comunidades autónomas y ciudades de Ceuta y Melilla, y se ha contado con la participación de organizaciones empresariales y sindicales, sociedades científicas y entidades sociales que han sido consultadas en audiencia.
Además, han emitido sus informes preceptivos la Agencia Española de Protección de Datos y el Consejo Económico y Social.
Este real decreto tiene carácter de norma básica y se dicta al amparo de lo dispuesto en el artículo 149.1.16.ª de la Constitución española y en desarrollo de los artículos 24, 25.3 y 40, apartados 5 y 6, de la Ley 14/1986, de 25 de abril.
En su virtud, a propuesta conjunta de la Ministra de Sanidad, Servicios Sociales e Igualdad y del Ministro de Hacienda y Función Pública, de acuerdo con el Consejo de Estado, y previa deliberación del Consejo de Ministros en su reunión del día 9 de junio de 2017,
DISPONGO:
[Bloque 3: #tp]
[Bloque 4: #a1]
El presente real decreto tiene por objeto regular:
a) Los ingredientes y las emisiones de los productos del tabaco.
b) El etiquetado y envasado de los productos del tabaco.
c) La trazabilidad y las medidas de seguridad de los productos del tabaco.
d) Los productos del tabaco novedosos.
e) La comercialización y etiquetado de determinados productos relacionados con los productos del tabaco, en concreto, de los dispositivos susceptibles de liberación de nicotina y envases de recarga y de los productos a base de hierbas para fumar.
f) El Registro de Fabricantes, Importadores y Distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga, el Registro de Fabricantes, Importadores y Distribuidores de productos a base de hierbas para fumar, y el Registro de Laboratorios de Verificación.
g) El procedimiento de verificación y control de los productos del tabaco, los dispositivos susceptibles de liberación de nicotina y los productos a base de hierbas para fumar, así como las funciones y el procedimiento de autorización de los laboratorios de verificación.
[Bloque 5: #a2]
1. Este real decreto será de aplicación a los productos del tabaco y a los productos relacionados especificados en el artículo 1.e) que se fabriquen o comercialicen en España.
2. Este real decreto no será de aplicación a:
a) Los productos incluidos en la definición de medicamento o de producto sanitario que se recogen en el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por el Real Decreto Legislativo 1/2015, de 24 de julio.
b) Los dispositivos susceptibles de liberación de nicotina y los envases de recarga que estén sujetos a autorización en virtud de lo previsto en el Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente, o en el Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 6: #a3]
A efectos del presente real decreto, se entenderá por:
a) «Aditivo»: una sustancia, distinta de las hojas del tabaco, añadida a un producto del tabaco, su unidad de envasado o cualquier embalaje exterior.
b) «Advertencia sanitaria»: advertencia relativa a los efectos adversos para la salud humana de los productos, u otras consecuencias no deseadas de su consumo, incluidas las advertencias de texto, las advertencias sanitarias combinadas, las advertencias generales y los mensajes informativos.
c) «Advertencia sanitaria combinada»: advertencia sanitaria establecida en este real decreto, en la que se combinan una advertencia de texto con la correspondiente fotografía o ilustración.
d) «Alquitrán»: el condensado de humo bruto anhidro y exento de nicotina.
e) «Aroma característico»: un olor o sabor claramente perceptible distinto del de tabaco, debido a un aditivo o una combinación de aditivos, incluidos frutas, especias, hierbas, alcohol, caramelo, mentol o vainilla entre otros, que sea perceptible antes del consumo del producto del tabaco, o durante dicho consumo.
f) «Aromatizante»: un aditivo que confiere olor y/o sabor.
g) «Cambio sustancial de circunstancias»: un incremento de, al menos, un 10% del volumen de ventas por categoría de producto en al menos cinco Estados miembros de la Unión Europea, sobre la base de los datos de las ventas transmitidos con arreglo al artículo 11.1 o un incremento del nivel de prevalencia en el grupo de consumidores de menos de 25 años de edad, de cinco puntos porcentuales como mínimo en al menos cinco Estados miembros, para la categoría de producto afectada. No se considera que ha habido cambio sustancial de circunstancias si el volumen de ventas por categoría de producto al por menor no supera el 2,5 % de las ventas totales de los productos del tabaco a nivel de la Unión Europea.
h) «Cigarrillo»: rollo de tabaco que puede ser consumido mediante un proceso de combustión, cuya definición pormenorizada está recogida en los apartados 3 y 6 del artículo 59 de la Ley 38/1992, de 28 de diciembre, de Impuestos Especiales.
i) «Cigarrito»: cigarro puro pequeño cuya definición pormenorizada está recogida en los apartados 1 y 2 del artículo 59 de la Ley 38/1992, de 28 de diciembre.
j) «Cigarro puro»: rollo de tabaco que puede ser consumido mediante un proceso de combustión, cuya definición pormenorizada está recogida en los apartados 1 y 2 del artículo 59 de la Ley 38/1992, de 28 de diciembre.
k) «Comercializar»: actividad que consiste en poner productos, con independencia de su lugar de fabricación, a disposición de los consumidores, mediante pago o no de dichos productos, incluso mediante la venta a distancia.
l) «Consumidor»: toda persona física que actúe con fines ajenos a sus actividades comerciales, empresariales, ocupacionales o profesionales.
m) «Dispositivo susceptible de liberación de nicotina»: un producto, o cualquiera de sus componentes, incluidos un cartucho, un depósito y el dispositivo sin cartucho o depósito, que pueda utilizarse para el consumo de vapor que contenga nicotina a través de una boquilla. Los dispositivos susceptibles de liberación de nicotina pueden ser desechables o recargables mediante un envase de recarga y un depósito, o recargables con cartuchos de un solo uso.
n) «Distribuir»: actividad que forma parte de la cadena de suministro de un producto y consiste en su comercialización desde el fabricante o el importador hasta el establecimiento minorista.
ñ) «Embalaje exterior»: todo embalaje utilizado para comercializar los productos de tabaco o productos relacionados y que incluye una unidad de envasado o un conjunto de unidades de envasado. Los envoltorios transparentes no son considerados como embalaje exterior.
o) «Emisiones»: todas las sustancias liberadas cuando se da al producto del tabaco, o al relacionado con él, el uso para el que está destinado, como, por ejemplo, las sustancias presentes en el humo o las sustancias liberadas durante el proceso de consumo de productos del tabaco sin combustión.
p) «Envase de recarga»: un receptáculo de líquido que contiene a su vez nicotina, el cual puede utilizarse para recargar un dispositivo susceptible de liberación de nicotina.
q) «Establecimiento minorista»: todo establecimiento en el que se comercializan los productos del tabaco, incluso por parte de una persona física.
r) «Fabricante»: toda persona física o jurídica que fabrica un producto, o que manda diseñar o fabricar un producto y lo comercializa con su nombre o marca comercial.
s) «Importación de tabaco o productos relacionados»: la entrada en el territorio de la Unión Europea de tales productos, a menos que estos, en el momento de su entrada en la Unión, sean incluidos en un procedimiento o régimen aduanero suspensivo, así como su despacho a consumo partiendo de un procedimiento o régimen aduanero suspensivo.
t) «Importador de tabaco o productos relacionados»: el propietario o la persona con derecho de disposición del tabaco y los productos relacionados que se han introducido en el territorio de la Unión.
u) «Ingrediente»: tabaco, un aditivo, así como toda sustancia o elemento presente en el producto elaborado, incluidos el papel, el filtro, las tintas, las cápsulas y la goma adhesiva.
v) «Nicotina»: los alcaloides nicotínicos.
w) «Nivel máximo» o «nivel máximo de emisión»: el contenido máximo o la emisión máxima de una sustancia en un producto del tabaco, en miligramos, incluido un valor igual a cero.
x) «Petaca»: una unidad de envasado de picadura para liar, ya sea en forma de bolsa rectangular con una solapa que cubre la abertura o en forma de petaca de base estable.
y) «Picadura para liar»: producto del tabaco para fumar que cumple los requisitos establecidos en el artículo 59.5 de la Ley 38/1992, de 28 de diciembre.
z) «Poder adictivo»: el potencial farmacológico de una sustancia para causar adicción, un estado que afecta a la capacidad del individuo para controlar el comportamiento, generalmente ofreciendo una recompensa o un alivio de los síntomas de abstinencia, o ambos.
aa) «Portal EU-CEG»: portal común electrónico de entrada para todos los Estados miembros de la Unión Europea en el que se realiza la comunicación sobre los productos del tabaco y los productos relacionados por parte de fabricantes e importadores.
ab) «Producto a base de hierbas para fumar»: producto a base de plantas, hierbas o frutas que no contiene tabaco y se puede consumir mediante un proceso de combustión.
ab) bis «Producto de tabaco calentado»: un producto del tabaco novedoso que se calienta para producir una emisión que contiene nicotina y otras sustancias químicas, la cual es luego inhalada por las personas usuarias, y que, dependiendo de sus características, es un producto del tabaco sin combustión o un producto del tabaco para fumar.
ac) «Productos del tabaco»: los productos que pueden ser consumidos y constituidos, total o parcialmente, por tabaco, genéticamente modificado o no.
ad) «Producto del tabaco novedoso»: producto del tabaco que:
1.º No está comprendido en ninguna de las siguientes categorías: cigarrillos, picadura para liar, tabaco de pipa, tabaco para pipa de agua, cigarros puros, cigarritos, tabaco de mascar, tabaco de uso nasal o tabaco de uso oral; y
2.º Se ha comercializado después del 19 de mayo de 2014.
ae) «Productos del tabaco para fumar»: productos del tabaco distintos de los productos de tabaco sin combustión.
af) «Producto del tabaco sin combustión»: un producto del tabaco que no implique un proceso de combustión, incluidos el tabaco de mascar, el tabaco de uso nasal y el tabaco de uso oral.
ag) «Tabaco»: hojas y otras partes naturales, transformadas o no, de la planta de tabaco, incluido el tabaco expandido y reconstituido.
ah) «Tabaco de mascar»: producto del tabaco sin combustión, exclusivamente para ser mascado.
ai) «Tabaco de pipa»: tabaco que puede ser consumido mediante un proceso de combustión y destinado exclusivamente a ser utilizado en una pipa.
aj) «Tabaco de uso nasal»: un producto del tabaco sin combustión, que se puede administrar a través de la nariz.
ak) «Tabaco de uso oral»: todos los productos destinados al uso oral, con excepción de los productos para inhalar o mascar, constituidos total o parcialmente por tabaco en forma de polvo, de partículas finas o en cualquier combinación de esas formas, en particular los presentados en sobres de dosis o en sobres porosos.
al) «Tabaco para pipa de agua»: un producto del tabaco que puede consumirse mediante una pipa de agua. A efectos del presente real decreto, el tabaco para pipa de agua se considera un producto del tabaco para fumar. En caso de que un producto pueda utilizarse tanto como tabaco para pipa de agua como en calidad de picadura para liar, se considerará picadura para liar.
am) «Toxicidad»: el grado en que una sustancia puede provocar efectos nocivos en el organismo humano, incluidos los efectos a largo plazo, generalmente derivados del consumo o la exposición continuos.
an) «Unidad de envasado»: el envase individual más pequeño de un producto del tabaco o producto relacionado comercializado.
Se añade la letra ab) bis por el art. único.1 del Real Decreto 47/2024, de 16 de enero. Ref. BOE-A-2024-812
Esta modificación tiene efectos desde el 17 de abril de 2024, según establece la disposición final 2.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 7: #ti]
[Bloque 8: #ci]
[Bloque 9: #a4]
1. Los cigarrillos comercializados o fabricados en España no podrán tener niveles de emisión superiores a:
a) 10 mg de alquitrán por cigarrillo.
b) 1 mg de nicotina por cigarrillo.
c) 10 mg de monóxido de carbono por cigarrillo.
2. Las emisiones de alquitrán, nicotina y monóxido de carbono a las que se refiere el apartado anterior se medirán según las normas ISO 4387, 10315 y 8454, respectivamente. La exactitud de la medición se comprobará de acuerdo con lo previsto en la norma ISO 8243.
[Bloque 10: #a5]
1. Los productos del tabaco que se comercialicen en España no podrán:
a) Tener aroma característico.
b) Contener aromatizantes en sus componentes, como filtros, papeles de fumar, envases, cápsulas, o cualquier otra característica técnica que permita modificar el olor o sabor de los productos del tabaco, o intensificar el humo. Los filtros, papeles y cápsulas no podrán contener tabaco ni nicotina.
c) Contener ninguno de los siguientes aditivos:
1.º Vitaminas y otros aditivos que creen la impresión de que un producto del tabaco reporta beneficios para la salud o reduce los riesgos para ésta.
2.º Cafeína, taurina u otros aditivos y compuestos estimulantes asociados con la energía y la vitalidad.
3.º Aditivos con propiedades colorantes durante la combustión.
4.º Aditivos que faciliten la inhalación o la ingesta de nicotina, en el caso de productos del tabaco para fumar.
5.º Aditivos que tengan propiedades carcinogénicas, mutagénicas o reprotóxicas, en adelante CMR, sin combustión.
d) Contener aditivos en cantidades que, sobre la base de datos científicos, incrementen, de forma significativa y mensurable durante el consumo, el efecto tóxico o adictivo o las propiedades CMR de un producto del tabaco.
2. Se exceptúa de lo establecido en el párrafo a) del apartado anterior, los aditivos esenciales para la fabricación de los productos del tabaco, como el azúcar añadido para sustituir al azúcar que se pierde durante el proceso de curado, siempre que estos aditivos no den lugar a un producto con aroma característico y no aumenten de una manera significativa y mensurable el poder adictivo, la toxicidad o las propiedades CMR del producto.
3. Lo establecido en los párrafos a) y b) del apartado 1 no se aplicará a los productos del tabaco distintos de los cigarrillos, de la picadura para liar y de los productos de tabaco calentado.
4. El procedimiento aplicable para la determinación de los aromas característicos a que se refiere el apartado 1.a) será el previsto en el Reglamento de Ejecución (UE) 2016/779 de la Comisión, de 18 de mayo de 2016, por el que se adoptan normas uniformes relativas a los procedimientos para determinar si un producto del tabaco presenta un aroma característico y en la Decisión de Ejecución (UE) 2016/786 de la Comisión, de 18 de mayo de 2016, por la que se adopta el procedimiento relativo a la creación y al funcionamiento de un grupo consultivo independiente que asista a los Estados miembros y a la Comisión al determinar si los productos del tabaco tienen un aroma característico.
5. En el caso de los productos del tabaco con aroma característico cuyas ventas a escala de la Unión Europea representen el 3 % o más de una categoría de producto particular, las disposiciones de este artículo se aplicarán a partir del 20 de mayo de 2020.
6. La Dirección General de Salud Pública, Calidad e Innovación comunicará a la Comisión Europea las medidas que se adopten para dar cumplimiento a lo establecido en este artículo.
Se modifica el apartado 3 por el art. único.2 del Real Decreto 47/2024, de 16 de enero. Ref. BOE-A-2024-812
Esta modificación tiene efectos desde el 17 de abril de 2024, según establece la disposición final 2.
[Bloque 11: #a6]
1. Los fabricantes o importadores de productos del tabaco deberán presentar a la Dirección General de Salud Pública, Calidad e Innovación, en el plazo señalado en el artículo 7, la siguiente información, detallada por marcas y tipos individuales de productos:
a) La lista de los ingredientes, y sus cantidades, utilizados en la fabricación de los productos del tabaco, ordenados por orden decreciente de peso, así como su situación. Se especificará si los ingredientes han sido registrados con arreglo al Reglamento (CE) nº 1907/2006 del Parlamento Europeo y del Consejo, de 18 de diciembre de 2006, y su clasificación con arreglo al Real Decreto 255/2003, de 28 de febrero, por el que se aprueba el Reglamento sobre clasificación, envasado y etiquetado de preparados peligrosos, y al Reglamento (CE) nº 1272/2008 del Parlamento Europeo y del Consejo, de 16 de diciembre de 2008, sobre clasificación, etiquetado y envasado de sustancias y mezclas, y por el que se modifican y derogan las Directivas 67/548/CEE y 1999/45/CE y se modifica el Reglamento (CE) n° 1907/2006.
b) Una declaración con los motivos de la inclusión de los ingredientes en el producto del tabaco de que se trate.
c) Datos toxicológicos de los ingredientes, con combustión o sin ella, y en particular información de sus efectos sobre la salud de los consumidores y los posibles efectos adictivos.
d) En el caso de cigarrillos y de la picadura para liar, un documento técnico en el que figure una descripción general de los aditivos utilizados y de sus propiedades.
e) Los niveles de emisiones especificadas en el artículo 4.
f) Información disponible sobre otras emisiones, sus niveles y los métodos de medición.
2. Los fabricantes o los importadores también estarán obligados a comunicar las modificaciones que afecten a la información a que se refiere el apartado anterior, cada vez que se produzcan.
3. La Dirección General de Salud Pública, Calidad e Innovación comprobará que la documentación aportada se ajusta a lo establecido en los apartados anteriores, pudiendo requerir la remisión de datos no aportados hasta que esté completa.
4. Las comunicaciones previstas en este artículo se realizarán a través del Portal EU-CEG, de acuerdo a lo previsto en la Decisión de Ejecución (UE) 2015/2186 de la Comisión, de 25 de noviembre de 2015, por la que se establece un formato para la presentación y la puesta a disposición de información sobre los productos del tabaco.
[Bloque 12: #a7]
1. La comunicación a que se refiere el artículo anterior se efectuará seis meses antes de la fecha de comercialización, cuando se trate de productos del tabaco nuevos o que hayan sido modificados.
2. Para productos del tabaco comercializados a la entrada en vigor de este real decreto, esta comunicación se efectuará dentro de un plazo de seis meses a contar desde la entrada en vigor del mismo, salvo que esta comunicación ya se haya efectuado previamente, sin perjuicio de que la misma deba ser completada en los términos señalados en el artículo anterior, o que sea modificada, debiendo ser notificada en ambos casos a través del Portal EU-CEG.
[Bloque 13: #a8]
1. Los fabricantes o los importadores de cigarrillos y de picadura para liar que contengan un aditivo incluido en la Decisión de Ejecución (UE) 2016/787 de la Comisión, de 18 de mayo de 2016, por la que se establece una lista prioritaria de aditivos contenidos en los cigarrillos y el tabaco para liar sujetos a obligaciones de notificación reforzadas, deberán realizar estudios exhaustivos donde, para cada uno de los aditivos, se examine si:
a) Contribuye a la toxicidad o poder adictivo de los productos de que se trate, y si ello redunda en un incremento significativo o mensurable de la toxicidad o adictividad de cualquiera de los productos en cuestión.
b) Genera un aroma característico.
c) Facilita la inhalación o la ingesta de nicotina.
d) Conduce a la formación de sustancias que tengan propiedades CMR, y en qué cantidades, y si tiene como consecuencia que se incrementen de manera significativa o mensurable las propiedades CMR en cualquiera de los productos de que se trate.
2. Los estudios tendrán en cuenta el uso previsto de los productos y, además, evaluarán:
a) Las emisiones resultantes del proceso de combustión en que intervenga el aditivo de que se trate.
b) La interacción con otros ingredientes contenidos en los productos de que se trate.
3. Los fabricantes o los importadores que utilicen el mismo aditivo en sus productos del tabaco podrán llevar a cabo un estudio conjunto cuando utilicen dicho aditivo en la composición de productos comparables.
4. Se exceptúan de las obligaciones establecidas en este artículo las pequeñas y medianas empresas definidas en la Recomendación 2003/361/CE de la Comisión, de 6 de mayo de 2003, cuando otro fabricante o importador elabore un informe sobre el aditivo de que se trate.
[Bloque 14: #a9]
1. Anualmente, los fabricantes y los importadores de cigarrillos y de picadura para liar elaborarán un informe que recogerá los resultados de los estudios a que se refiere el artículo anterior, y que tendrá el siguiente contenido:
a) Un resumen de los estudios realizados.
b) Una presentación detallada que recopile la bibliografía científica disponible en relación con cada aditivo, y resuma los datos internos sobre sus efectos.
2. Este informe se remitirá a la Dirección General de Salud Pública, Calidad e Innovación y a la Comisión Europea, en el plazo previsto en la Decisión de Ejecución (UE) 2016/787 de la Comisión, de 18 de mayo de 2016.
3. La Dirección General de Salud Pública, Calidad e Innovación comprobará los datos de dichos informes, pudiendo solicitar al fabricante o al importador información adicional sobre el aditivo en cuestión, que integrará en el mismo informe.
4. Cuando existan dudas razonables sobre los estudios o los resultados aportados en los informes, la Dirección General de Salud Pública, Calidad e Innovación, la Comisión Europea o algún Estado miembro podrán exigir que éstos sean objeto de revisión inter pares a cargo de un organismo científico independiente, en particular por lo que respecta a su exhaustividad, su metodología y sus conclusiones, de acuerdo con la Decisión de Ejecución (UE) 2016/787, de 18 de mayo de 2016.
5. Se exceptúan de las obligaciones establecidas en este artículo las pequeñas y medianas empresas definidas en la Recomendación 2003/361/CE de la Comisión, de 6 de mayo de 2003, cuando otro fabricante o importador elabore un informe sobre el aditivo de que se trate.
[Bloque 15: #a1-2]
1. La información presentada de conformidad con lo dispuesto en los apartados 1 y 2 del artículo 6 y en los apartados 1 y 2 del artículo 8, estará disponible en la página web del Ministerio de Sanidad, Servicios Sociales e Igualdad, con las limitaciones previstas en la normativa vigente.
2. De la información a que se refiere el apartado anterior, los fabricantes o los importadores estarán obligados a especificar aquella que consideren sujeta a secreto comercial, al objeto de adoptar las medidas necesarias para su protección.
[Bloque 16: #a1-3]
1. Los fabricantes o los importadores de los productos del tabaco que se comercialicen en España deberán presentar:
a) Los estudios internos y externos de que dispongan sobre investigación de mercado y preferencias de diferentes grupos de consumidores, incluidos los jóvenes y los fumadores actuales, en relación con los ingredientes y las emisiones.
b) Los resúmenes operativos de cualquier estudio de mercado que lleven a cabo con motivo del lanzamiento de nuevos productos.
c) Información sobre el volumen de ventas, especificado por marcas y tipos individuales, en unidades de tabaco en rollo o en kilos, sobre una base anual.
2. Esta información se comunicará a la Dirección General de Salud Pública, Calidad e Innovación siguiendo el formato establecido en la Decisión de Ejecución (UE) 2015/2186 de la Comisión, de 25 de noviembre de 2015. La primera comunicación se realizará dentro de los seis meses siguientes a la entrada en vigor de este real decreto y, posteriormente, se presentará con carácter anual dentro del primer trimestre de cada año.
[Bloque 17: #ci-2]
[Bloque 18: #a1-4]
1. Cada unidad de envasado y el embalaje exterior de los productos del tabaco incluirá en castellano las advertencias sanitarias a que se refiere este capítulo.
2. Las advertencias sanitarias irán rodeadas de un borde negro de 1 mm de ancho en el interior de la superficie reservada a la advertencia, excepto en el caso de las advertencias sanitarias a que se refiere el artículo 17.
3. Las imágenes de las unidades de envasado y del embalaje exterior se ajustarán a lo dispuesto en el presente capítulo.
[Bloque 19: #a1-5]
1. Las dimensiones que deberán adoptar las advertencias sanitarias a que se refiere este capítulo se calcularán en relación con toda la superficie, cuando el paquete esté cerrado.
2. Las advertencias sanitarias ocuparán la totalidad de la superficie de la unidad de envasado o del embalaje que se les haya reservado, y no deberán ser objeto de comentario, paráfrasis o referencia de ningún otro tipo.
[Bloque 20: #a1-6]
1. Las advertencias sanitarias de la unidad de envasado y del embalaje exterior se imprimirán de forma inamovible e indeleble y serán totalmente visibles. No deberán estar parcial o totalmente disimuladas o separadas por timbres fiscales, medidas de seguridad, envoltorios, bolsas, cajas o cualquier otro objeto, marca o leyenda que deba ser mostrada.
2. Las advertencias sanitarias no deberán separarse al abrir la unidad de envasado, salvo cuando se trate de paquetes con cierre abatible donde, en todo caso, quedará asegurada la integridad gráfica, la visibilidad del texto, las fotografías y la información relativa al abandono del tabaquismo.
3. Las advertencias sanitarias no deberán en ningún caso disimular u ocultar los timbres fiscales, las marcas para seguimiento y rastreo o las medidas de seguridad de las unidades de envasado.
4. Las advertencias sanitarias de las unidades de envasado de los productos del tabaco distintos de los cigarrillos y de la picadura para liar en petacas podrán fijarse mediante adhesivos, a condición de que éstos no puedan despegarse.
[Bloque 21: #a1-7]
1. Las unidades de envasado y el embalaje exterior de los productos del tabaco para fumar incluirán la advertencia general «Fumar mata».
2. Además, las unidades de envasado y el embalaje exterior de los productos del tabaco para fumar incluirán el mensaje informativo «El humo del tabaco contiene más de 70 sustancias cancerígenas».
3. Respecto a su ubicación, se tendrá en cuenta lo siguiente:
a) En los paquetes de cigarrillos y en los paquetes de picadura para liar en forma de paralelepípedo, la advertencia general estará impresa en la parte inferior de la superficie lateral de la unidad de envasado, y el mensaje informativo estará impreso en la parte inferior de la otra superficie lateral. Estas advertencias serán de 20 mm de anchura, como mínimo.
b) En los paquetes en forma de cajetilla de cuerpo superior articulado en la que la superficie lateral se divide en dos partes cuando se abre el paquete, la advertencia general y el mensaje informativo estarán impresos íntegramente en la zona más grande de esas dos superficies. La advertencia general también figurará en la superficie interior de la tapa que queda visible cuando se abre la cajetilla. La cara lateral de este tipo de paquete tendrá una altura, como mínimo, de 16 milímetros.
c) En la picadura para liar en petaca, la advertencia sanitaria y el mensaje informativo estarán impresos en las superficies que permitan la visibilidad completa de las advertencias sanitarias.
d) En los paquetes de picadura para liar de forma cilíndrica, la advertencia general estará impresa en la superficie exterior de la tapa y el mensaje informativo en la superficie interior de la tapa.
4. La advertencia general y el mensaje informativo deberán:
a) Cubrir el 50 % de la superficie en la que estén impresos.
b) Estar impresos en negrita, en caracteres tipográficos Helvética, negros sobre fondo blanco, con un tamaño de punto tipográfico de los caracteres que permita ocupar el mayor espacio posible en la superficie reservada al efecto.
c) Estar centrados en el espacio reservado para su impresión. En los paquetes en forma de paralelepípedo, y en todo embalaje exterior, serán paralelos al borde lateral de la unidad de envasado.
5. Se exceptúa de lo establecido en el apartado anterior, la picadura para liar en petaca, para la que la Comisión Europea establecerá la posición exacta de la advertencia general y del mensaje informativo.
[Bloque 22: #a1-8]
1. Cada unidad de envasado y el embalaje exterior de los productos del tabaco para fumar incluirán advertencias sanitarias combinadas.
2. Las advertencias sanitarias combinadas:
a) Constarán de una de las advertencias de texto enumeradas en el anexo I y de la correspondiente fotografía en color especificada en la biblioteca de imágenes del anexo II.
b) Incluirán información relativa al abandono del tabaquismo, como números de teléfono, direcciones de correo electrónico o sitios Internet cuyo objetivo sea informar a los consumidores de los programas existentes para ayudar a las personas que quieran dejar de fumar.
c) Cubrirán el 65 % de la cara externa de las superficies anterior y posterior de la unidad de envasado, así como de todo embalaje exterior. Los paquetes de forma cilíndrica presentarán dos advertencias sanitarias combinadas situadas de forma equidistante la una de la otra y cubriendo el 65 % de su mitad respectiva de la superficie curva.
d) Mostrarán idénticas advertencias de texto y fotografías en color correspondientes en ambas caras de las unidades de envasado y de todo embalaje exterior.
e) Estarán ubicadas en el borde superior de la unidad de envasado o de todo embalaje exterior, y aparecerán en la misma dirección que otra información que aparezca en dicha superficie del embalaje.
f) Se reproducirán de acuerdo con el formato, la presentación, el diseño y las proporciones especificadas por la Comisión, que se detallan en las Decisiones de Ejecución (UE) 2015/1735 de la Comisión, de 24 de septiembre de 2015, sobre la posición exacta de la advertencia general y del mensaje informativo en el tabaco para liar en petaca, y la Decisión de Ejecución (UE) 2015/1842 de la Comisión, de 9 de octubre de 2015, relativa a las especificaciones técnicas sobre la presentación, el diseño y la forma de las advertencias sanitarias combinadas de los productos del tabaco para fumar.
g) Respetarán, en las unidades de envasado de los cigarrillos, las siguientes dimensiones:
1.º Altura: no menos de 44 mm.
2.º Anchura: no menos de 52 mm.
3. Las advertencias sanitarias combinadas se agruparán en tres juegos, según la forma establecida en el anexo II. Cada juego se podrá utilizar durante un año natural, empezando a contar desde la entrada en vigor de este real decreto, y se alternarán de manera que se garantice la aparición regular de cada advertencia en una cantidad igual de unidades de envasado por cada marca.
[Bloque 23: #a1-9]
1. Los productos del tabaco para fumar distintos de los cigarrillos, de la picadura para liar, del tabaco para pipa de agua y de los productos de tabaco calentado estarán exentos de la obligación de incluir el mensaje informativo contemplado en el artículo 15.2 y de las fotografías en color especificadas en la biblioteca de imágenes del anexo II, que forman parte de las advertencias sanitarias combinadas contempladas en el artículo 16.
2. Cada unidad de envasado y el embalaje exterior de estos productos deberá llevar la advertencia general especificada en el artículo 15.1, que cumplirá los siguientes requisitos:
a) Incluir una referencia a los servicios para el abandono del tabaquismo contemplada en el artículo 16.2.b).
b) Aparecer en la cara más visible de la unidad de envasado, así como en todo embalaje exterior, y cubrir un 30 % de la cara exterior de la superficie correspondiente de la unidad de envasado y de todo embalaje exterior. En caso de que deba aparecer en una superficie superior a 150 cm², la advertencia cubrirá un área de 45 cm².
c) Cumplir los requisitos especificados en los párrafos b) y c) del artículo 15.4.
d) El texto deberá ser paralelo al texto principal que figura en la superficie reservada a esas advertencias.
e) La advertencia general irá rodeada de un borde negro de no menos de 3 mm y no más de 4 mm de ancho. Este borde aparecerá fuera de la superficie reservada a la advertencia general.
3. Además, cada unidad de envasado y el embalaje exterior de estos productos deberá llevar una de las advertencias de texto contempladas en el anexo I, que:
a) Se imprimirá en la siguiente superficie más visible de la unidad de envasado, así como en todo embalaje exterior.
En las unidades de envasado con cierre articulado, la siguiente superficie más visible será la que se haga visible al abrir la cajetilla.
b) Cubrirá un 40 % de la cara exterior de la superficie correspondiente de la unidad de envasado y de todo embalaje exterior. En caso de que deba aparecer en una superficie superior a 150 cm², la advertencia cubrirá un área de 45 cm².
c) Irá rodeada de un borde negro de no menos de 3 mm y no más de 4 mm de ancho. Este borde aparecerá fuera de la superficie reservada a las advertencias sanitarias.
Las advertencias de texto mencionadas en este apartado se alternarán de manera que se garantice la aparición regular de cada advertencia en una cantidad igual de unidades de envasado por cada marca.
Se modifica el título y el apartado 1 por el art. único.3 del Real Decreto 47/2024, de 16 de enero. Ref. BOE-A-2024-812
Esta modificación tiene efectos desde el 17 de abril de 2024, según establece la disposición final 2.
[Bloque 24: #a1-10]
1. En las unidades de envasado y en el embalaje exterior de los productos del tabaco sin combustión figurará la siguiente advertencia sanitaria: «Este producto del tabaco es nocivo para su salud y crea adicción».
2. Esta advertencia sanitaria:
a) Cumplirá los requisitos especificados en los párrafos b) y c) del artículo 15.4.
b) El texto deberá ser paralelo al texto principal en la superficie reservada a esas advertencias.
c) Aparecerá en las dos superficies más grandes de la unidad de envasado, así como en todo embalaje exterior.
d) Cubrirá un 30% de la cara externa de la superficie correspondiente en la unidad de envasado y en todo embalaje exterior.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 25: #a1-11]
1. El etiquetado de cada unidad de envasado, del embalaje exterior y del propio producto del tabaco deberá estar escrito en castellano. No incluirá ningún elemento o característica que:
a) Promocione un producto del tabaco o fomente su consumo suscitando una impresión equivocada sobre sus características, sus efectos sobre la salud, sus peligros o sus emisiones. Tampoco incluirá información alguna sobre el contenido en nicotina, alquitrán o monóxido de carbono.
b) Sugiera que un producto del tabaco en particular es menos nocivo que otro, o que tiene por objeto reducir el efecto de algunos componentes nocivos del humo, o que tiene efectos vitalizantes, energéticos, curativos, rejuvenecedores, naturales, ecológicos u otros efectos positivos sobre la salud o el estilo de vida.
c) Haga referencia a sabores, olores, aromatizantes u otros aditivos, o a la ausencia de estos.
d) Se parezca a un producto alimenticio o cosmético.
e) Sugiera que determinado producto del tabaco ha mejorado en biodegradabilidad o en otras ventajas medioambientales.
2. La unidad de envasado o el embalaje exterior no incluirá indicaciones que sugieran ventaja económica alguna mediante la inclusión de bonos de reducción impresos, ofertas de descuentos, distribución gratuita u ofertas de dos por uno o similares.
3. La unidad de envasado o el embalaje exterior no contendrá elementos o características prohibidos con arreglo a los apartados anteriores, como textos, símbolos, nombres, marcas, signos figurativos, dibujos, fotografías u otros elementos similares.
[Bloque 26: #a2-2]
1. Las unidades de envasado de cigarrillos tendrán forma de paralelepípedo. Las unidades de envasado de la picadura para liar tendrán forma paralelepípeda o cilíndrica o tendrán forma de petaca. Una unidad de envasado de cigarrillos incluirá, como mínimo, veinte cigarrillos. Una unidad de envasado de picadura para liar contendrá tabaco por un peso mínimo de 30 g.
2. Las unidades de envasado de cigarrillos podrán ser de cartón o de un material flexible y no incluirán ninguna abertura que pueda cerrarse o sellarse de nuevo una vez se haya abierto distinta del cierre abatible y del cierre superior articulado. En el caso de las cajetillas de cierre abatible y de cierre articulado, el cierre se articulará únicamente por la parte trasera del paquete.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 27: #a2-3]
1. Todas las unidades de envasado de productos del tabaco estarán marcadas con un identificador único. Con objeto de garantizar su integridad, los identificadores únicos se imprimirán de forma inamovible e indeleble y no deberán quedar en ningún caso disimulados o separados, tampoco por timbres fiscales y etiquetas de precio, o por la apertura de la unidad de envasado. Por lo que se refiere a los productos fabricados fuera de la Unión Europea, las obligaciones establecidas en el presente artículo solo son aplicables a los destinados al mercado de la Unión Europea o comercializados en dicho mercado.
2. El identificador único permitirá determinar lo siguiente:
a) La fecha y el lugar de fabricación.
b) Las instalaciones de fabricación.
c) La máquina utilizada para fabricar los productos del tabaco.
d) El turno de producción o la hora de fabricación.
e) La descripción del producto.
f) El mercado o el establecimiento minorista al que está destinado.
g) La ruta de envío prevista.
h) En su caso, el importador en la Unión.
i) La ruta de envío efectiva, desde la fabricación hasta el primer establecimiento minorista, incluidos todos los almacenes, así como la fecha de envío, el destino, el punto de partida y el destinatario.
j) La identidad de todos los compradores, desde la fabricación hasta el primer establecimiento minorista.
k) Las facturas, los albaranes y los comprobantes de pago de todos los compradores, desde la fabricación hasta el establecimiento minorista.
3. La información de los párrafos a), b), c), d), e), f), g) y, en su caso, h) del apartado anterior formarán parte del identificador único.
4. La información mencionada en los párrafos i), j) y k) del apartado 2 deberá ser accesible mediante un enlace con el identificador único.
5. Todos los operadores económicos que participen en el comercio de productos del tabaco, desde el fabricante hasta el último operador económico anterior al primer establecimiento minorista, deberán registrar la entrada de todas las unidades de envasado de que dispongan, así como todos los movimientos intermedios y el momento en que dejan definitivamente de disponer de ellos. Esta obligación podrá cumplirse mediante el marcado y el registro del embalaje de unidades múltiples, como el cartón, la caja o palet, siempre que siga siendo posible el seguimiento y el rastreo de todas las unidades de envasado.
6. Todas las personas físicas o jurídicas que intervengan en la cadena de suministro de los productos del tabaco deberán mantener un registro completo y preciso de todas las transacciones pertinentes referidas en el presente artículo.
7. Los fabricantes de productos del tabaco deberán suministrar a todos los operadores económicos que participen en el comercio de productos del tabaco, desde el fabricante hasta el último operador económico anterior al primer establecimiento minorista, incluidos los importadores, los almacenes y los transportistas, el equipo necesario para registrar los productos del tabaco adquiridos, vendidos, almacenados, transportados o manipulados de cualquier otra forma. El equipo deberá poder leer y transmitir los datos electrónicamente a una instalación de almacenamiento de datos conforme al apartado 8.
8. Los fabricantes y los importadores de productos del tabaco deben celebrar contratos de almacenamiento de datos con una tercera parte independiente con el fin de albergar la instalación para el almacenamiento de todos los datos pertinentes. La instalación para el almacenamiento de datos estará situada físicamente en el territorio de la Unión Europea. La Comisión Europea aprobará la idoneidad de la tercera parte, en particular, su independencia y sus capacidades técnicas, así como el contrato.
Las actividades de dicha tercera parte serán supervisadas por un auditor externo, propuesto y pagado por el fabricante de productos del tabaco y aprobado por la Comisión Europea. El auditor externo presentará a las autoridades competentes designadas por el Ministro de Hacienda y Función Pública y a la Comisión Europea un informe anual en el que, en particular, evaluará cualquier irregularidad en el acceso.
Las instalaciones de almacenamiento de datos deberán ser completamente accesibles para las autoridades competentes de los Estados miembros, la Comisión Europea y el auditor externo independiente. En casos debidamente justificados, podrá concederse a los fabricantes o importadores acceso a los datos almacenados, sin perjuicio de que la información sensible desde un punto de vista comercial siga estando adecuadamente protegida, de conformidad con el Derecho de la Unión y español aplicable.
9. Ningún operador económico que participe en el comercio de los productos del tabaco podrá modificar ni eliminar los datos registrados.
10. La materia de la trazabilidad de los productos del tabaco será competencia del Ministerio de Hacienda y Función Pública, regulándose por Orden Ministerial las normas de desarrollo y ejecución de las medidas necesarias para asegurar su cumplimiento.
11. La información de carácter personal solo se utilizará de conformidad con las normas y salvaguardias establecidas en la Ley Orgánica 15/1999, de 13 de diciembre, de Protección de Datos de Carácter Personal.
12. Los apartados anteriores se aplicarán a los cigarrillos y a la picadura para liar a partir del 20 de mayo de 2019 y a los productos del tabaco distintos de los cigarrillos y la picadura para liar a partir del 20 de mayo de 2024.
13. Corresponderá al Ministerio de Hacienda y Función Pública dictar las normas técnicas de desarrollo y ejecución relativas a la trazabilidad de los productos del tabaco.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 28: #a2-4]
1. Además del identificador único, contemplado en el artículo 21, las unidades de envasado de los productos del tabaco que se comercialicen en España incorporarán, de forma visible e invisible, una medida de seguridad a prueba de manipulaciones. La medida de seguridad se imprimirá o se colocará de forma inamovible, será indeleble y no deberá quedar en ningún caso disimulada ni oculta, tampoco por marcas fiscales, etiquetas de precio, u otros elementos obligatorios de conformidad con la normativa vigente.
Podrán utilizarse las marcas fiscales reguladas en la normativa de los impuestos especiales como medida de seguridad en las condiciones que reglamentariamente se determinen.
2. Corresponderá al Ministerio de Hacienda y Función Pública dictar las normas técnicas de desarrollo y ejecución relativas a la medida de seguridad.
3. El apartado 1 se aplicará a los cigarrillos y a la picadura para liar a partir del 20 de mayo de 2019 y a los productos del tabaco distintos de los cigarrillos y la picadura para liar a partir del 20 de mayo de 2024.
[Bloque 29: #ci-3]
[Bloque 30: #a2-5]
1. Los fabricantes o los importadores que pretendan comercializar un producto del tabaco novedoso deberán comunicar a la Dirección General de Salud Pública, Calidad e Innovación, a través del Portal EU-CEG, y siguiendo el formato establecido en la Decisión de Ejecución (UE) 2015/2186 de la Comisión, de 25 de noviembre de 2015, la siguiente información:
a) Una descripción pormenorizada del producto del tabaco novedoso en cuestión.
b) Una descripción de las instrucciones de uso.
c) La información sobre los ingredientes y las emisiones que contempla el artículo 6.
2. A la comunicación anterior se deberá adjuntar la siguiente documentación:
a) Los estudios científicos disponibles sobre toxicidad, poder adictivo y atractivo del producto del tabaco novedoso, en particular por lo que se refiere a sus ingredientes y emisiones.
b) Los estudios disponibles, así como resúmenes de los mismos, y las investigaciones de mercado sobre preferencias de diferentes grupos de consumidores, incluidos los jóvenes.
c) Otra información disponible pertinente, incluidos un análisis de riesgo/beneficios del producto, los efectos previstos sobre el abandono del tabaquismo y los efectos previstos sobre la iniciación al consumo del tabaco, así como los efectos sobre la percepción de los consumidores previstos.
3. La comunicación a la que se refieren los apartados anteriores se efectuará seis meses antes de la fecha de comercialización prevista del producto.
4. Asimismo, se comunicará cualquier modificación de la información referida en los apartados anteriores.
5. La Dirección General de Salud Pública, Calidad e Innovación comprobará que la documentación aportada se ajusta a lo establecido en los apartados 1 y 2, pudiendo requerir la remisión de datos no aportados hasta completar la documentación. También podrá solicitar, motivadamente, a los fabricantes o importadores la realización de ensayos adicionales o la presentación de información complementaria.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 31: #a2-6]
1. A los productos del tabaco novedosos que estén incluidos en la definición de productos del tabaco sin combustión prevista en el artículo 3.af), les será de aplicación, además, lo establecido en este real decreto para este tipo de productos.
2. A los productos del tabaco novedosos que estén incluidos en la definición de productos del tabaco para fumar prevista en el artículo 3.ae), les será de aplicación, además, lo establecido en este real decreto para este tipo de productos.
[Bloque 32: #a2-7]
Se prohíbe la comercialización del tabaco de uso oral.
[Bloque 33: #ti-2]
[Bloque 34: #ci-4]
[Bloque 35: #a2-8]
1. Los fabricantes o los importadores que pretendan comercializar dispositivos susceptibles de liberación de nicotina o envases de recarga comunicarán a la Dirección General de Salud Pública, Calidad e Innovación, a través del Portal EU-CEG, y siguiendo el formato establecido en la Decisión de Ejecución (UE) 2015/2183 de la Comisión, de 24 de noviembre de 2015, por la que se establece un formato común para la notificación de cigarrillos electrónicos y envases de recarga, la siguiente información:
a) Nombre y datos de contacto del fabricante y, en su caso, del importador en la Unión Europea.
b) La descripción de la composición del producto, incluido en su caso el mecanismo de apertura y recarga del dispositivo, o de los envases de recarga.
c) La lista de todos los ingredientes del dispositivo susceptible de liberación de nicotina o los ingredientes del envase de recarga, y las emisiones que genere el uso del mismo, especificados por marcas y tipos, incluidas las cantidades de dichos ingredientes.
d) Los datos toxicológicos acerca de los ingredientes y emisiones del producto, incluso sometidos a calentamiento, mencionándose, en particular, sus efectos sobre la salud de los consumidores y teniendo en cuenta, entre otras cosas, su posible efecto adictivo.
e) La información sobre dosificación e ingesta de la nicotina en condiciones de consumo normales o razonablemente previsibles.
f) La descripción del proceso de producción, incluida la producción en serie, y la declaración de que el proceso de producción garantiza la conformidad con los requisitos del presente artículo.
g) Una declaración de que el fabricante y el importador se responsabilizan totalmente de la calidad y seguridad del producto, una vez comercializado y en condiciones de uso normales o razonablemente previsibles.
Esta comunicación también deberá presentarse cuando se produzca cualquier modificación sustancial de los dispositivos susceptibles de liberación de nicotina y envases de recarga comercializados.
2. Además, los fabricantes e importadores de dispositivos susceptibles de liberación de nicotina y envases de recarga deberán presentar a la Dirección General de Salud Pública, Calidad e Innovación, con carácter previo a su comercialización, el diseño del etiquetado, envasado y folleto informativo para cada marca y tipo de producto, al objeto de comprobar que se ajuste a los requisitos establecidos en el artículo 30.
3. La Dirección General de Salud Pública, Calidad e Innovación comprobará que la documentación aportada se ajusta a lo establecido en los apartados 1 y 2, pudiendo requerir la remisión de otros datos para completar esta documentación.
4. Las comunicaciones a que se refieren los apartados 1 y 2 se efectuarán:
a) Para los dispositivos nuevos o que hayan sido modificados, seis meses antes de la fecha de su comercialización.
b) Para los dispositivos susceptibles de liberación de nicotina y envases de recarga comercializados con anterioridad a la entrada en vigor de este real decreto, la notificación se presentará dentro de un plazo de seis meses a partir de la entrada en vigor del mismo, salvo que esta comunicación ya se haya efectuado previamente, sin perjuicio de que la misma deba ser completada en los términos señalados en los apartados 1 y 2, o que sea modificada, debiendo ser notificada en ambos casos a través del Portal EU-CEG.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 36: #a2-9]
1. Los fabricantes e importadores de dispositivos susceptibles de liberación de nicotina y envases de recarga deberán presentar, con carácter anual dentro del primer trimestre de cada año, a la Dirección General de Salud Pública, Calidad e Innovación la siguiente información:
a) Los datos generales de volumen de ventas, por marca y tipo de producto.
b) La información sobre las preferencias de diversos grupos de consumidores, incluidos los jóvenes, los no fumadores y los principales tipos de usuarios actuales.
c) El modo de venta de los productos.
d) Los resúmenes de cualesquiera estudios de mercado realizados con respecto a lo anterior, en castellano o en inglés.
2. Corresponde a la Dirección General de Salud Pública, Calidad e Innovación evaluar la evolución del mercado de los dispositivos susceptibles de liberación de nicotina y de los envases de recarga, y su posible utilización como vía de acceso a la adicción a la nicotina o al consumo tradicional de tabaco, especialmente entre los jóvenes y los no fumadores.
[Bloque 37: #a2-10]
Los dispositivos susceptibles de liberación de nicotina y los envases de recarga deberán cumplir los siguientes requisitos:
a) Que el líquido que contiene la nicotina sea comercializado únicamente en envases de recarga cuyo volumen no sea superior a 10 ml, en dispositivos susceptibles de liberación de nicotina desechables o en cartuchos de un solo uso, y que el volumen de los cartuchos o depósitos no sea superior a 2 ml.
b) Que el líquido que contiene la nicotina no contenga más de 20 mg/ml de nicotina.
c) Que el líquido que contiene la nicotina no contenga ninguno de los aditivos no permitidos a que se refiere el artículo 5.1.c).
d) Que en la fabricación del líquido que contiene la nicotina se usen sólo ingredientes de gran pureza, cuyos estándares de calidad hayan sido definidos por la farmacopea europea o similar, y que toda sustancia que no sean los ingredientes a que se refiere el artículo 26.1.c) estén presentes sólo en niveles de restos, y siempre que sea técnicamente inevitable durante la fabricación.
e) Que, con excepción de la nicotina, en el líquido que contiene la nicotina se usen sólo ingredientes que no sean peligrosos para la salud humana, tanto en forma caliente como fría, y cuyos estándares de calidad se ajusten a lo dispuesto en el párrafo d) de este apartado.
f) Que los dispositivos susceptibles de liberación de nicotina administren las dosis de nicotina de forma constante en las condiciones normales de uso.
g) Que sean seguros para los niños e imposibles de manipular, que estén protegidos contra la rotura y los escapes y que tengan un mecanismo que permita un rellenado sin escapes.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 38: #a2-11]
1. Los fabricantes o los importadores de dispositivos susceptibles de liberación de nicotina y envases de recarga, como responsables de asegurar los requisitos de calidad y seguridad de sus productos, presentarán anualmente un informe con la siguiente información:
a) Los resultados cuali-cuantitativos de los ingredientes de estos productos.
b) El tamaño de la muestra en relación con el tamaño del lote de producción.
c) Los procedimientos analíticos empleados, así como la validación de los mismos.
2. Este informe deberá ser comunicado a la Dirección General de Salud Pública, Calidad e Innovación, durante el primer trimestre del año siguiente a su realización.
[Bloque 39: #a3-2]
1. Las unidades de envasado y el embalaje exterior de los dispositivos susceptibles de liberación de nicotina y envases de recarga deberán cumplir los siguientes requisitos:
a) Incluir una lista de todos los ingredientes que contenga el producto en orden descendente y una indicación del contenido de nicotina y su administración por dosis, el número de lote de fabricación y una recomendación de que se mantenga fuera del alcance de los niños.
b) No incluir elementos ni características de las mencionadas en el artículo 19.1, a excepción de lo previsto en sus párrafos a) y c) referente a la información sobre el contenido de nicotina y los aromas.
c) Llevar la siguiente advertencia sanitaria: «Este producto contiene nicotina, una sustancia muy adictiva. No se recomienda su consumo a los no fumadores». Esta advertencia deberá cumplir los requisitos especificados en el artículo 18.2.
2. Además, las unidades de envasado y el embalaje exterior de los dispositivos susceptibles de liberación de nicotina y envases de recarga deberán incluir un folleto, redactado al menos en castellano, con información sobre:
a) El uso y el almacenamiento, incluidos la advertencia de que el producto no se recomienda para consumo de jóvenes y no fumadores.
b) Las contraindicaciones.
c) Las advertencias a grupos de riesgo específicos.
d) Los posibles efectos adversos.
e) La adicción y toxicidad.
f) Los datos de contacto del fabricante o importador y de una persona física o jurídica en la Unión Europea.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 40: #a3-3]
1. La información presentada de conformidad con lo dispuesto en el artículo 26.1 estará disponible en la página web del Ministerio de Sanidad, Servicios Sociales e Igualdad, con las excepciones previstas en la normativa vigente.
2. De la información a que se refiere el apartado anterior, los fabricantes o los importadores estarán obligados a especificar aquella que consideren sujeta a secreto comercial, al objeto de adoptar las medidas necesarias para su protección.
[Bloque 41: #ci-5]
[Bloque 42: #a3-4]
1. Se crea el Registro de Fabricantes, Importadores y Distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga, con la finalidad de recopilar y ordenar la información sobre éstos y facilitar el ejercicio de las actuaciones administrativas relacionadas con sus posibles efectos adversos.
2. El registro tendrá naturaleza administrativa y estará adscrito a la Dirección General de Salud Pública, Calidad e Innovación, que será el órgano responsable del mismo.
3. Mediante orden de la persona titular del Ministerio de Sanidad, Servicios Sociales e Igualdad se determinarán las características y contenido del registro.
[Bloque 43: #a3-5]
1. En el registro constará la siguiente información relativa a fabricantes, importadores y distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga que tengan su sede social en España:
a) Nombre y datos de contacto del fabricante, importador y distribuidor en España.
b) Nombre y datos de contacto del representante legal.
c) Tipos, marcas y modelos de productos comercializados, con indicación de la referencia identificativa del producto, «ID», asignada por el Portal EU-CEG.
2. En el caso de fabricantes e importadores, la incorporación de esta información en el registro se llevará a cabo de oficio por la Dirección General de Salud Pública, Calidad e Innovación, a partir de los datos aportados al Portal EU-CEG en el contexto de las obligaciones de comunicación a las que se refiere el artículo 26. En el caso de distribuidores, estos comunicarán la información a la Dirección General de Salud Pública, Calidad e Innovación, que la incorporará al registro.
3. La modificación y cancelación de la información contenida en el registro se realizará por la Dirección General de Salud Pública, Calidad e Innovación de acuerdo con lo que determine la normativa que regule el registro.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 44: #ci-6]
[Bloque 45: #a3-6]
1. Los fabricantes, importadores y distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga deberán disponer de un sistema de recopilación de información sobre los posibles efectos adversos de los productos que fabriquen, importen o comercialicen, con el siguiente contenido mínimo:
a) Información sobre los posibles efectos adversos.
b) Información sobre la seguridad y peligrosidad de sus productos.
c) Información sobre la calidad de sus productos.
2. Esta información estará a disposición de la Dirección General de Salud Pública, Calidad e Innovación y de las autoridades sanitarias competentes para su consulta.
[Bloque 46: #a3-7]
1. Los fabricantes, importadores y distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga estarán obligados a adoptar, inmediatamente, la medida correctora necesaria, incluida la retirada temporal o permanente de los productos del mercado, cuando existan indicios de que puedan darse alguna de estas circunstancias:
a) Que los productos sean peligrosos o no sean seguros.
b) Que incumplan las normas de calidad relativas a ingredientes y emisiones establecidas en este real decreto.
c) Que se incumpla cualquier otra obligación establecida para estos productos en este real decreto.
2. En los supuestos previstos en el apartado anterior, los fabricantes, importadores y distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga estarán obligados a remitir, de forma detallada y en el plazo de 24 horas desde que se adopte la medida, a la Dirección General de Salud Pública, Calidad e Innovación, la siguiente información:
a) Riesgo para la salud y la seguridad.
b) Medidas correctoras adoptadas.
La Dirección General de Salud Pública, Calidad e Innovación remitirá esta información a las comunidades autónomas y ciudades de Ceuta y Melilla.
3. Además, los fabricantes, importadores y distribuidores de dispositivos susceptibles de liberación de nicotina y envases de recarga estarán obligados a remitir la información a que se refiere el apartado anterior a las autoridades de supervisión del mercado de los Estados miembros en que esté disponible, o vaya a estar, el producto.
[Bloque 47: #a3-8]
1. De conformidad con lo dispuesto en el capítulo I del título II de la Ley 33/2011, de 4 de octubre, corresponde al Ministerio de Sanidad, Servicios Sociales e Igualdad, a las comunidades autónomas y a las ciudades de Ceuta y Melilla, en el ámbito de sus competencias de organización y gestión de la vigilancia en salud pública, las funciones de vigilancia sobre los riesgos que para la salud humana puedan causar los dispositivos susceptibles de liberación de nicotina y envases de recarga, pudiendo adoptar alguna de las medidas previstas en el artículo 54 de la Ley 33/2011, de 4 de octubre, y en el artículo 26 de la Ley 14/1986, de 25 de abril.
2. Las medidas adoptadas y los datos en que se apoyan se comunicarán a la Comisión Europea y a las autoridades competentes de los demás Estados miembros.
[Bloque 48: #ti-3]
[Bloque 49: #a3-9]
1. Los fabricantes o los importadores de productos a base de hierbas para fumar están obligados a comunicar a la Dirección General de Salud Pública, Calidad e Innovación, a través del Portal EU-CEG, y siguiendo el formato establecido en la Decisión de Ejecución (UE) 2015/2186 de la Comisión, de 25 de noviembre de 2015, lo siguiente:
a) La lista de todos los ingredientes utilizados en la fabricación de los productos, especificados por marcas y tipos.
b) Las cantidades de dichos ingredientes.
2. Además, los fabricantes o los importadores de productos a base de hierbas para fumar deberán presentar a la Dirección General de Salud Pública, Calidad e Innovación, con carácter previo a su comercialización, el diseño del etiquetado y envasado para cada marca y tipo de producto, al objeto de comprobar que se ajuste a los requisitos establecidos en el artículo 39.
3. La Dirección General de Salud Pública, Calidad e Innovación comprobará que la documentación aportada se ajusta a lo establecido en los apartados anteriores, pudiendo requerir la remisión de datos no aportados hasta completar la documentación.
4. Las comunicaciones a que se refieren los apartados 1 y 2 de este artículo se efectuarán:
a) Para los productos a base de hierbas para fumar nuevos o que hayan sido modificados, seis meses antes de la fecha de su comercialización.
b) Para los productos a base de hierbas para fumar ya comercializados con anterioridad a la entrada en vigor de este real decreto, la notificación se presentará dentro de un plazo de seis meses a partir de la entrada en vigor del mismo, salvo que esta información ya se haya comunicado a través del Portal EU-CEG.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 50: #a3-10]
1. La información presentada de conformidad con lo dispuesto en el artículo 37.1 estará disponible en la página web de Ministerio de Sanidad, Servicios Sociales e Igualdad, con las excepciones previstas en la normativa vigente.
2. De la información a que se refiere el apartado anterior, los fabricantes o los importadores estarán obligados a especificar aquella que consideren sujeta a secreto comercial, al objeto de adoptar las medidas necesarias para su protección.
[Bloque 51: #a3-11]
1. Cada unidad de envasado y el embalaje exterior de los productos a base de hierbas para fumar deberá incluir la siguiente advertencia general: «Fumar este producto es nocivo para su salud».
2. La advertencia sanitaria se imprimirá en las caras externas posterior y anterior de la unidad de envasado y en el embalaje exterior.
3. La advertencia sanitaria cubrirá el 30 % de la cara externa de la superficie correspondiente de cada unidad de envasado y de todo embalaje exterior, y deberá:
a) Estar impresa en negrita, en caracteres tipográficos Helvética negros sobre fondo blanco, con un tamaño de punto tipográfico de los caracteres de manera que ocupen el mayor espacio posible en la superficie reservada al efecto.
b) Estar centrada en el espacio reservado para su impresión, y en los paquetes en forma de paralelepípedo y en todo embalaje exterior, paralela al borde lateral de la unidad de envasado.
4. Las unidades de envasado y el embalaje exterior de los productos a base de hierbas para fumar no incluirán ningún elemento o característica que:
a) Promocione el producto o fomente su consumo suscitando una impresión equivocada sobre sus características, sus efectos sobre la salud, sus peligros o sus emisiones.
b) Sugiera que el producto en particular es menos nocivo que otro, o que tiene por objeto reducir el efecto de algunos componentes nocivos del humo, o que tiene efectos vitalizantes, energéticos, curativos, rejuvenecedores, naturales, ecológicos u otros efectos positivos sobre la salud o el estilo de vida.
c) Se parezca a un producto alimenticio o cosmético.
d) Indique que el producto no contiene aditivos o aromatizantes.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 52: #a4-2]
1. Se crea el Registro de Fabricantes, Importadores y Distribuidores de productos a base de hierbas para fumar con la finalidad de recopilar y ordenar la información sobre los mismos.
2. El registro tendrá naturaleza administrativa y estará adscrito a la Dirección General de Salud Pública, Calidad e Innovación, que será el órgano responsable del mismo.
3. Mediante orden de la persona titular del Ministerio de Sanidad, Servicios Sociales e Igualdad se determinarán las características y contenido del registro.
[Bloque 53: #a4-3]
1. En el registro constará la siguiente información relativa a fabricantes, importadores y distribuidores de productos a base de hierbas para fumar que tengan su sede social en España:
a) Nombre y datos de contacto del fabricante, importador y distribuidor en España.
b) Nombre y datos de contacto del representante legal.
c) Tipos, marcas y modelos de productos comercializados, con indicación de la referencia identificativa del producto, «ID», asignada por el Portal EU-CEG.
2. En el caso de fabricantes e importadores, la incorporación de esta información en el registro se llevará a cabo de oficio por la Dirección General de Salud Pública, Calidad e Innovación, a partir de los datos aportados al Portal EU-CEG en el contexto de las obligaciones de comunicación a las que se refiere el artículo 37. En el caso de distribuidores, estos comunicarán la información a la Dirección General de Salud Pública, Calidad e Innovación, que la incorporará al registro.
3. La modificación y cancelación de la información contenida en el registro se realizará por la Dirección General de Salud Pública, Calidad e Innovación de acuerdo con lo que determine la normativa que regule el registro.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 54: #ti-4]
[Bloque 55: #a4-4]
1. La Dirección General de Salud Pública, Calidad e Innovación aprobará un Plan anual de verificación relativo a los productos del tabaco, a los dispositivos susceptibles de liberación de nicotina y envases de recarga y a los productos a base de hierbas para fumar que se encuentren en el mercado, con la finalidad de controlar el cumplimiento de los requisitos relativos a ingredientes, emisiones, calidad y seguridad previstos en la normativa vigente.
2. Este plan recogerá las marcas y tipos de productos que deberán ser analizados, el número de muestras a tomar y los laboratorios de verificación a que se refiere el artículo 44 que participarán en los ensayos.
3. En la elaboración de este plan participará el Laboratorio de control y supervisión a que se refiere el artículo 43.
[Bloque 56: #a4-5]
1. El Centro de Investigación y Control de la Calidad dependiente de la Agencia Española de Consumo, Seguridad Alimentaria y Nutrición, tendrá la consideración de Laboratorio de control y supervisión, a los efectos de lo establecido en este real decreto.
2. El Laboratorio de control y supervisión colaborará con la Dirección General de Salud Pública, Calidad e Innovación en el procedimiento de autorización de los laboratorios de verificación previsto en este título e inspeccionará su funcionamiento.
3. El Laboratorio de control y supervisión elaborará anualmente un informe sobre el cumplimiento del Plan anual de verificación que remitirá a la Dirección General de Salud Pública, Calidad e Innovación.
[Bloque 57: #a4-6]
1. Los laboratorios de verificación comprobarán alguno o varios de los aspectos siguientes:
a) Ingredientes a que se refiere el artículo 6.1.a)
b) Niveles de emisiones a que se refiere el artículo 6.1.e).
c) Niveles de emisiones e ingredientes a que se refieren los párrafos b), c) y d) del artículo 26.1 y el artículo 29.
d) Requisitos de calidad y seguridad establecidos en el artículo 28.
e) Ingredientes a que se refiere el artículo 37.1.
Para ello, podrán realizar análisis y ensayos sobre los productos del tabaco, los dispositivos susceptibles de liberación de nicotina y envases de recarga y los productos a base de hierbas para fumar, de acuerdo con lo que establezca su autorización y el Plan anual de verificación.
2. Los laboratorios de verificación serán autorizados por la Dirección General de Salud Pública, Calidad e Innovación siempre que cumplan los requisitos a los que se refiere el artículo 45. En la autorización se establecerá su ámbito de actuación en relación con los productos del tabaco, los dispositivos susceptibles de liberación de nicotina y envases de recarga y los productos a base de hierbas para fumar que se encuentren en el mercado.
[Bloque 58: #a4-7]
Los laboratorios de verificación deberán cumplir los siguientes requisitos:
a) Ser independientes de las entidades relacionadas con el sector objeto de verificación y no pertenecer o estar controlados directa o indirectamente por ellas.
b) Disponer de los recursos financieros, tecnológicos, humanos y de organización adecuados para realizar las comprobaciones que pretendan realizar.
c) Desarrollar actividades en el ámbito de la cooperación europea e internacional sobre productos del tabaco, dispositivos susceptibles de liberación de nicotina y envases de recarga o productos a base de hierbas para fumar.
d) Contar con un sistema de calidad implantado, que justifique y determine su competencia técnica para llevar a cabo las mediciones oportunas sobre productos del tabaco, dispositivos susceptibles de liberación de nicotina y envases de recarga o productos a base de hierbas para fumar.
e) Garantizar la confidencialidad en sus actuaciones.
[Bloque 59: #a4-8]
1. Las entidades interesadas en obtener una autorización como laboratorio de verificación deberán solicitarlo a la Dirección General de Salud Pública, Calidad e Innovación, adjuntando la documentación que justifique el cumplimiento de los requisitos previstos en el artículo 45.
2. Además, deberán aportar la siguiente documentación:
a) Nombre y datos de contacto del laboratorio y del representante legal.
b) Descripción del ámbito de actuación para el que se solicita autorización.
c) Plano de la instalación y descripción de los equipos.
d) Información disponible en relación al aseguramiento de la calidad de los ensayos analíticos que realicen para el control de emisiones y componentes de los productos del tabaco, de los dispositivos susceptibles de liberación de nicotina y envases de recarga o de los productos a base de hierbas para fumar.
[Bloque 60: #a4-9]
1. La Subdirección General de Promoción de la Salud y Vigilancia en Salud Pública será el órgano encargado de la instrucción del procedimiento, con la colaboración del Laboratorio de control y supervisión a que se refiere el artículo 43.
2. El Laboratorio de control y supervisión emitirá un informe sobre el cumplimiento de los requisitos previstos en el artículo 45 previa visita de comprobación a la entidad solicitante.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 61: #a4-10]
1. La Dirección General de Salud Pública, Calidad e Innovación, en el plazo de seis meses a contar desde la presentación de la solicitud, dictará y notificará resolución concediendo o denegando la autorización a la entidad solicitante.
Transcurrido este plazo sin haberse dictado y notificado la correspondiente resolución, la solicitud se podrá entender estimada.
2. La autorización delimitará el ámbito de actuación del laboratorio en relación con los productos del tabaco, los dispositivos susceptibles de liberación de nicotina y envases de recarga o los productos a base de hierbas para fumar.
3. Contra la resolución de la Dirección General de Salud Pública, Calidad e Innovación podrá interponerse recurso de alzada, en el plazo de un mes, ante la Secretaría General de Sanidad y Consumo, de conformidad con lo dispuesto en los artículos 121 y 122 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
4. La Dirección General de Salud Pública, Calidad e Innovación inscribirá el contenido de la autorización en el Registro de Laboratorios de Verificación, a que se refiere el artículo 50, y lo comunicará a la Comisión Europea, precisando los criterios utilizados para su autorización, así como los medios de supervisión aplicados.
[Bloque 62: #a4-11]
1. La Dirección General de Salud Pública, Calidad e Innovación verificará el cumplimiento de los requisitos de la autorización. Para ello, podrá requerir la colaboración del Laboratorio de control y supervisión.
2. En caso de incumplimiento de la autorización o de los requisitos previstos en el artículo 45, la Dirección General de Salud Pública, Calidad e Innovación podrá revocar la autorización concedida, previa audiencia del interesado.
3. Cuando se produzca el cese de la actividad del laboratorio por iniciativa propia, éste deberá comunicarlo a la Dirección General de Salud Pública, Calidad e Innovación, quien procederá a darle de baja en el registro y lo comunicará a la Comisión Europea.
[Bloque 63: #a5-2]
1. Se crea el Registro de Laboratorios de Verificación, con la finalidad de recopilar y ordenar la información sobre los laboratorios de verificación autorizados.
2. El registro tendrá naturaleza administrativa y estará adscrito a la Dirección General de Salud Pública, Calidad e Innovación, que será el órgano responsable del mismo.
3. Mediante orden de la persona titular del Ministerio de Sanidad, Servicios Sociales e Igualdad se determinarán las características y contenido del registro.
[Bloque 64: #da]
Lo dispuesto en este real decreto no supondrá incremento de las dotaciones, ni de retribuciones ni de otros gastos en materia de personal. Asimismo, la puesta en marcha y el mantenimiento de los registros que se crean a través de este real decreto se asumirá con los medios personales existentes actualmente en el órgano de adscripción, sin incremento de dotaciones presupuestarias ni de otros gastos de personal.
[Bloque 65: #da-2]
De conformidad con lo dispuesto en el artículo 5 de la Ley 13/1998, de 4 de mayo, de Ordenación del Mercado de Tabacos y Normativa Tributaria, corresponde al Comisionado para el Mercado de Tabacos las funciones de inspección y control establecidas en los artículos 4, 5 y 7 y en los capítulos II y III del título I de este real decreto.
[Bloque 66: #dt]
1. No obstante lo establecido en la disposición derogatoria única, podrán seguir fabricándose o despachándose a libre práctica hasta tres meses después de la entrada en vigor de este real decreto:
a) Los productos del tabaco etiquetados de conformidad con lo dispuesto en el Real Decreto 1079/2002, de 18 de octubre.
b) Los dispositivos susceptibles de liberación de nicotina y envases de recarga y los productos a base de hierbas para fumar, envasados y etiquetados de conformidad con la normativa anteriormente vigente.
2. Los productos a que se refiere el apartado anterior podrán seguir comercializándose hasta diez meses después de la entrada en vigor del presente real decreto.
3. La picadura para liar en petacas etiquetada con una advertencia general y un mensaje informativo de conformidad con lo dispuesto en la Decisión de Ejecución (UE) 2015/1735 de la Comisión, podrá seguir fabricándose o despachándose a libre práctica hasta el 20 de mayo de 2018, y seguir comercializándose hasta el 20 de mayo de 2019.
[Bloque 67: #dt-2]
En las unidades de envasado de cigarrillos que deban ir provistas de una precinta de circulación u otra marca fiscal, con vigencia límite hasta el 20 de mayo de 2019, la posición de las advertencias sanitarias combinadas se regirá por las siguientes reglas:
a) Si las marcas fiscales se colocan en el borde superior de una unidad de envasado hecha de cartón, las advertencias sanitarias combinadas que aparecerán en la superficie posterior deberán colocarse directamente debajo de la marca fiscal.
b) En el caso de una unidad de envasado de material flexible, se reservará una superficie rectangular para las marcas fiscales de una altura que no podrá ser superior a 13 mm entre el límite superior de la cajetilla y el límite superior de las advertencias sanitarias.
c) Las marcas y los logotipos no podrán situarse por encima de la advertencia sanitaria.
[Bloque 68: #dt-3]
Los laboratorios que a la entrada en vigor de este real decreto estén realizando alguna de las funciones previstas en el artículo 44 podrán continuar desempeñándolas durante el plazo máximo de un año a contar desde su entrada en vigor aunque no dispongan de la autorización prevista en el título IV de este real decreto.
[Bloque 69: #dd]
Queda derogado el Real Decreto 1079/2002, de 18 de octubre, por el que se regulan los contenidos máximos de nicotina, alquitrán y monóxido de carbono de los cigarrillos, el etiquetado de los productos del tabaco, así como las medidas relativas a ingredientes y a denominaciones de los productos del tabaco, y cuantas disposiciones de igual o inferior rango se opongan a lo dispuesto en el presente real decreto.
[Bloque 70: #df]
El presente real decreto tiene el carácter de norma básica, dictada al amparo de lo previsto en el artículo 149.1.16.ª de la Constitución, que atribuye al Estado la competencia sobre bases y coordinación general de la sanidad.
[Bloque 71: #df-2]
Se suprime el apartado 3.25.80 de la sección 8.ª del capítulo XXV de la Tercera Parte del Código Alimentario Español, aprobado mediante el Decreto 2484/1967, de 21 de septiembre, por el que se aprueba el texto del Código Alimentario Español.
[Bloque 72: #df-3]
1. Mediante este real decreto se incorpora parcialmente al derecho español la Directiva 2014/40/UE del Parlamento Europeo y del Consejo, de 3 de abril de 2014, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros en materia de fabricación, presentación y venta de los productos del tabaco y los productos relacionados y por la que se deroga la Directiva 2001/37/CE.
Asimismo, se incorpora al derecho español la Directiva Delegada 2014/109/UE de la Comisión, de 10 de octubre de 2014, que modifica el anexo II de la Directiva 2014/40/UE del Parlamento Europeo y del Consejo estableciendo la biblioteca de advertencias gráficas que han de utilizarse en los productos del tabaco.
2. Las referencias hechas en la normativa vigente a la Directiva 2001/37/CE del Parlamento Europeo y del Consejo, de 5 de junio de 2001, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros en materia de fabricación, presentación y venta de los productos del tabaco, se entenderán hechas a la Directiva 2014/40/UE del Parlamento Europeo y del Consejo, de 3 de abril de 2014, relativa a la aproximación de las disposiciones legales, reglamentarias y administrativas de los Estados miembros en materia de fabricación, presentación y venta de los productos del tabaco y los productos relacionados y por la que se deroga la Directiva 2001/37/CE.
[Bloque 73: #df-4]
1. Se faculta a la persona titular del Ministerio de Sanidad, Servicios Sociales e Igualdad para dictar cuantas disposiciones sean necesarias para el desarrollo de lo establecido en este real decreto con la salvedad de lo dispuesto en los artículos 21 y 22, en los que corresponderá a la persona titular del Ministerio de Hacienda y Función Pública dictar las normas técnicas de desarrollo y ejecución relativas a la trazabilidad de los productos del tabaco y de las medidas de seguridad.
2. Mediante orden de la persona titular del Ministerio de Sanidad, Servicios Sociales e Igualdad se podrá:
a) Establecer niveles máximos de emisión para los cigarrillos que se refieran a sustancias distintas de las contempladas en el artículo 4.
b) Establecer los niveles máximos de las sustancias emitidas por otros productos del tabaco distintos de los cigarrillos.
c) Establecer los métodos de medición de las emisiones a que se refieren los apartados anteriores.
La Dirección General de Salud Pública, Calidad e Innovación comunicará a la Comisión Europea los niveles máximos y los métodos de medición que se establezcan en aplicación de este apartado.
Redactado conforme a la corrección de errores publicada en BOE núm. 210, de 1 de septiembre de 2017. Ref. BOE-A-2017-10090
[Bloque 74: #df-5]
El presente Real Decreto entrará en vigor el día siguiente al de su publicación en el «Boletín Oficial del Estado».
[Bloque 75: #fi]
Dado en la Embajada de España en Astaná, el 9 de junio de 2017.
FELIPE R.
La Vicepresidenta del Gobierno y Ministra de la Presidencia y para las Administraciones Territoriales,
SORAYA SÁENZ DE SANTAMARÍA ANTÓN
[Bloque 76: #ai]
(1) Fumar provoca 9 de cada 10 cánceres de pulmón.
(2) Fumar provoca cáncer de boca y garganta.
(3) Fumar daña los pulmones.
(4) Fumar provoca infartos.
(5) Fumar provoca embolias e invalidez.
(6) Fumar obstruye las arterias.
(7) Fumar aumenta el riesgo de ceguera.
(8) Fumar daña los dientes y las encías.
(9) Fumar puede matar al hijo que espera.
(10) Su humo es malo para sus hijos, familia y amigos.
(11) Los hijos de fumadores tienen más probabilidades de empezar a fumar.
(12) Deje de fumar: siga vivo para sus seres queridos.
(13) Fumar reduce la fertilidad.
(14) Fumar aumenta el riesgo de impotencia.
[Bloque 77: #ai-2]


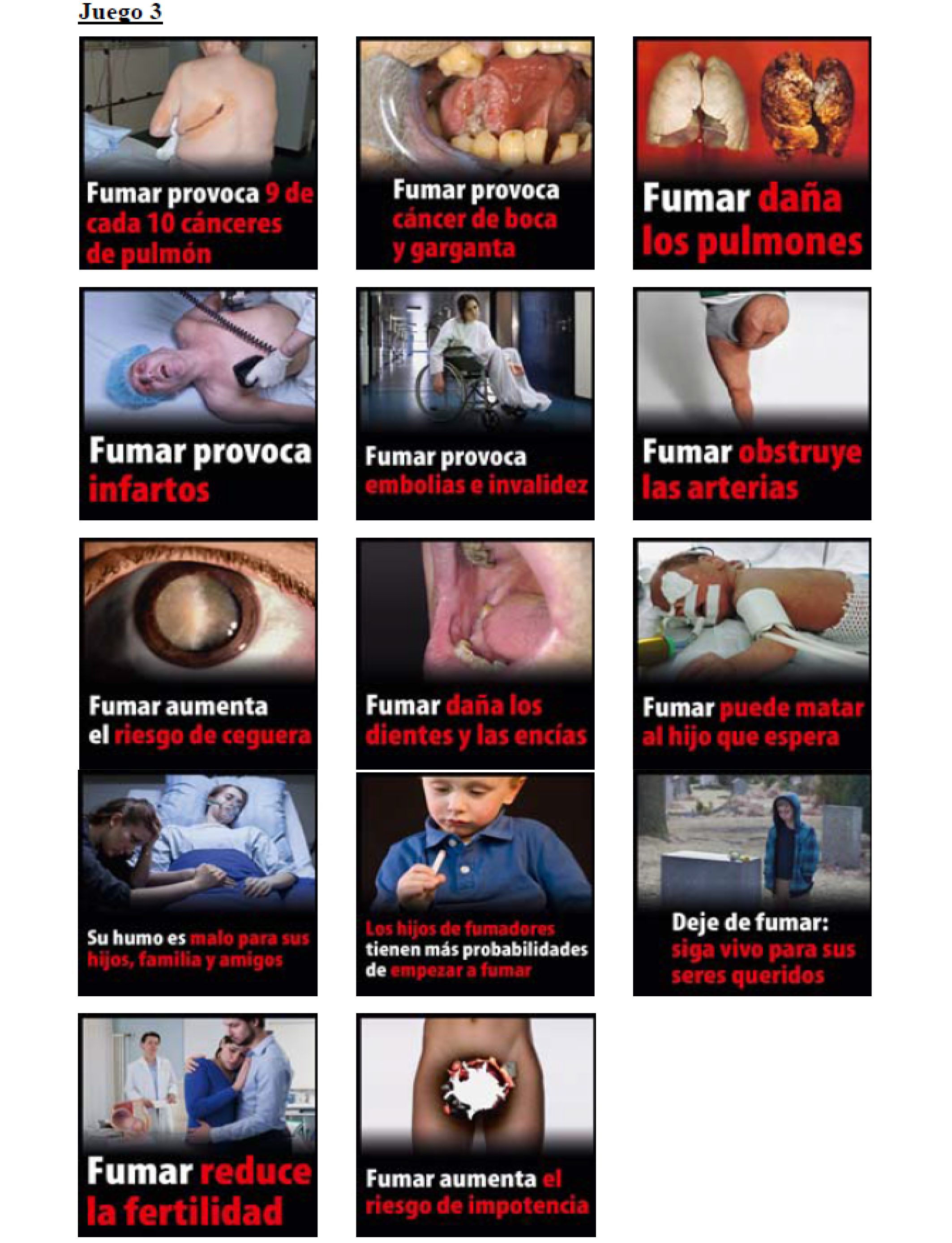
Este documento es de carácter informativo y no tiene valor jurídico.
Ayúdenos a mejorar: puede dirigir sus comentarios y sugerencias a nuestro Servicio de atención al ciudadano
Agence d'État Bulletin Officiel de l'État
Av. Manoteras, 54 - 28050 Madrid