Contido non dispoñible en galego
El sistema de precios de referencia, aplicable en materia de financiación de medicamentos por el Sistema Nacional de Salud y establecido en el artículo 98 del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por el Real Decreto Legislativo 1/2015, de 24 de julio, se ha manifestado como herramienta esencial de control del gasto farmacéutico, necesario para la sostenibilidad del sistema sanitario público.
El desarrollo reglamentario necesario para poder hacer efectivo el mandato legal de establecer, con periodicidad anual, los nuevos conjuntos de referencia de medicamentos, así como de proceder a la revisión de los precios de referencia de los conjuntos ya existentes, se encuentra establecido en el Real Decreto 177/2014, de 21 de marzo, por el que se regula el sistema de precios de referencia y de agrupaciones homogéneas en el Sistema Nacional de Salud, y determinados sistemas de información en materia de financiación y precios de los medicamentos y productos sanitarios.
El artículo 5.1 del Real Decreto 177/2014, de 21 de marzo, encomienda a la persona titular del Ministerio de Sanidad, Servicios Sociales e Igualdad para que, con periodicidad anual, mediante la correspondiente orden y previo informe a la Comisión Delegada del Gobierno para Asuntos Económicos, establezca los nuevos conjuntos y sus precios de referencia, así como para que revise los precios de referencia de las presentaciones de medicamentos incluidas en los conjuntos ya existentes y, en su caso, proceda a la supresión de los conjuntos cuando hayan dejado de cumplir los requisitos exigidos para su establecimiento.
La última actualización de los conjuntos de referencia de medicamentos y de sus precios de referencia se produjo por medio de la Orden SSI/1305/2016, de 27 de julio, por la que se procede a la actualización en 2016 del sistema de precios de referencia de medicamentos en el Sistema Nacional de Salud.
A través de la presente Orden ministerial se procede a la actualización en 2017 de los conjuntos y precios de referencia establecidos por la Orden SSI/1305/2016, de 27 de julio, y para ello se determinan los nuevos conjuntos y se fijan sus precios de referencia, así como se revisan los precios de referencia fijados por la misma. Igualmente se procede a la supresión de los conjuntos de referencia previamente determinados por no cumplir, por causas sobrevenidas, los requisitos exigibles para su establecimiento.
Para el establecimiento de nuevos conjuntos de referencia de medicamentos y el mantenimiento de los conjuntos establecidos por medio de la orden antes citada, así como para la supresión de conjuntos de referencia, se han tenido en cuenta las disposiciones recogidas en el artículo 3 del Real Decreto 177/2014, de 21 de marzo. En relación con determinados conjuntos de referencia –señaladamente los que han sido objeto de recientes sentencias de los Tribunales de lo Contencioso-Administrativo–, cumple significar que, en aplicación de las indicaciones recogidas en las correspondientes sentencias, se ha justificado adecuadamente la postura de la Administración respecto a la no variación en esta nueva orden de algunos de los conjuntos afectados.
Para la fijación de los precios de referencia de las presentaciones de medicamentos integradas en los nuevos conjuntos de referencia de medicamentos y para la revisión de los precios de referencia de las presentaciones de medicamentos integradas en conjuntos previamente determinados, se han seguido las disposiciones establecidas en el artículo 4 del citado real decreto.
Esta orden se dicta de acuerdo con la habilitación específica prevista en el artículo 5.1 del Real Decreto 177/2014, de 21 de marzo, y en trámite de audiencia se ha dado traslado a las administraciones sanitarias de las comunidades autónomas, a las entidades gestoras de la prestación farmacéutica del Sistema Nacional de Salud, a los laboratorios farmacéuticos interesados, a las entidades de distribución de medicamentos, así como a las entidades representativas de los sectores afectados, incluidas las asociaciones de consumidores y usuarios.
En su virtud, dispongo:
Establecer en 2017 los nuevos conjuntos de referencia y los precios de referencia de las presentaciones de medicamentos incluidas en los mismos, así como revisar los precios de referencia de las presentaciones de medicamentos incluidas en conjuntos previamente existentes.
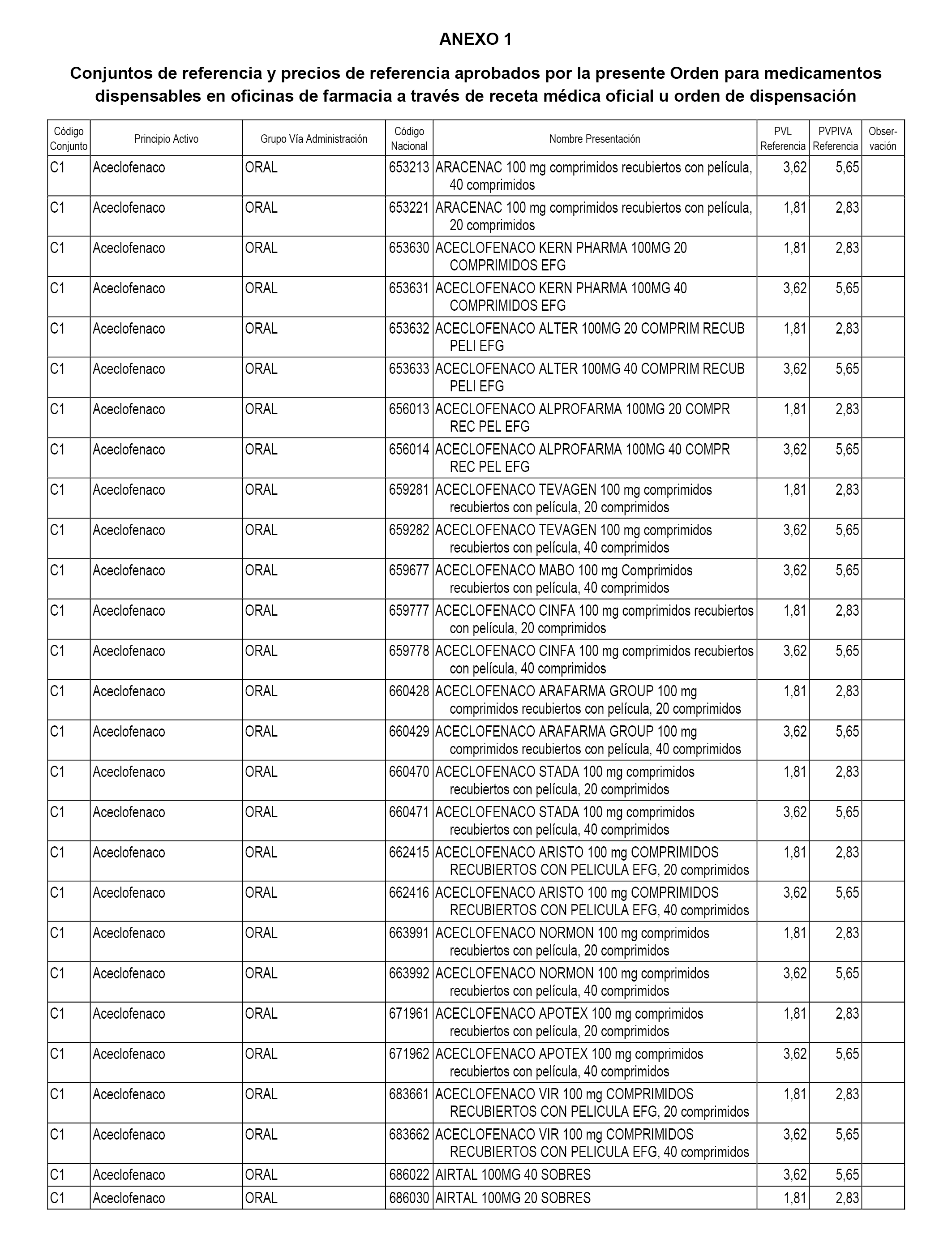
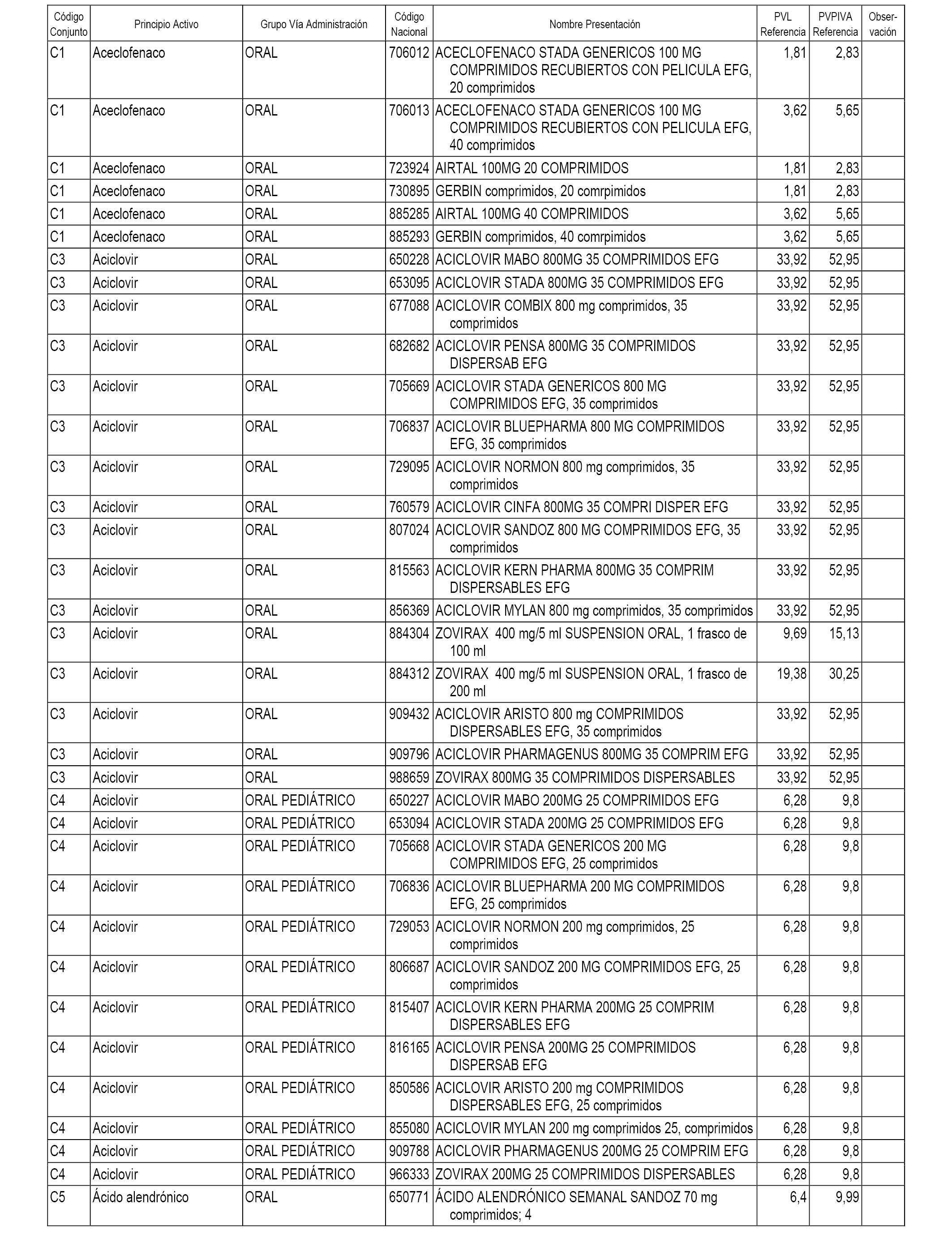
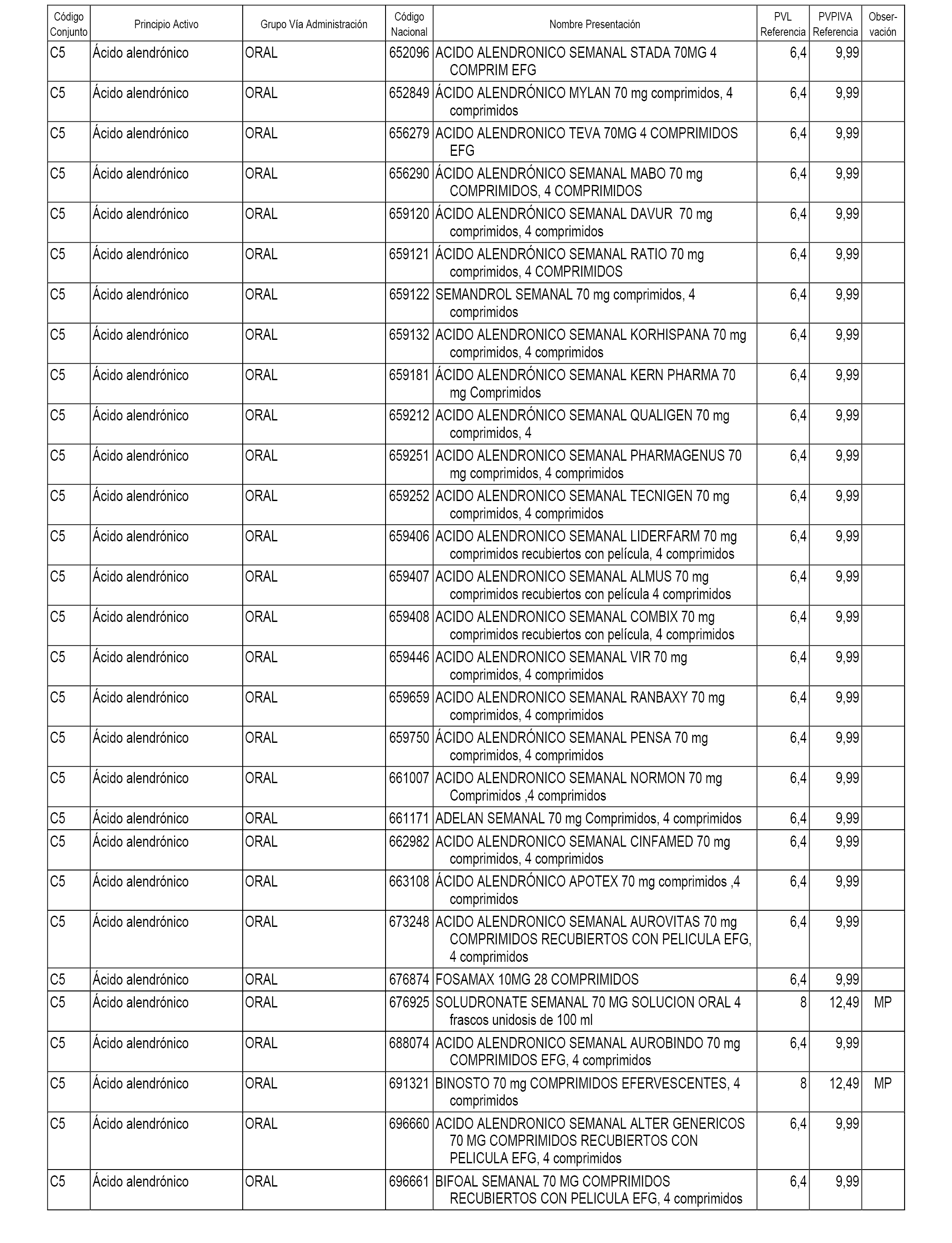
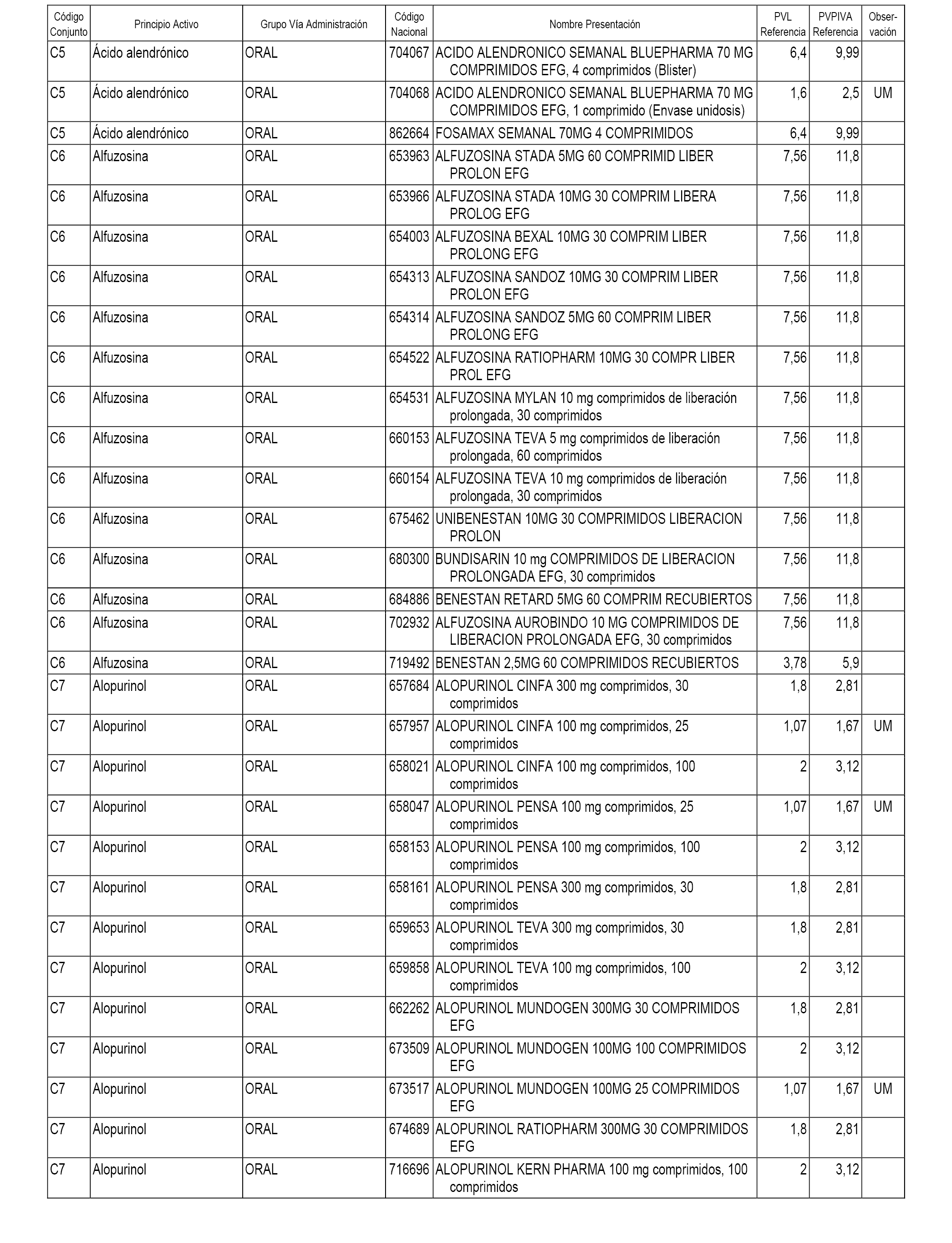
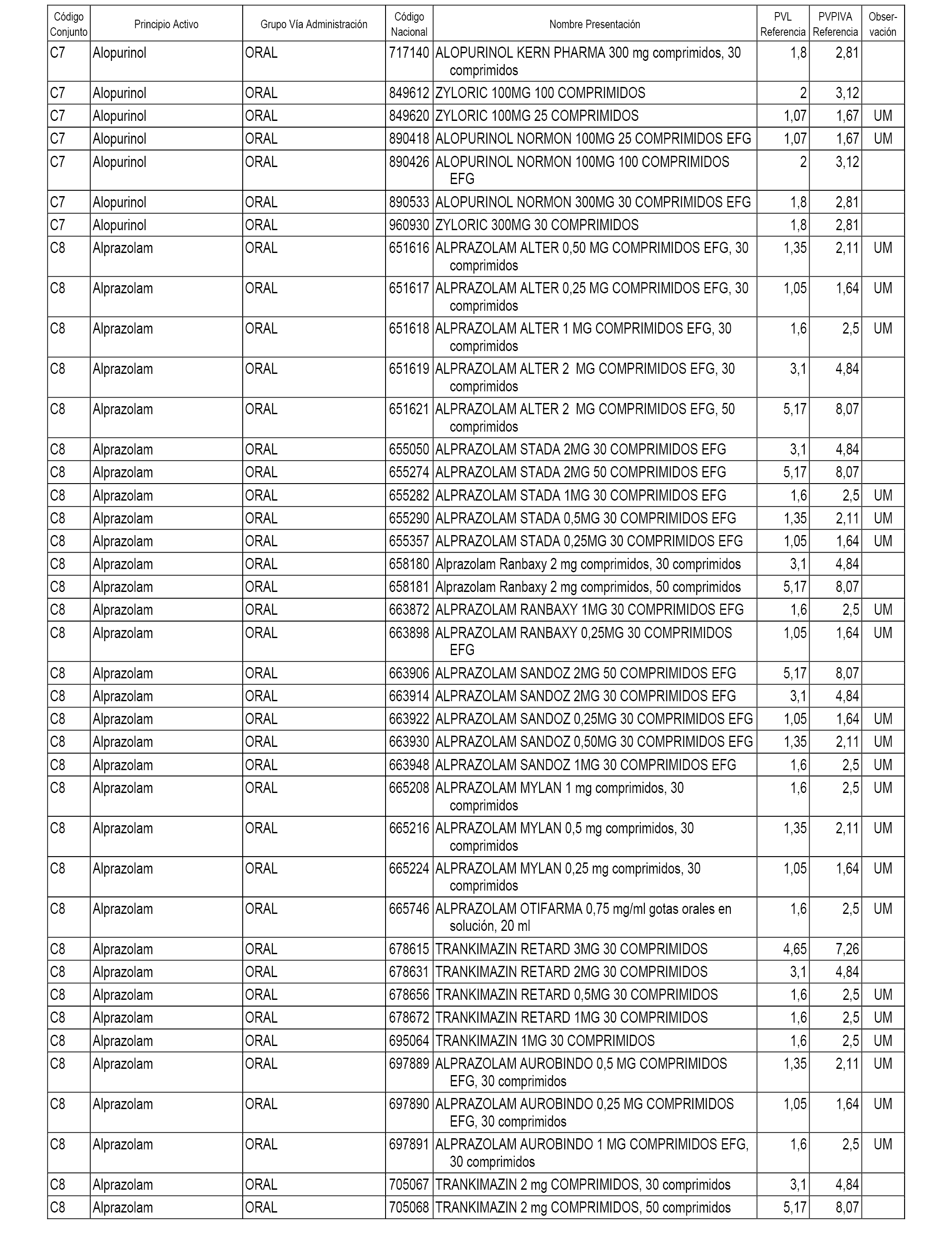
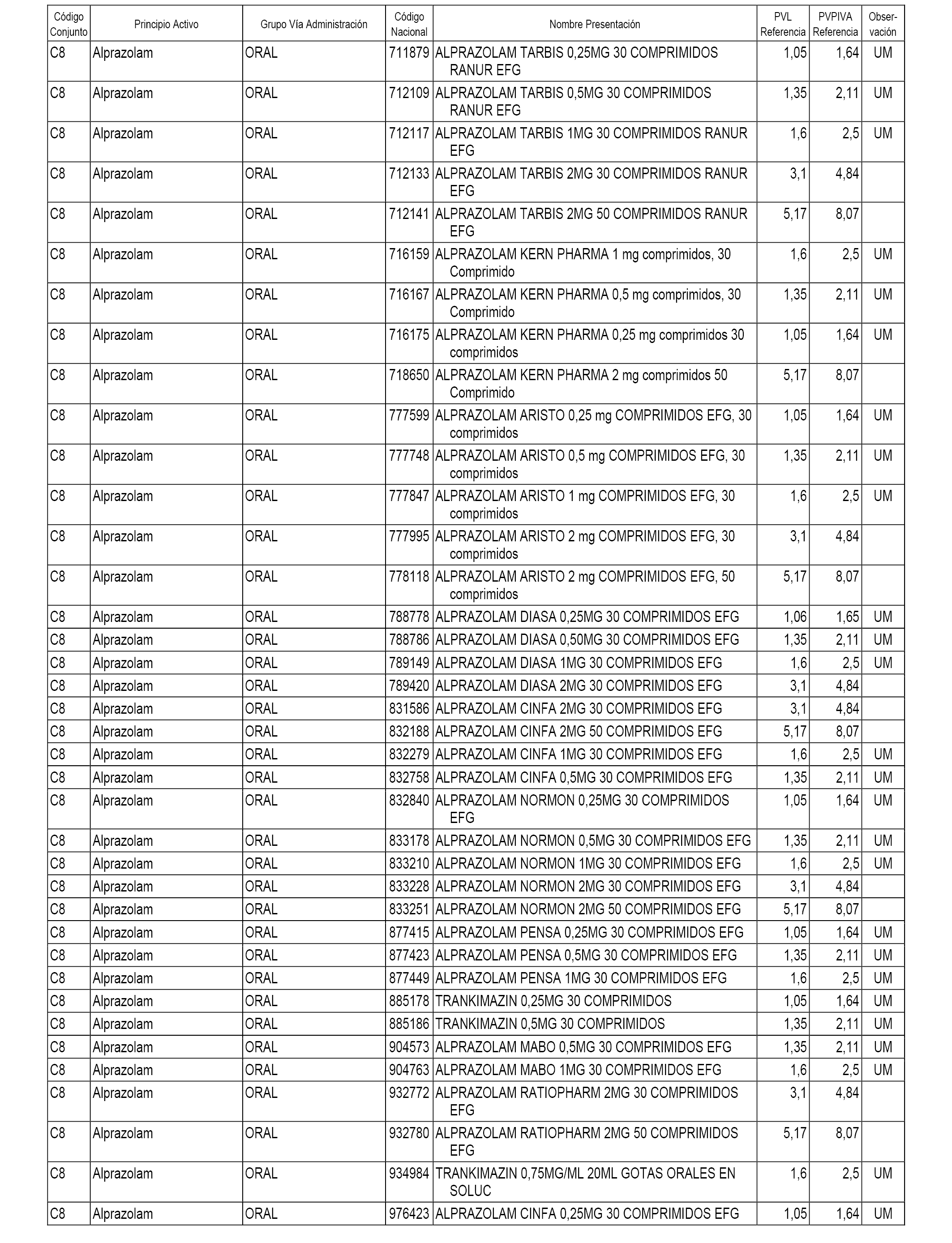
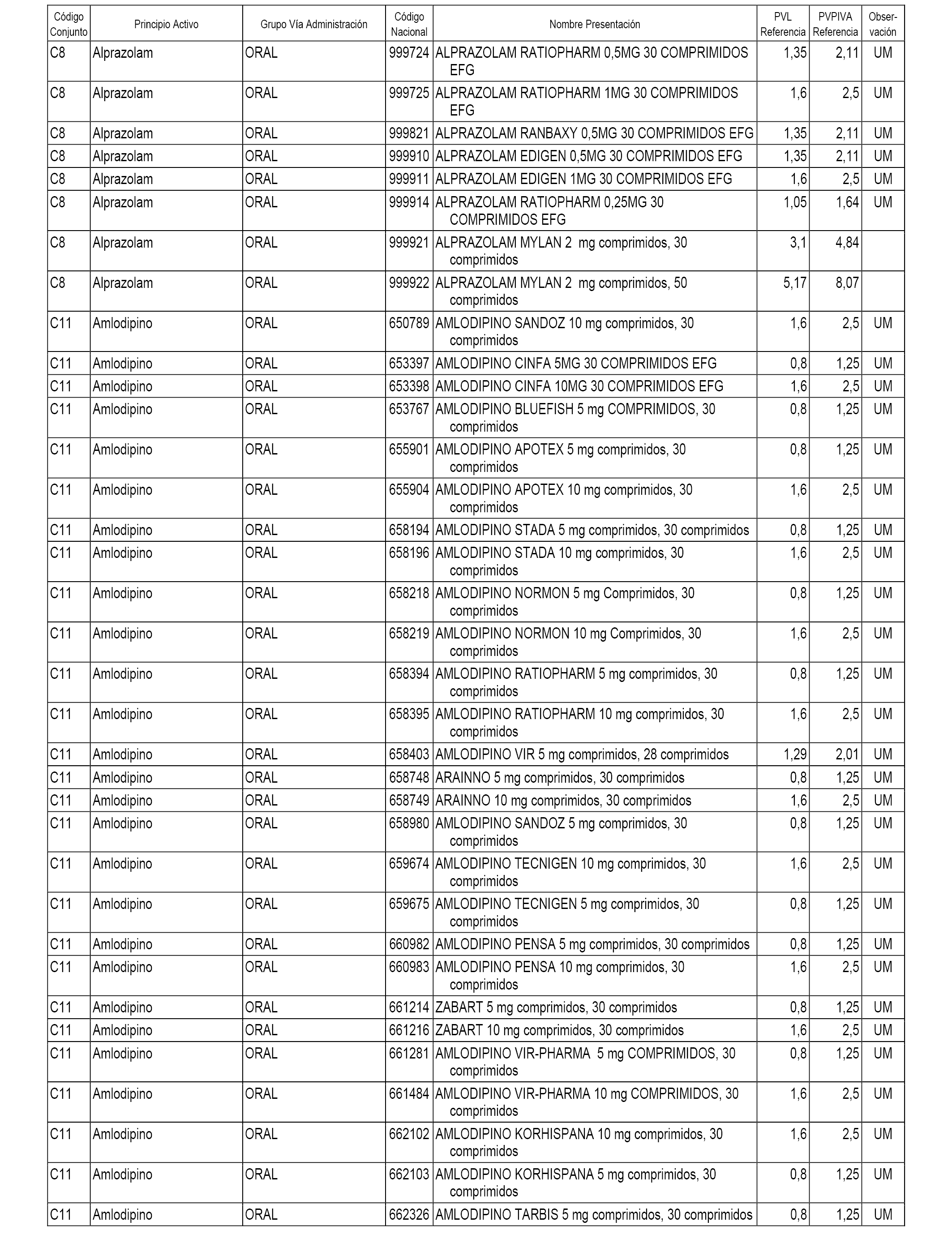
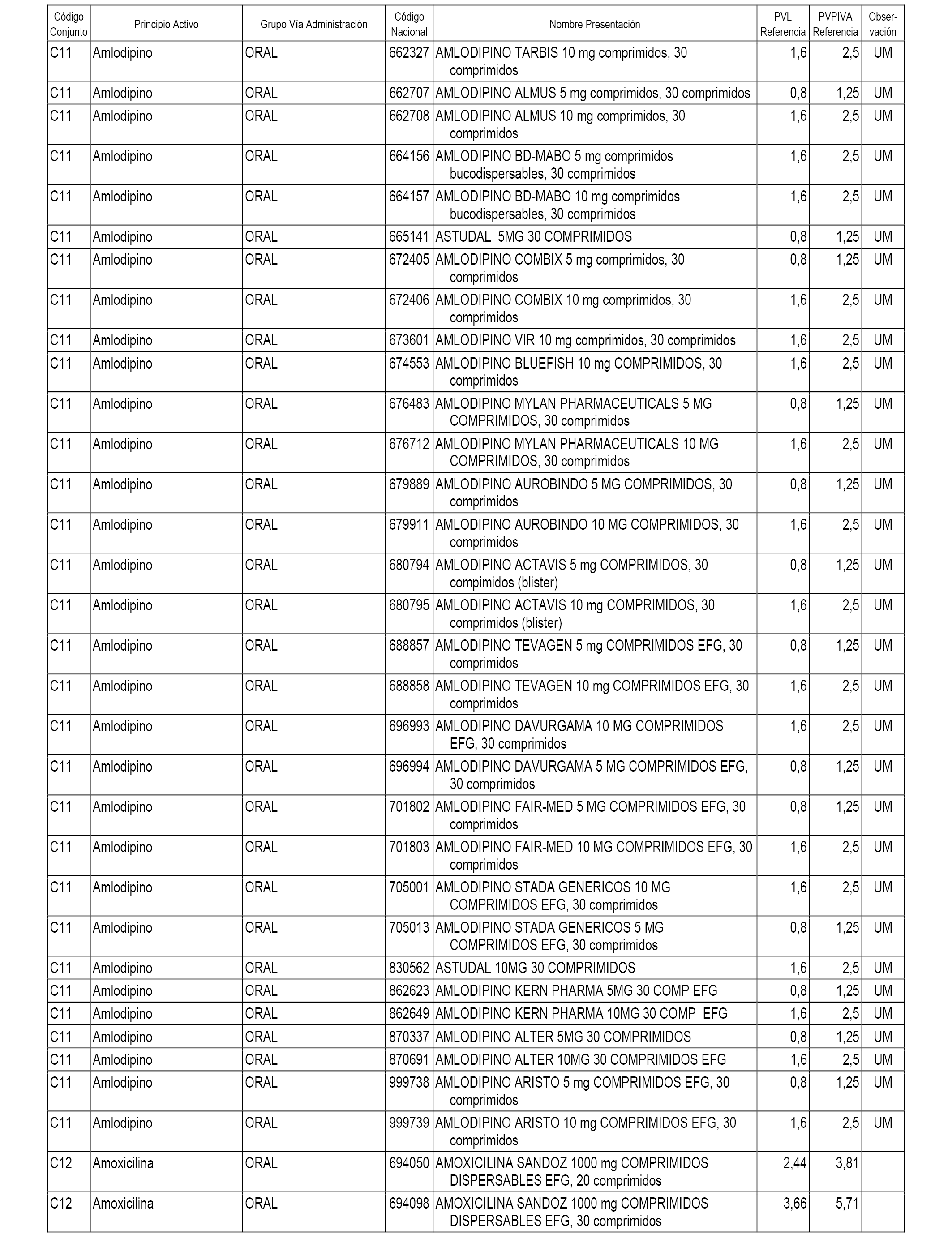
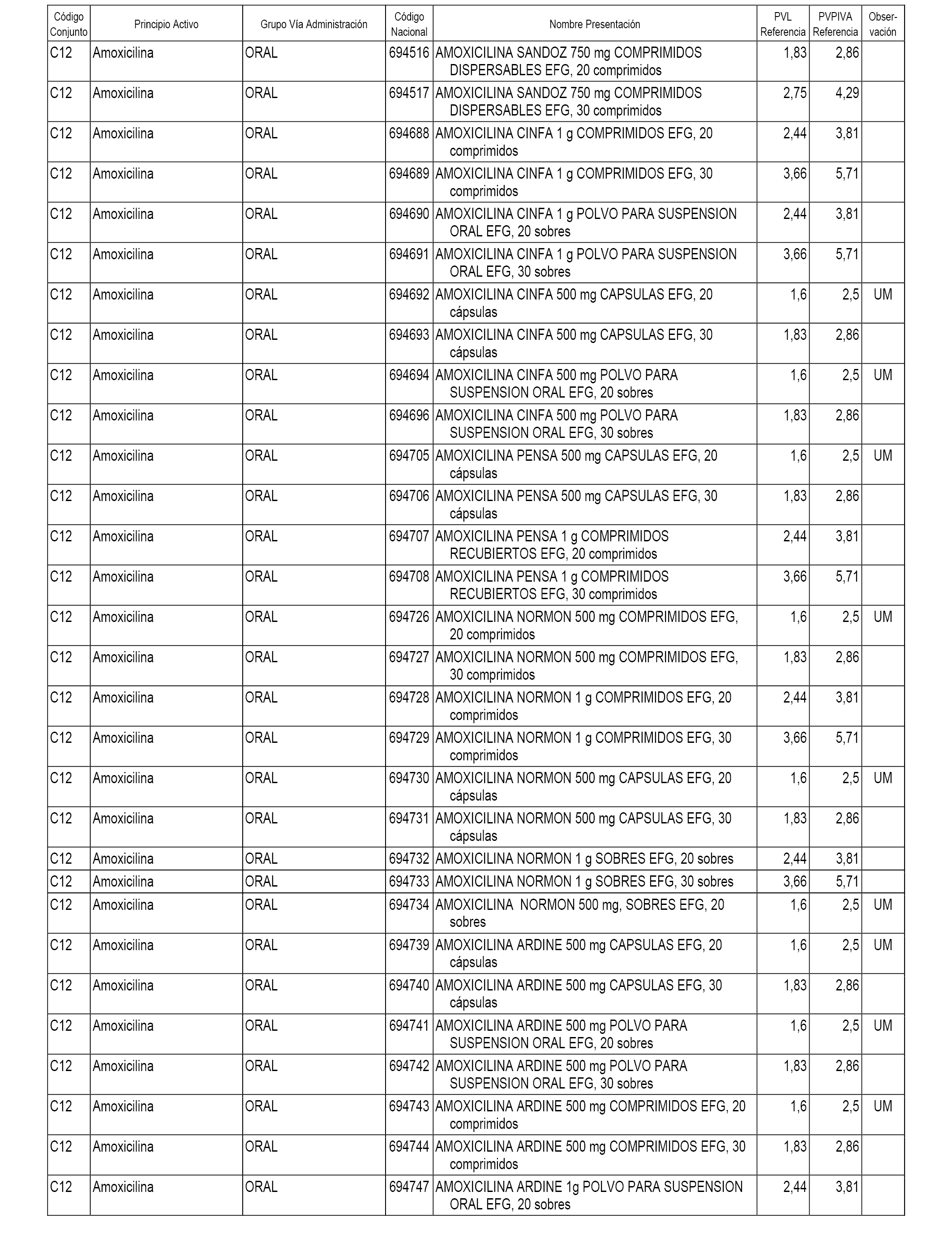
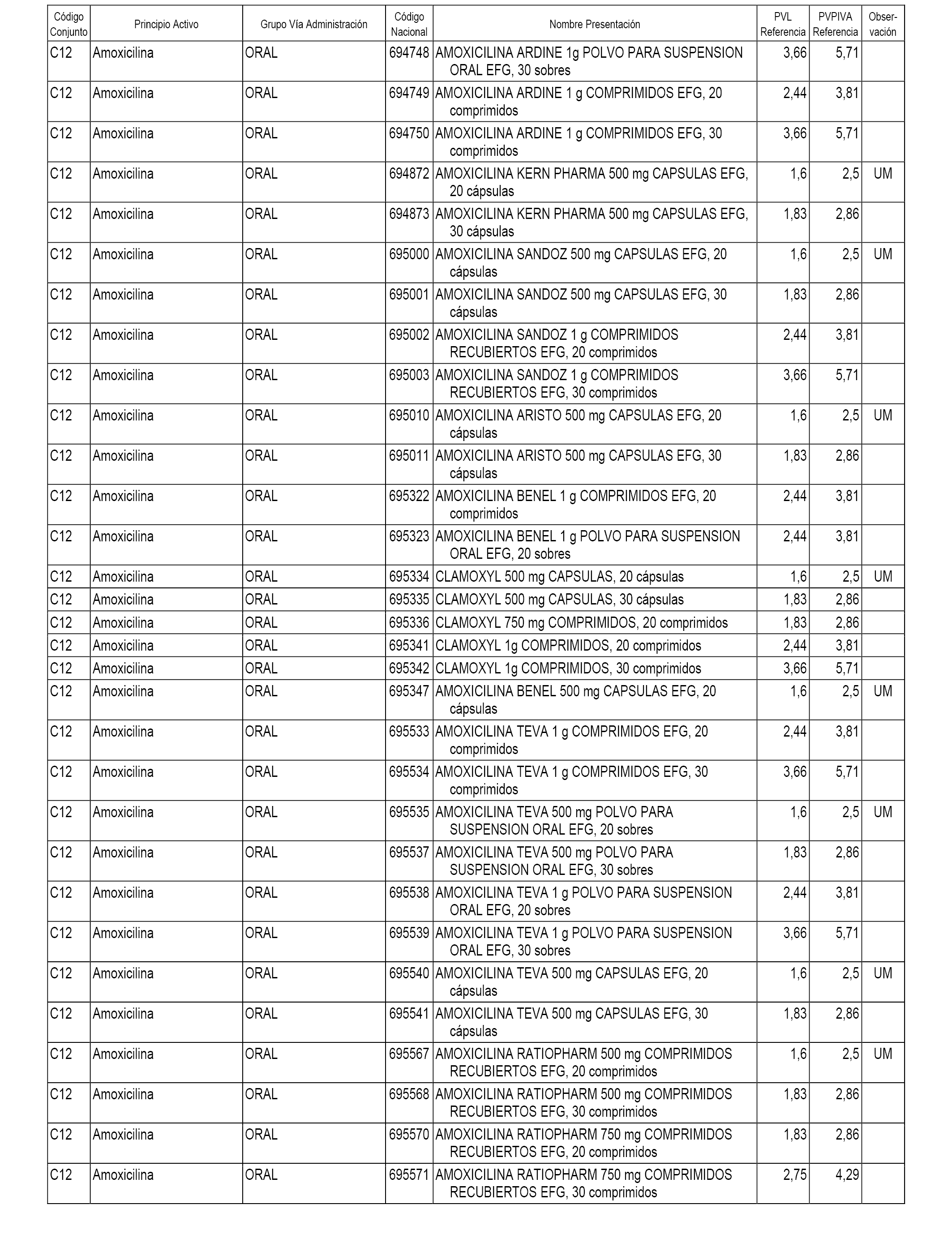
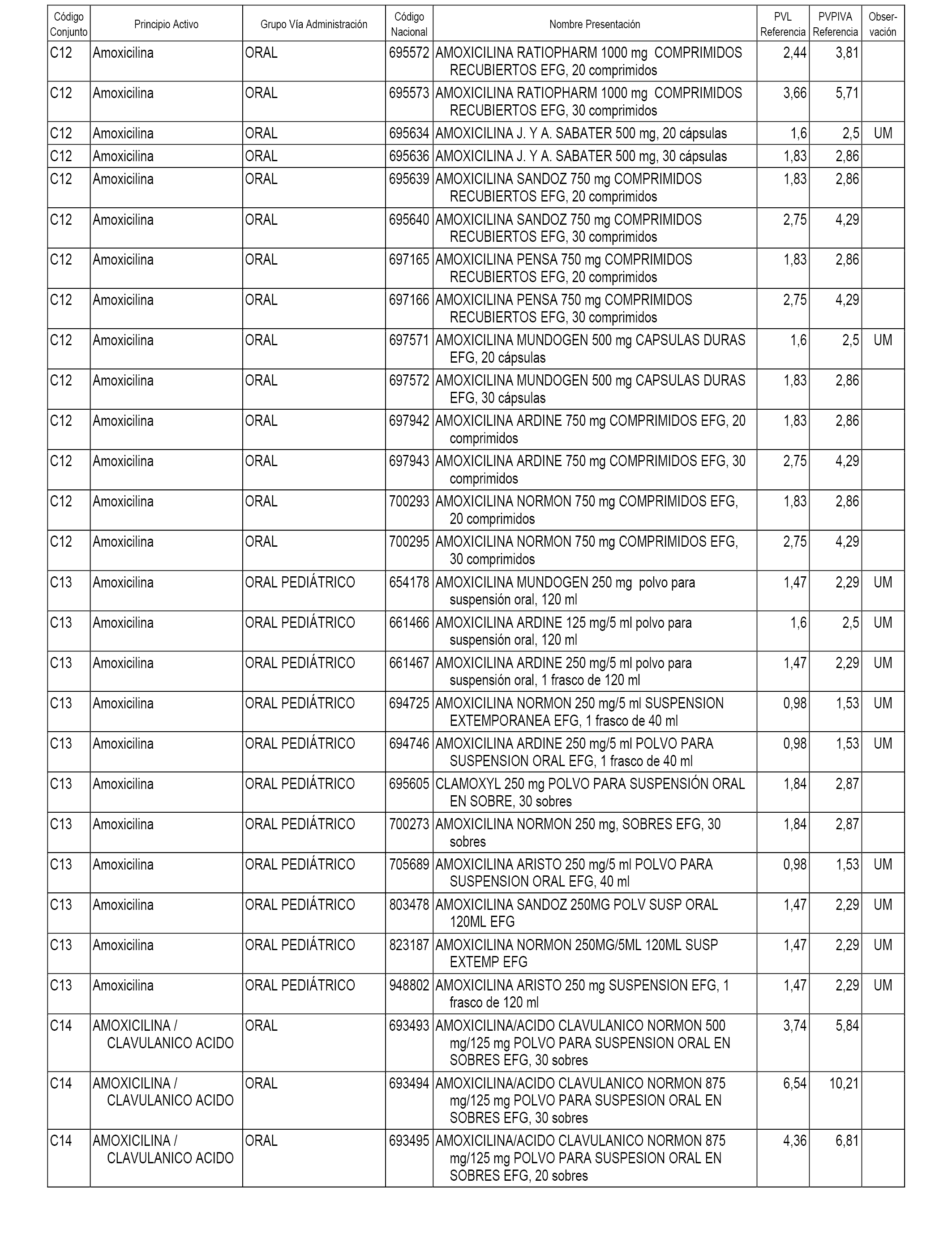
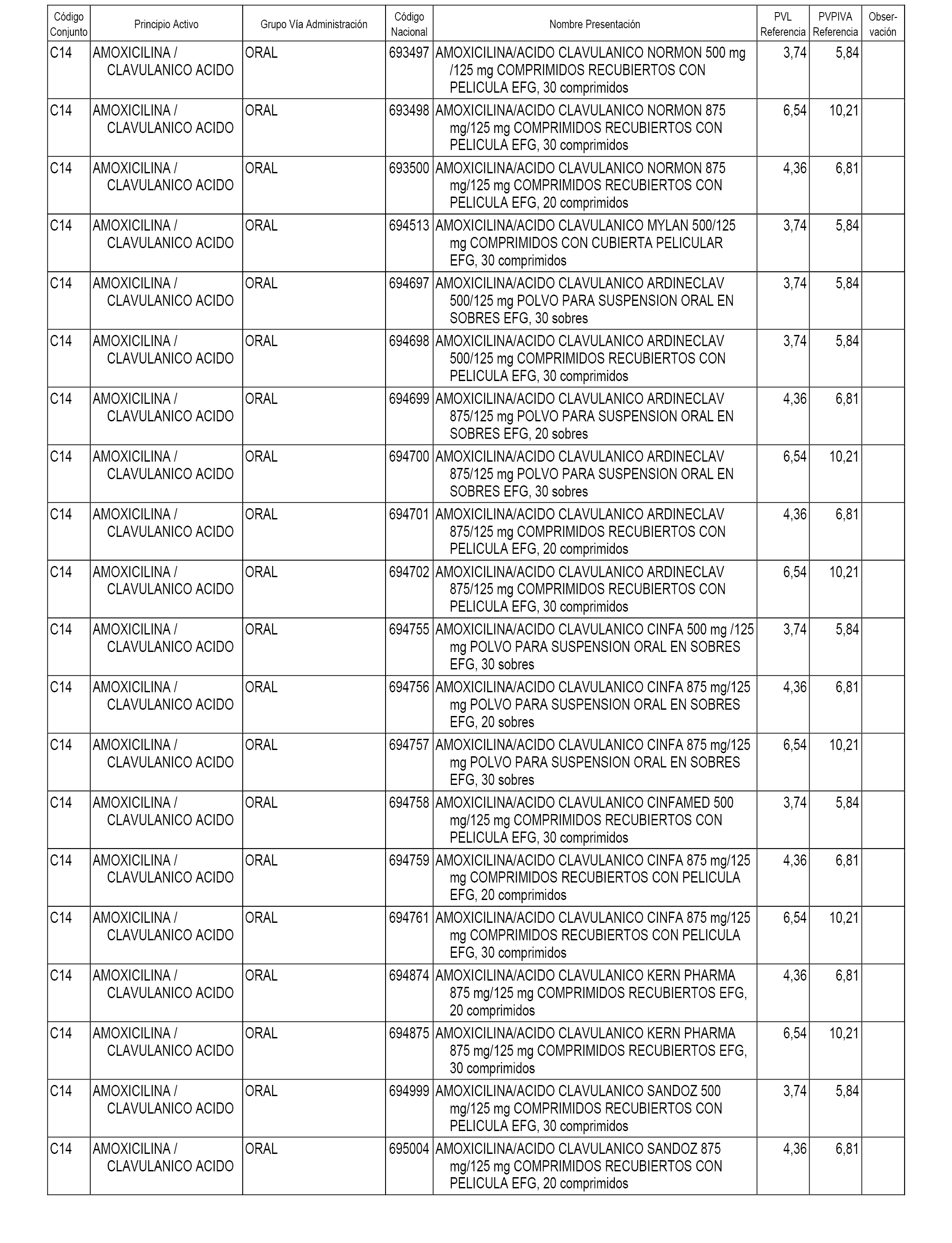
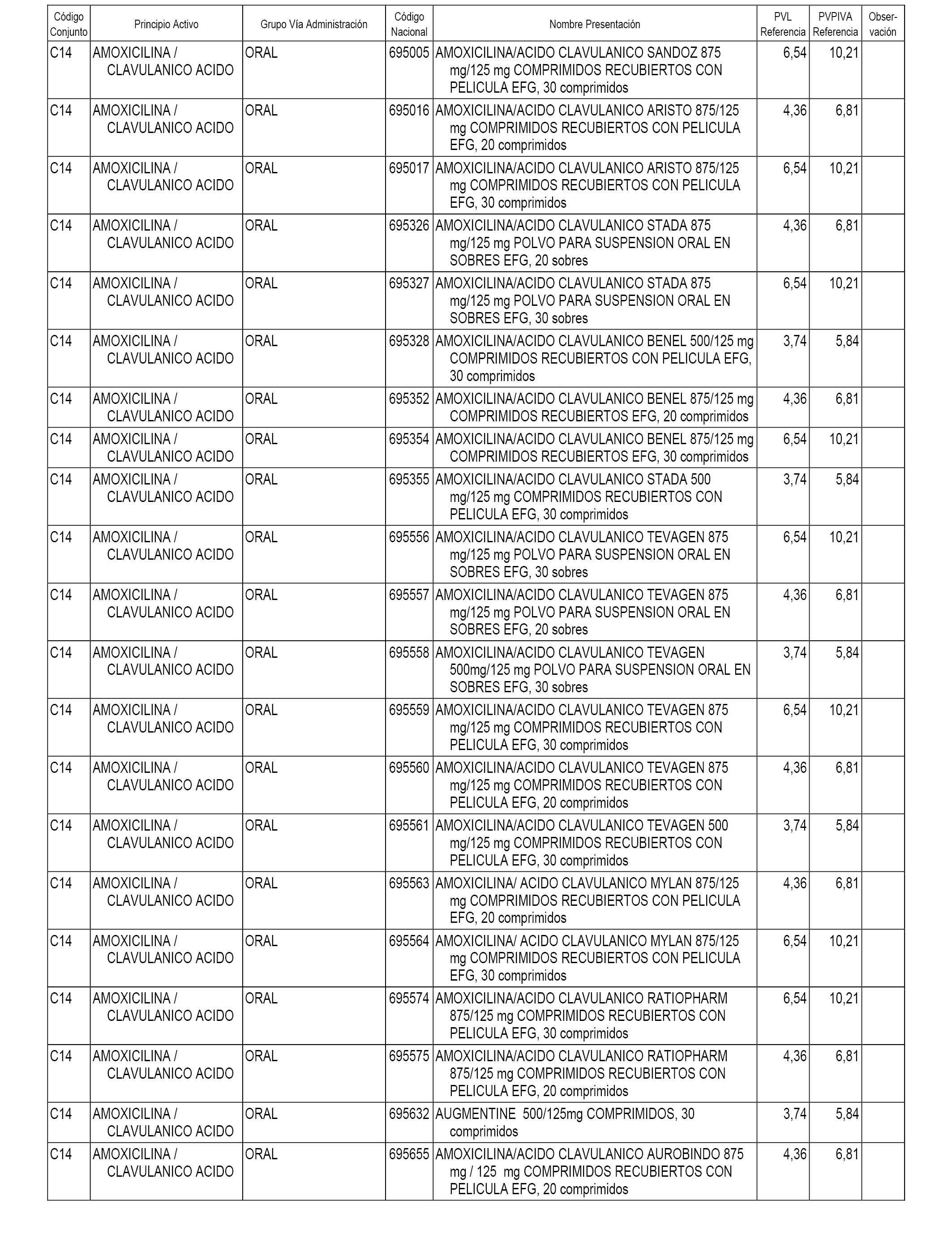
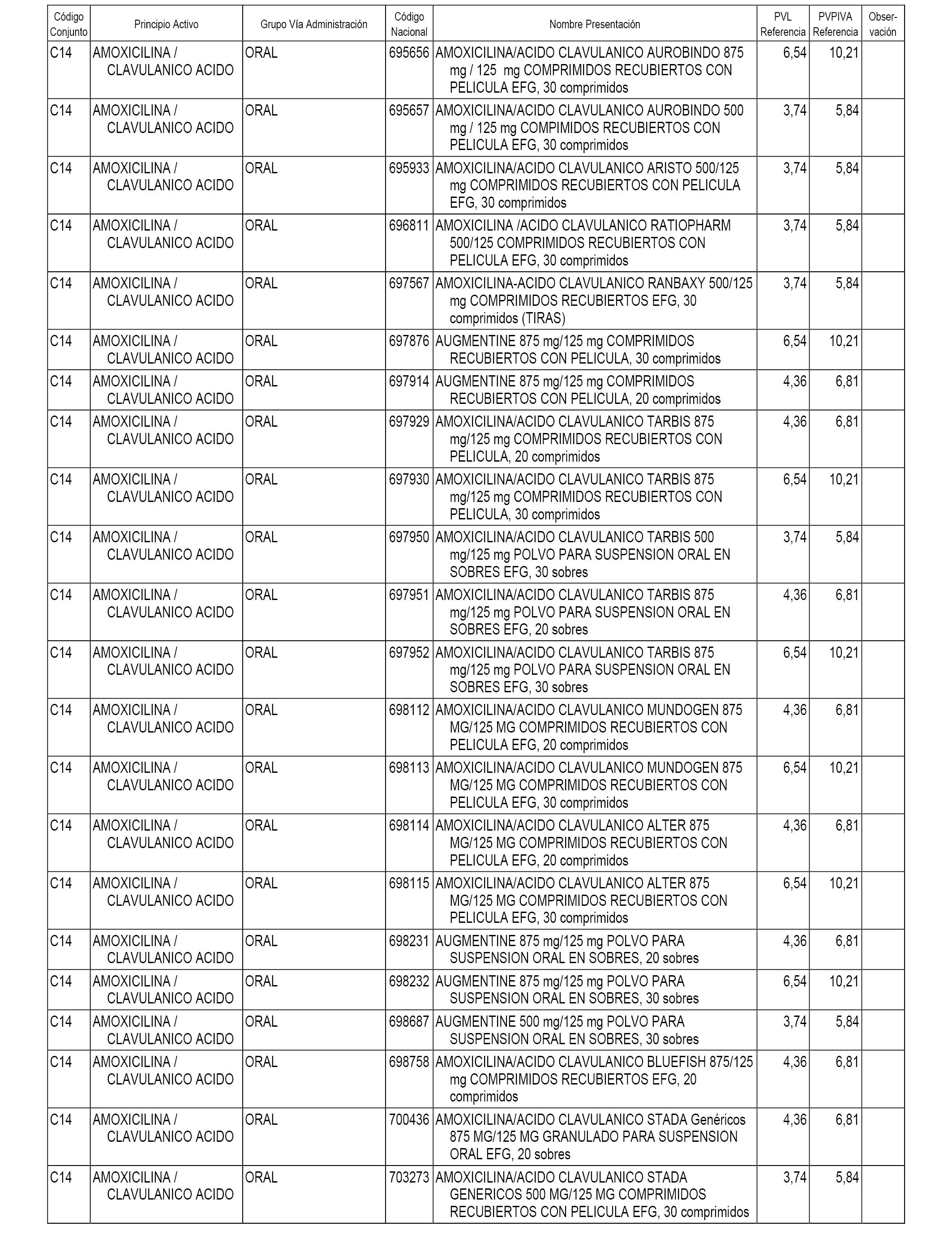
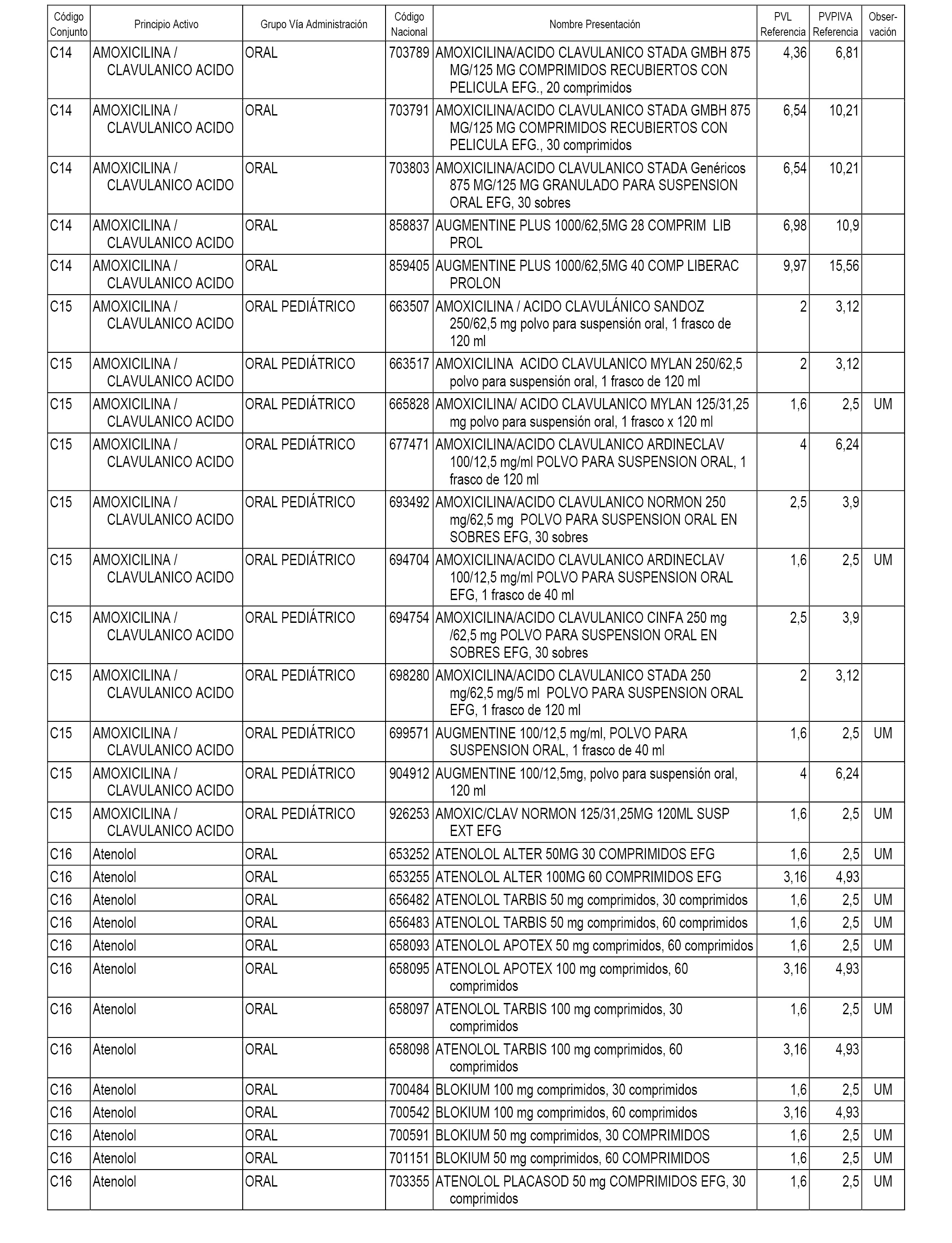
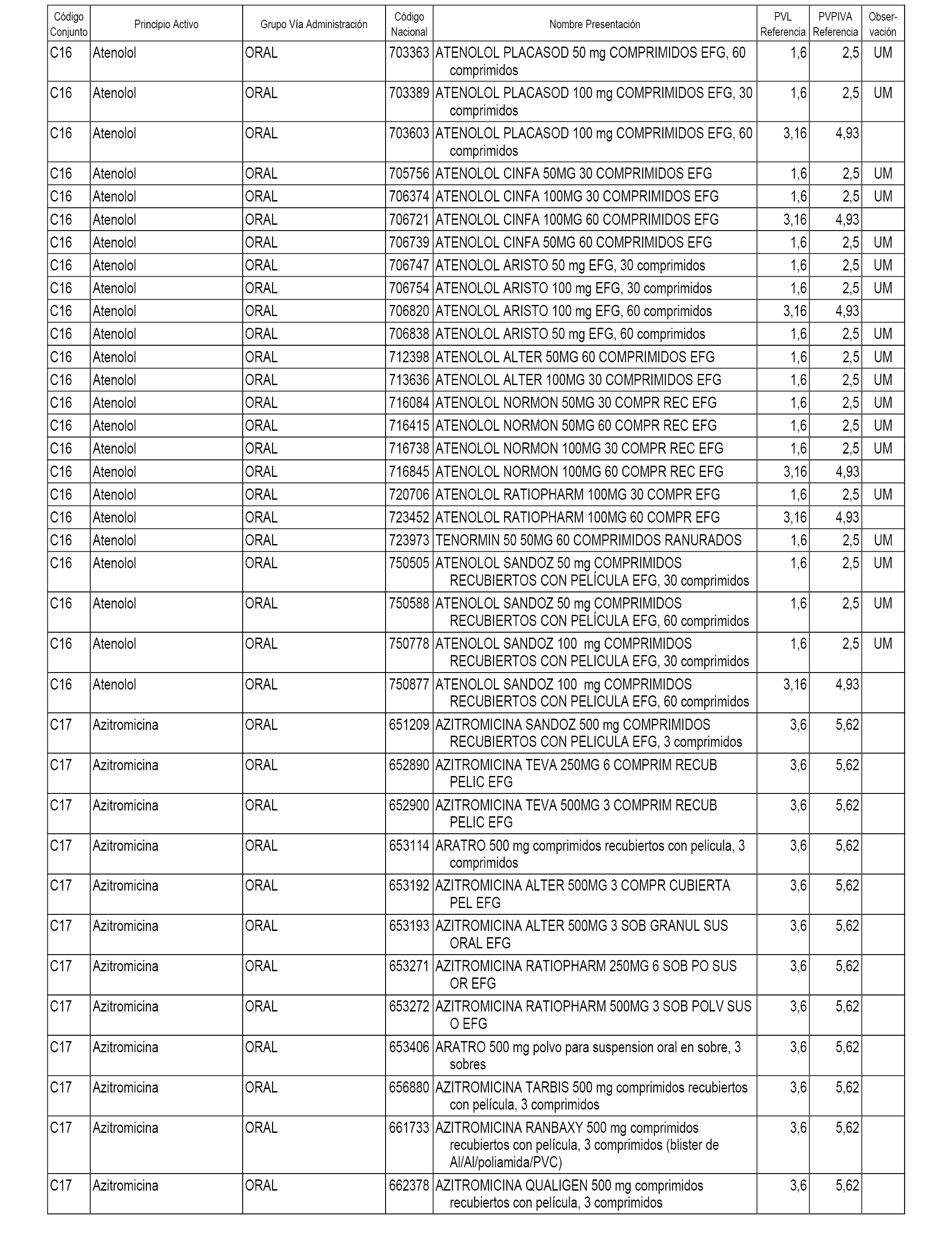
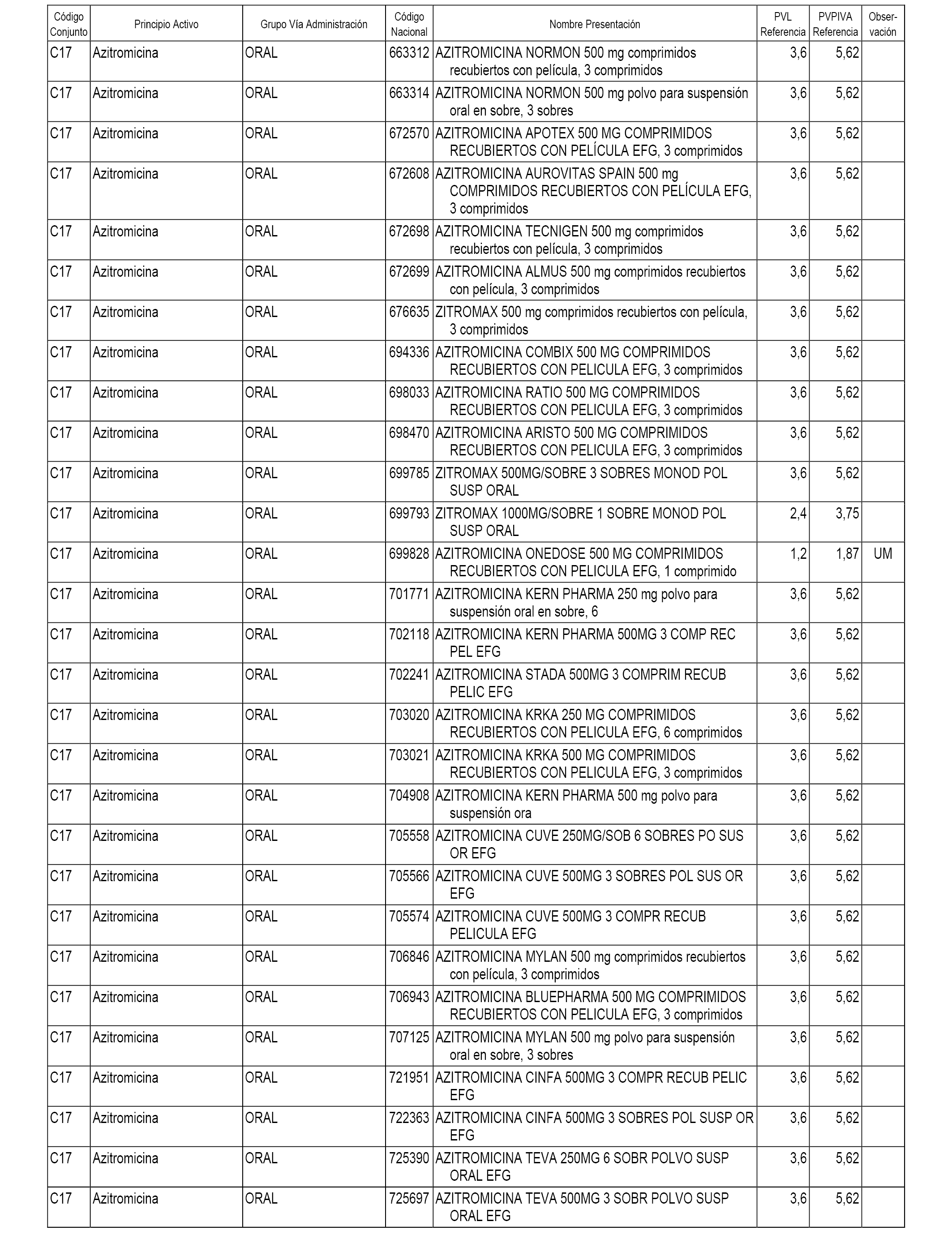
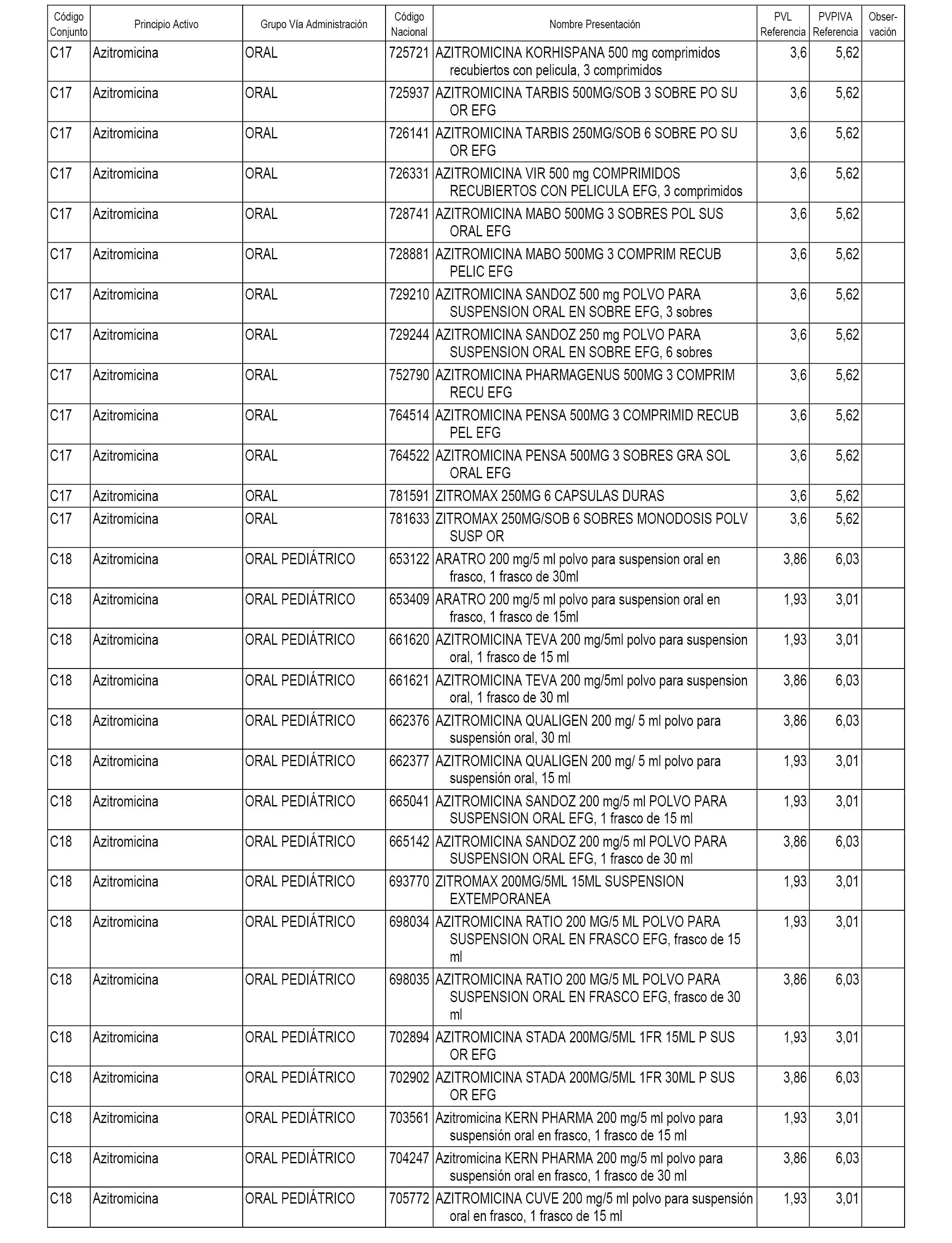
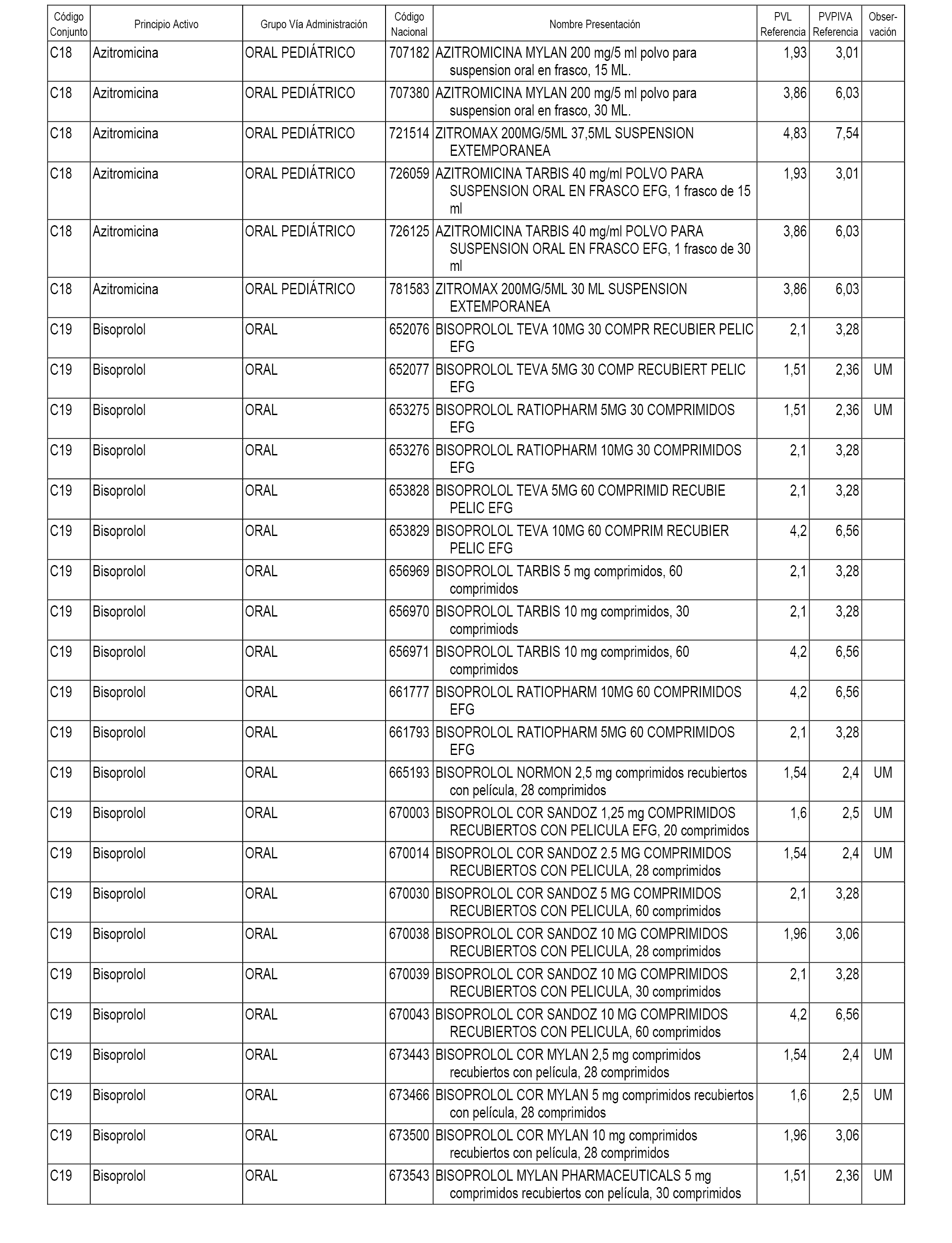
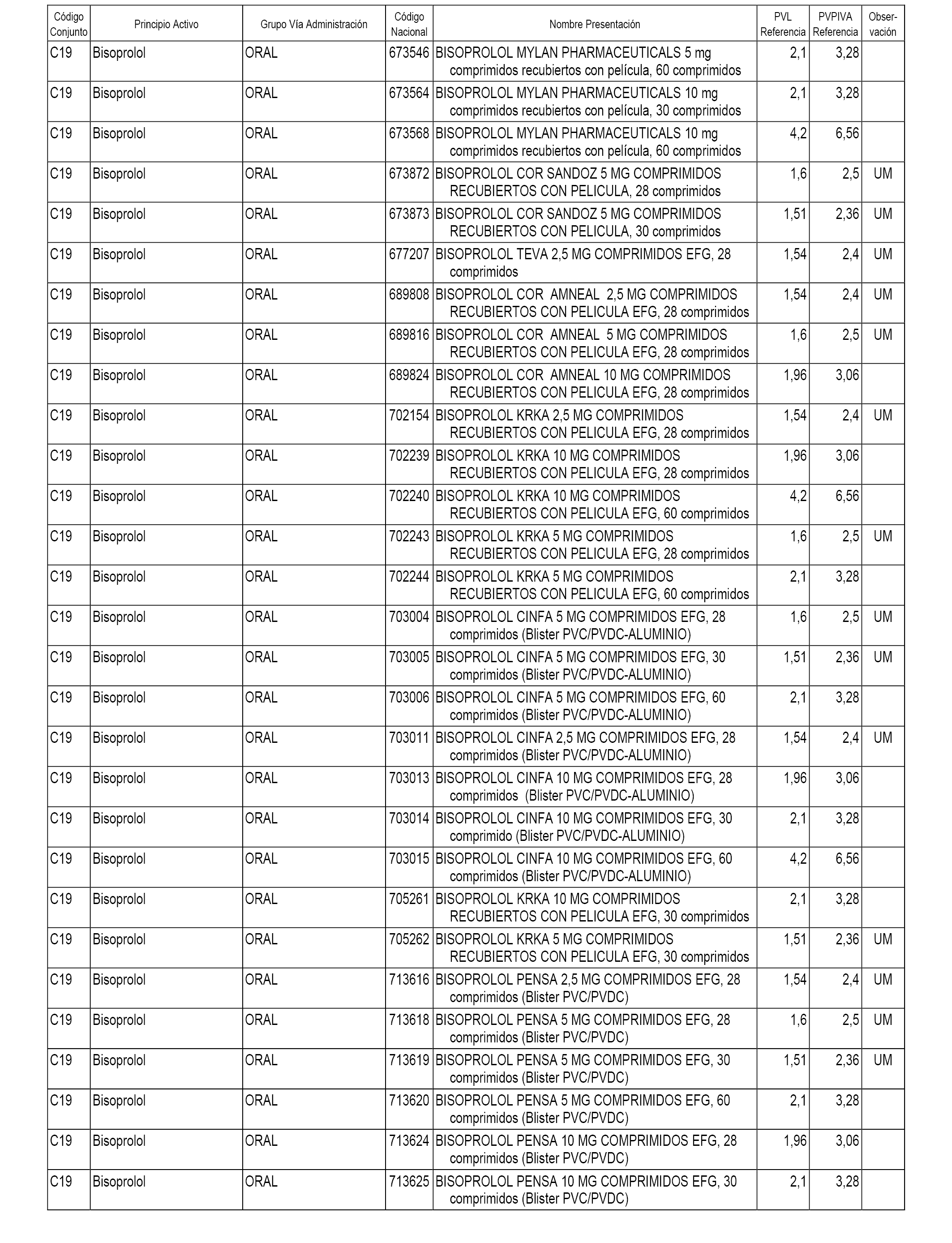
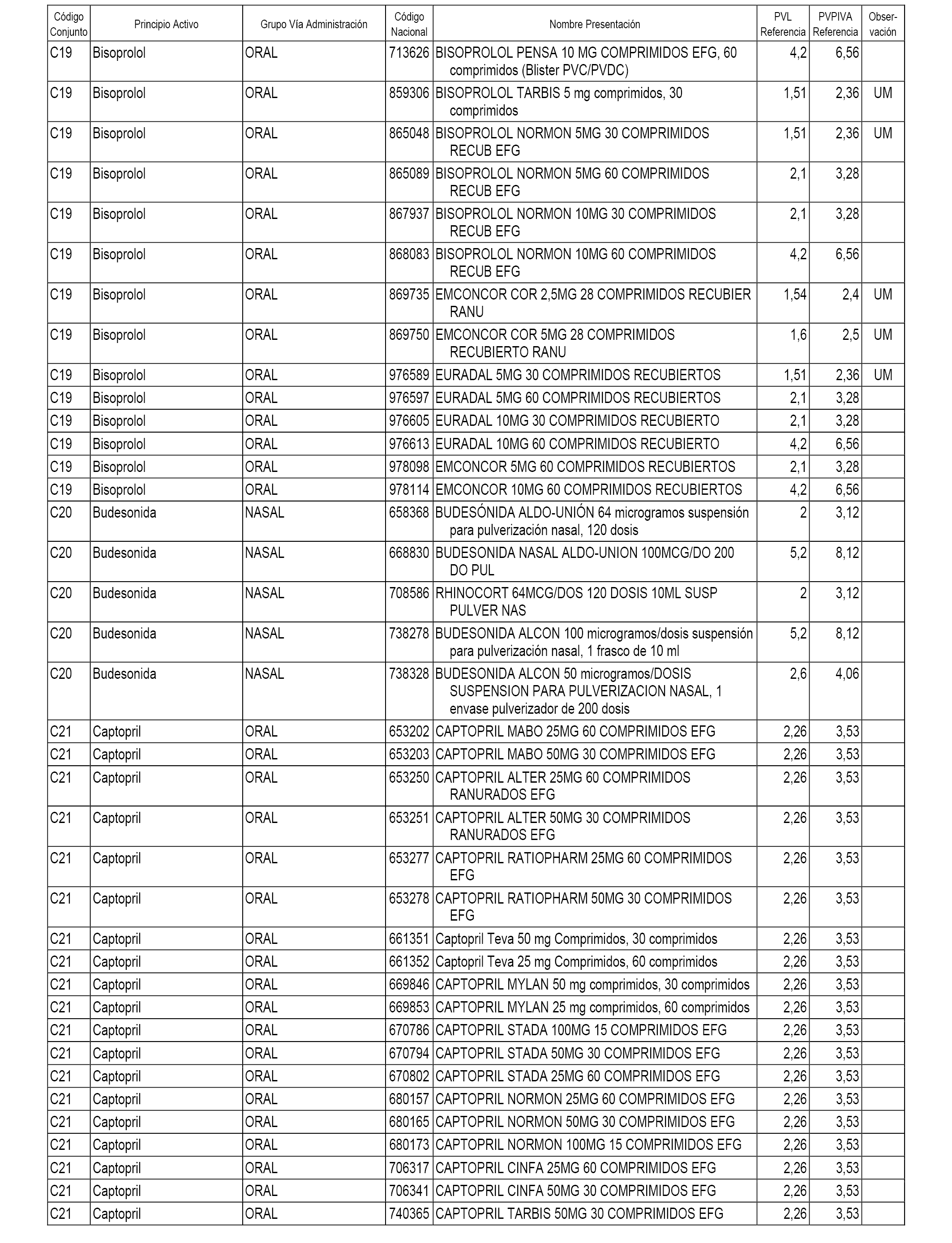
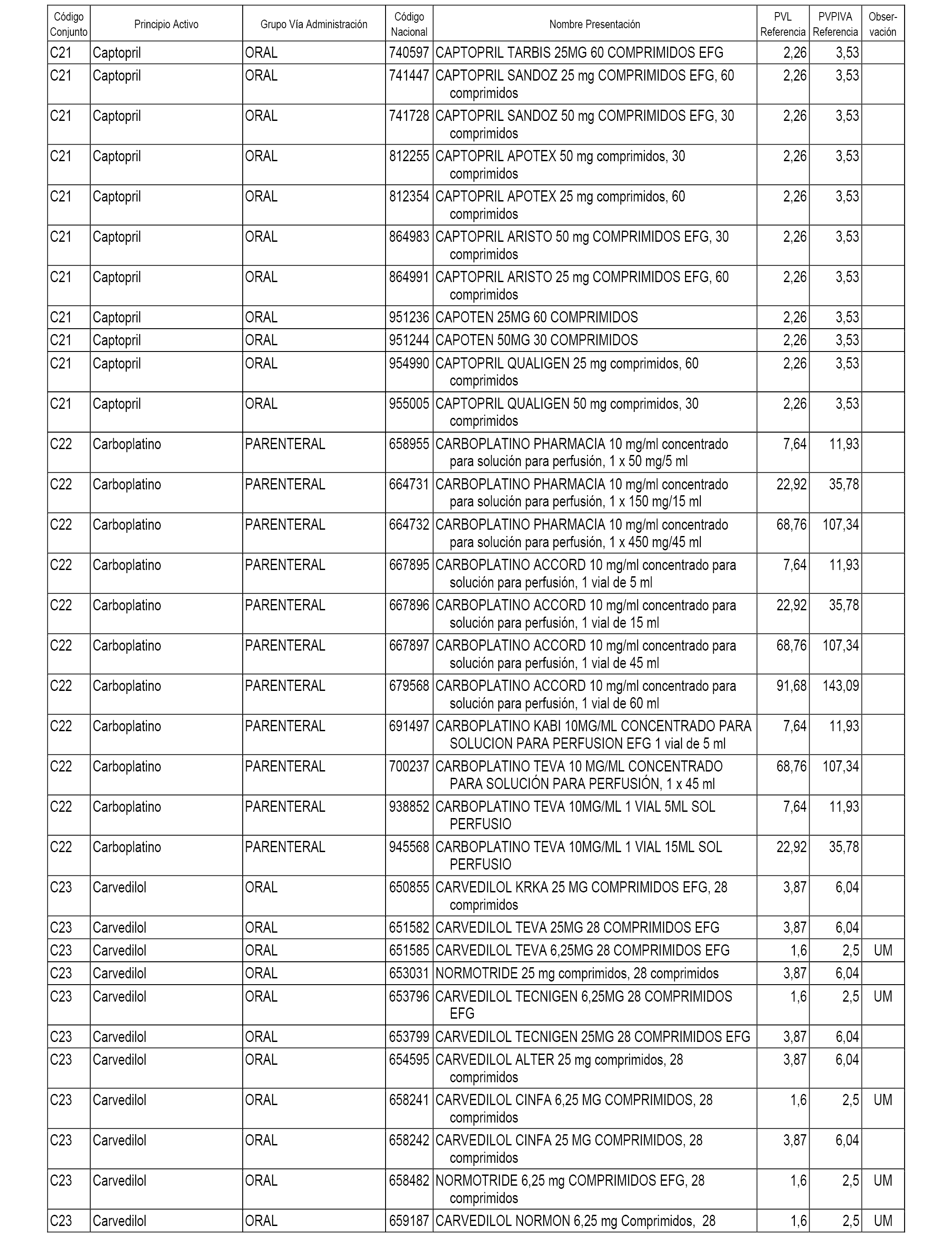
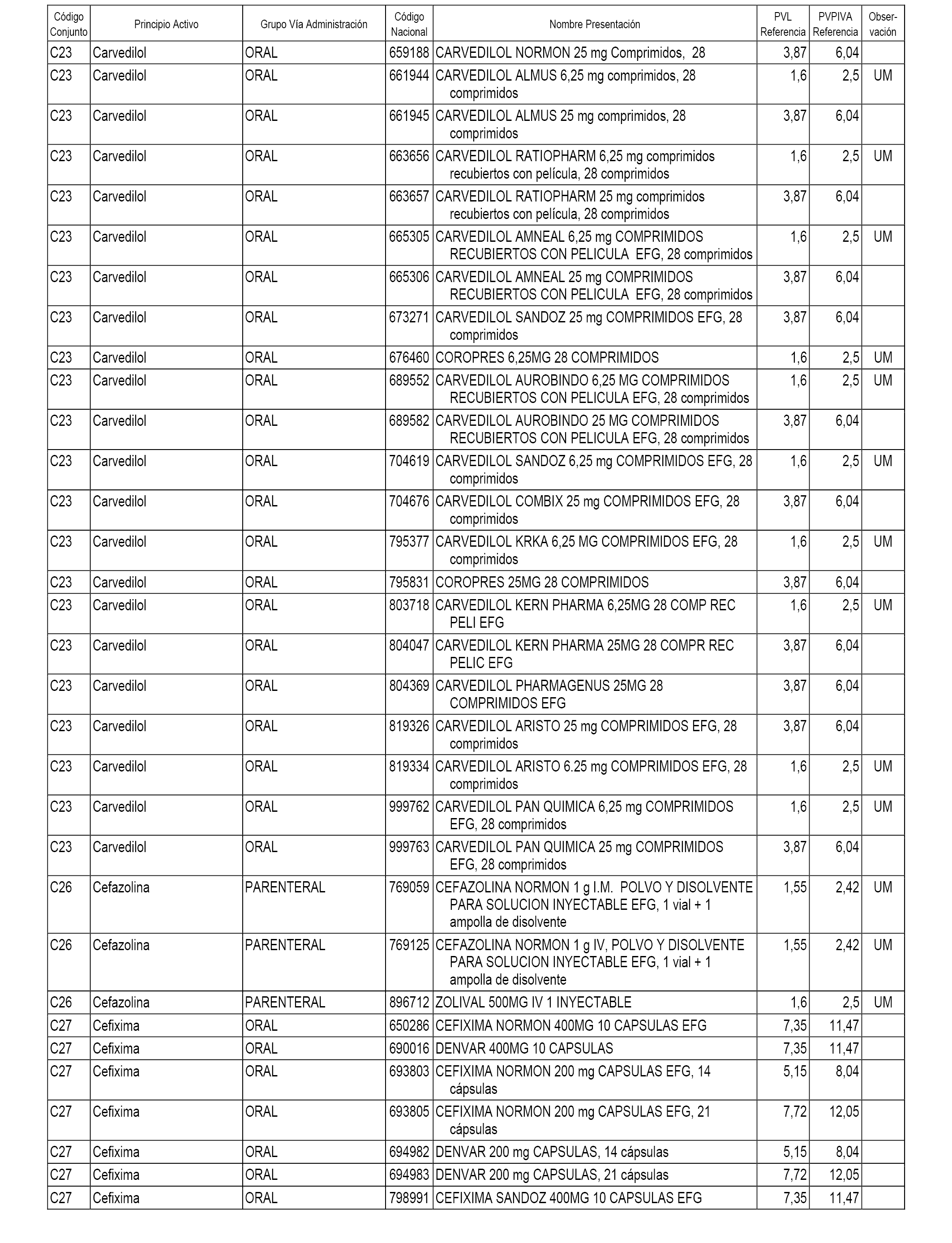
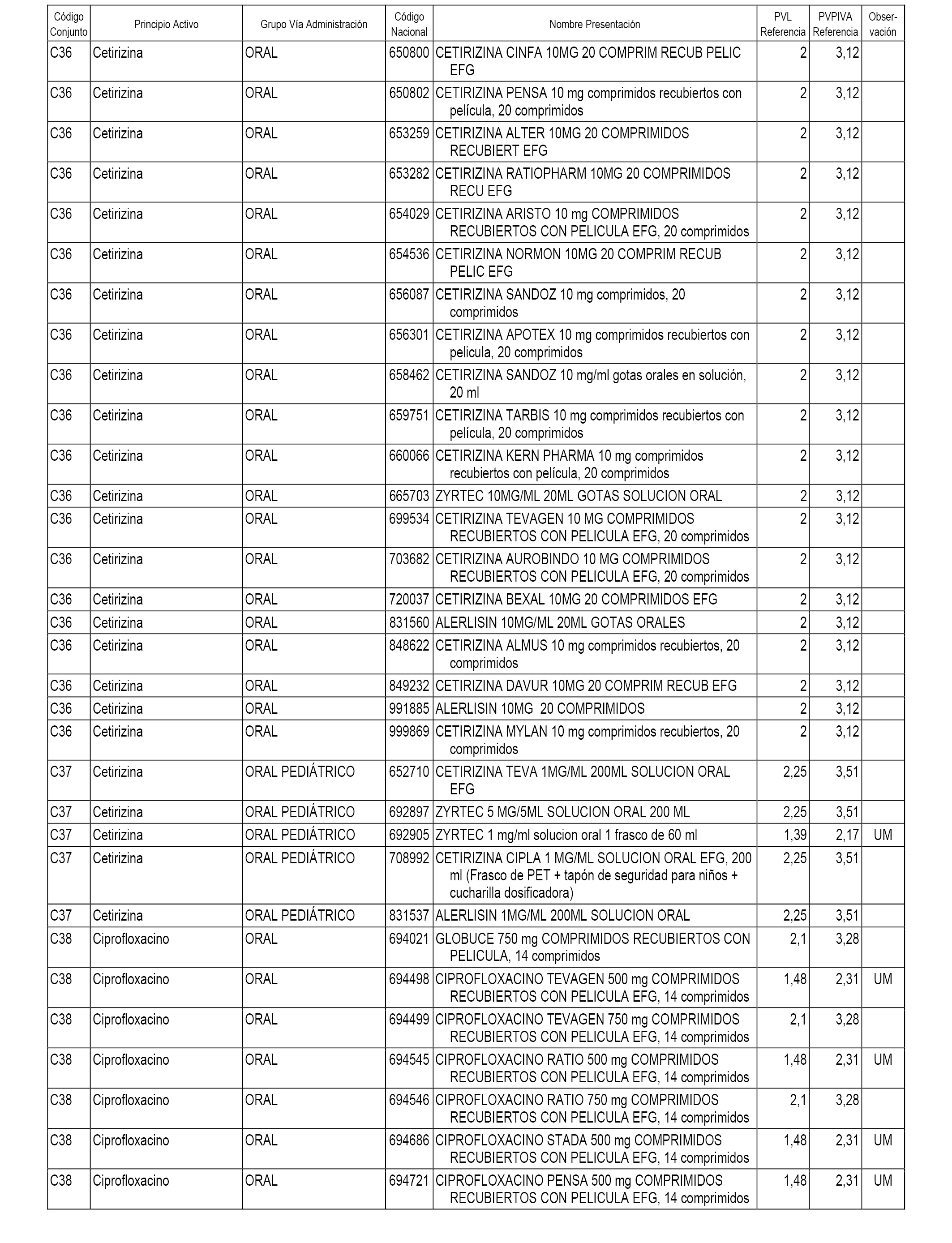
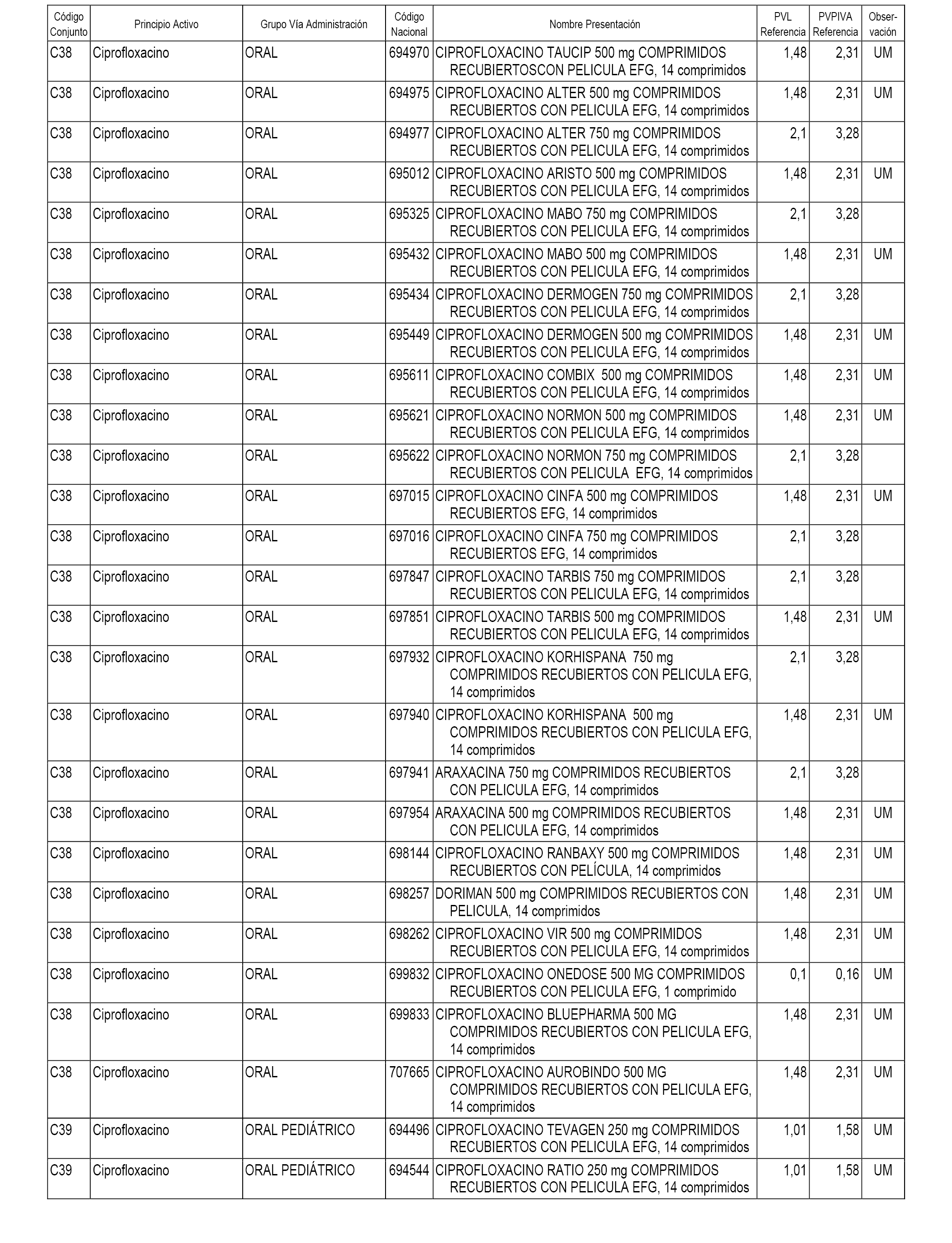
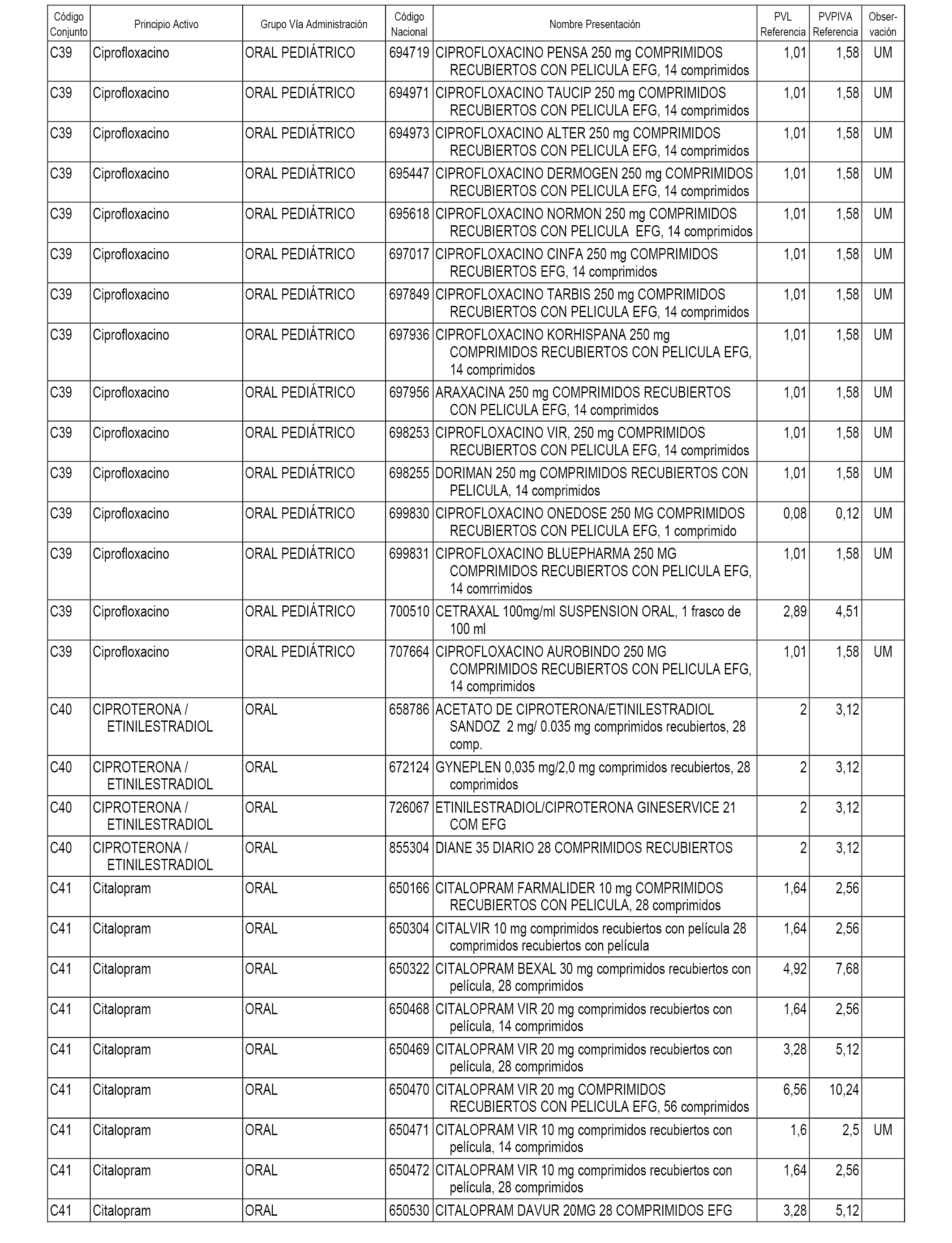
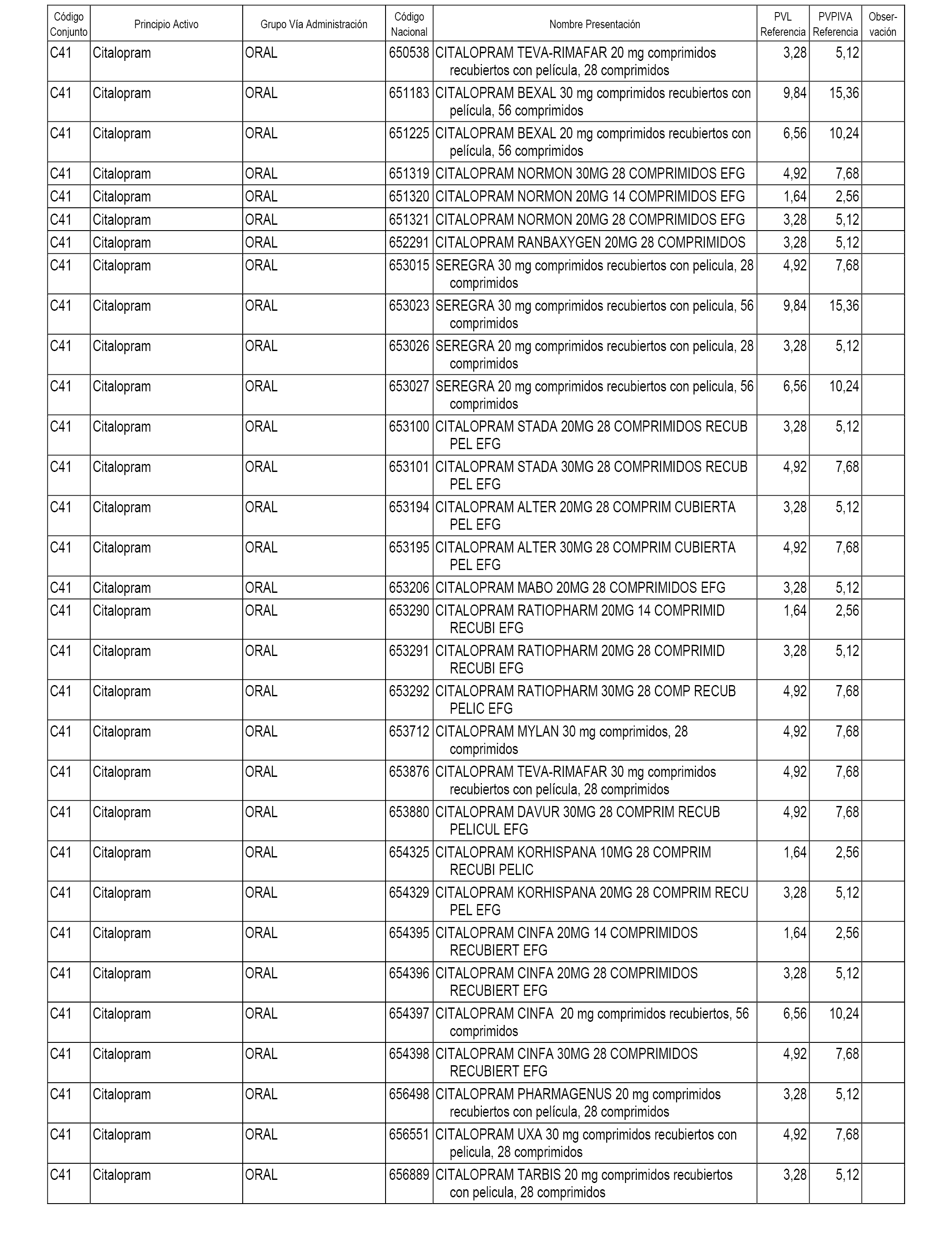
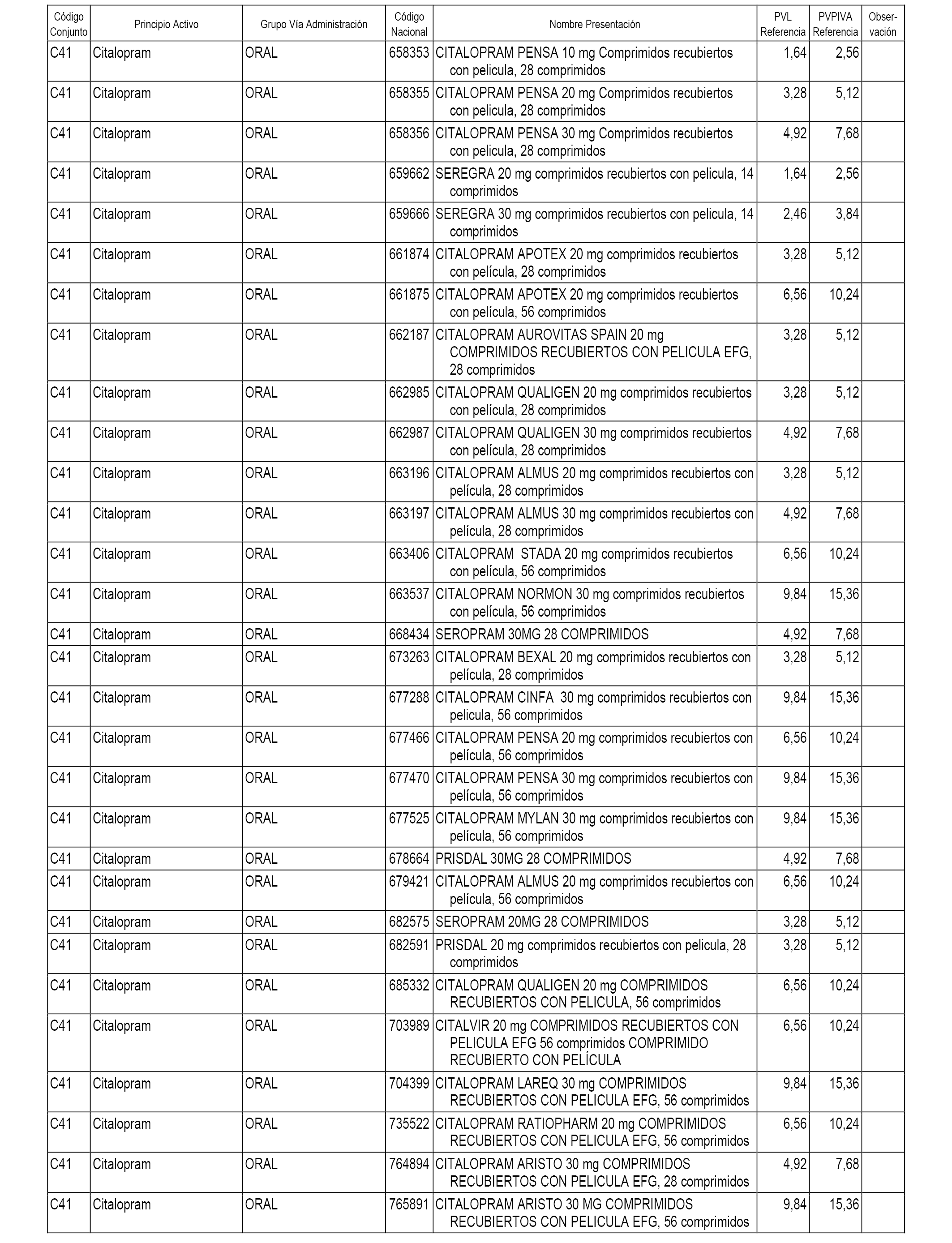
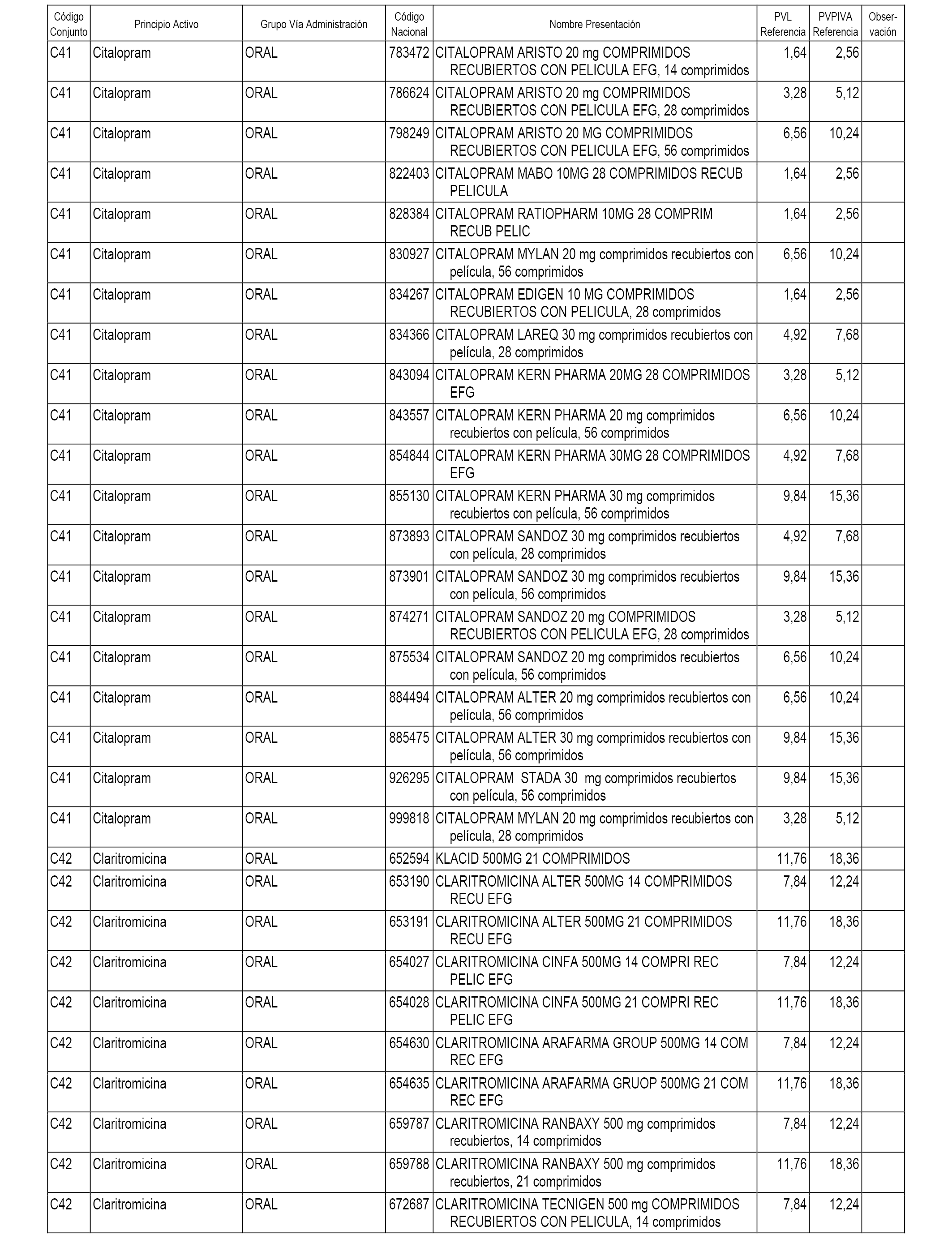
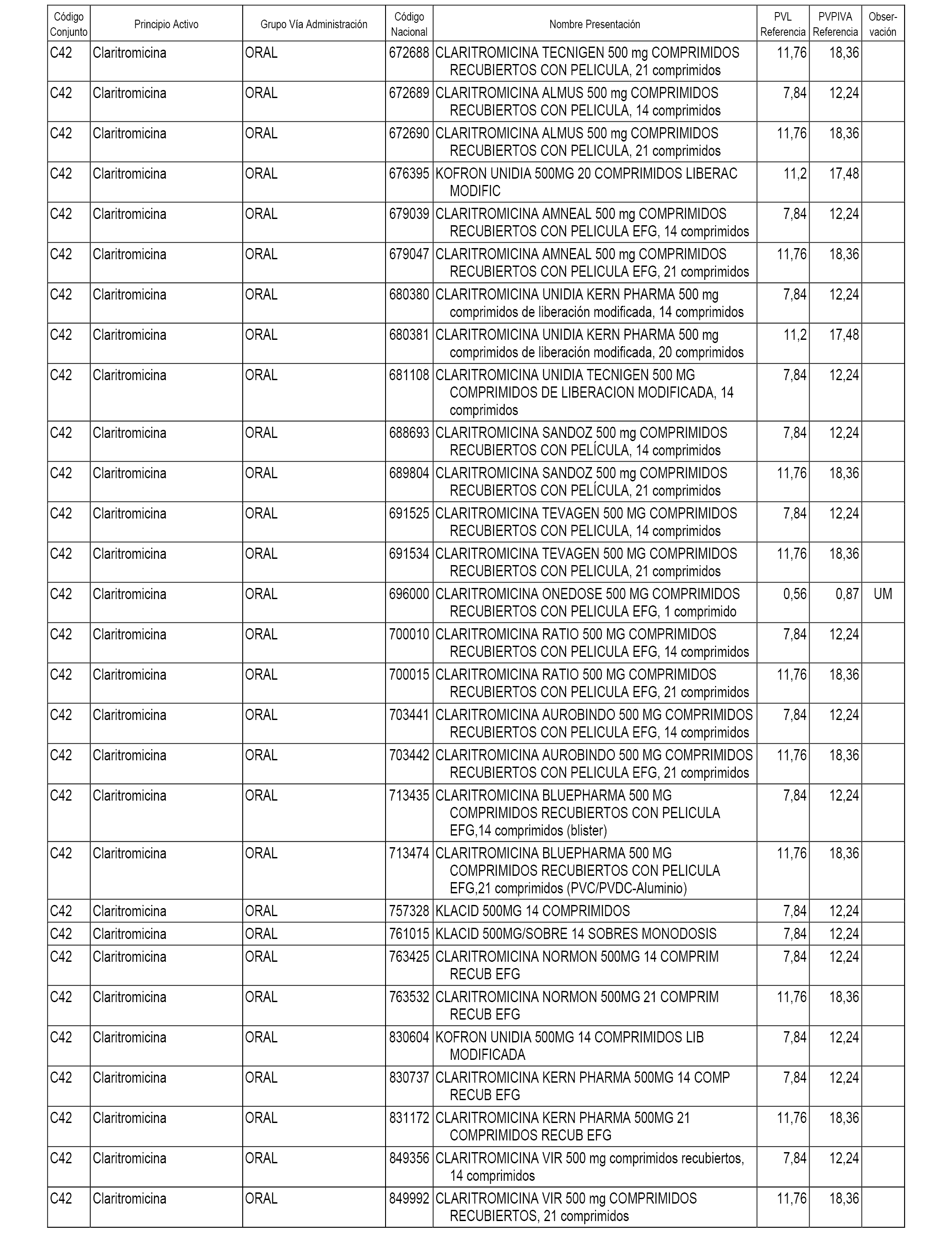
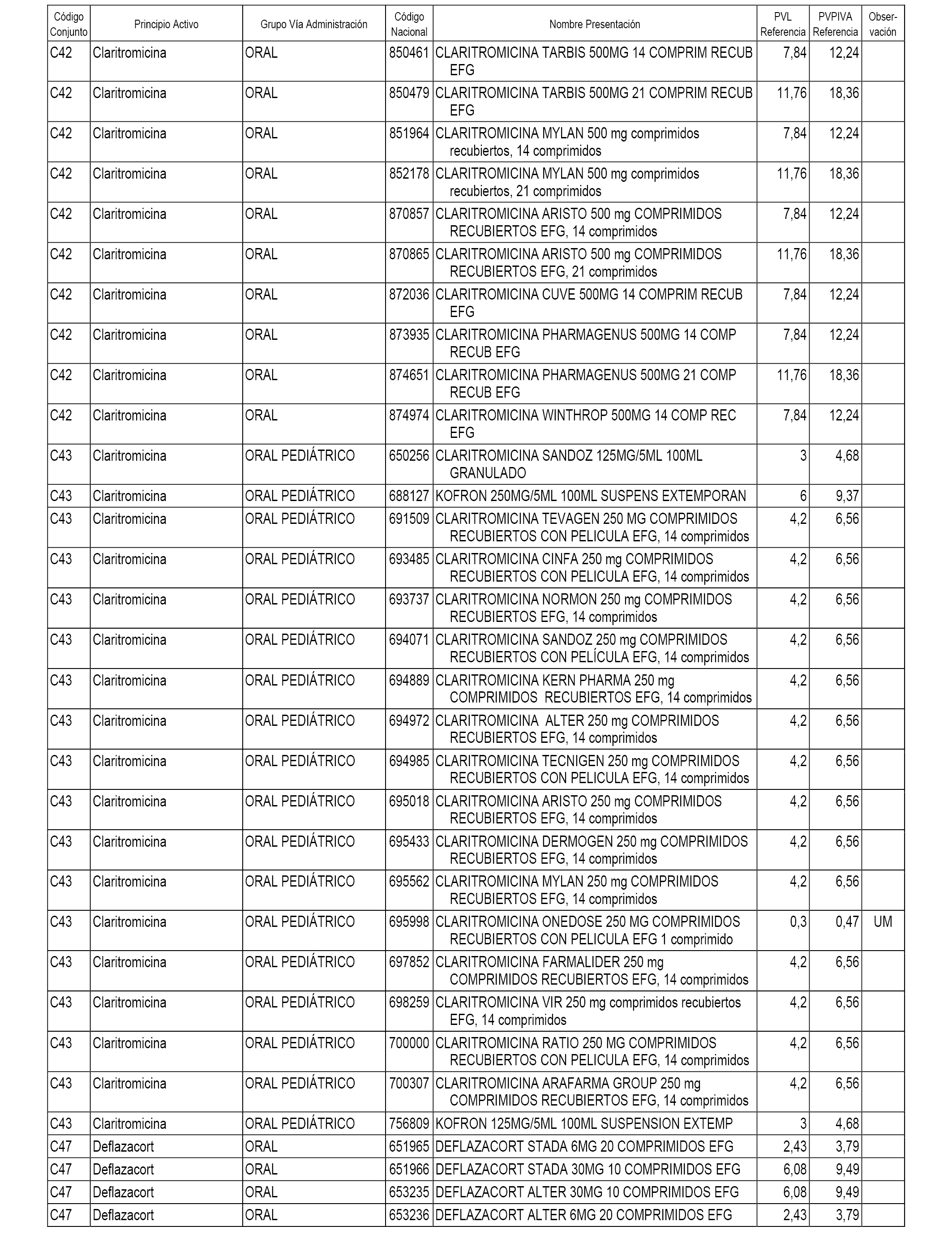
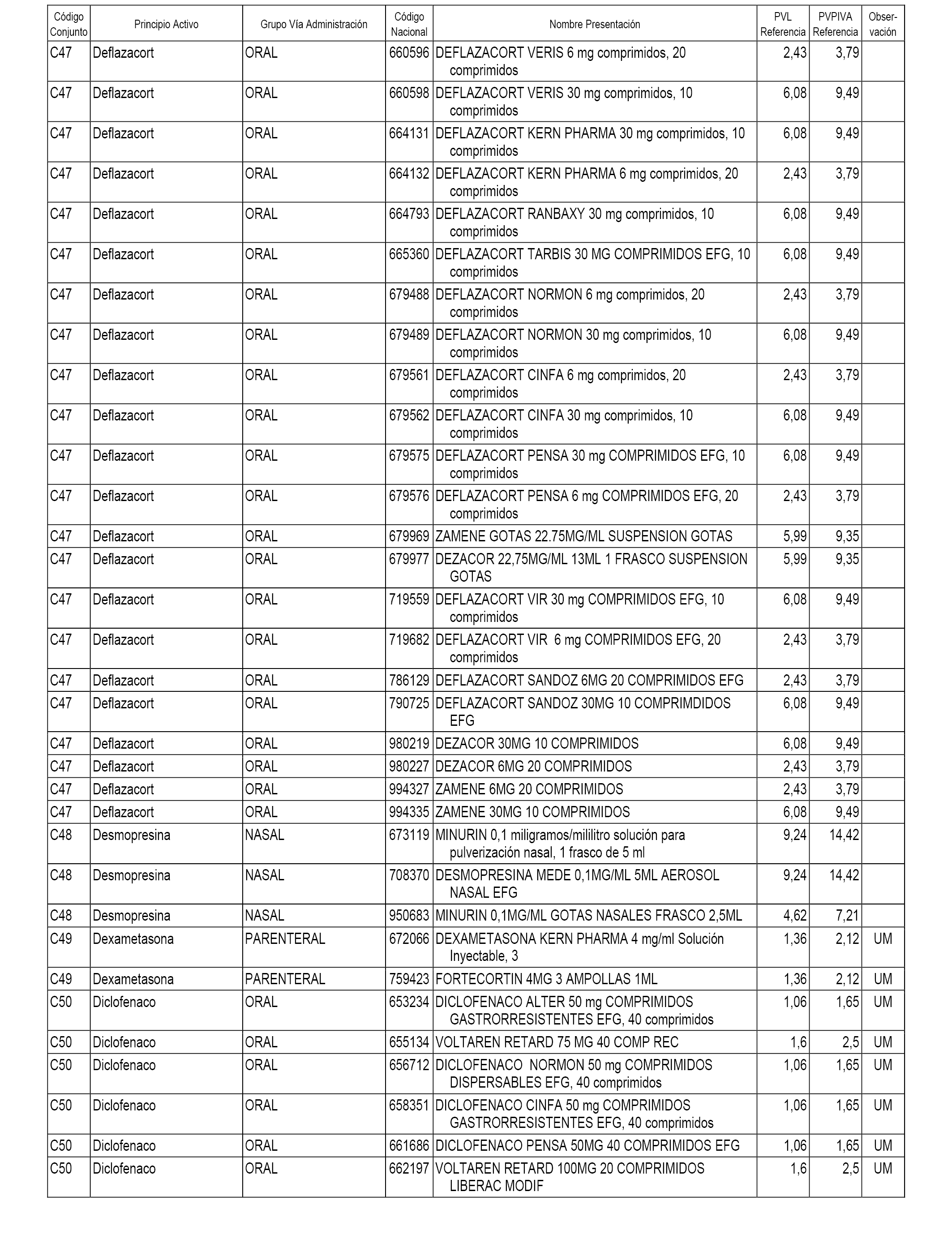
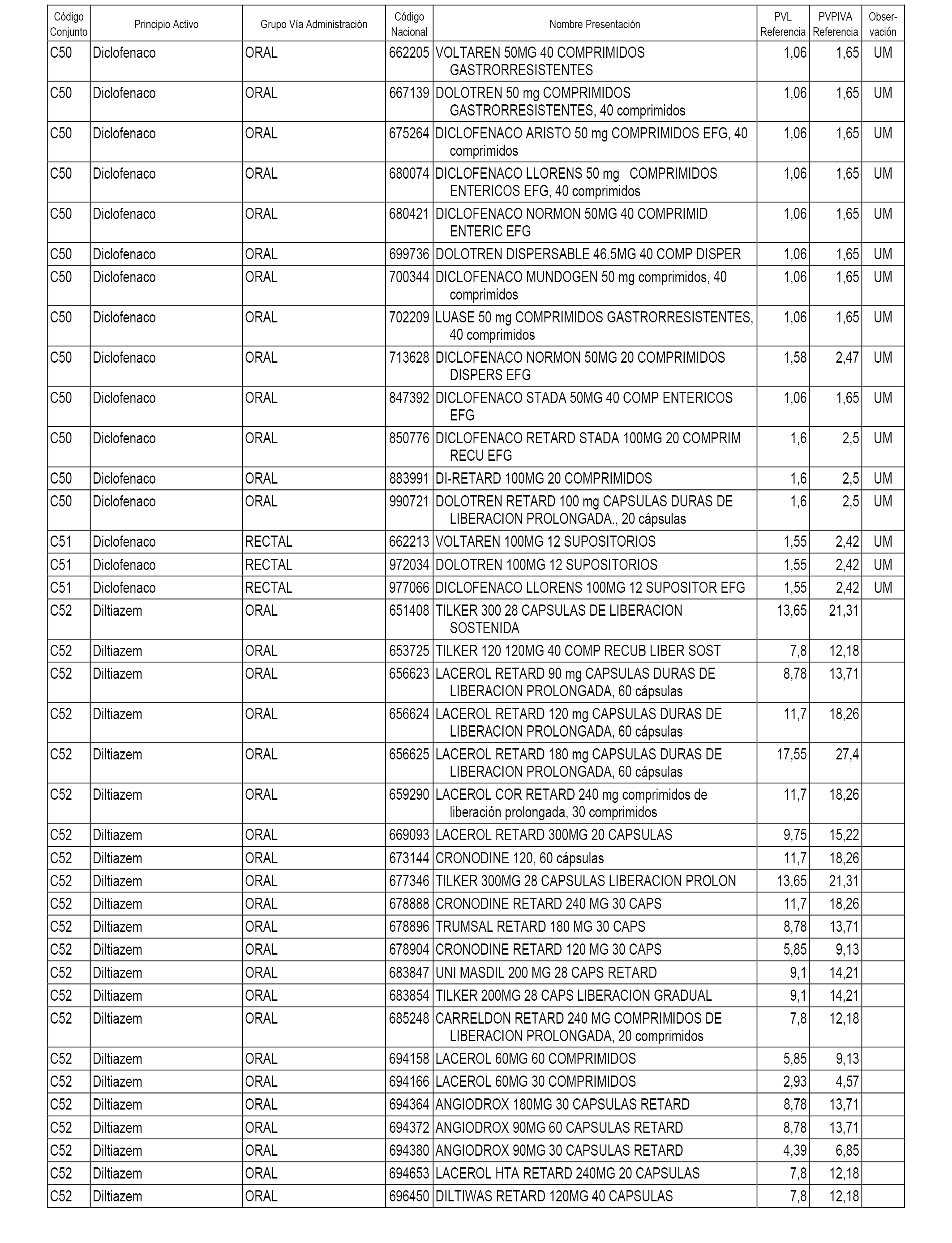
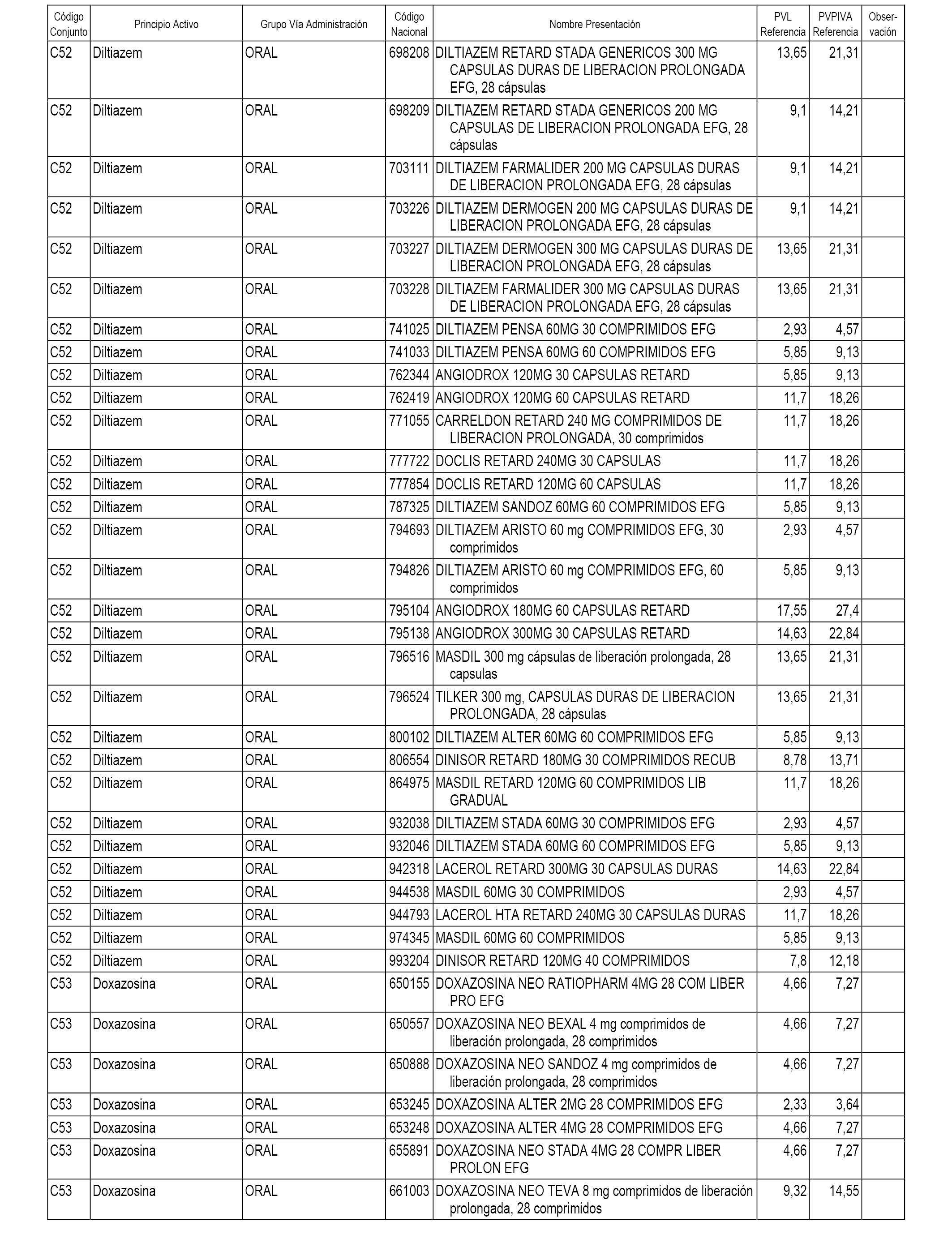
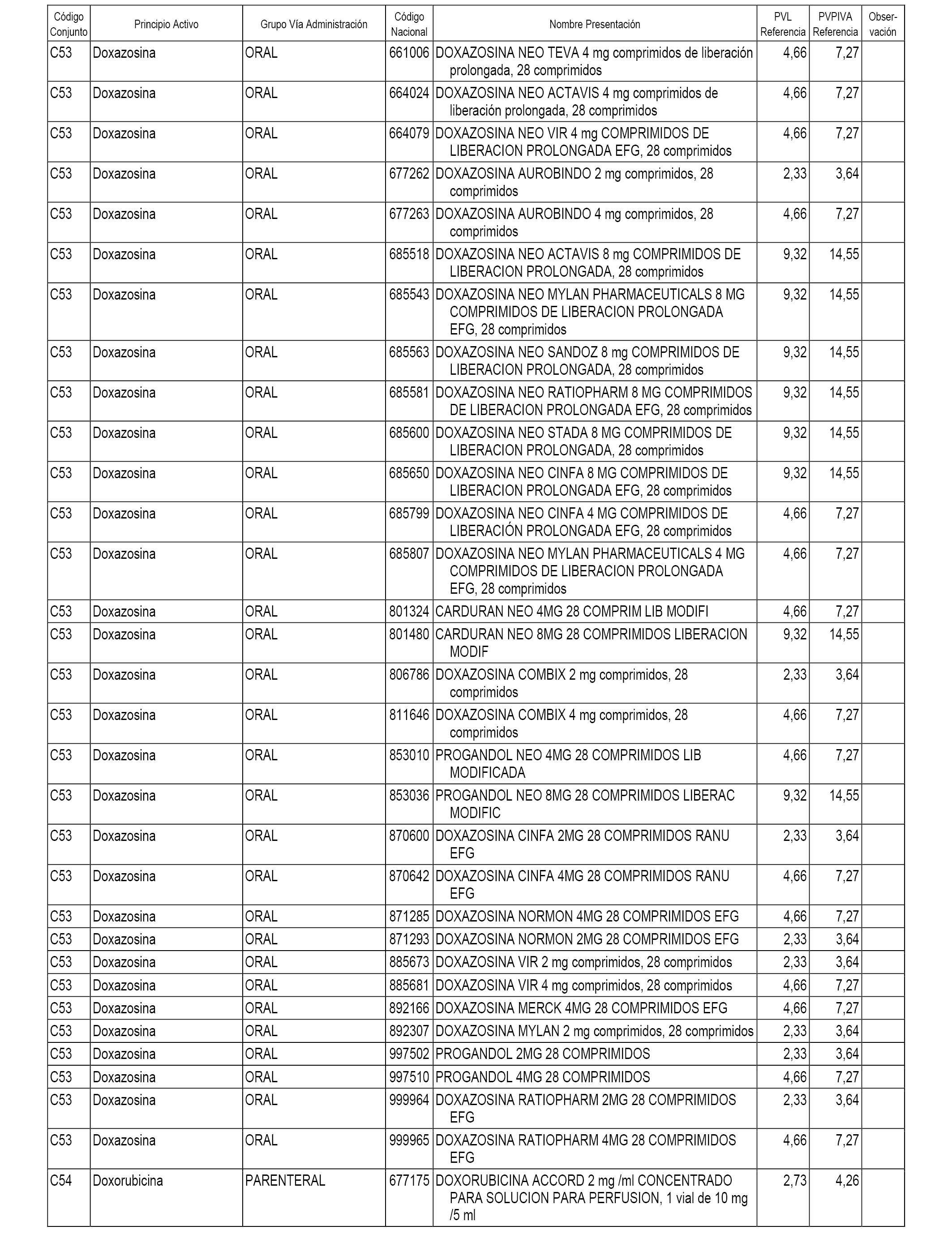
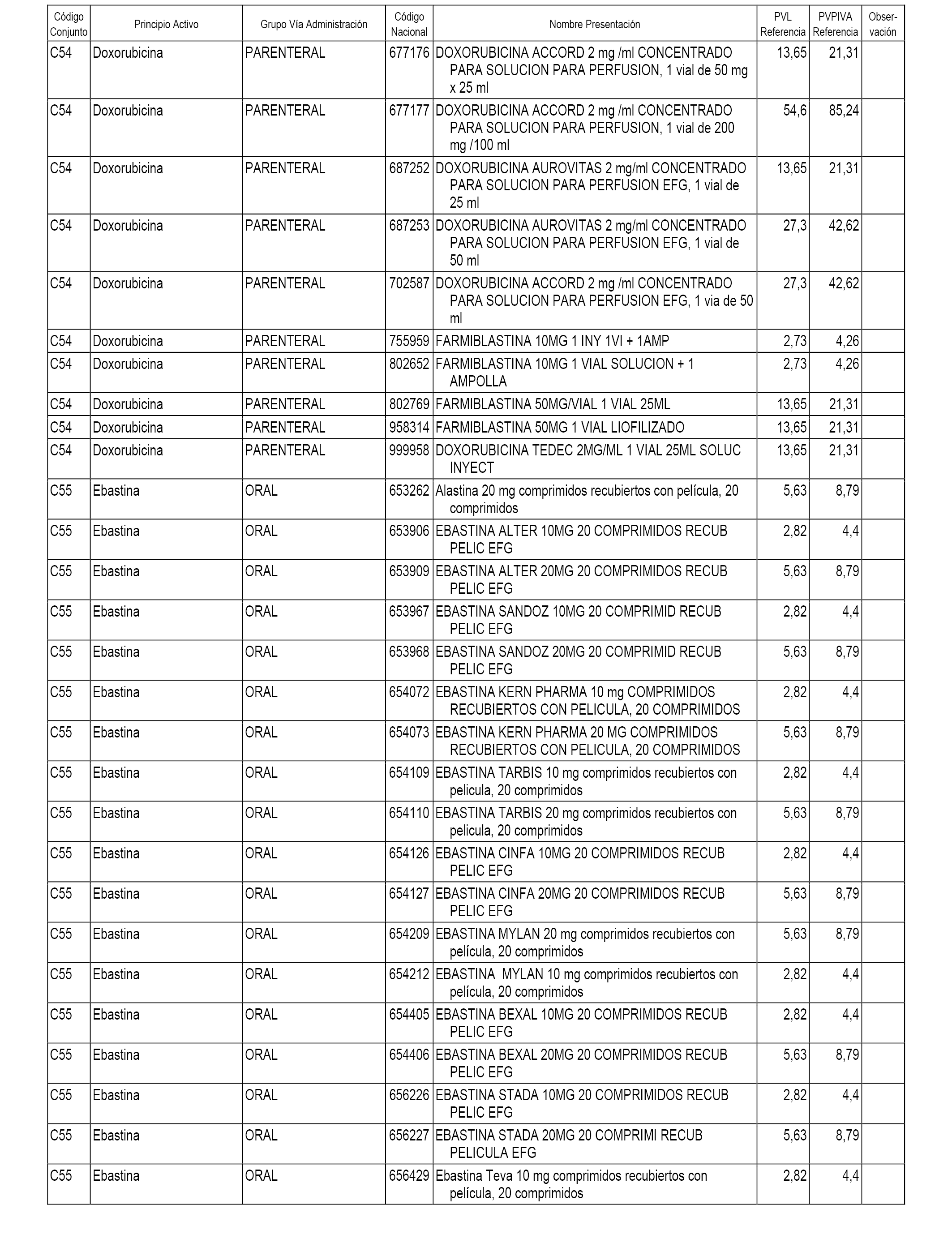
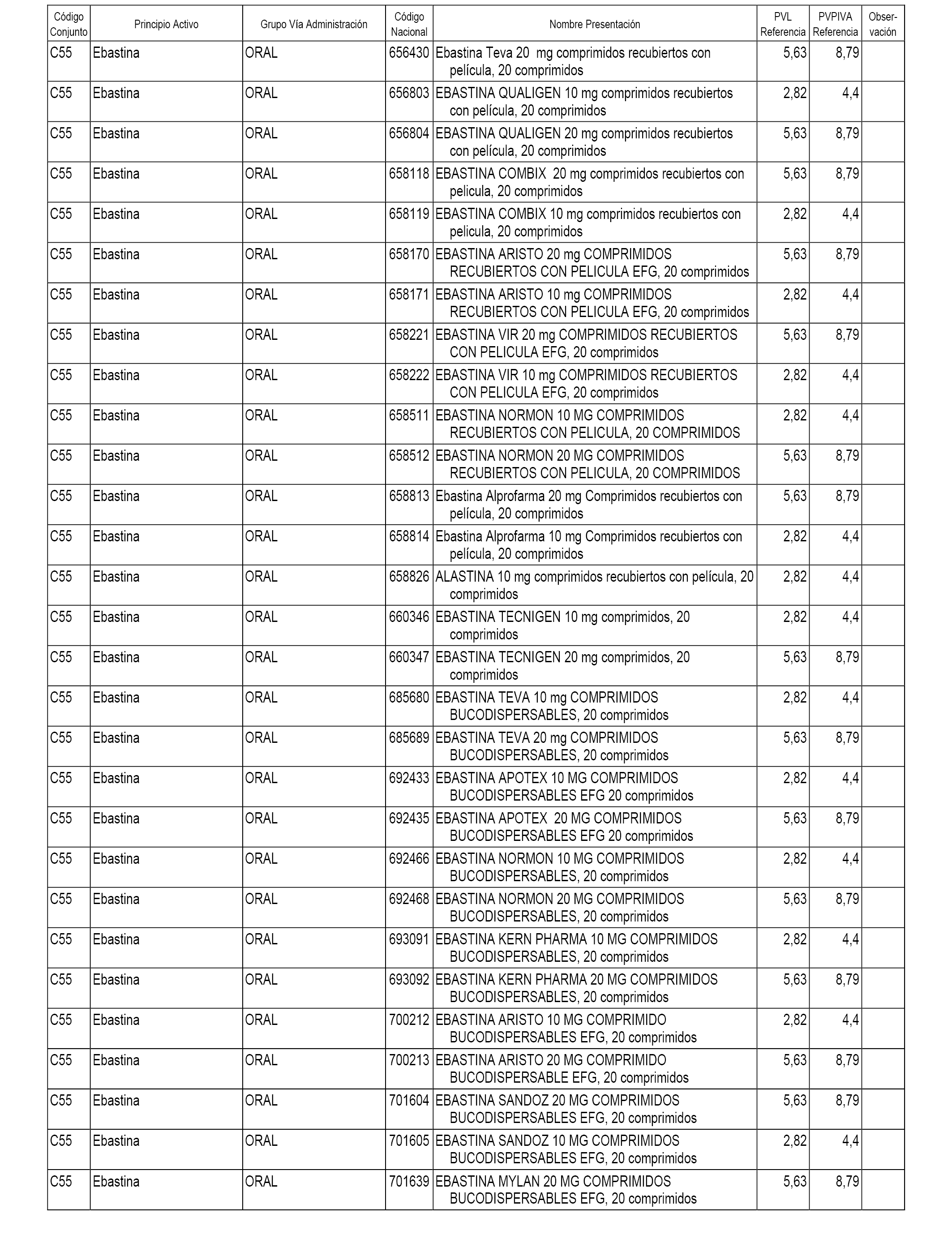
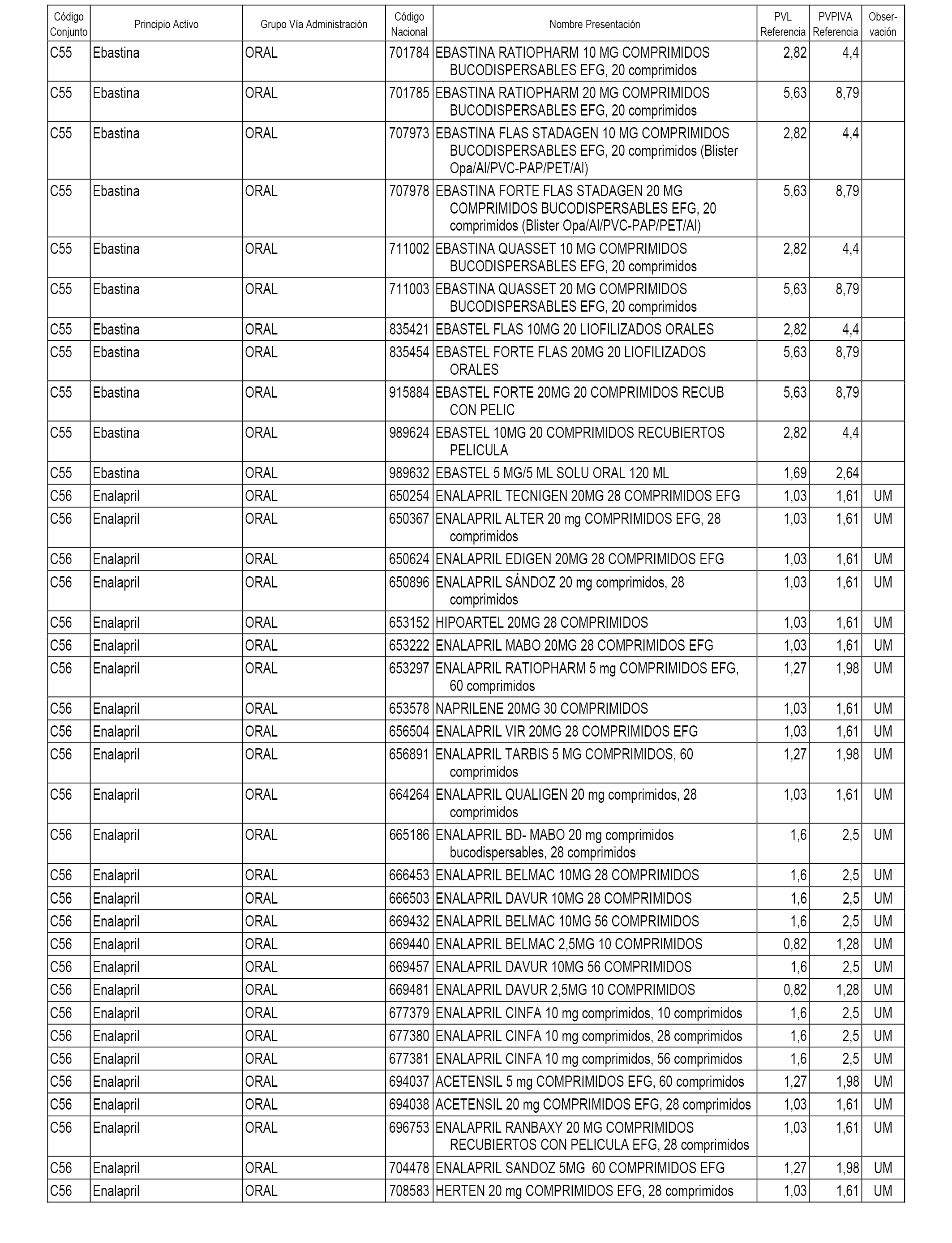
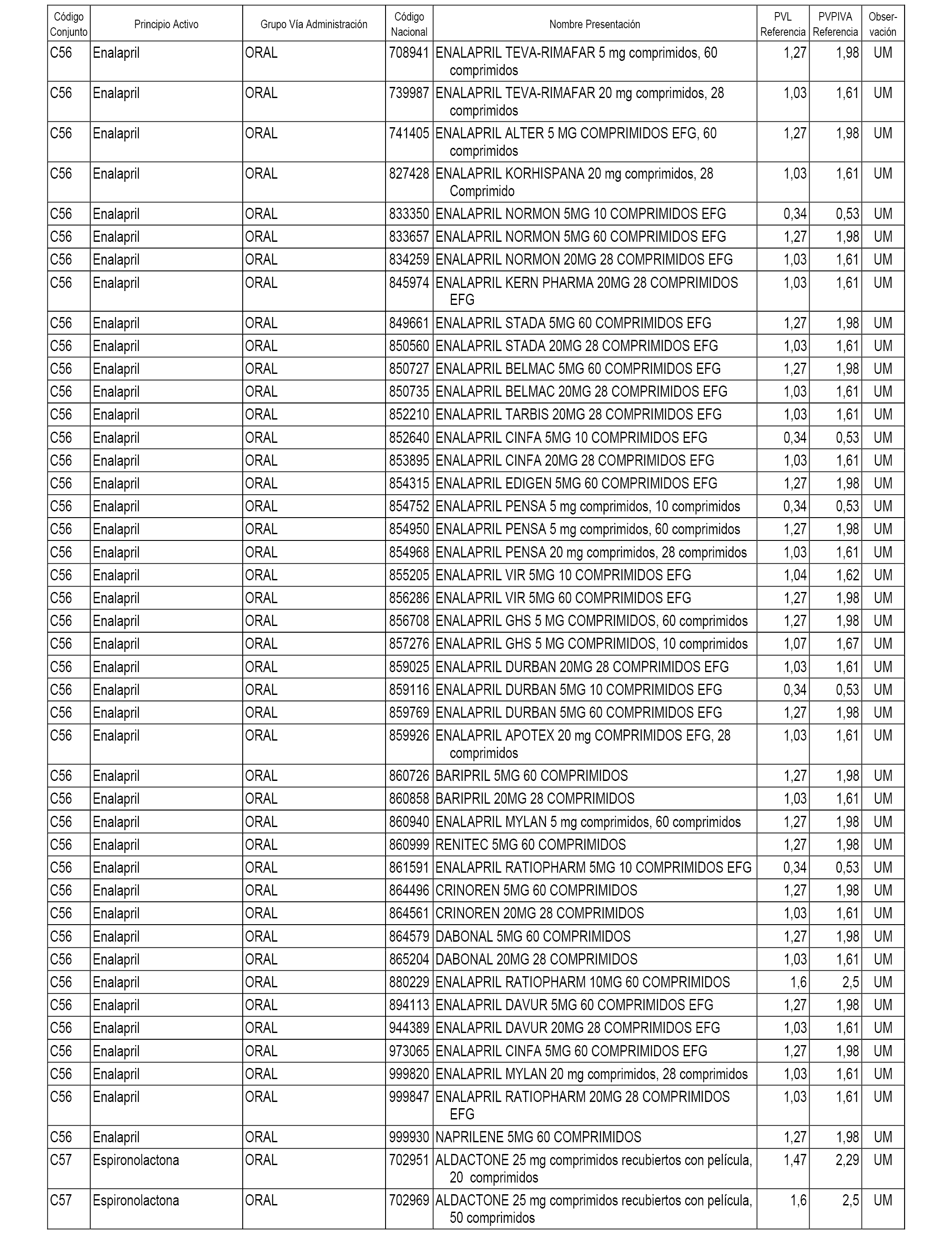
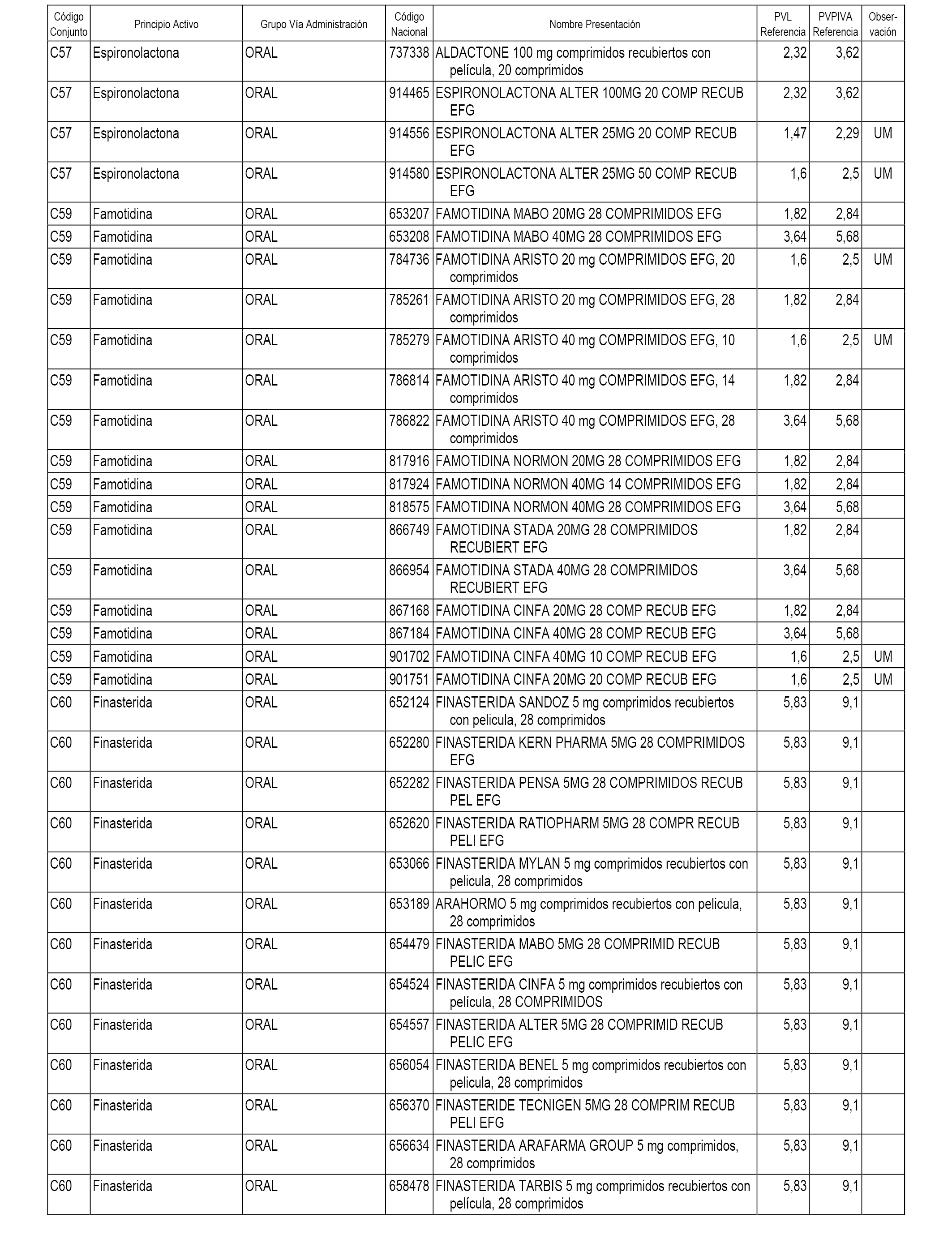
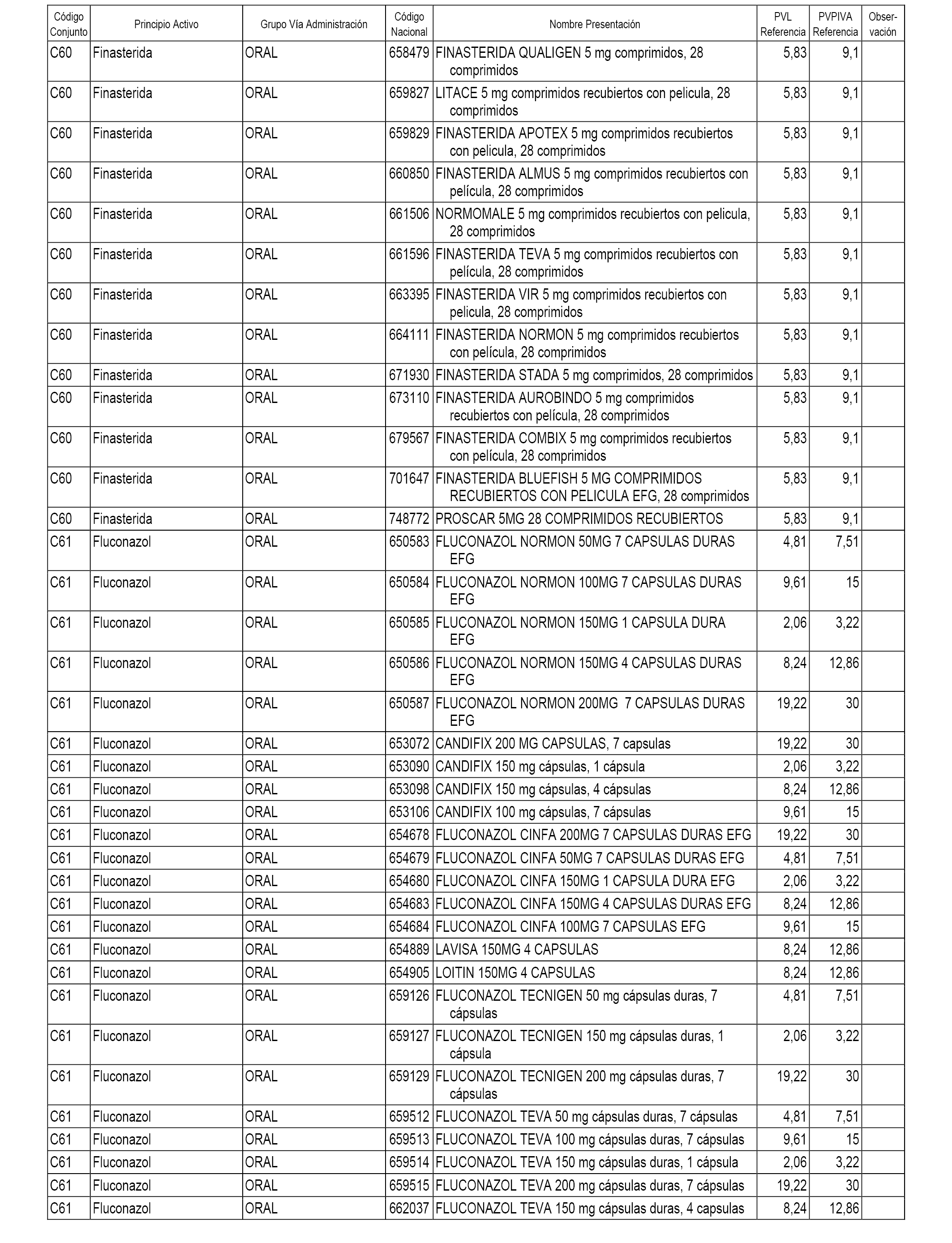
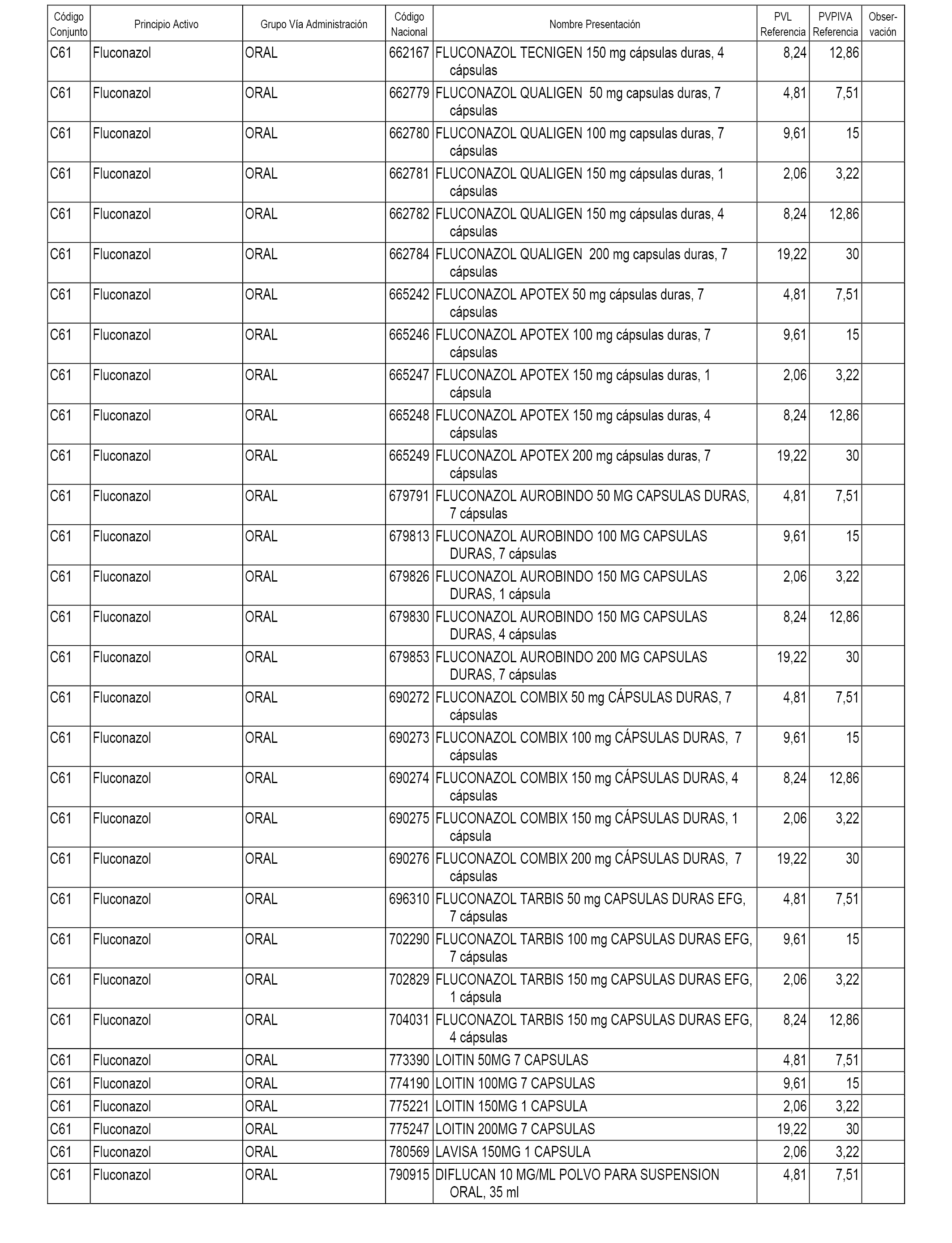
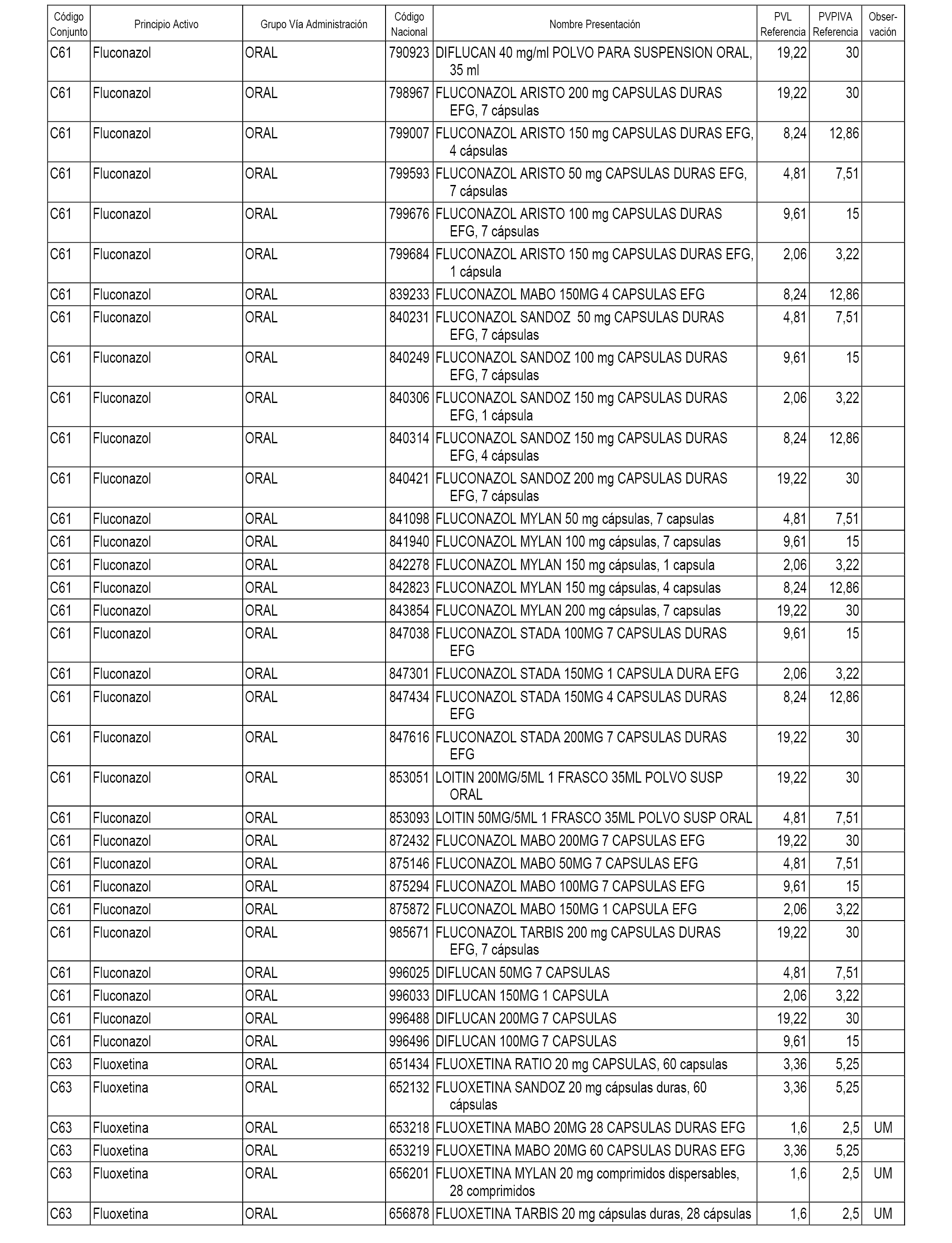
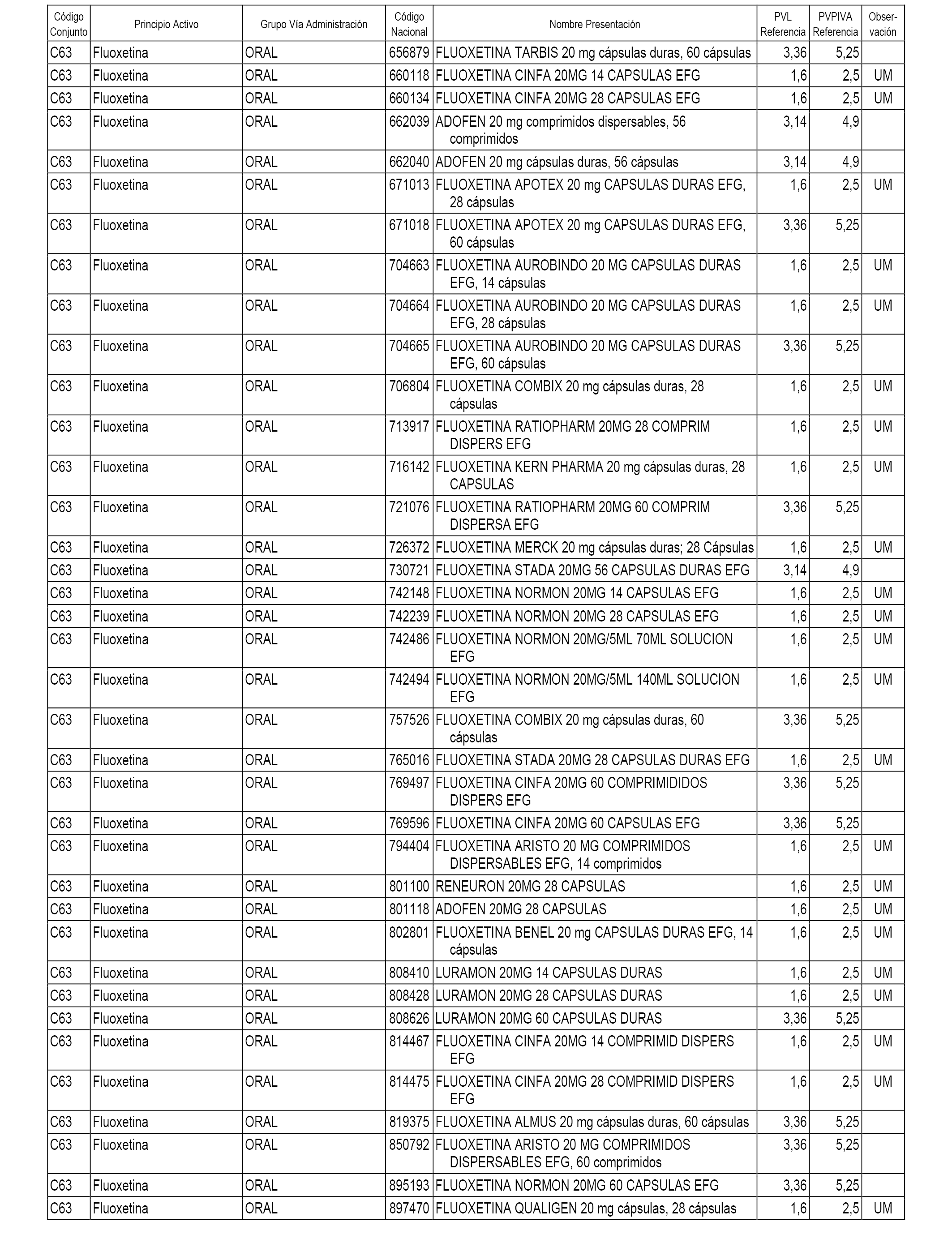
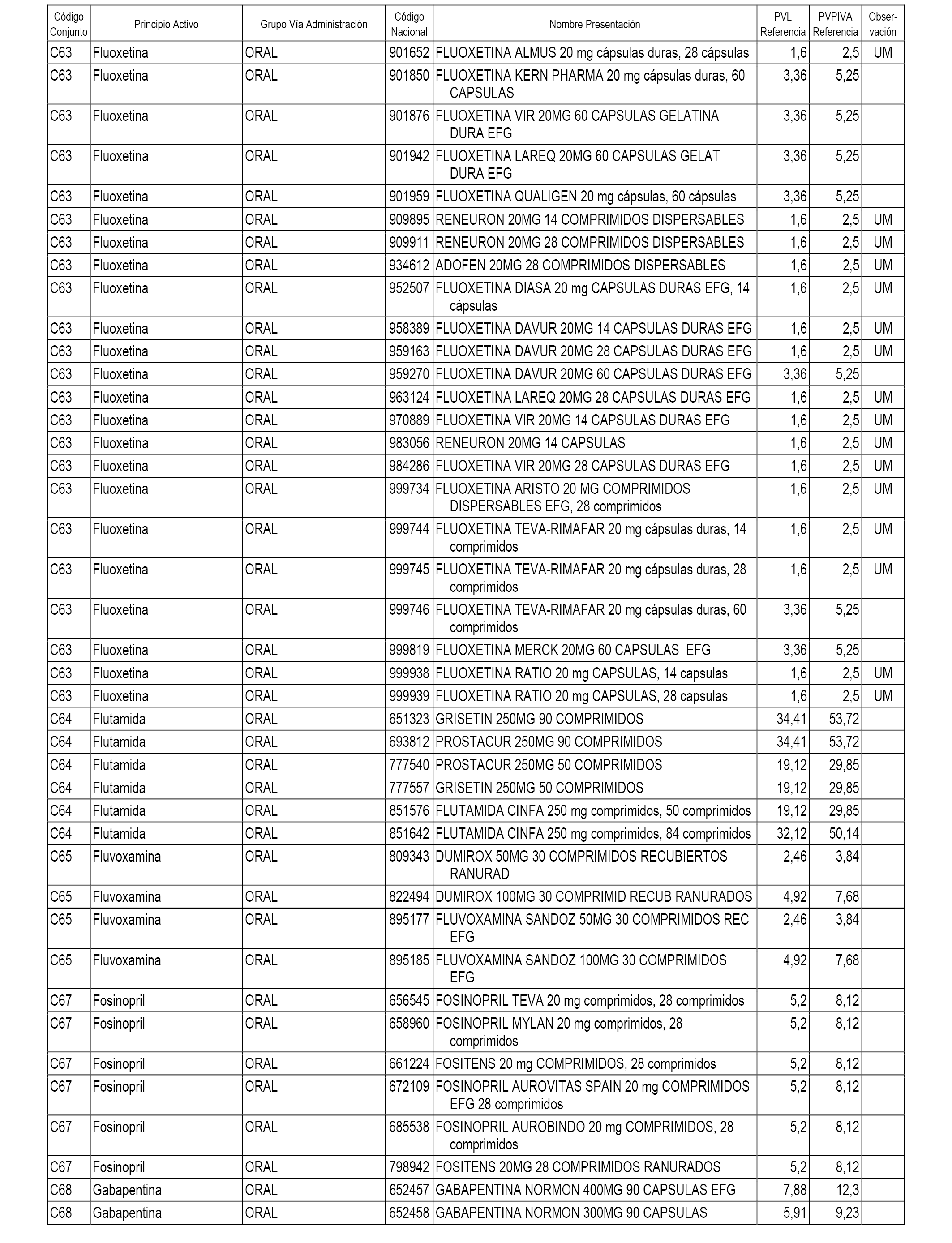
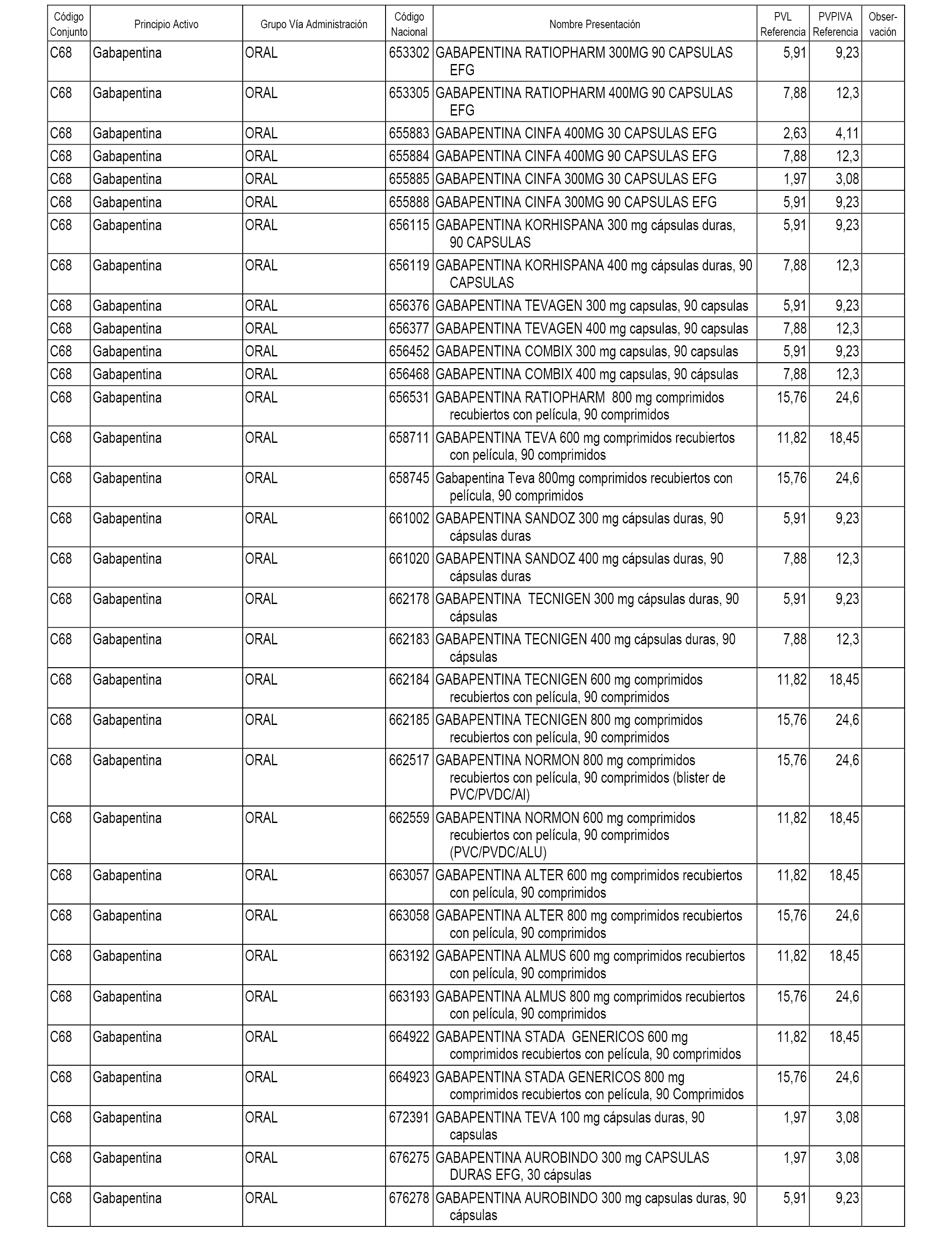
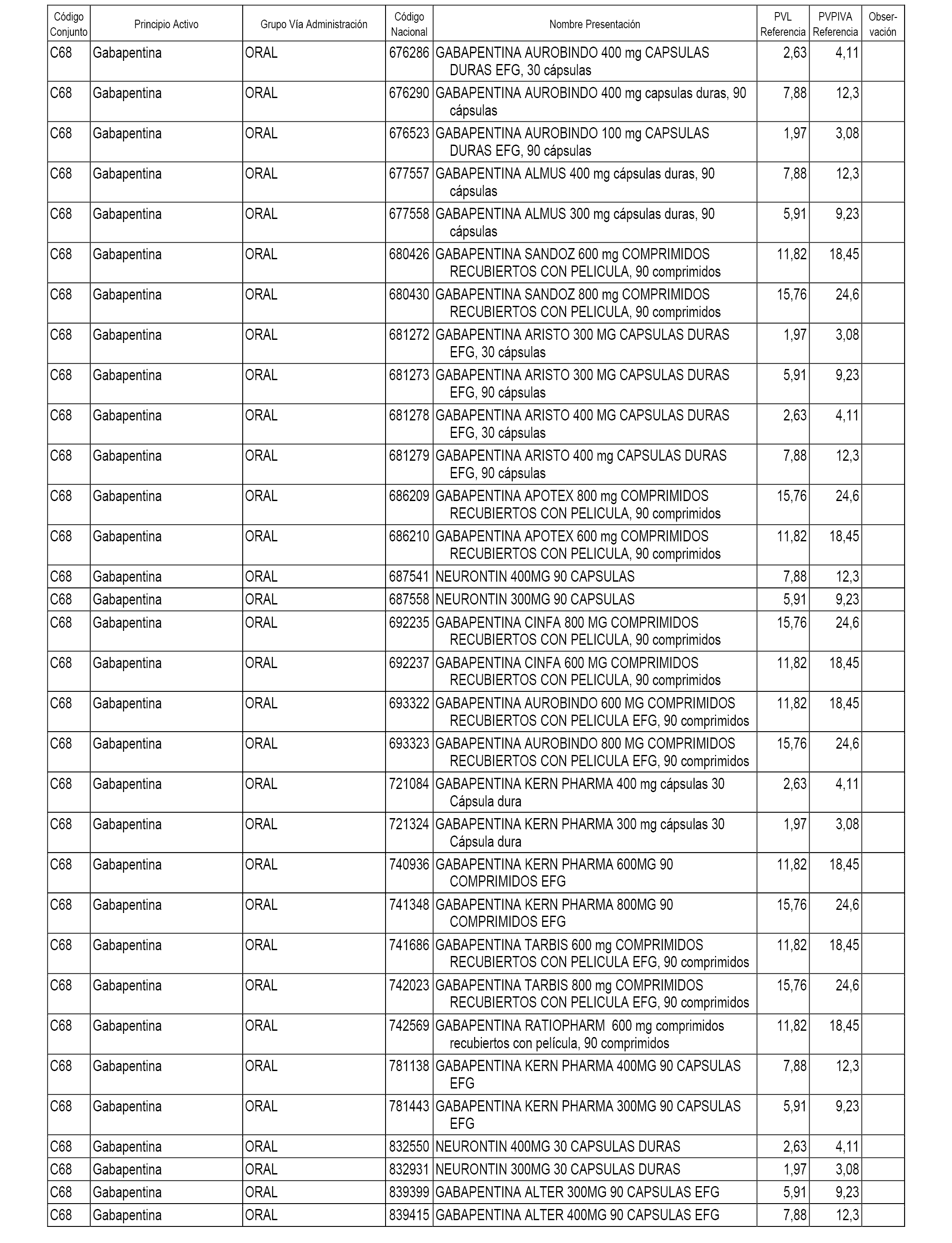
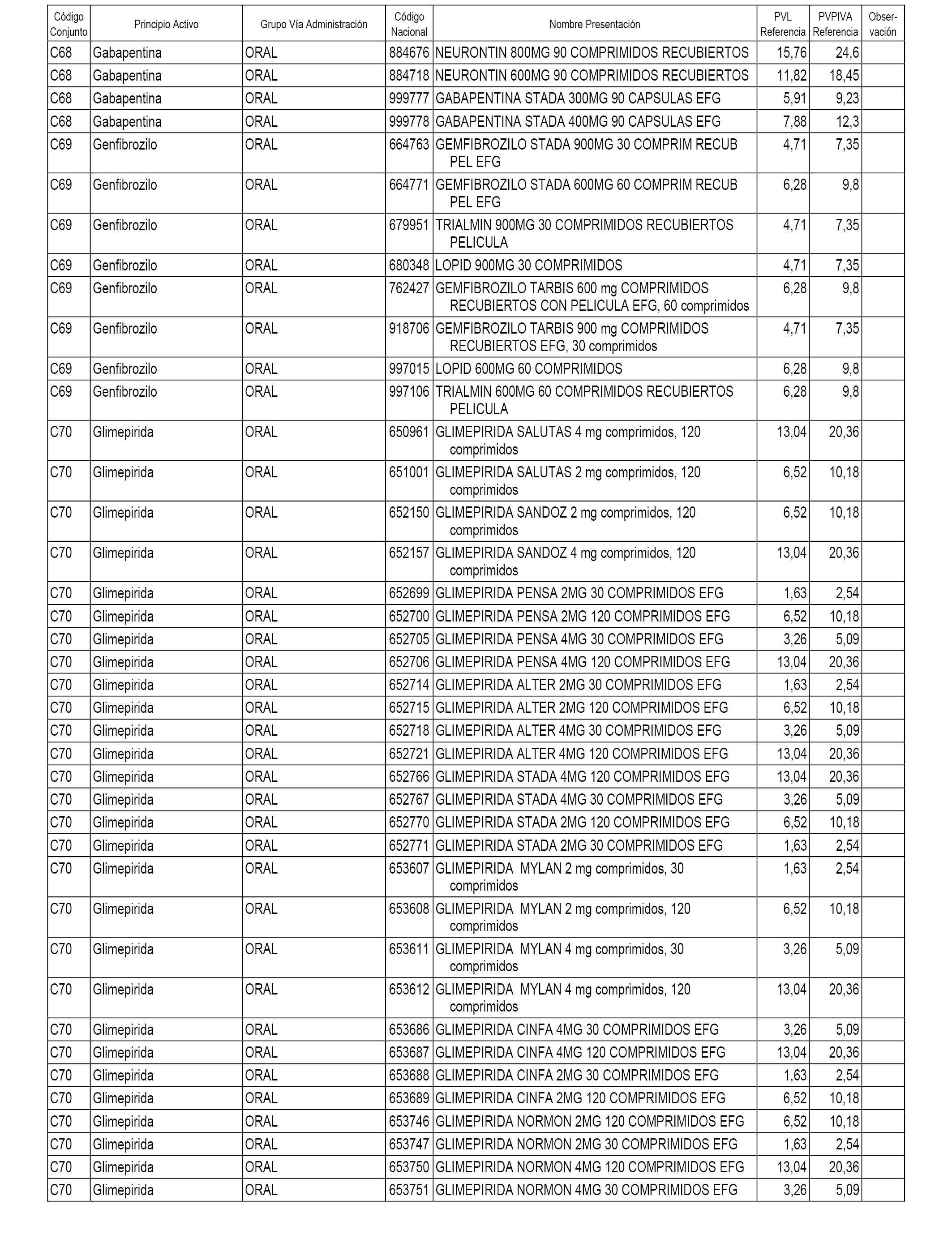
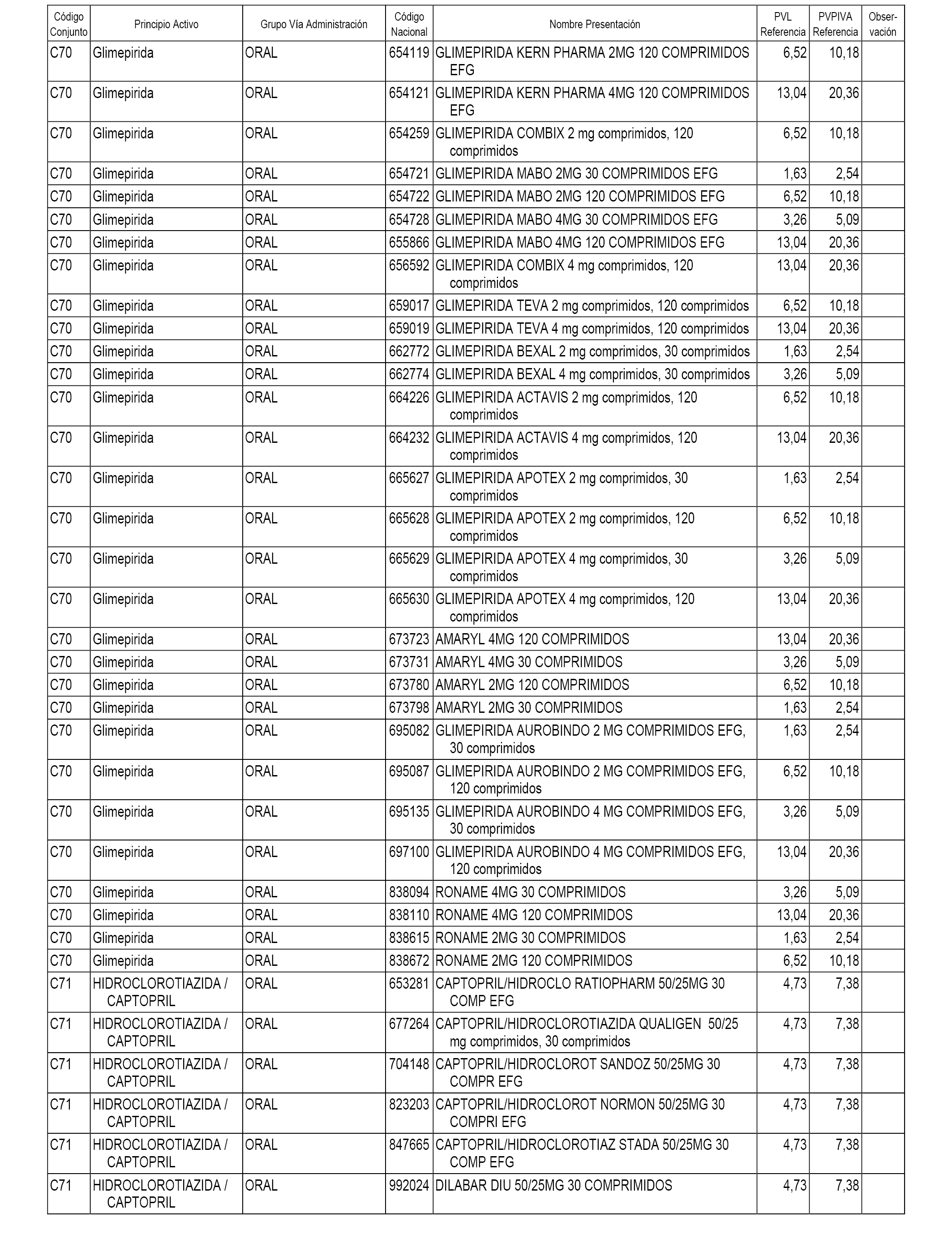
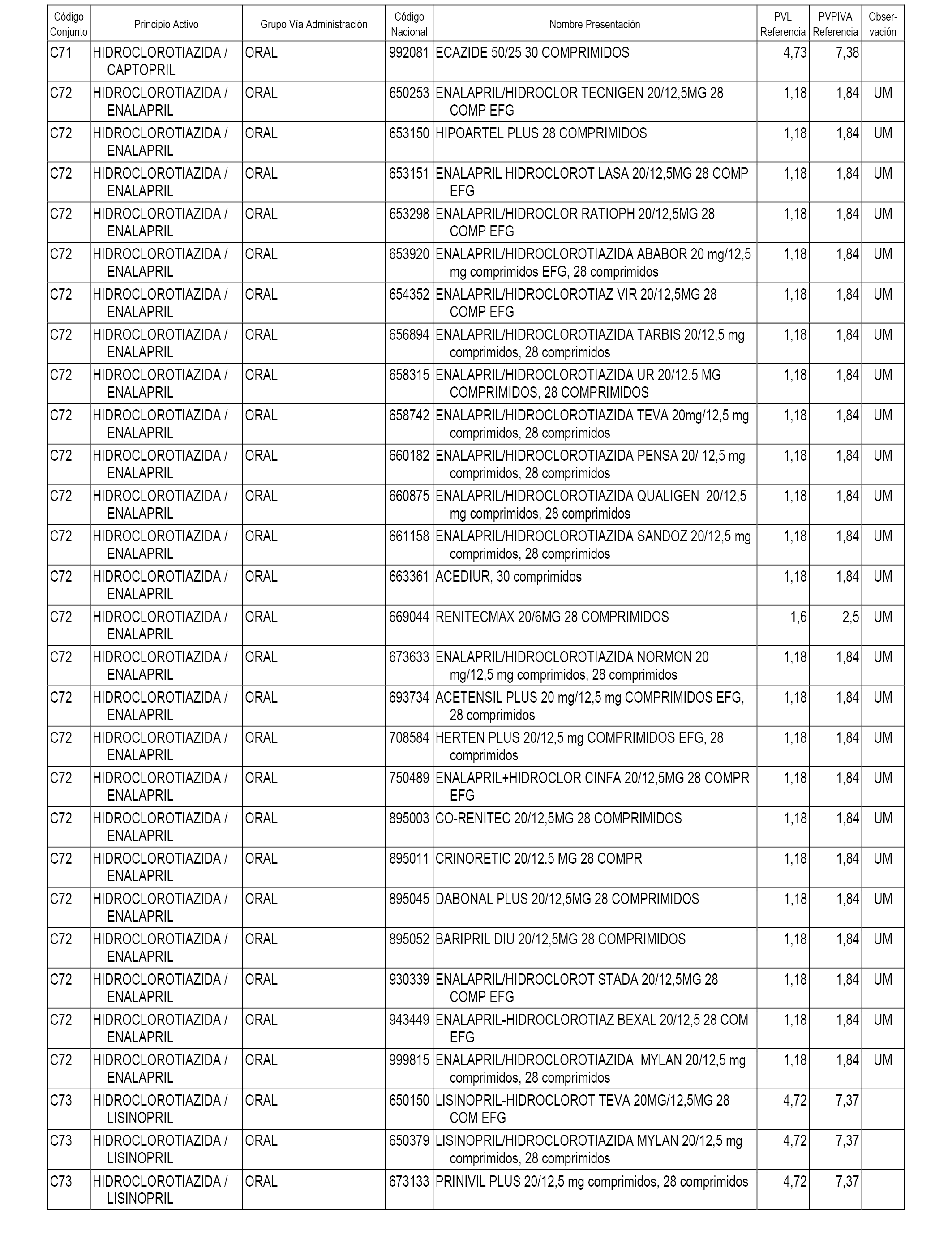
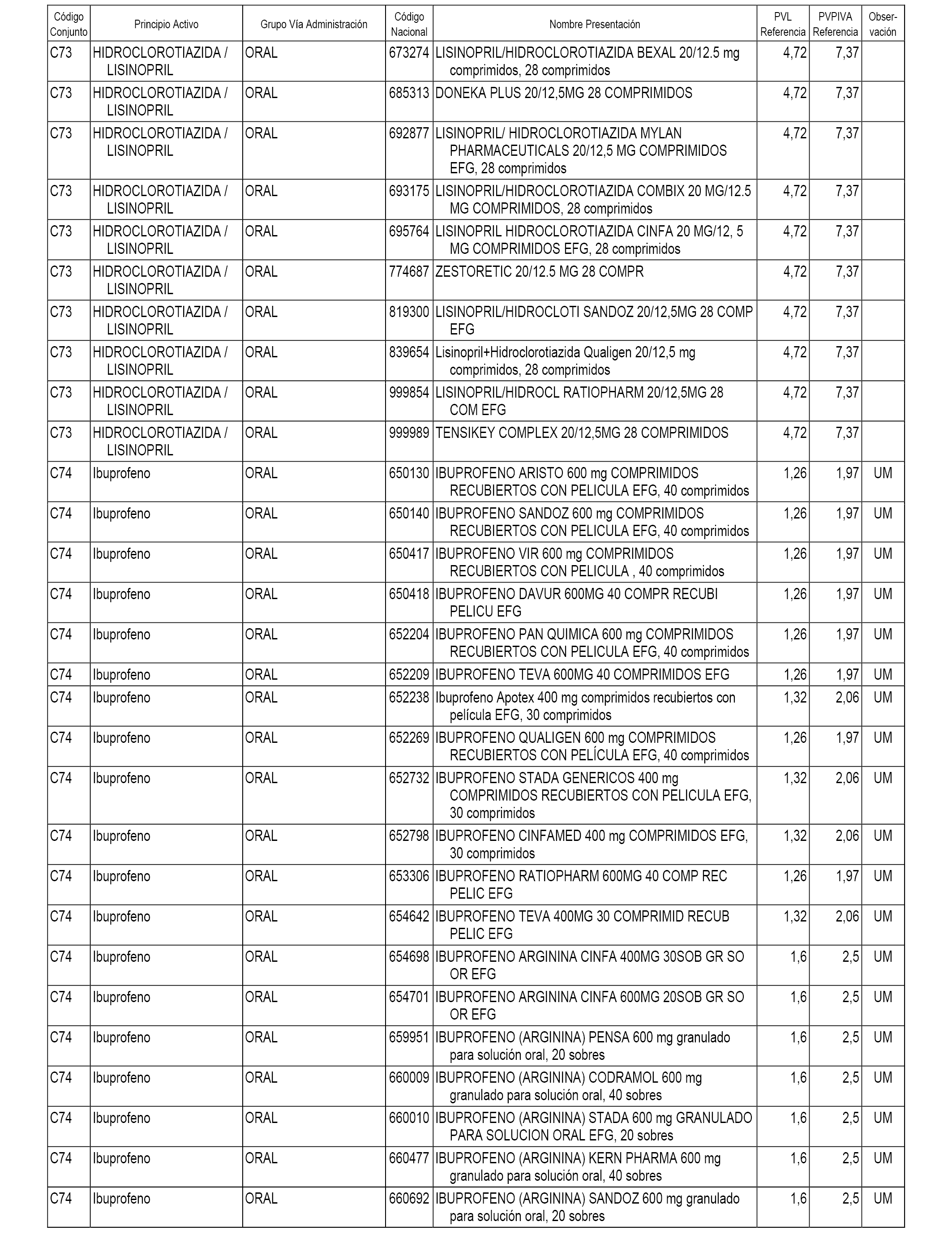
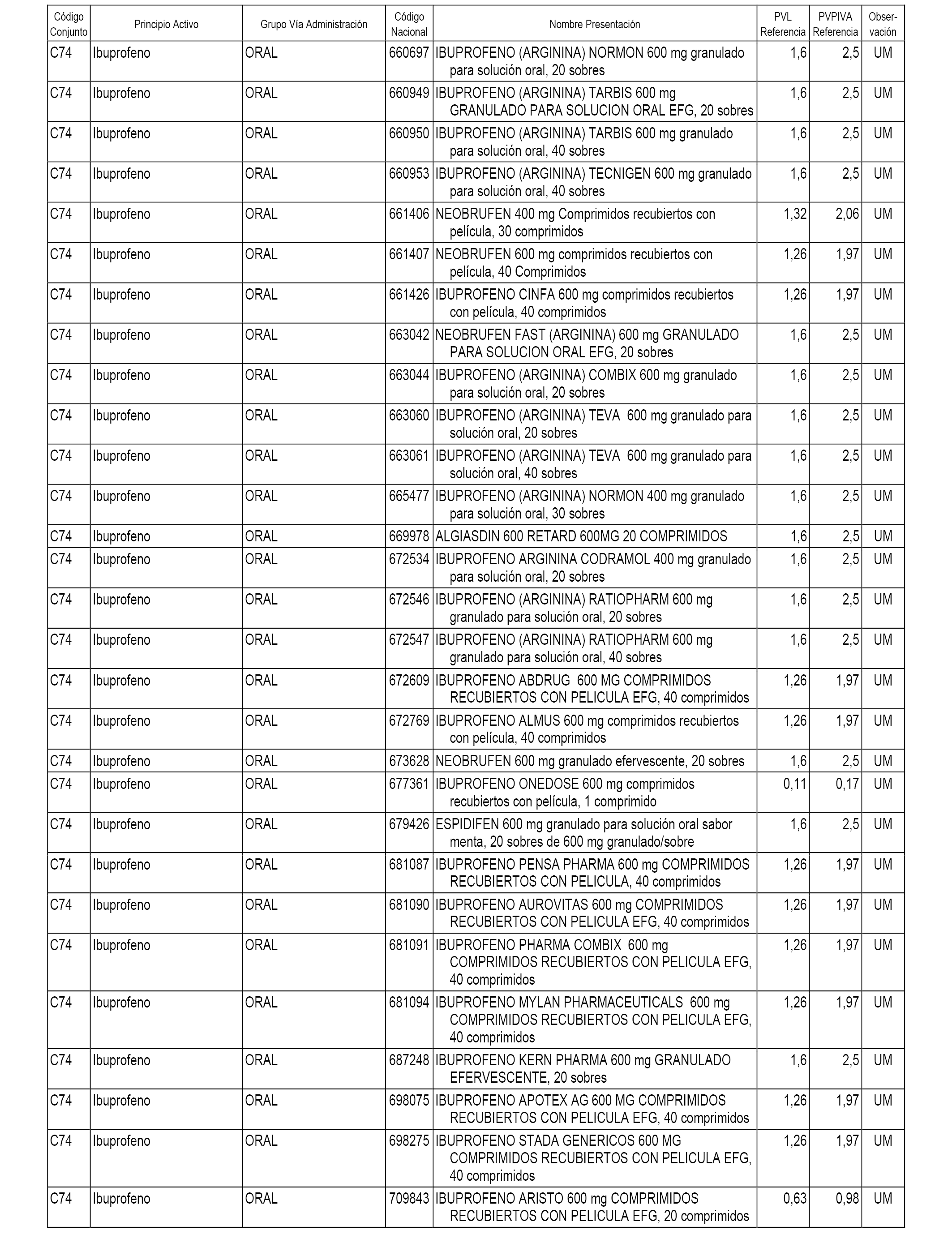
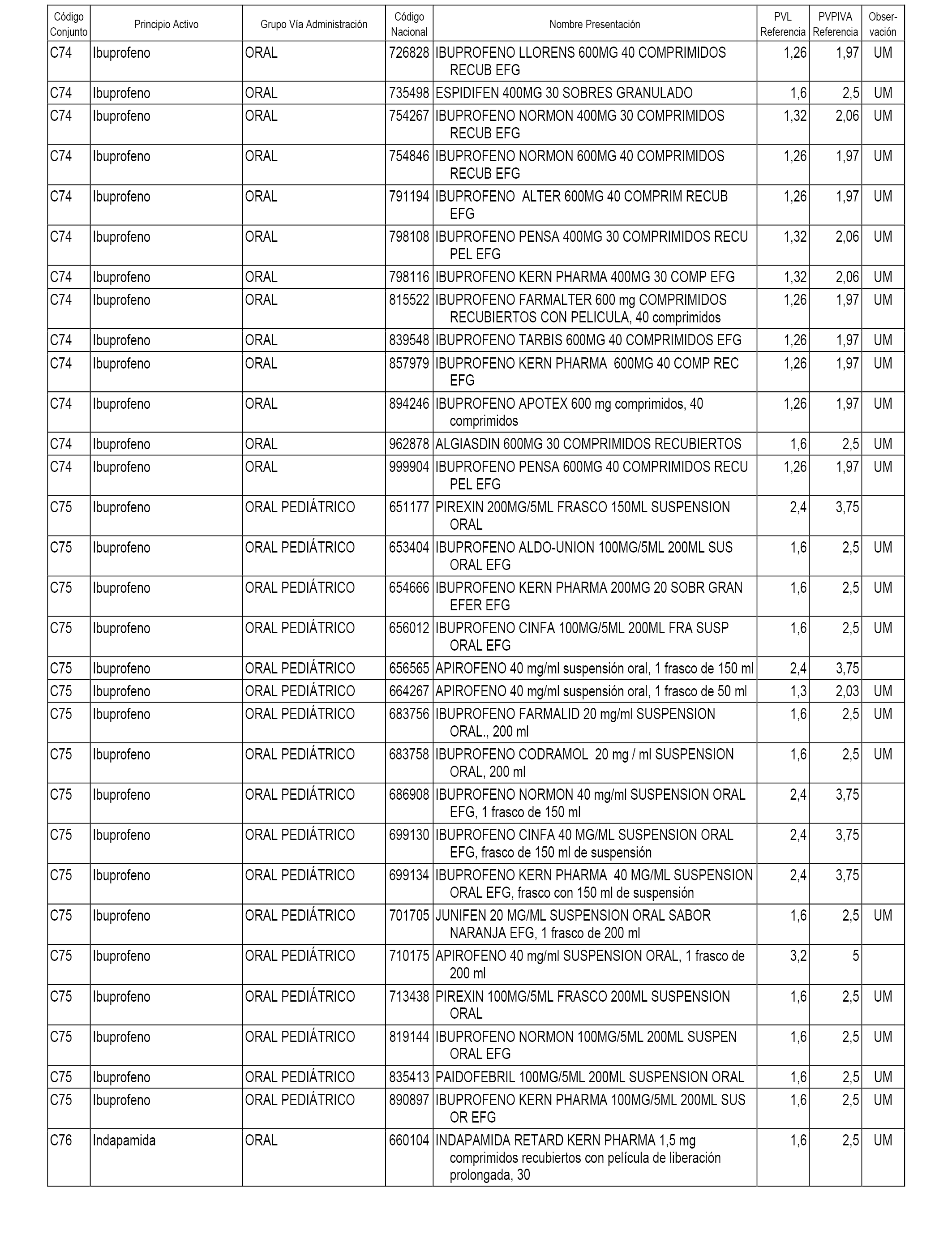
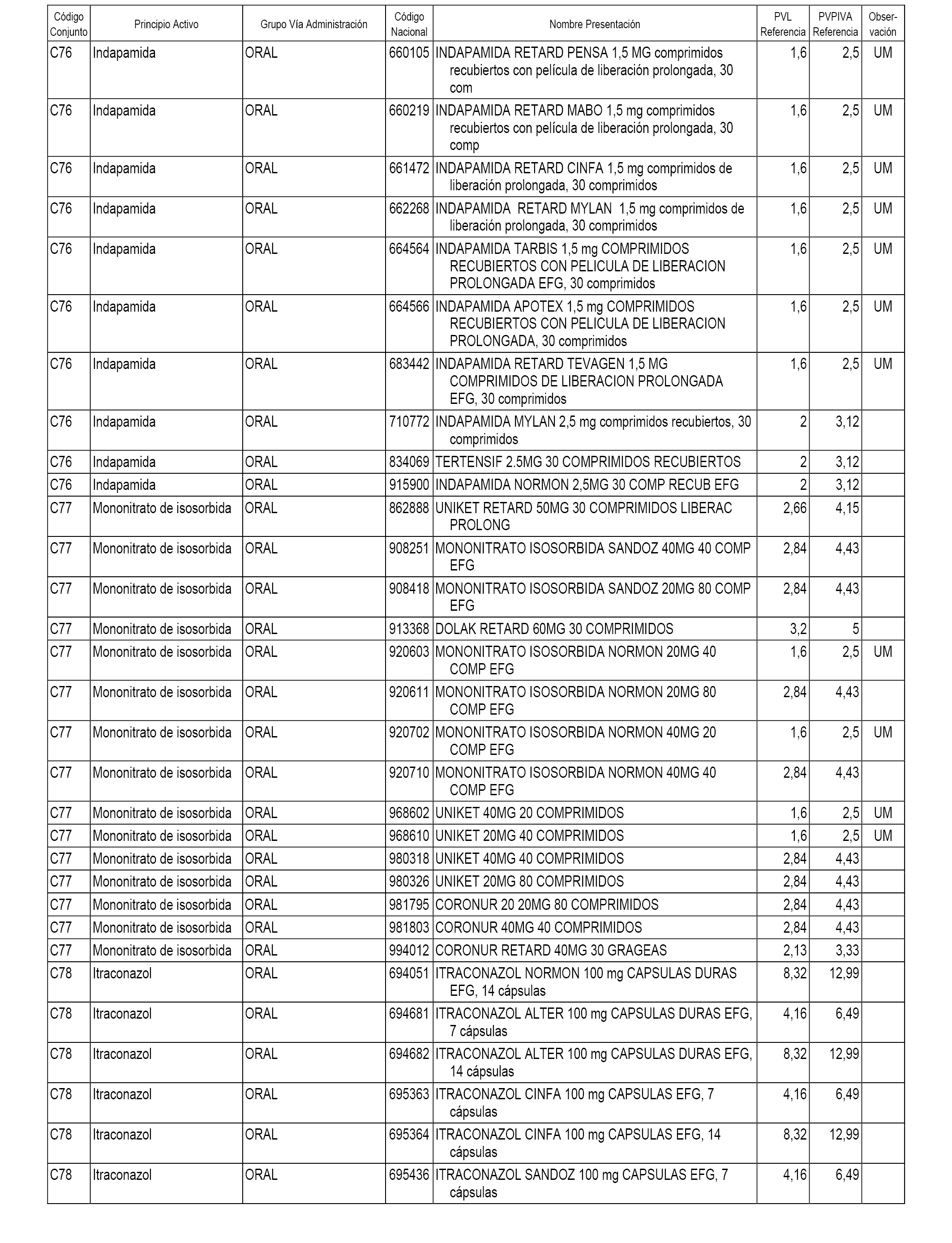
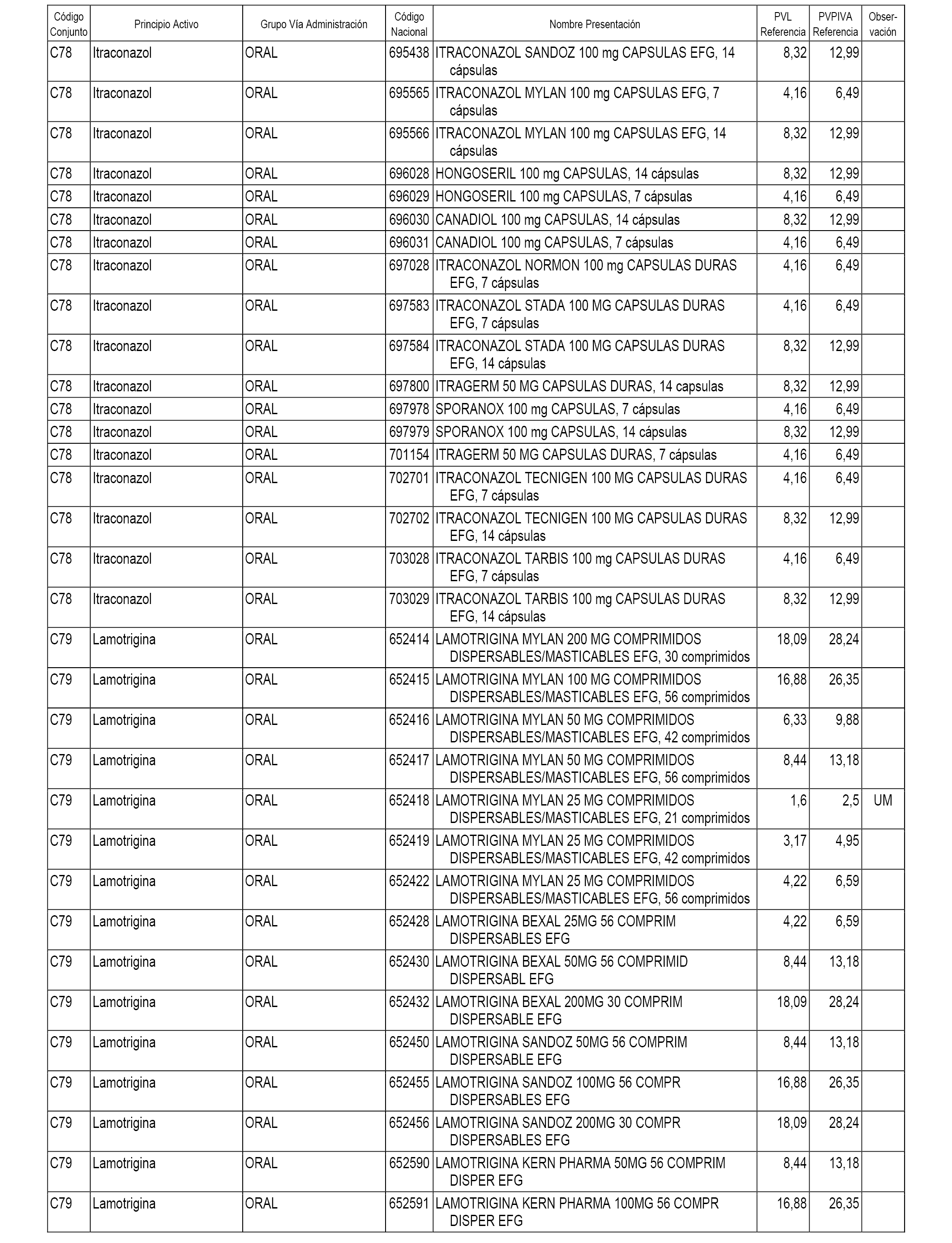
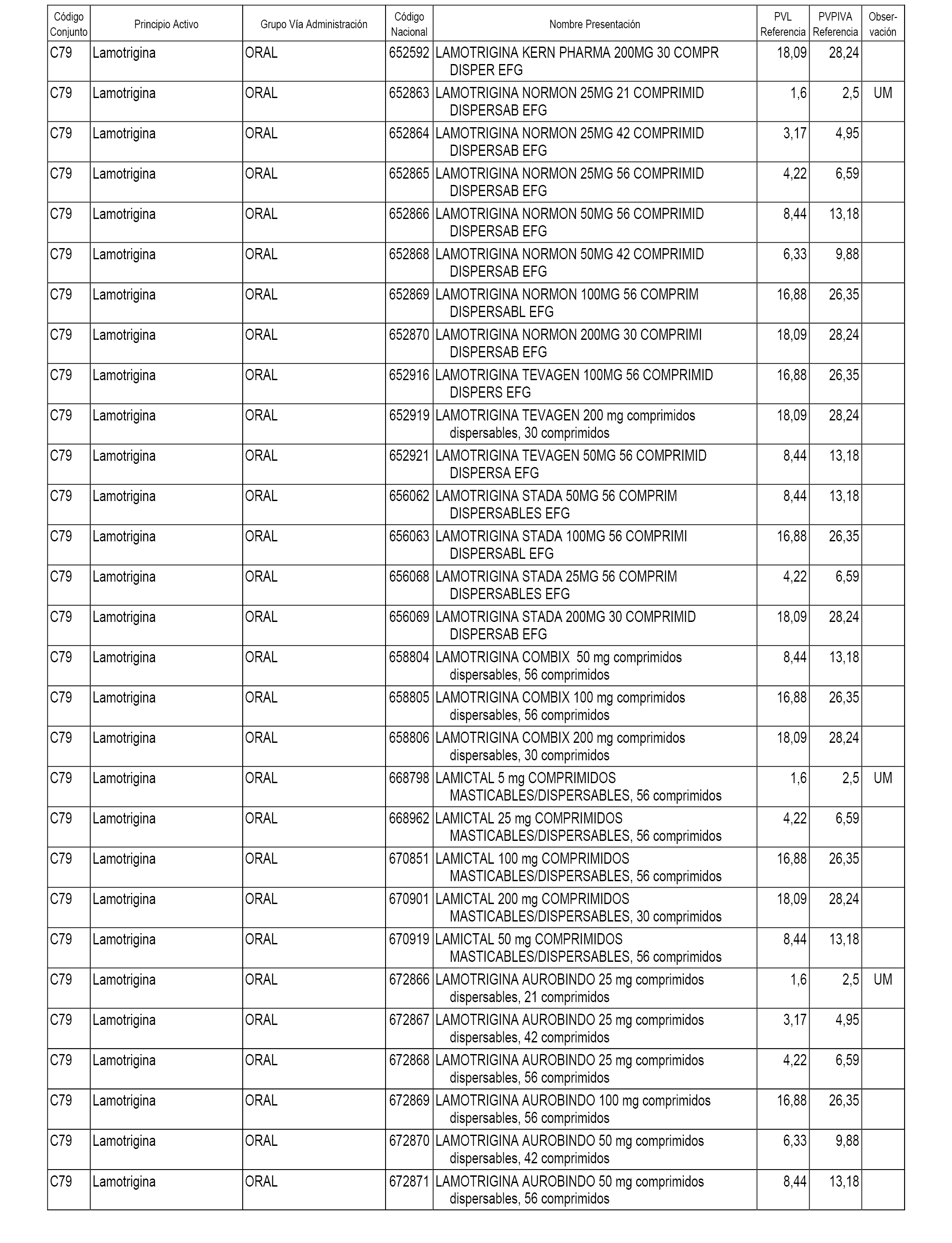
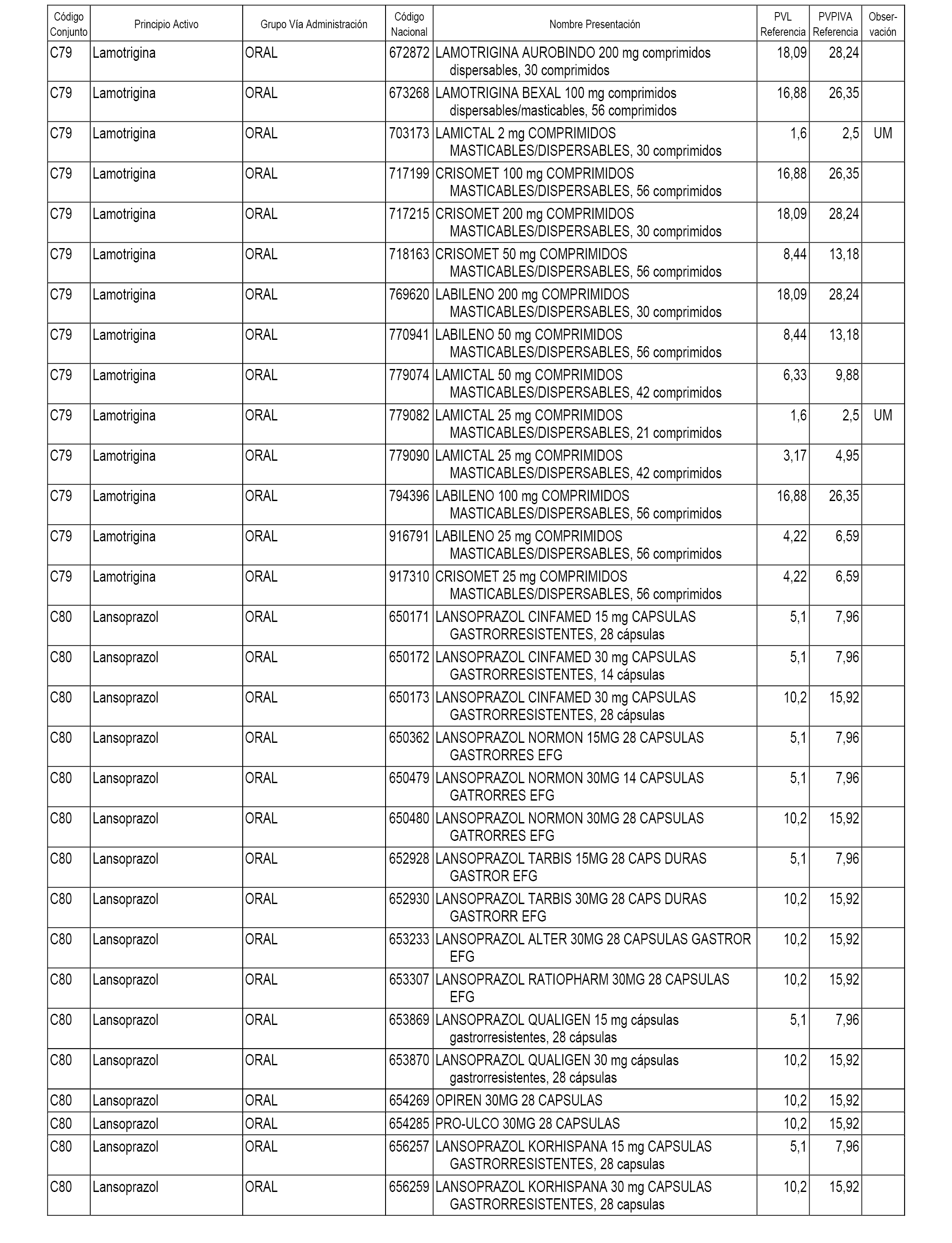
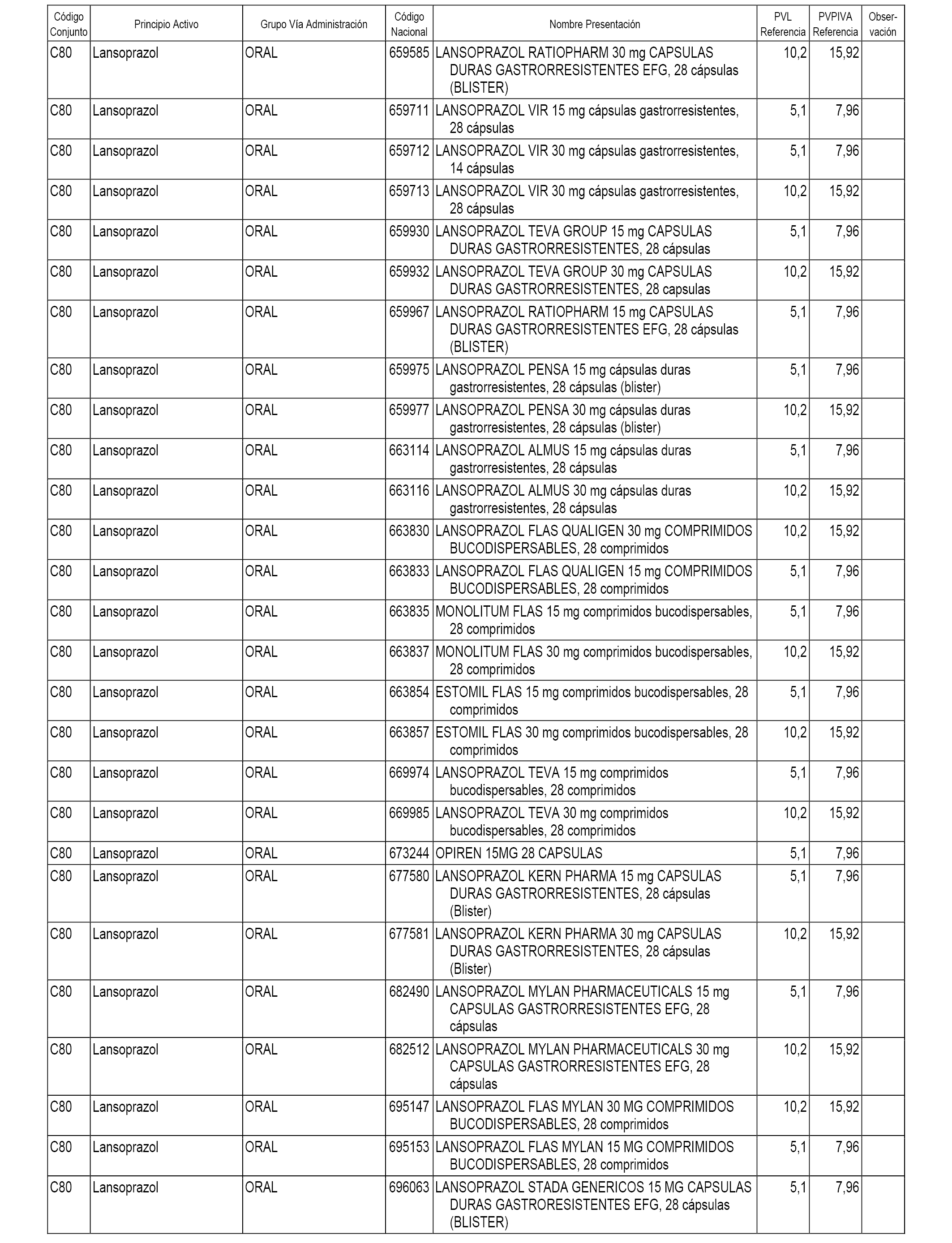
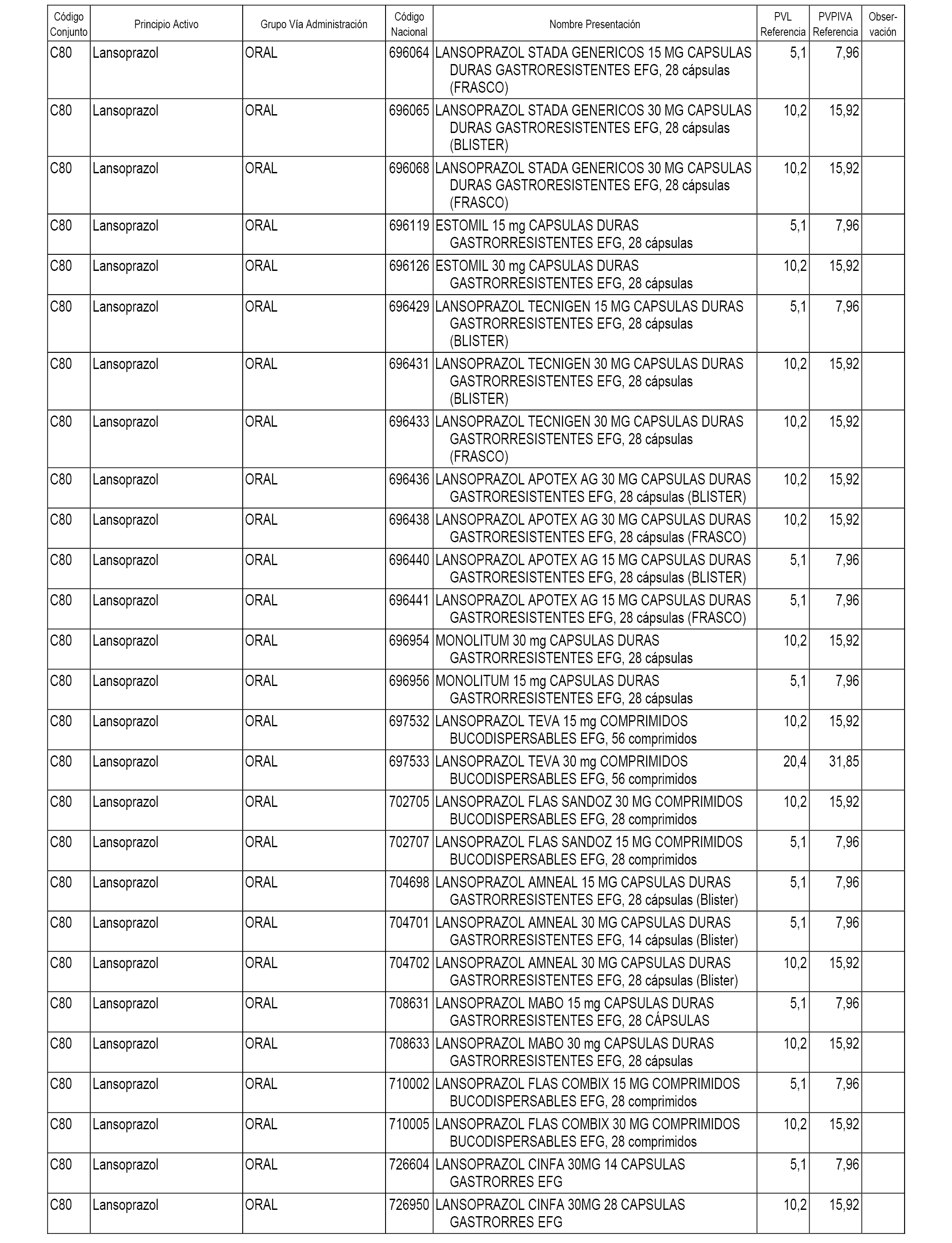
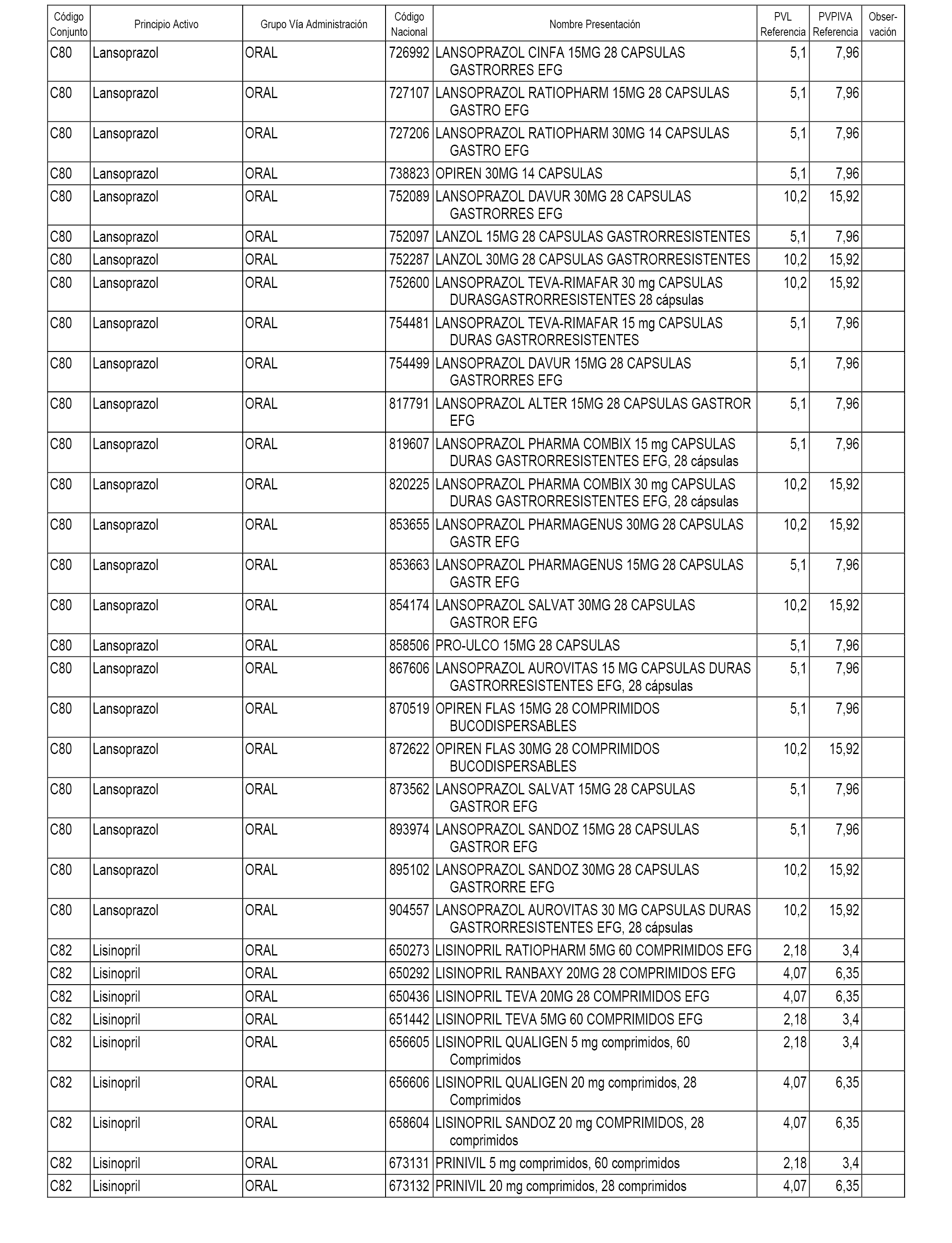
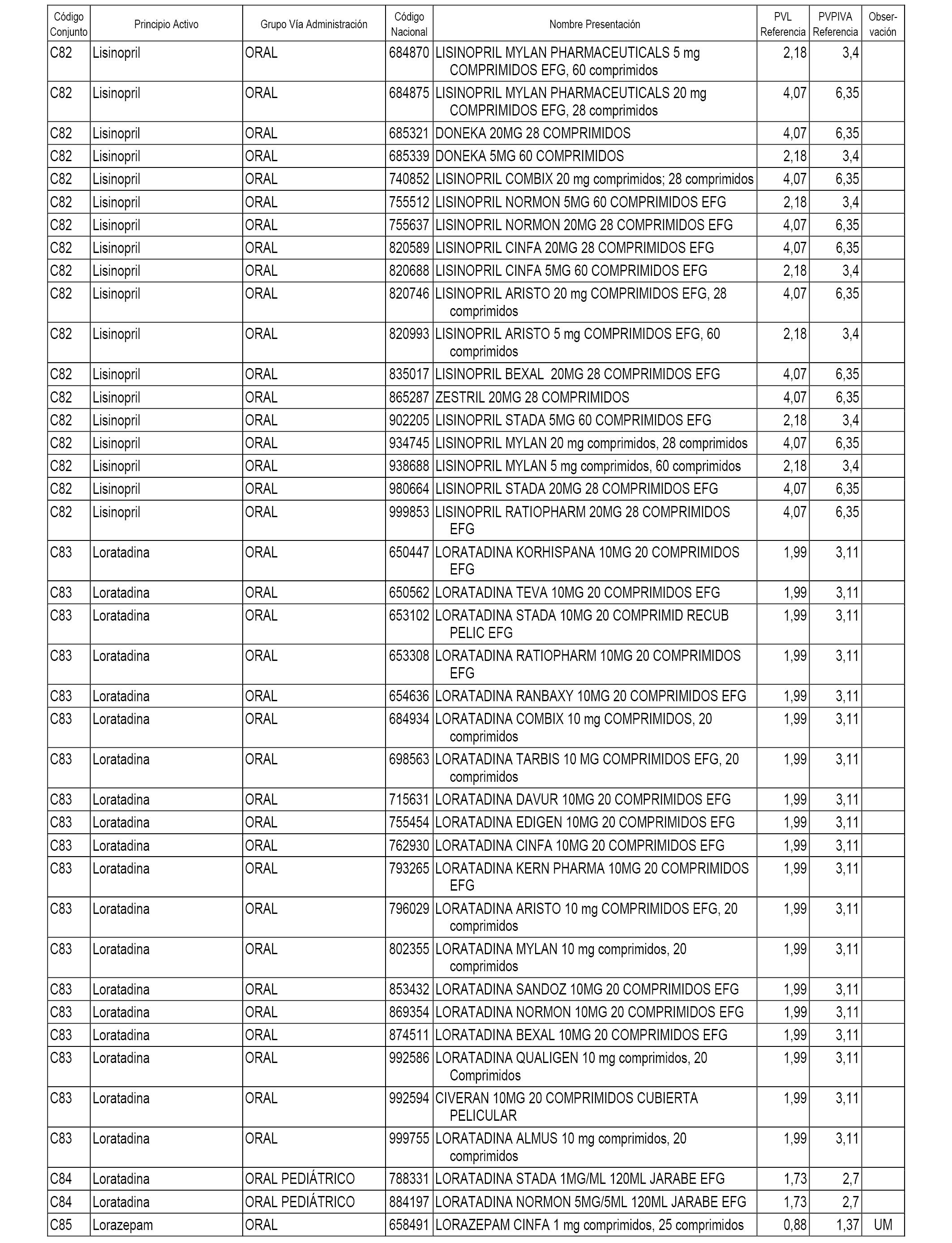
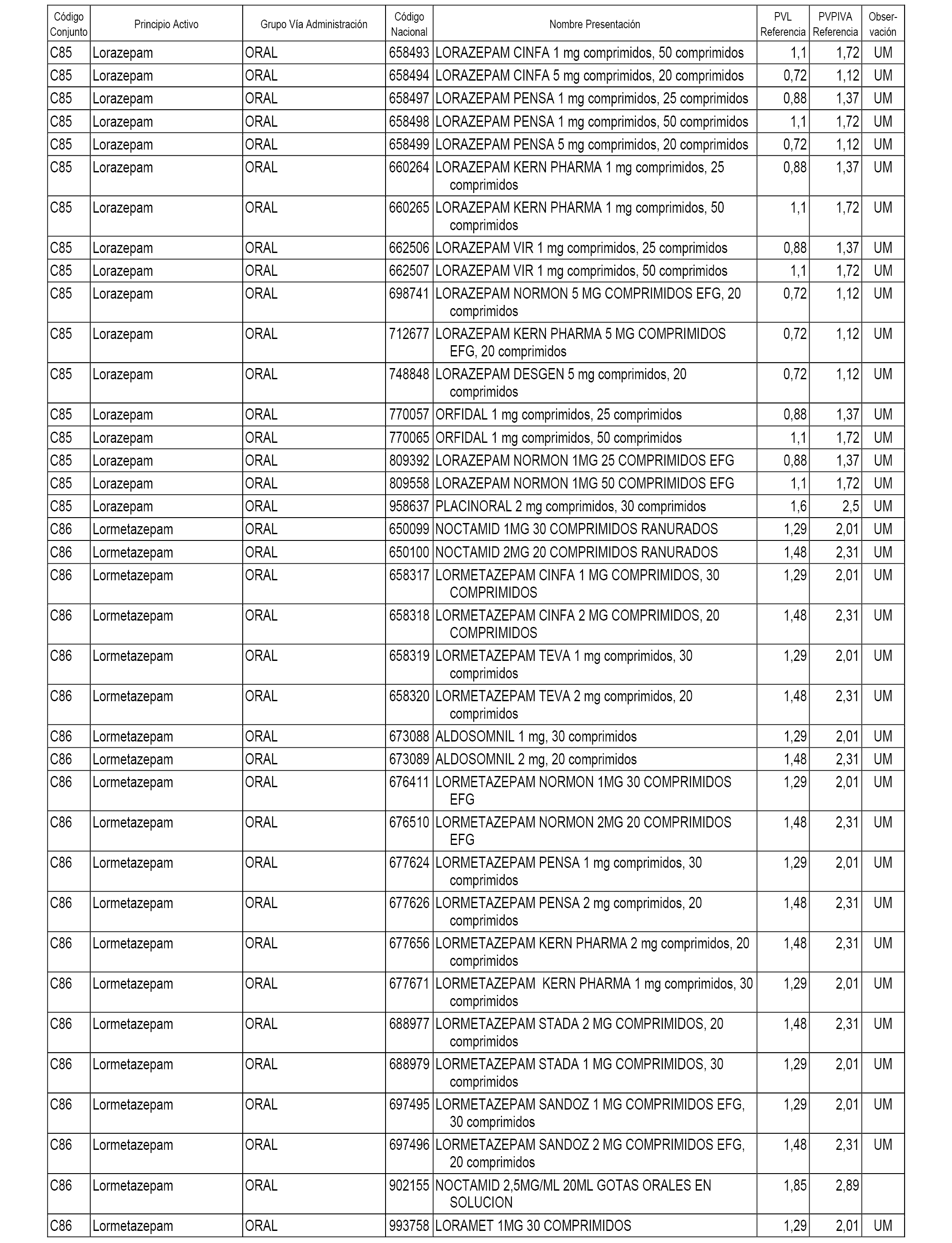
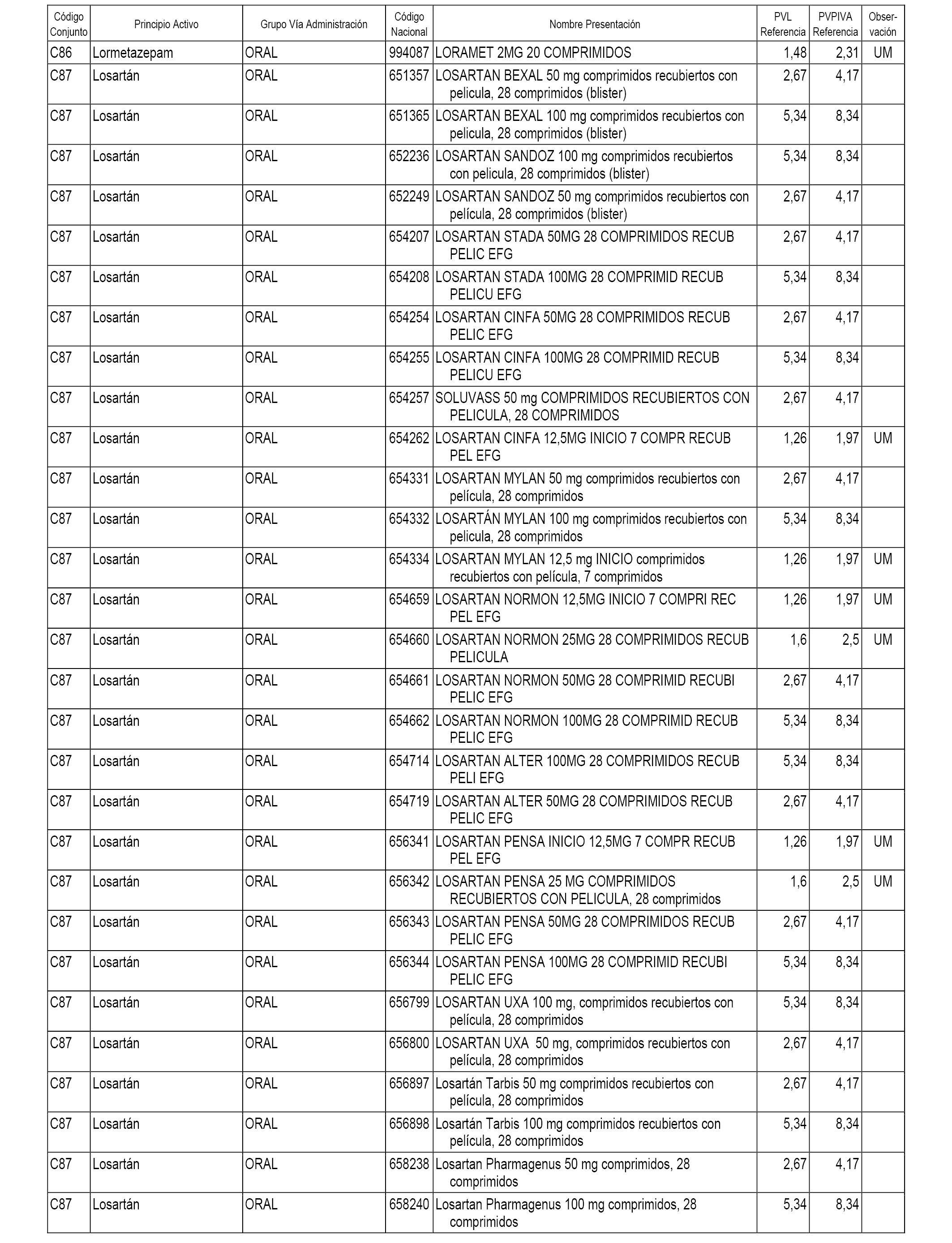
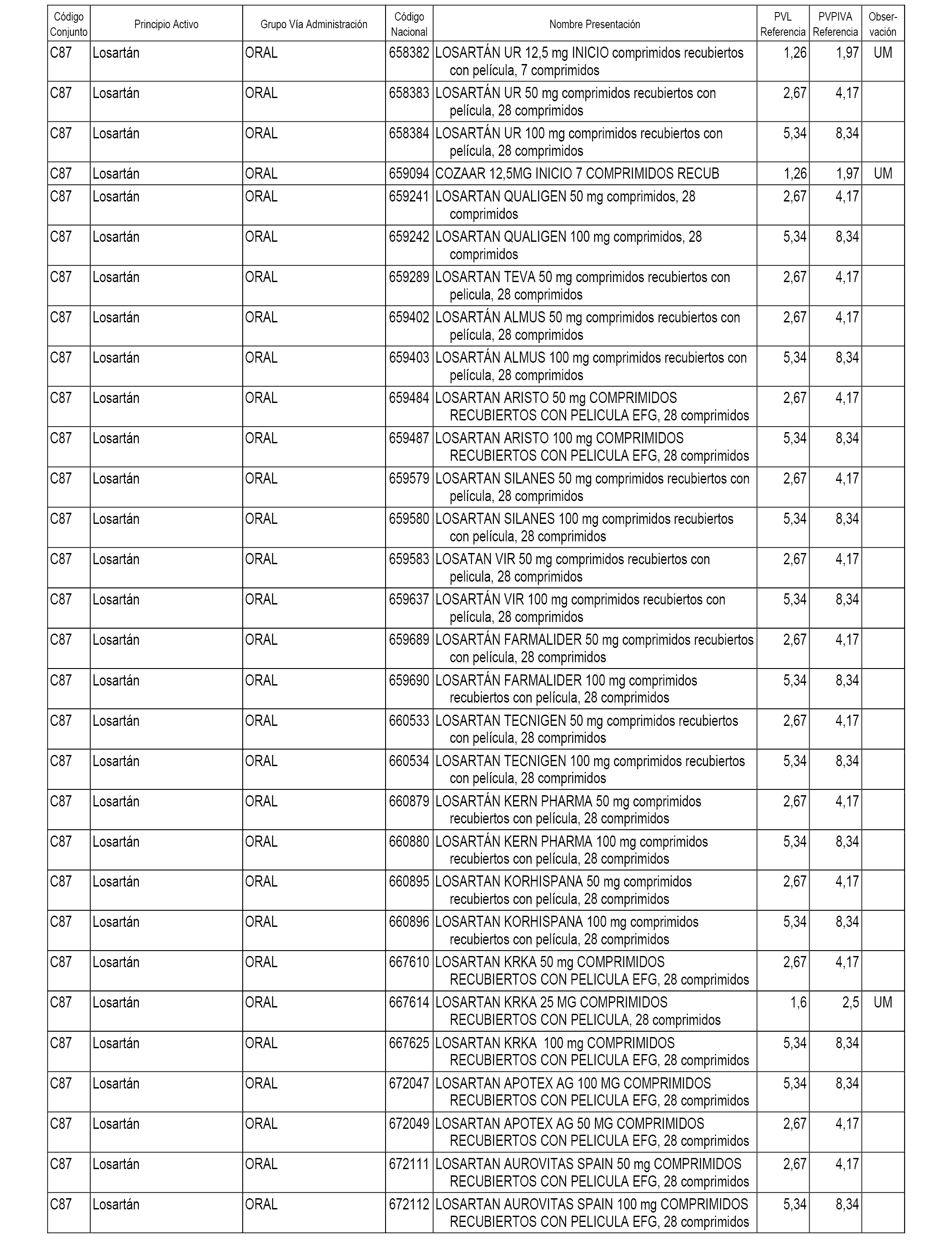
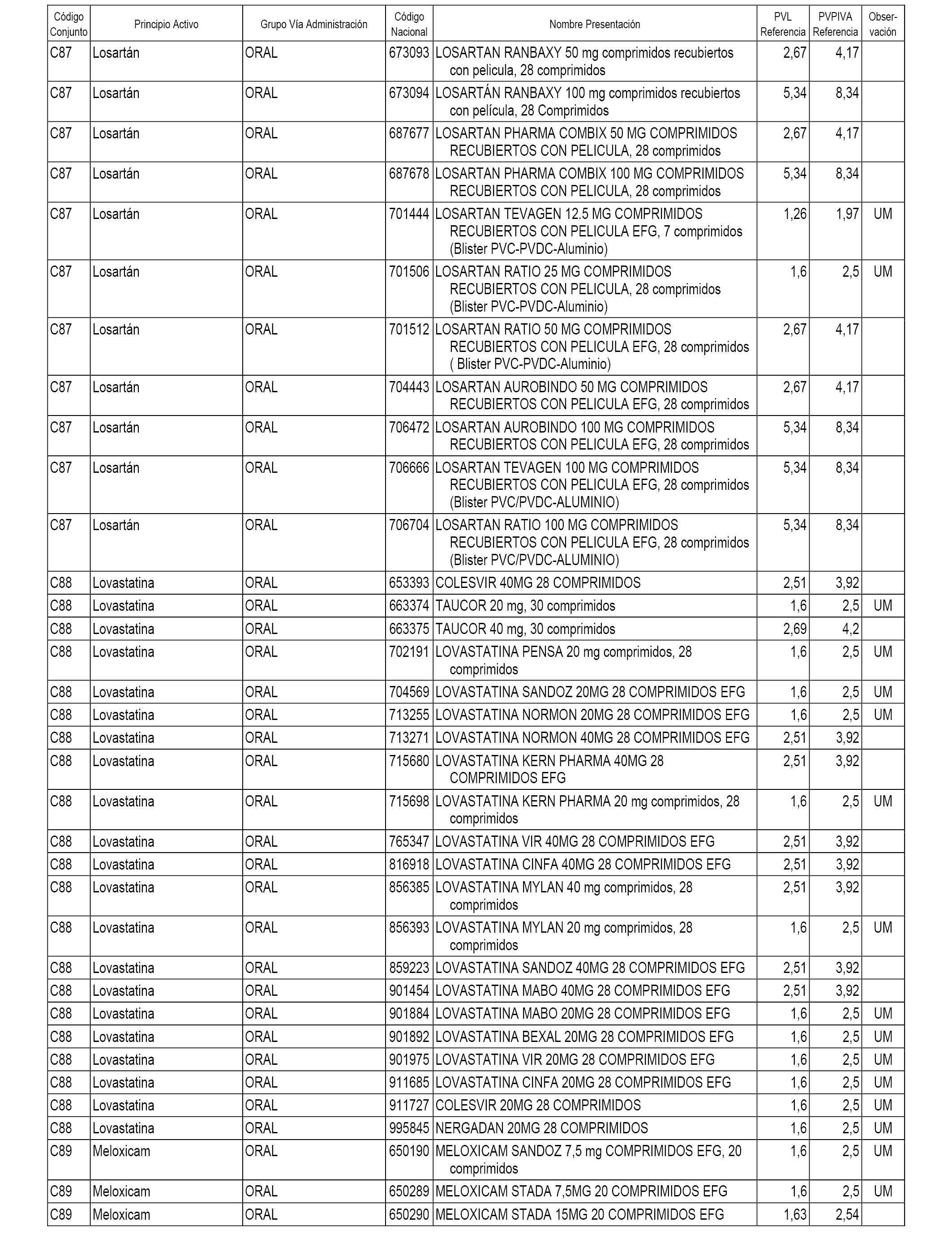
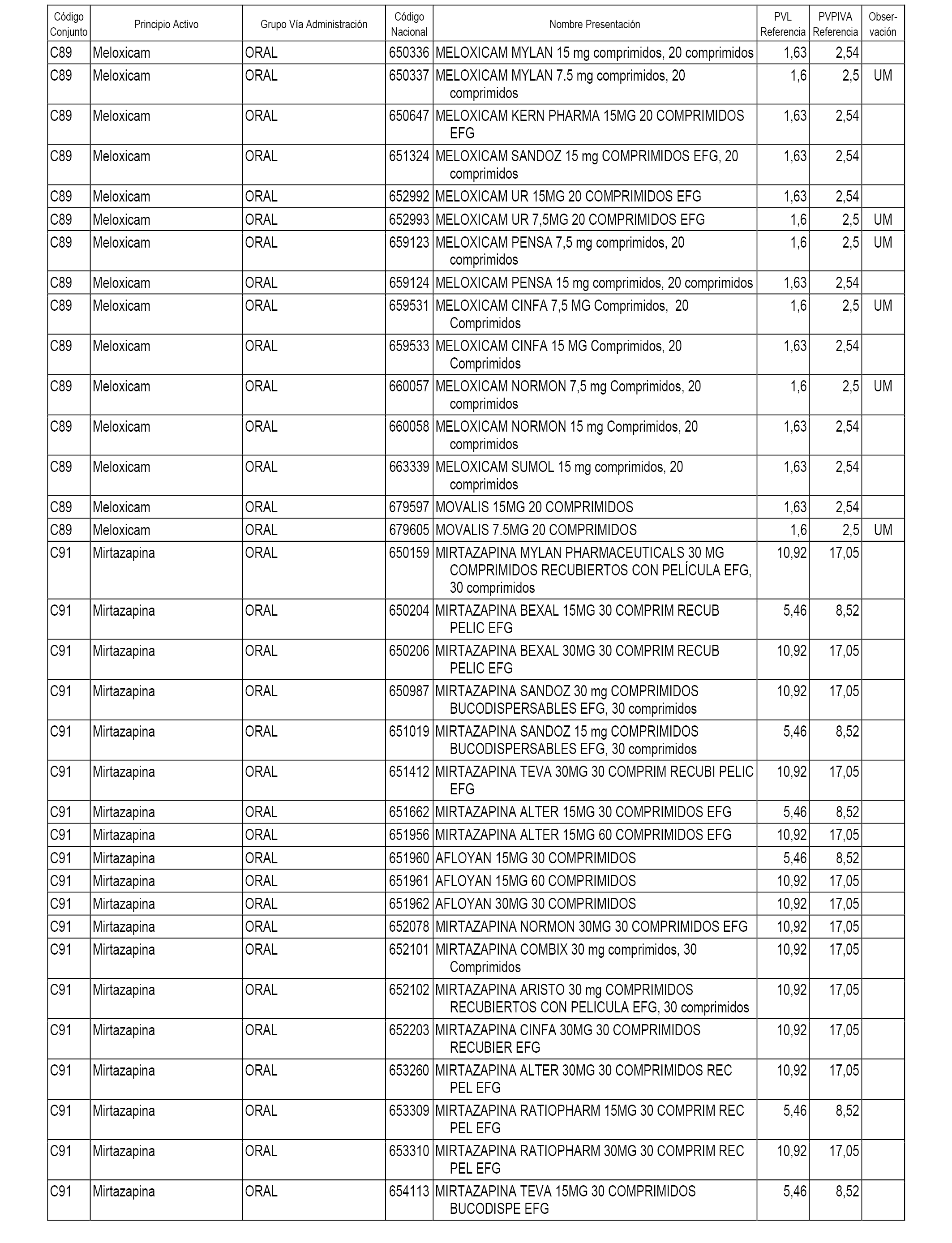
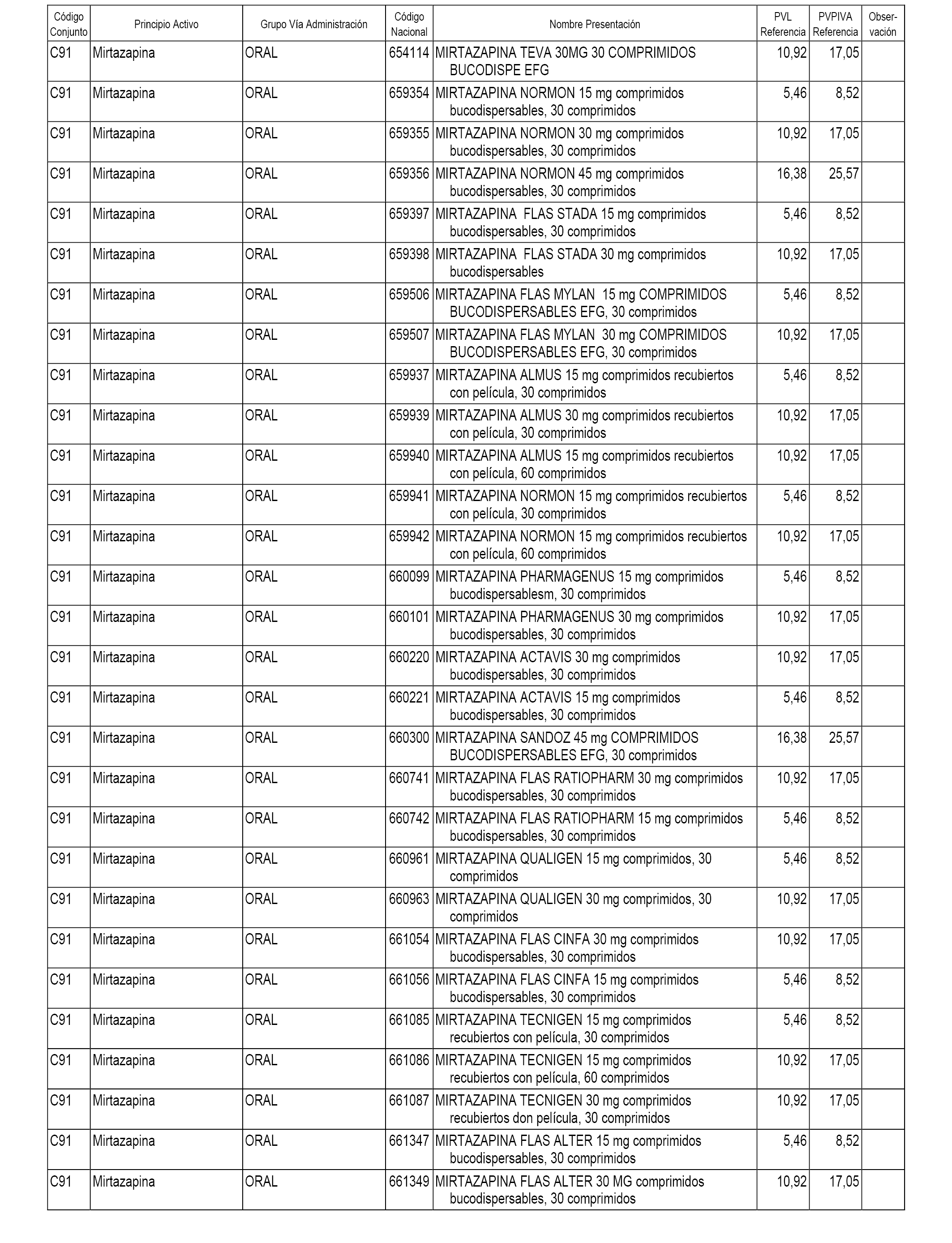
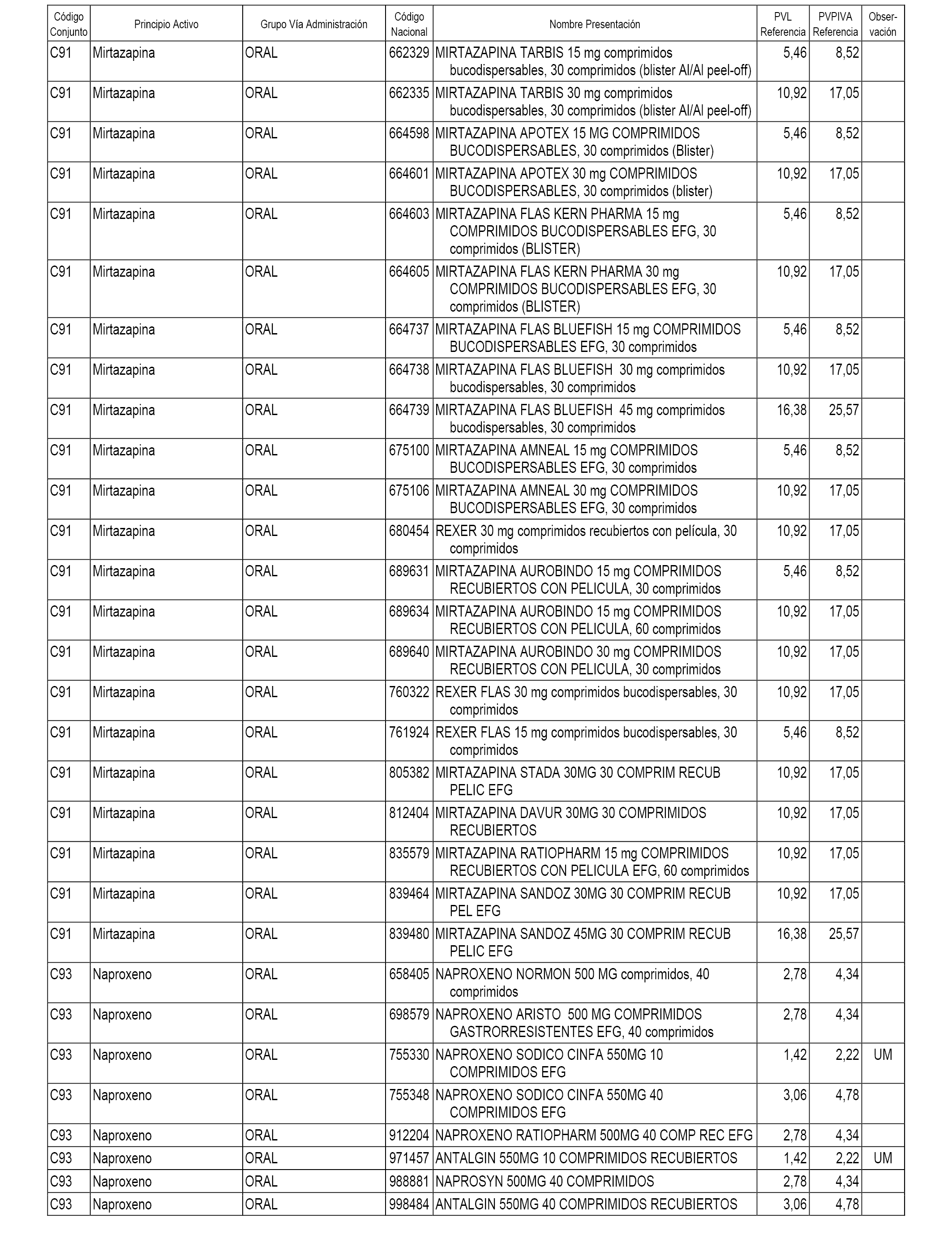
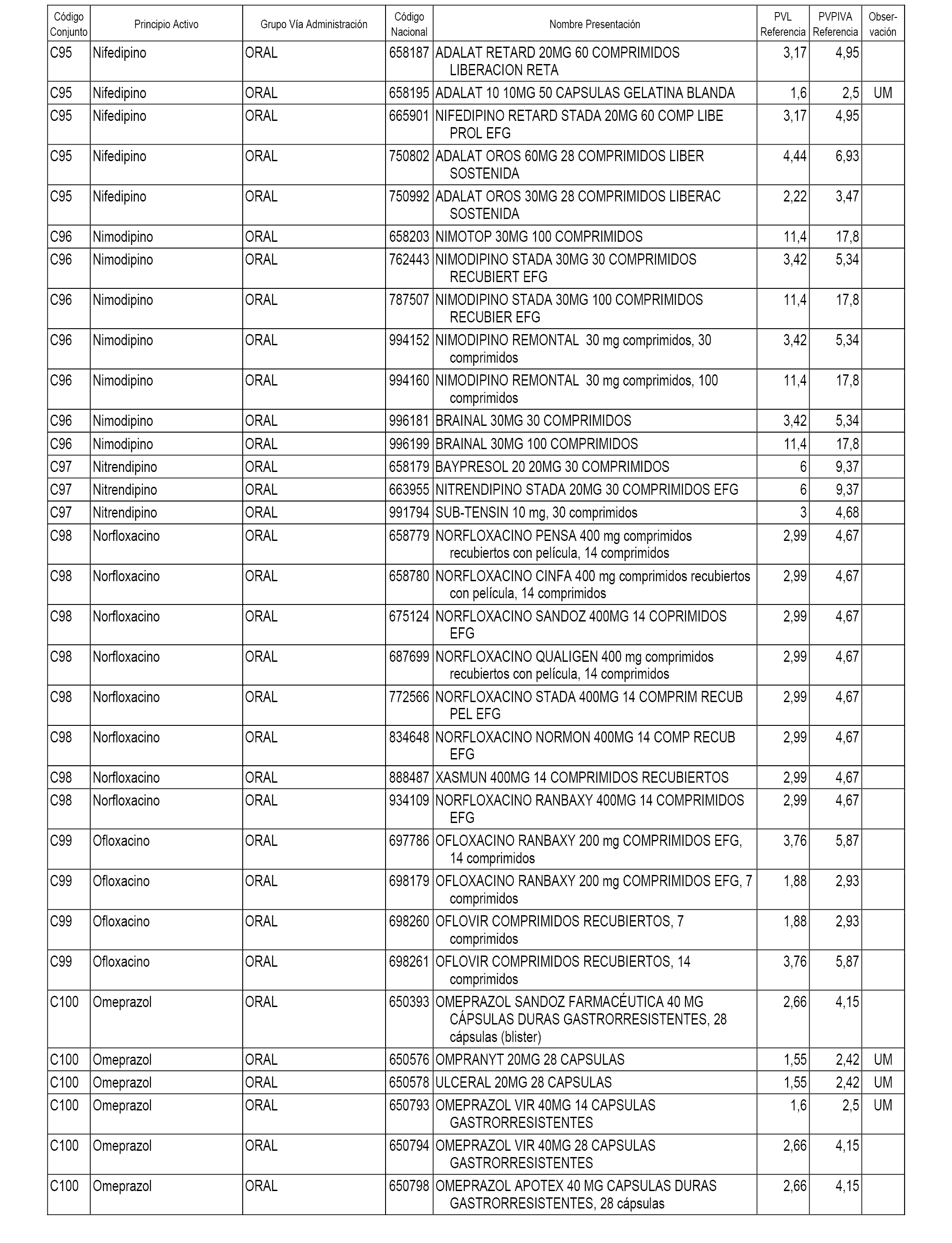
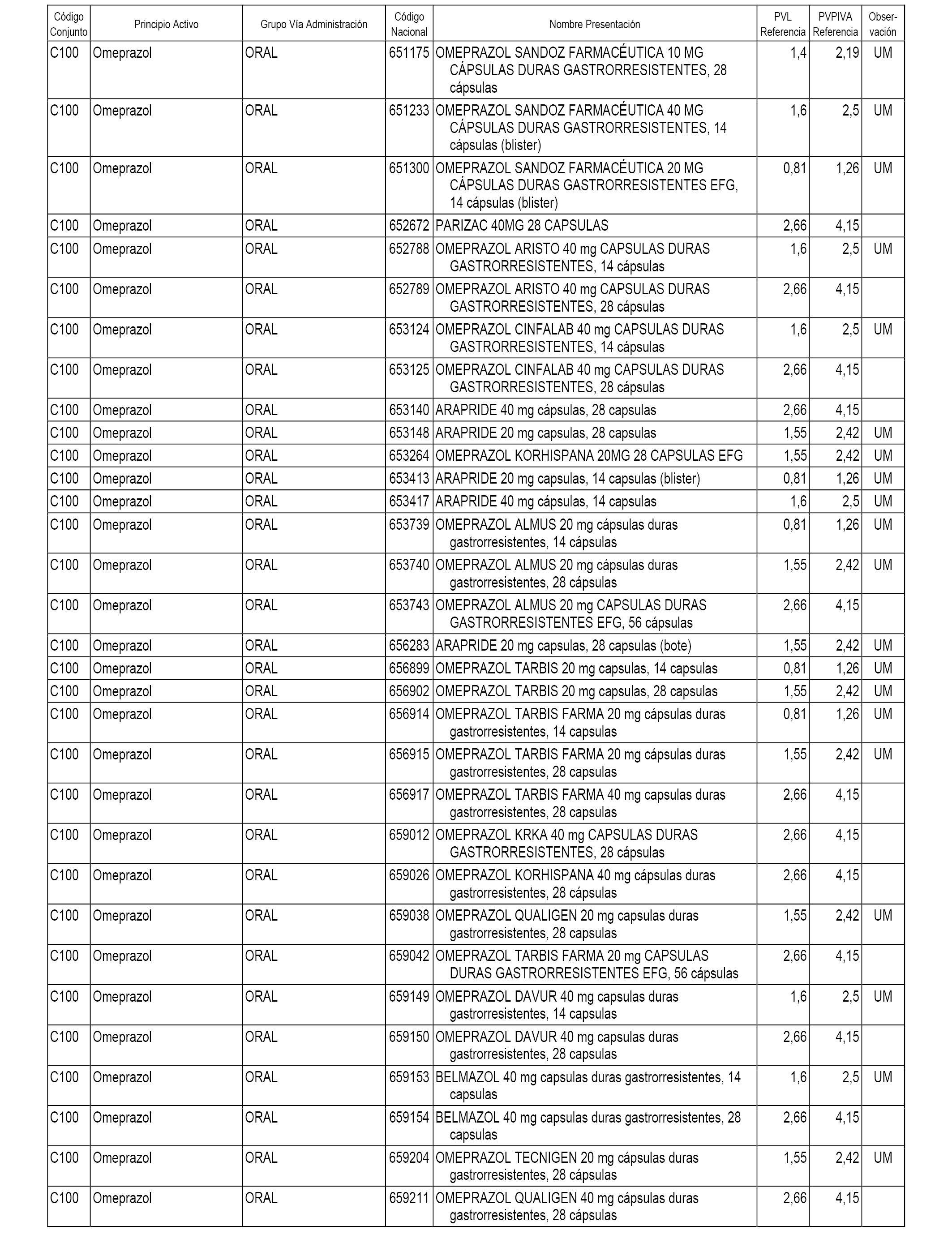
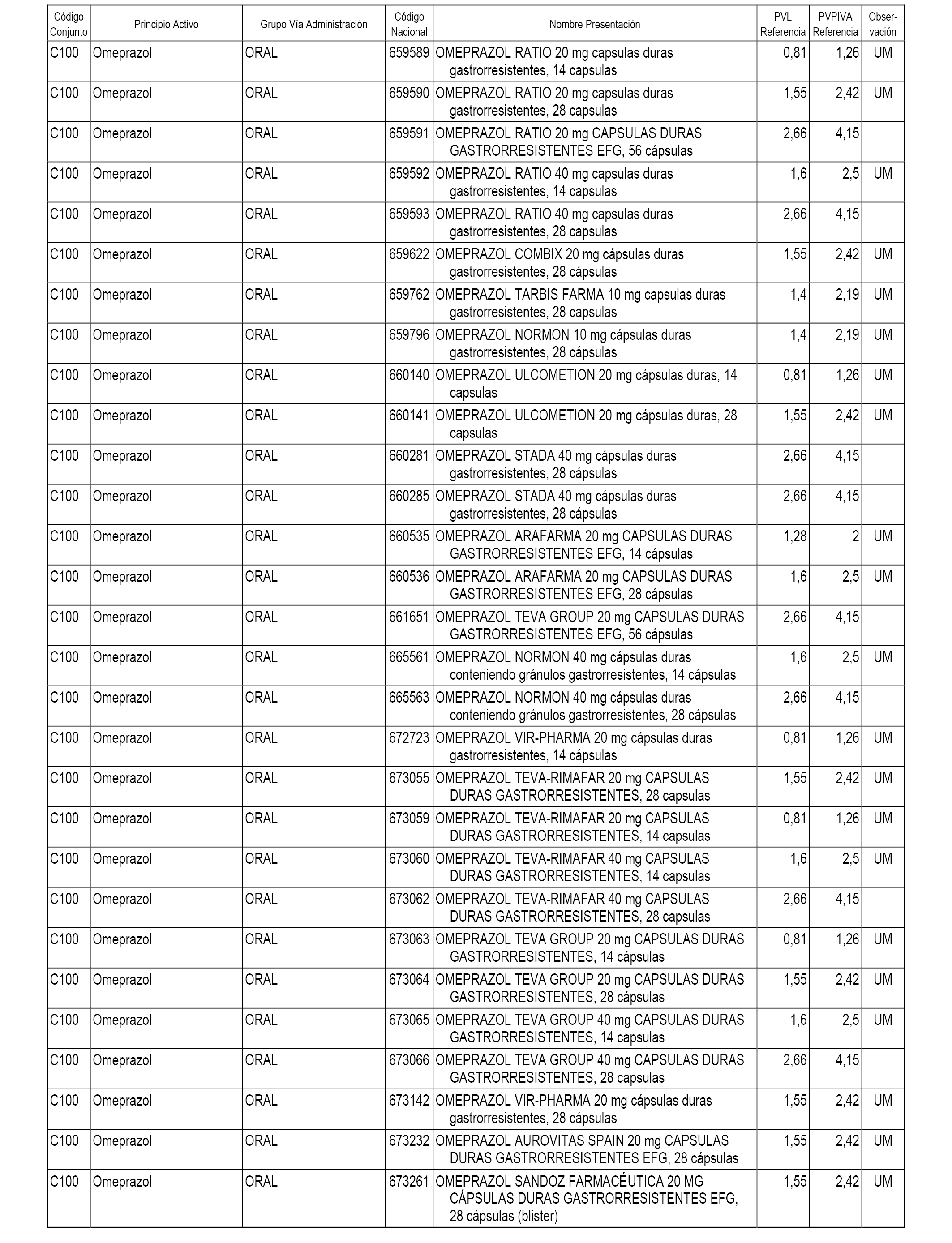
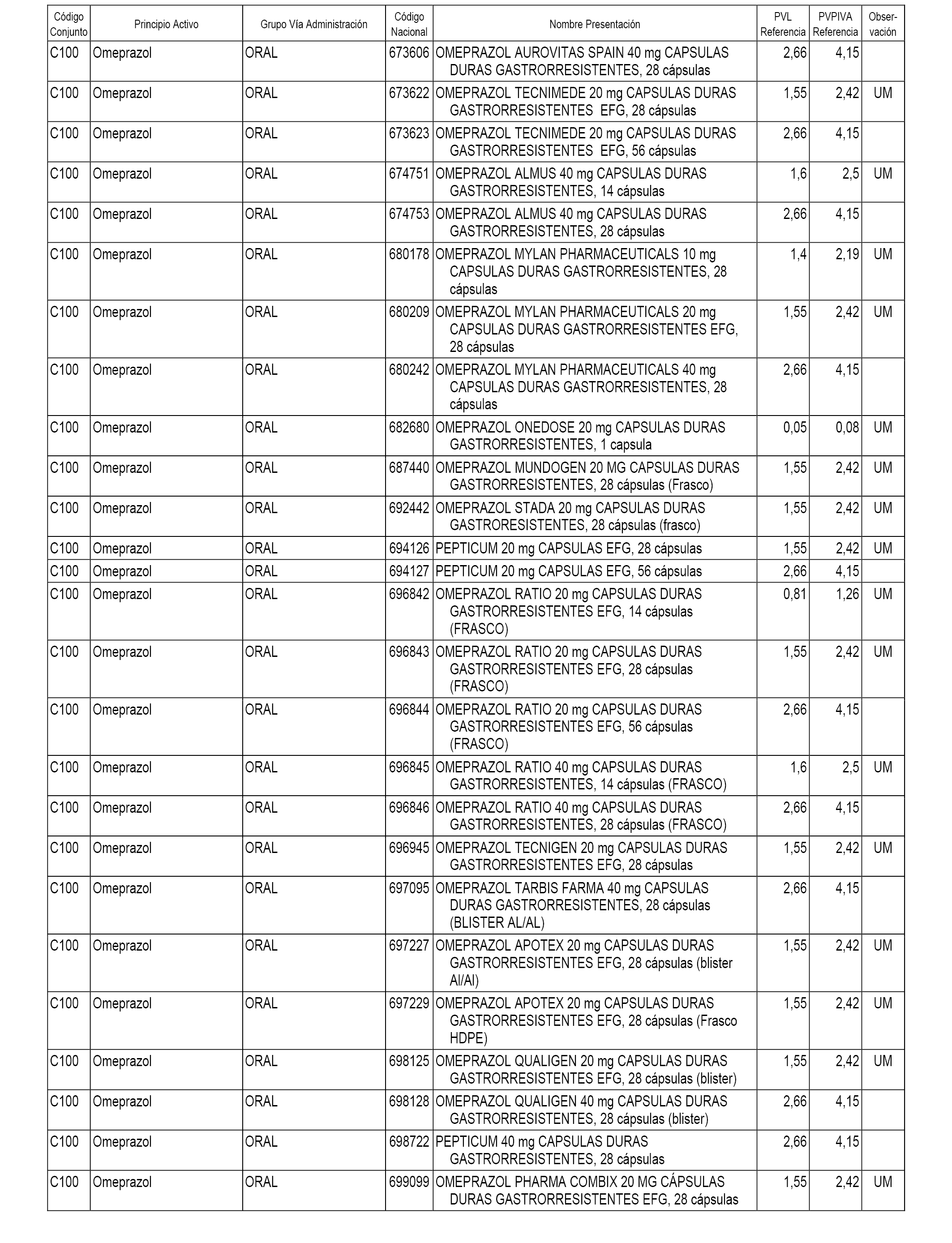
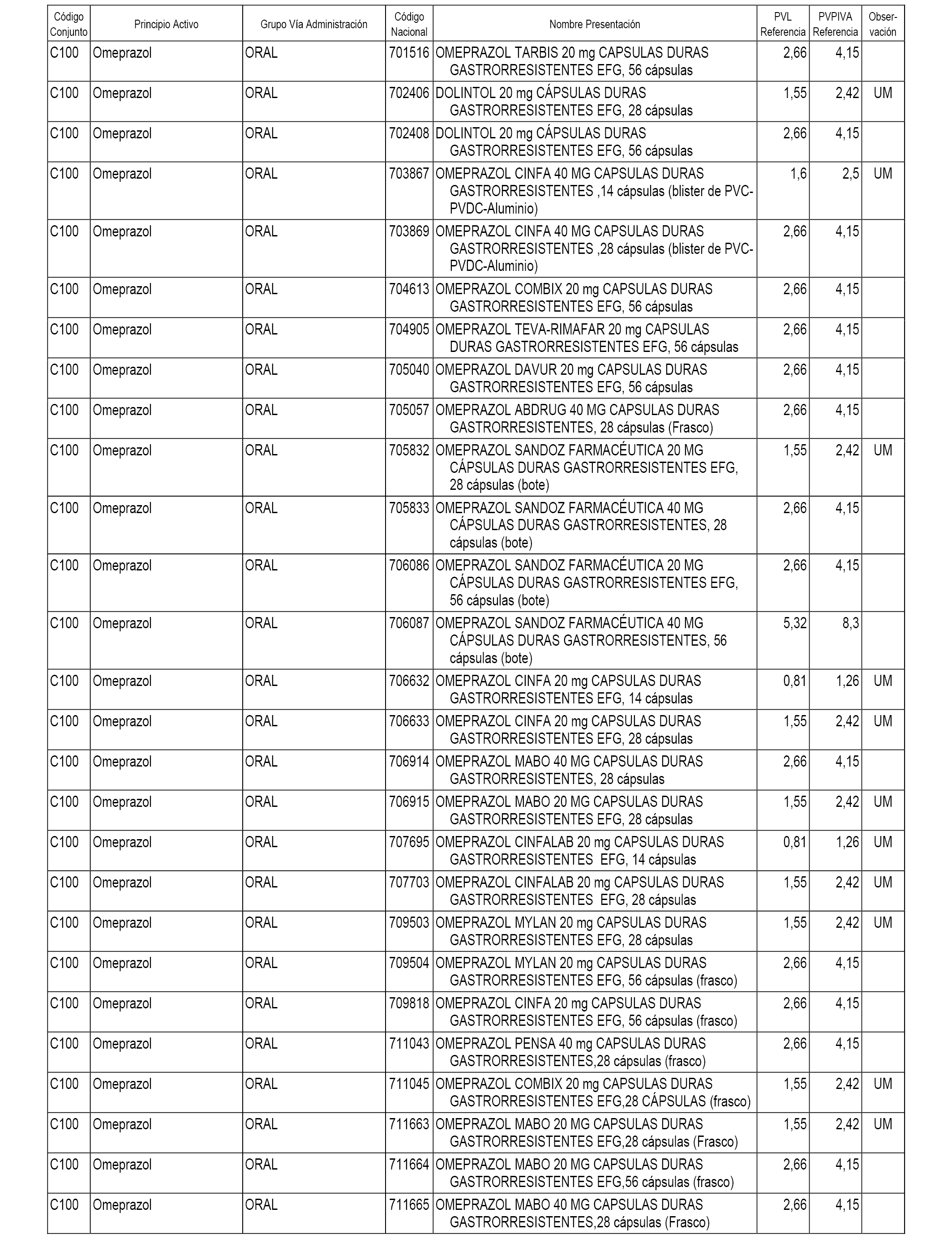
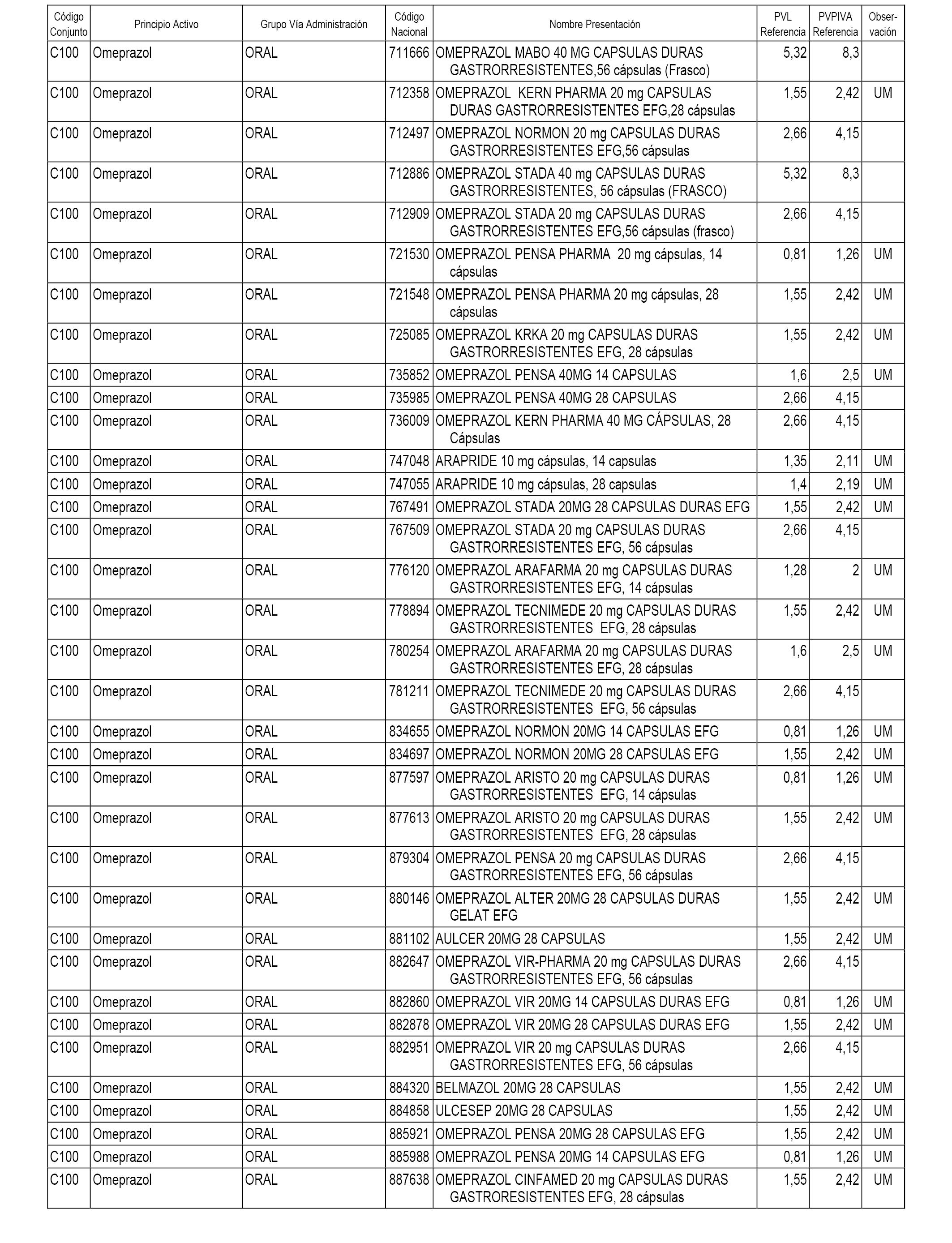
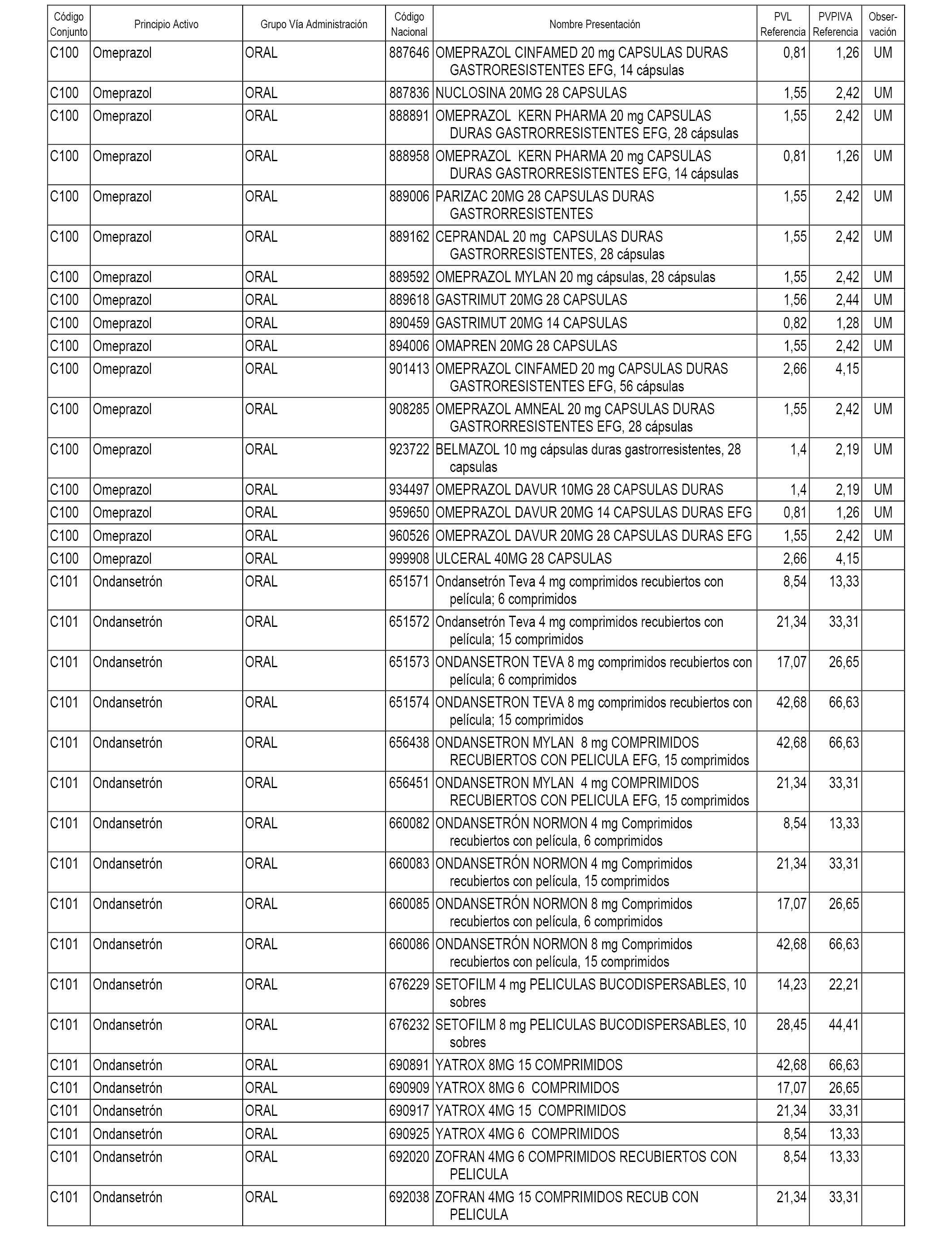
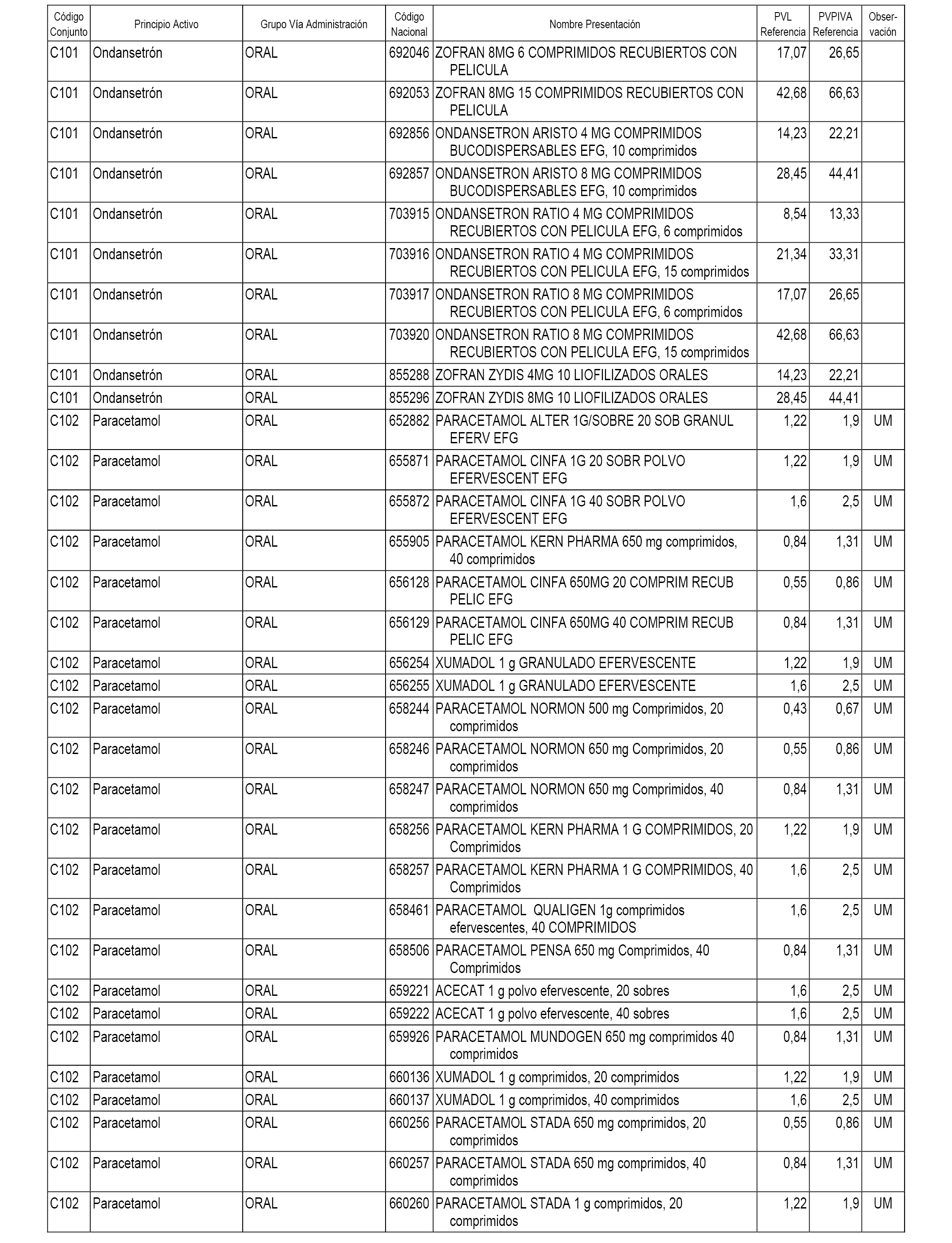
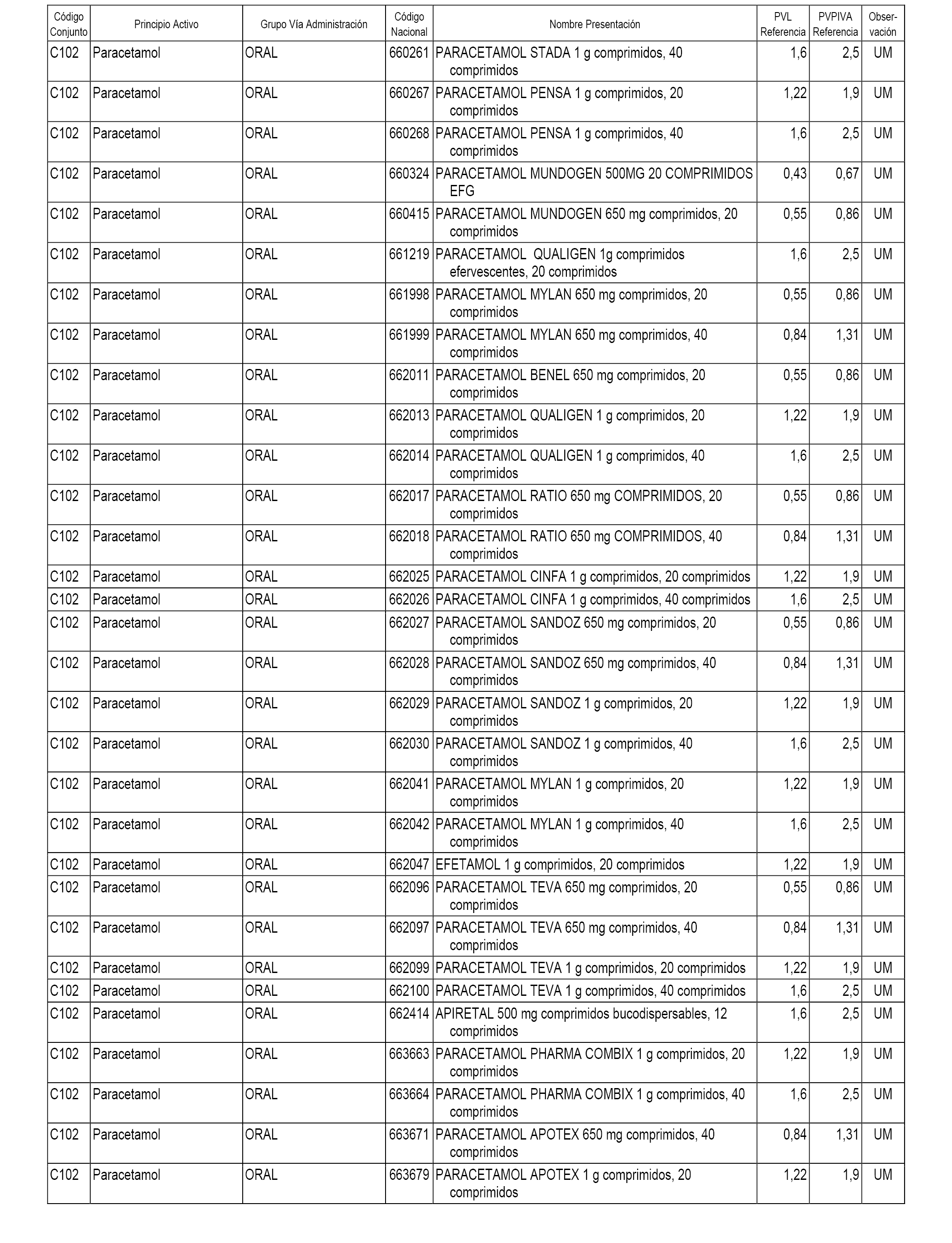
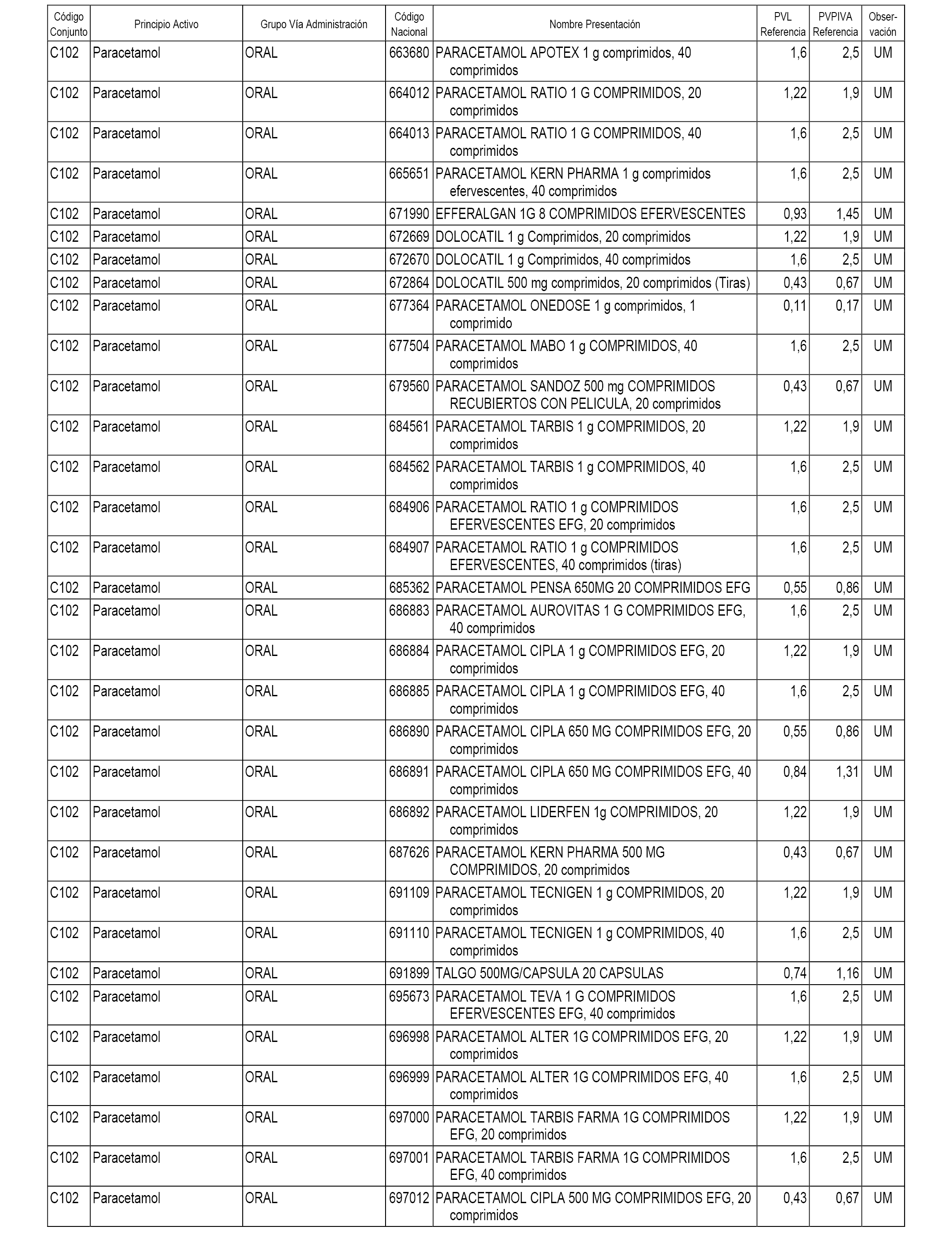
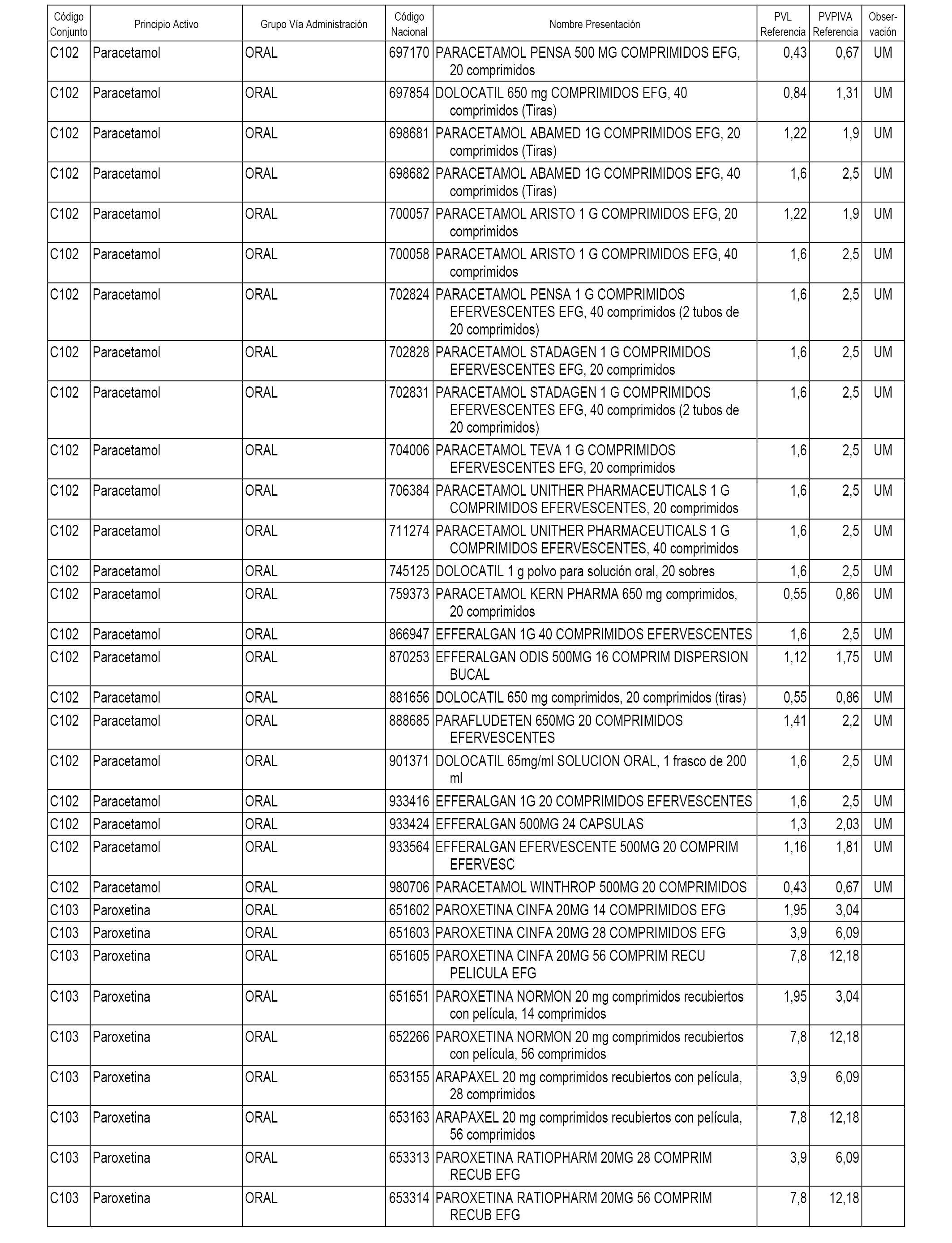
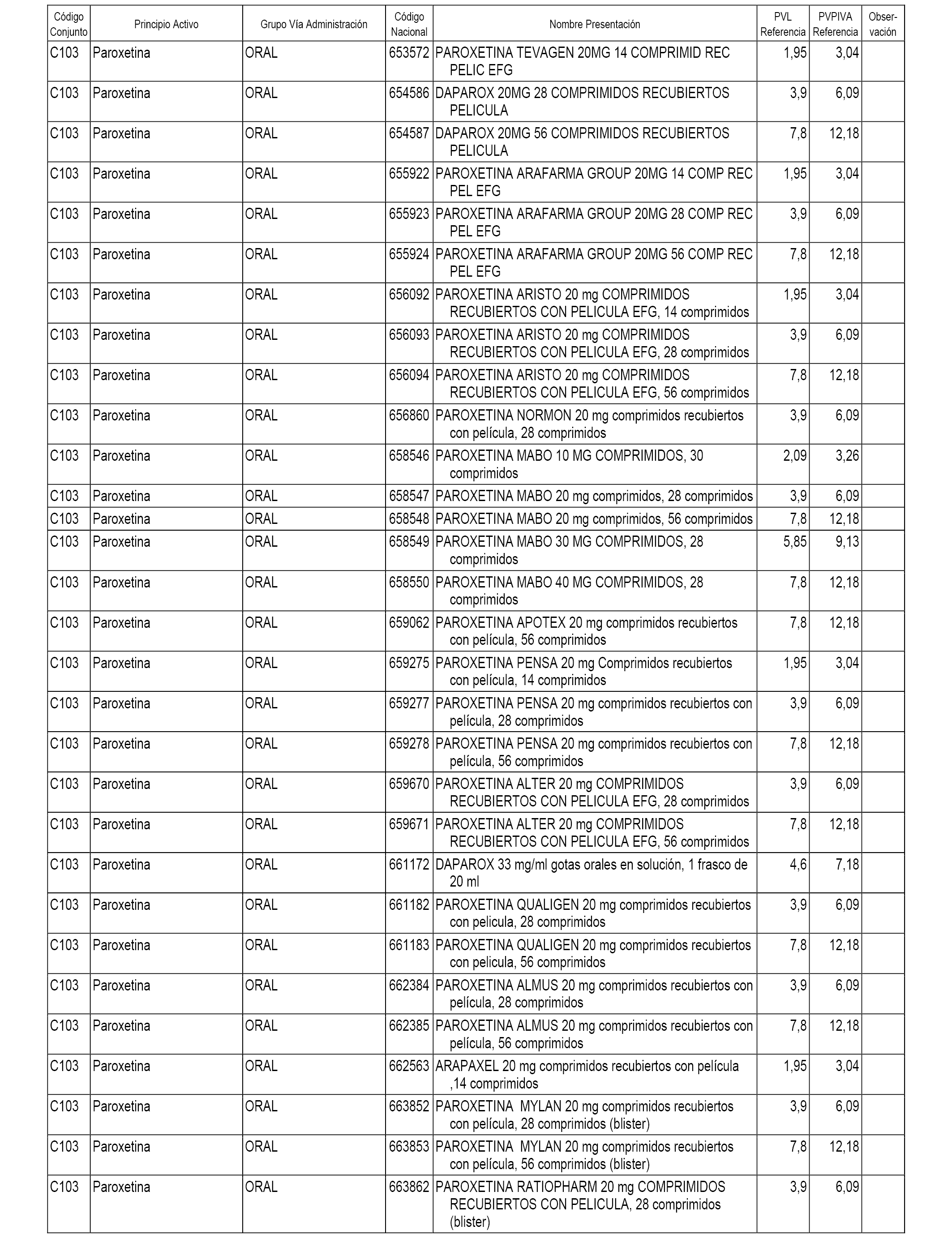
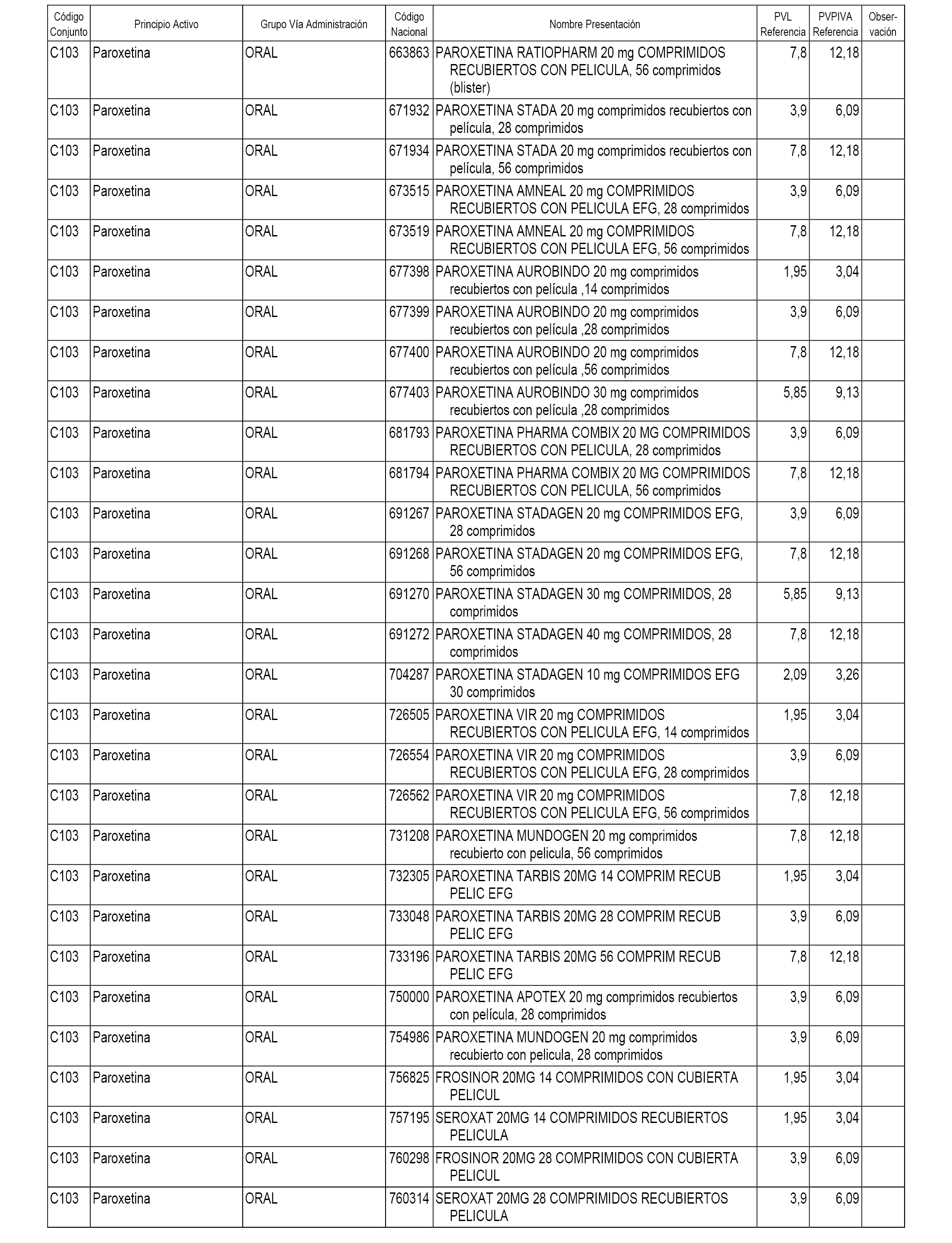
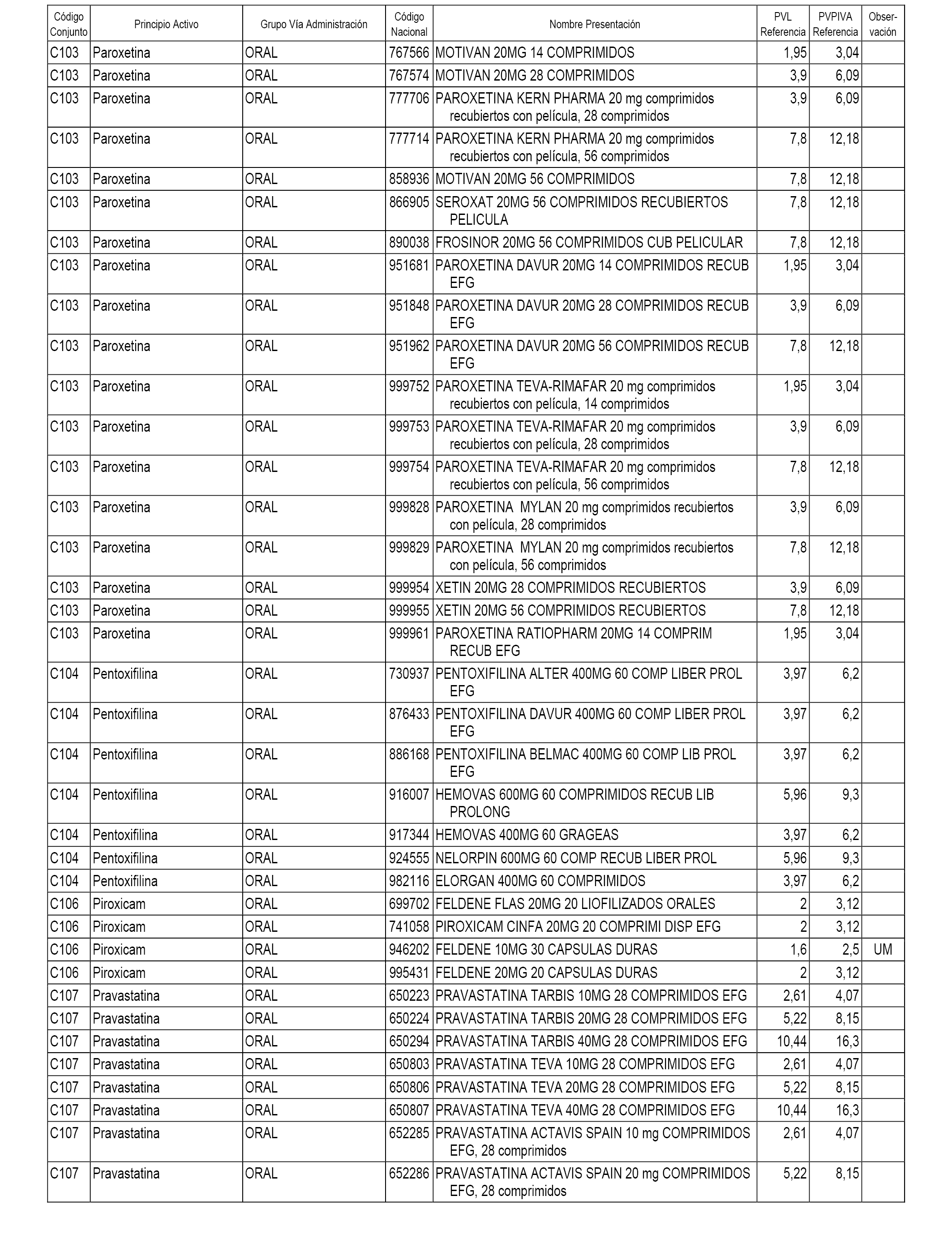
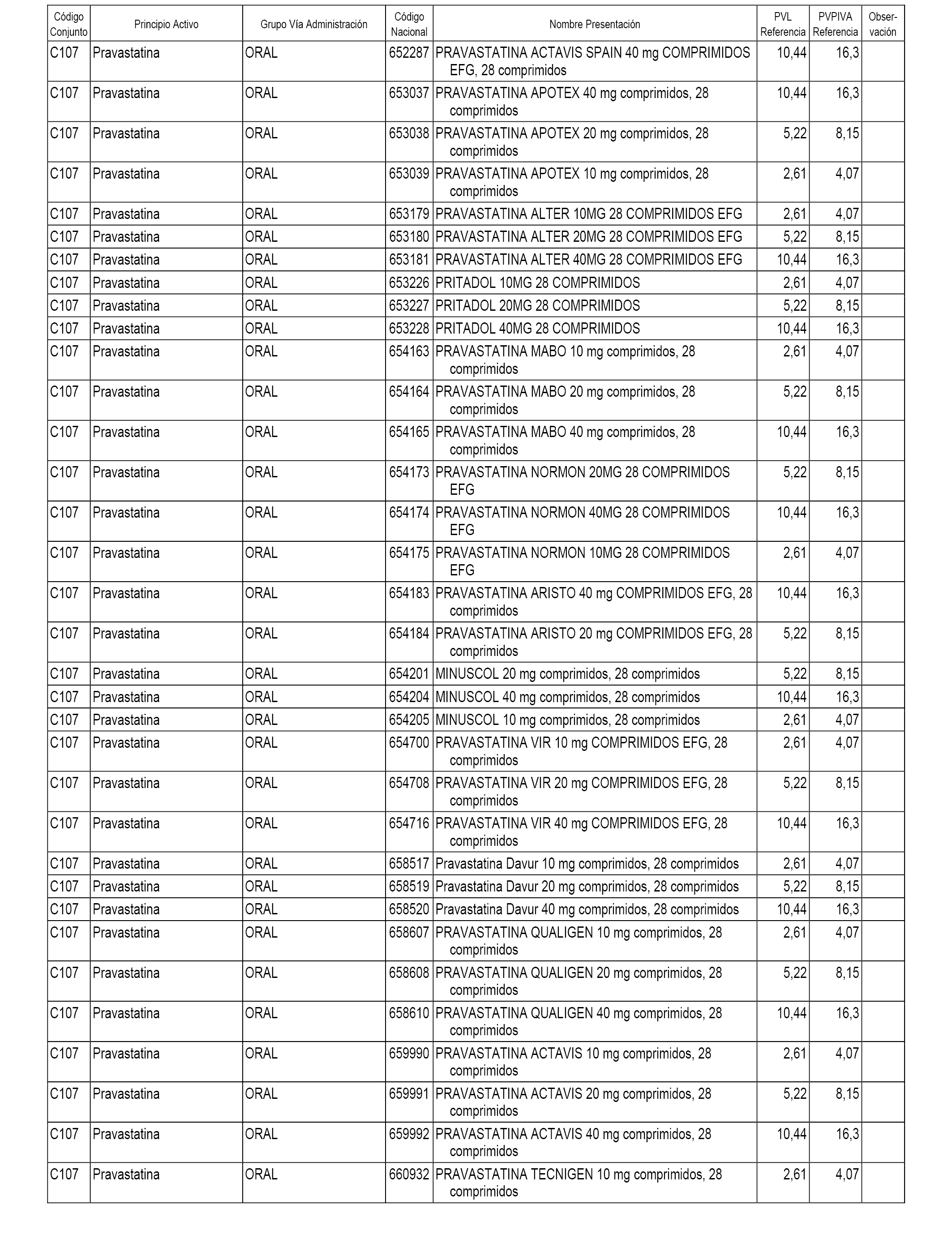
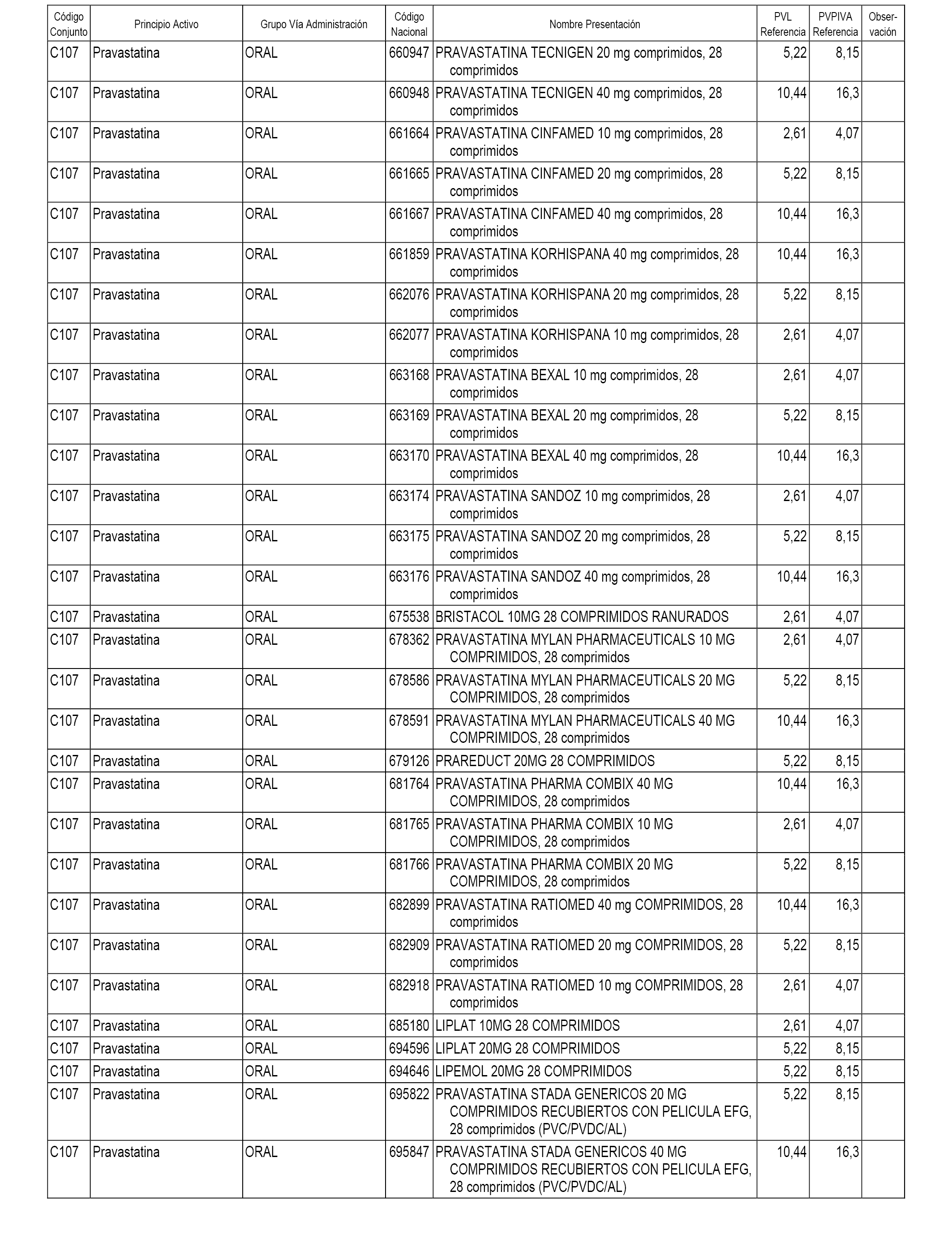
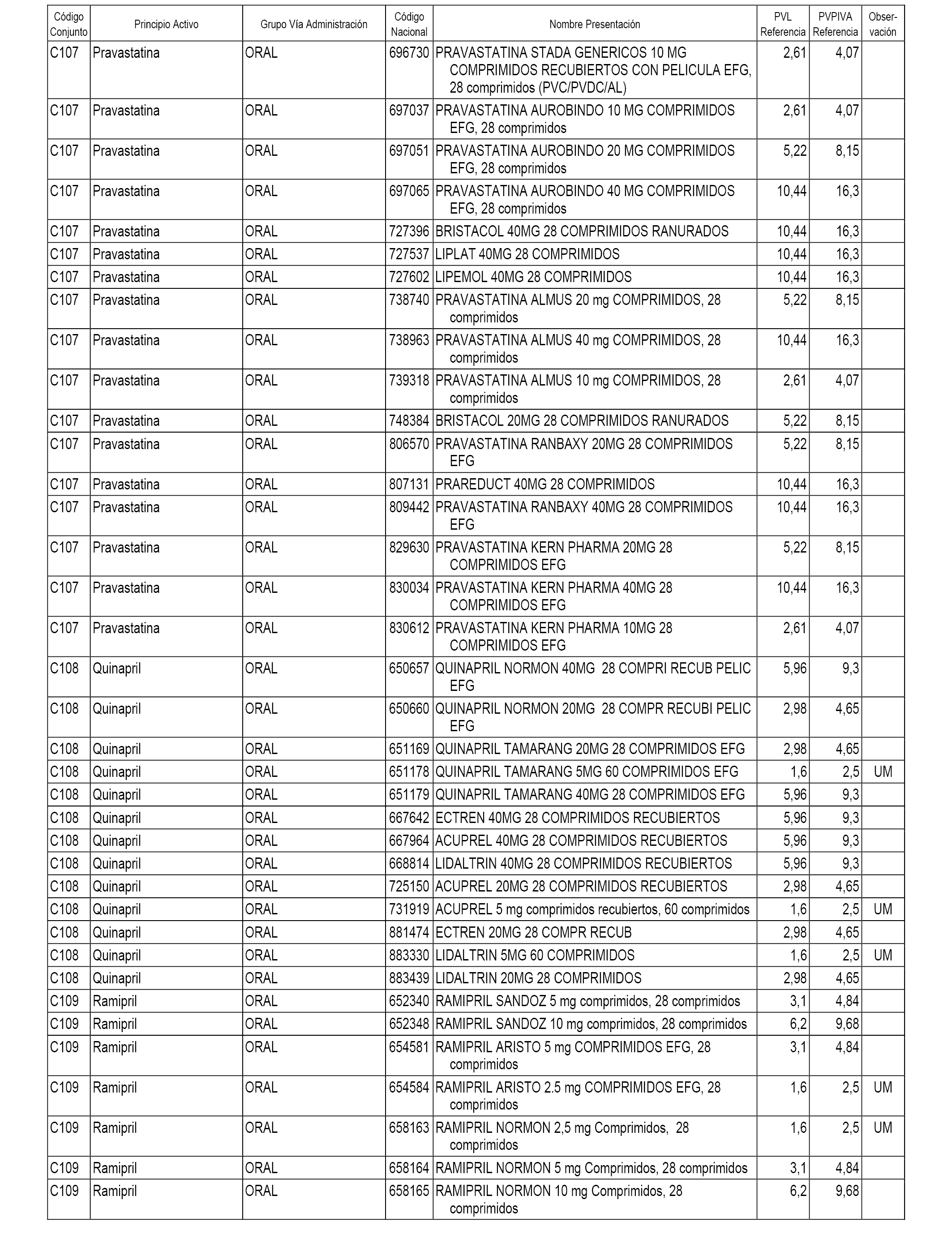
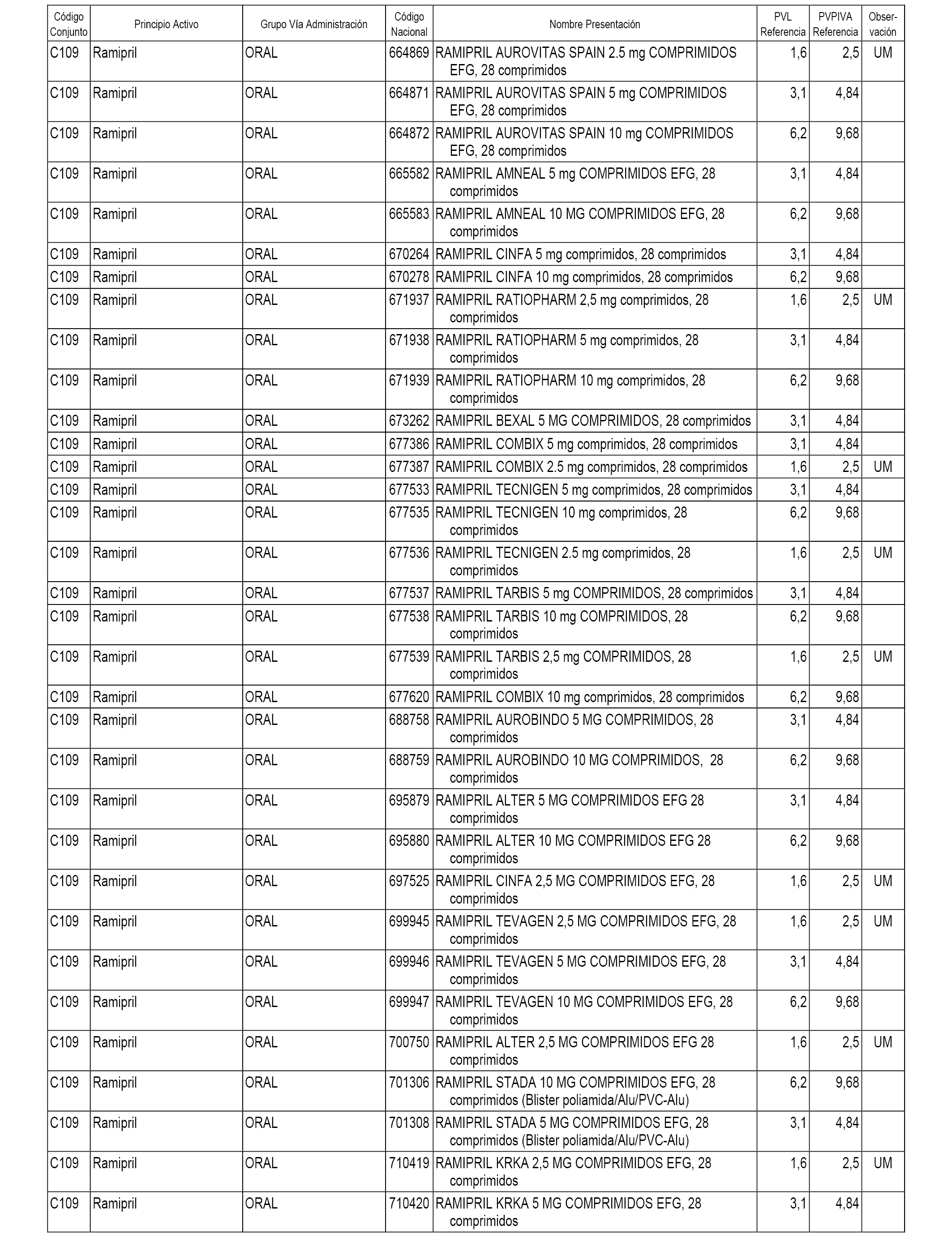
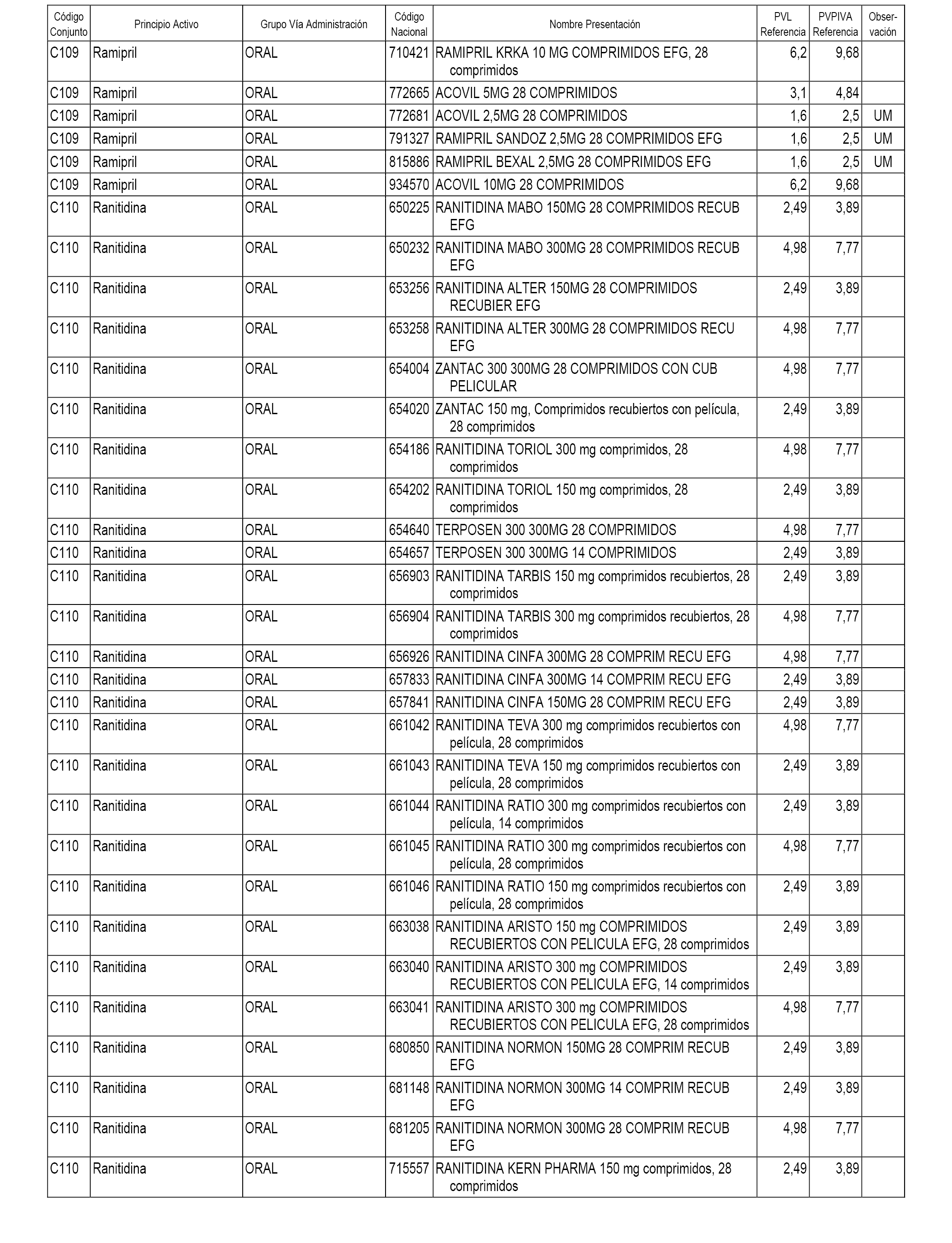
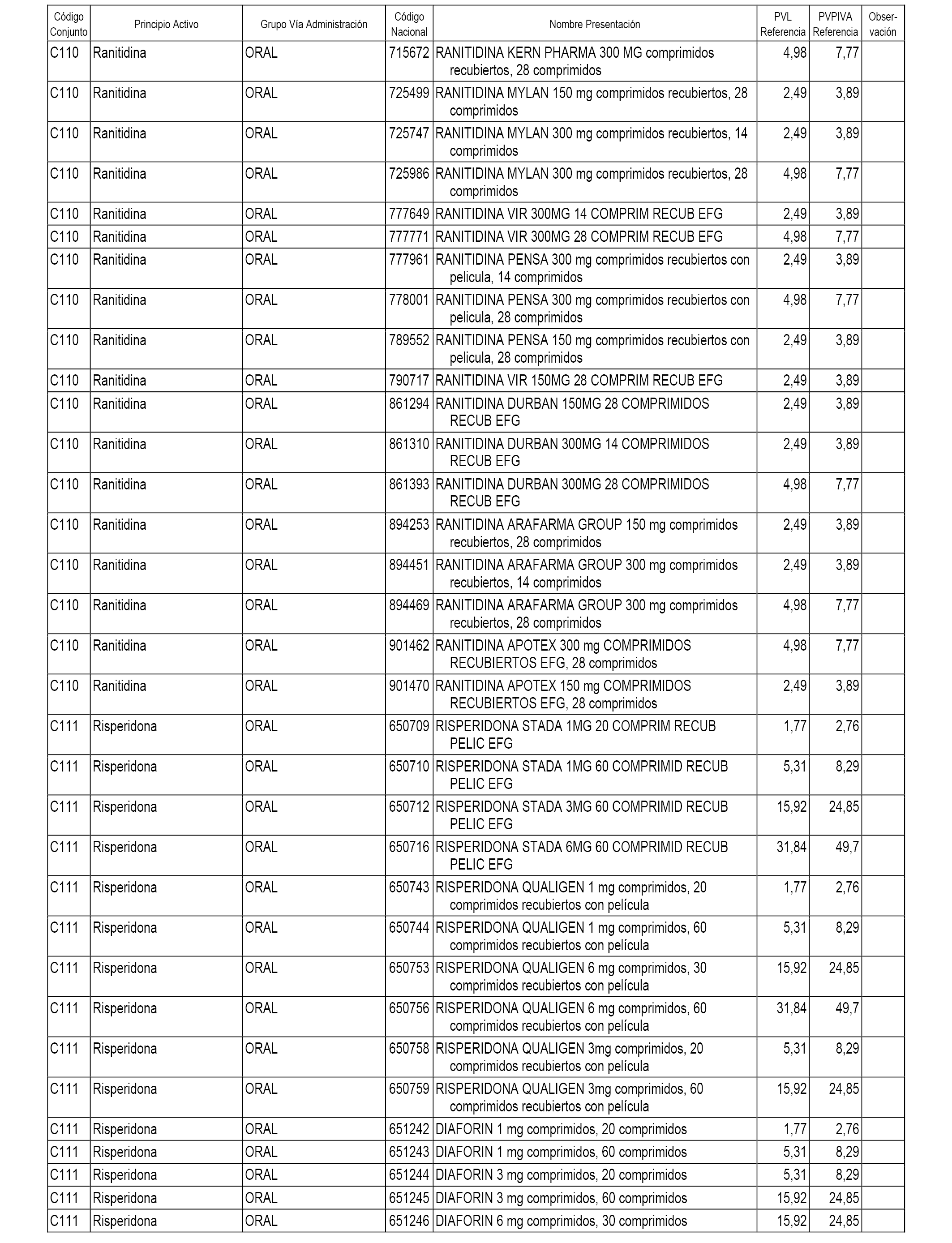
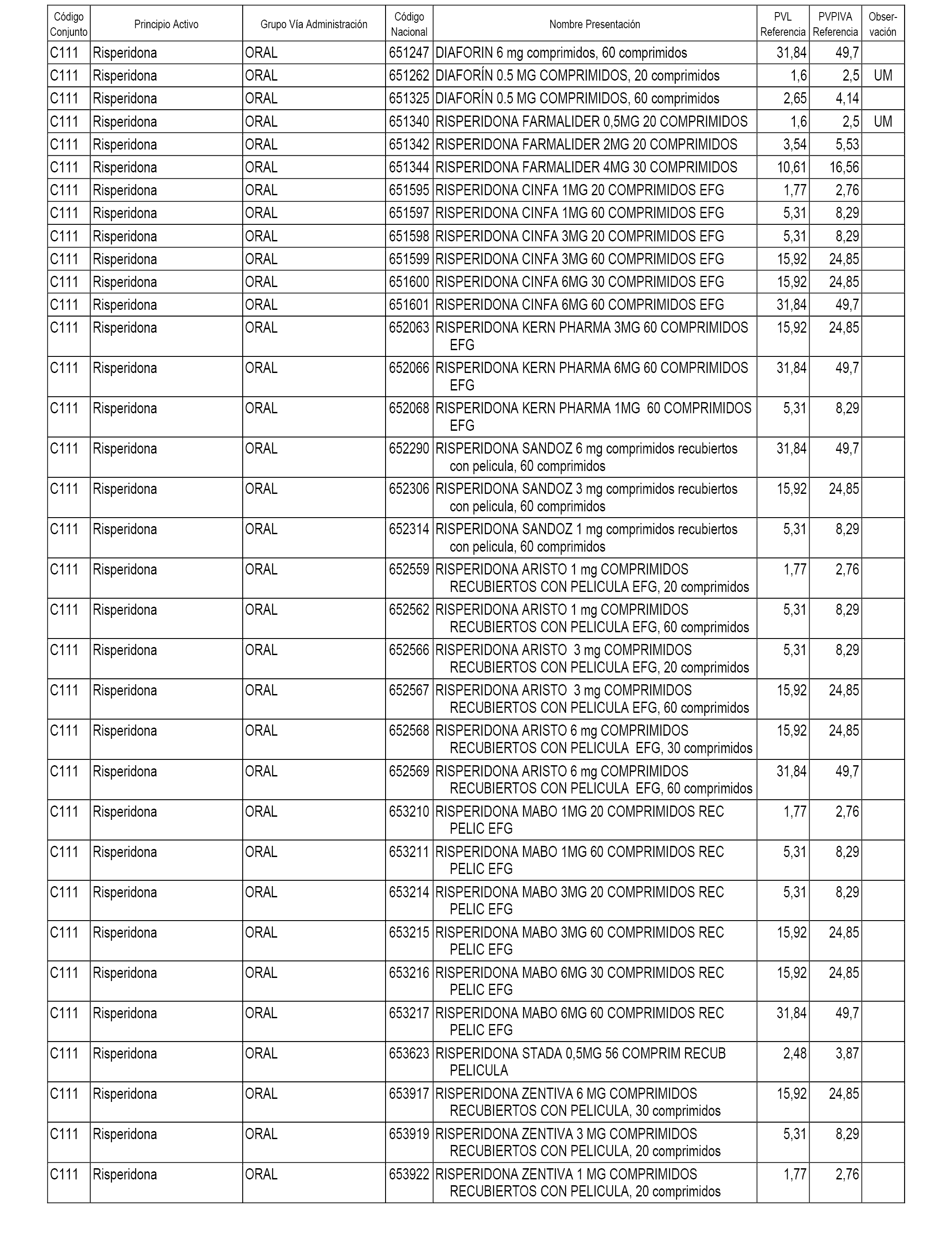
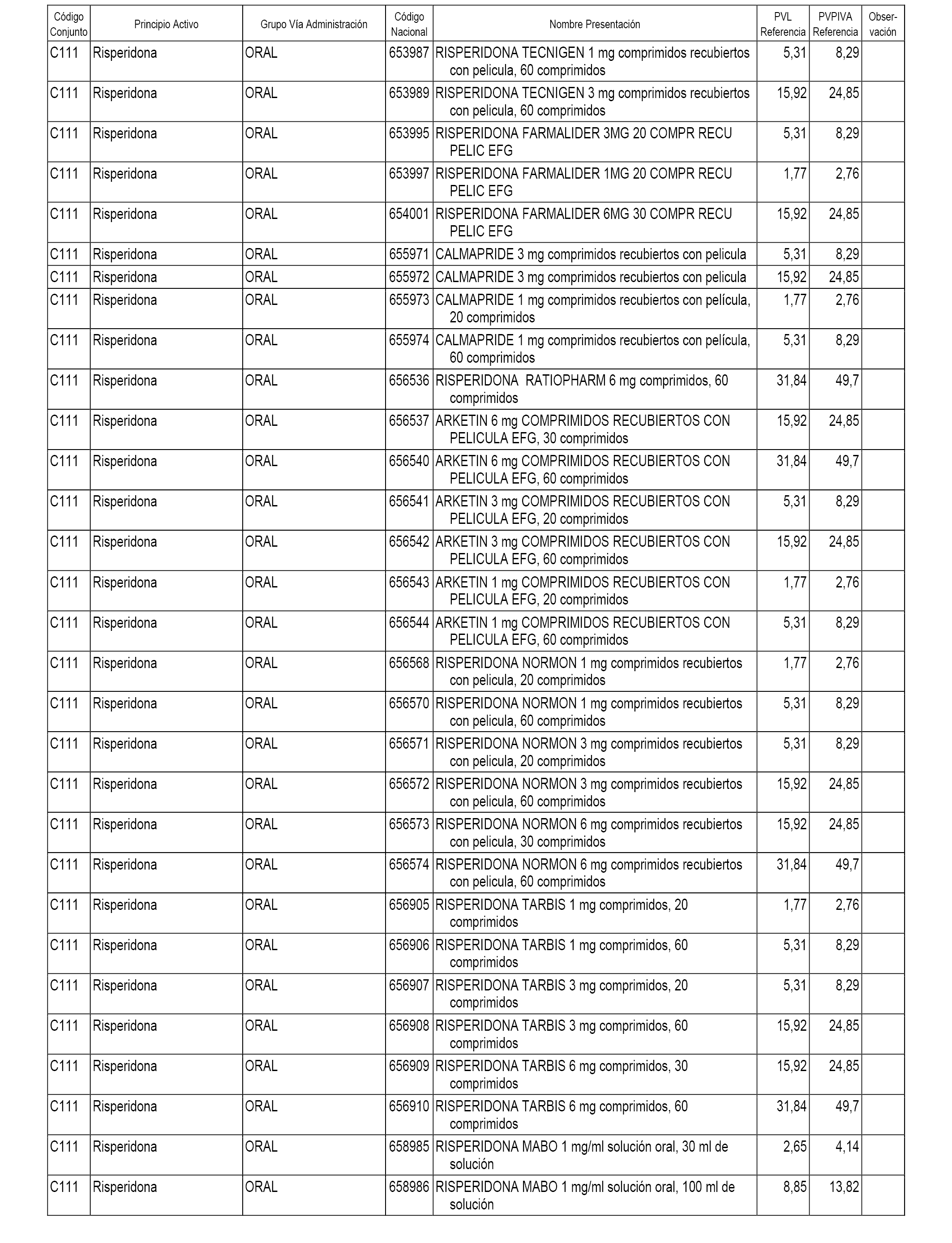
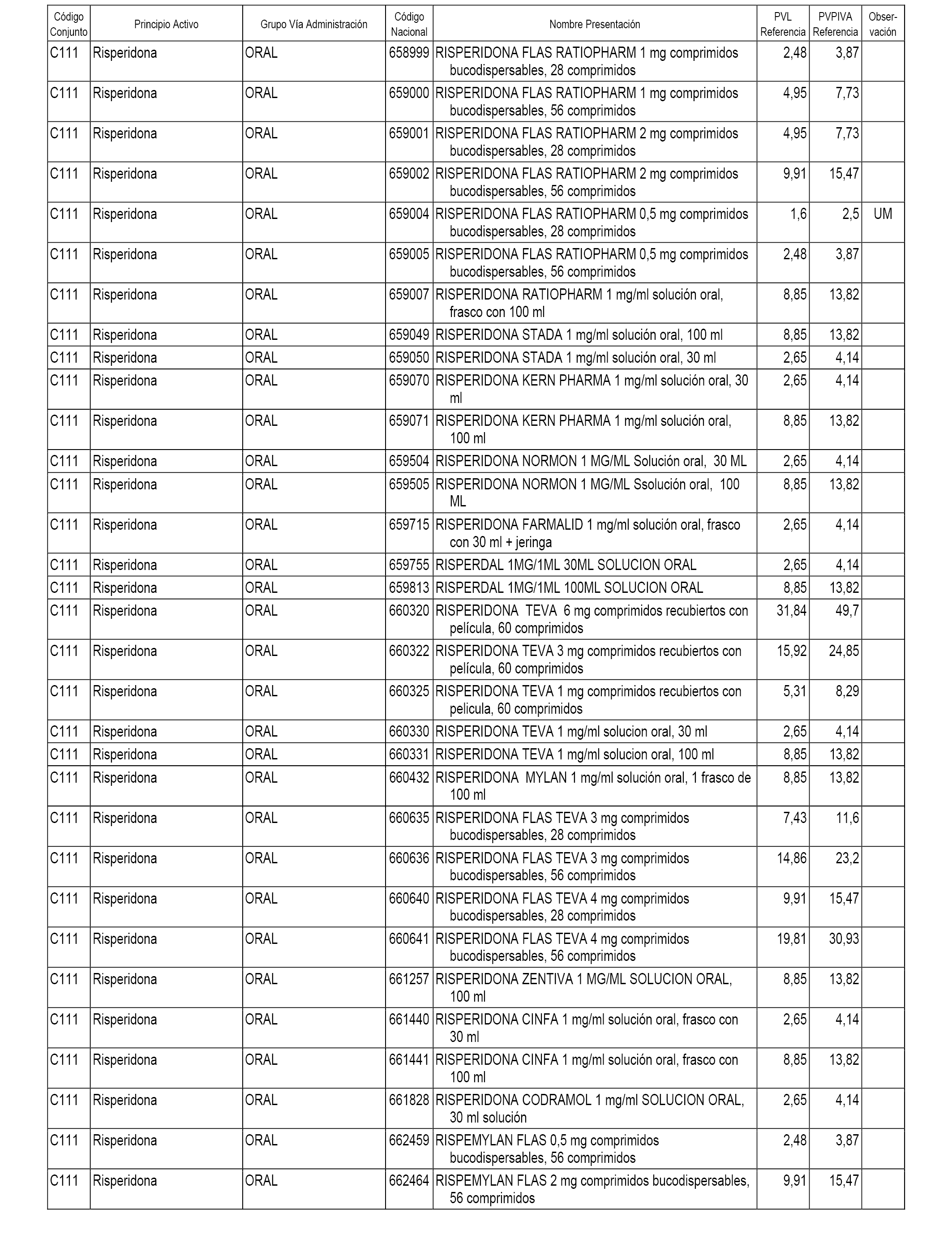
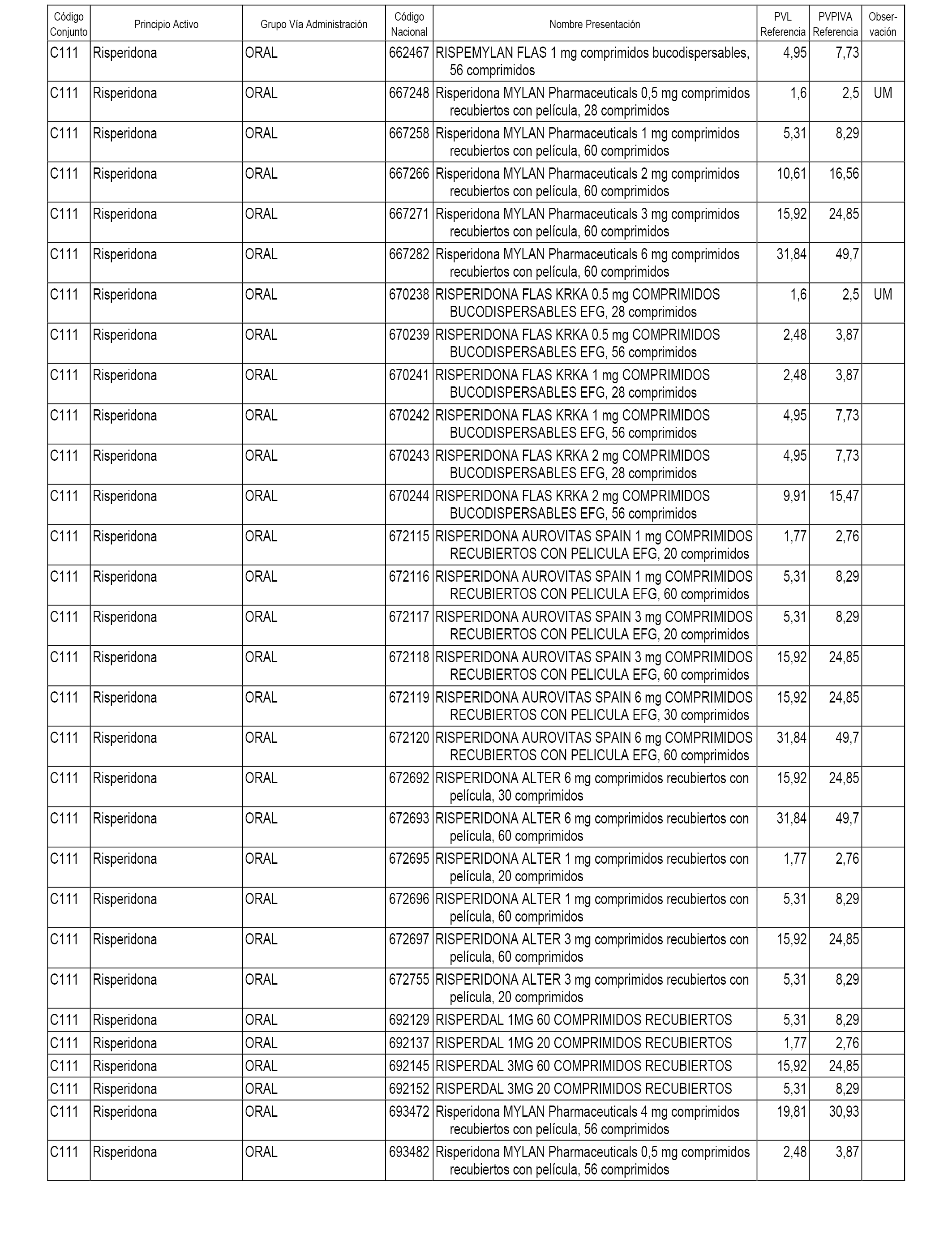
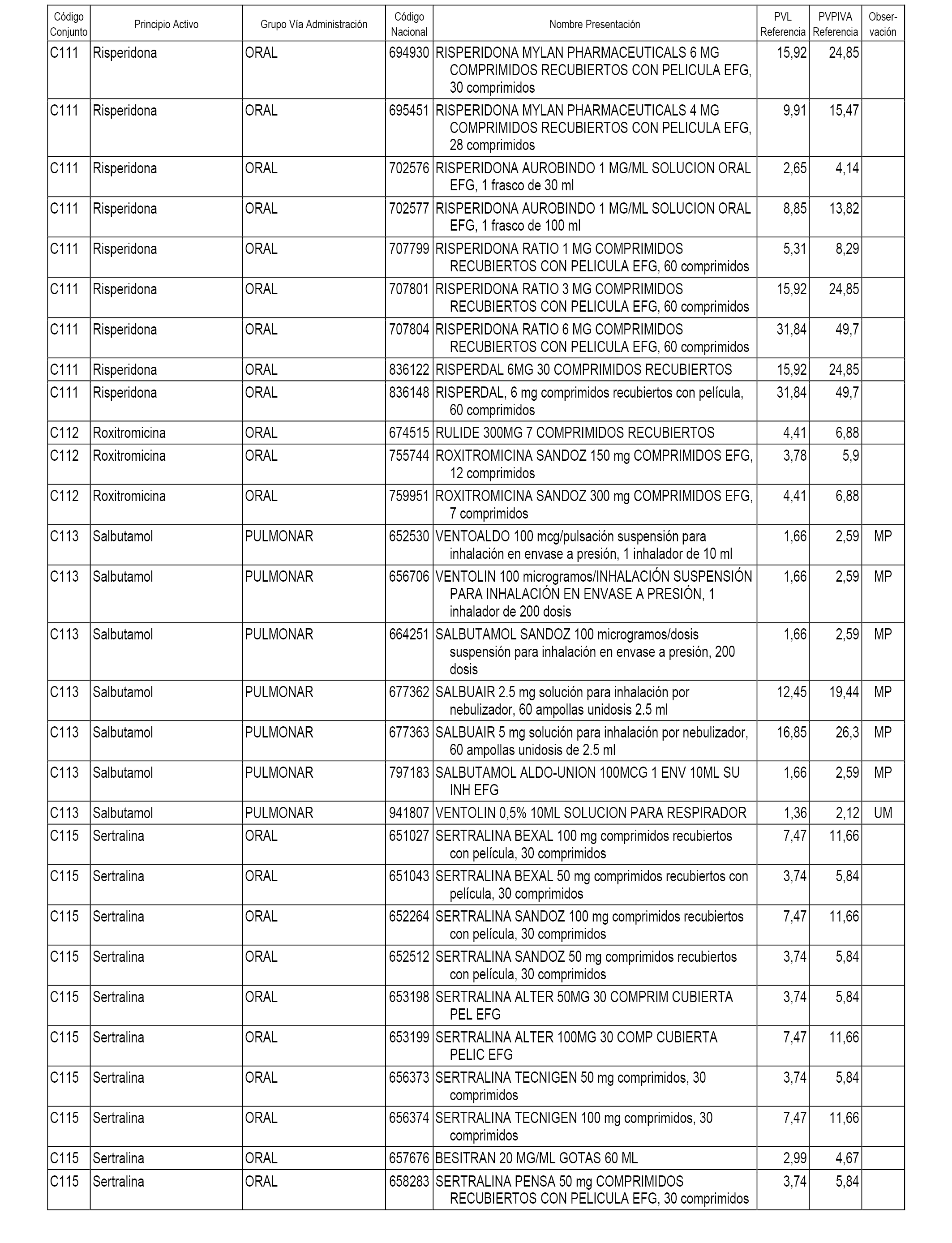
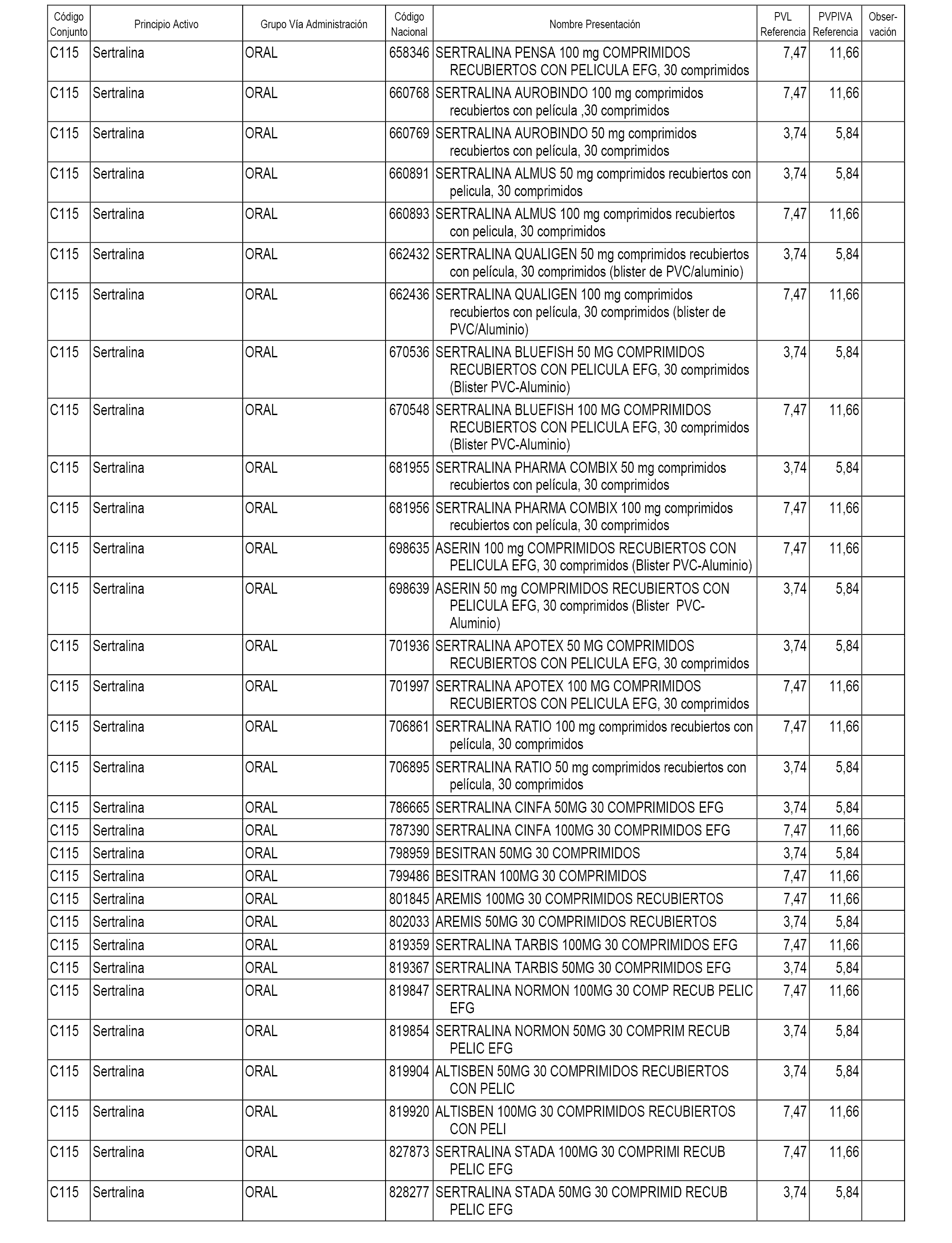
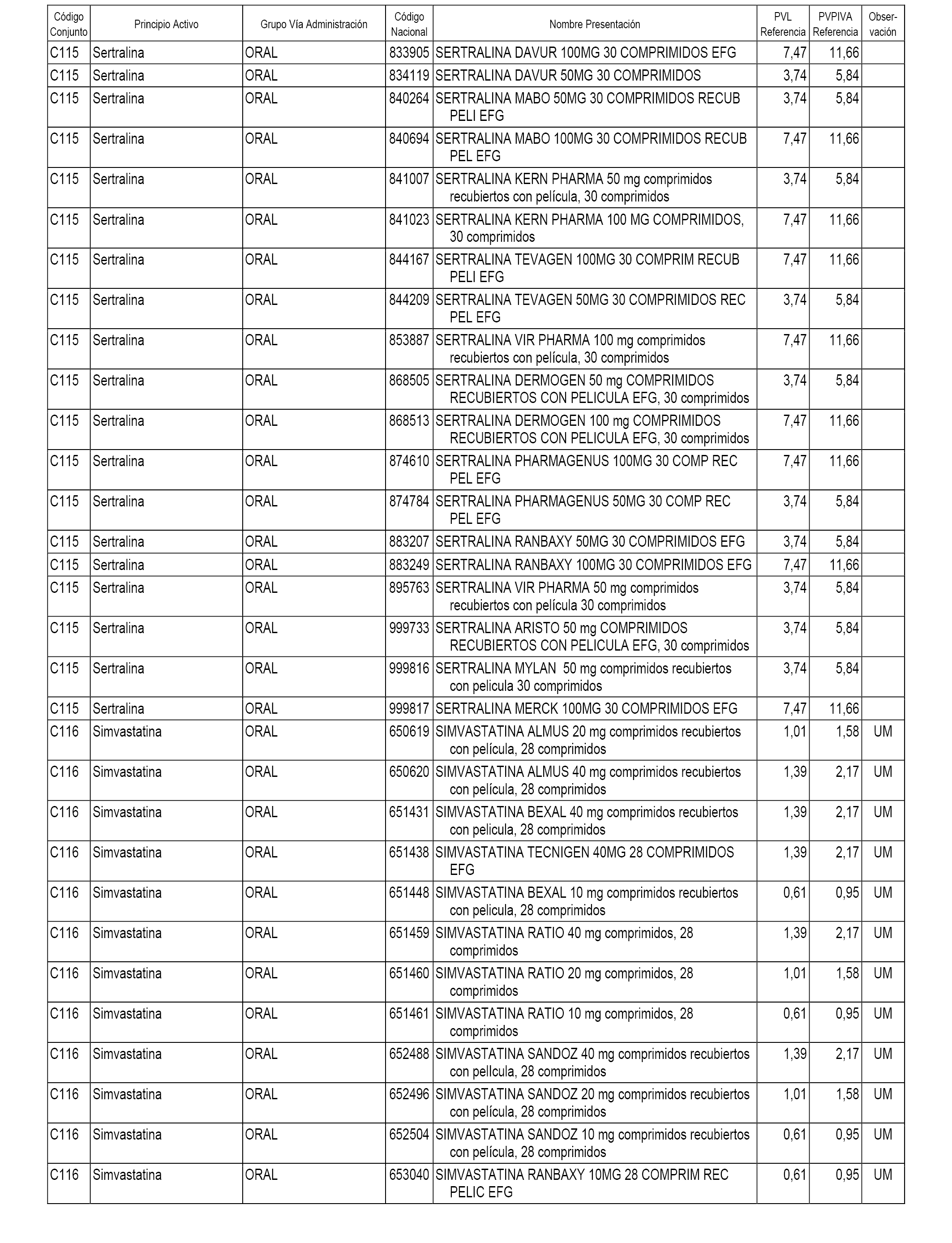
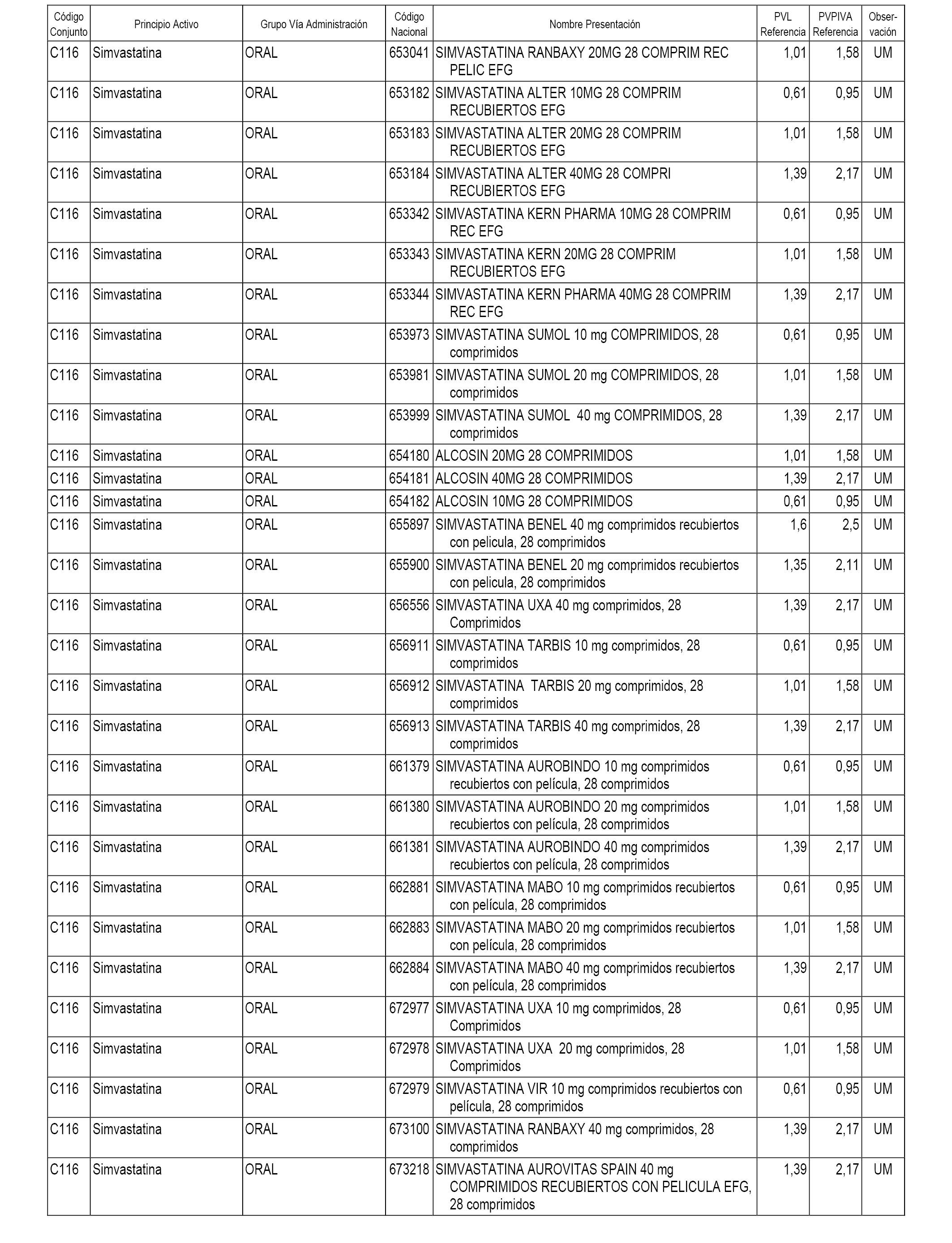
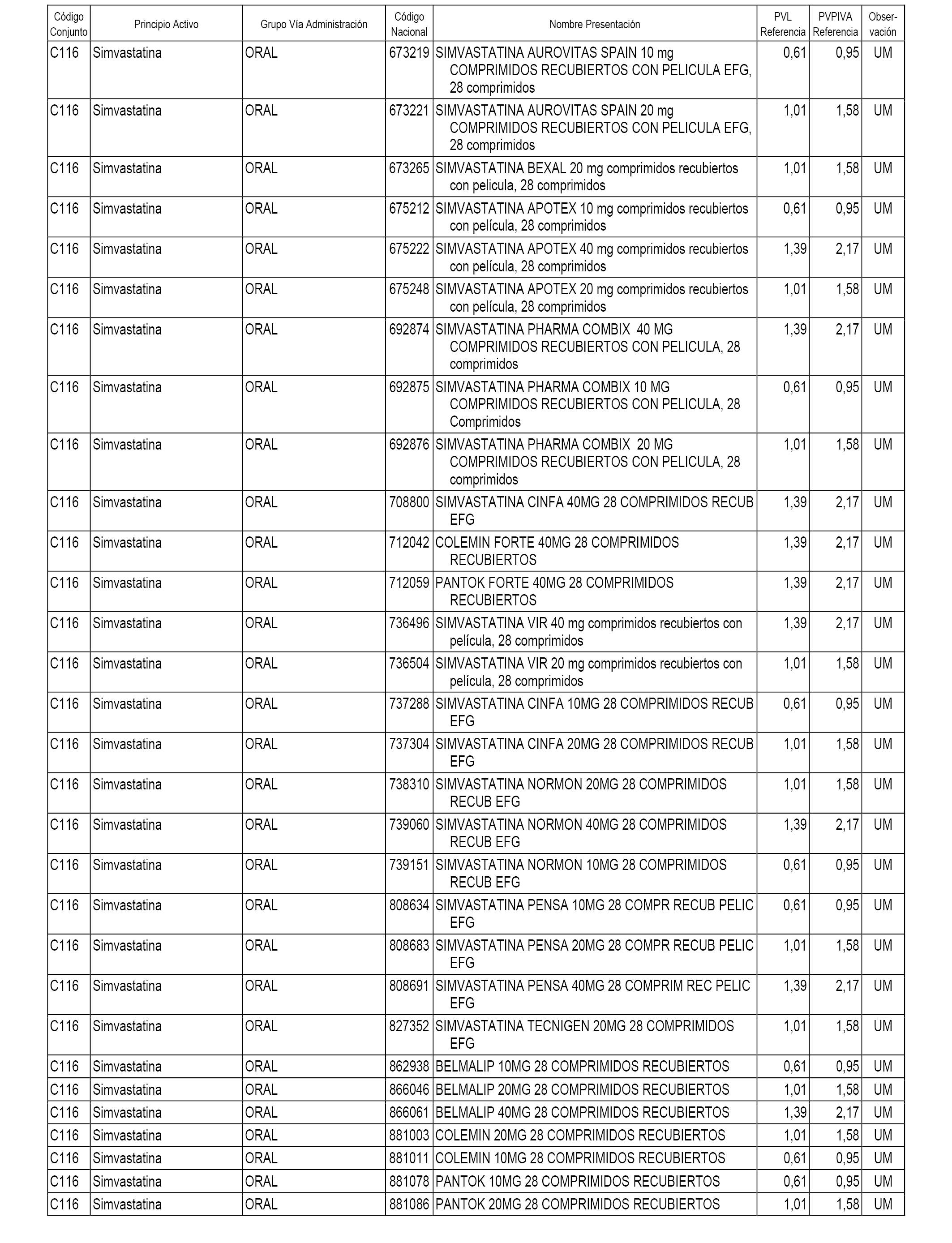
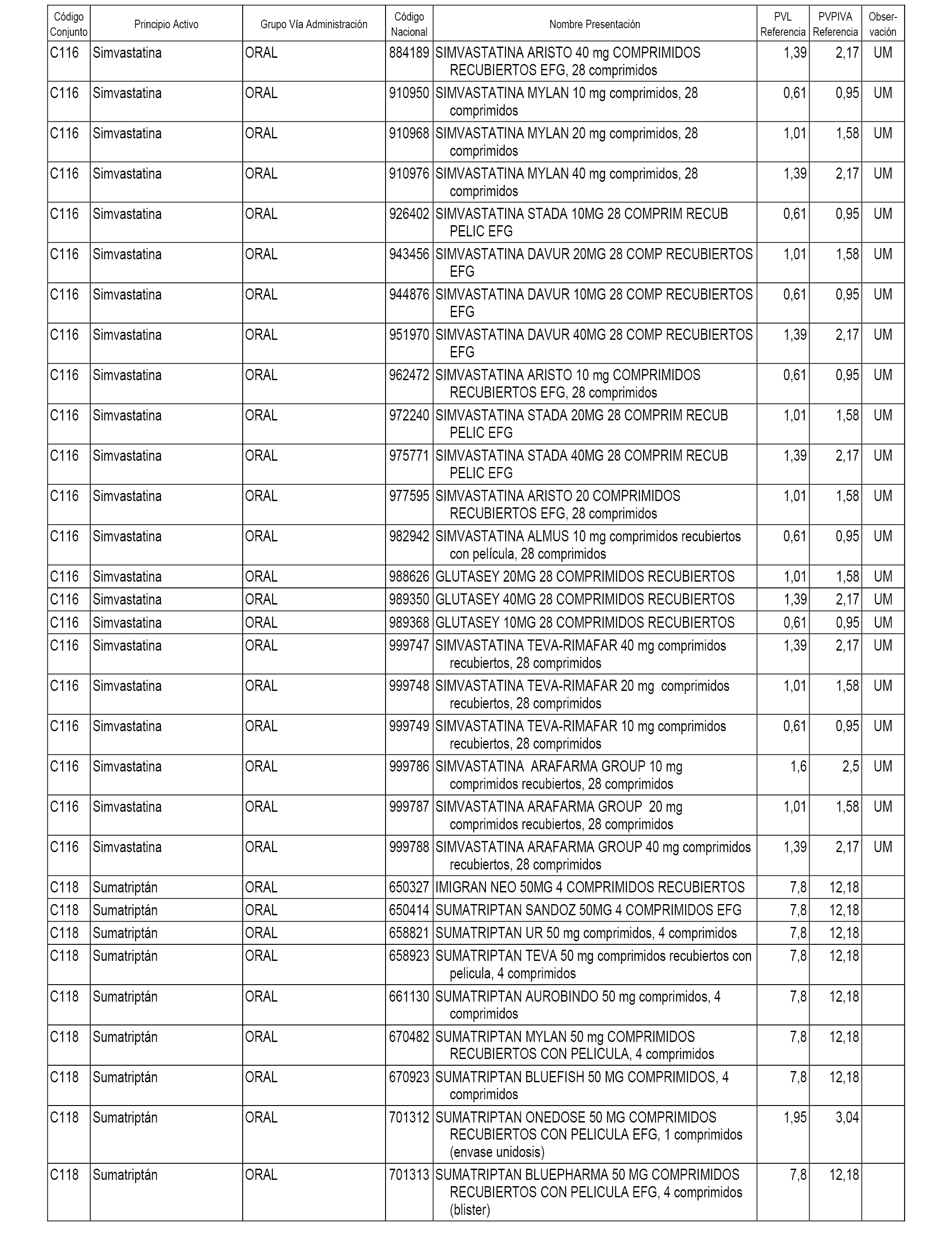
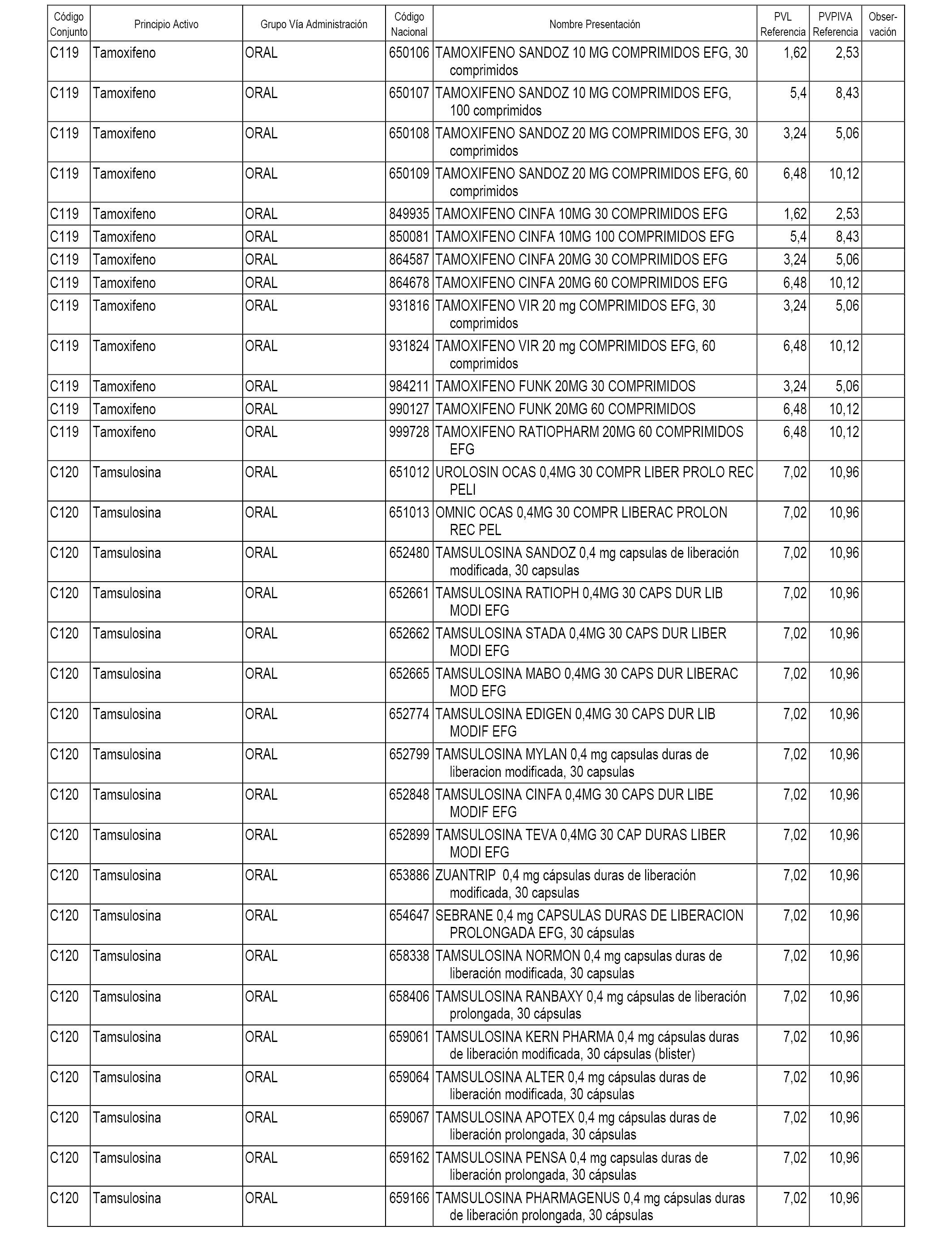
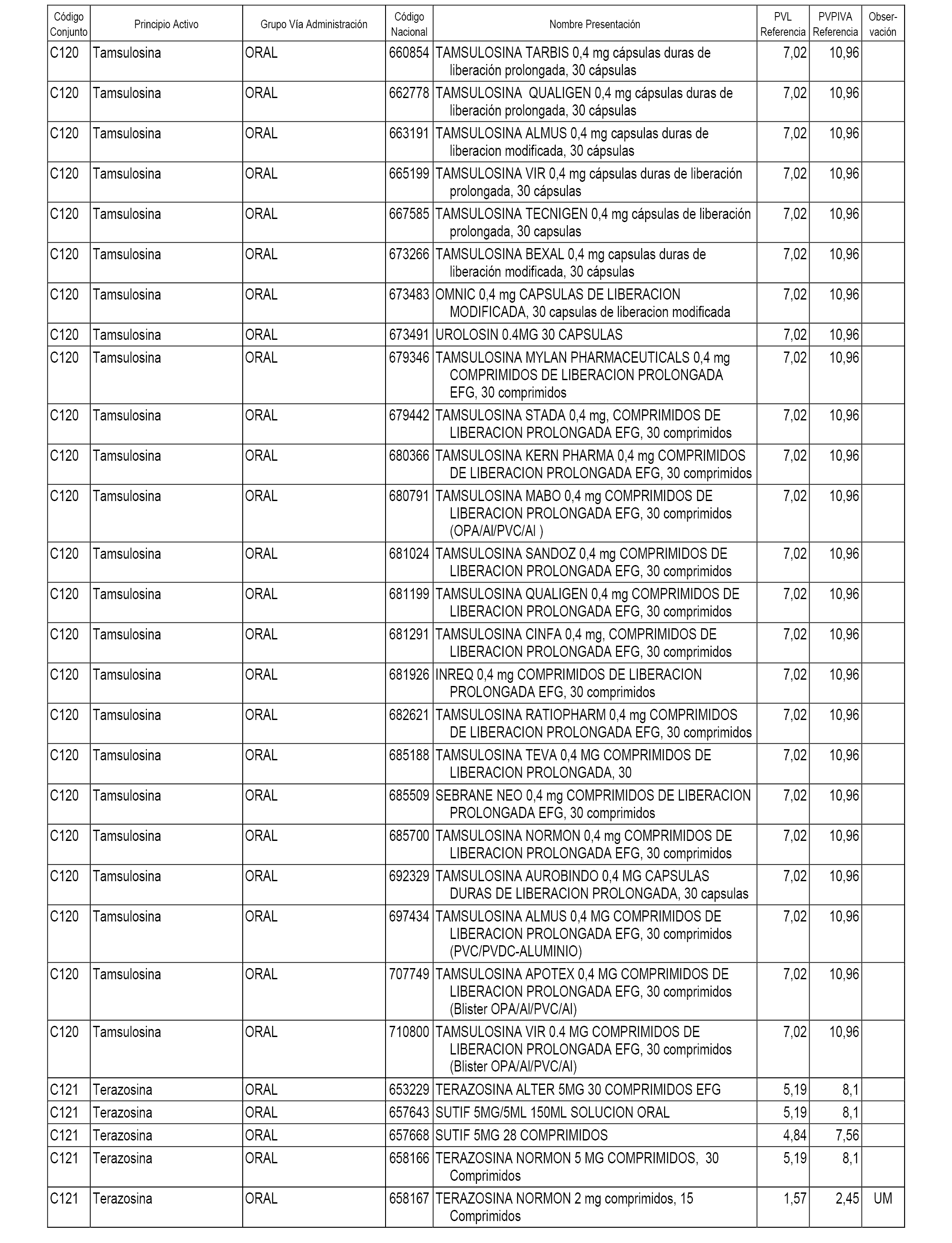
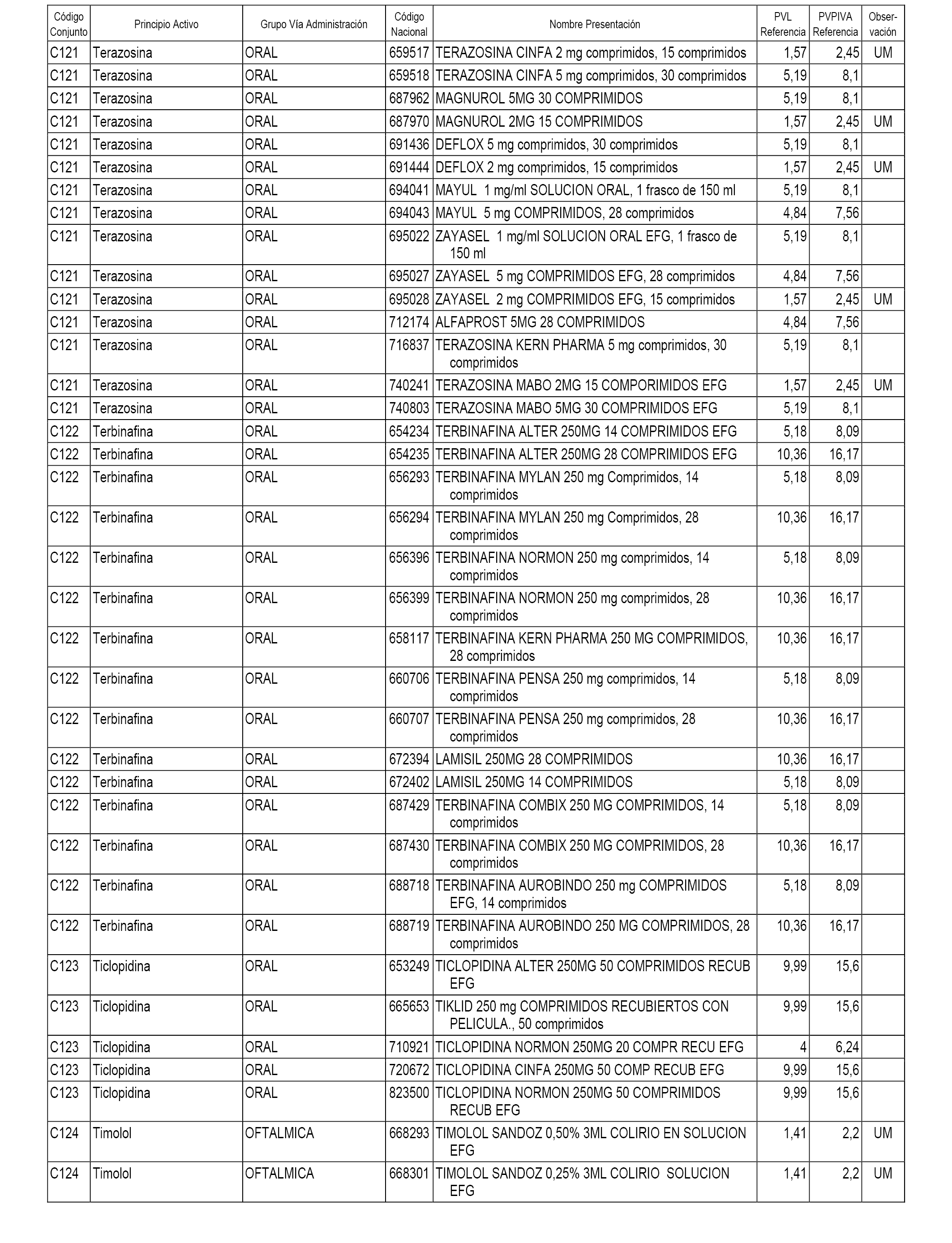
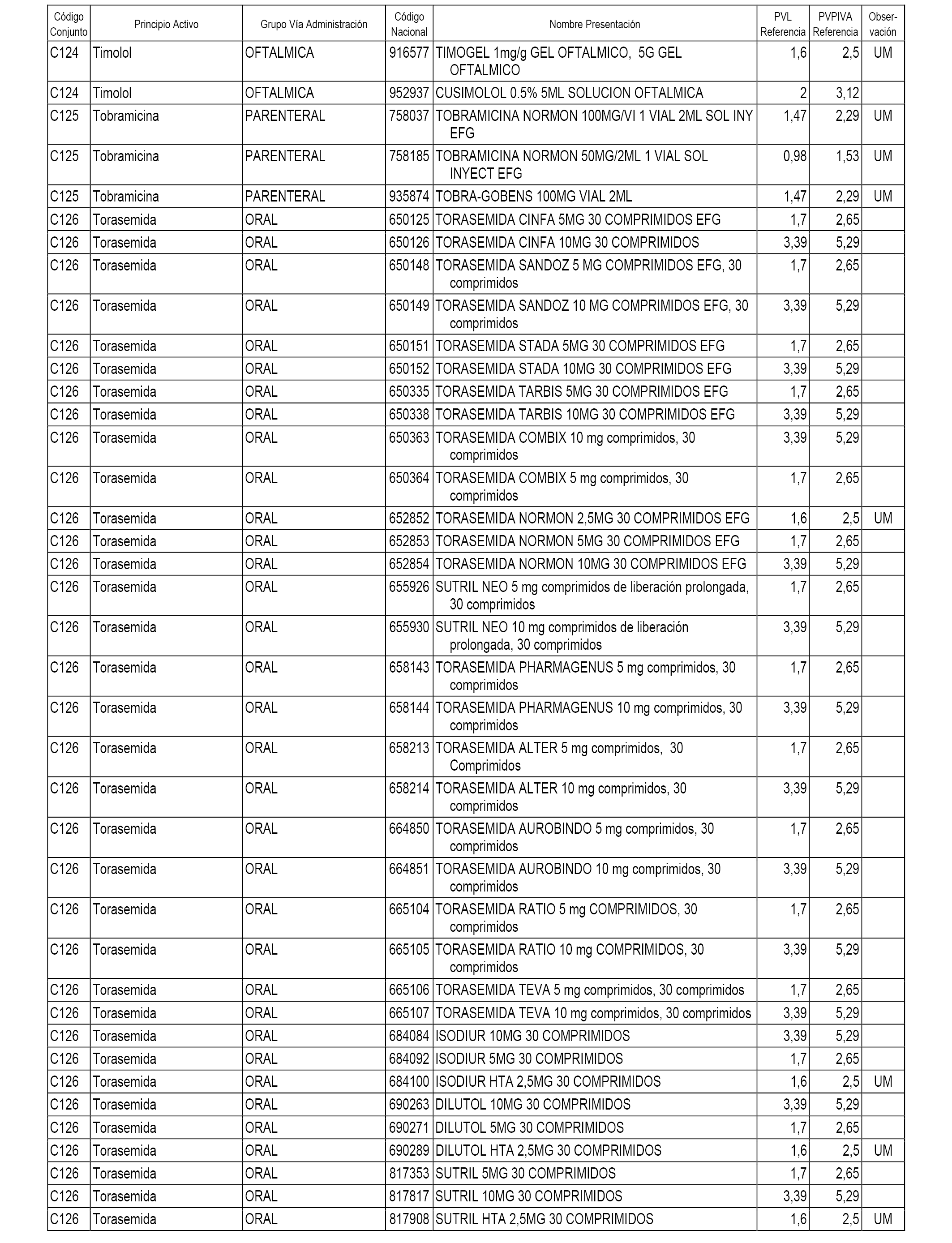
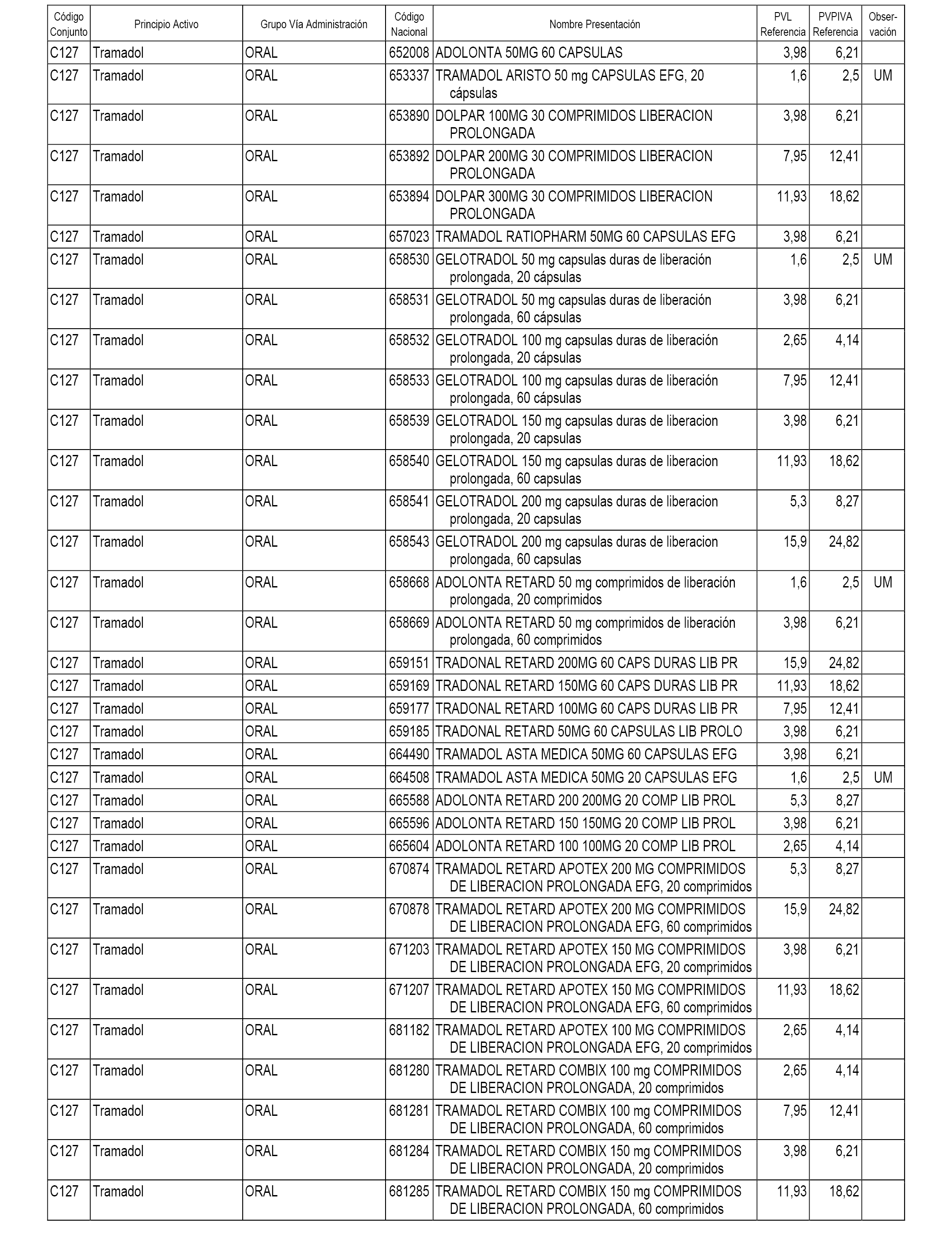
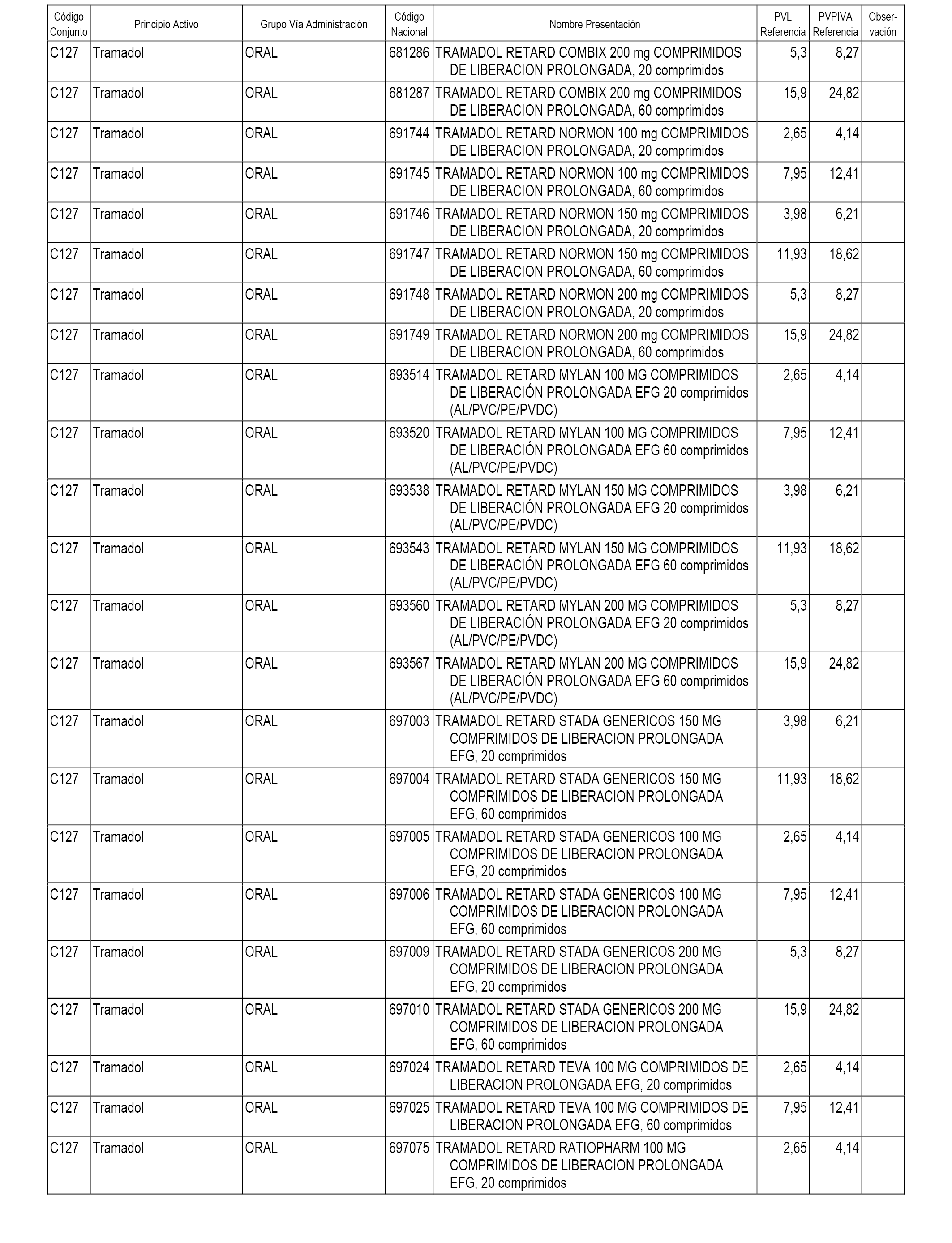
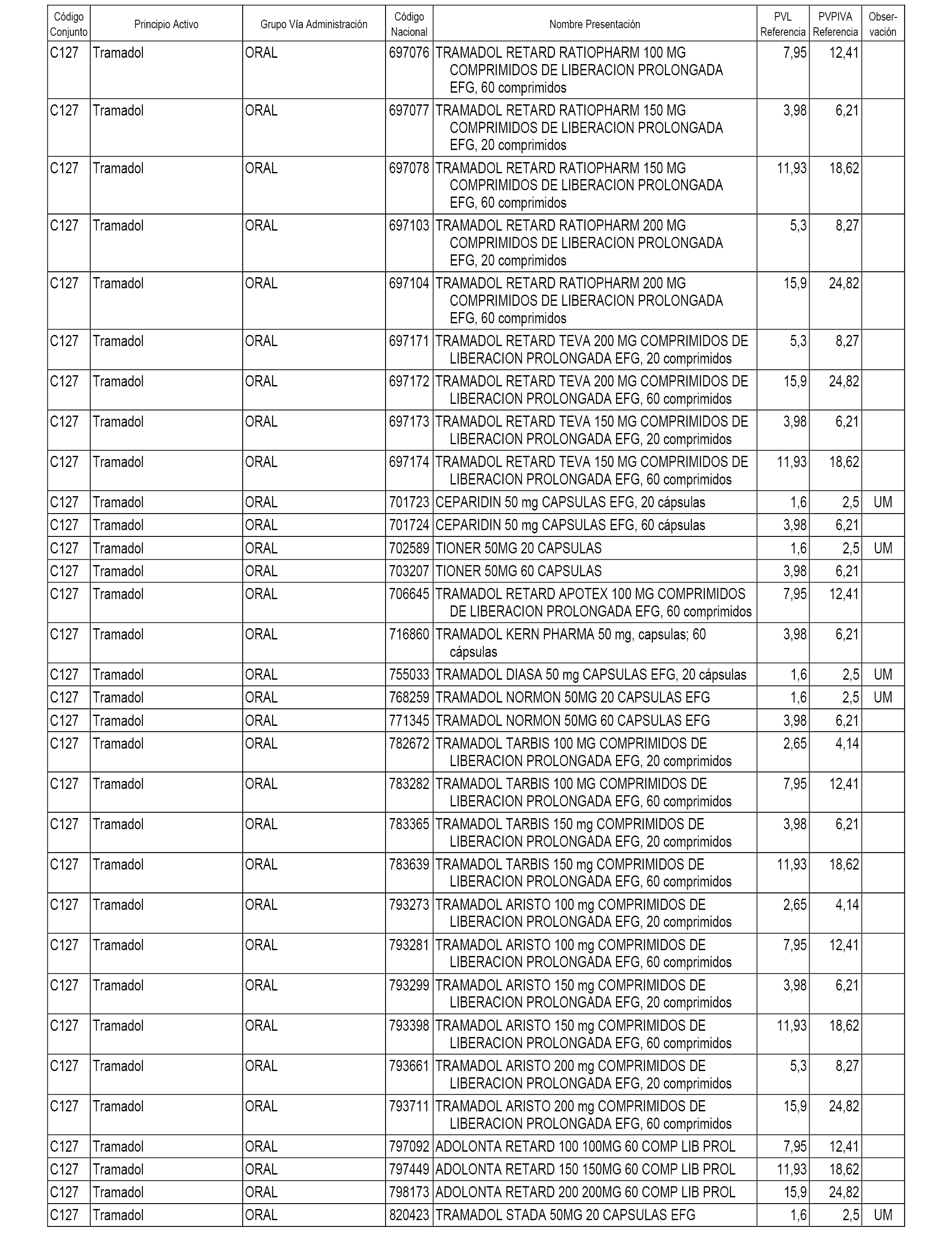
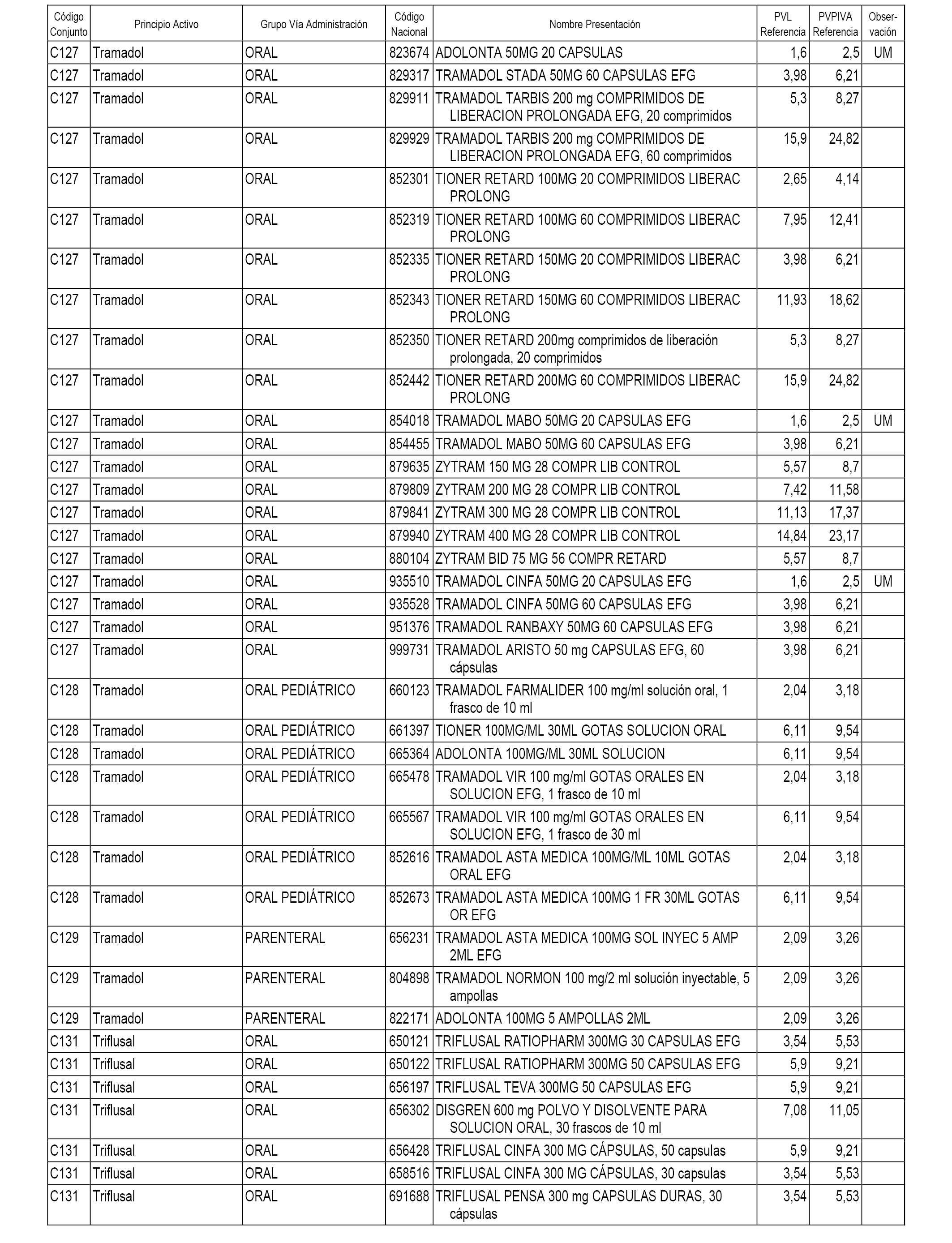
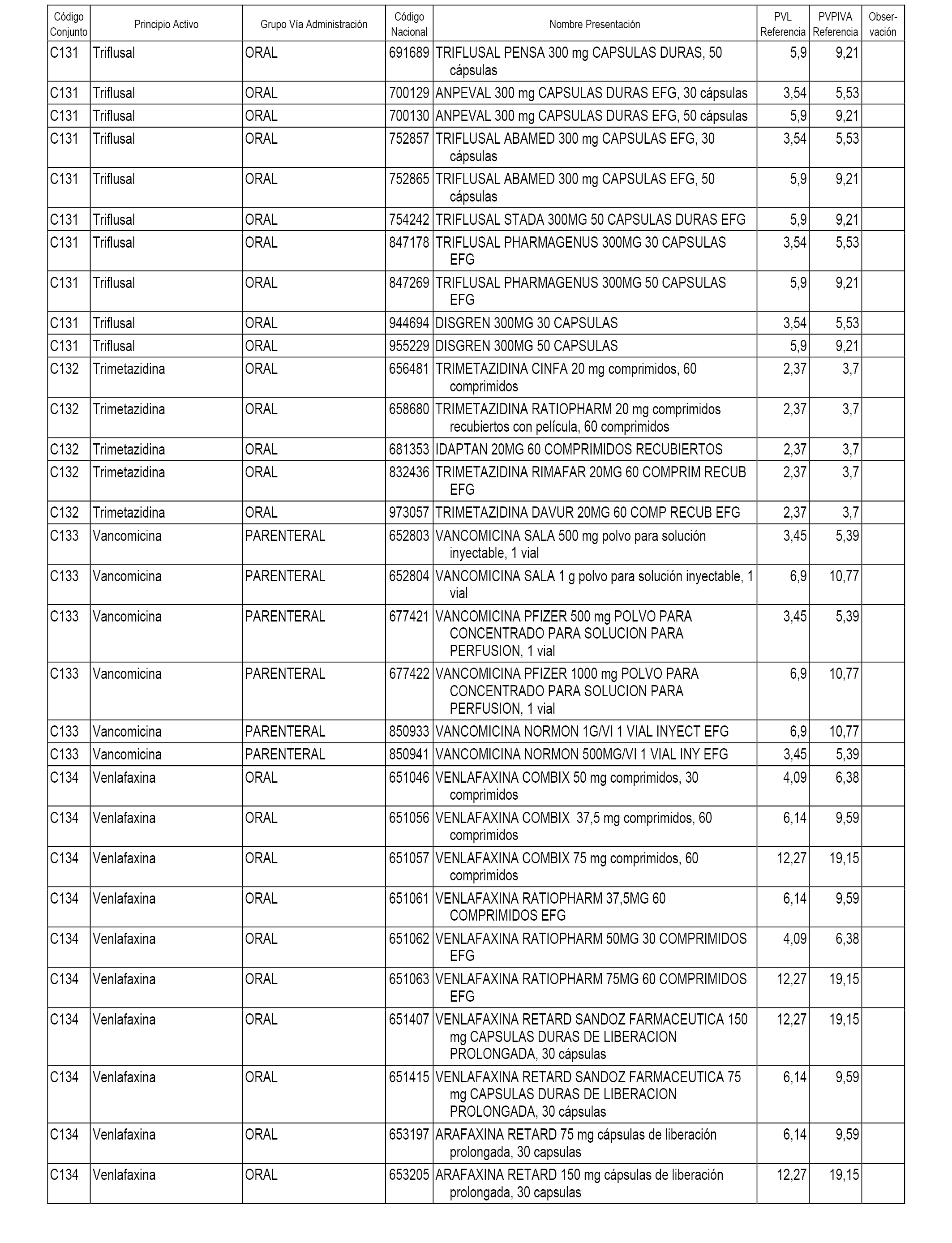
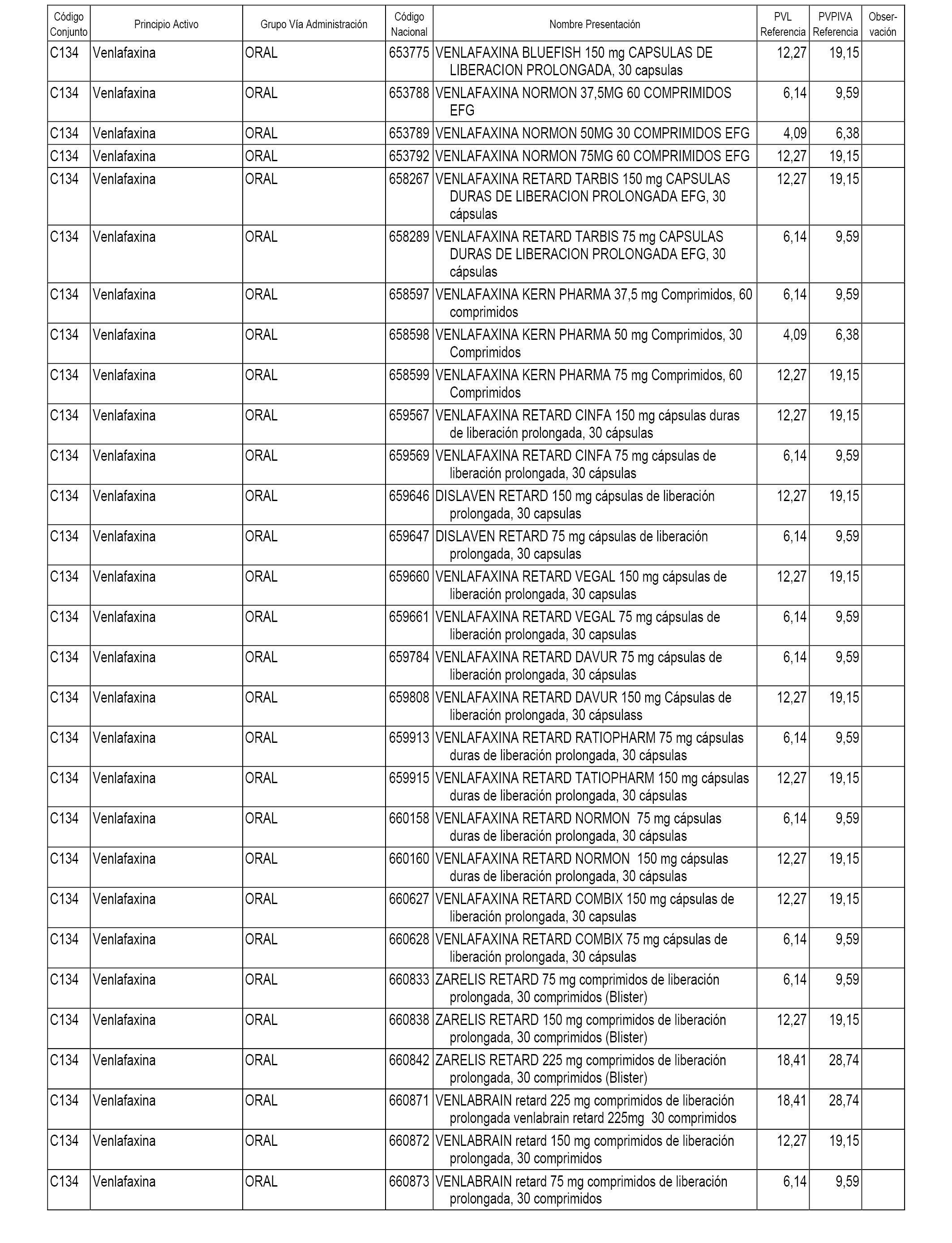
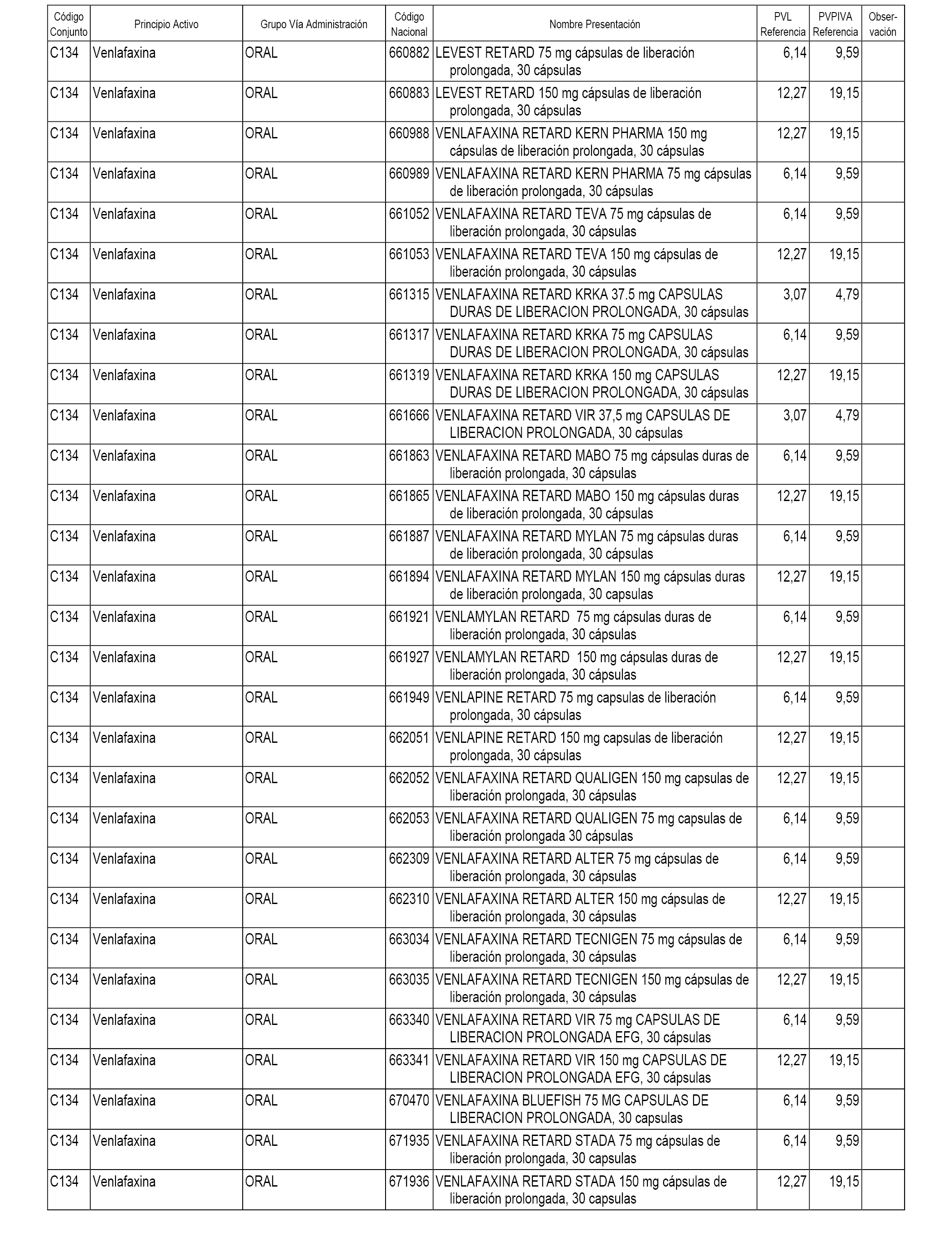
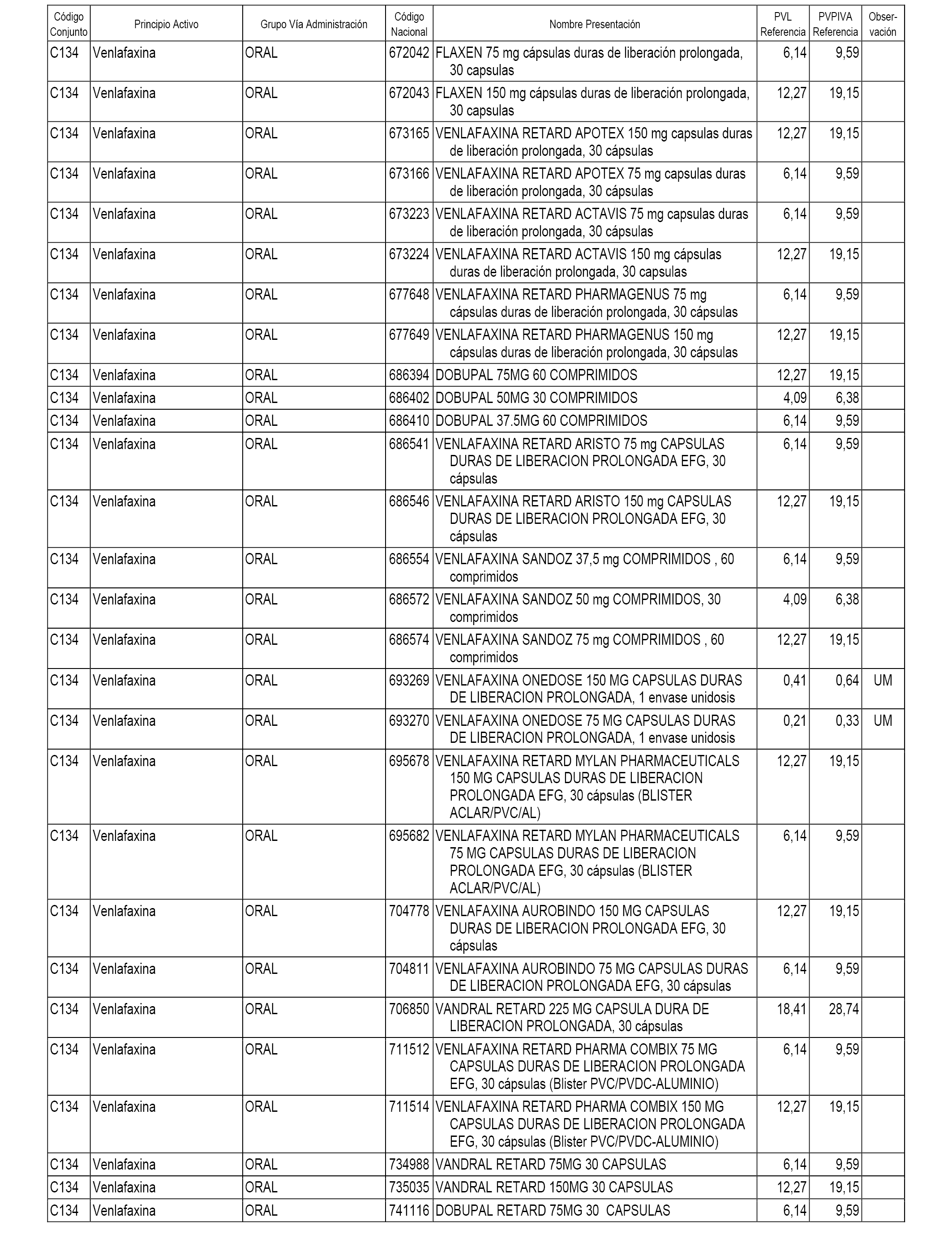
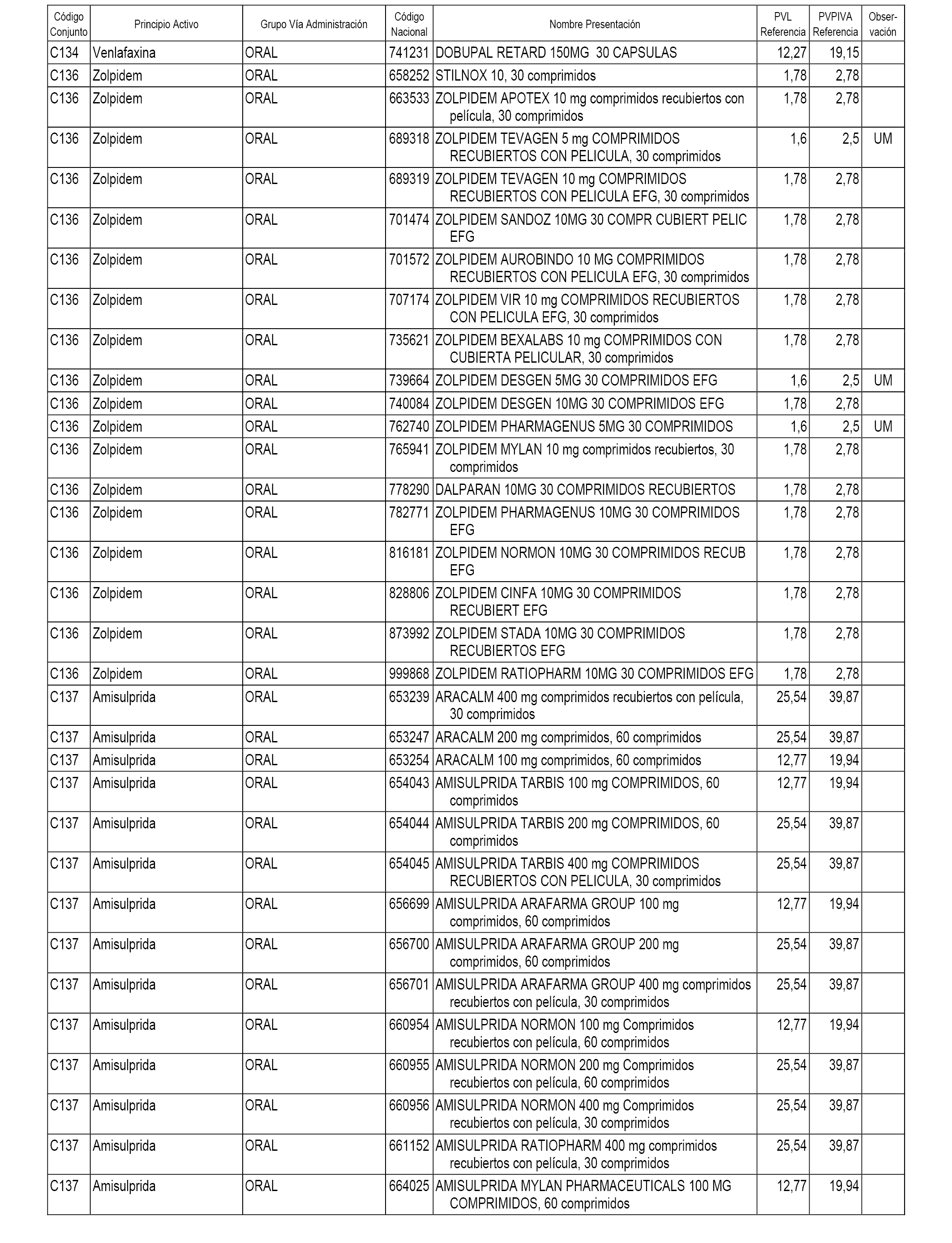
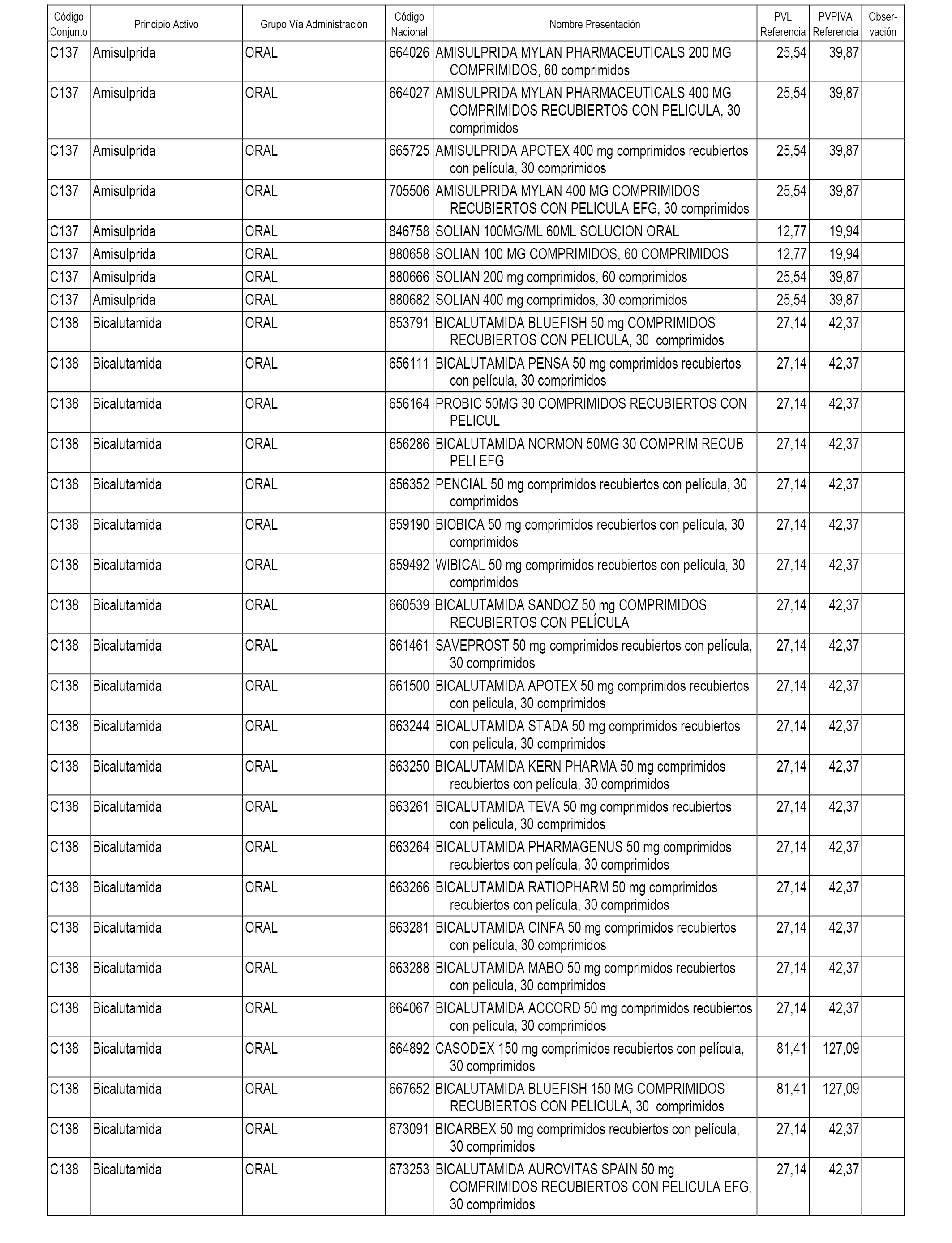
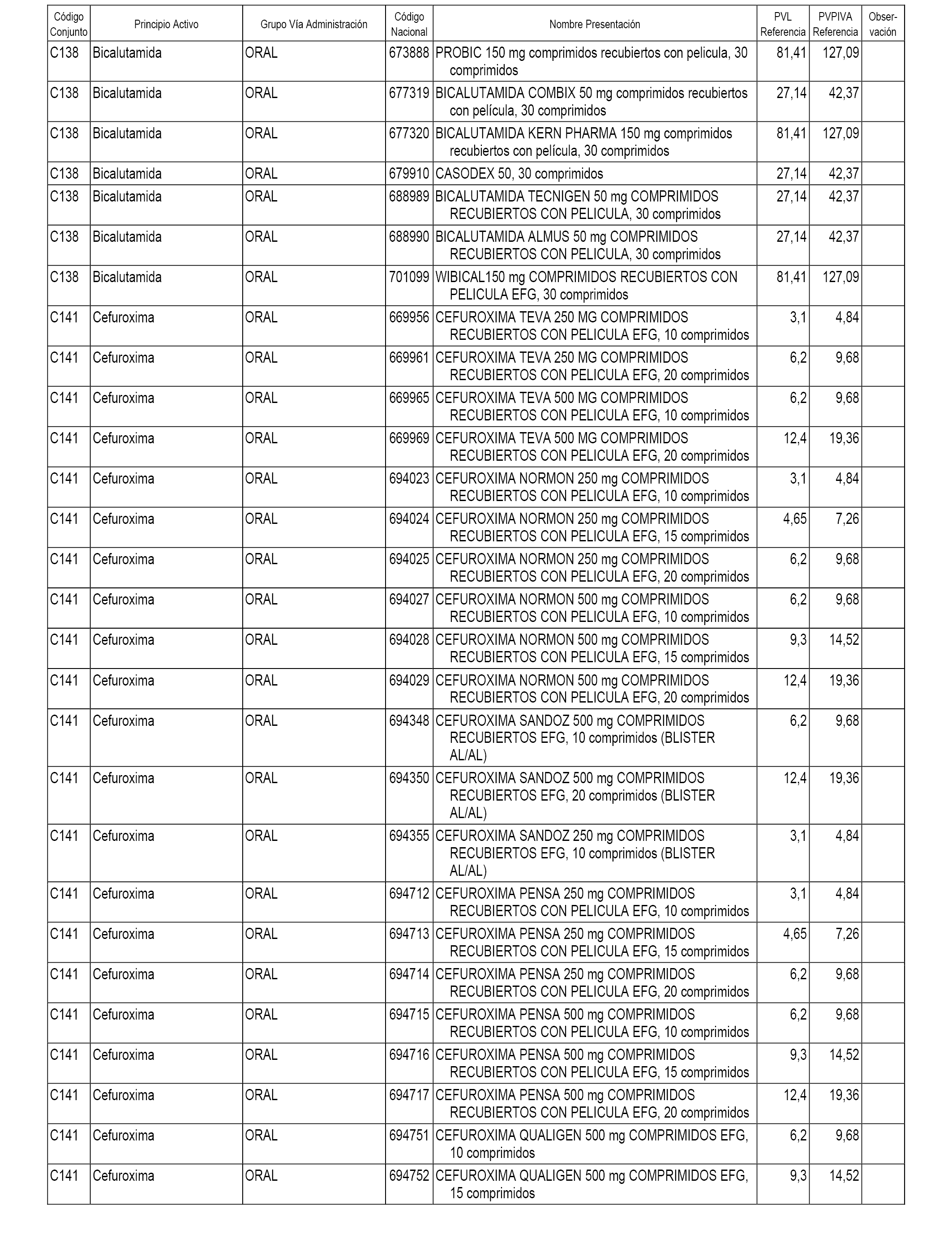
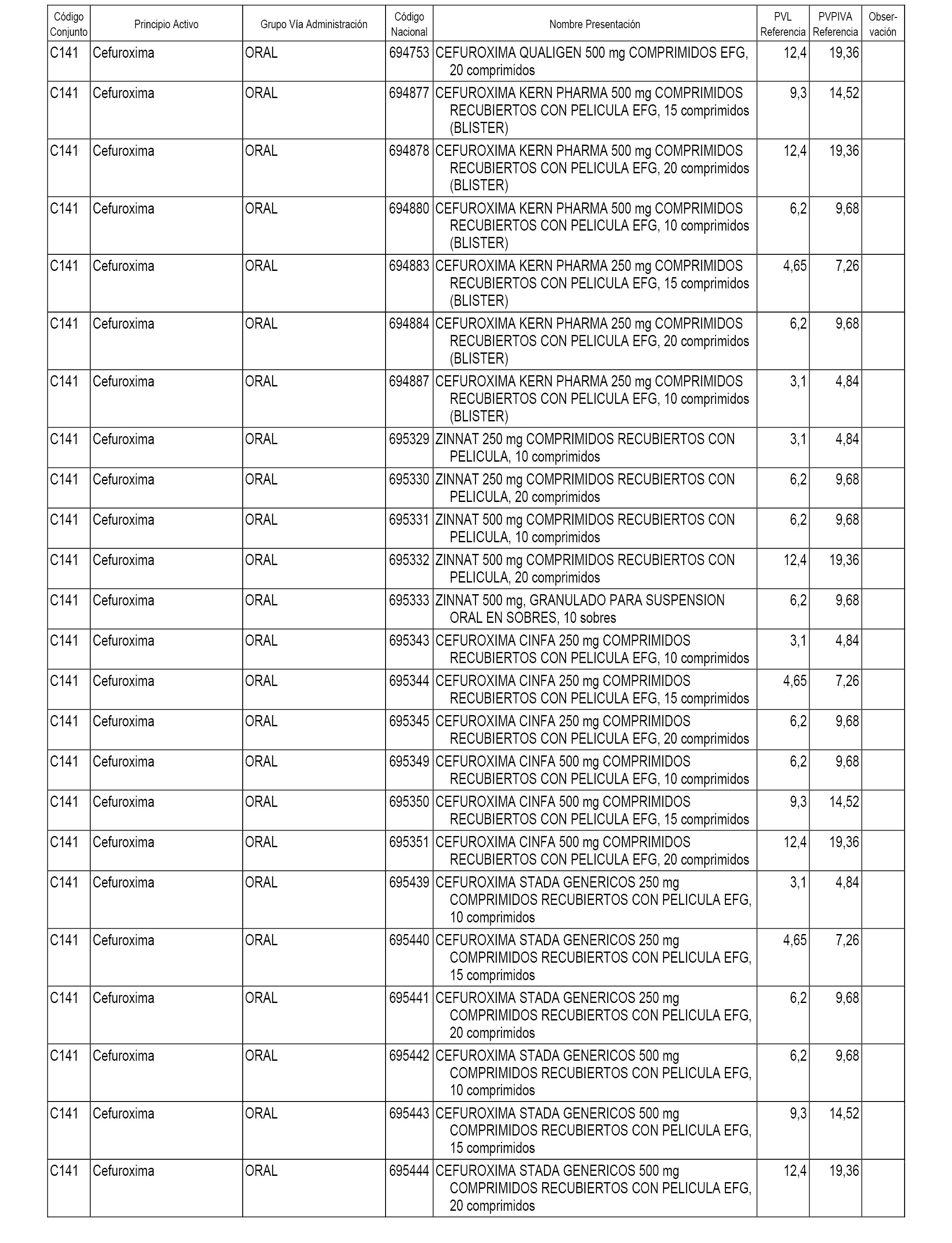
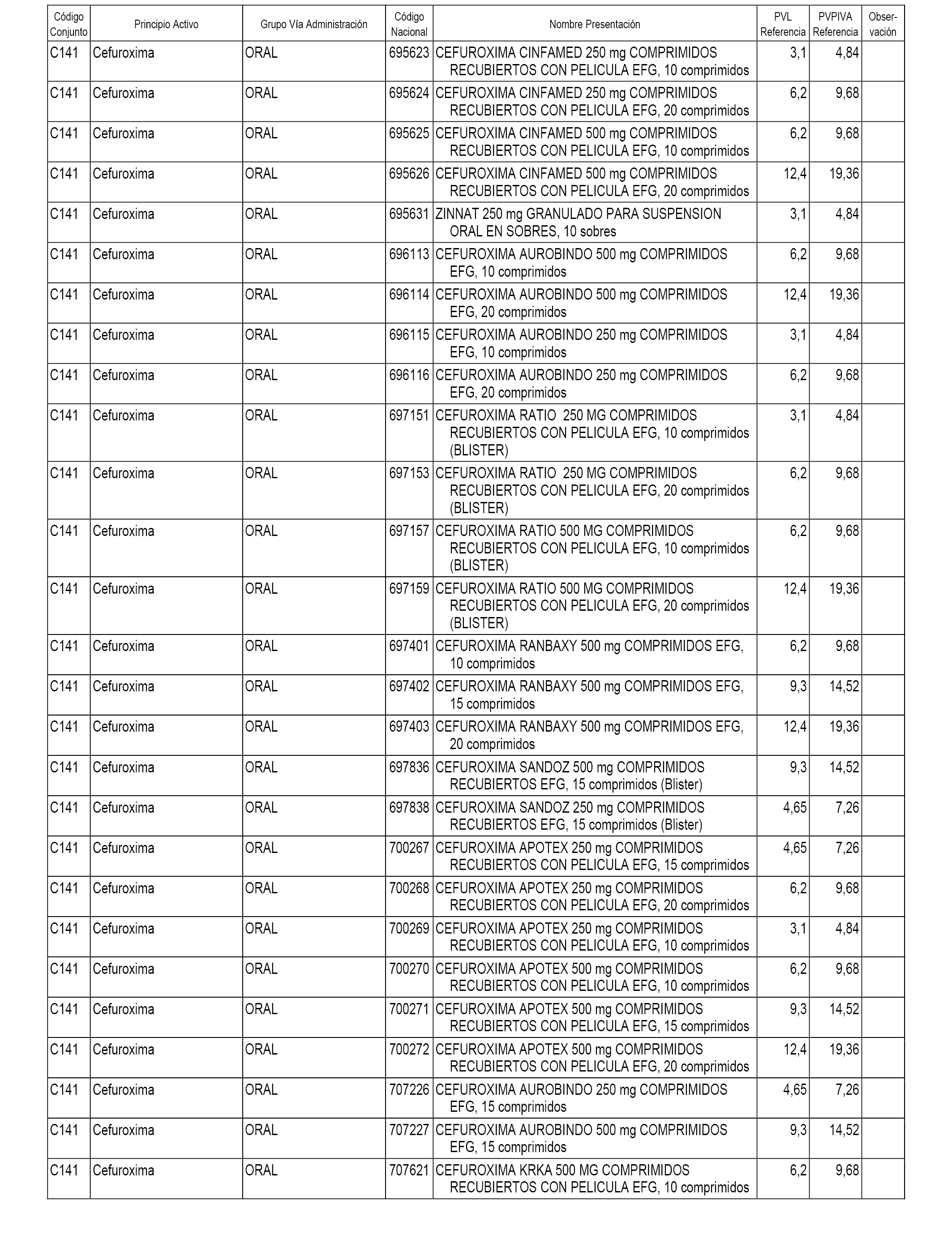
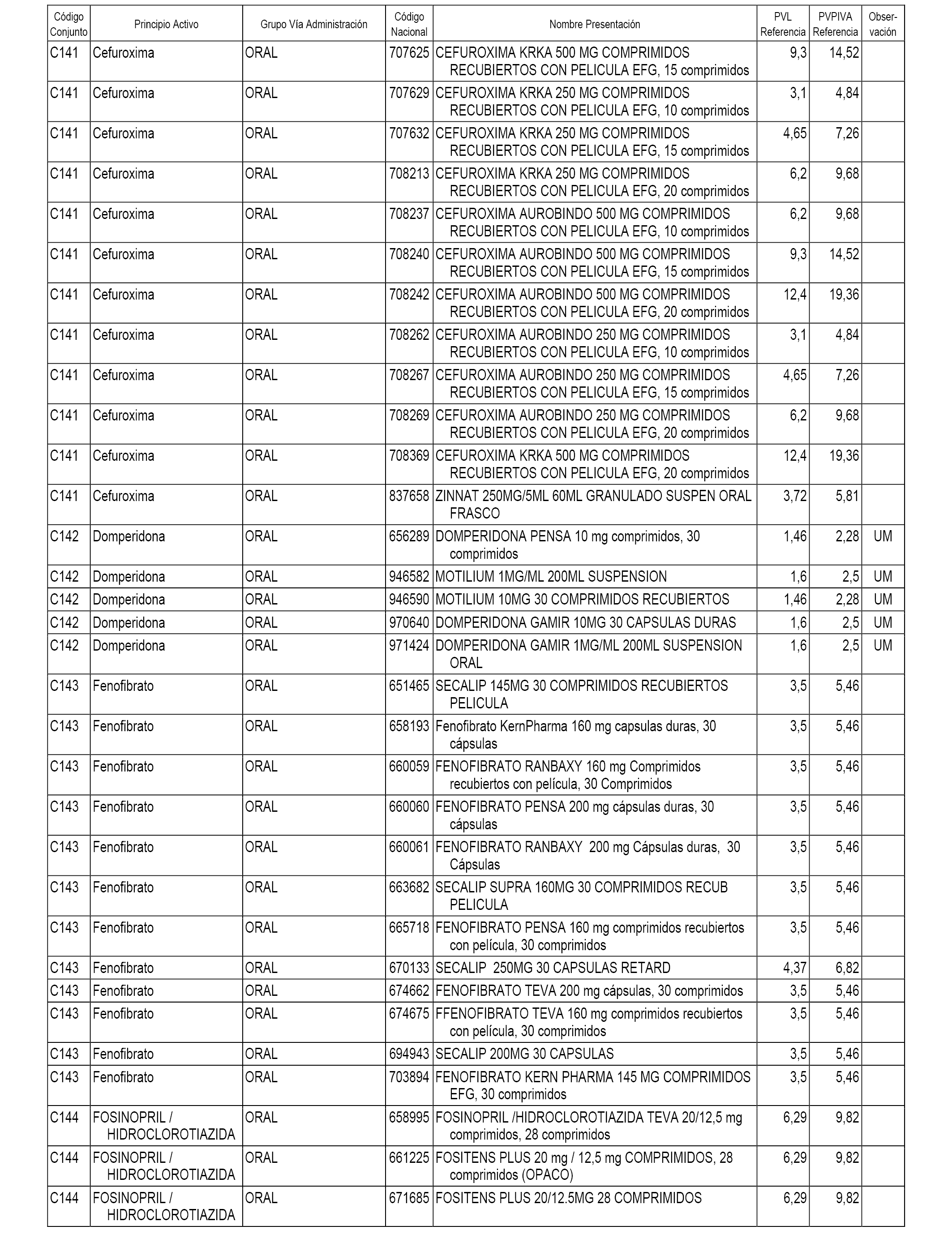
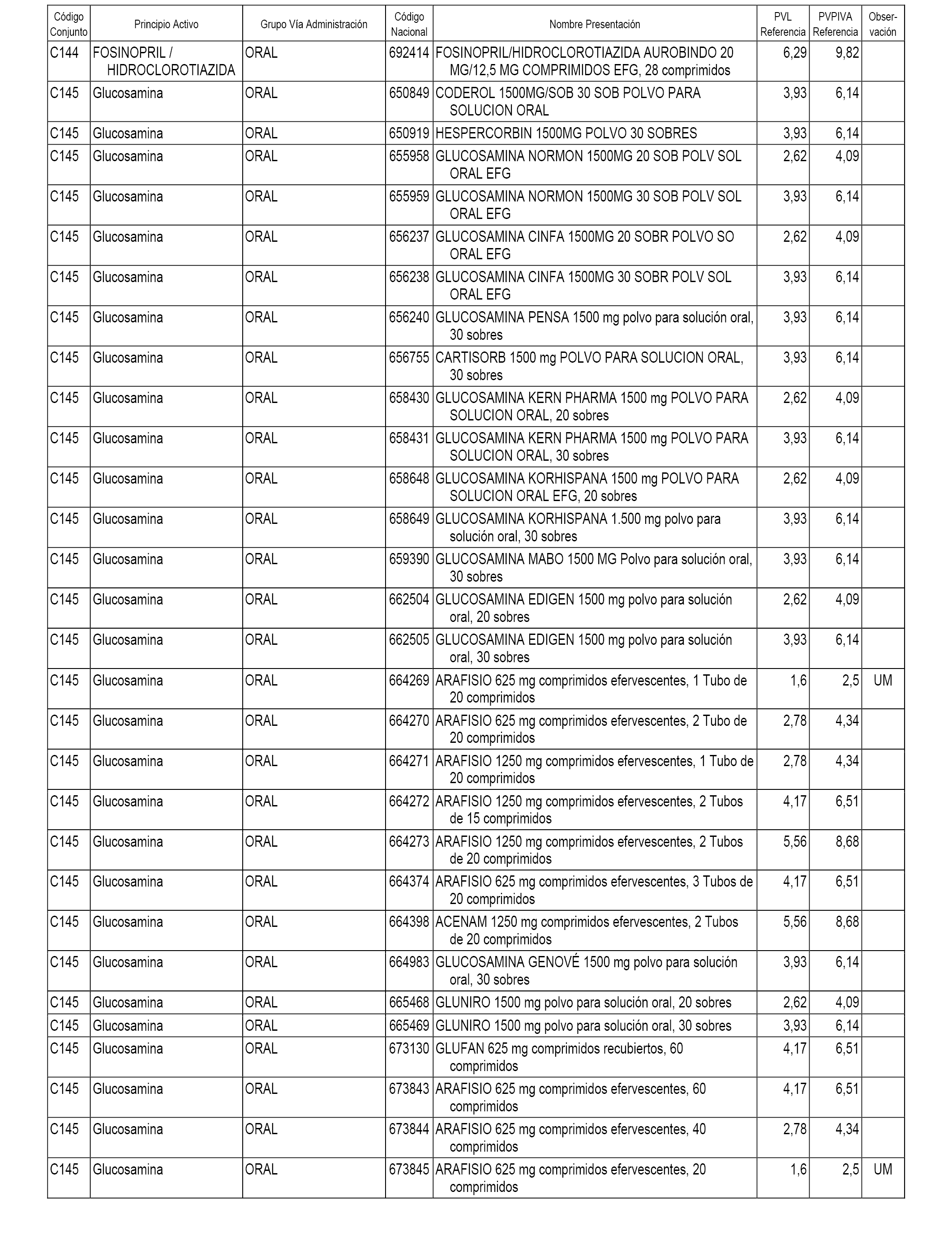
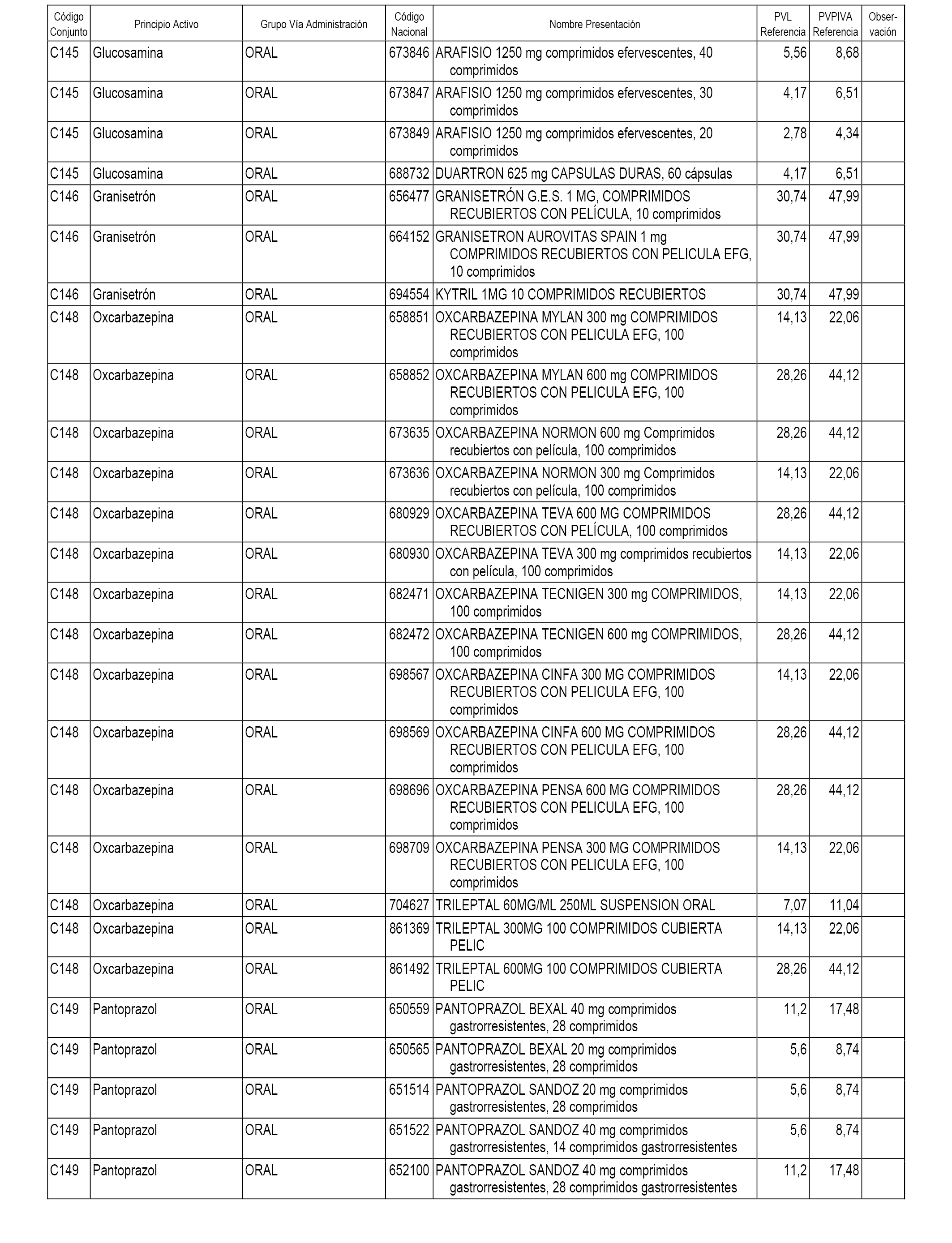
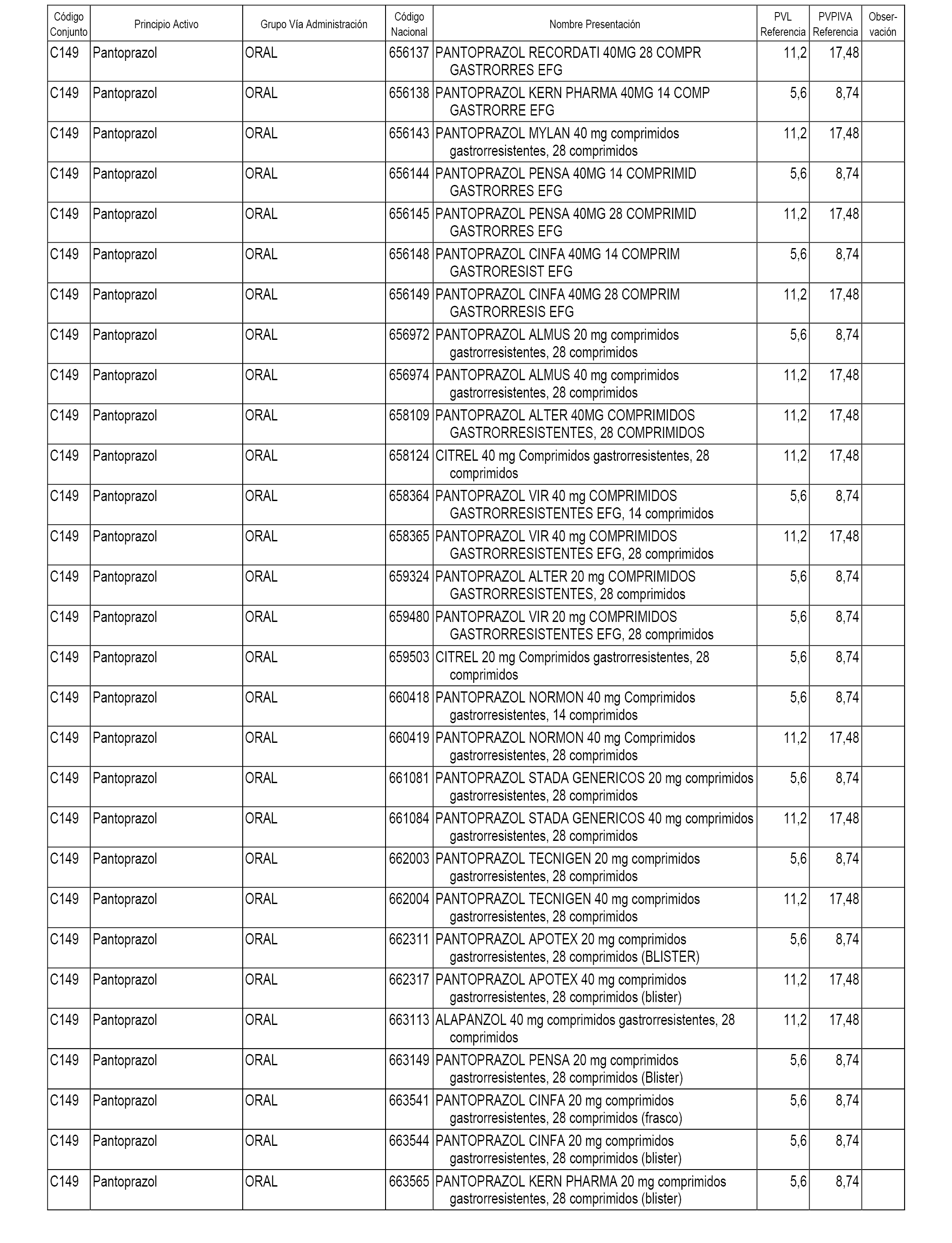
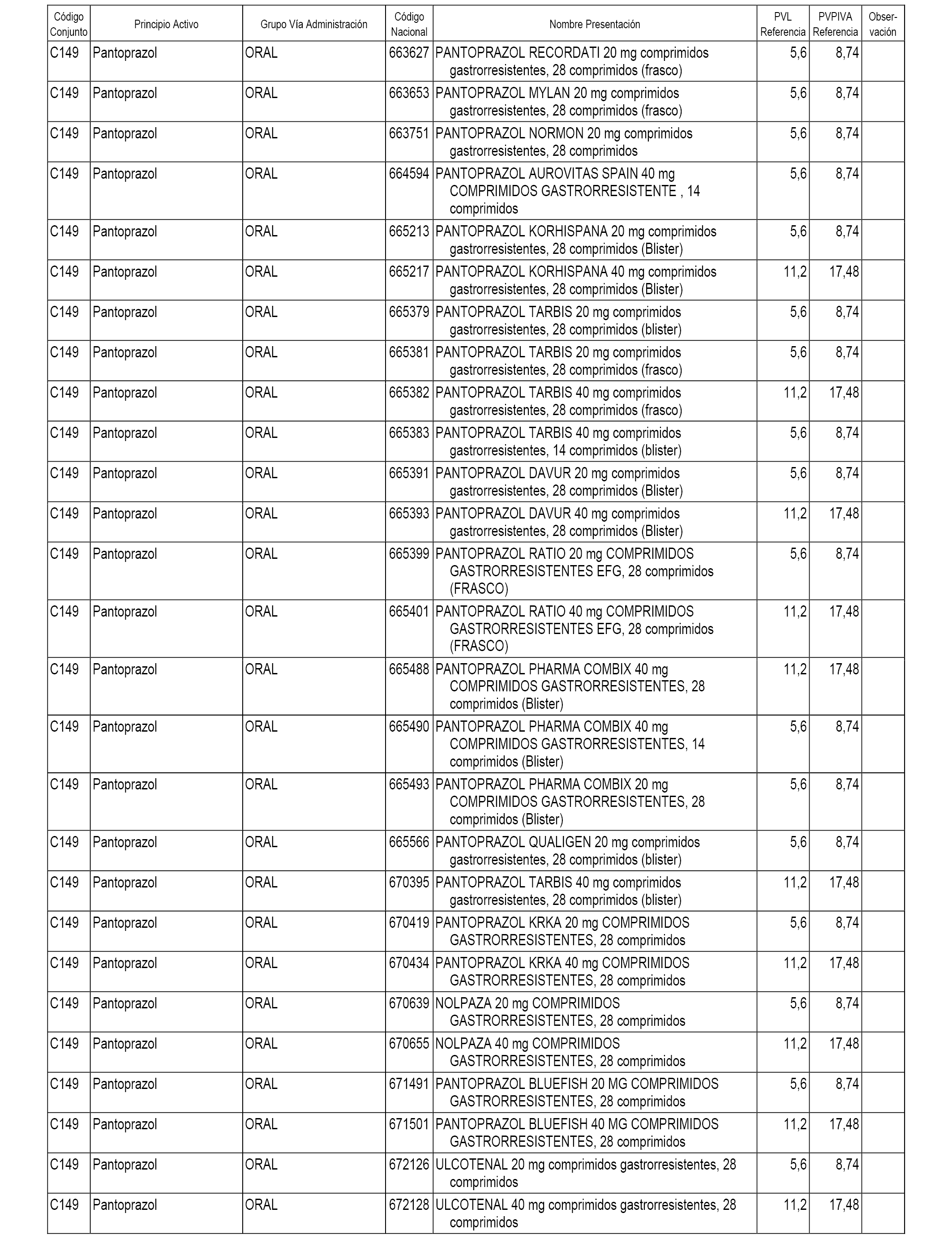
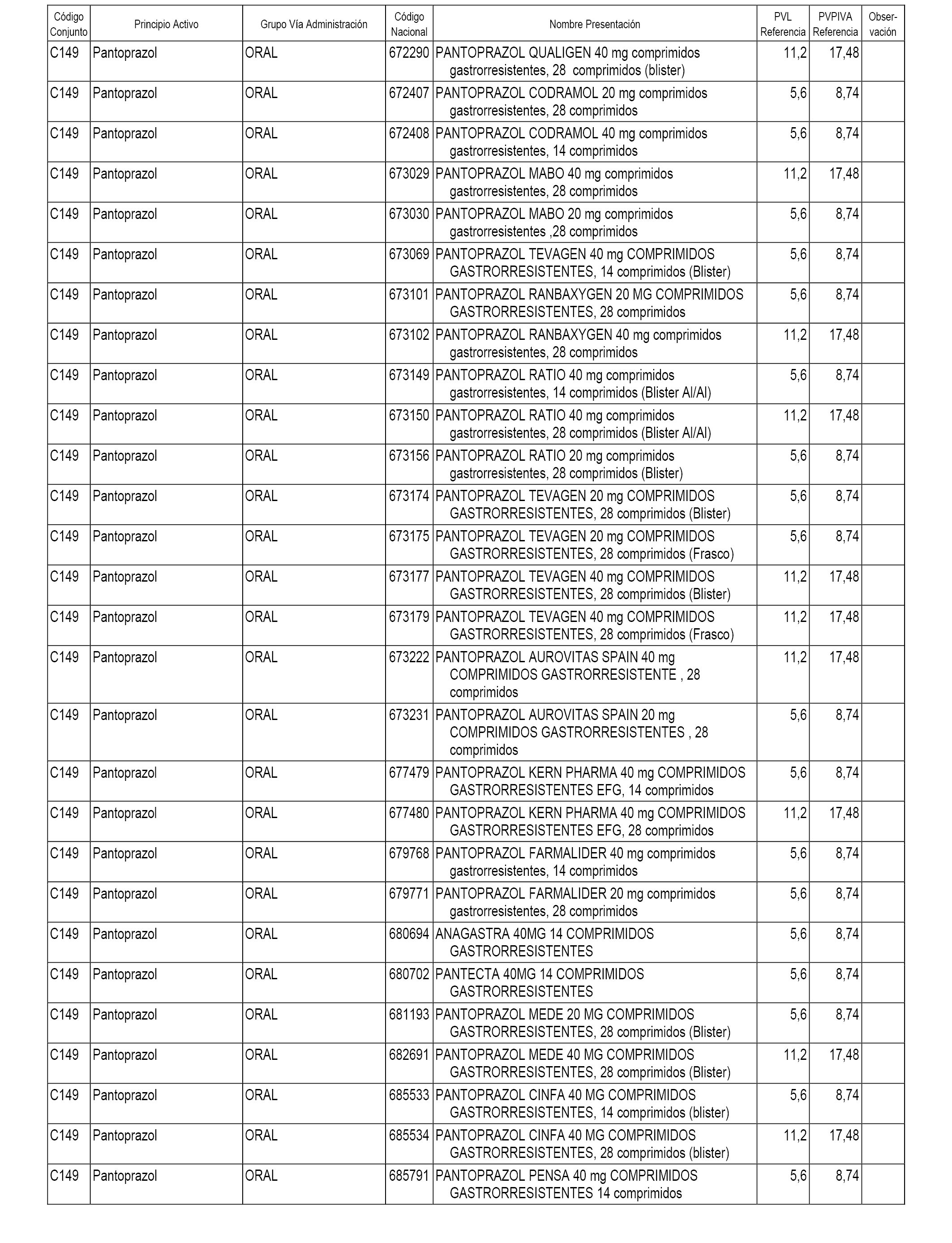
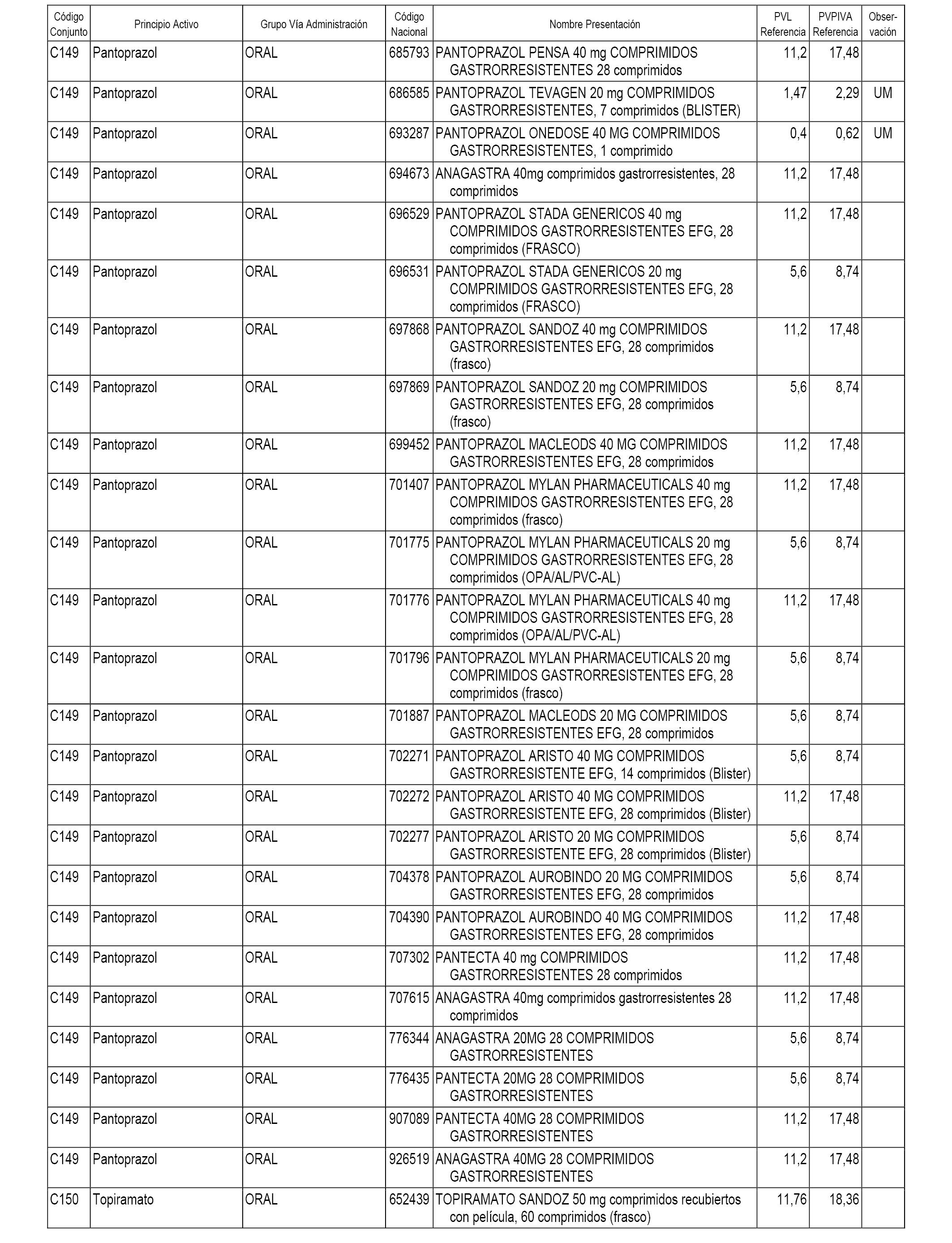
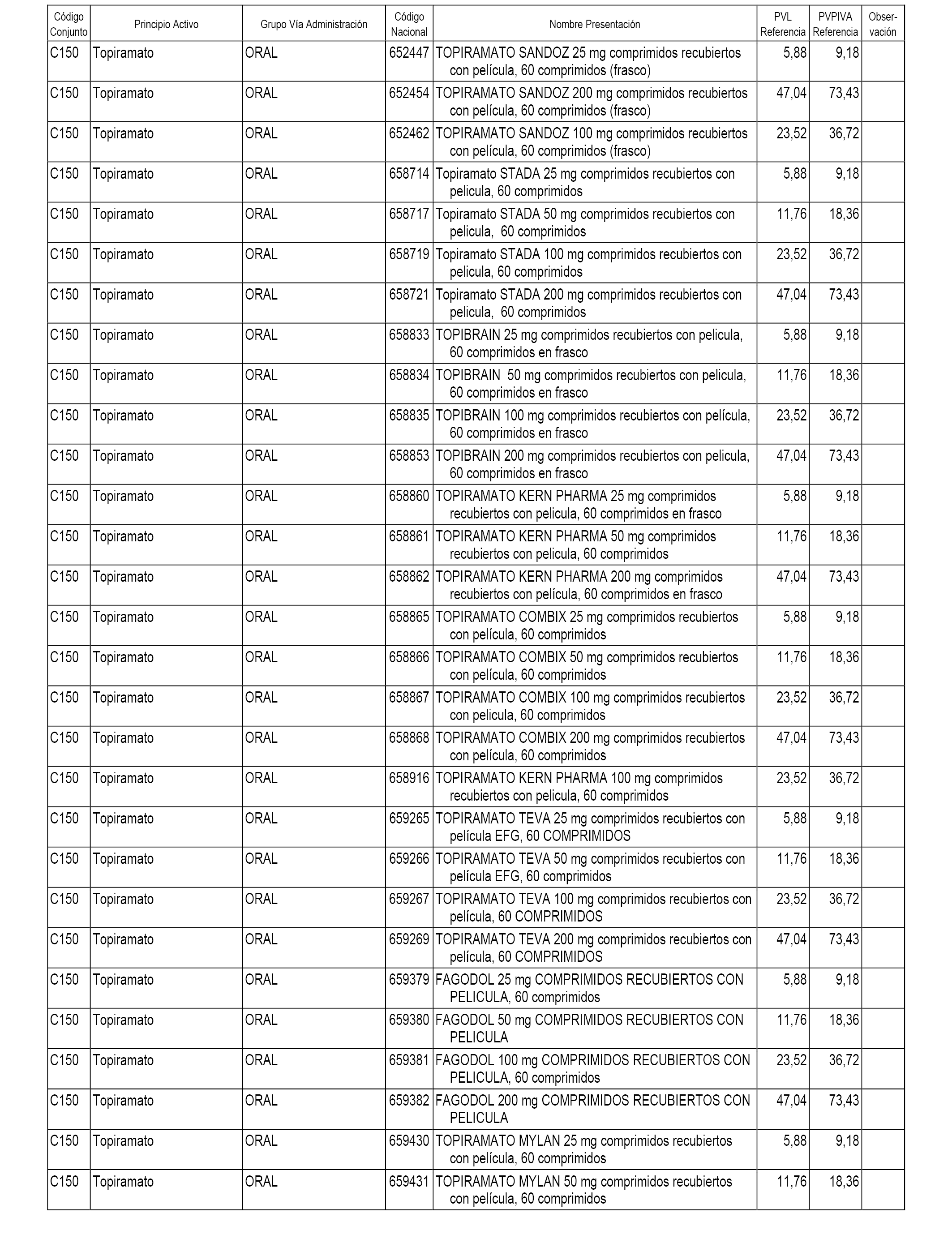
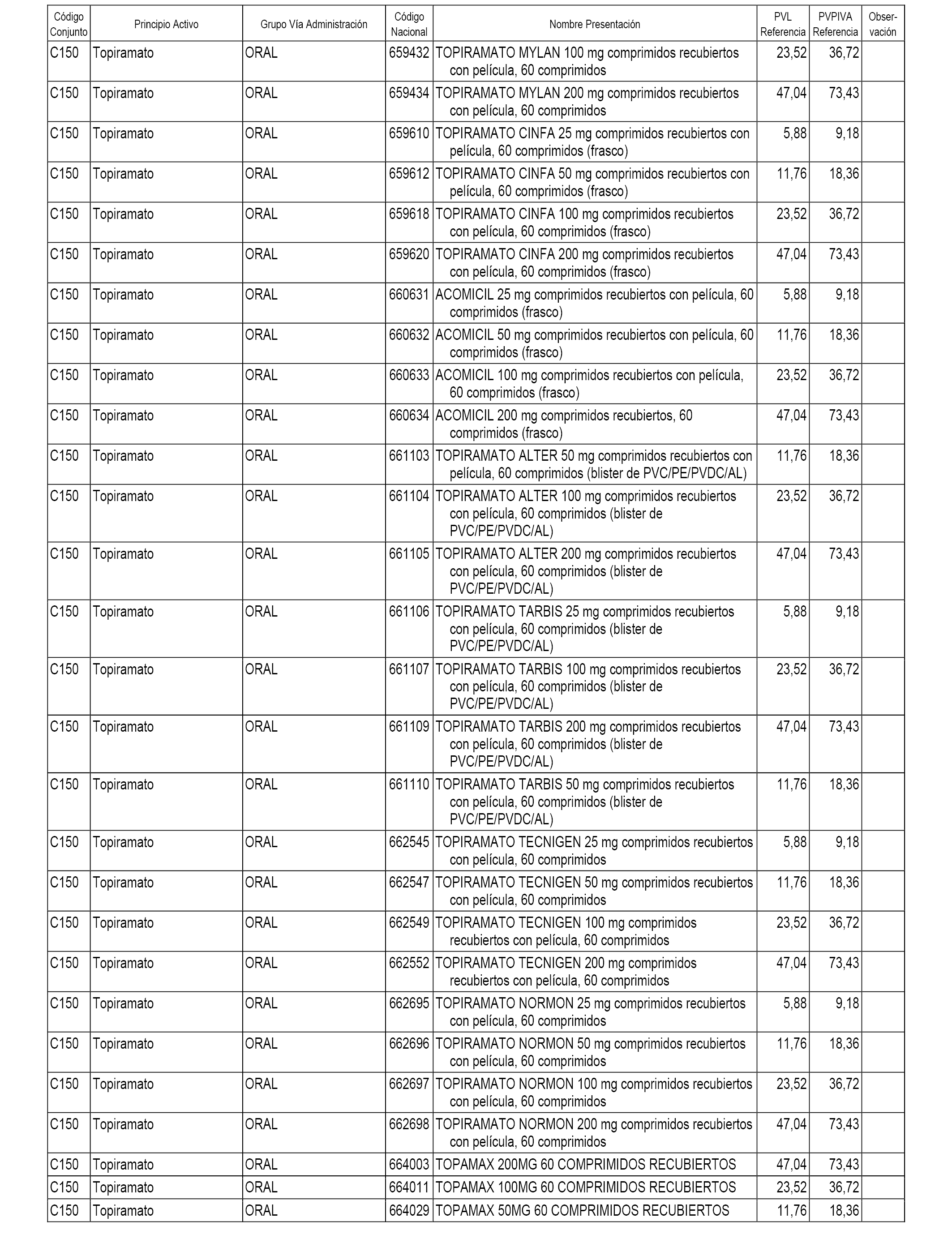
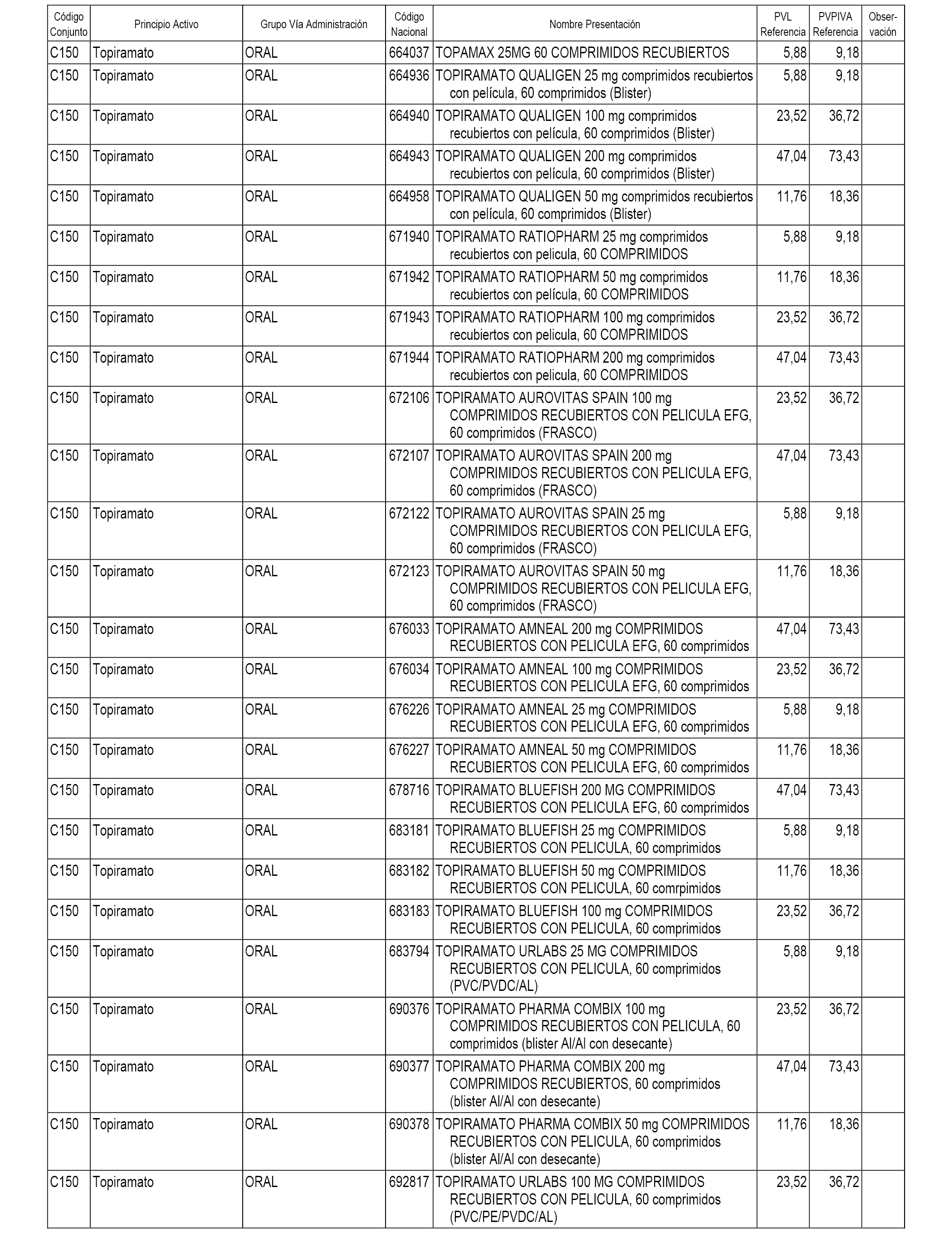
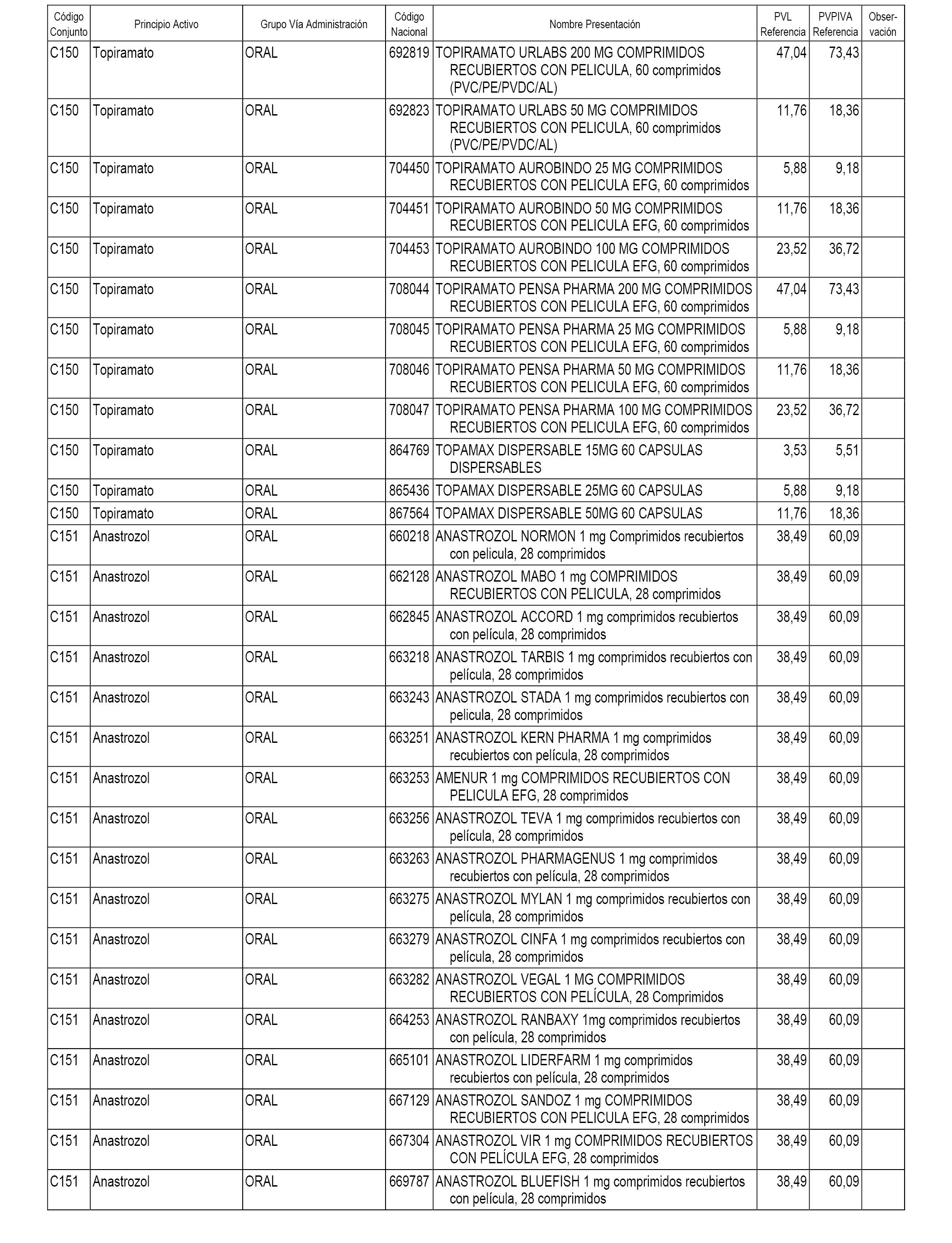
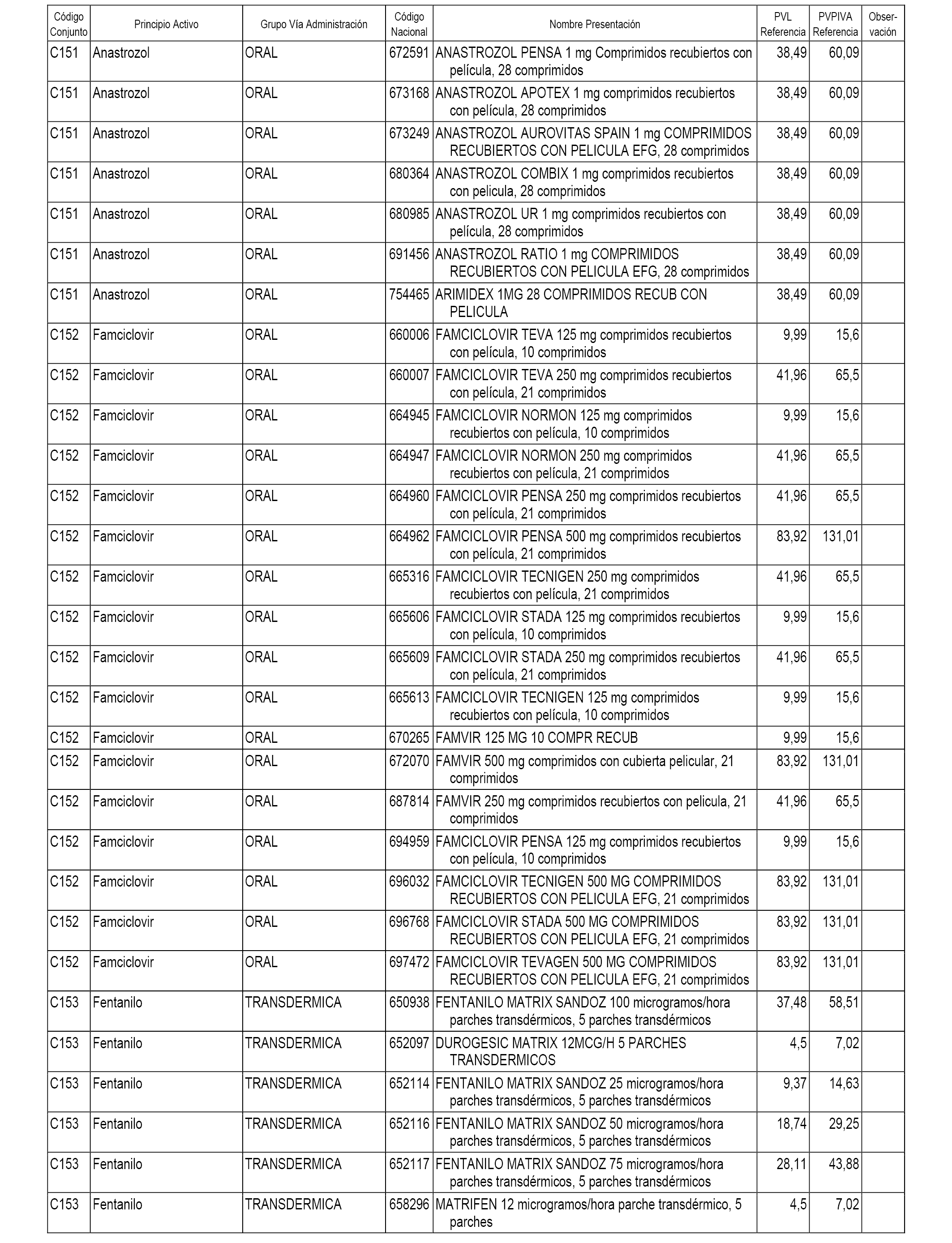
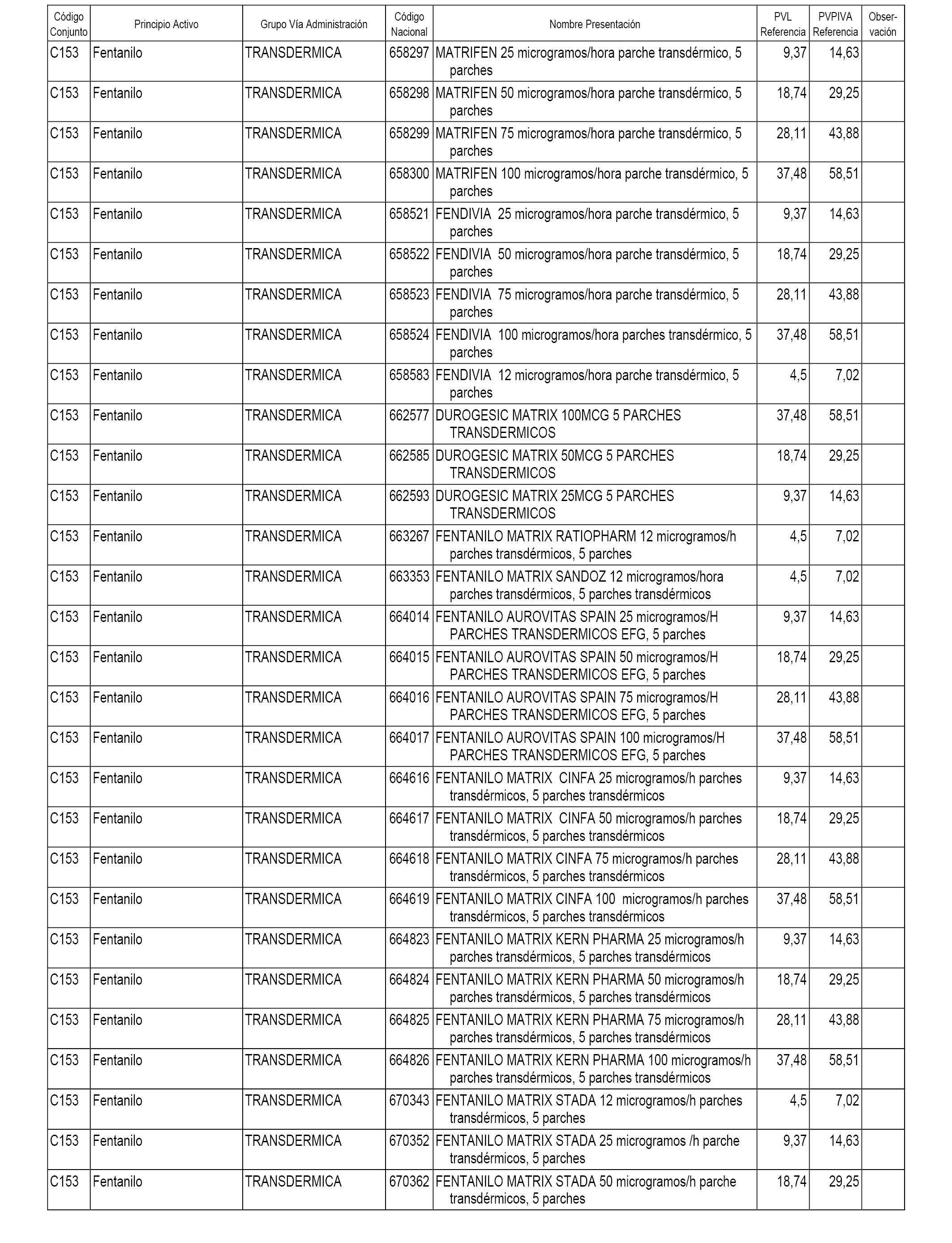
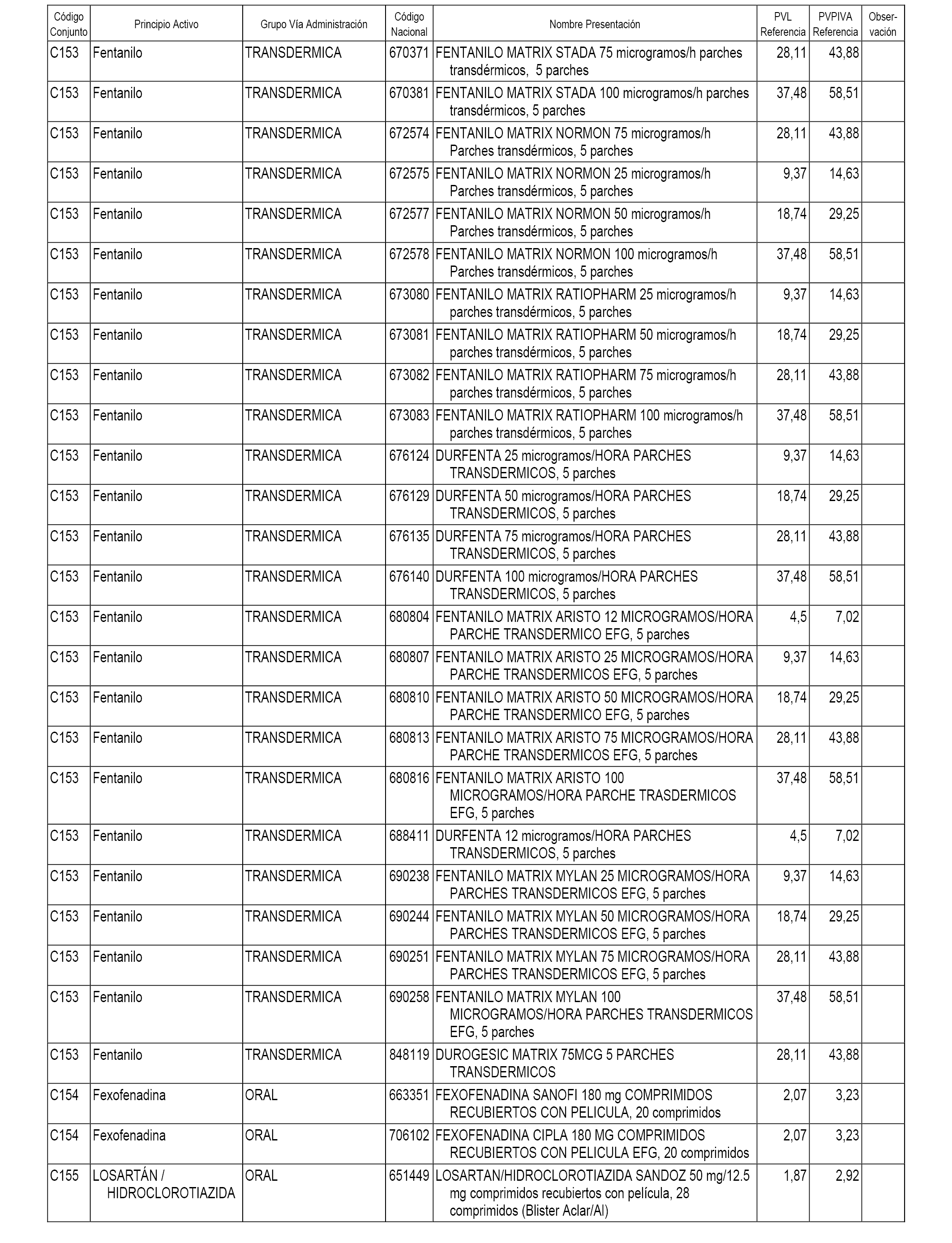
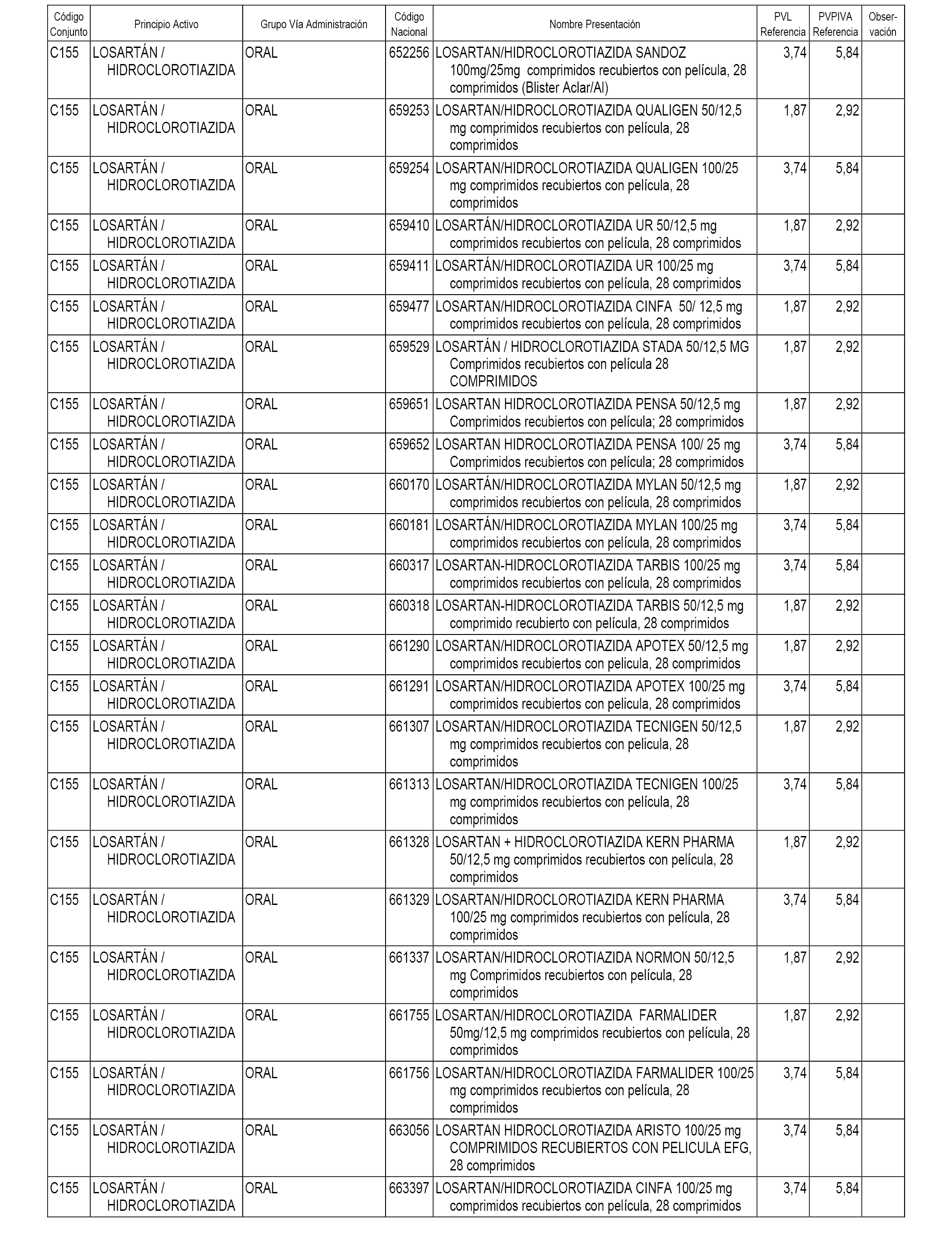
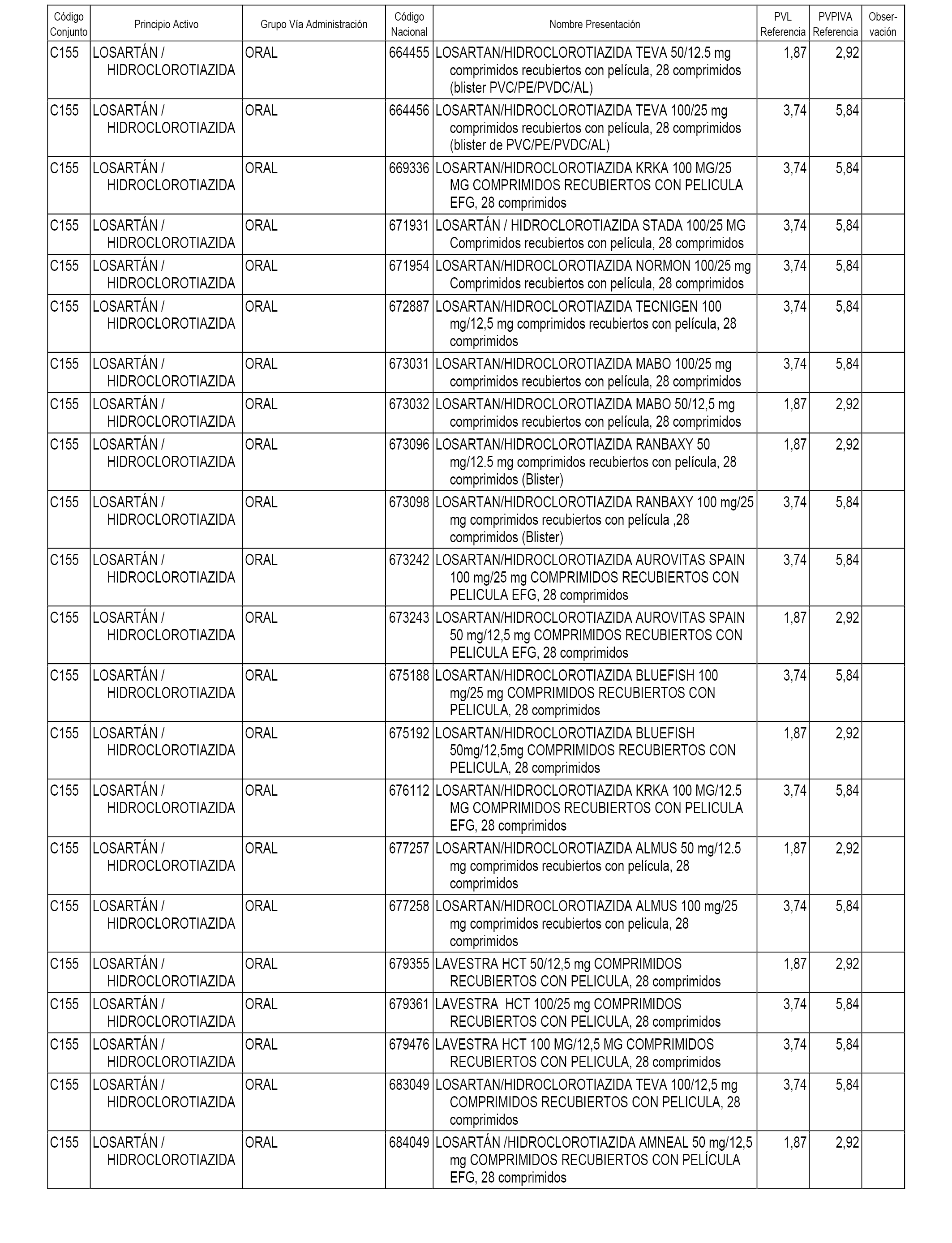
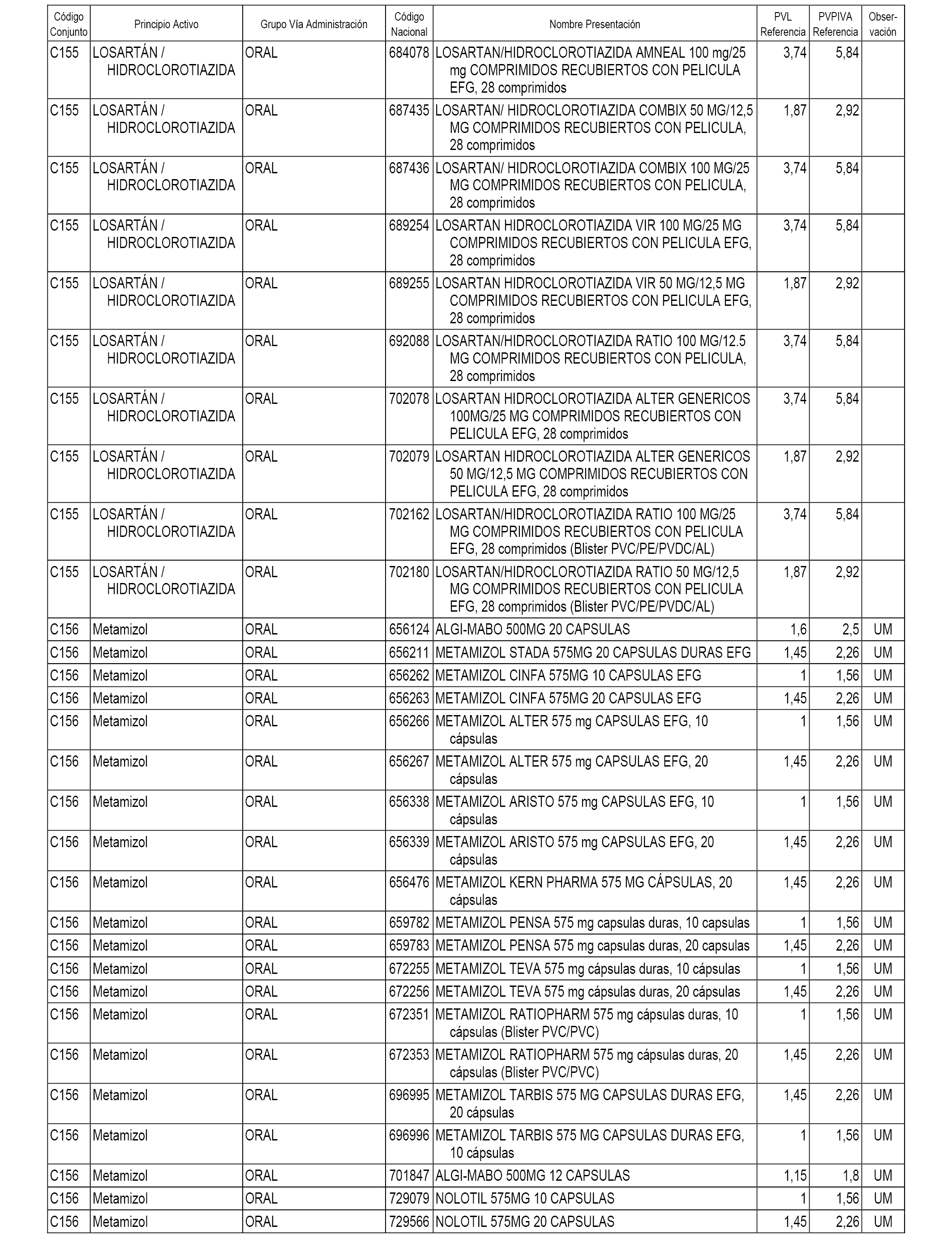
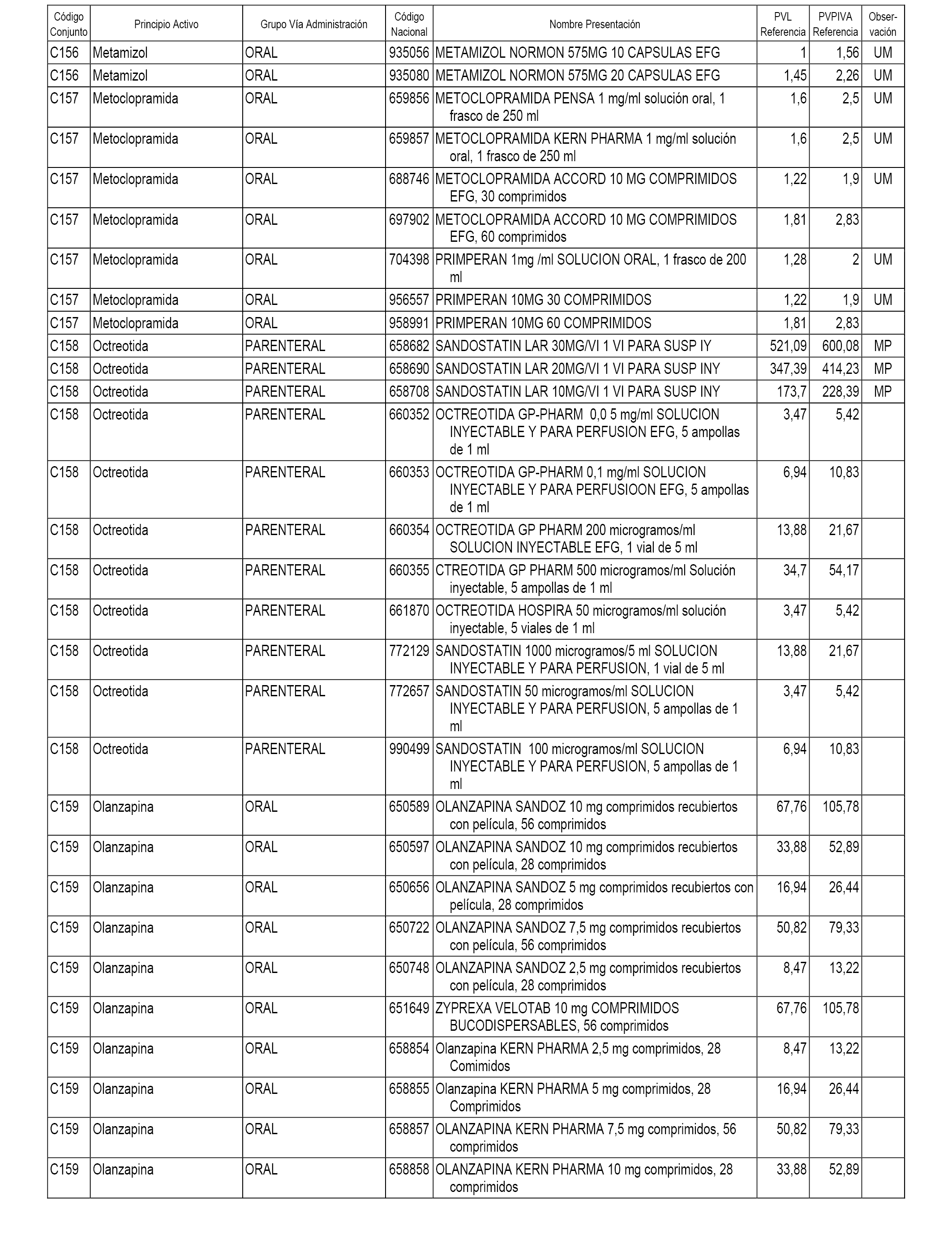
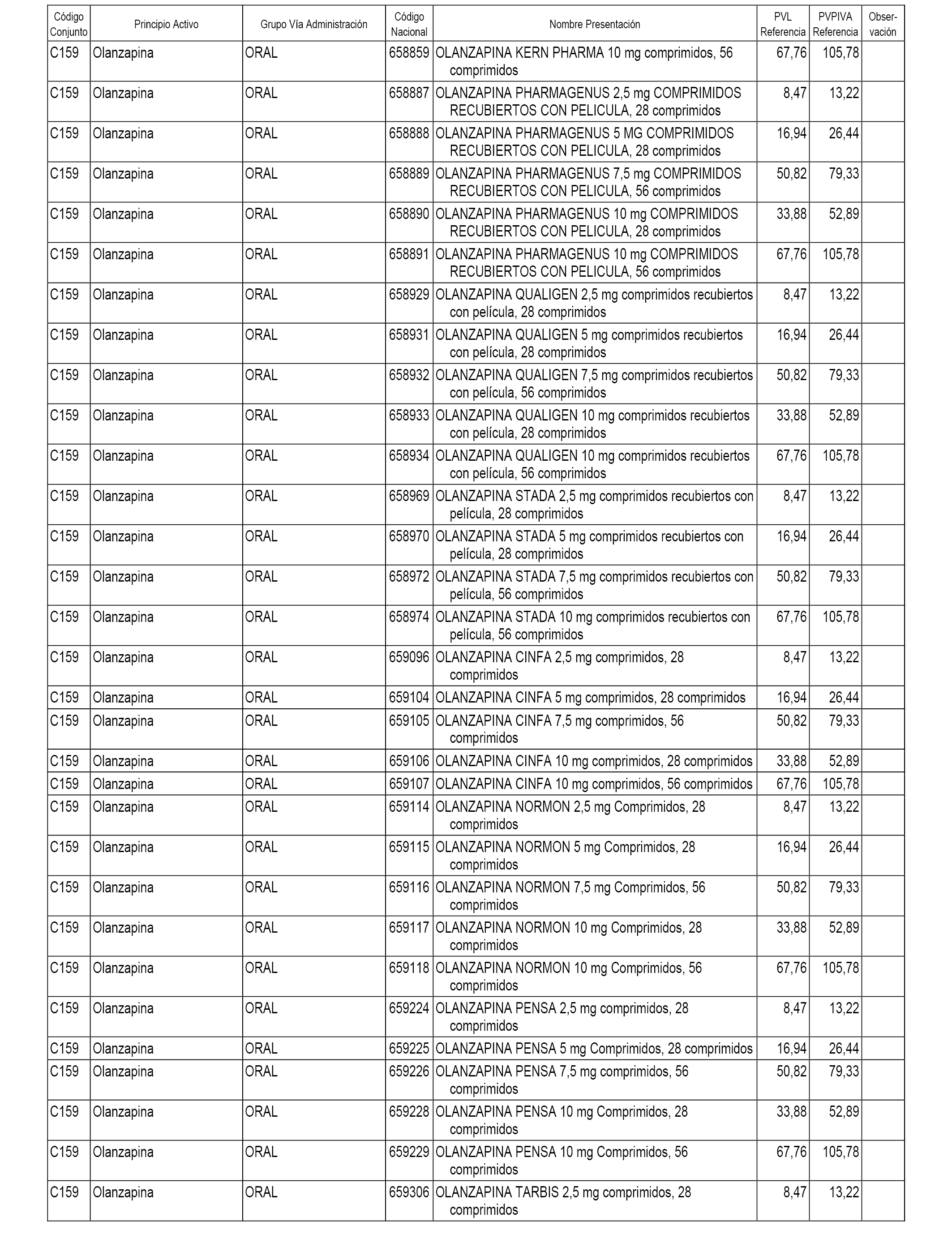
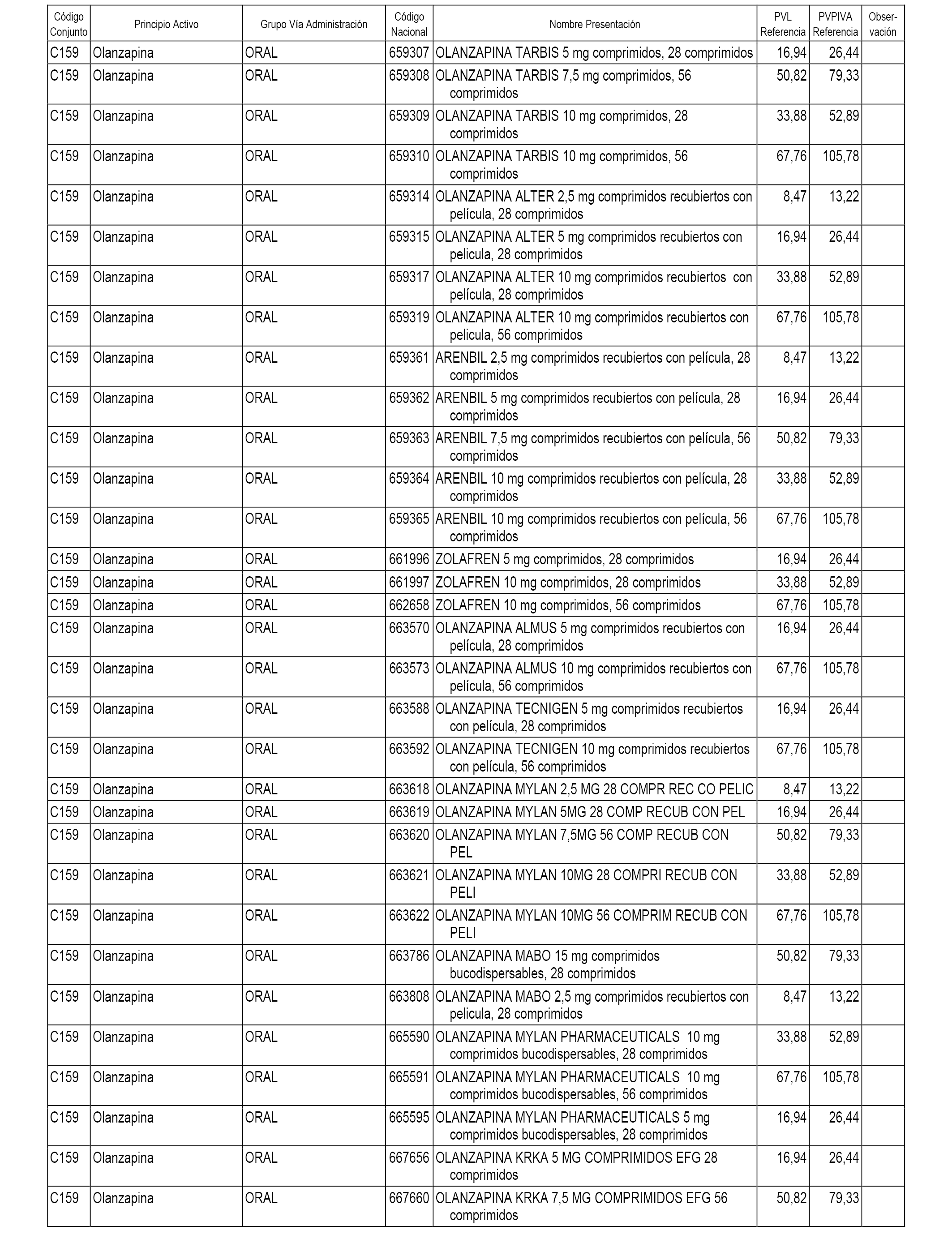
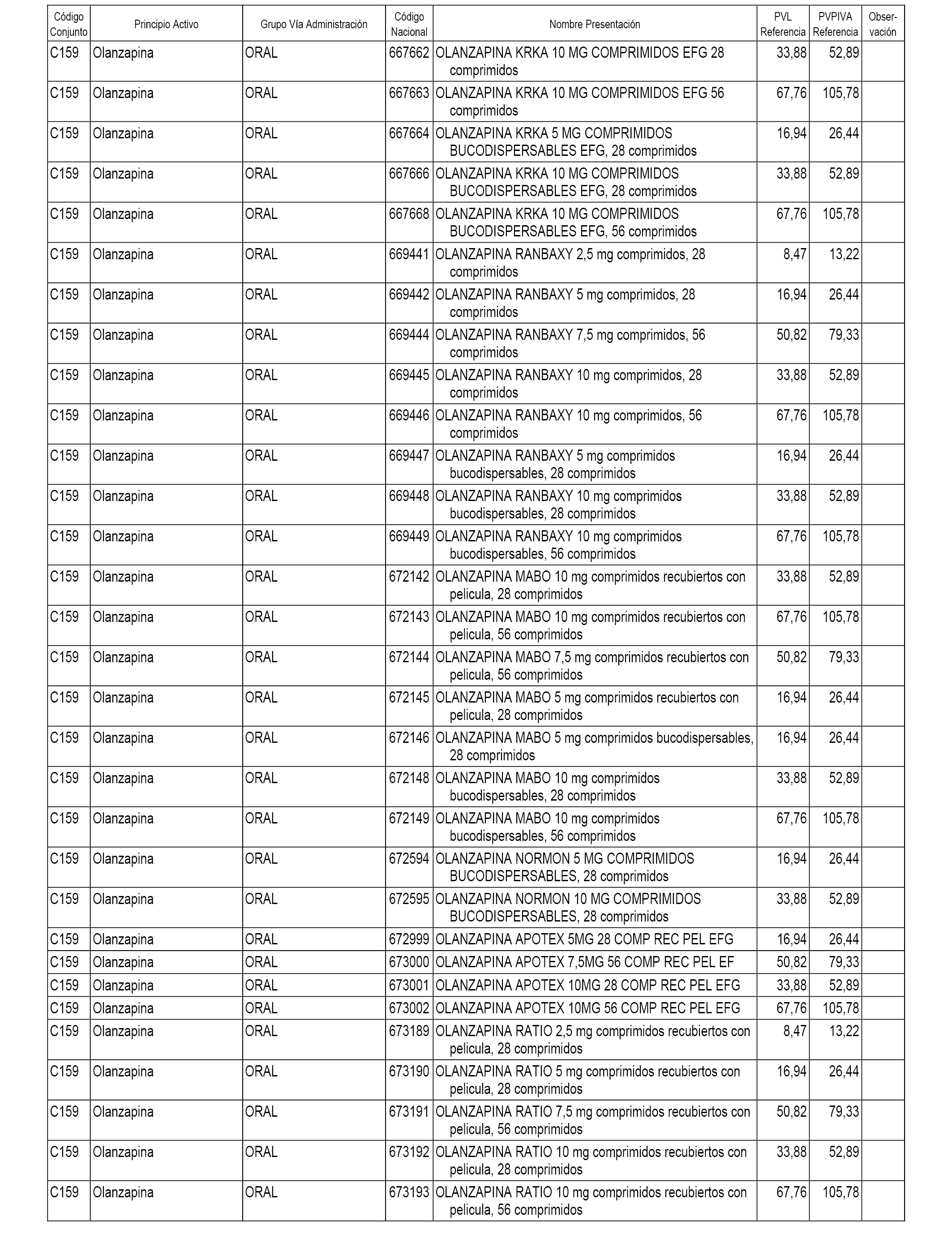
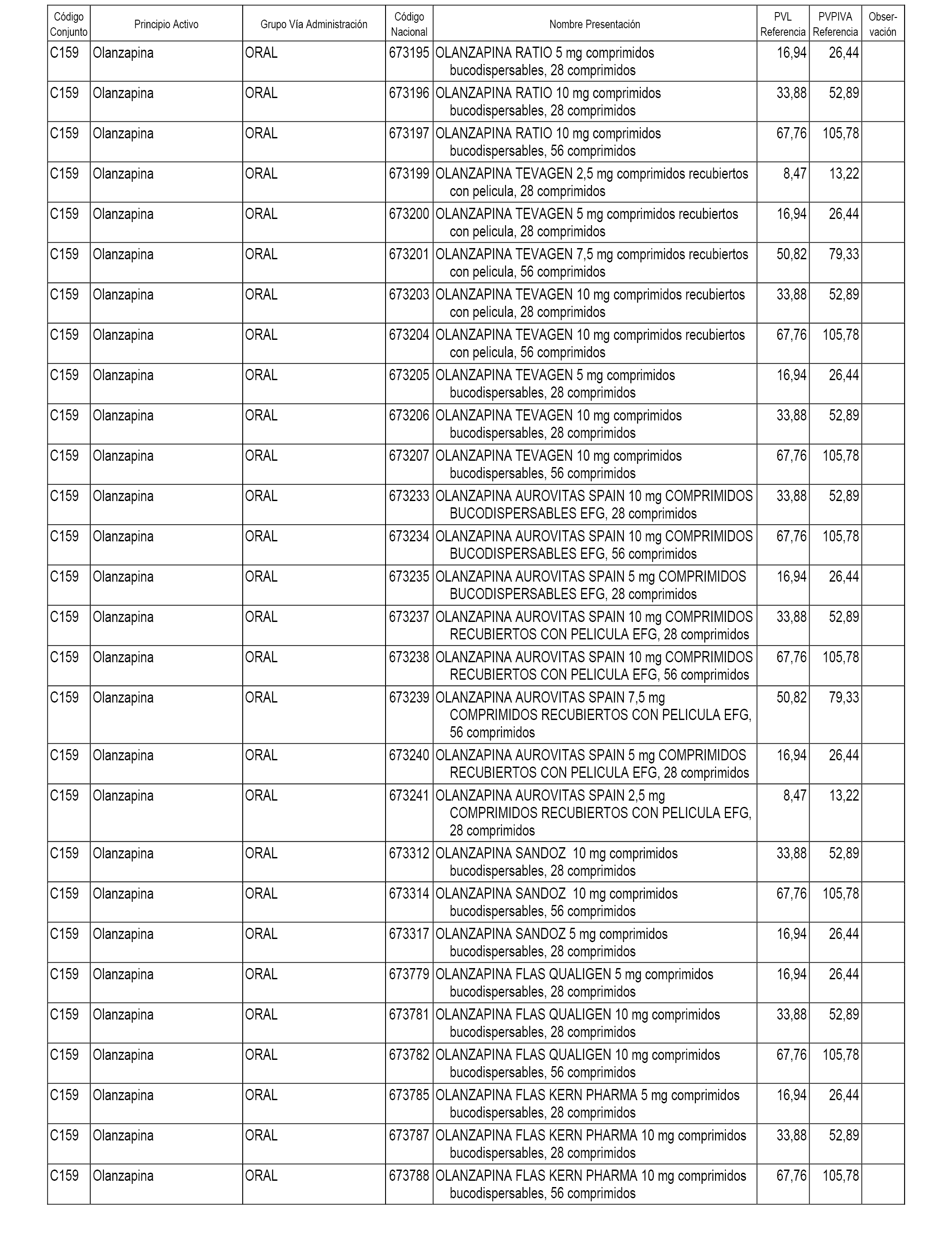
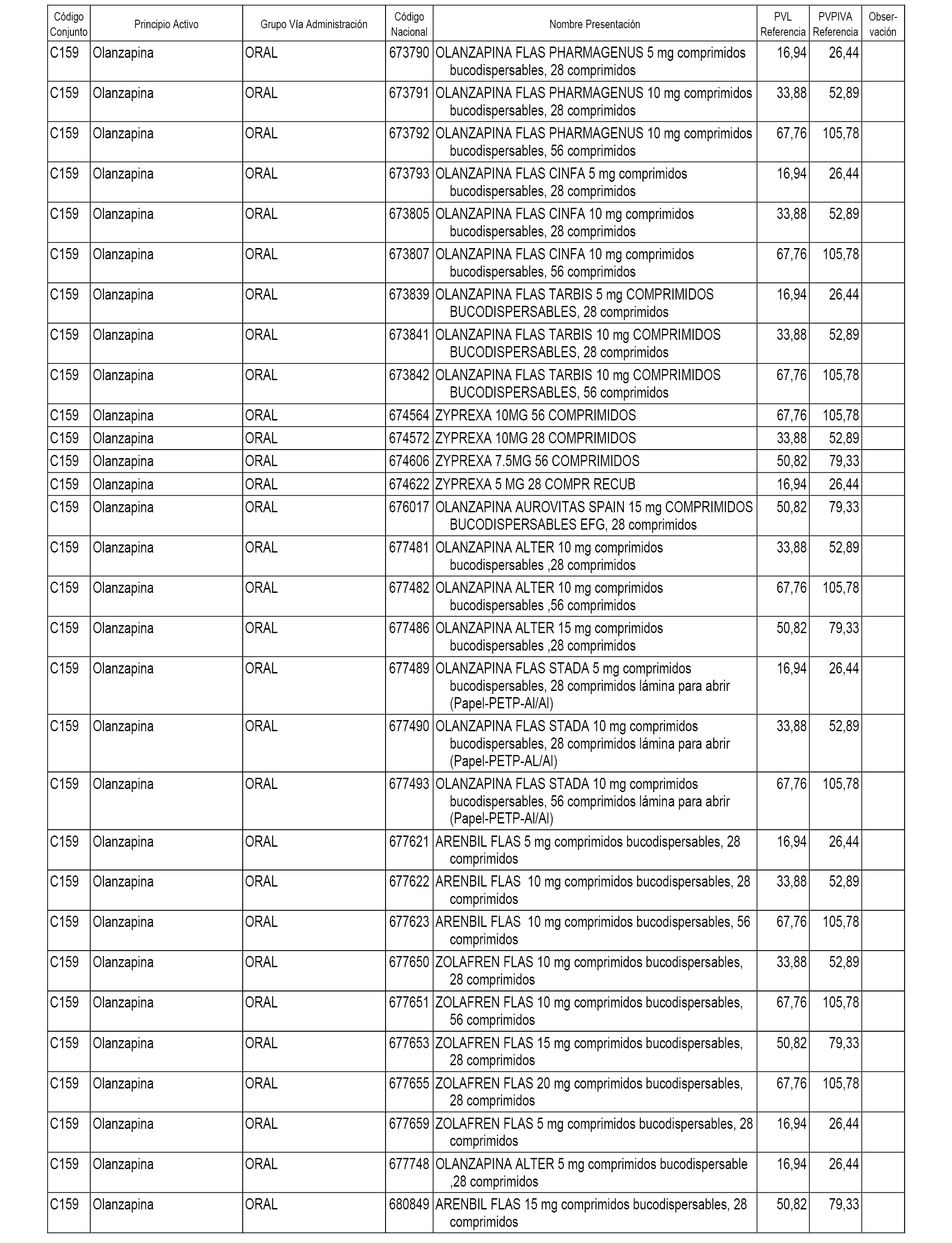
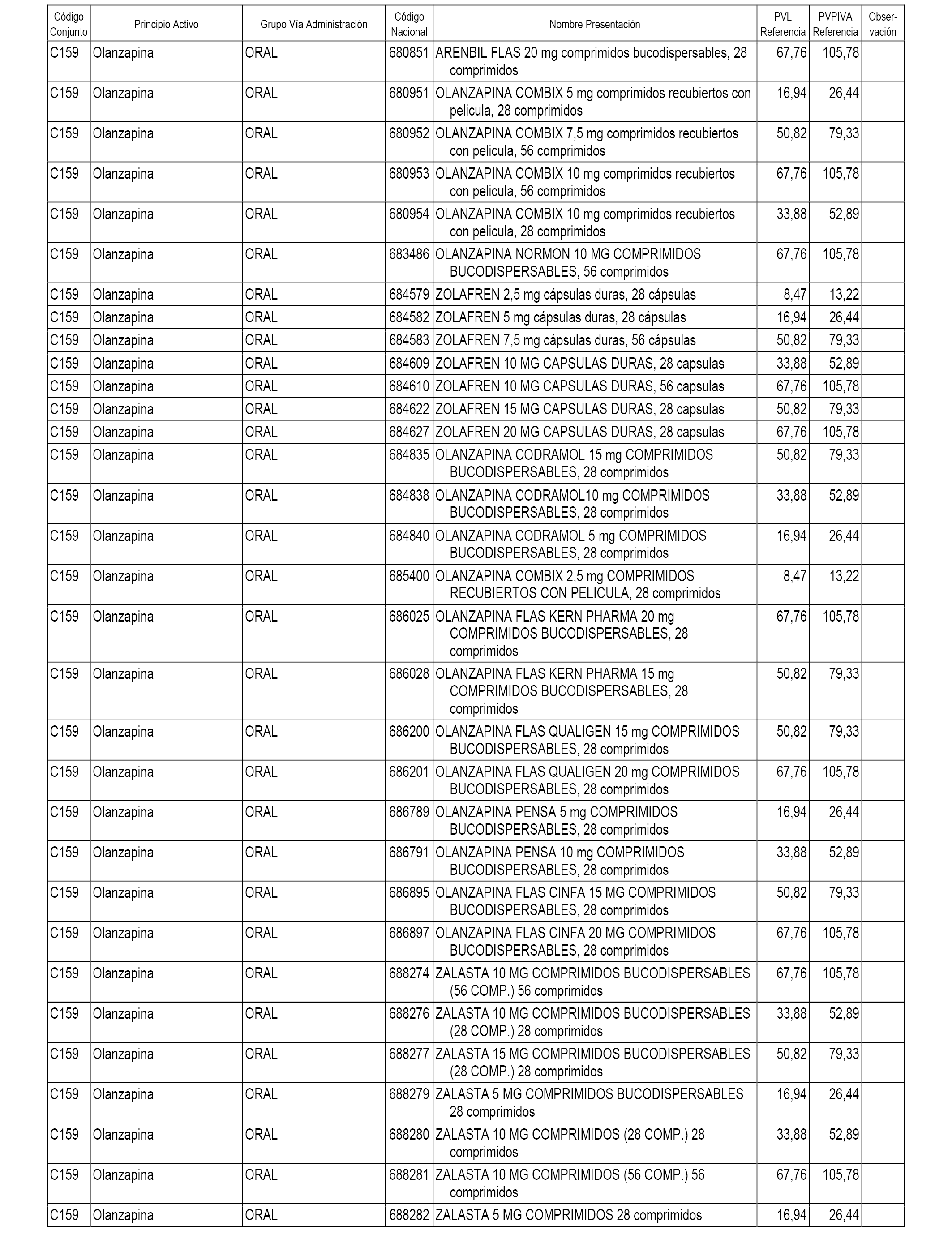
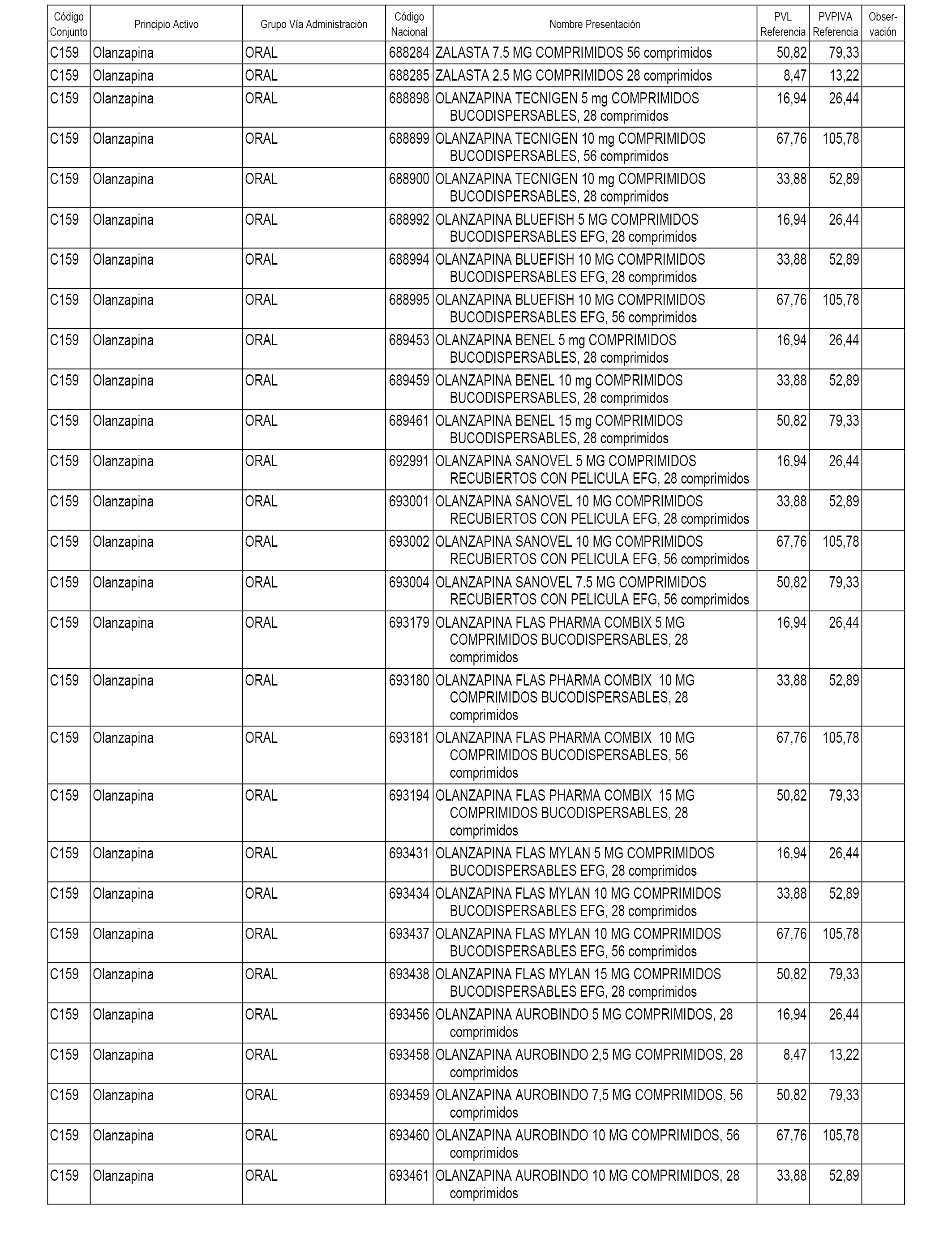
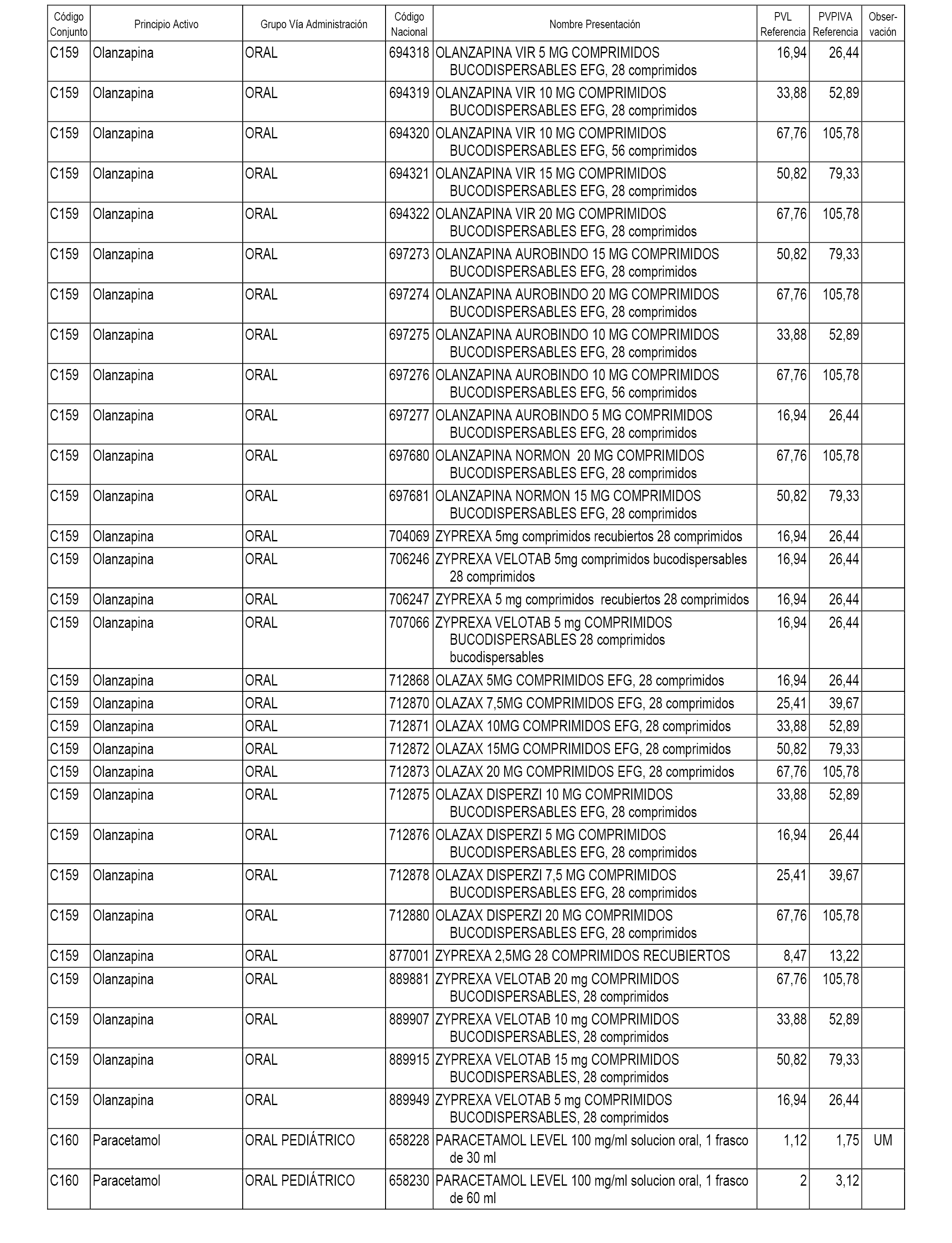
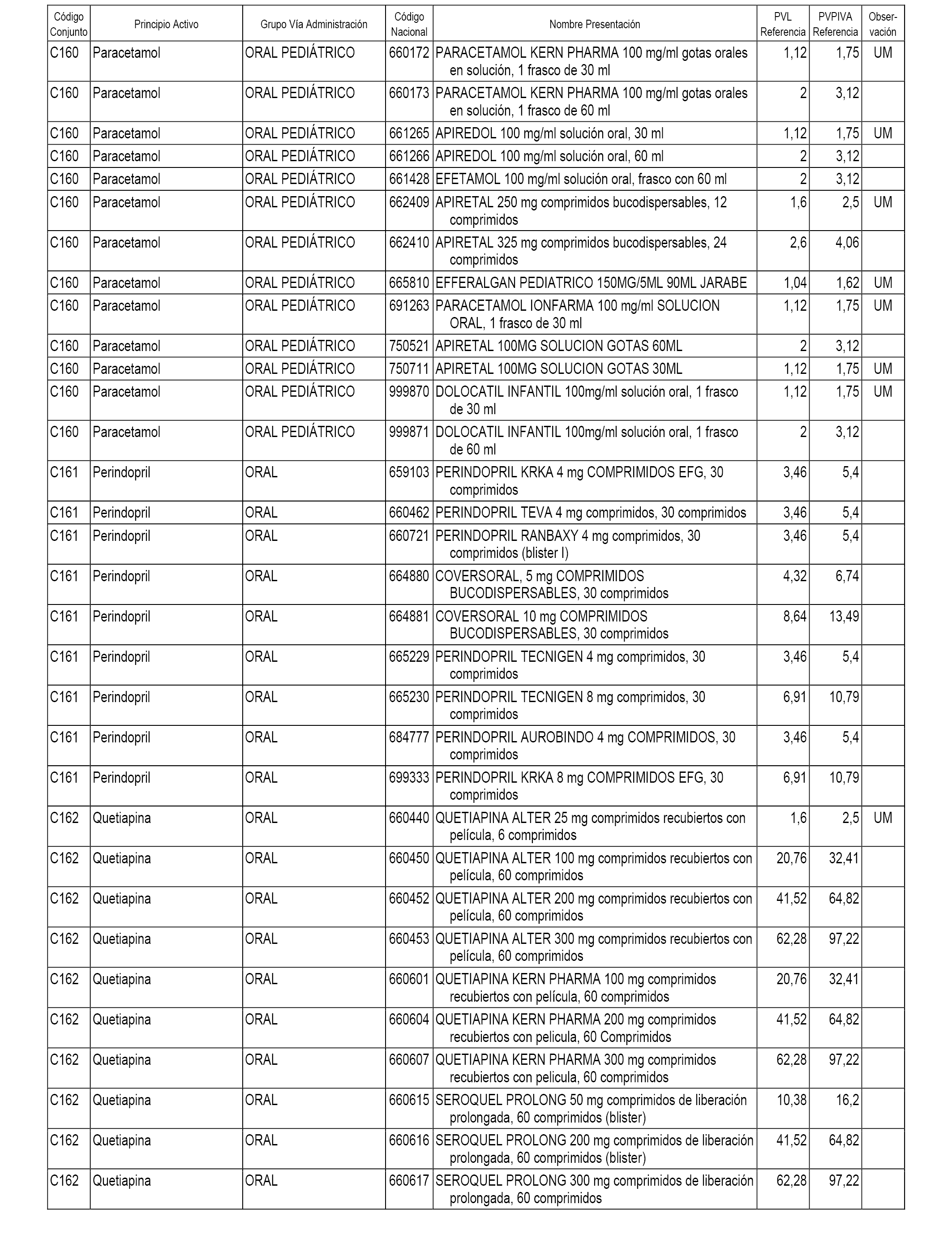
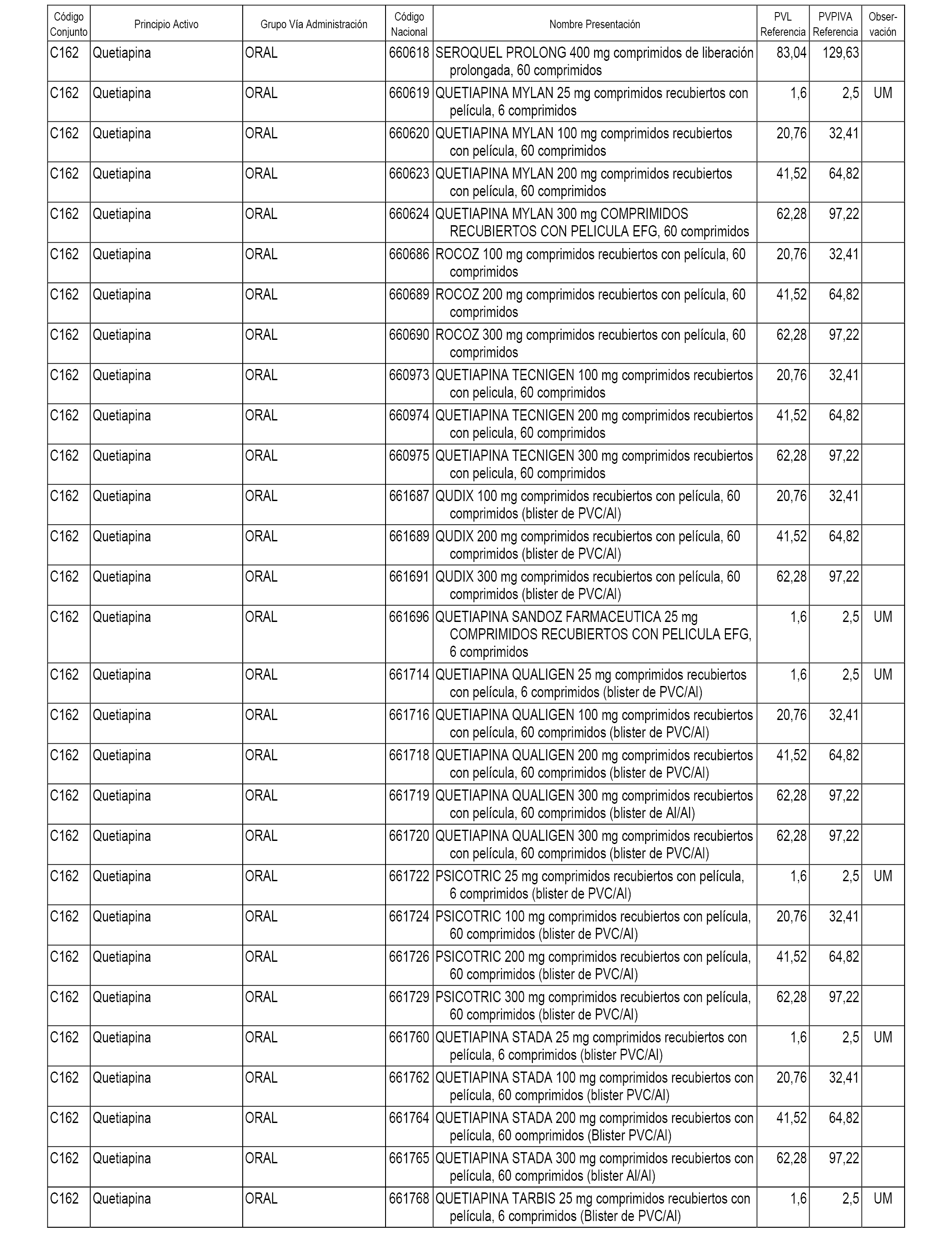
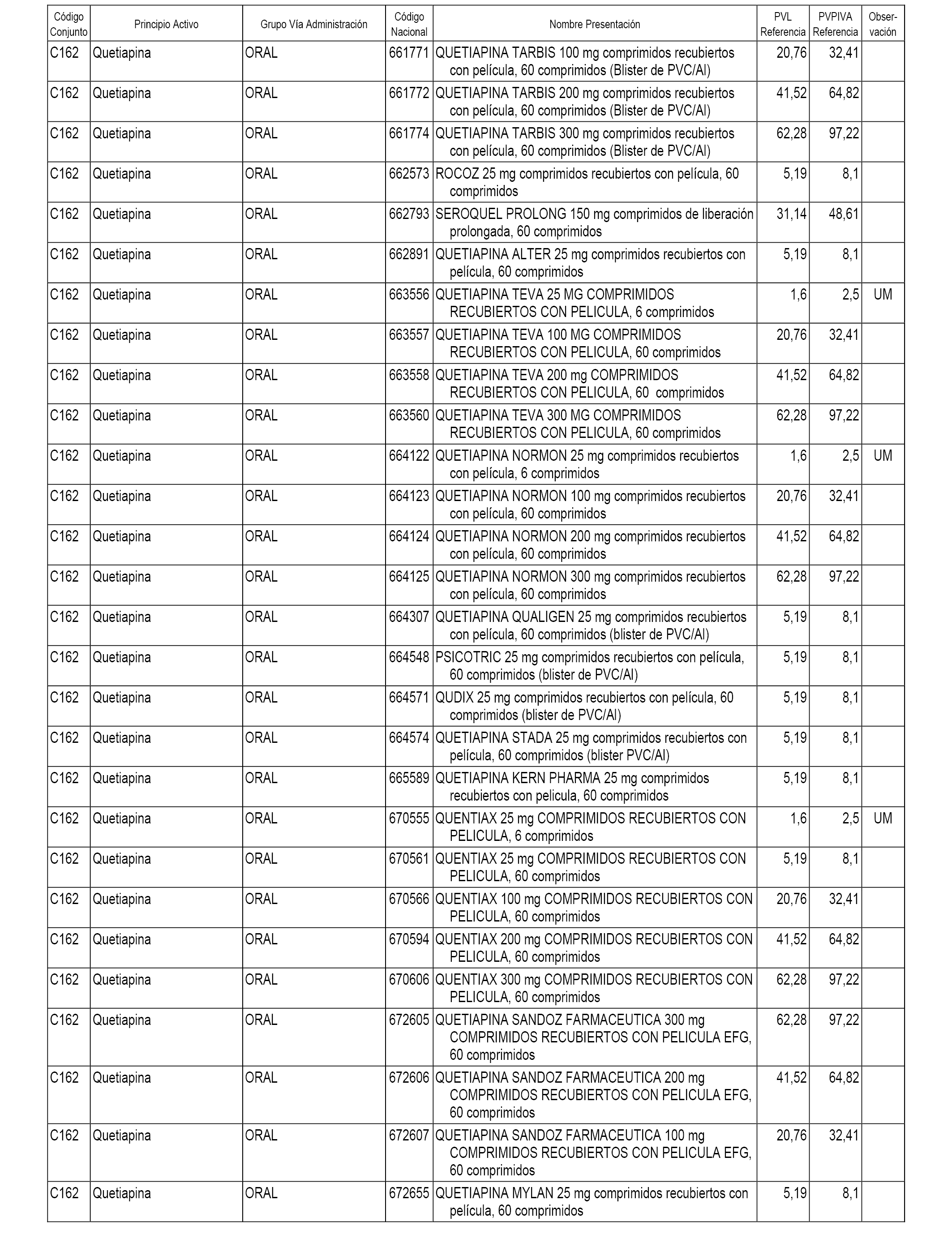
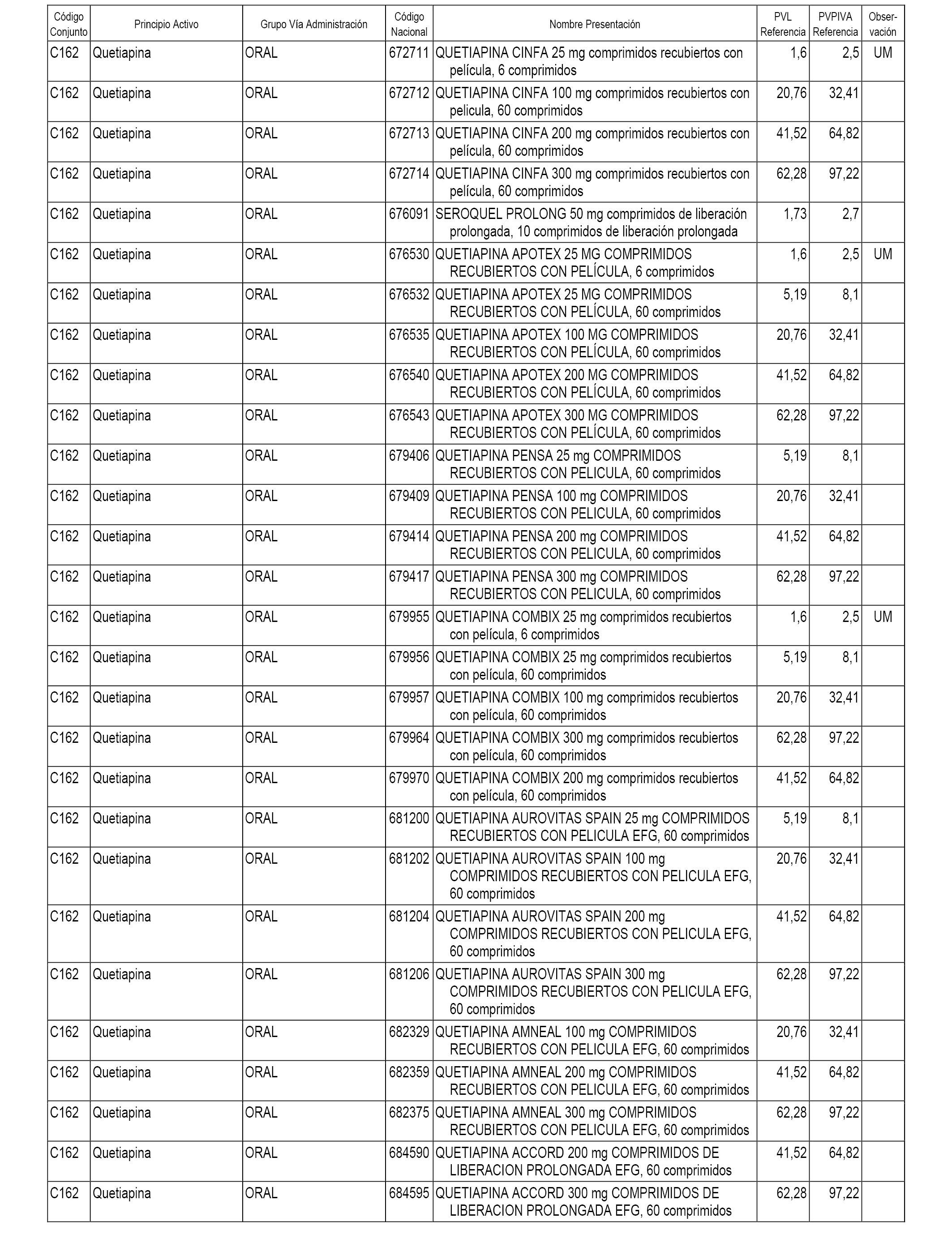
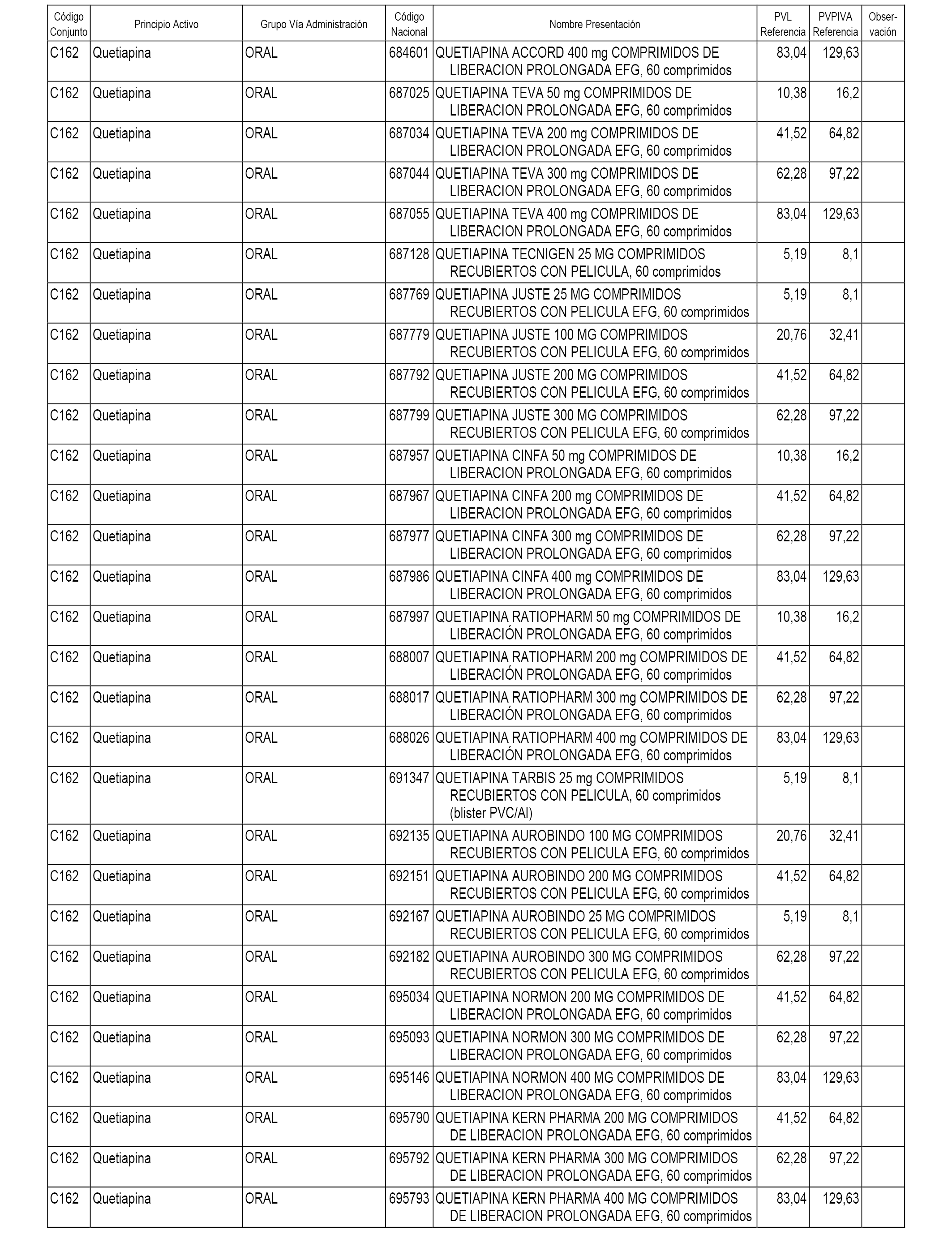
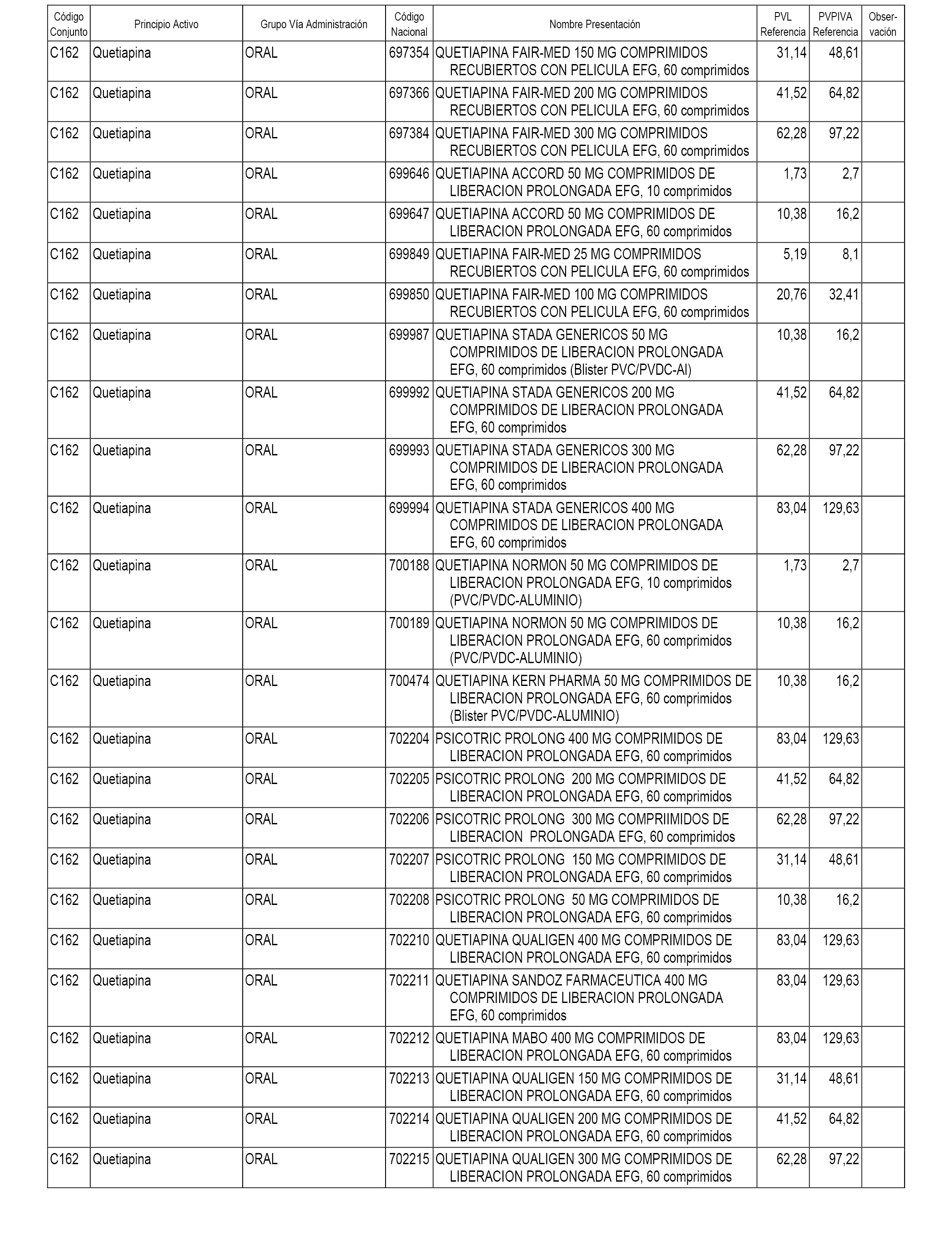
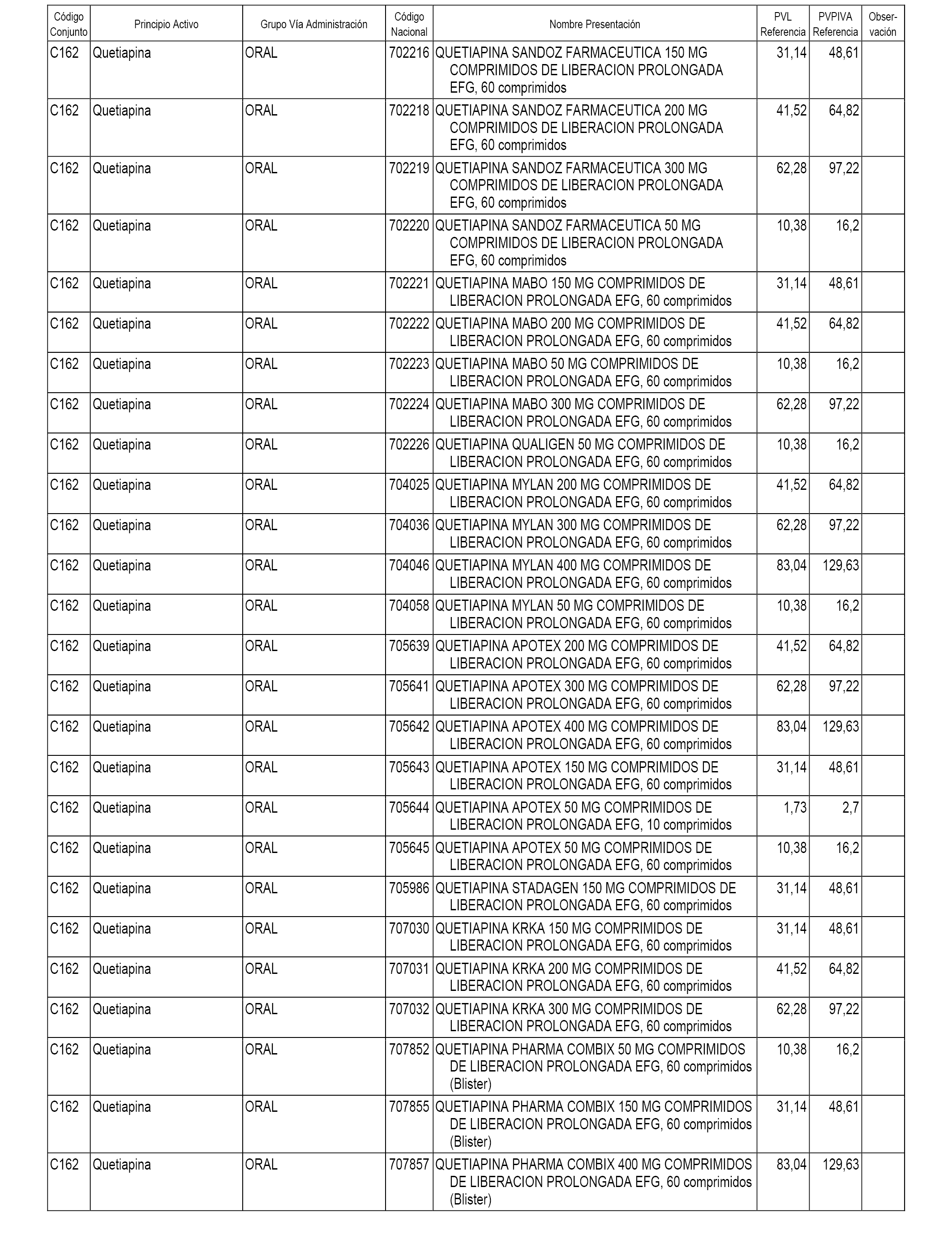
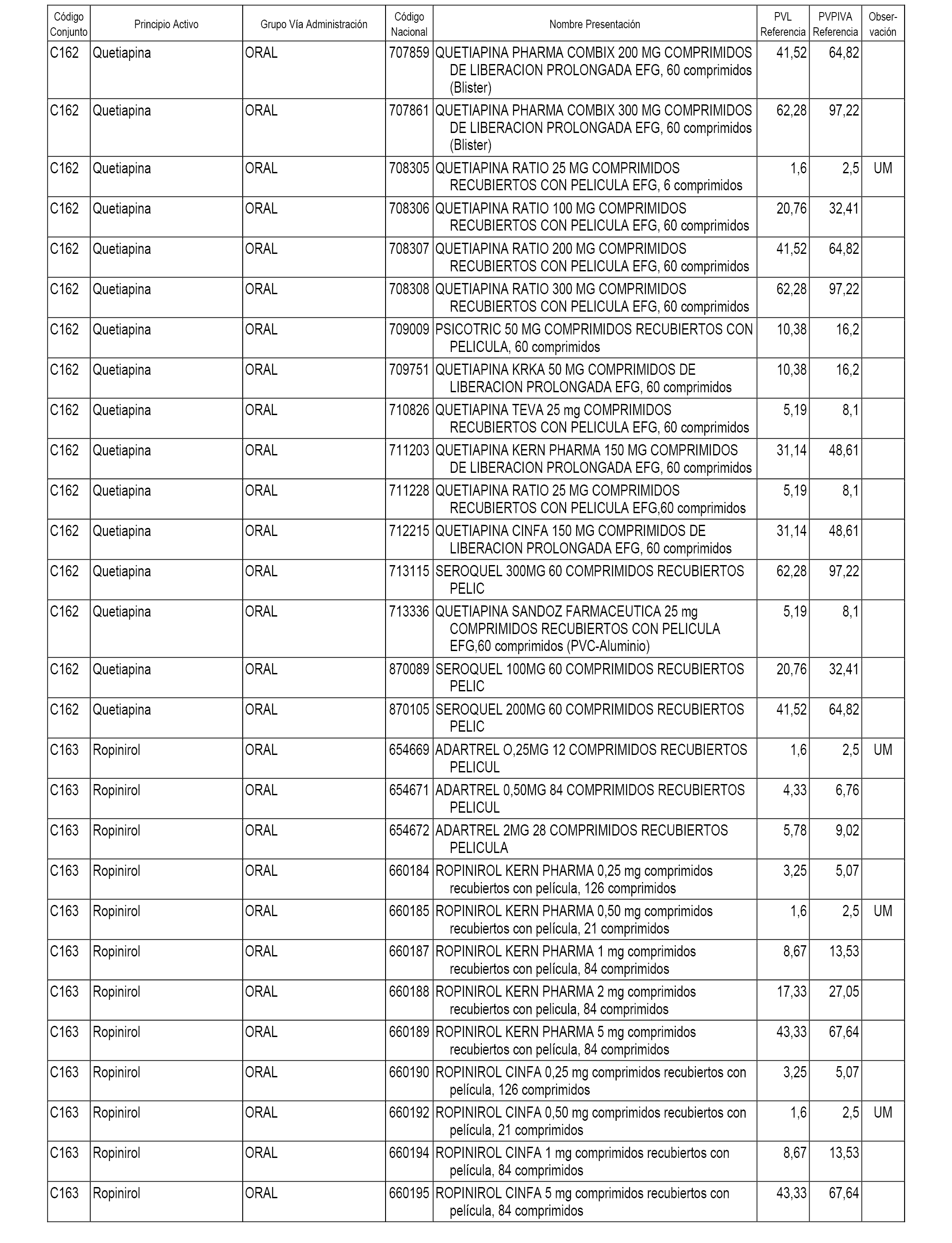
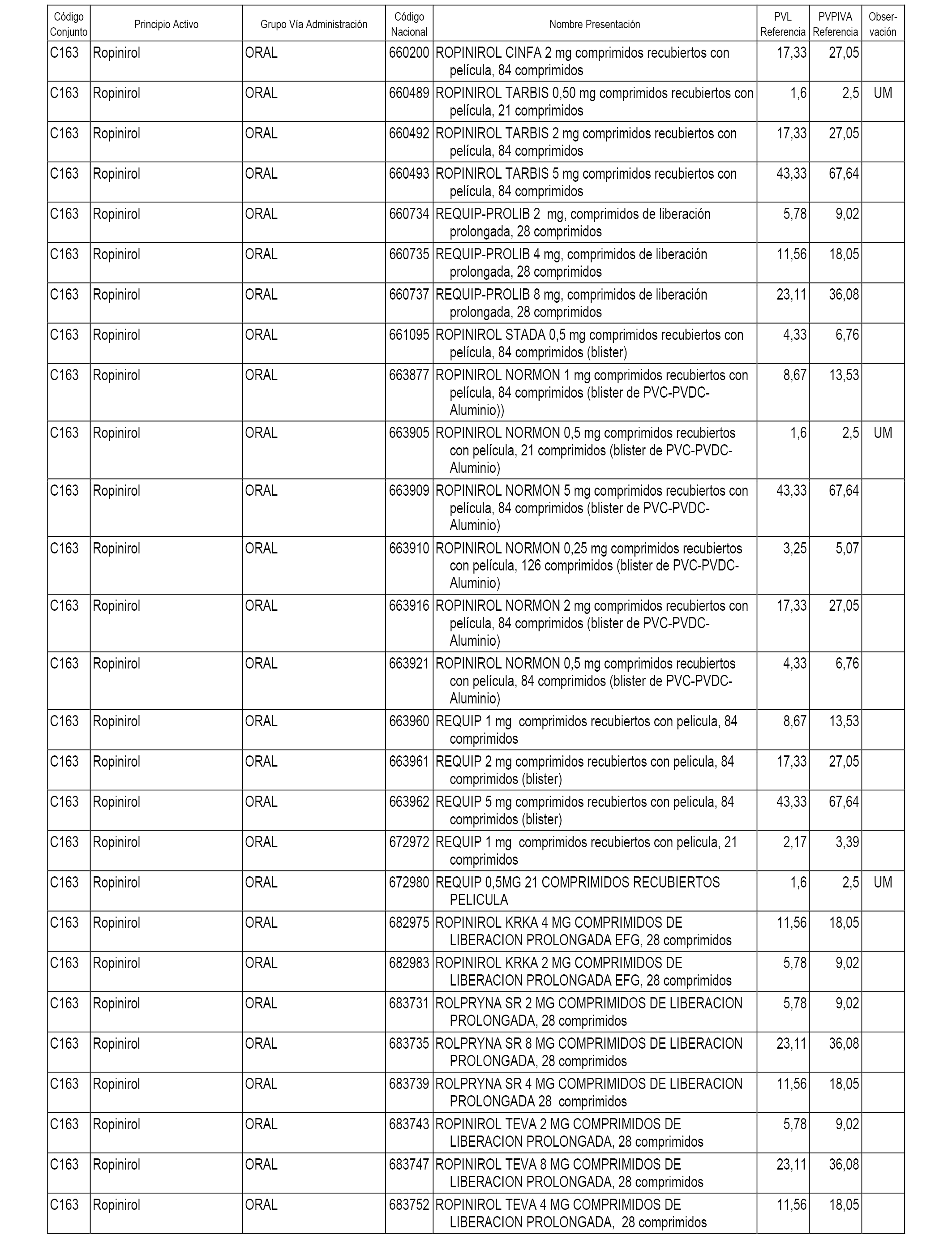
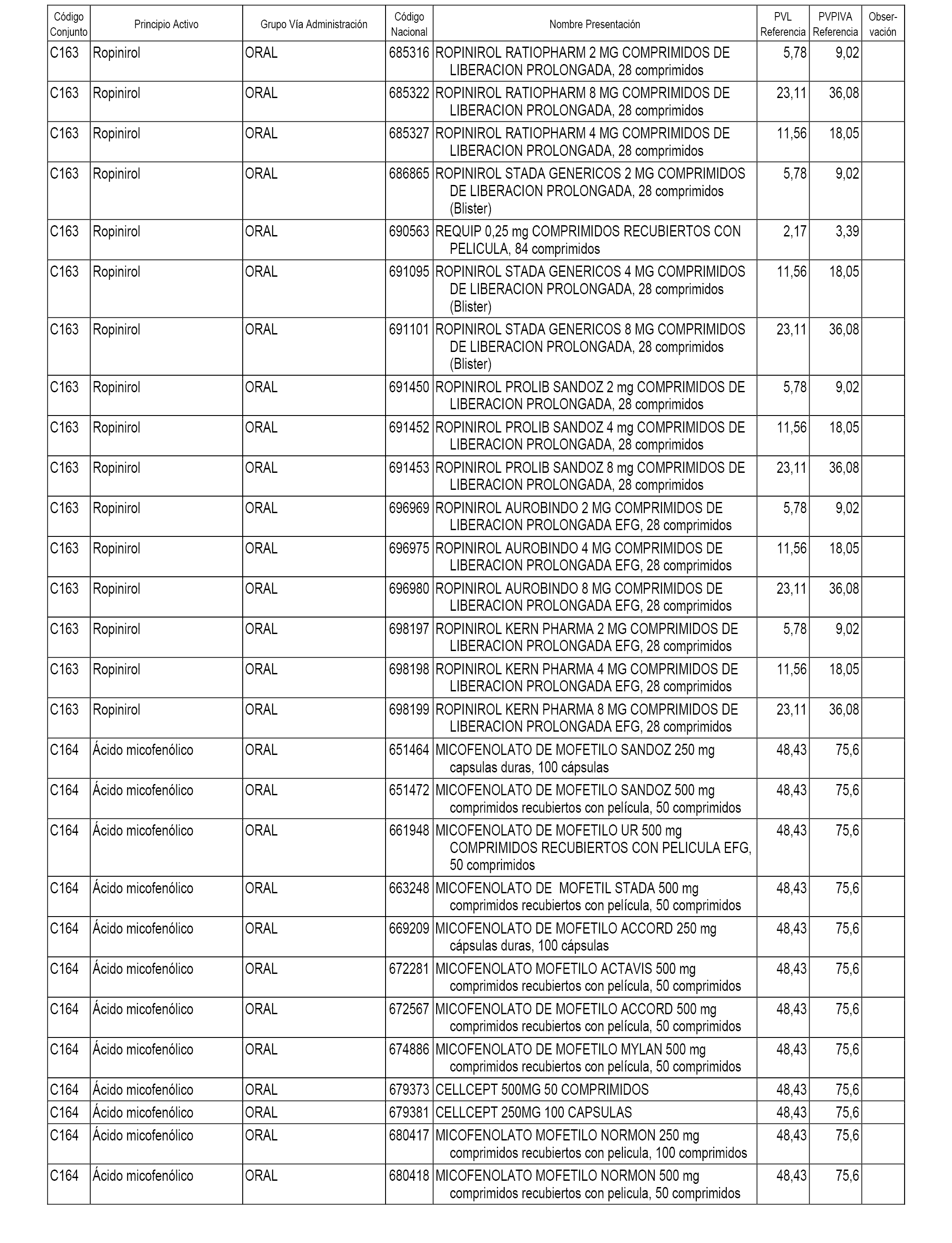
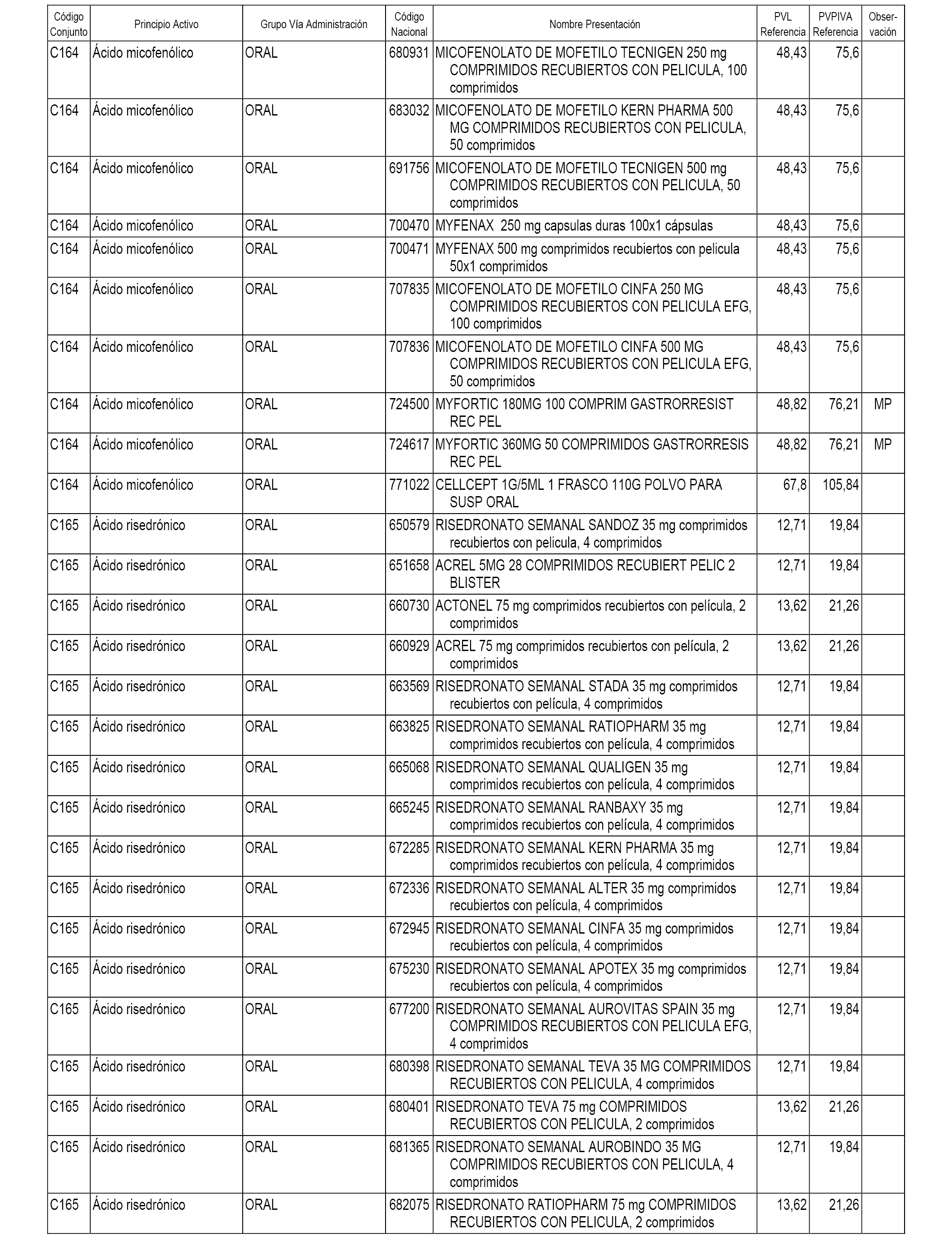
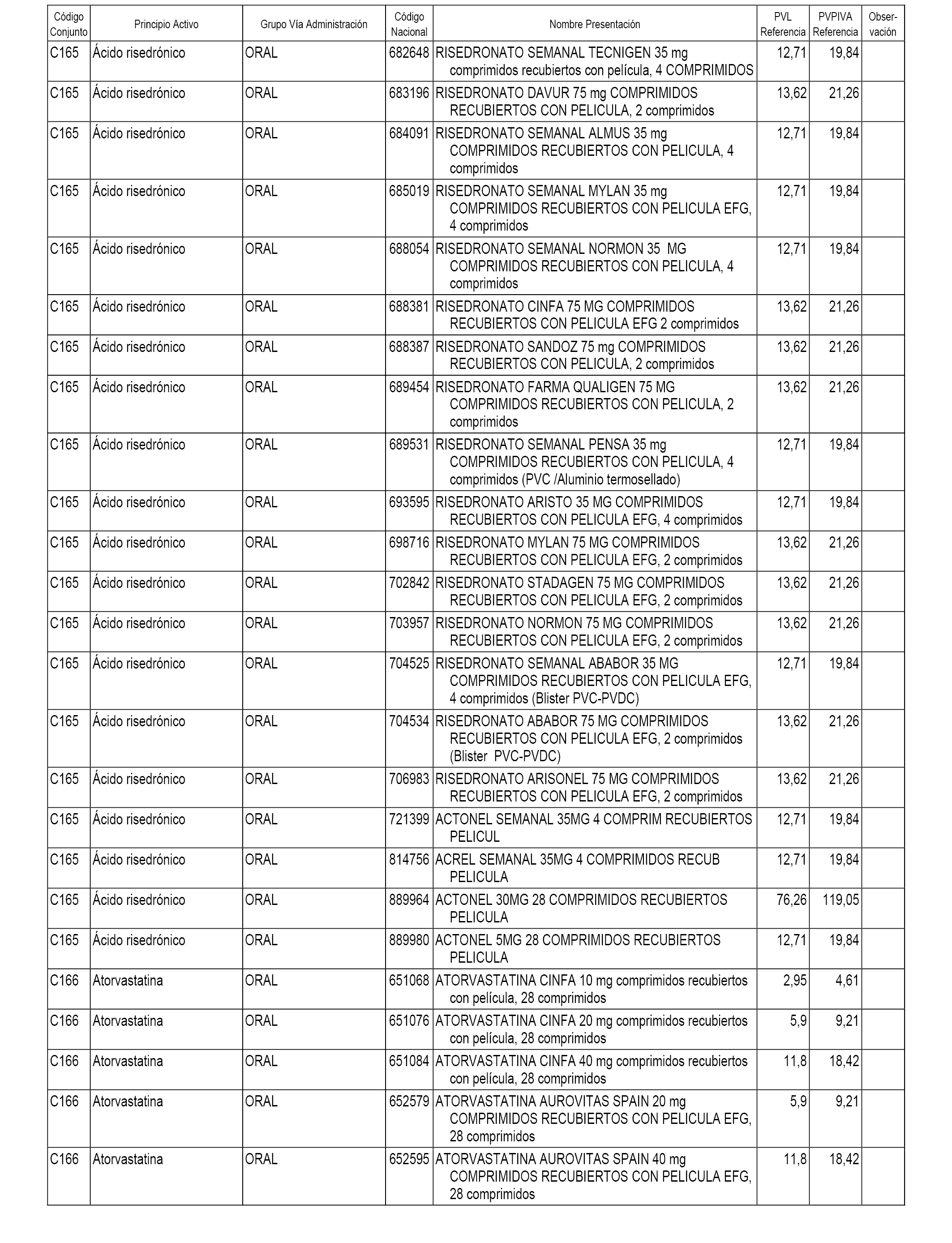
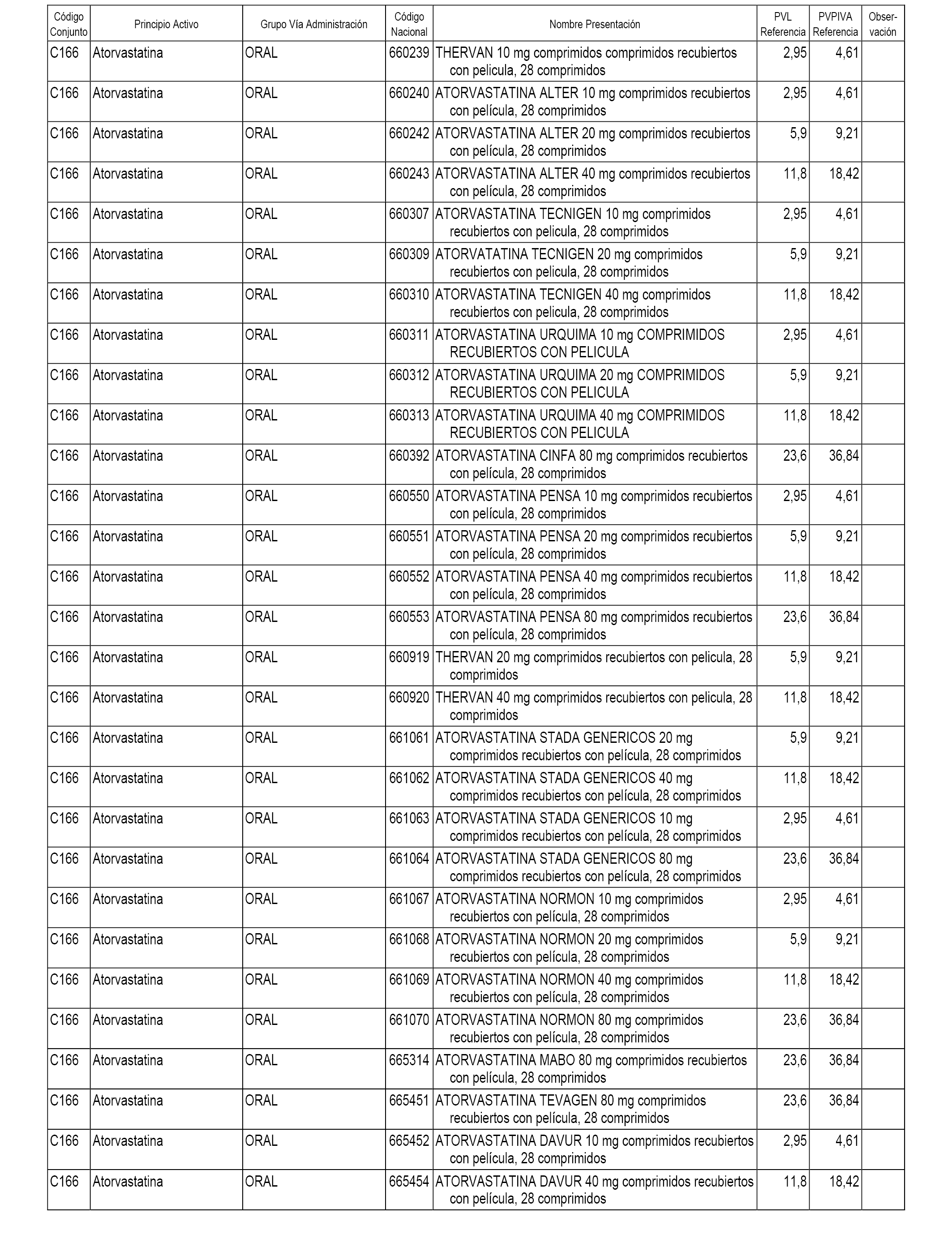
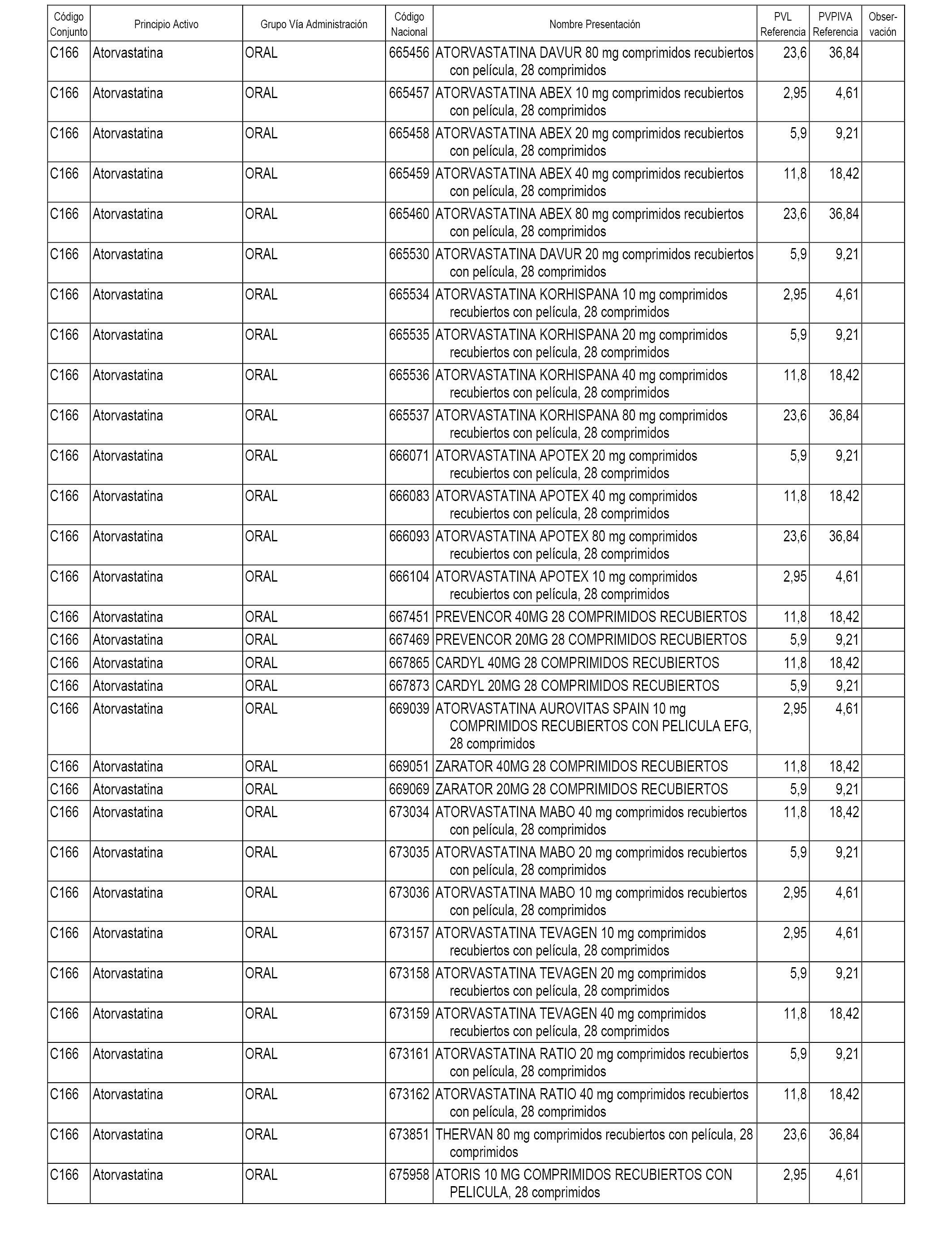
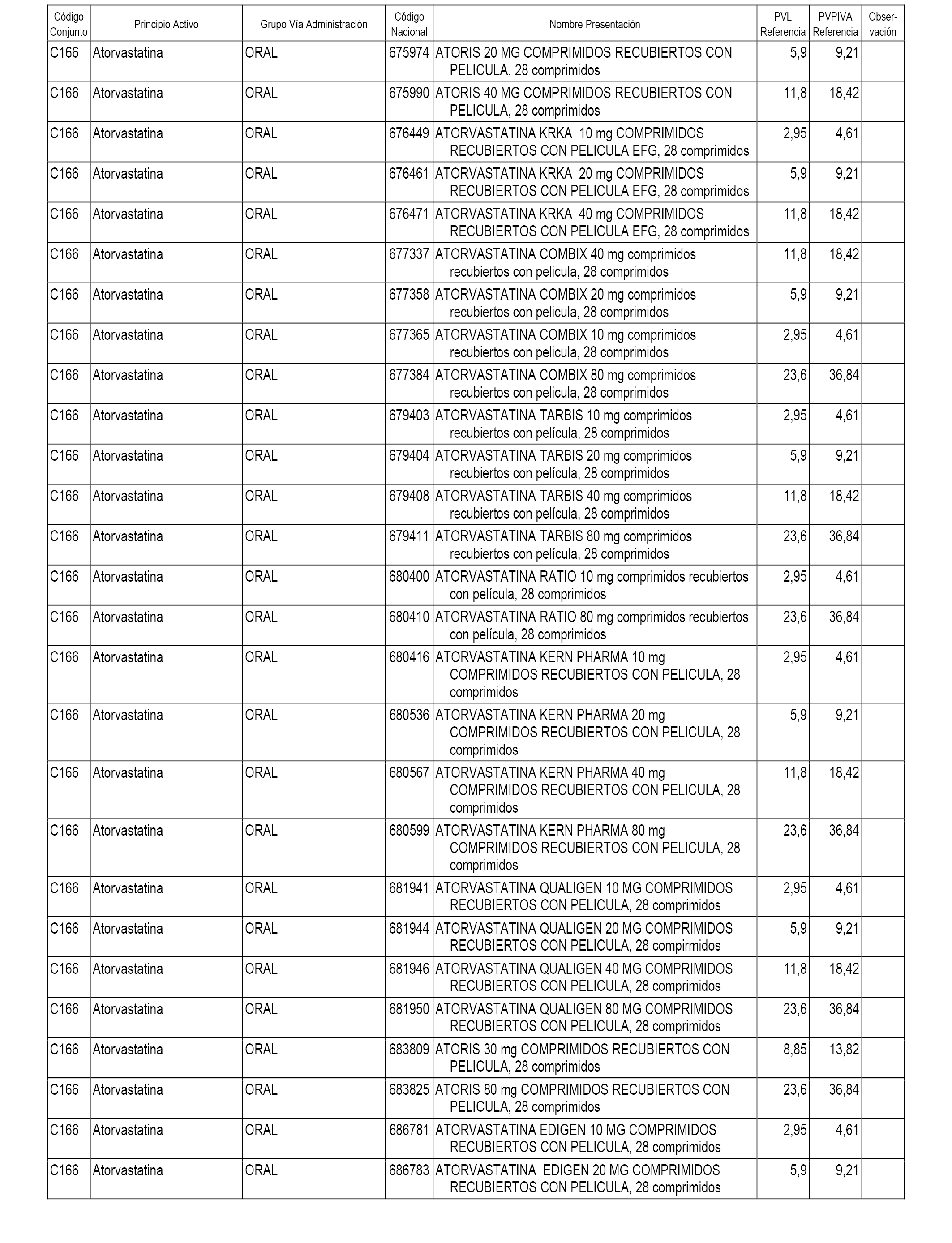
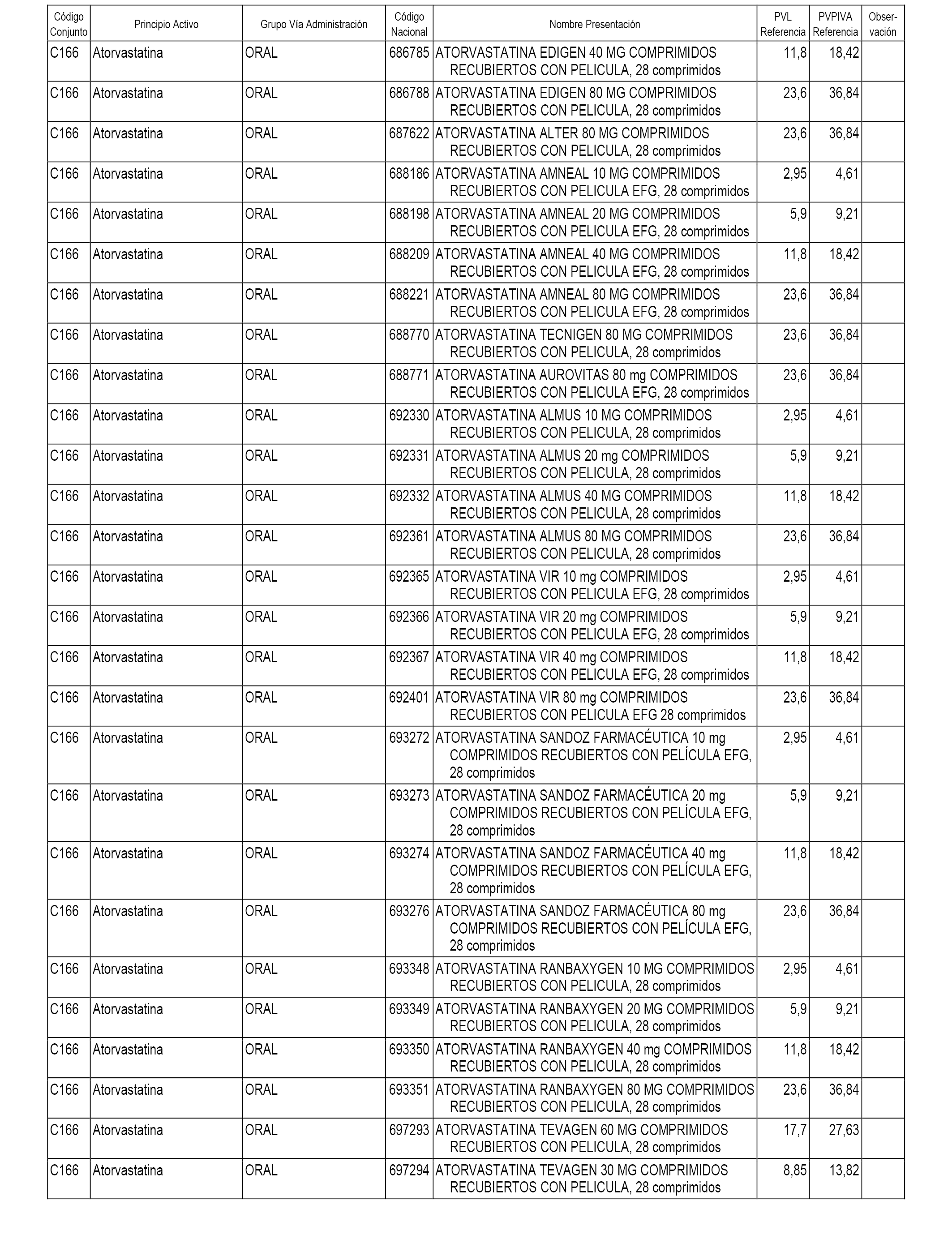
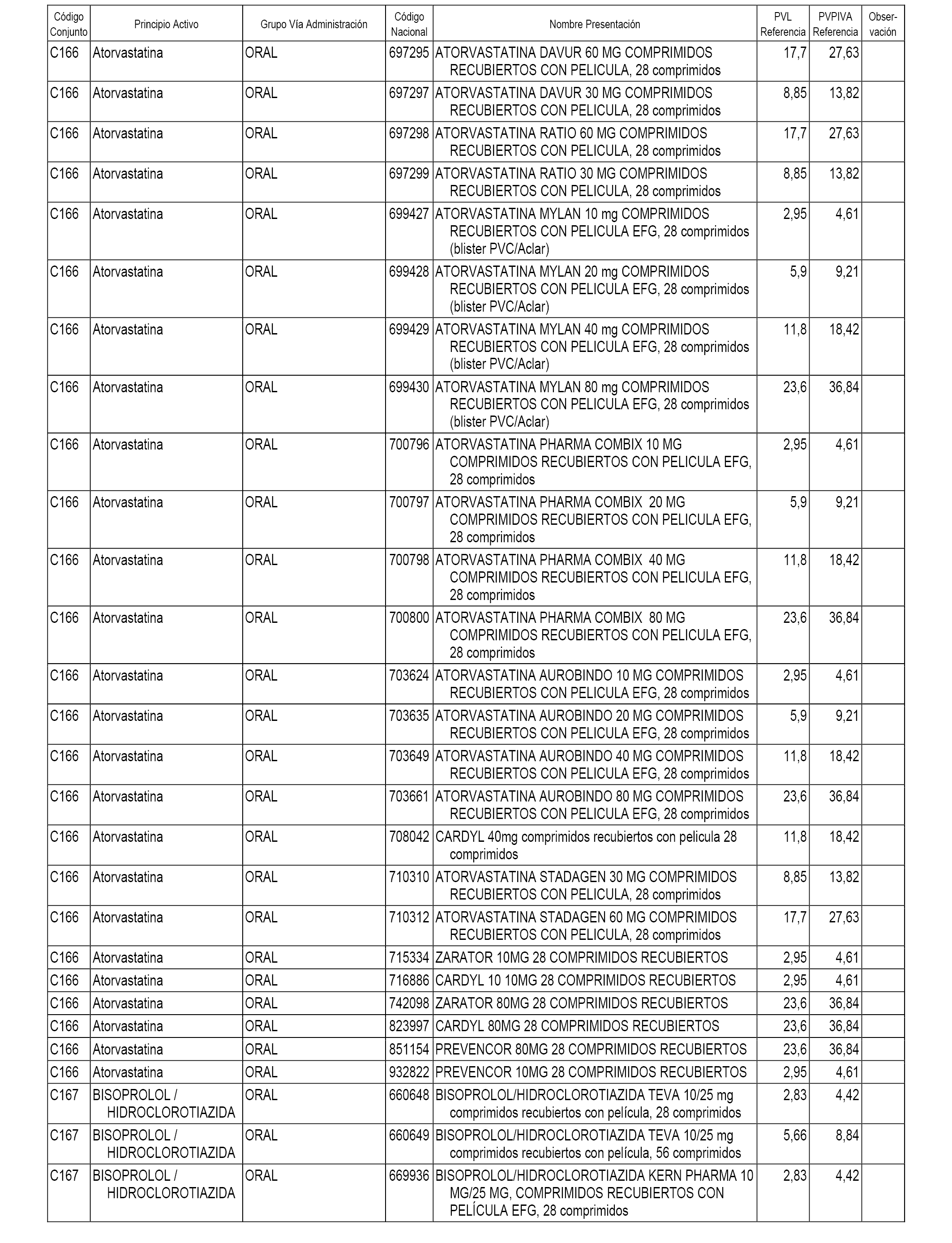
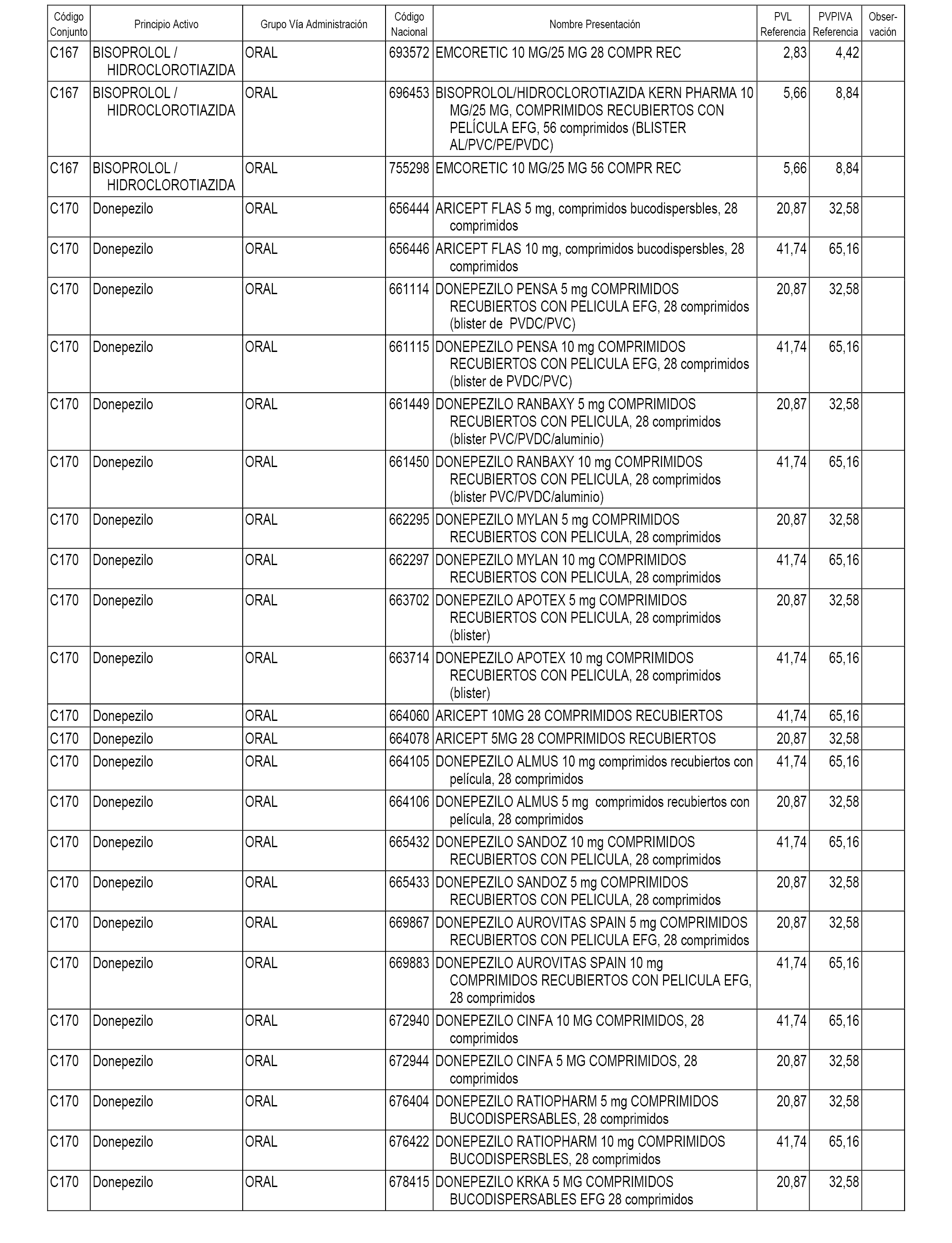
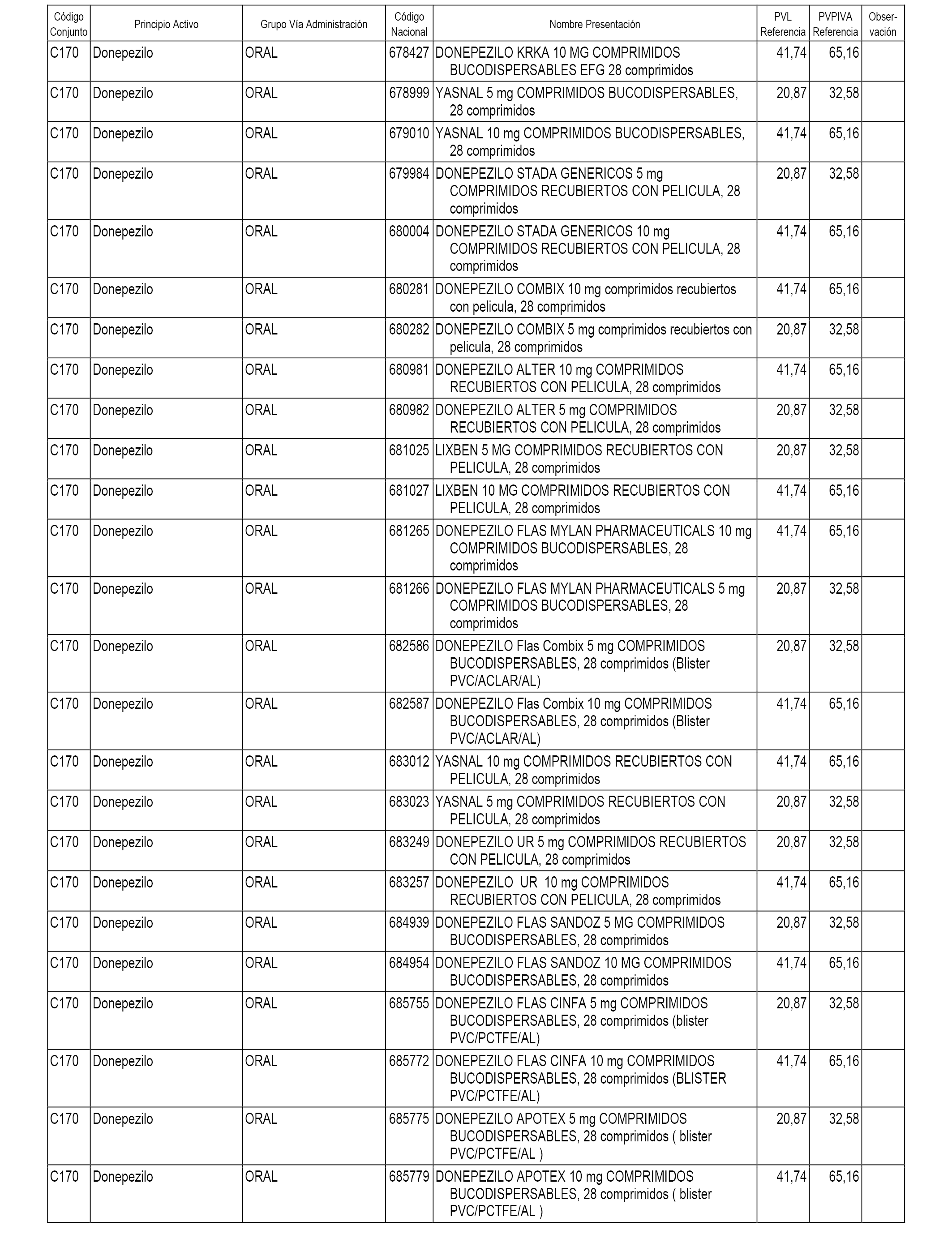
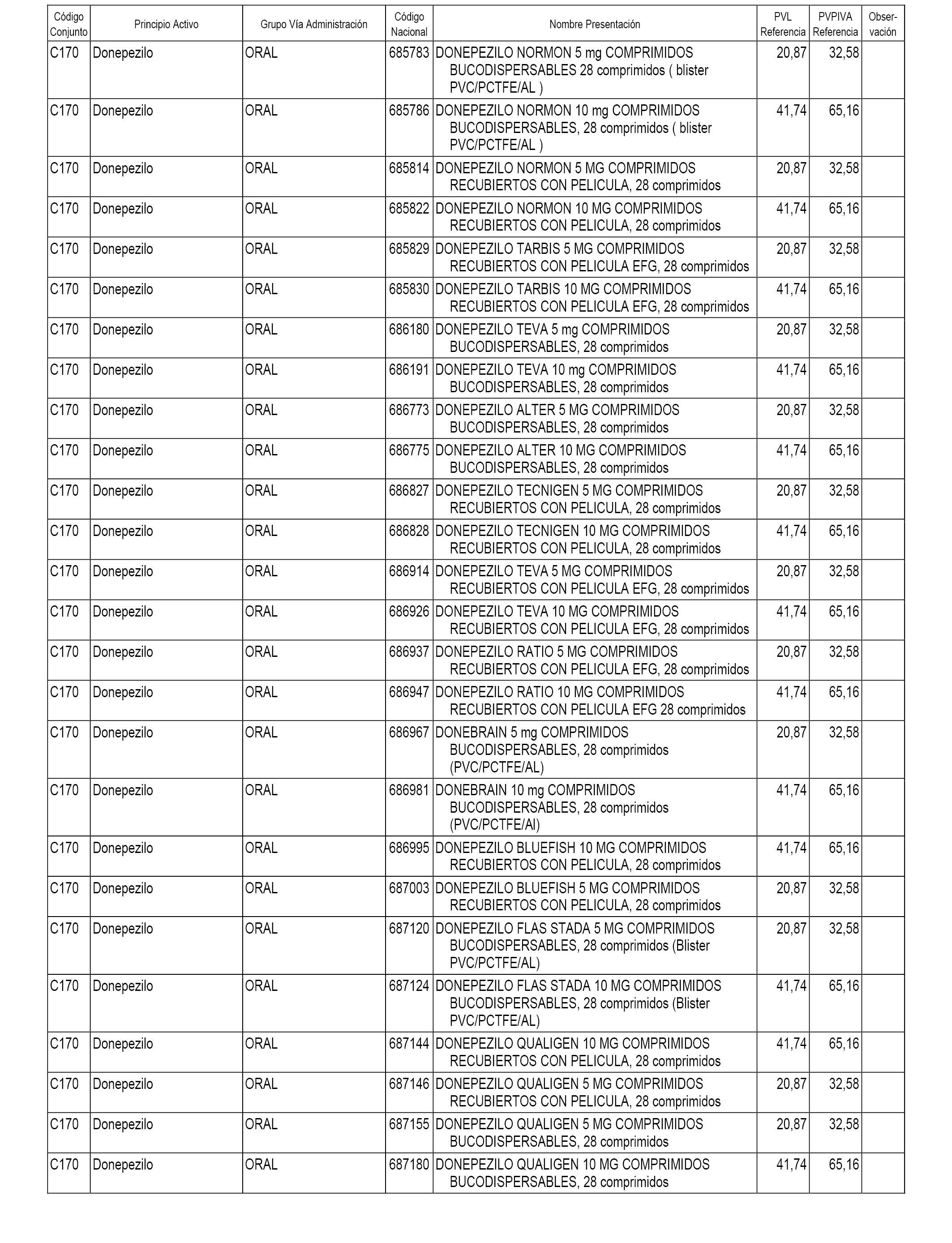
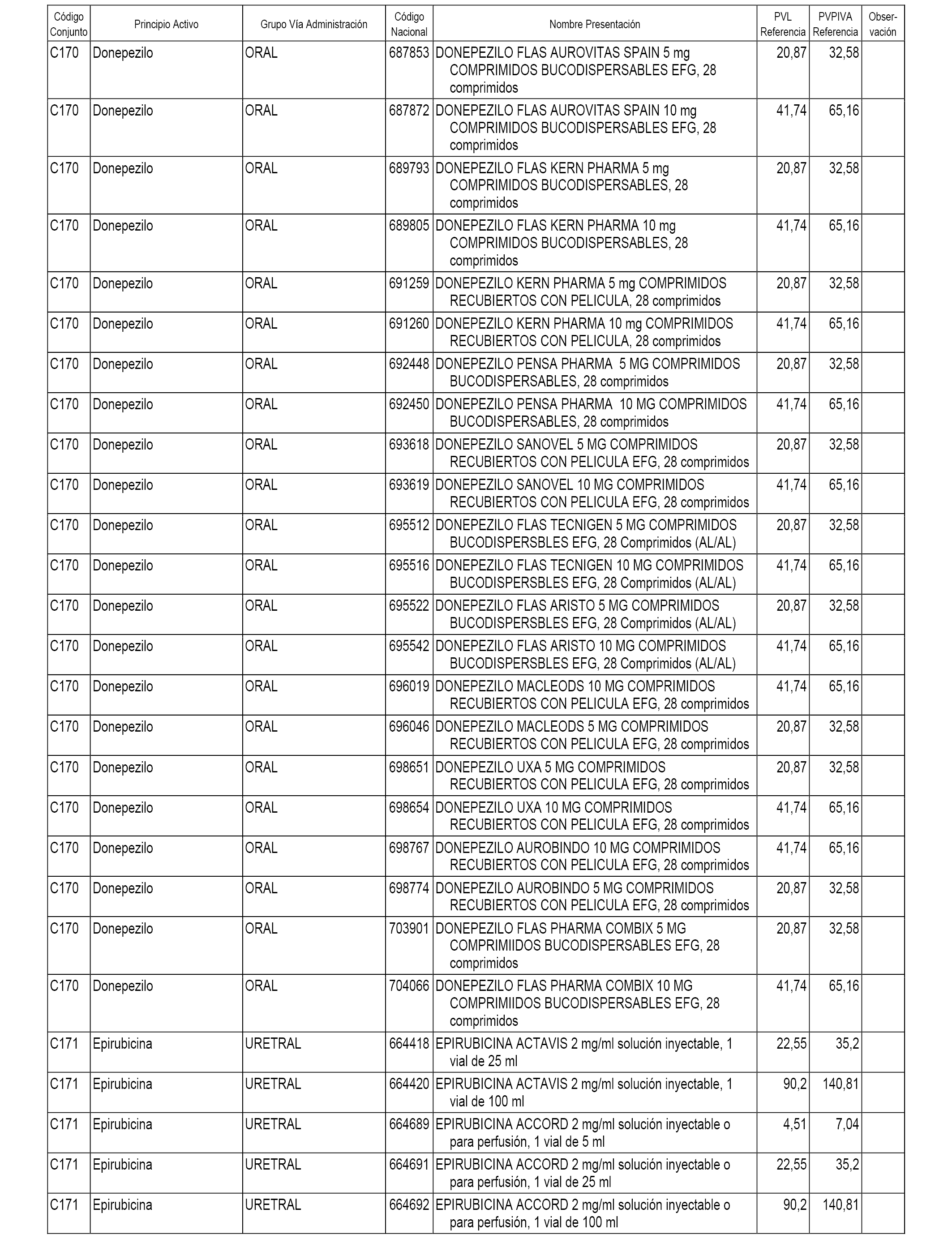
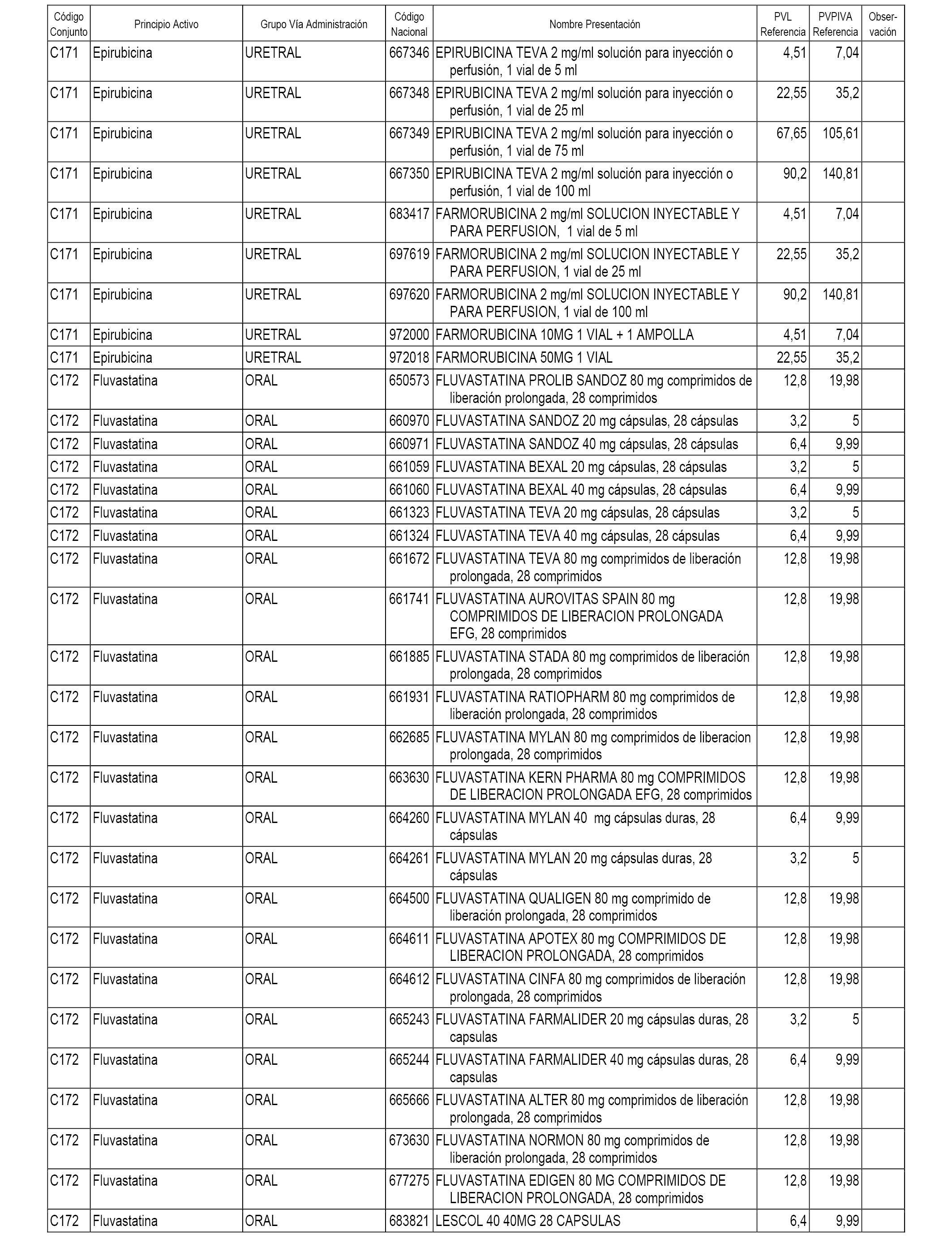
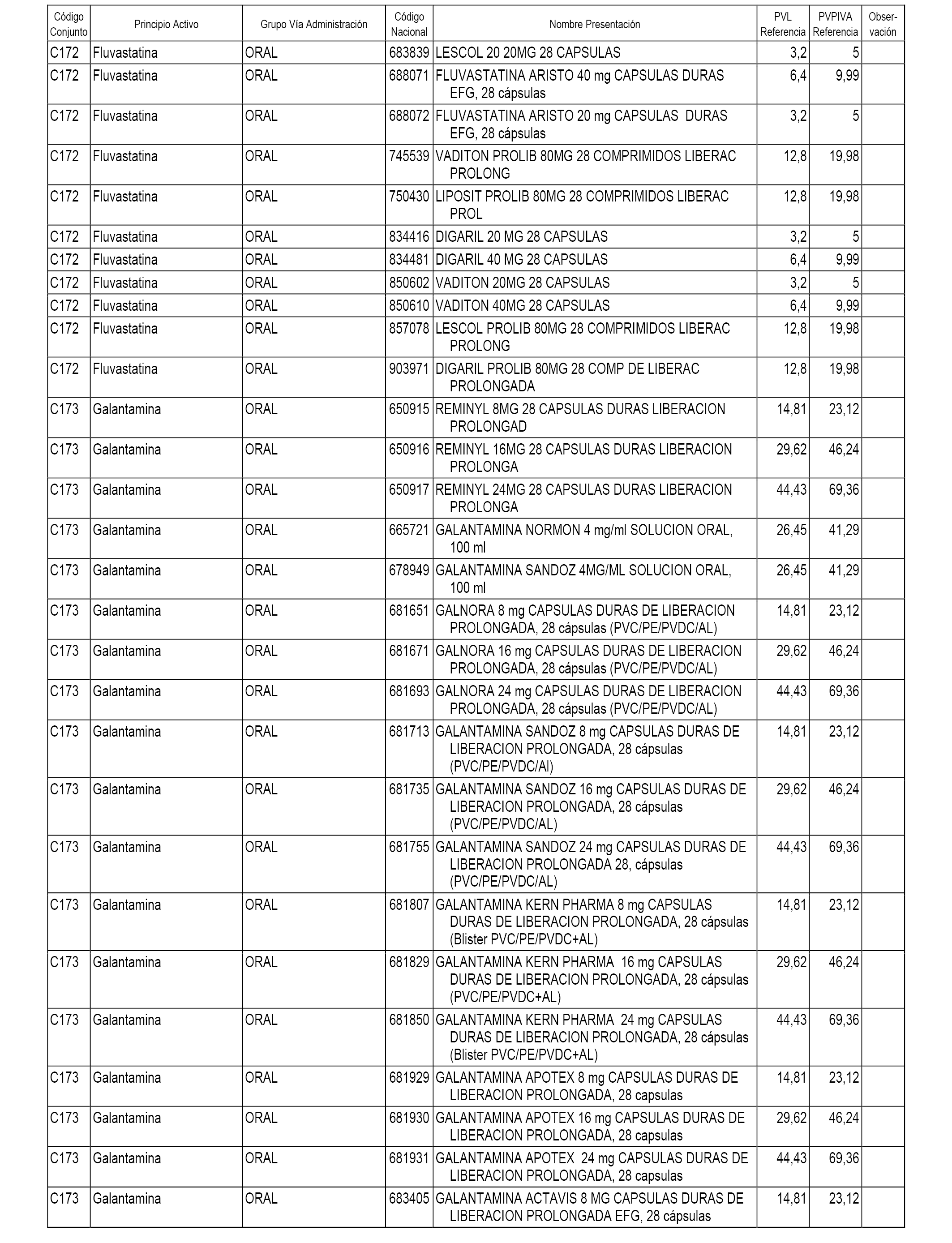
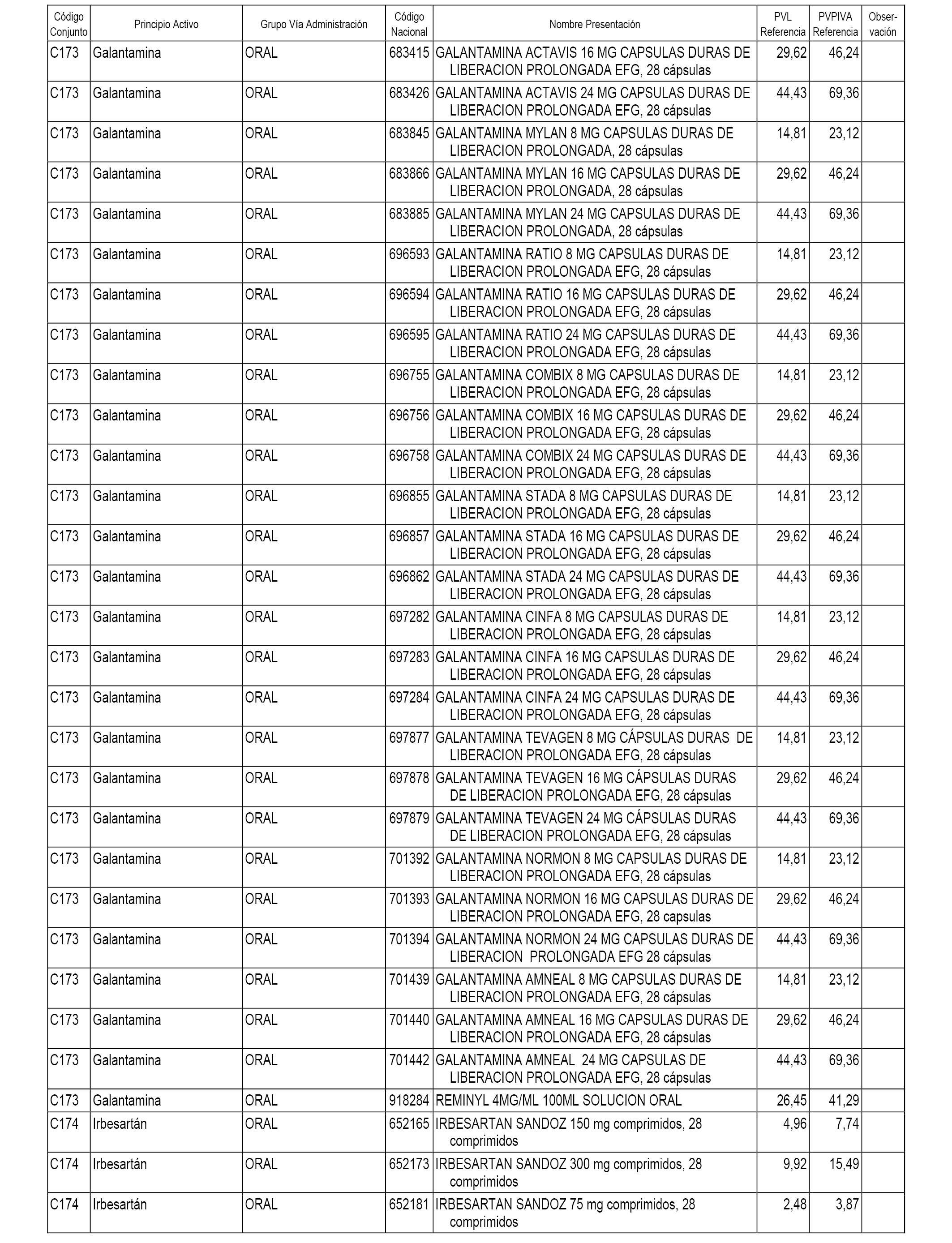
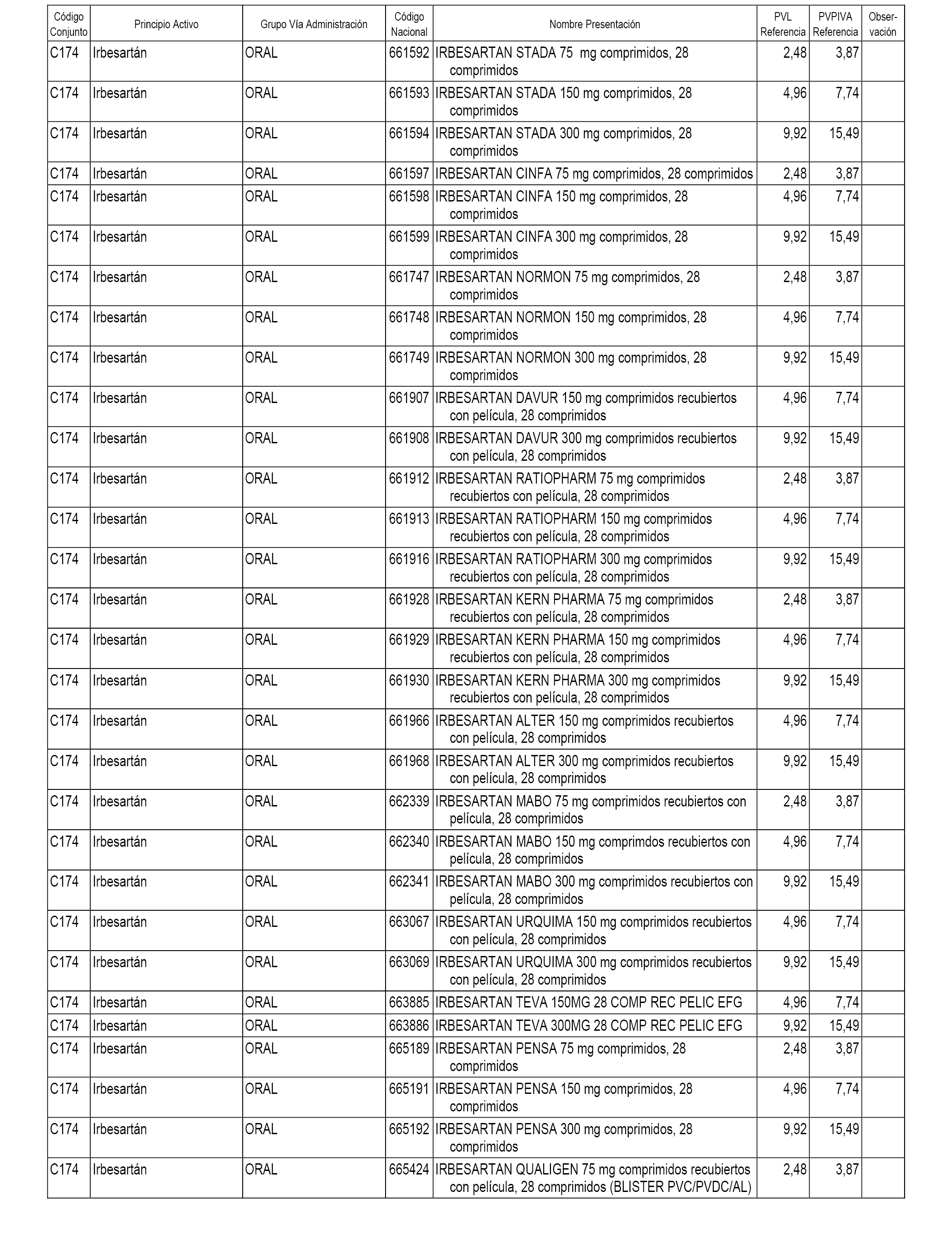
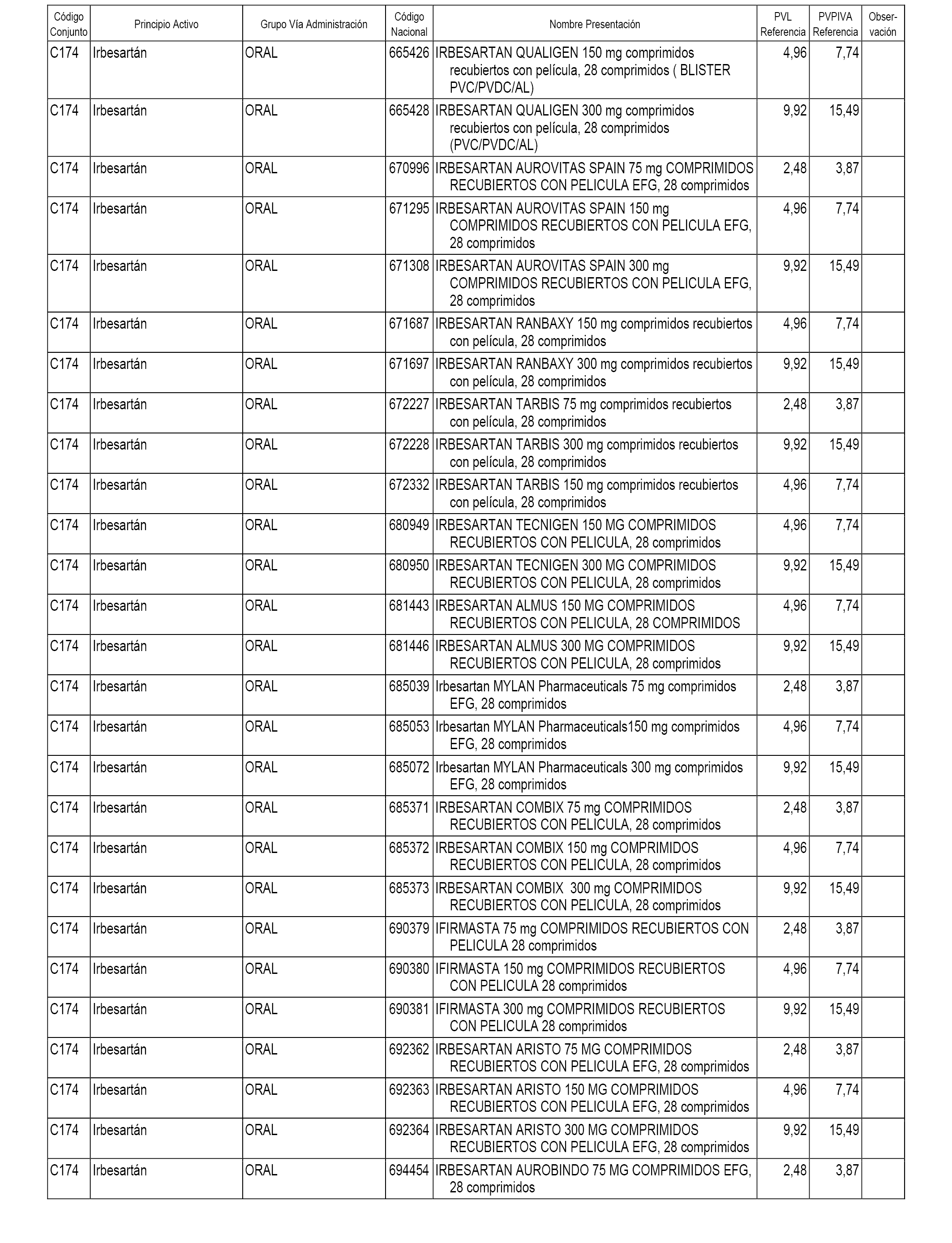
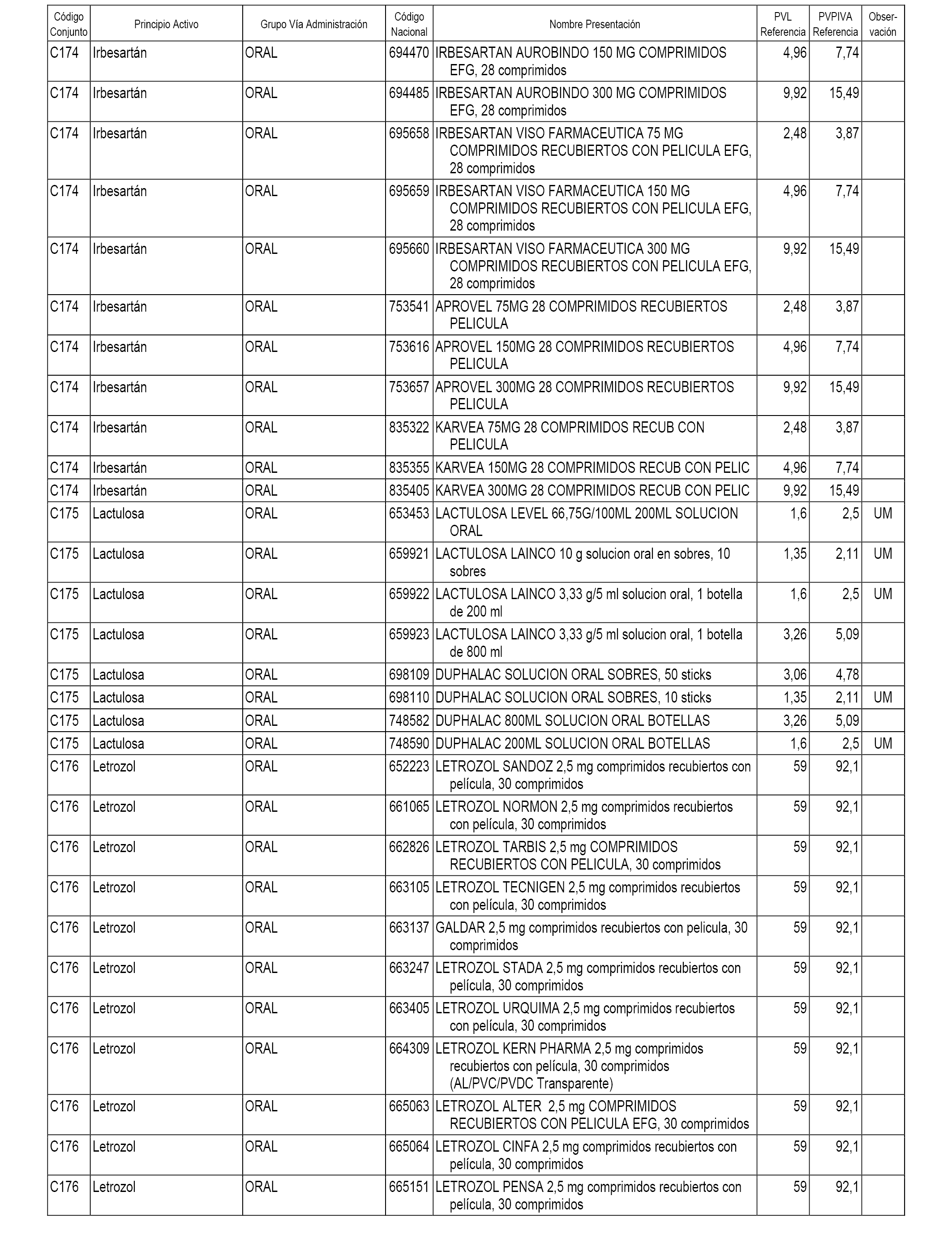
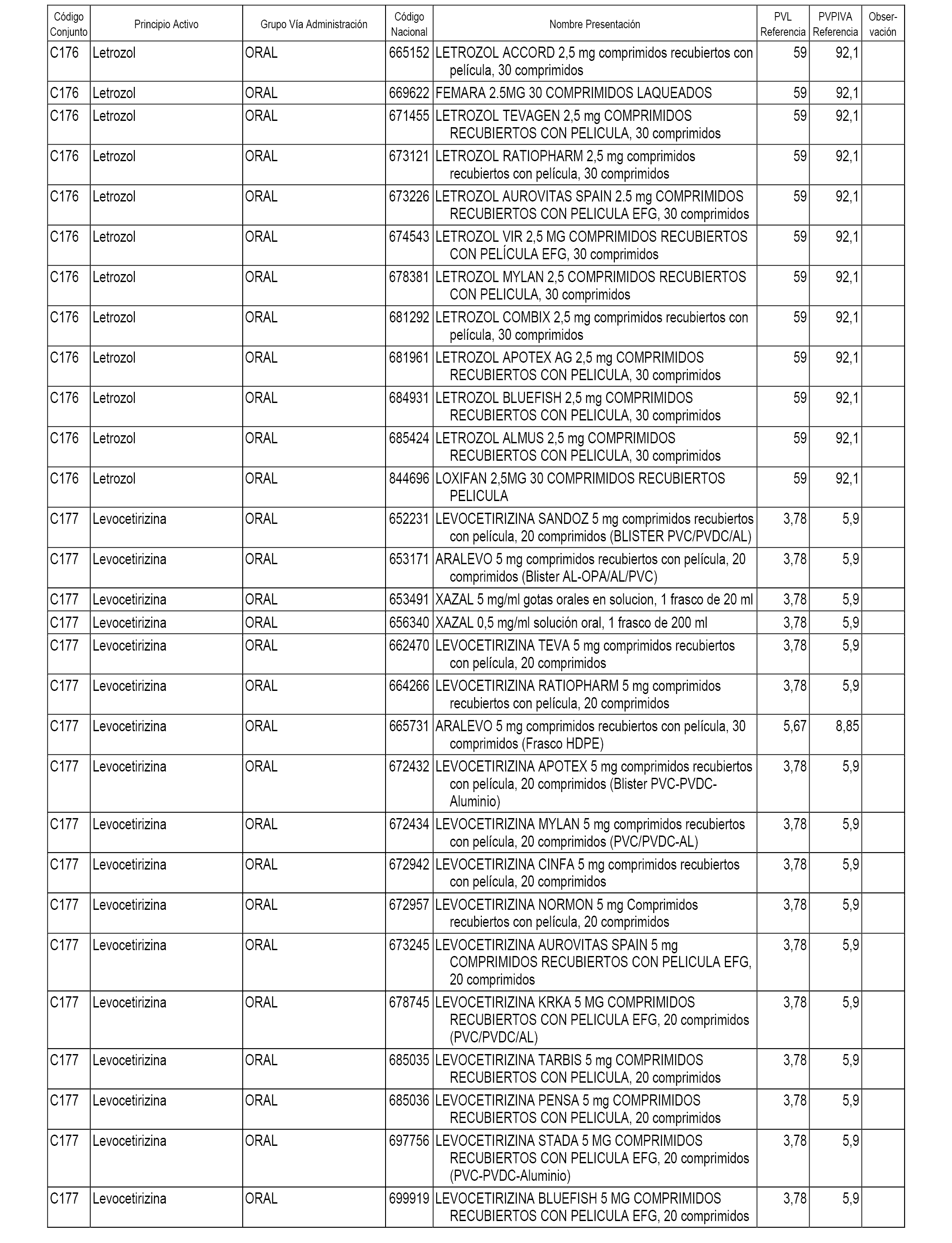
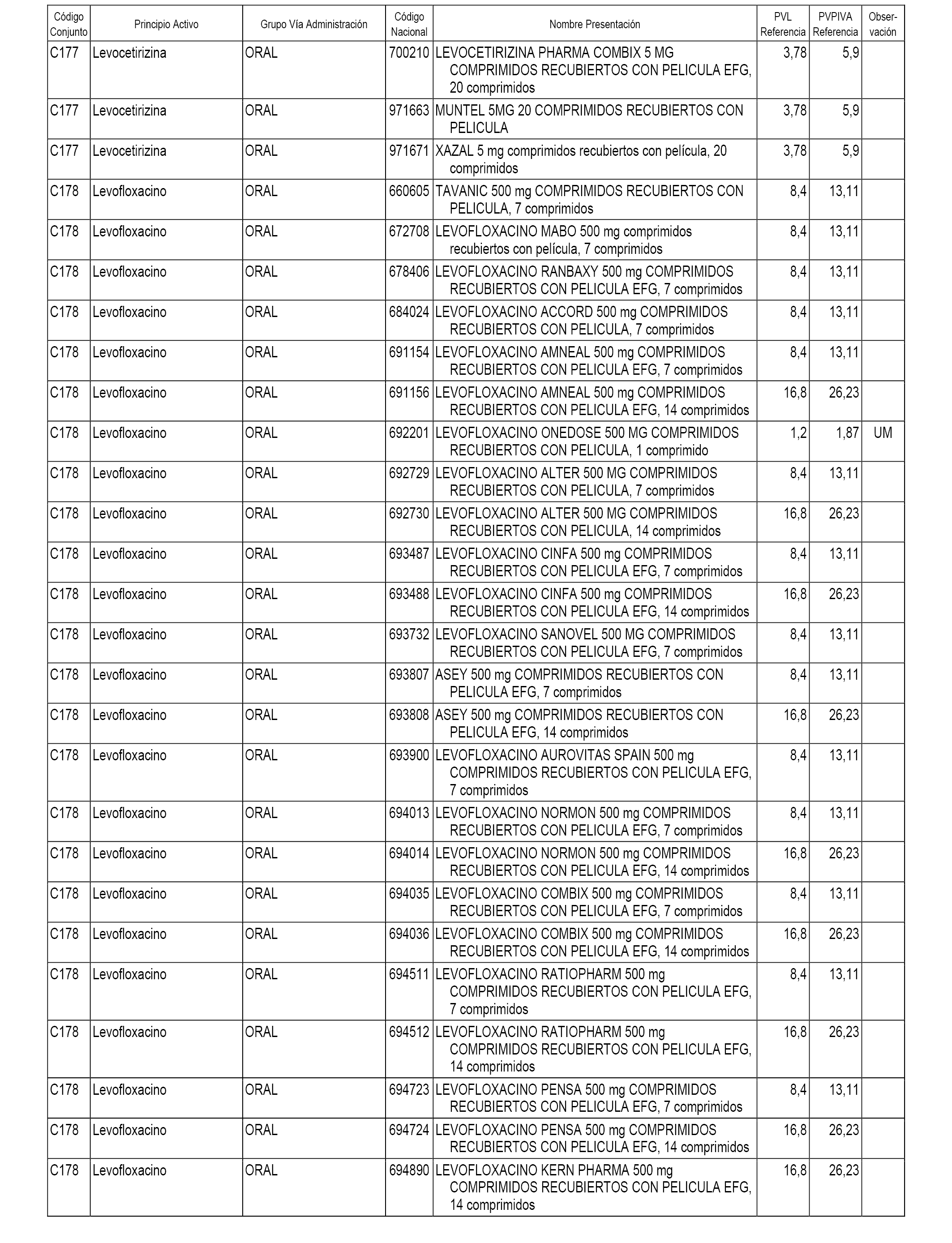
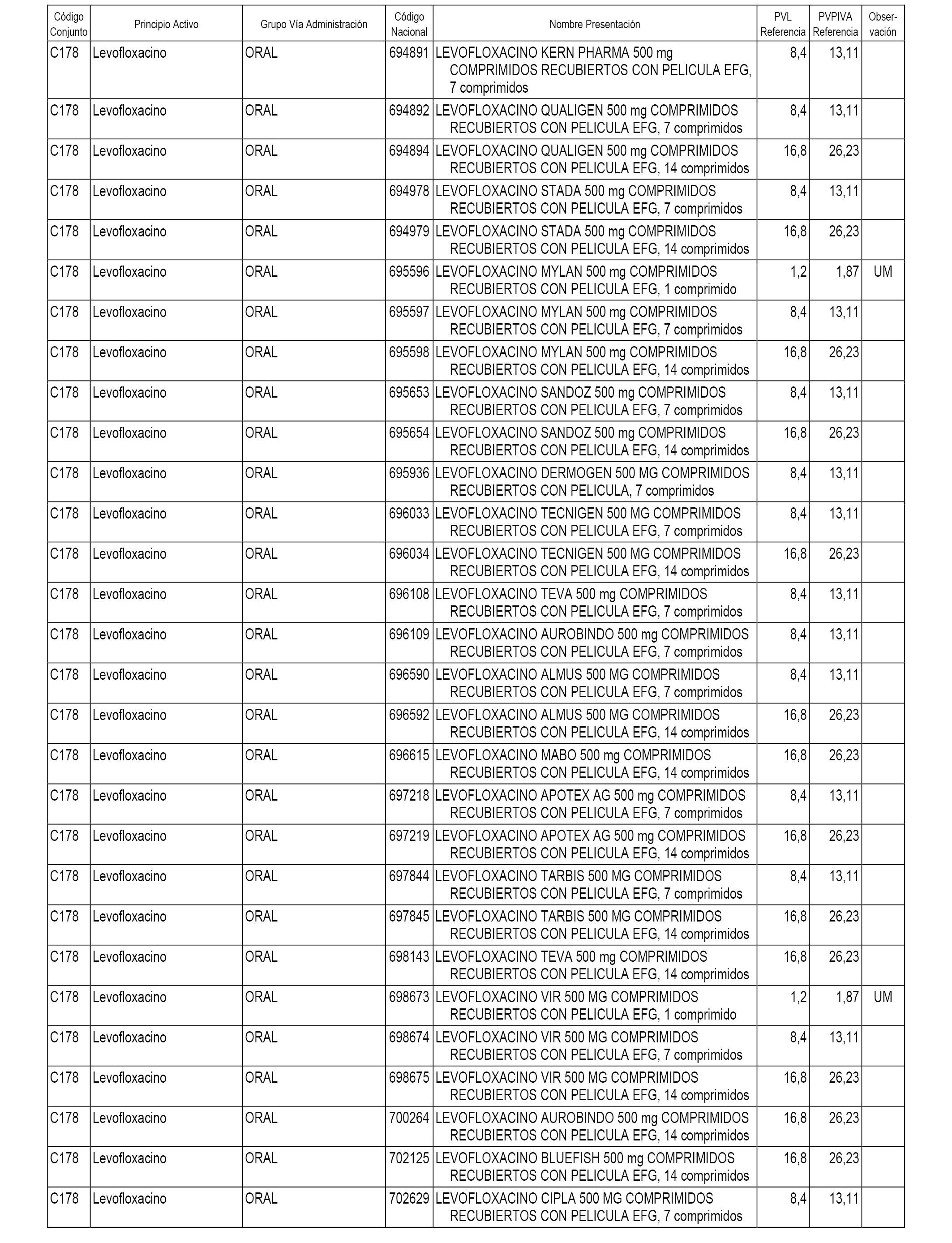
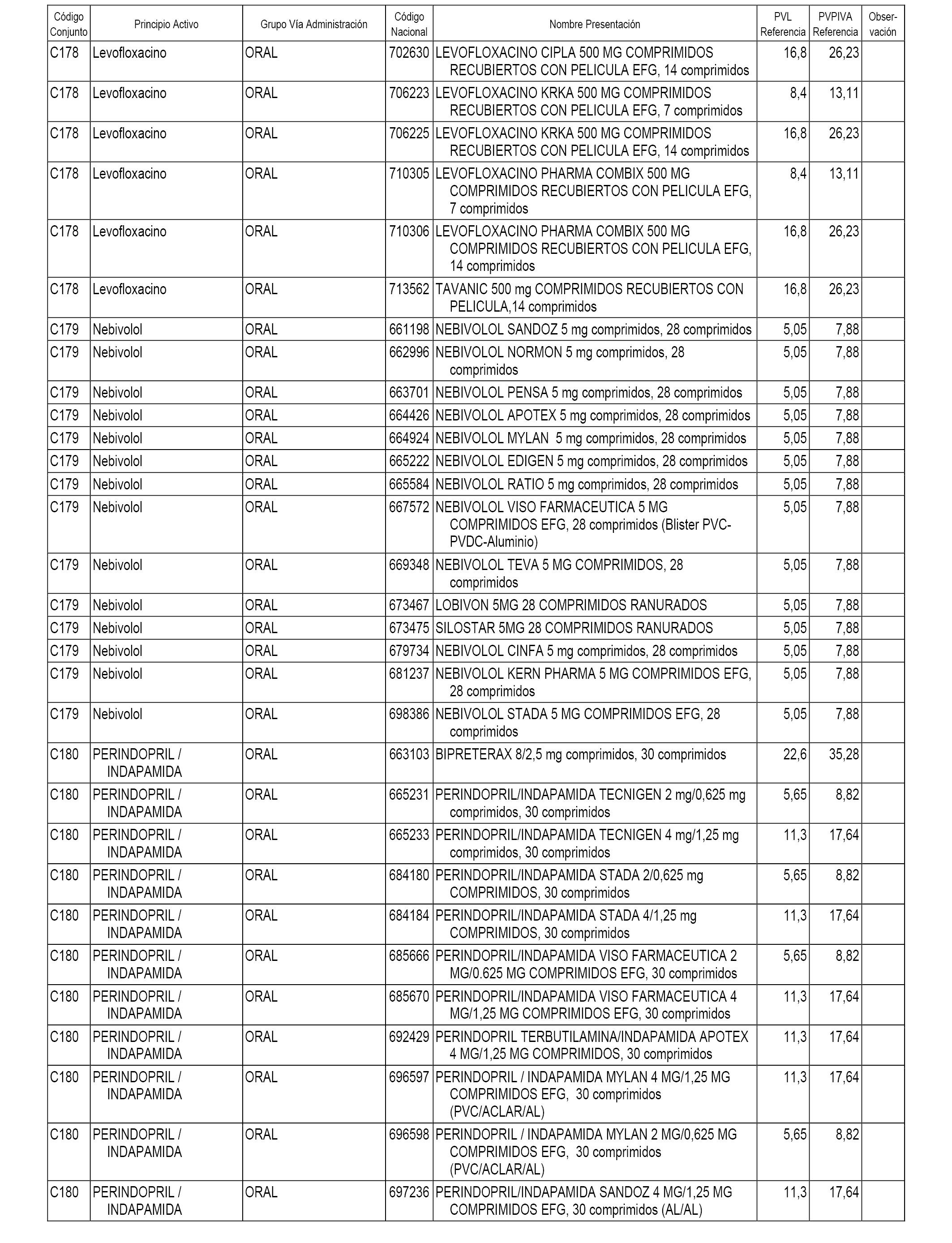
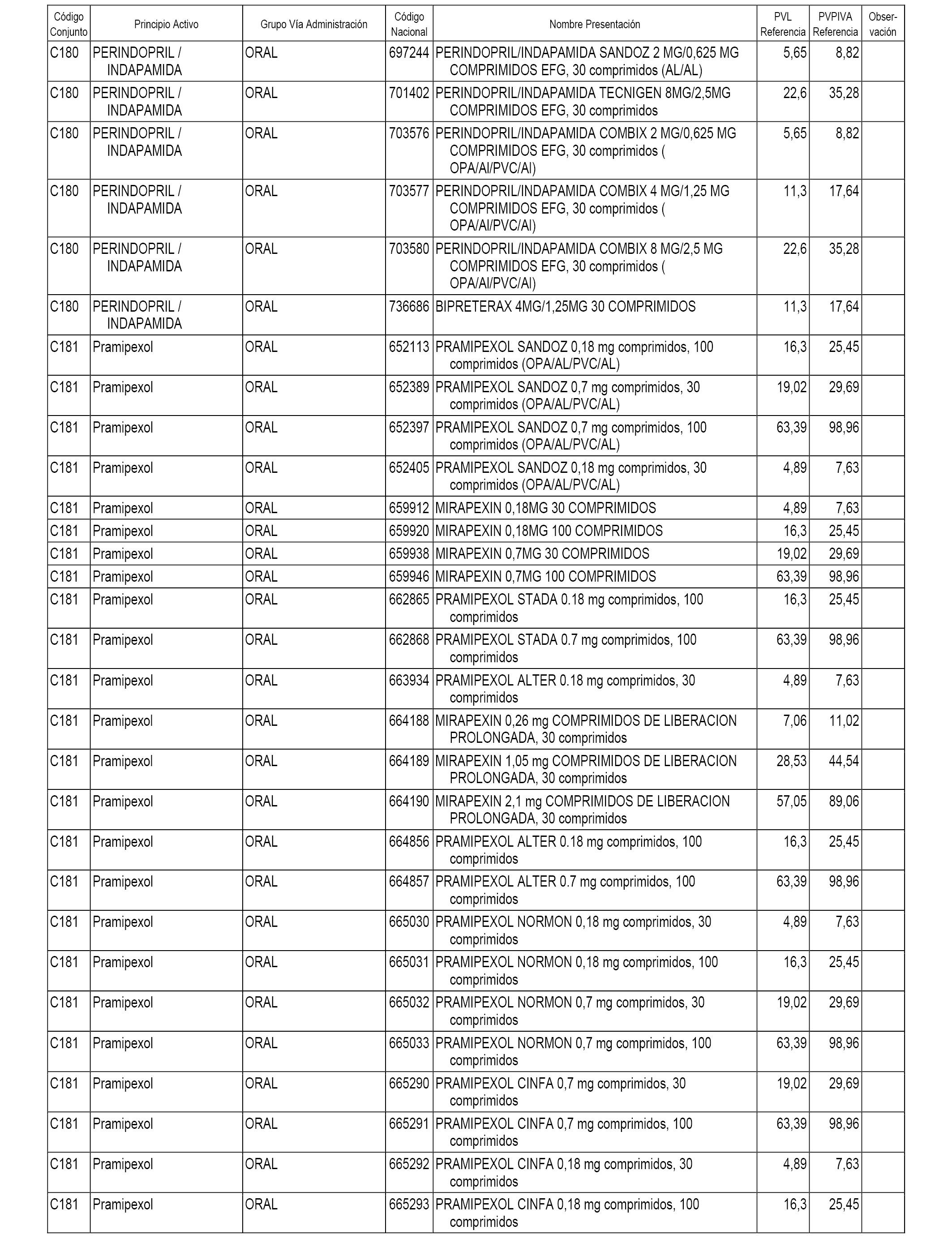
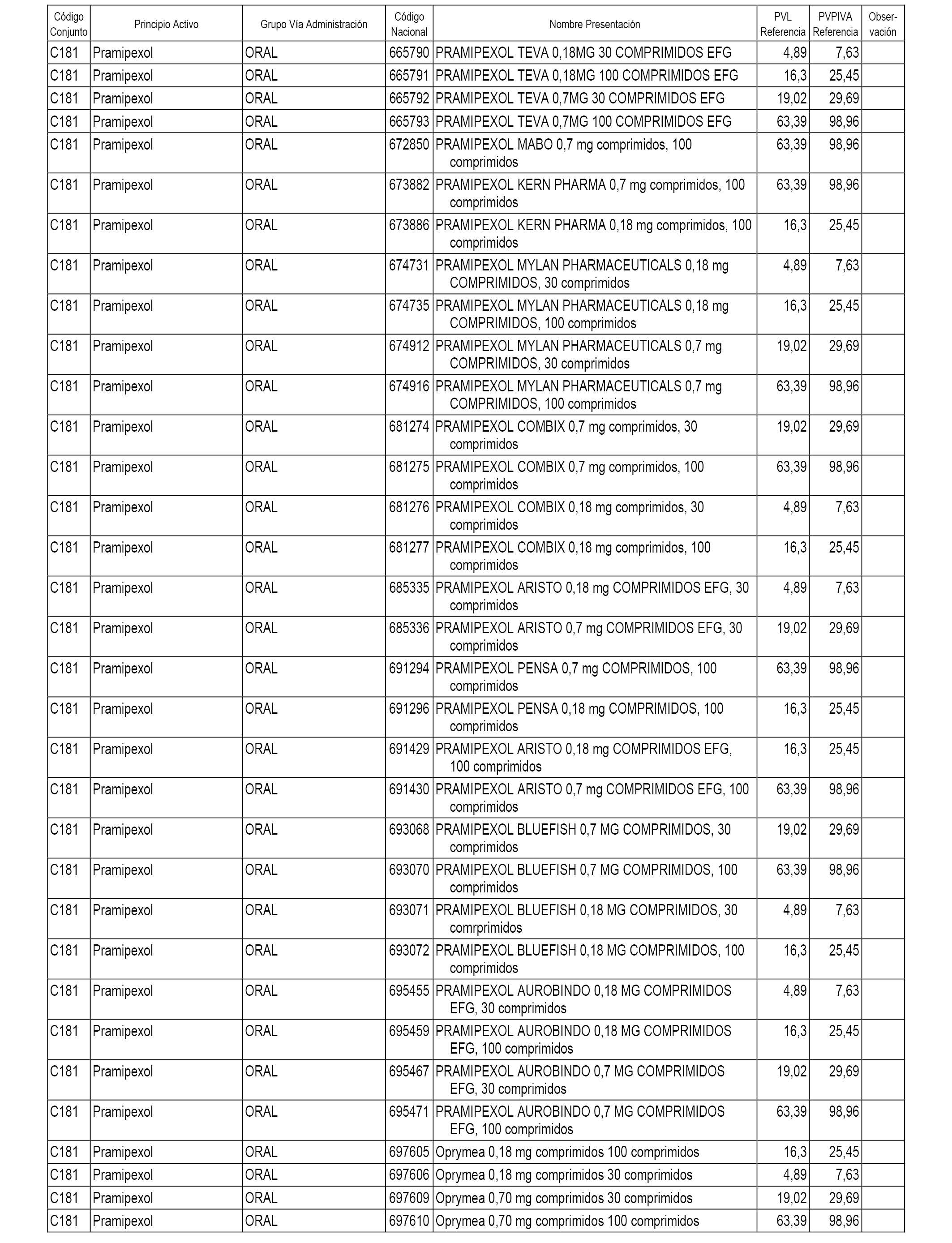
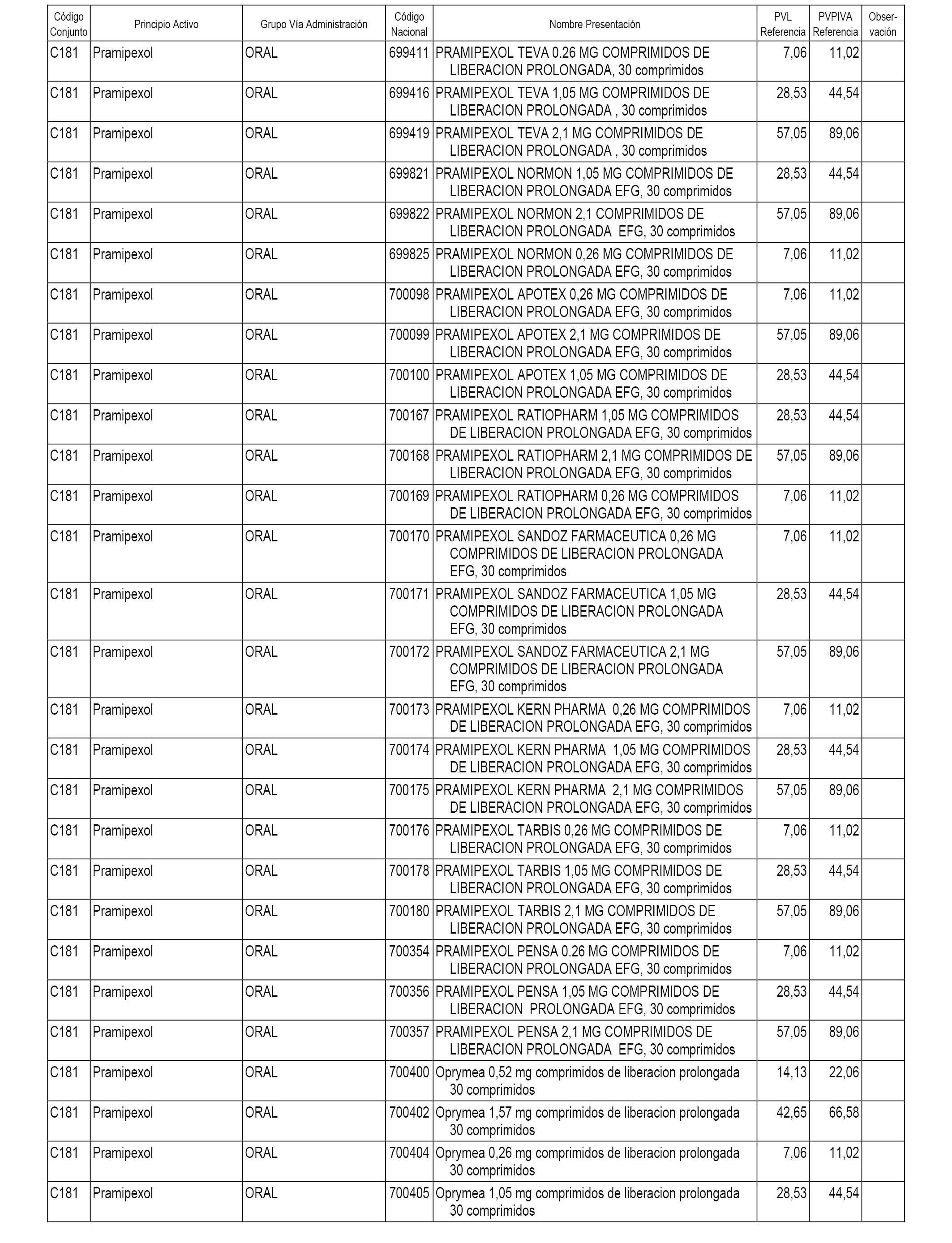
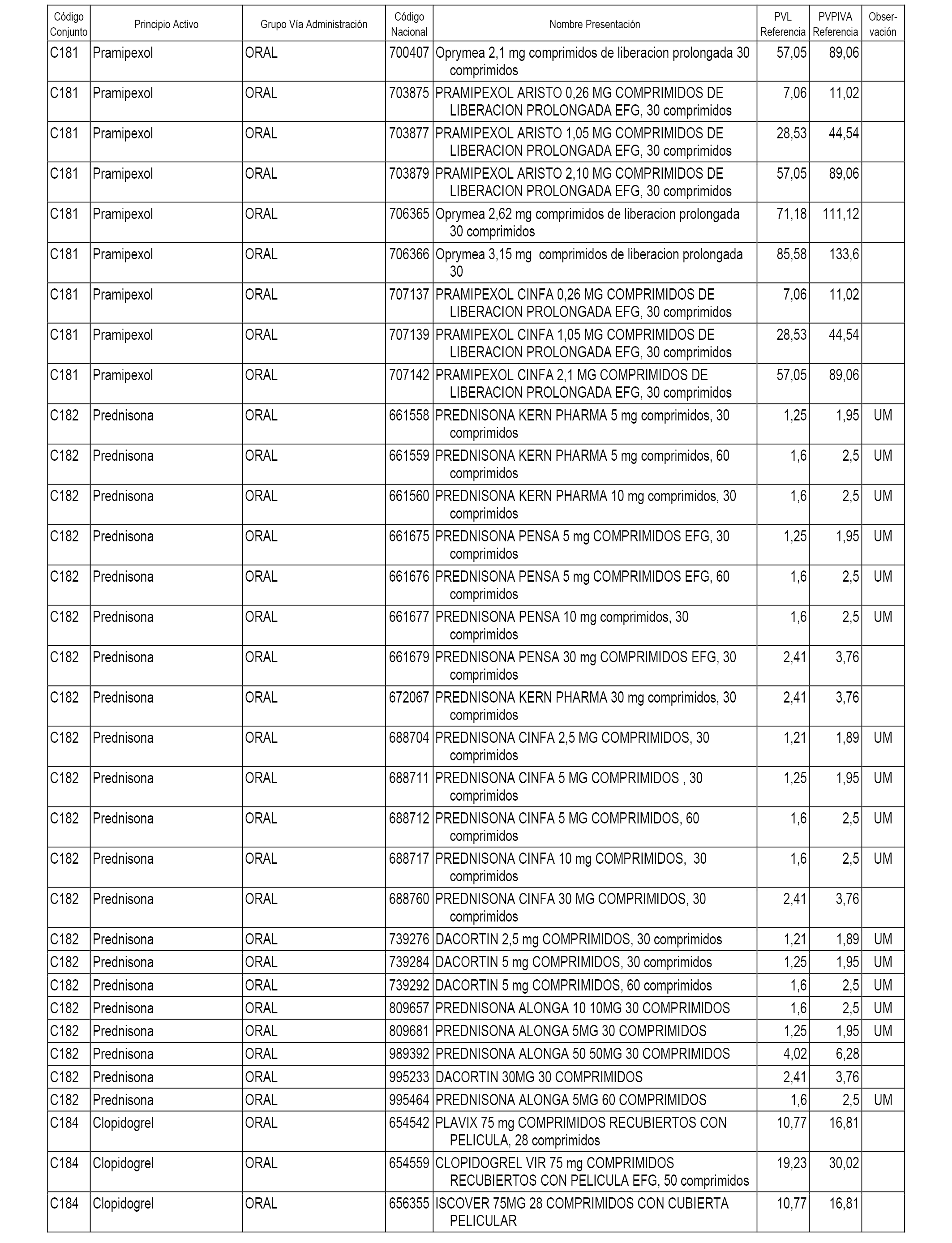
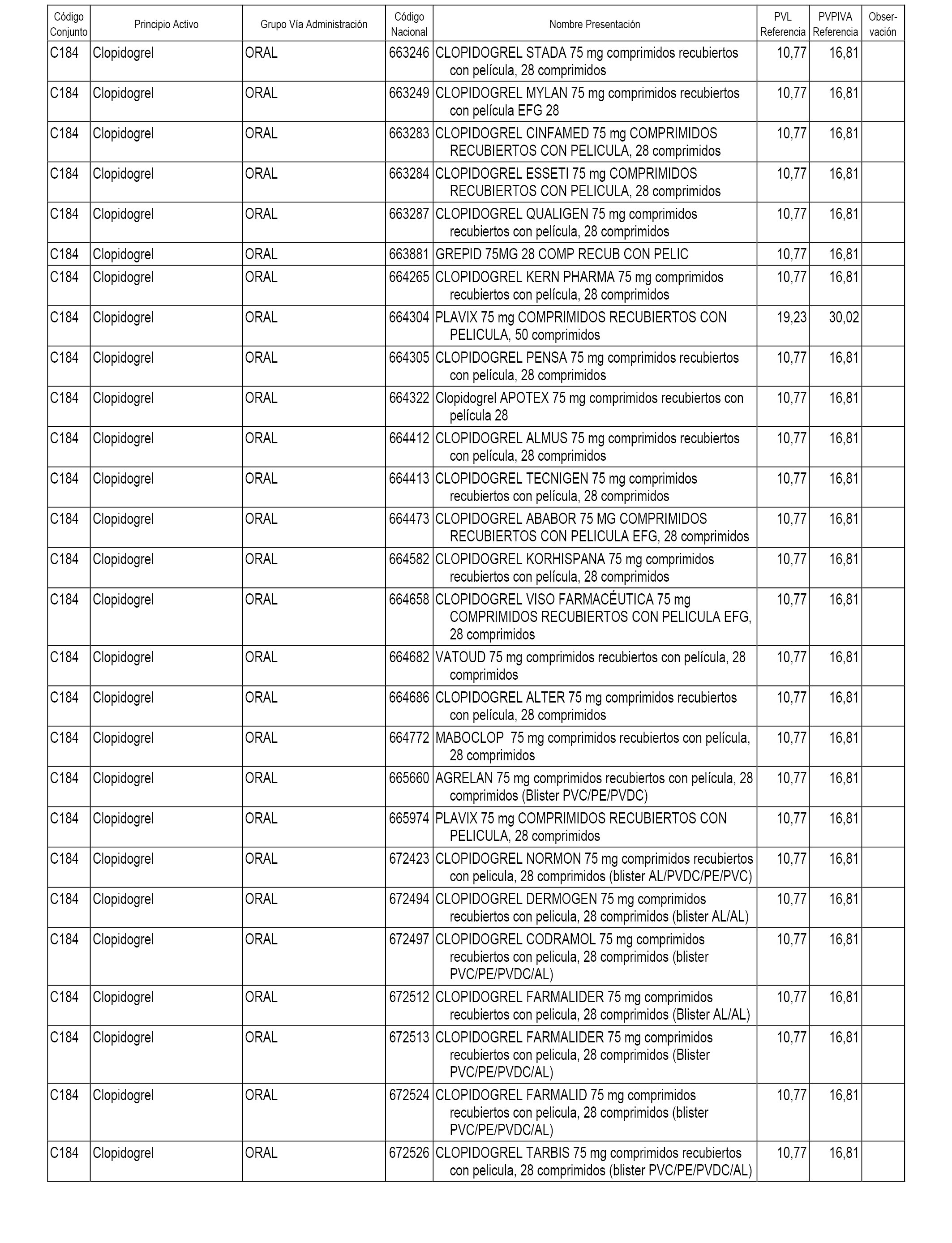
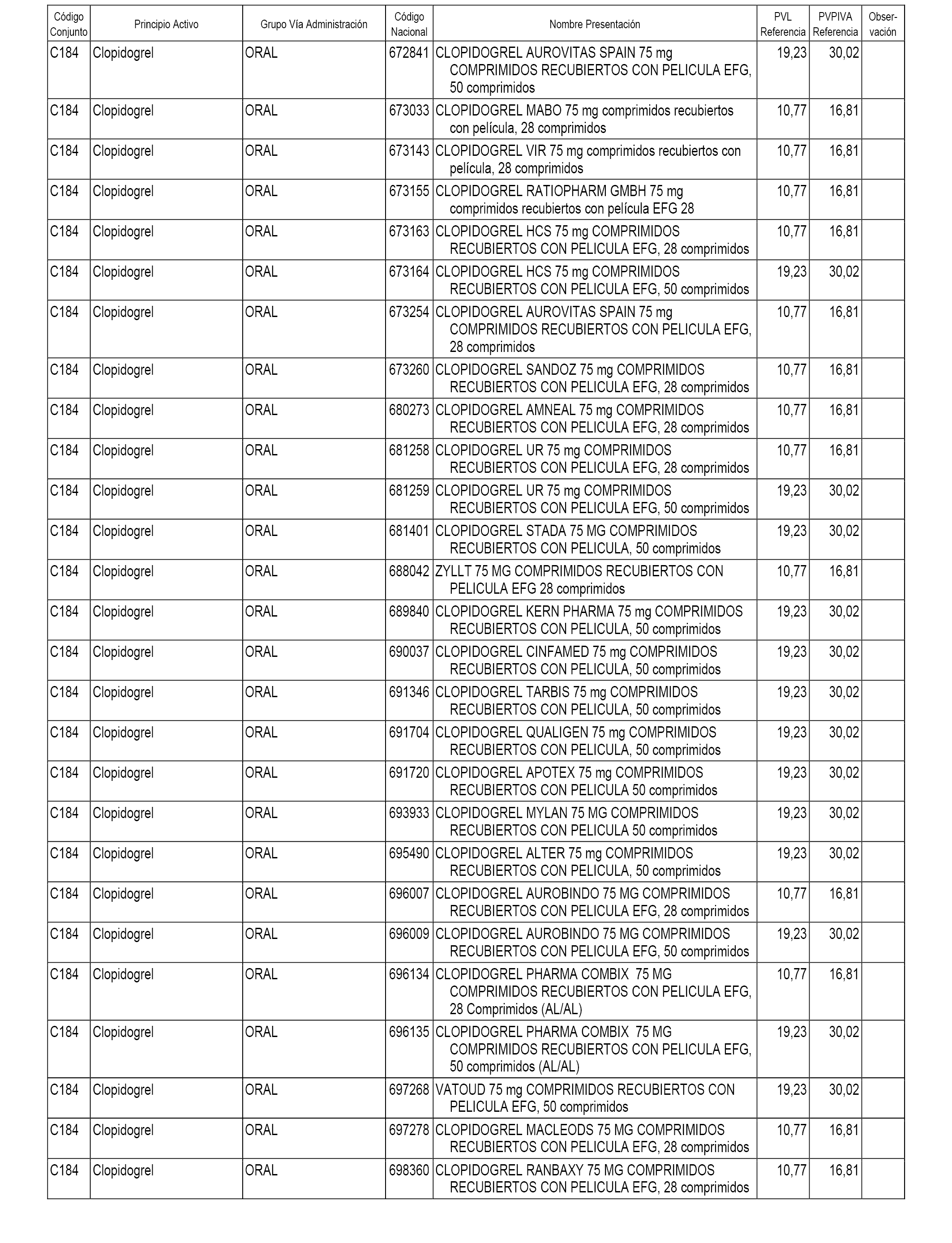
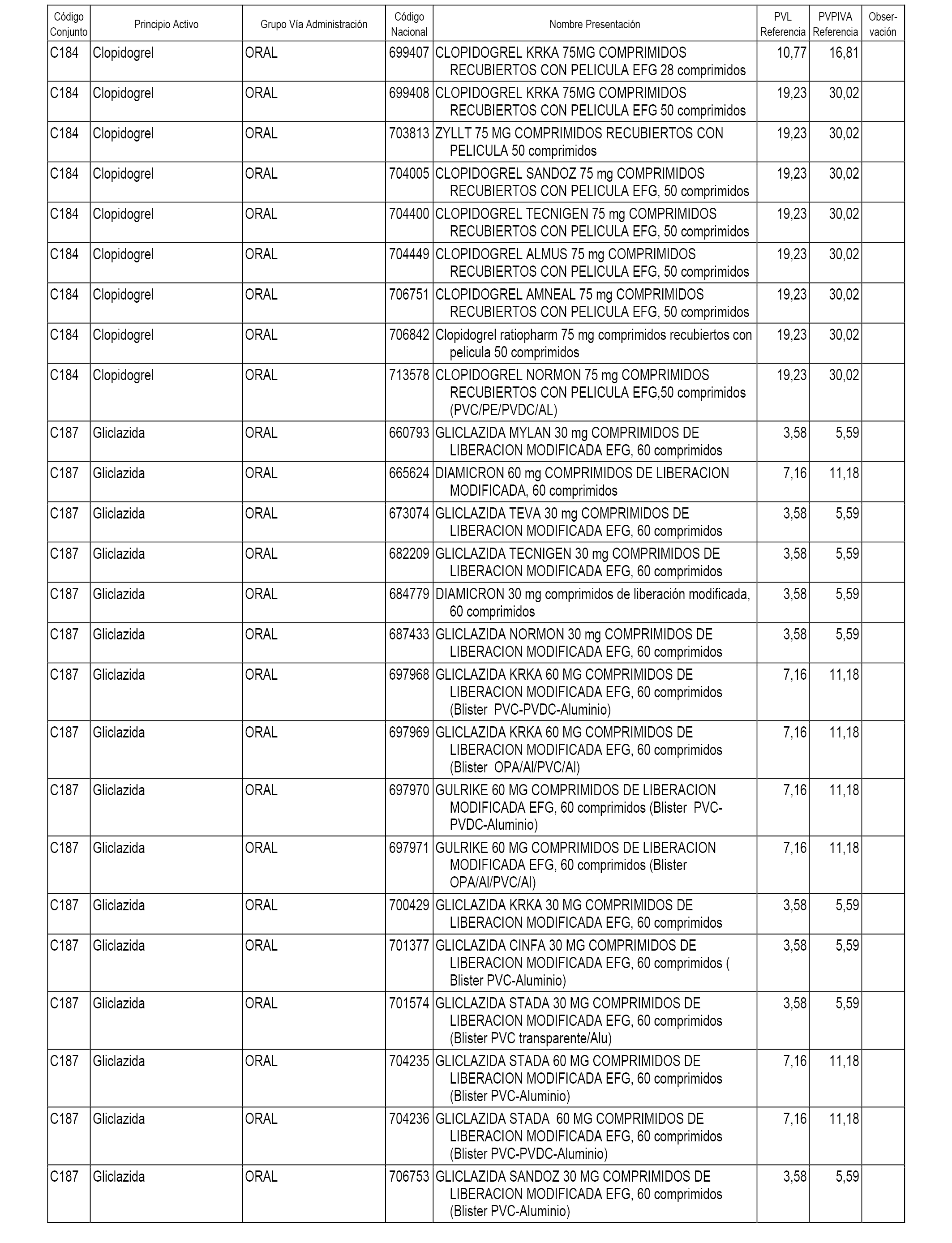
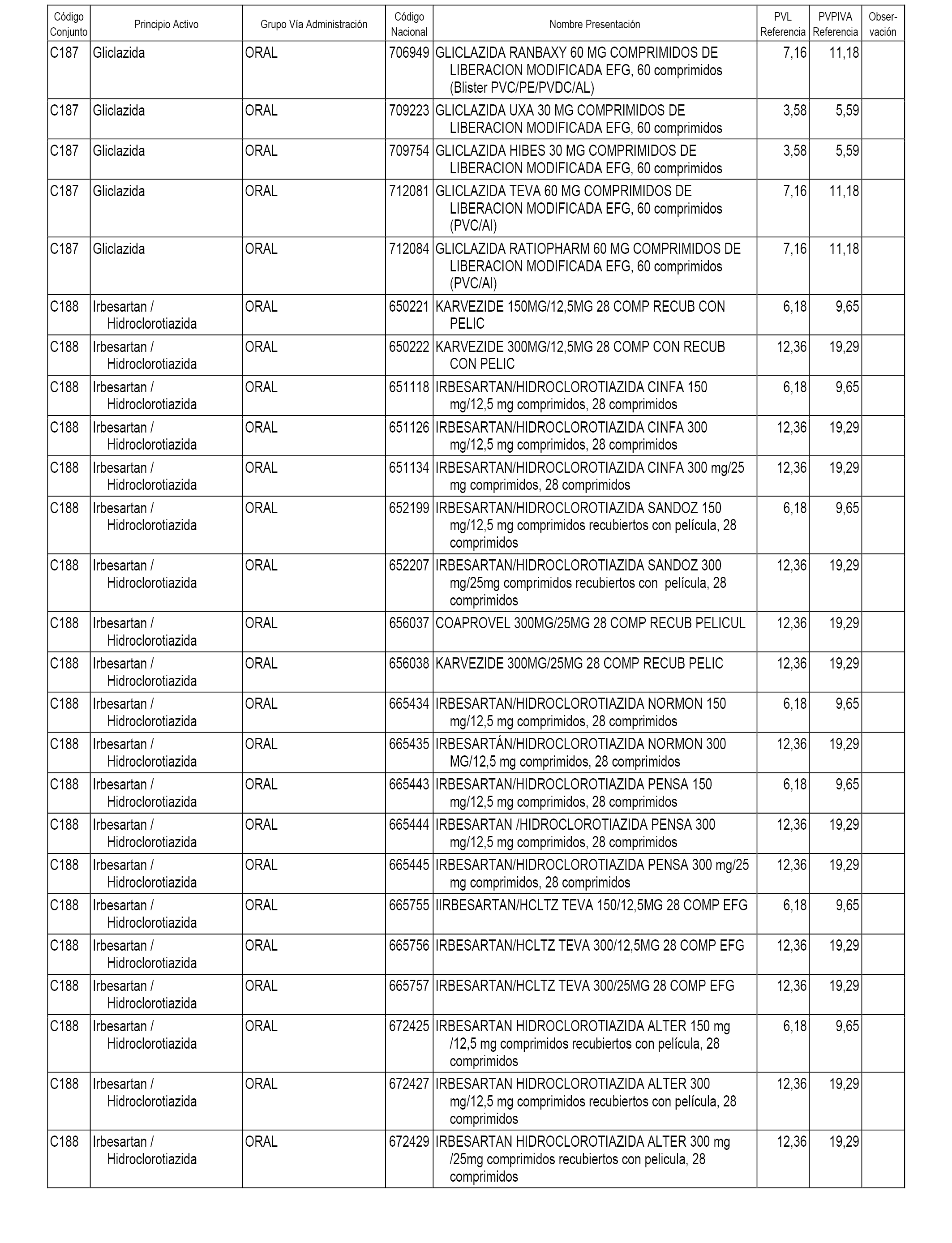
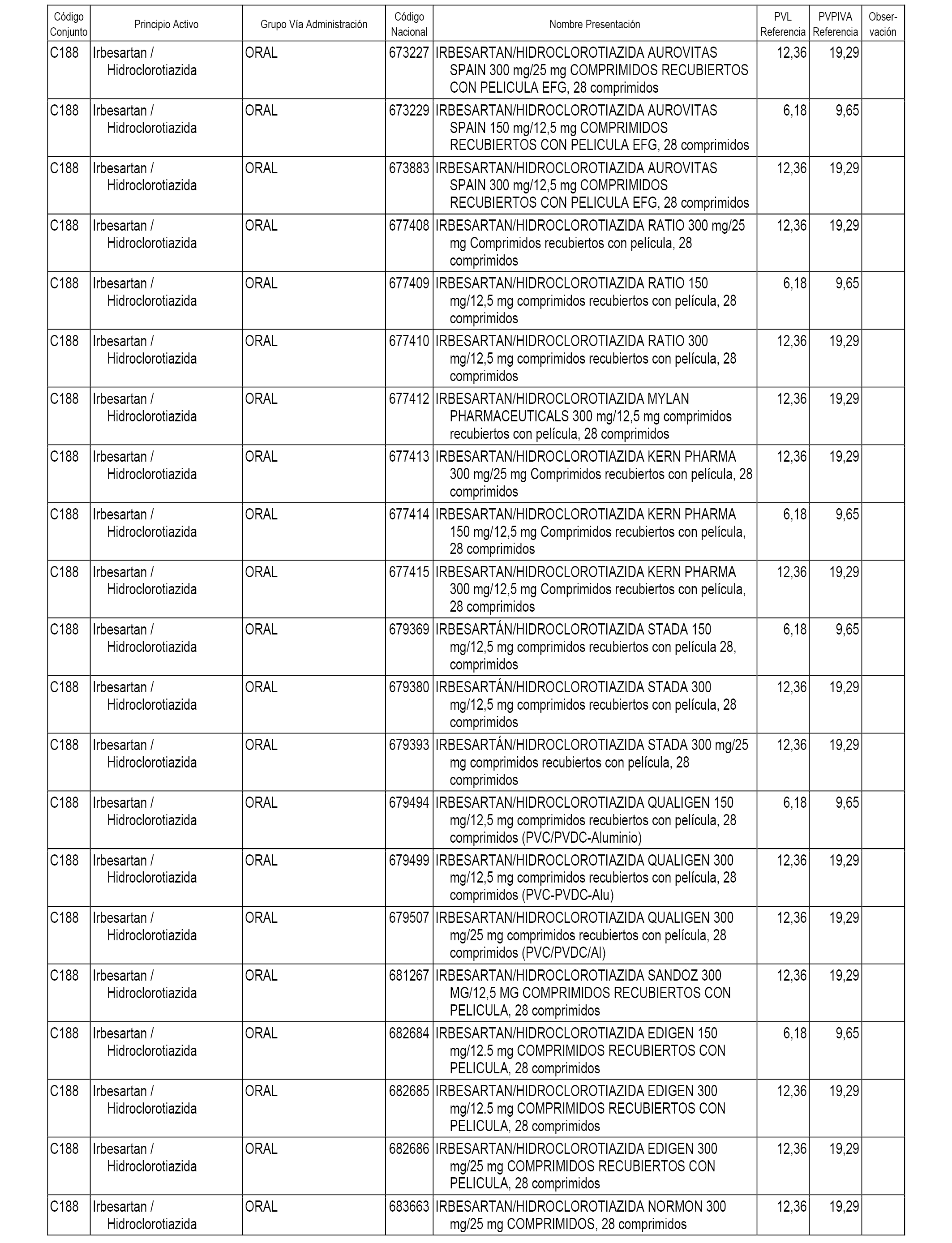
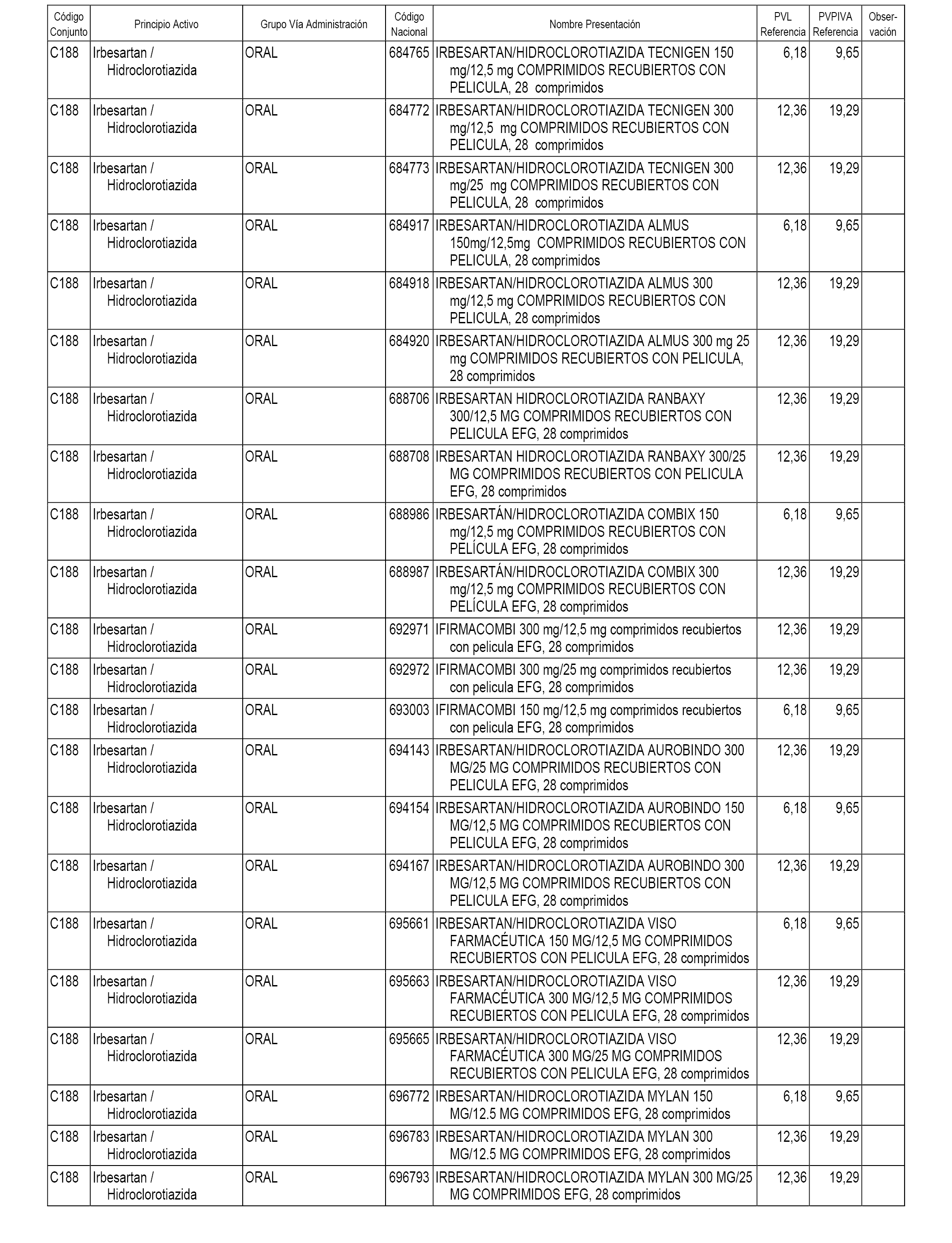
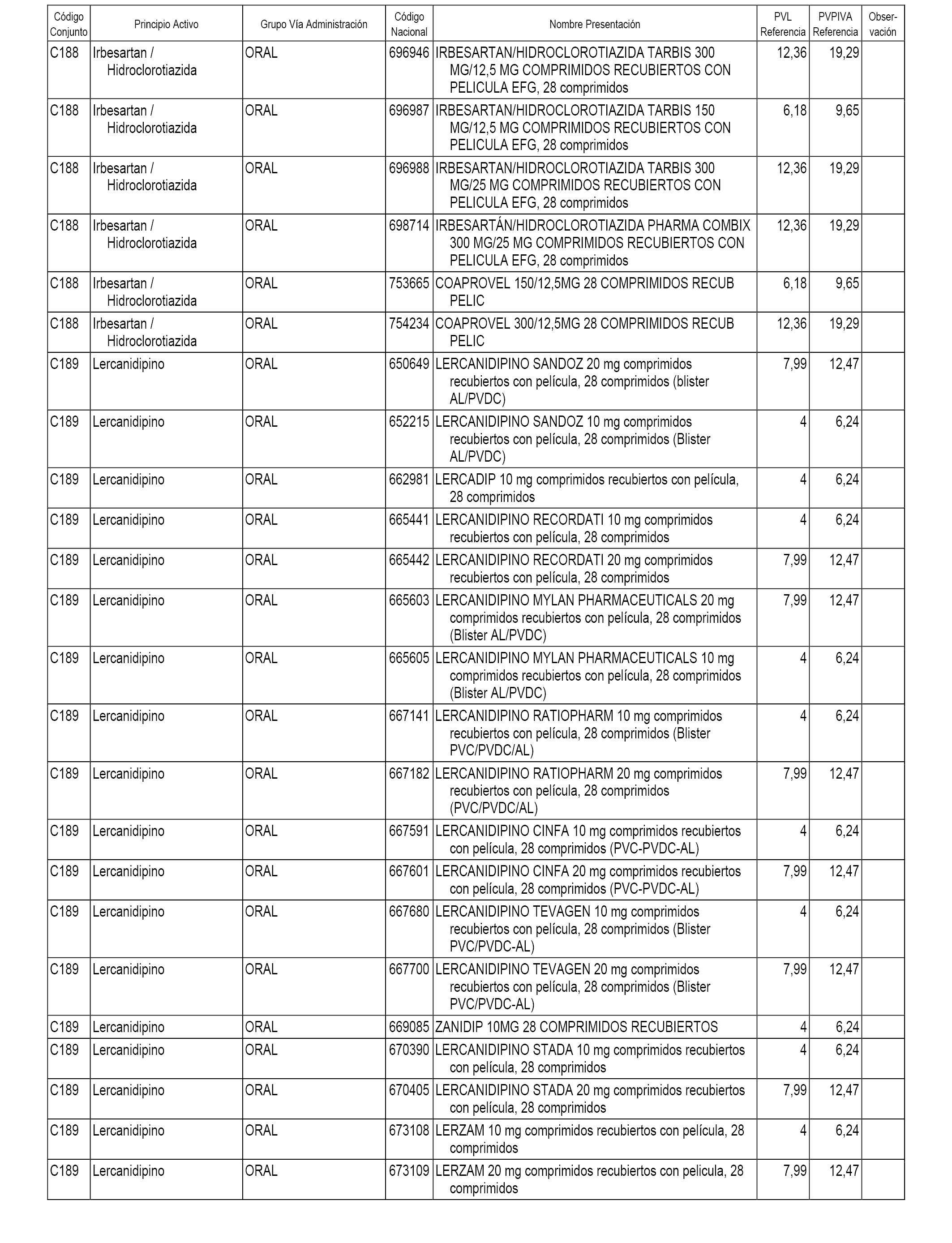
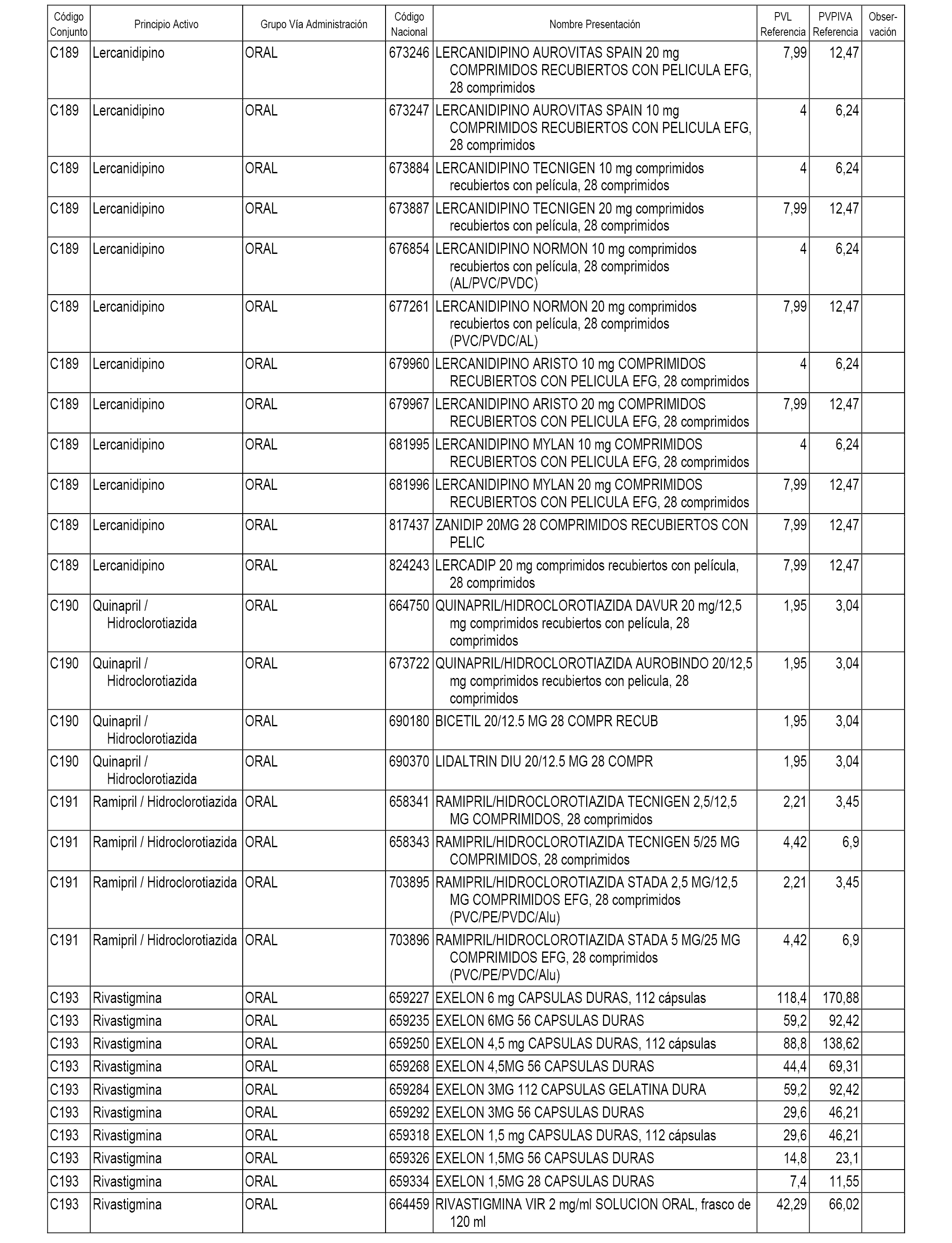
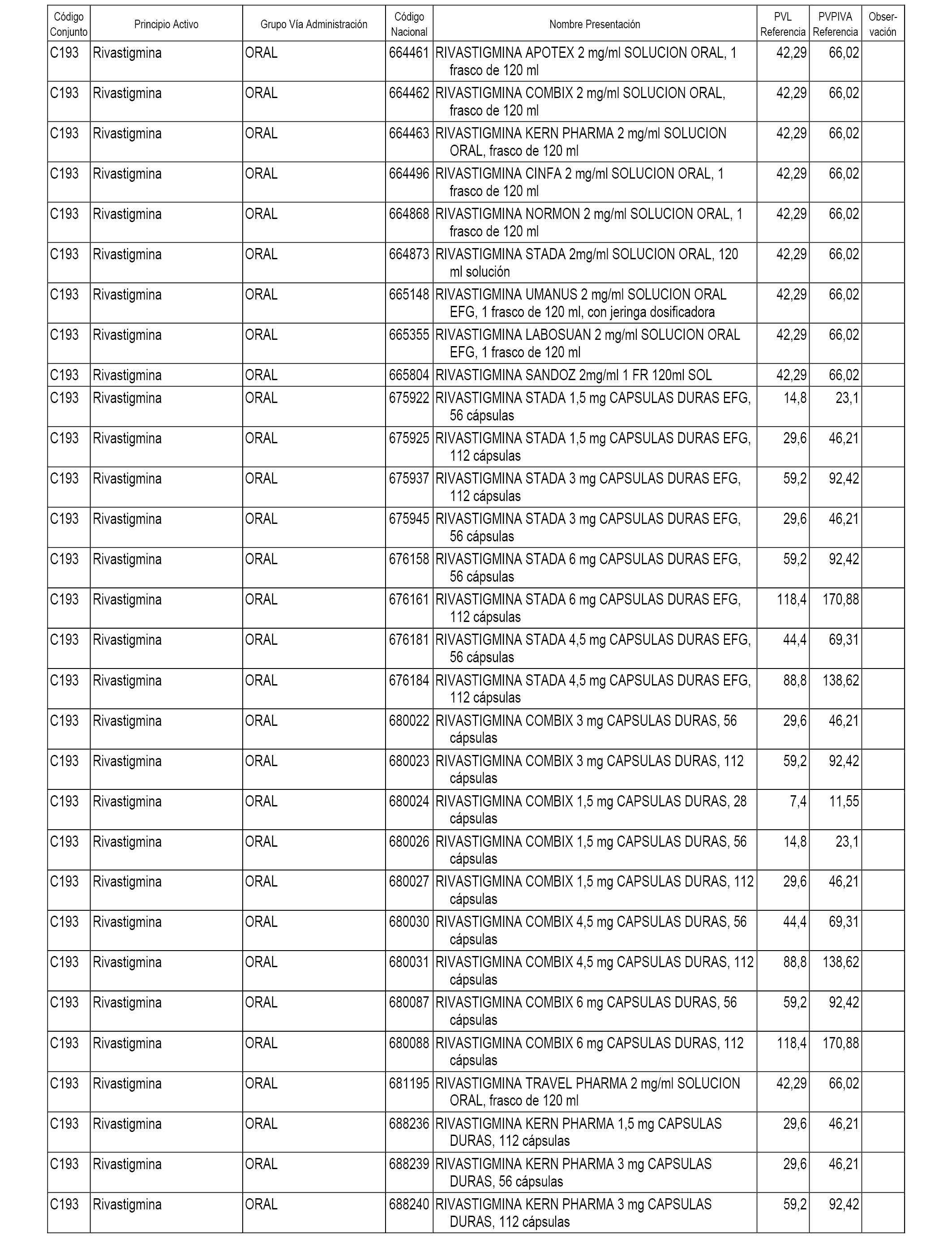
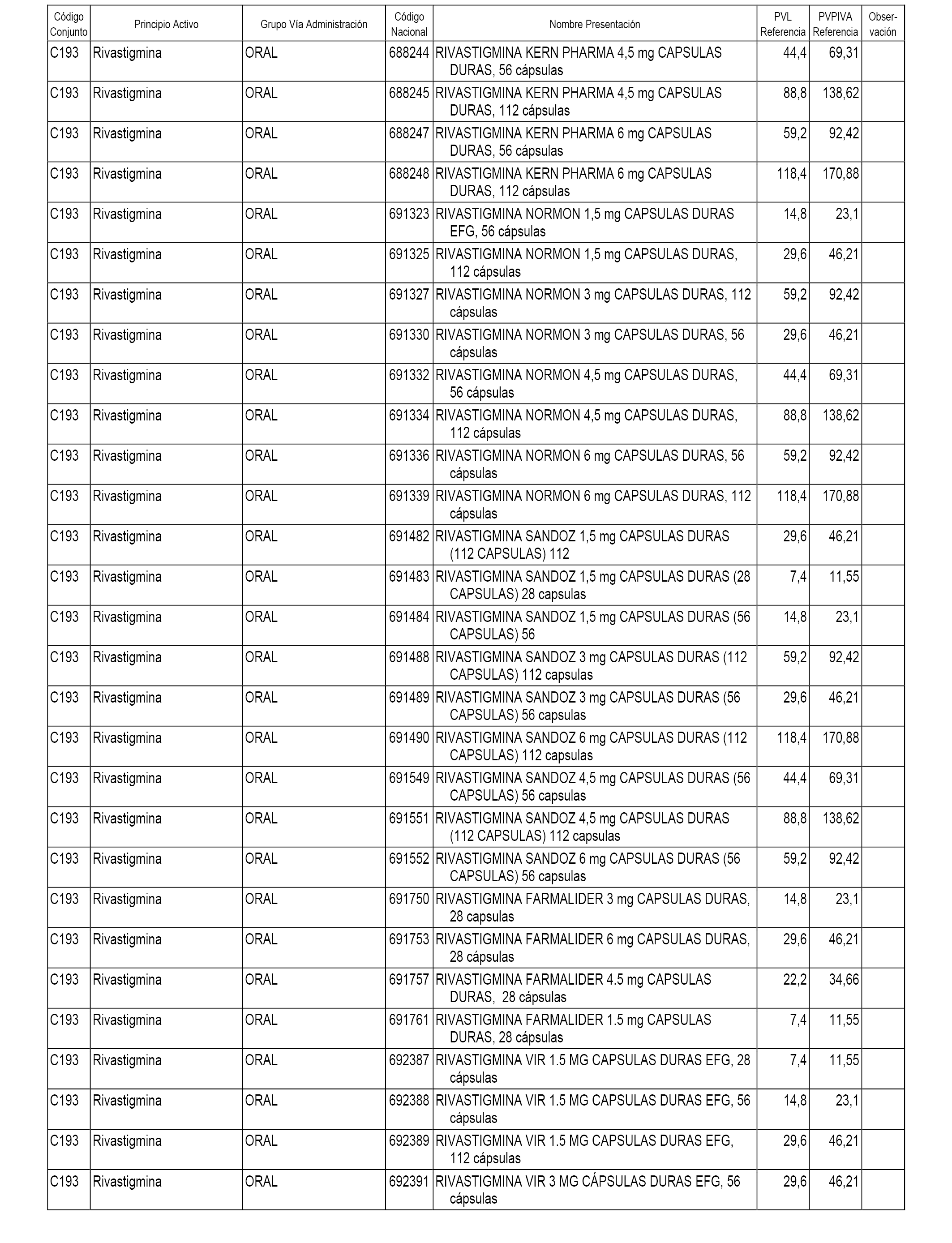
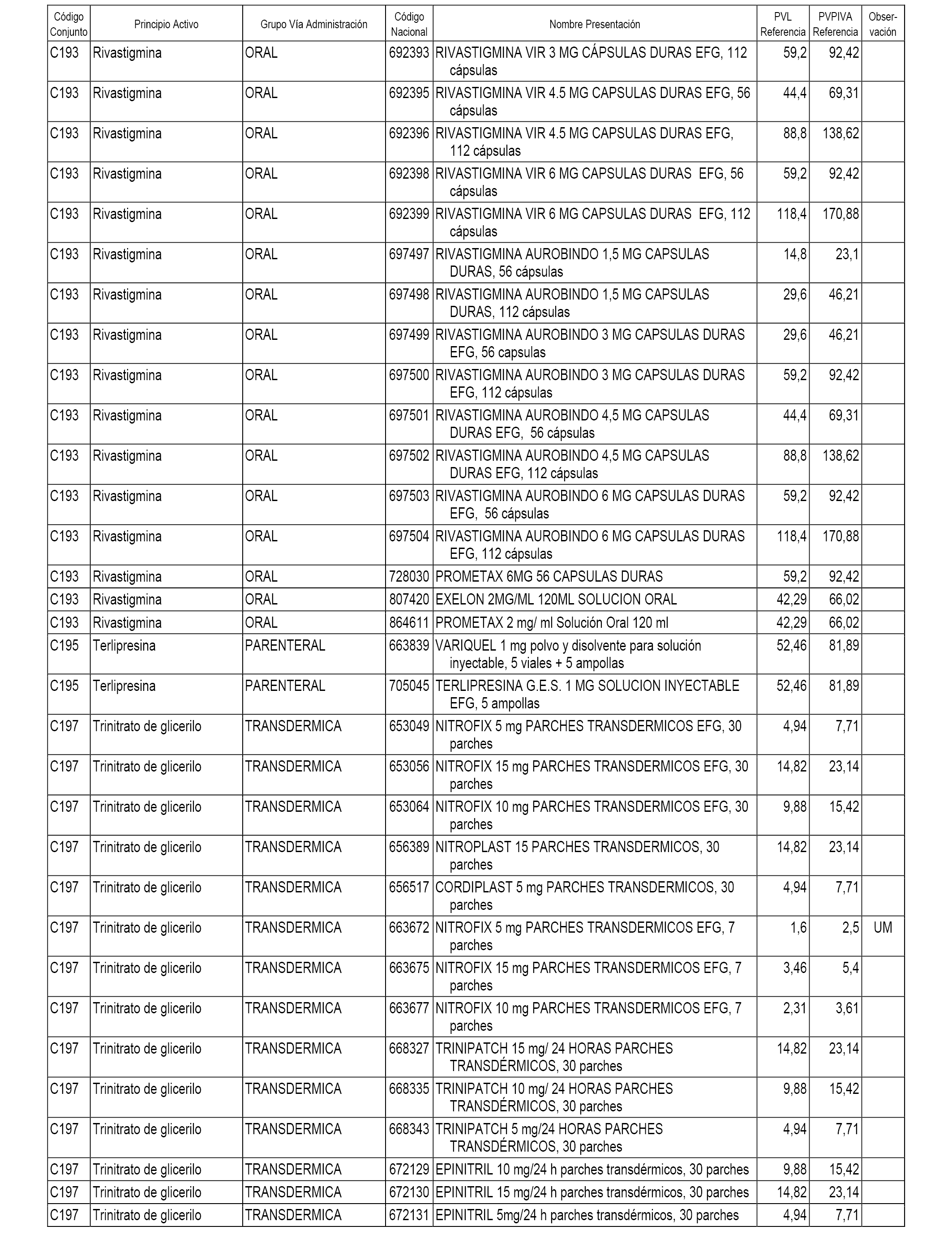
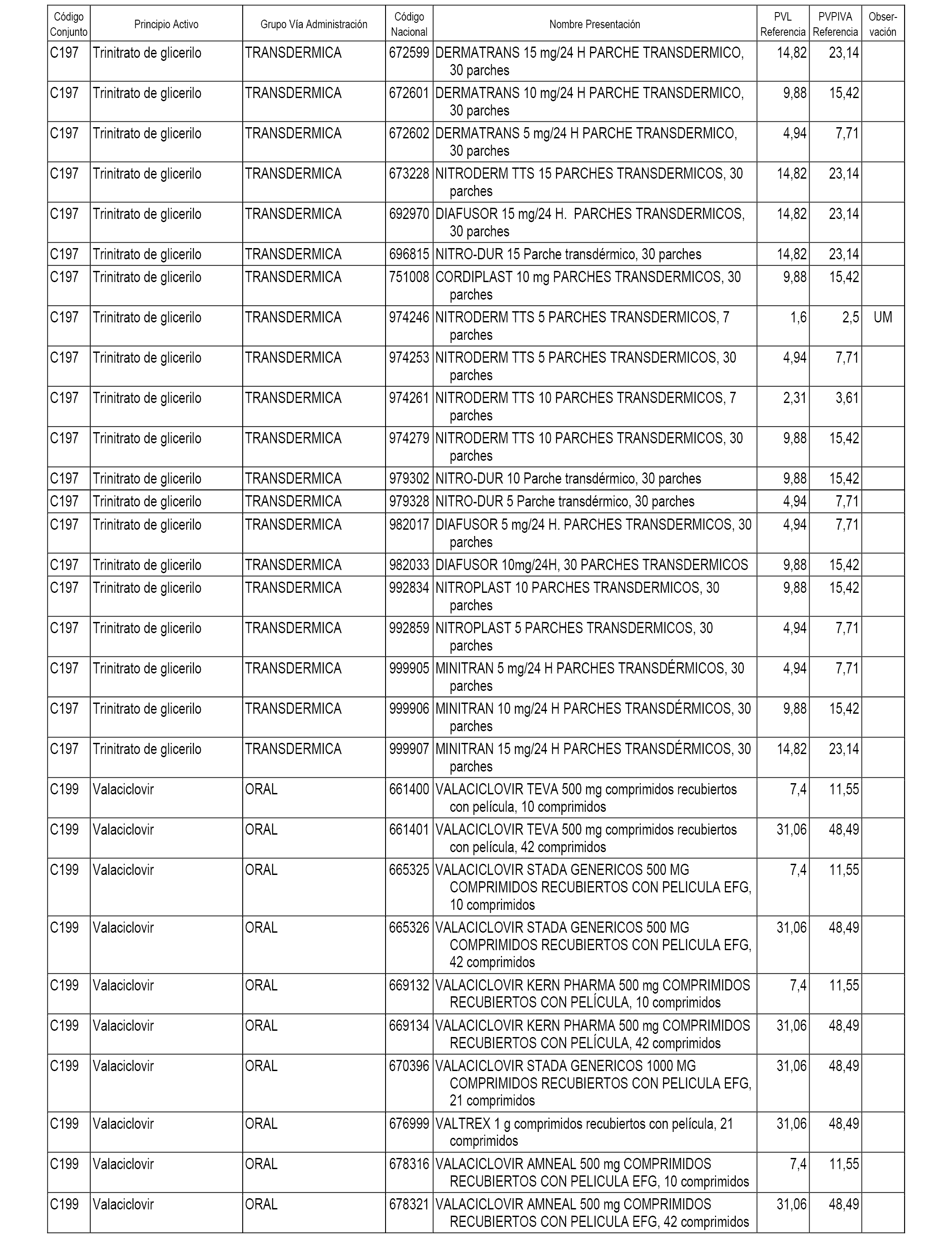
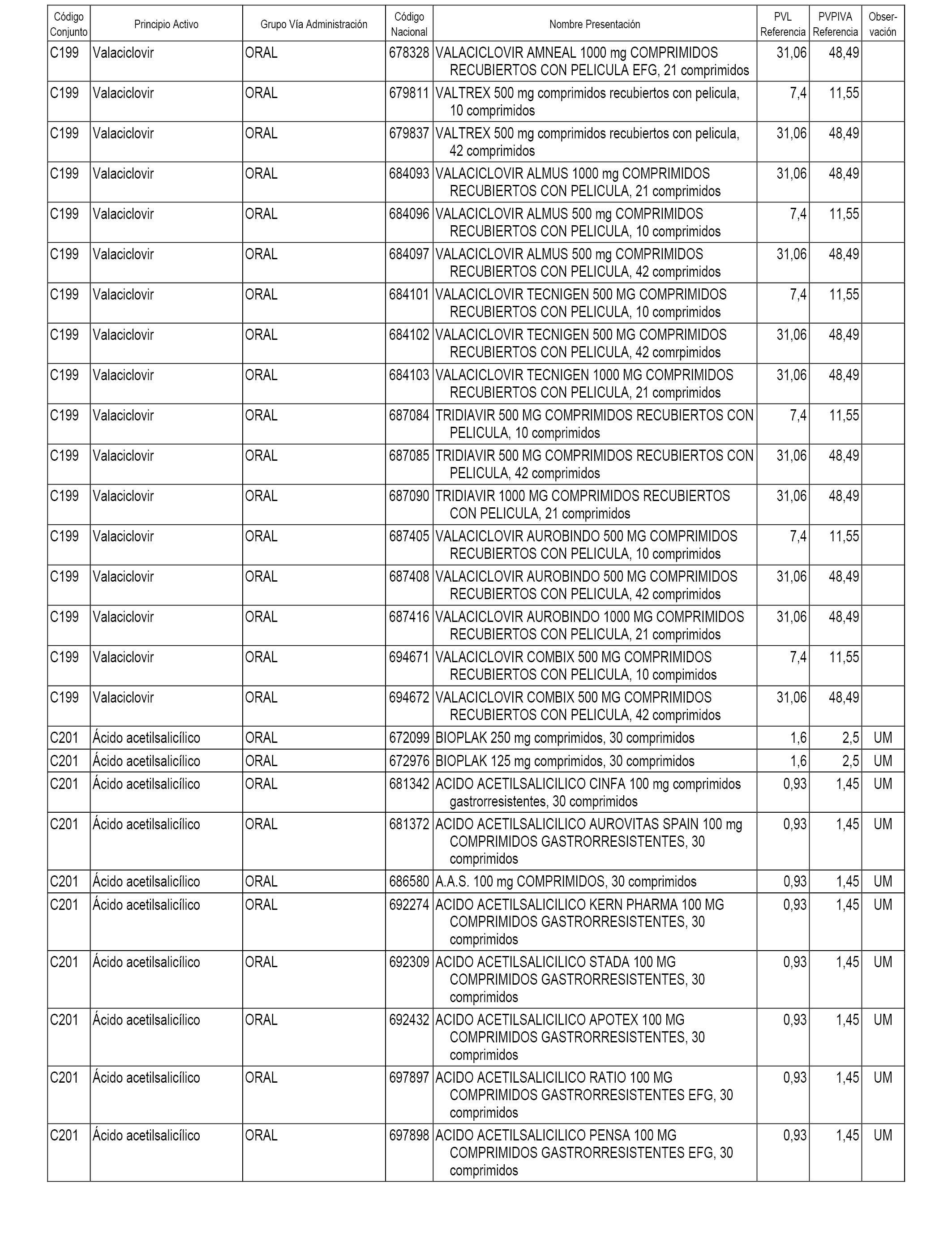
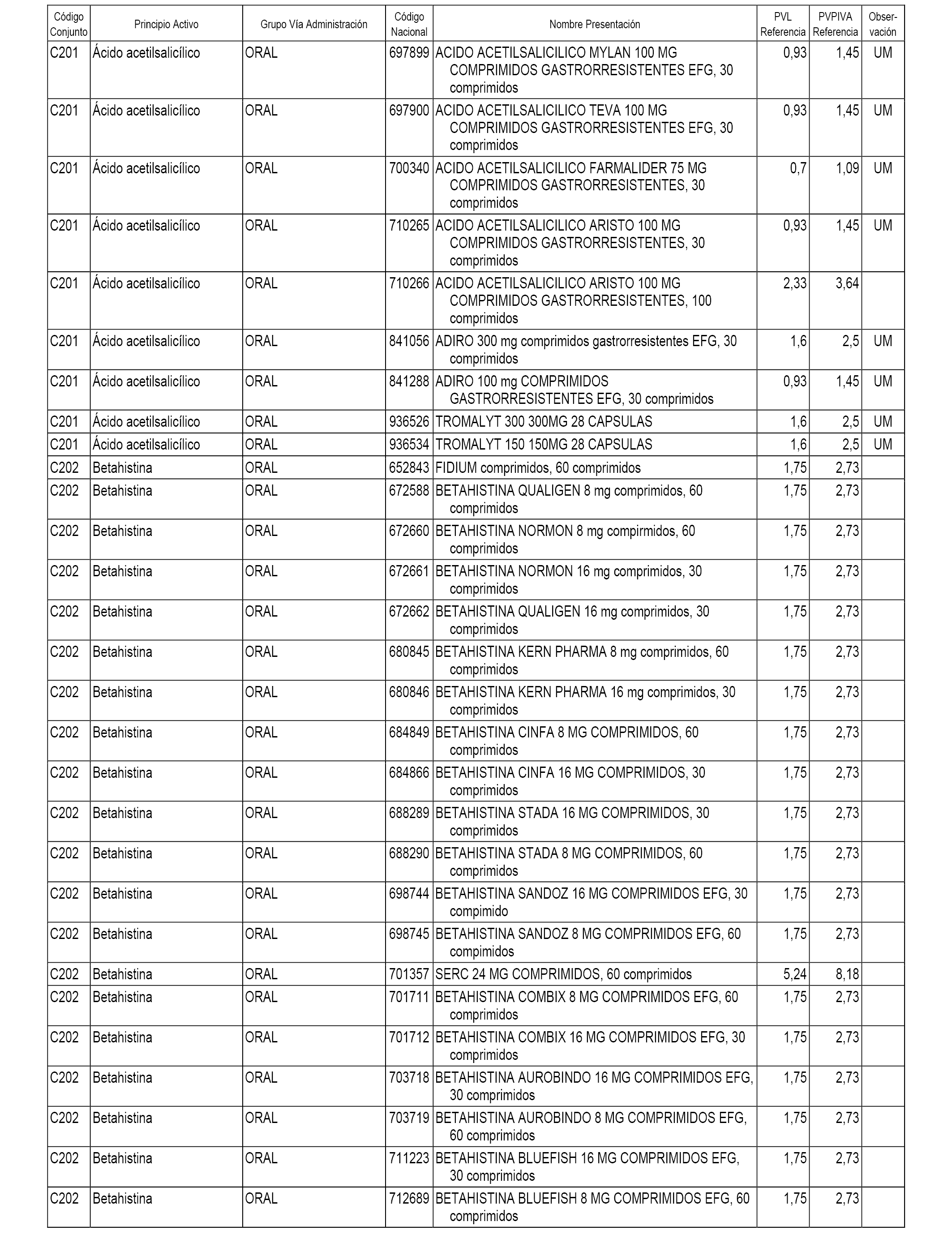
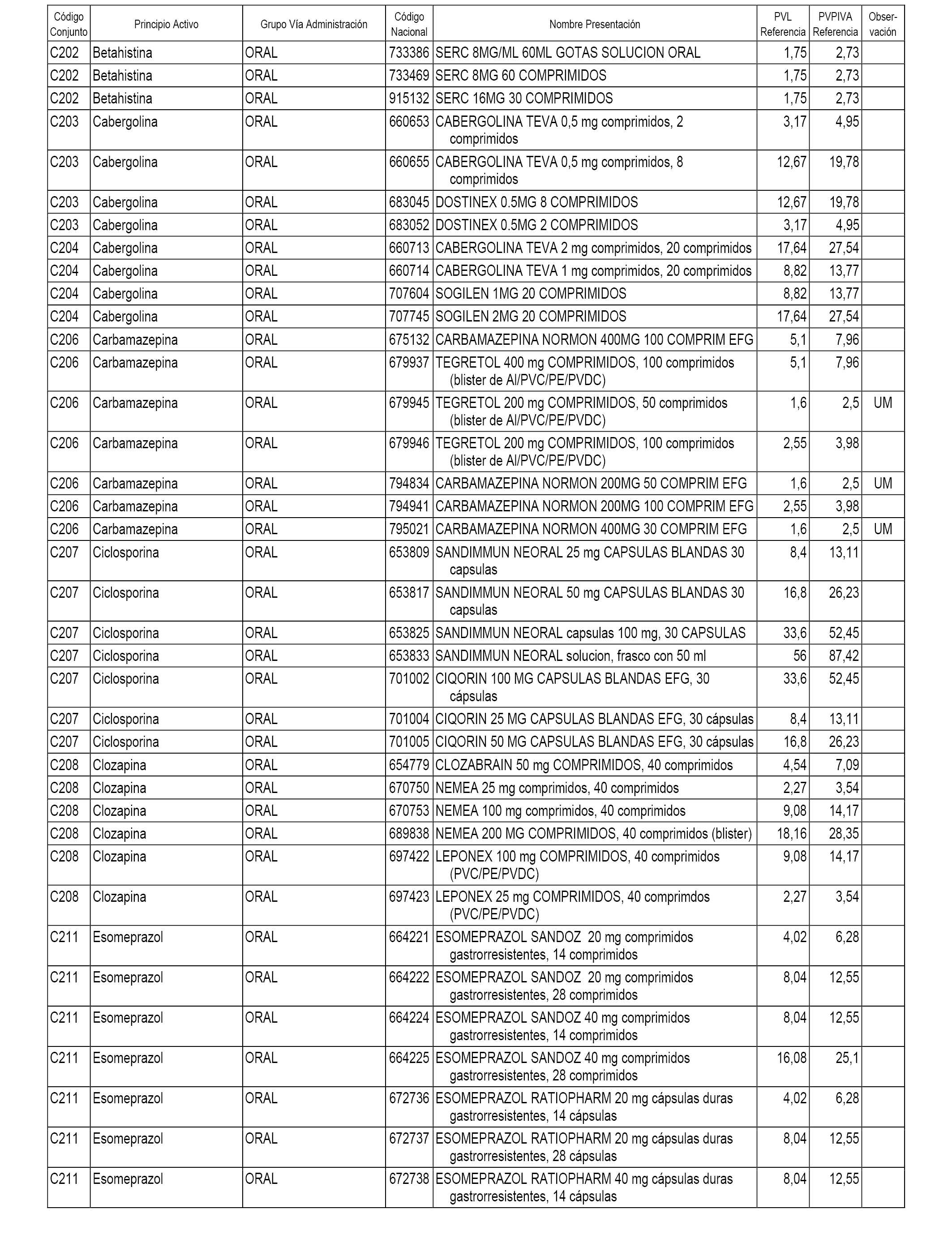
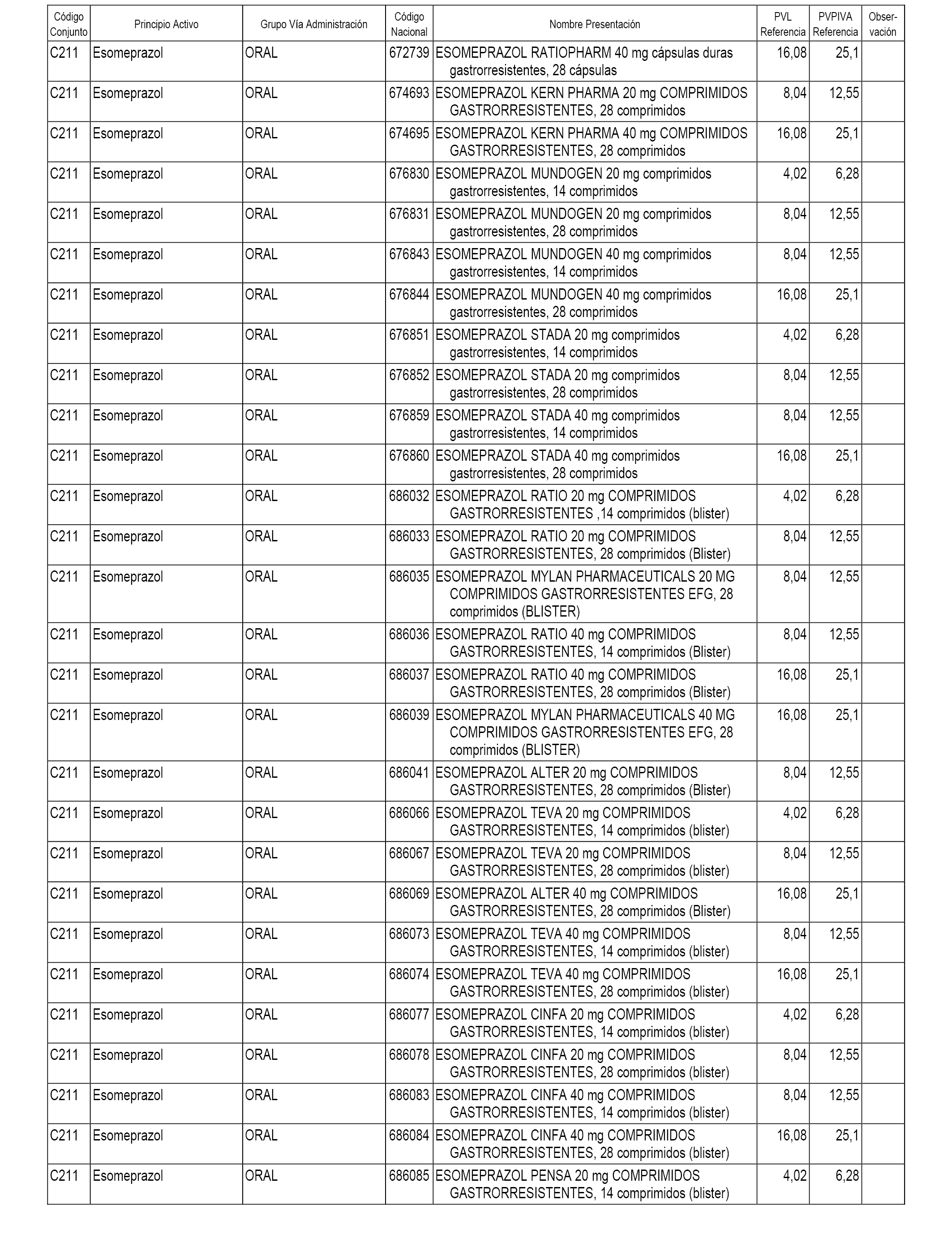
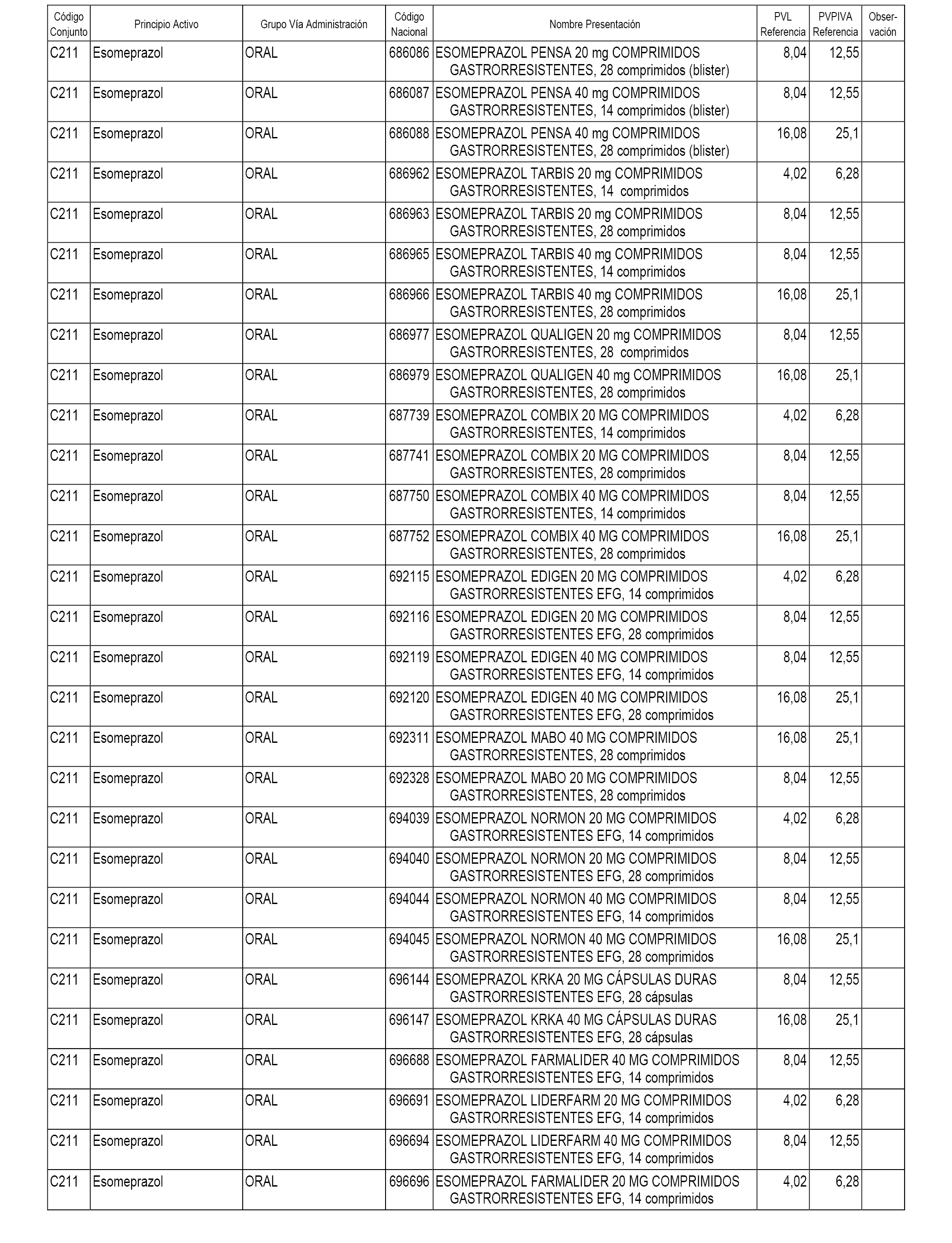
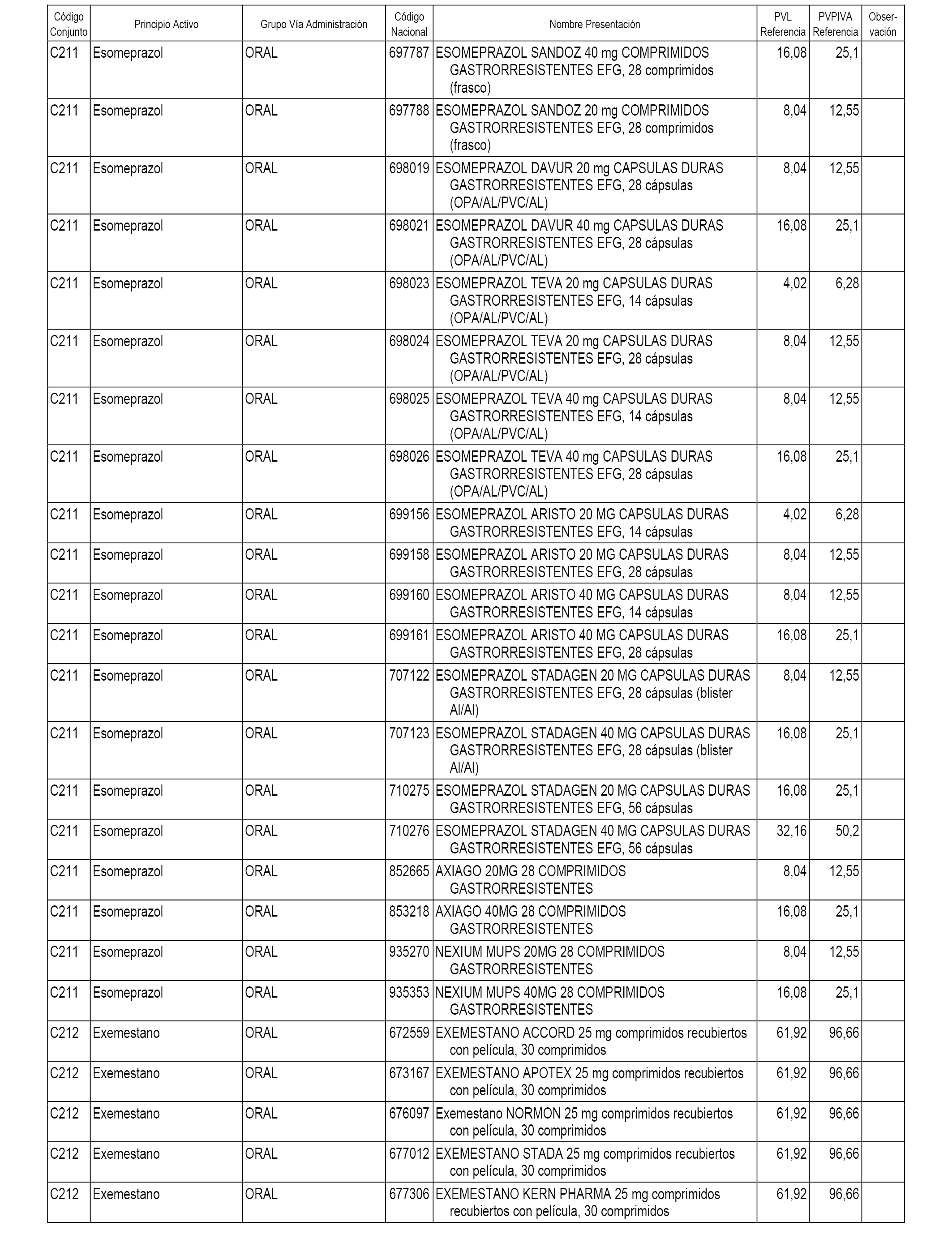
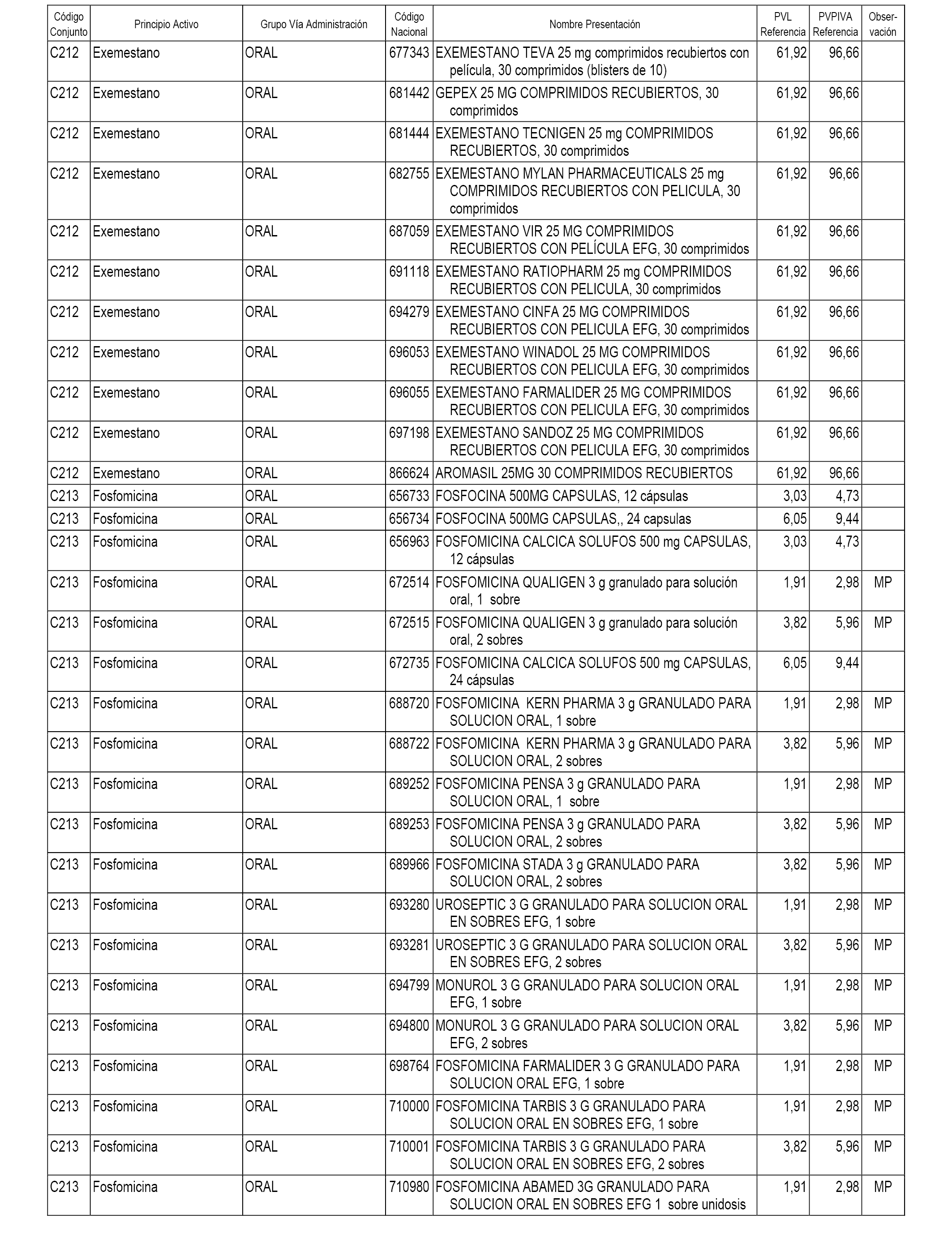
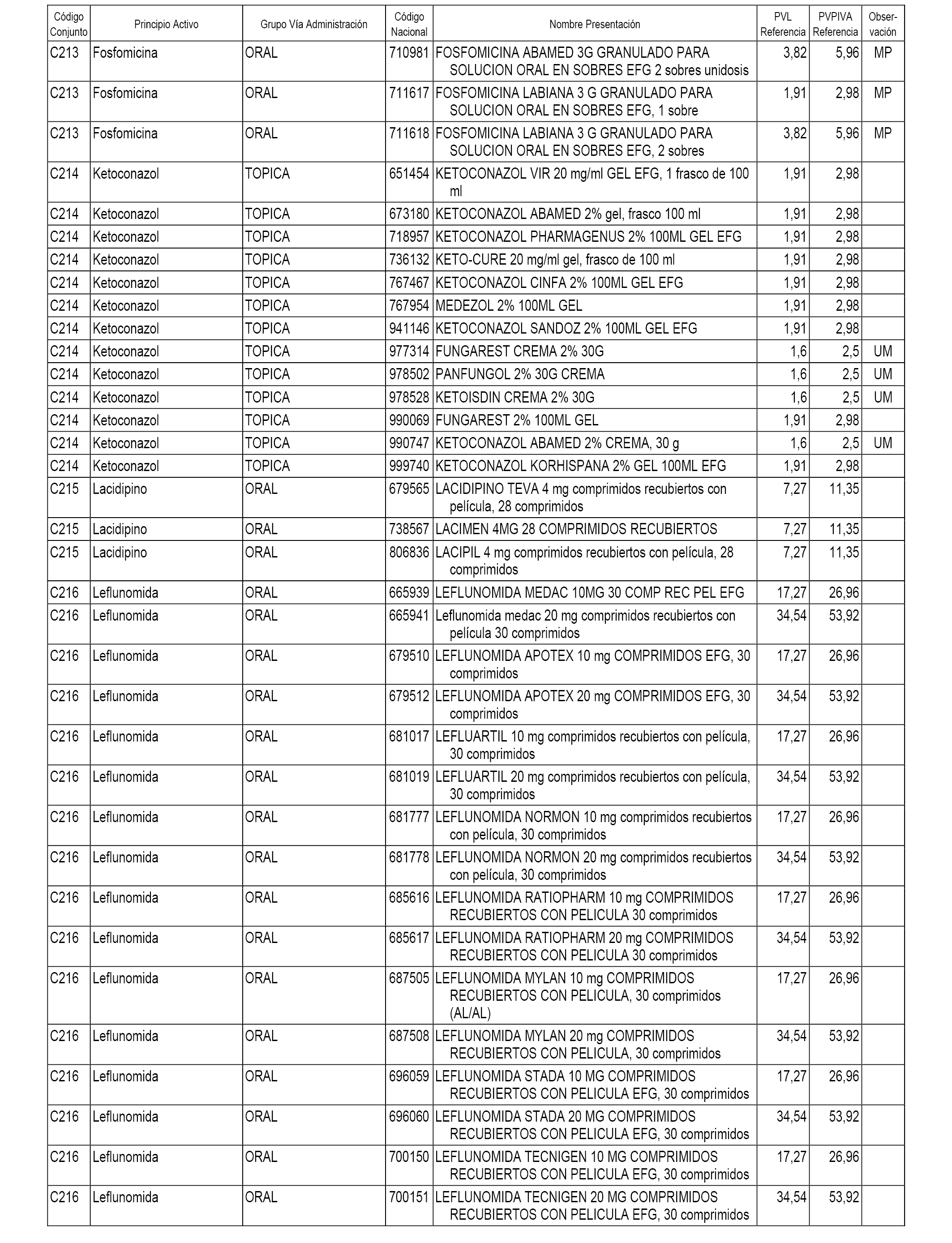
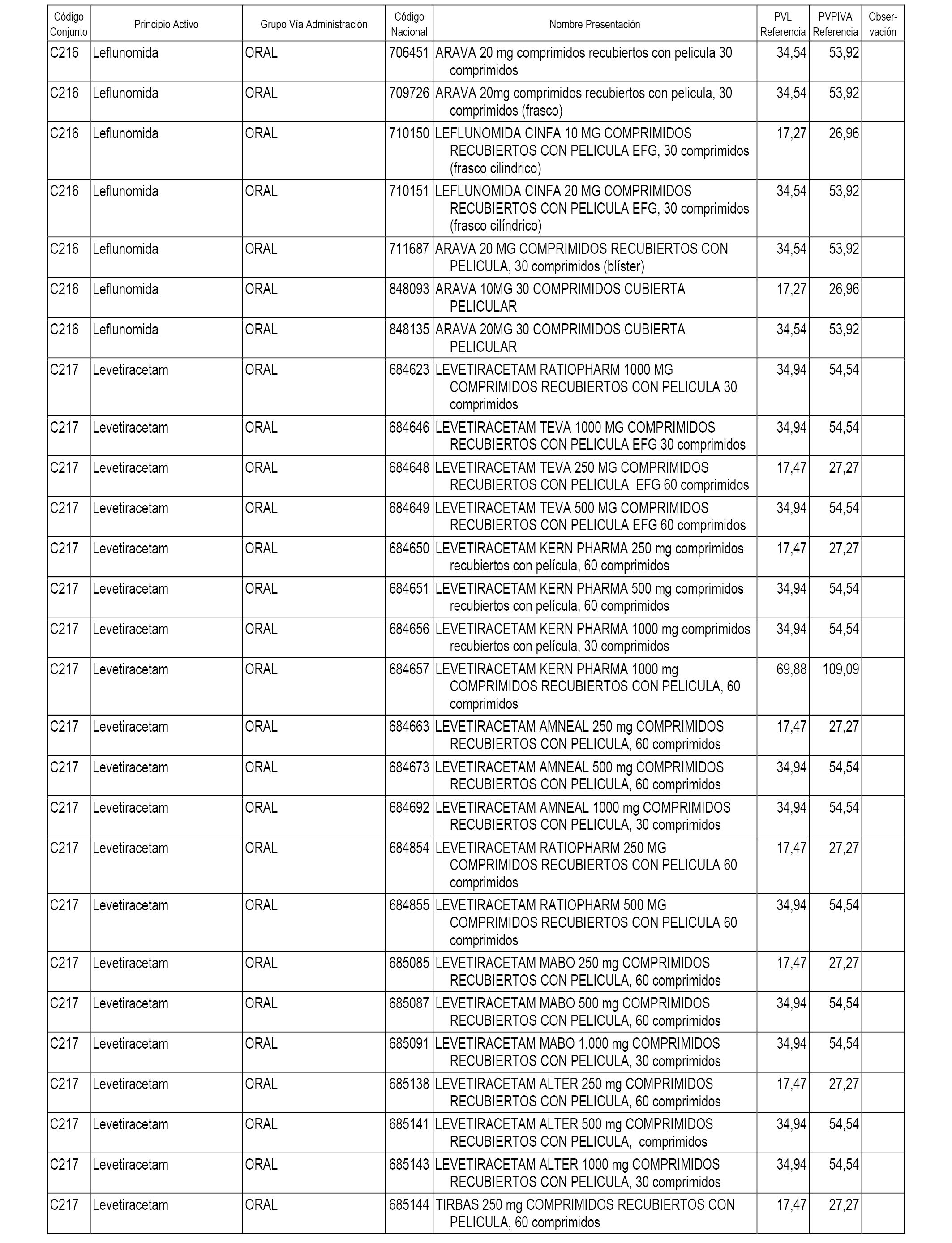
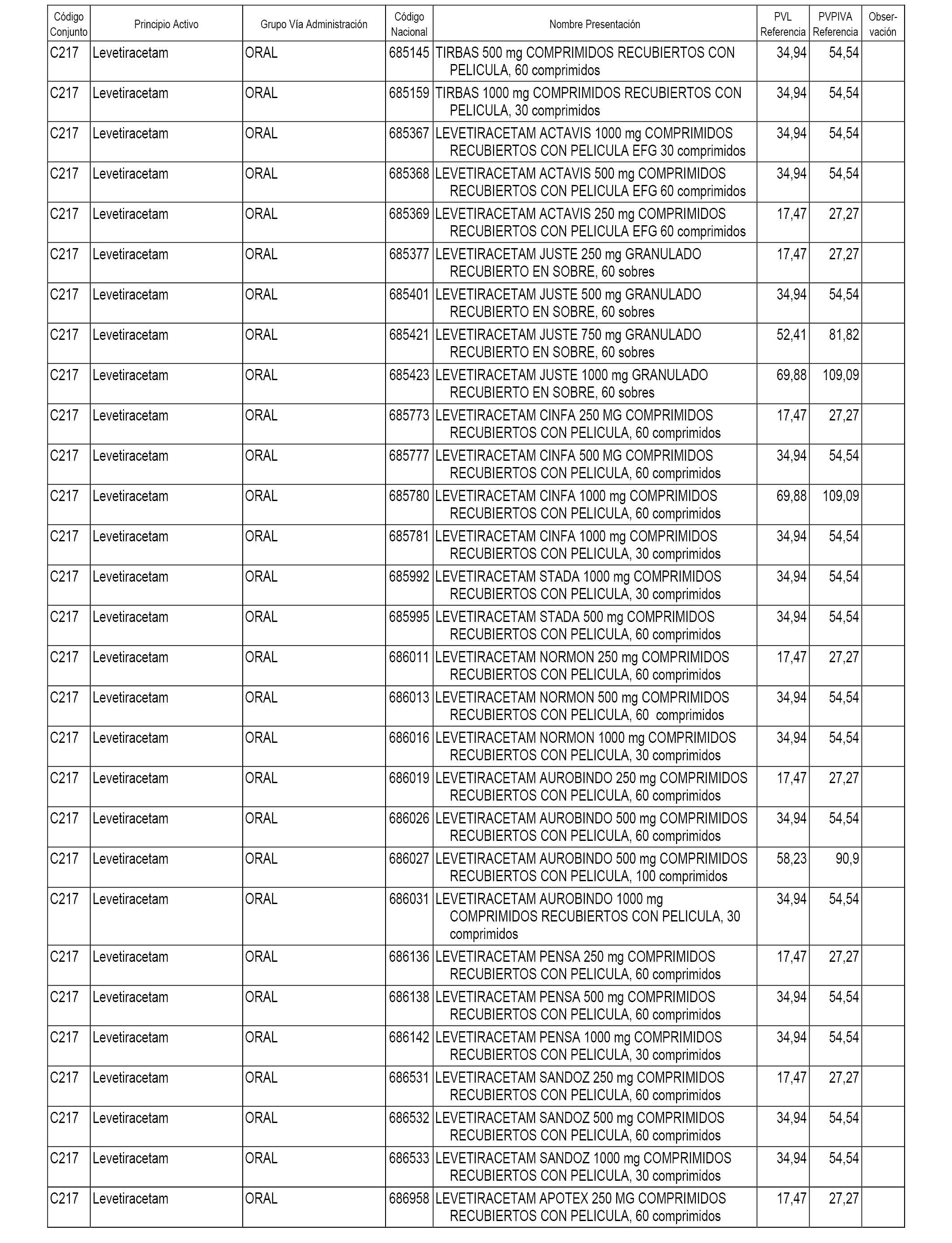
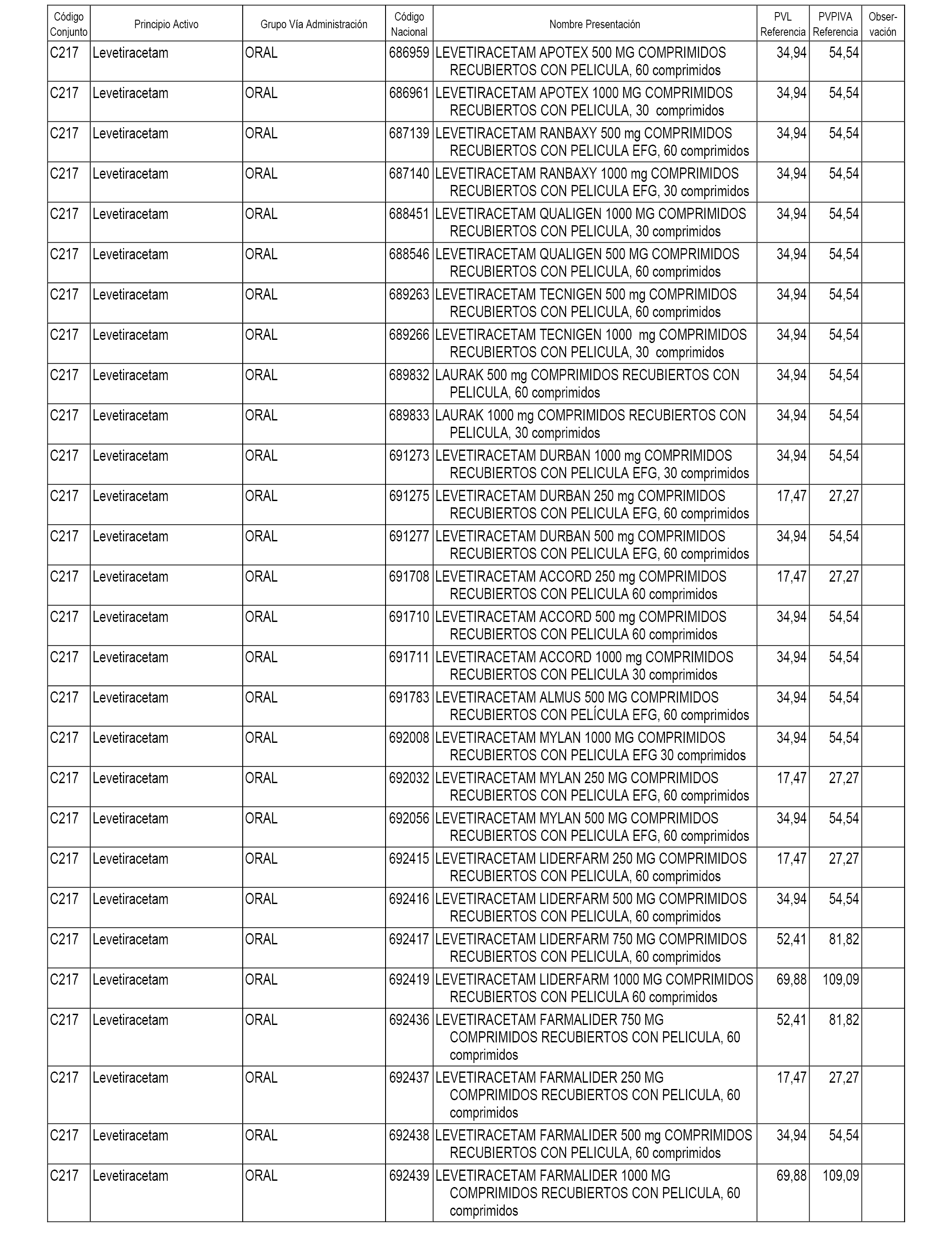
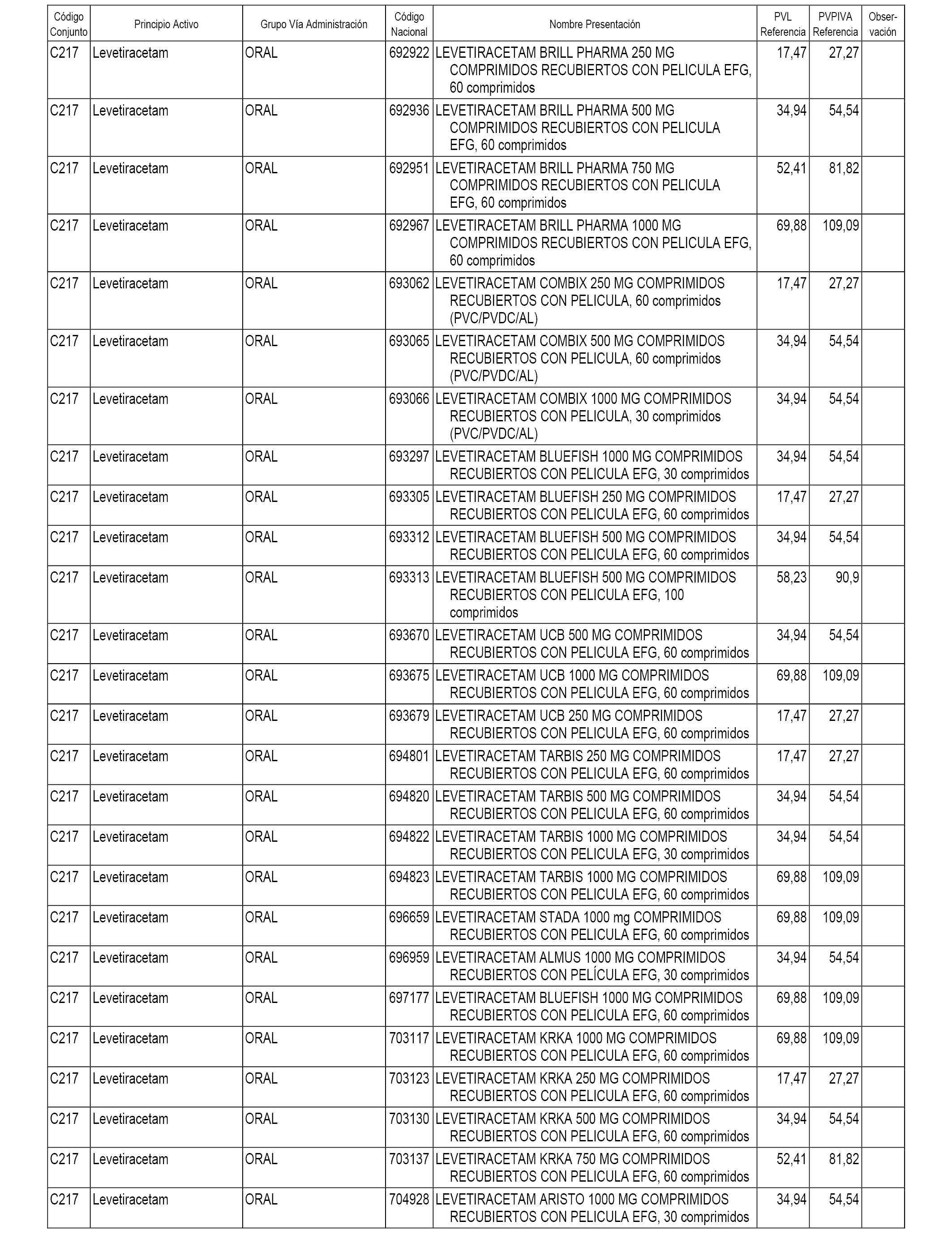
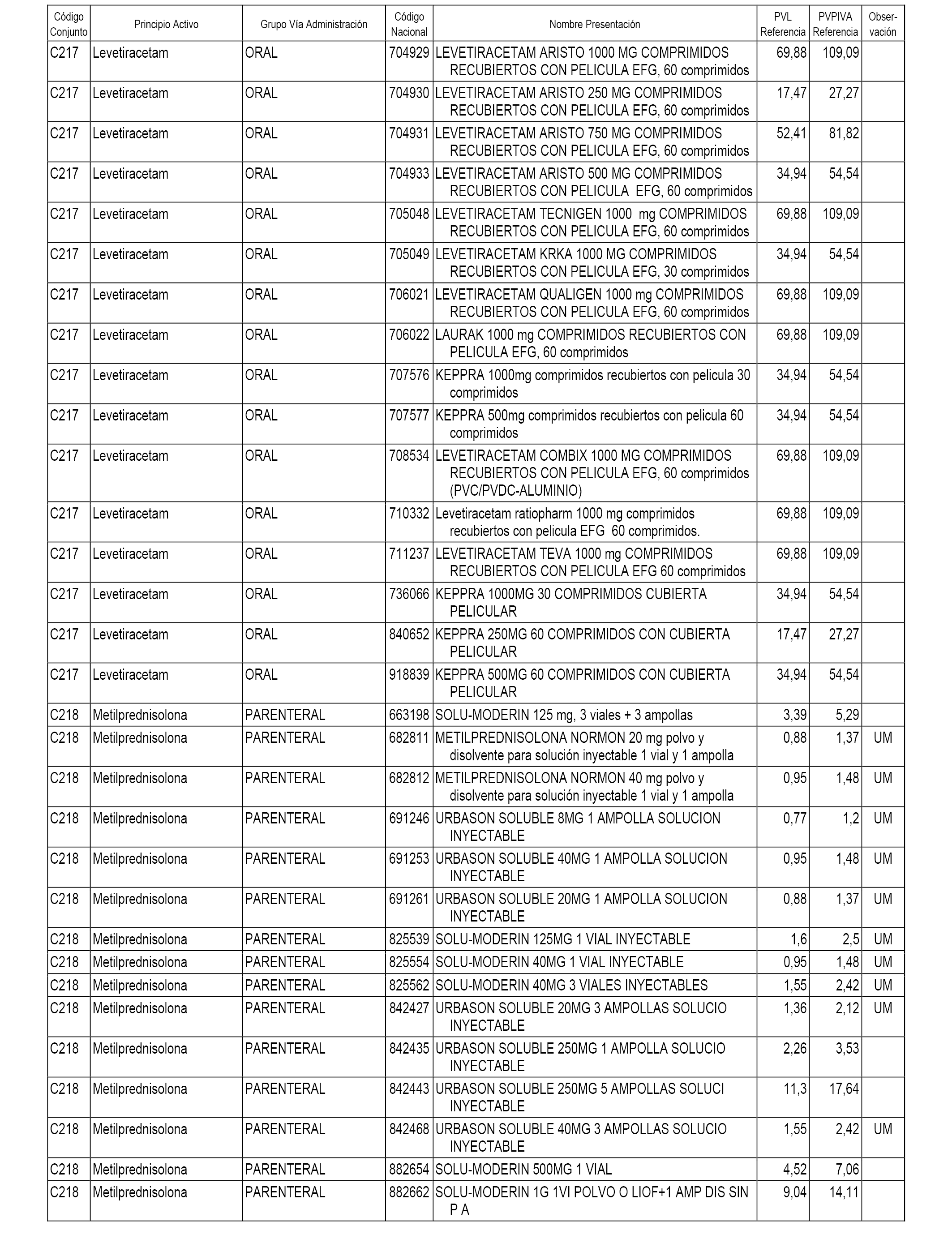
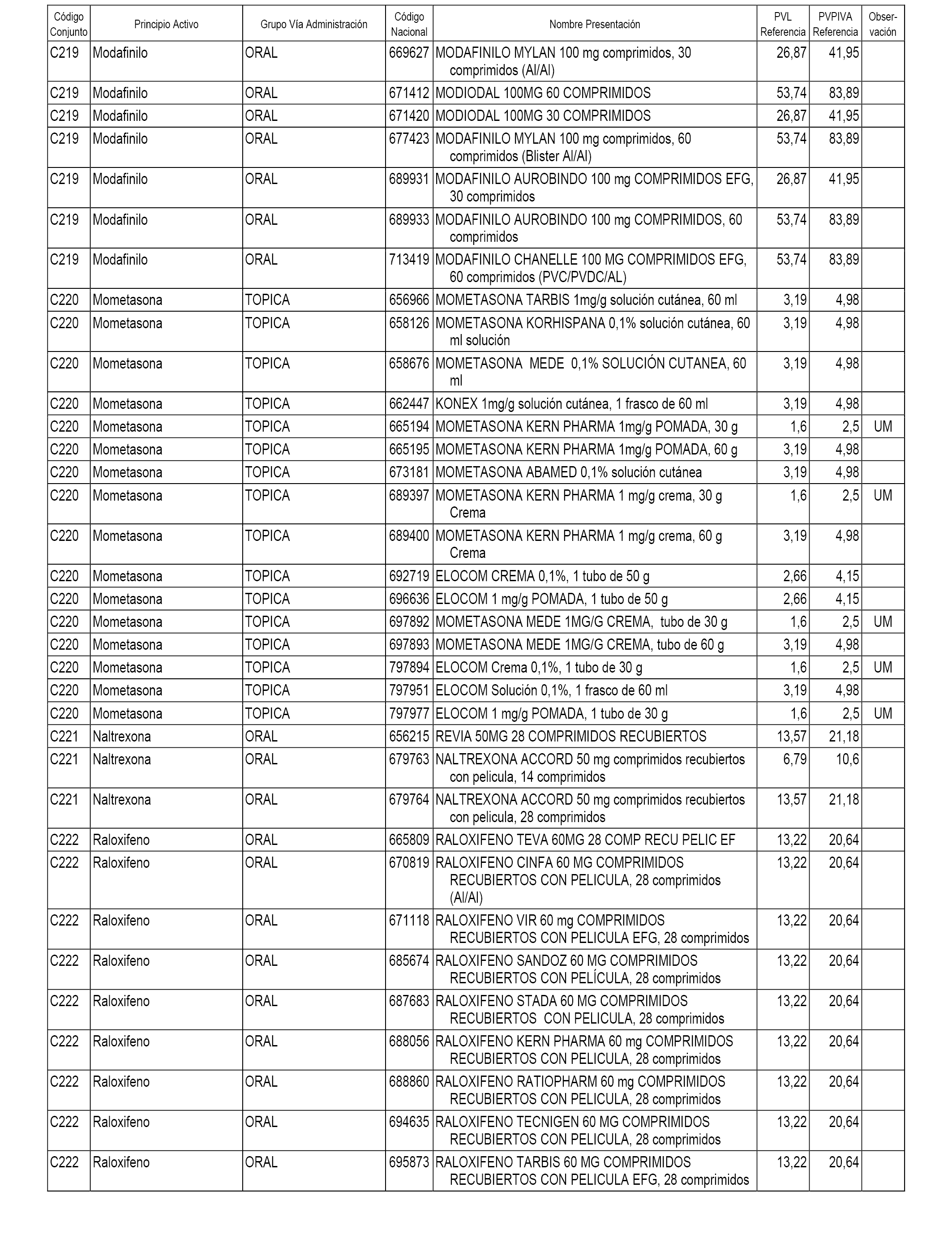
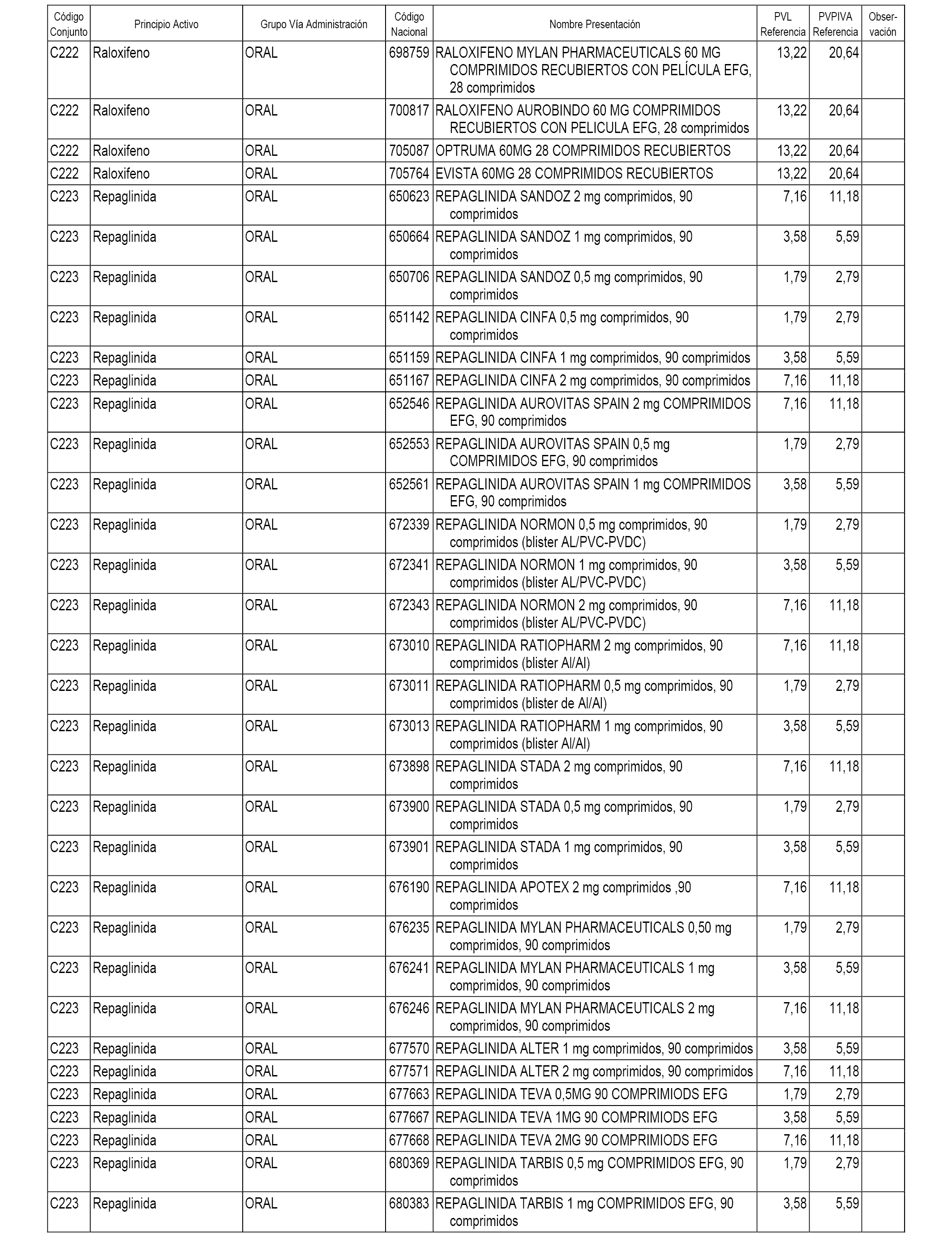
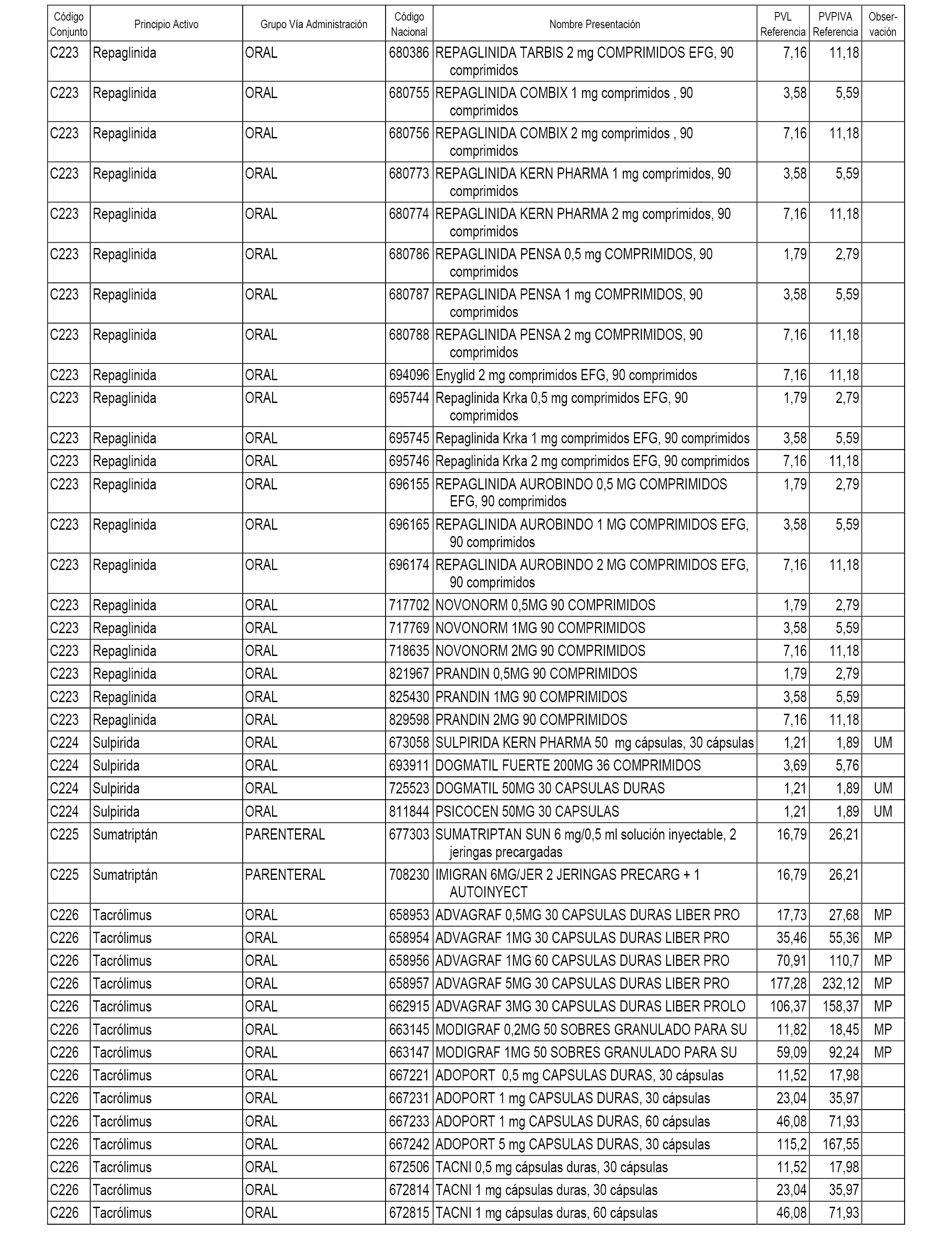
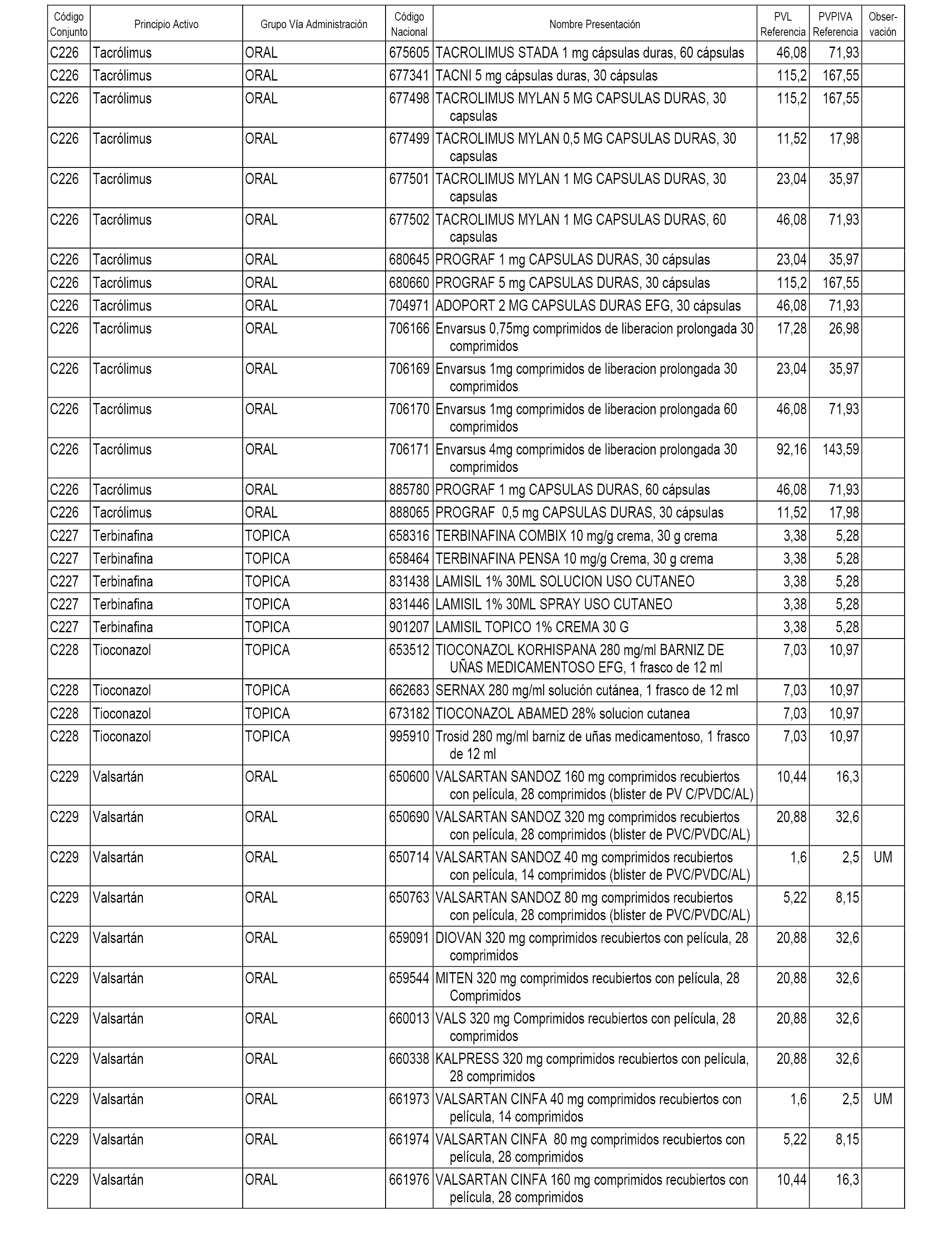
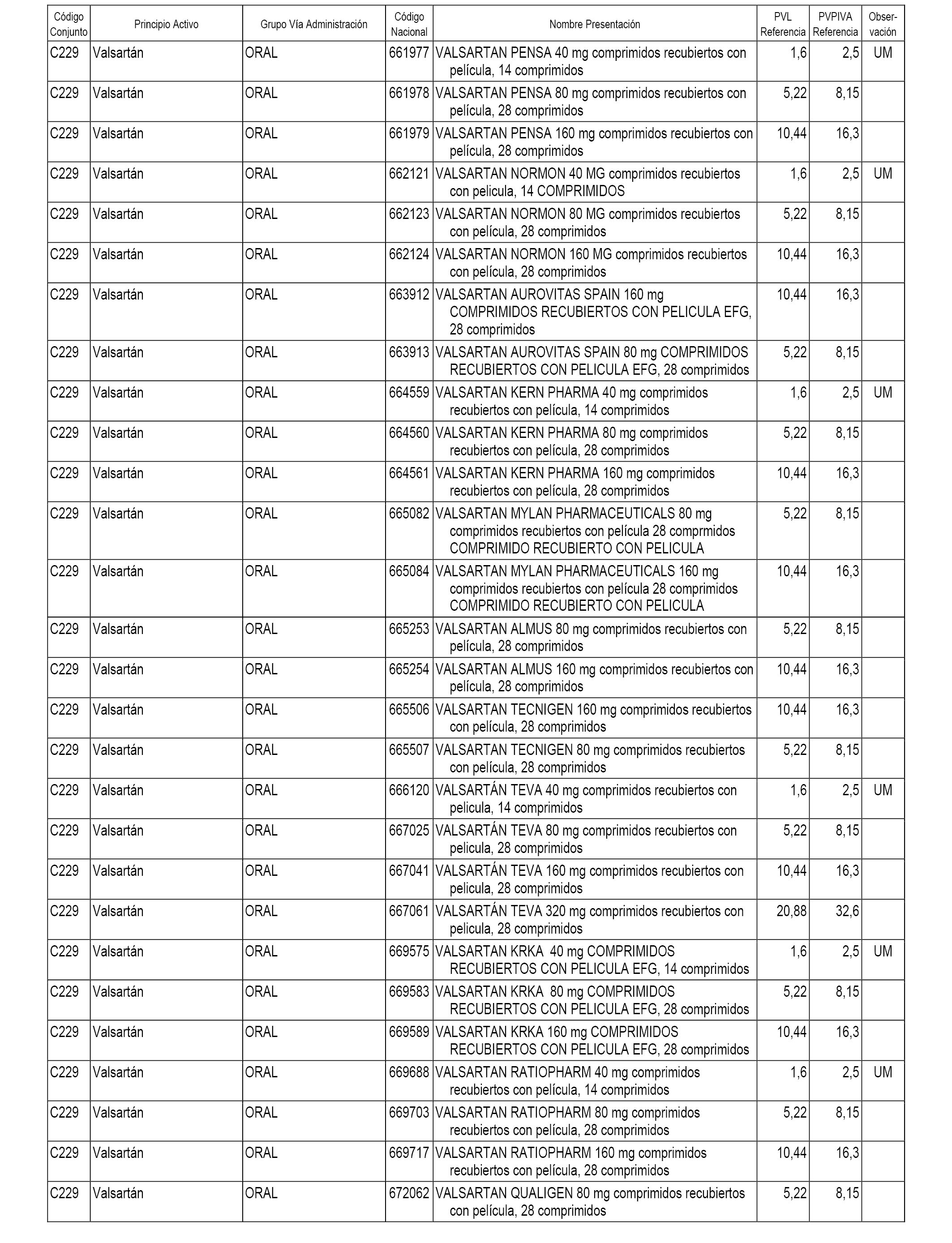
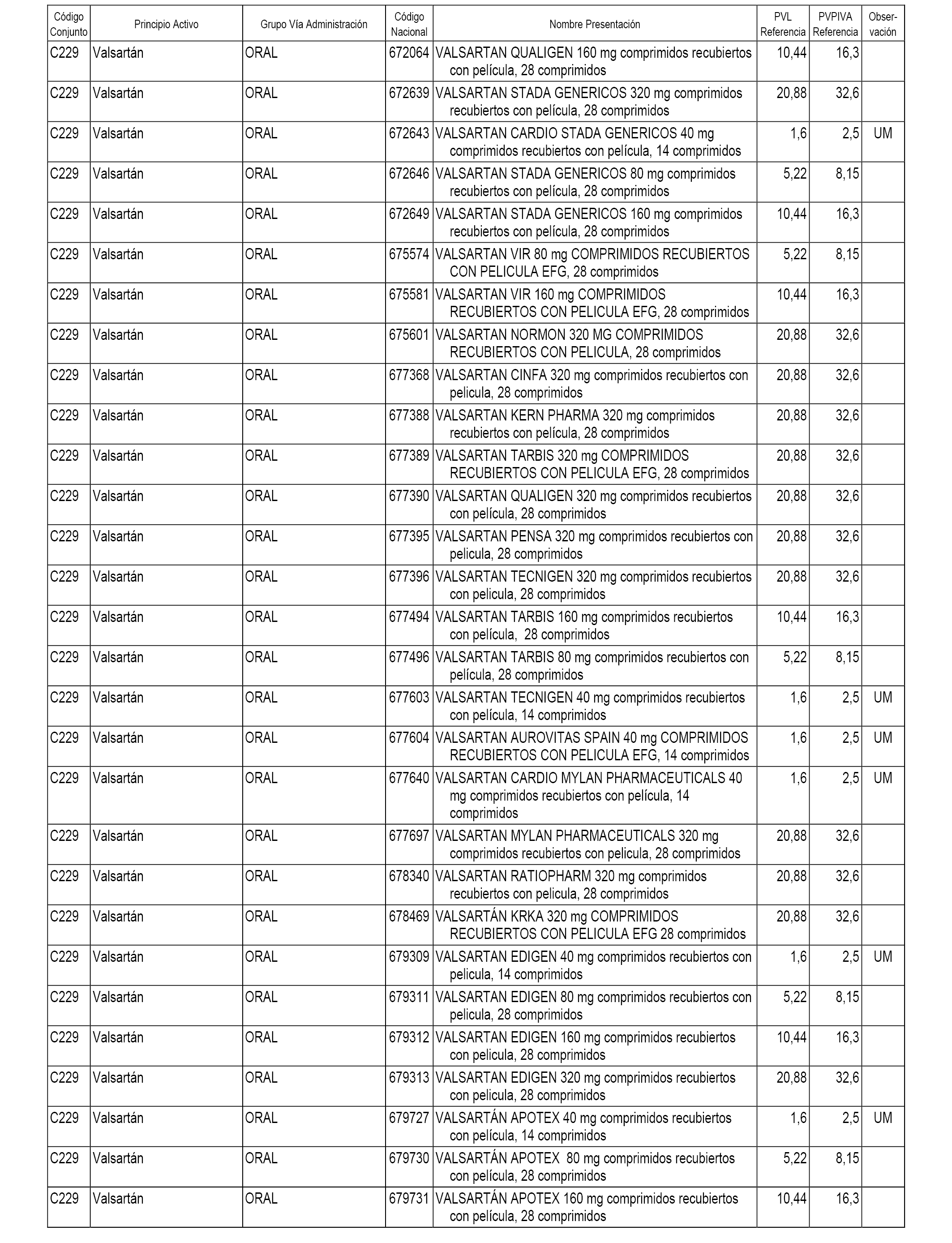
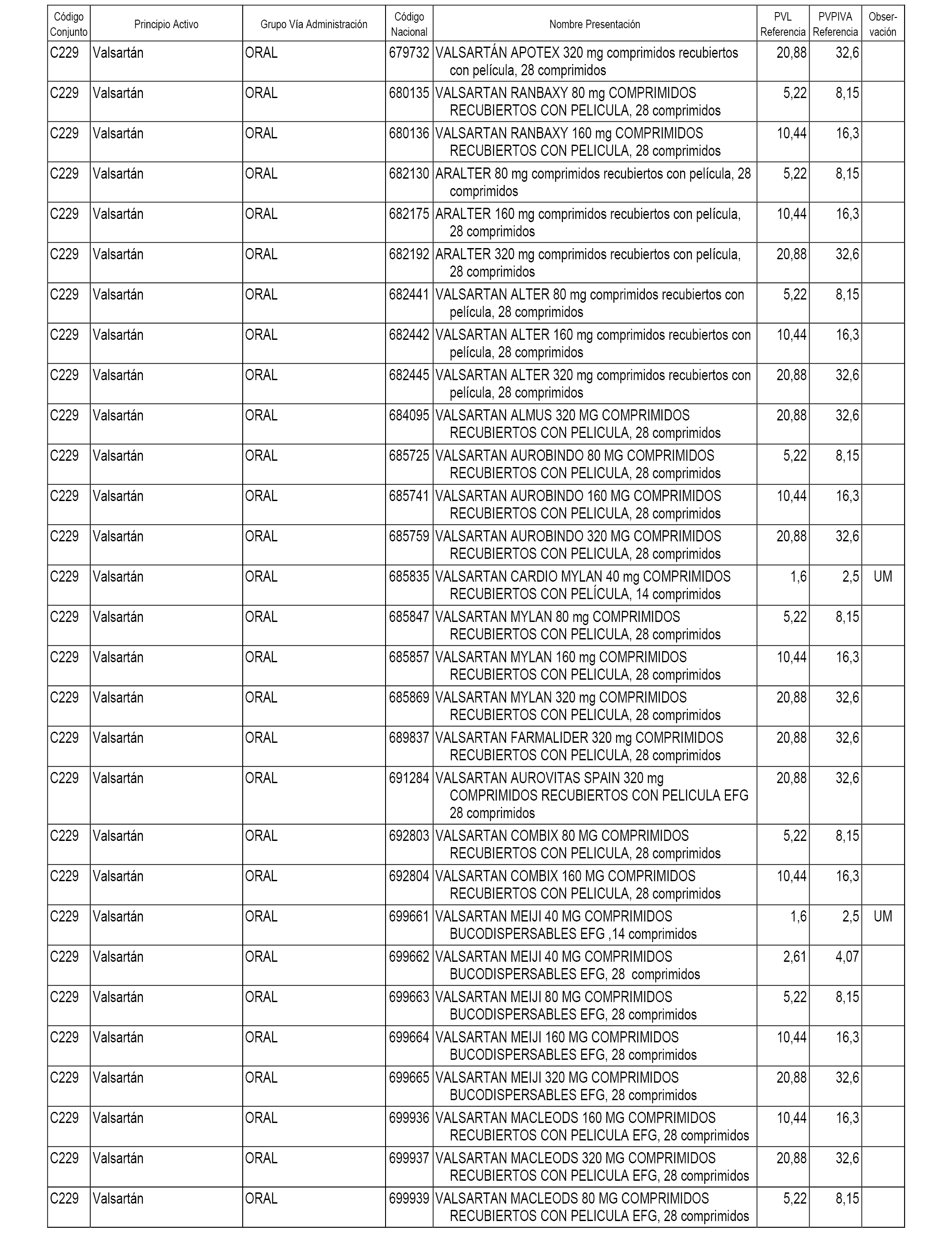
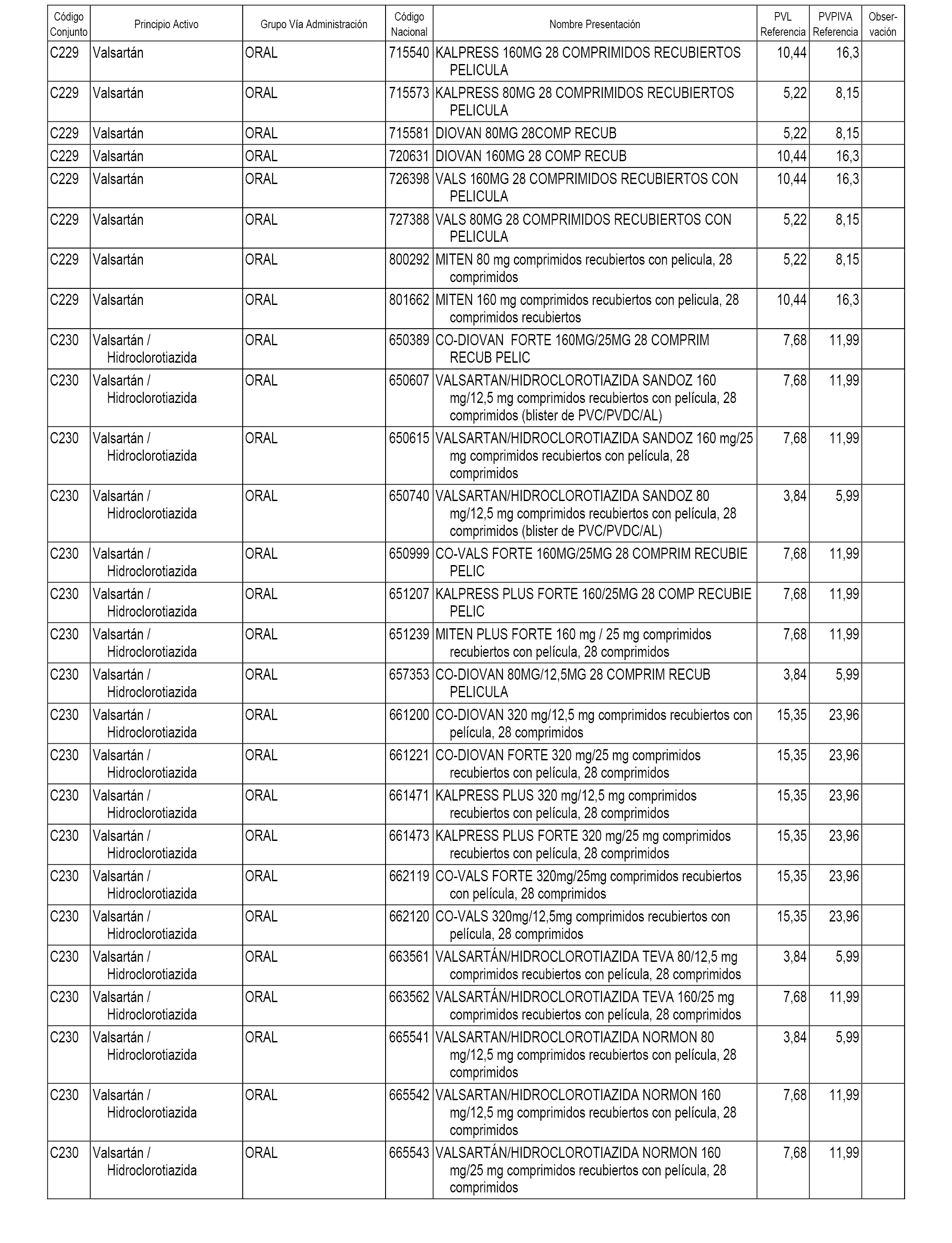
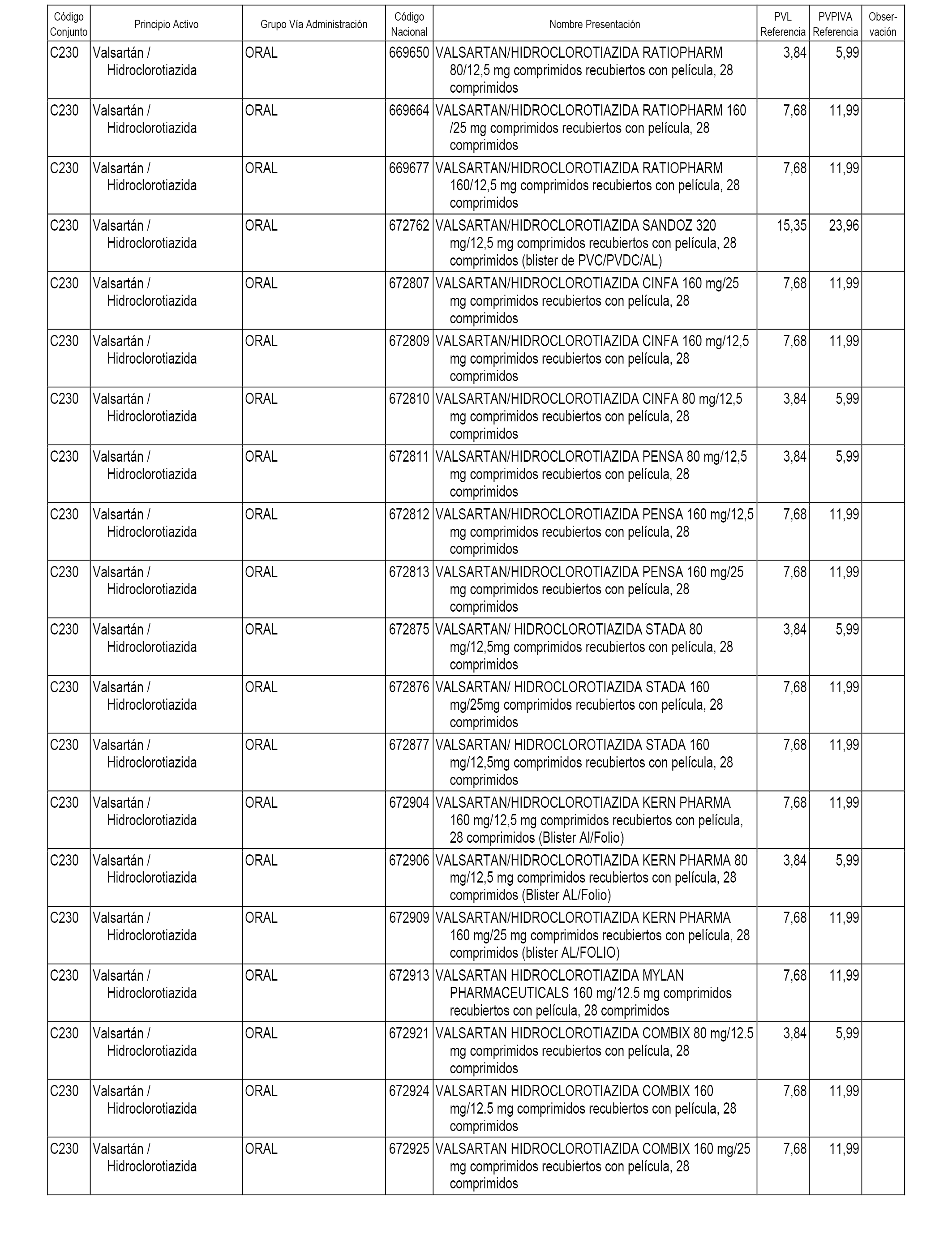
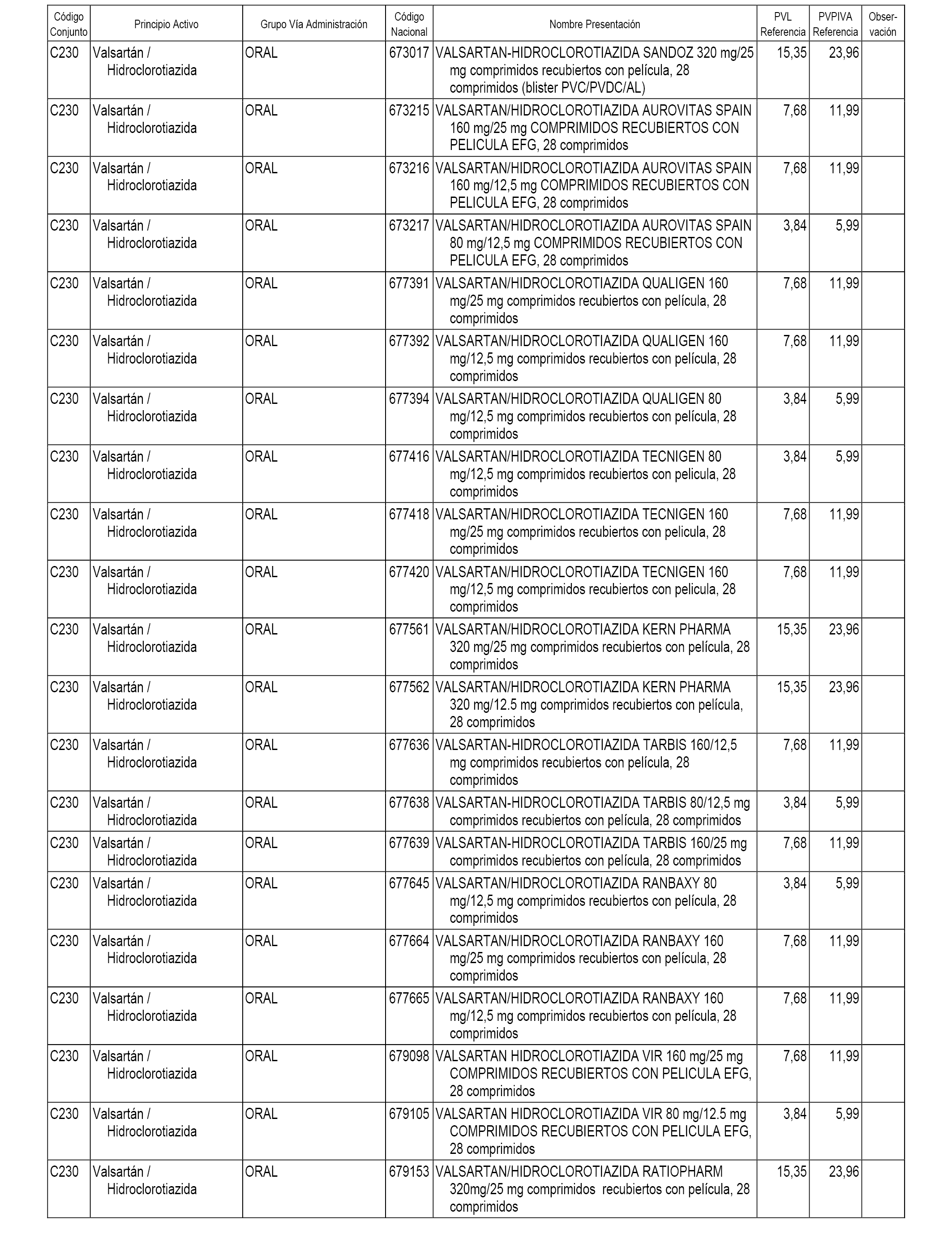
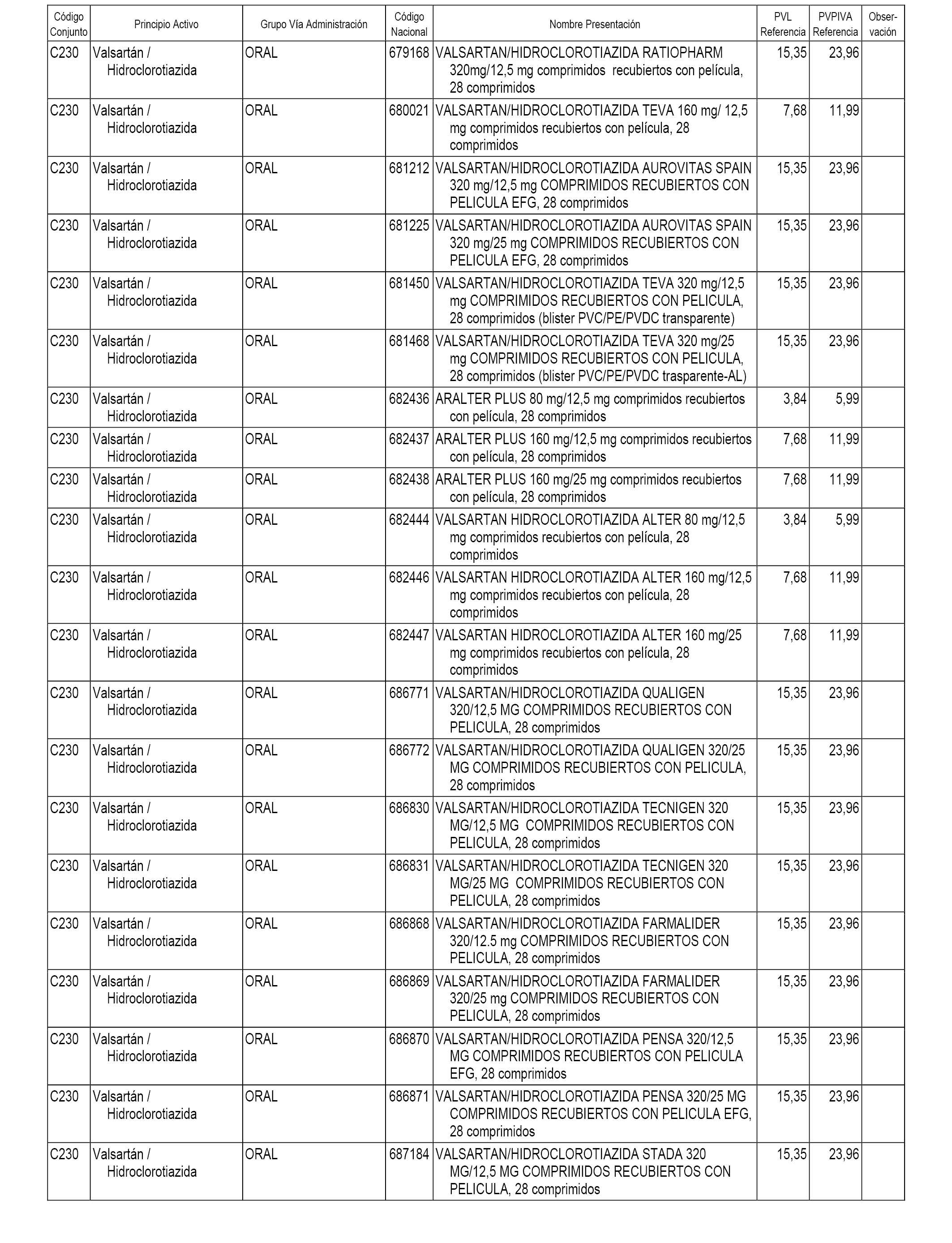
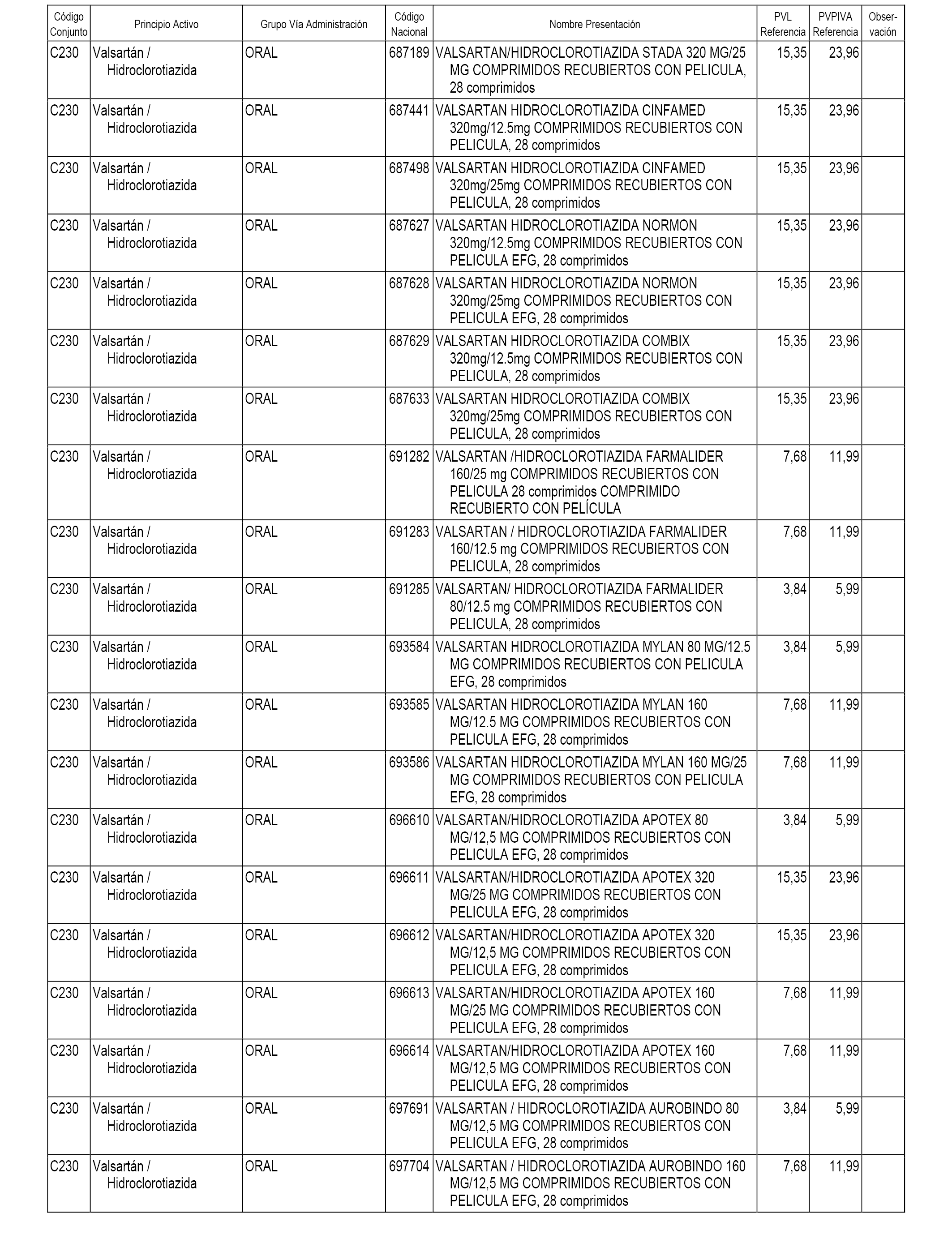
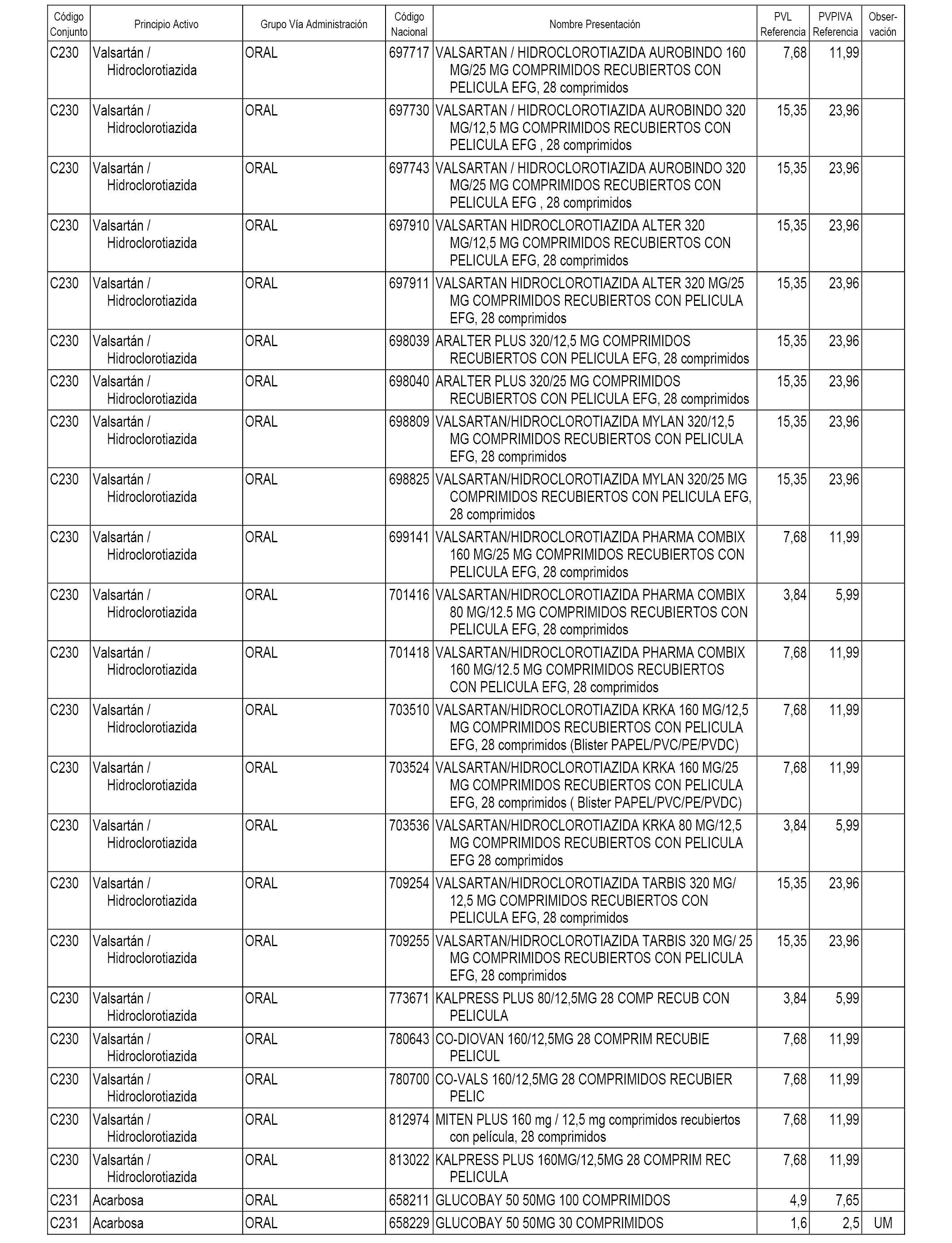
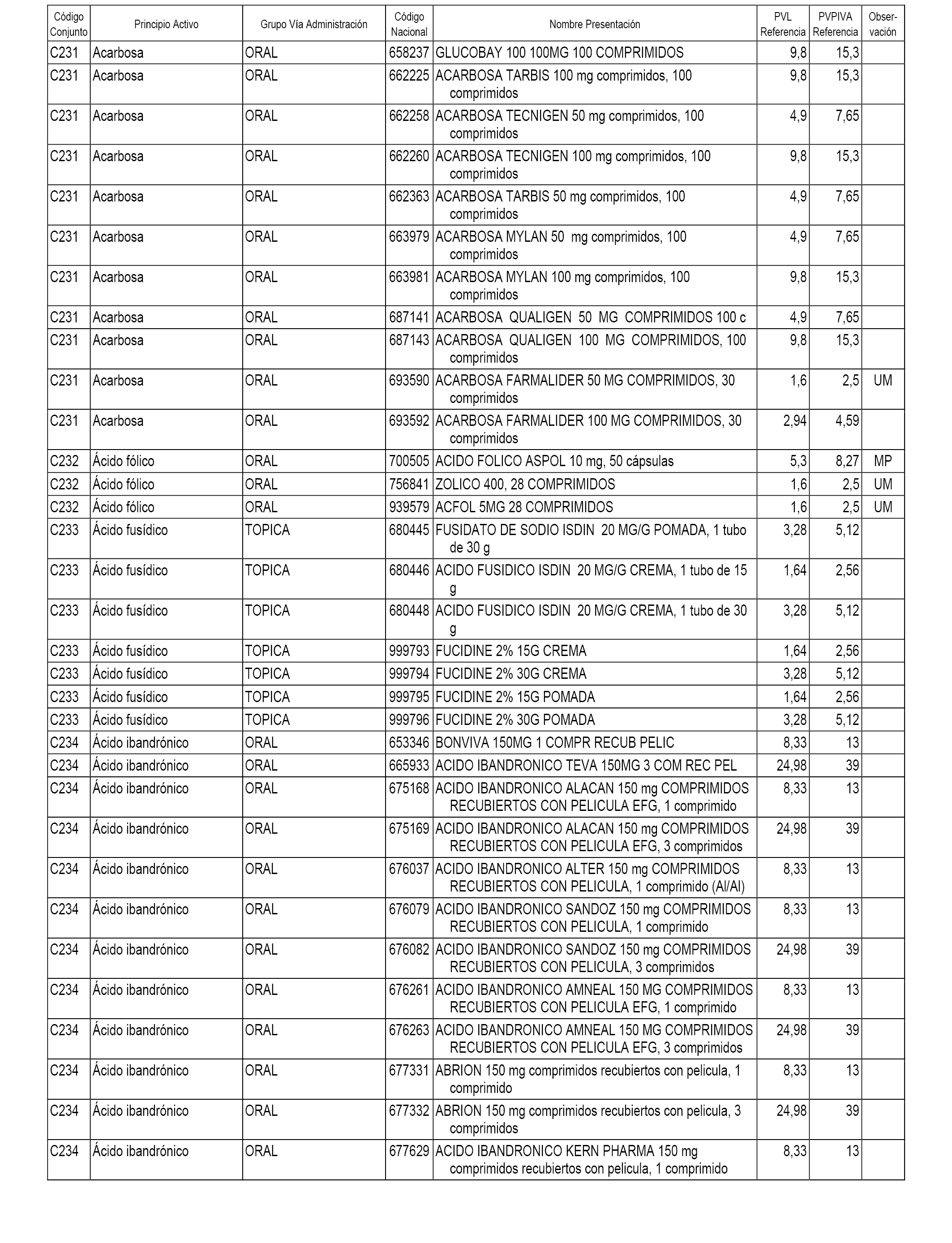
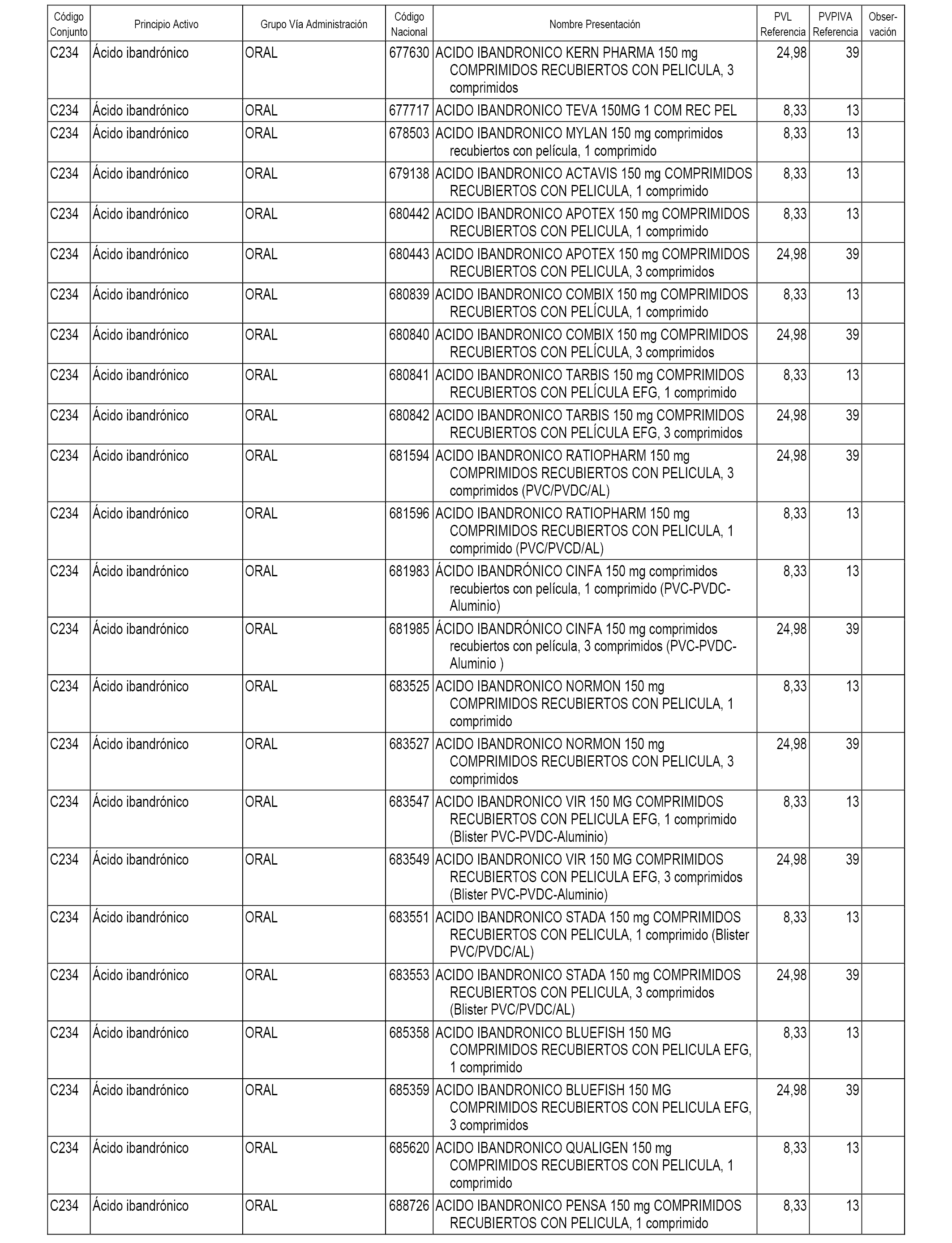
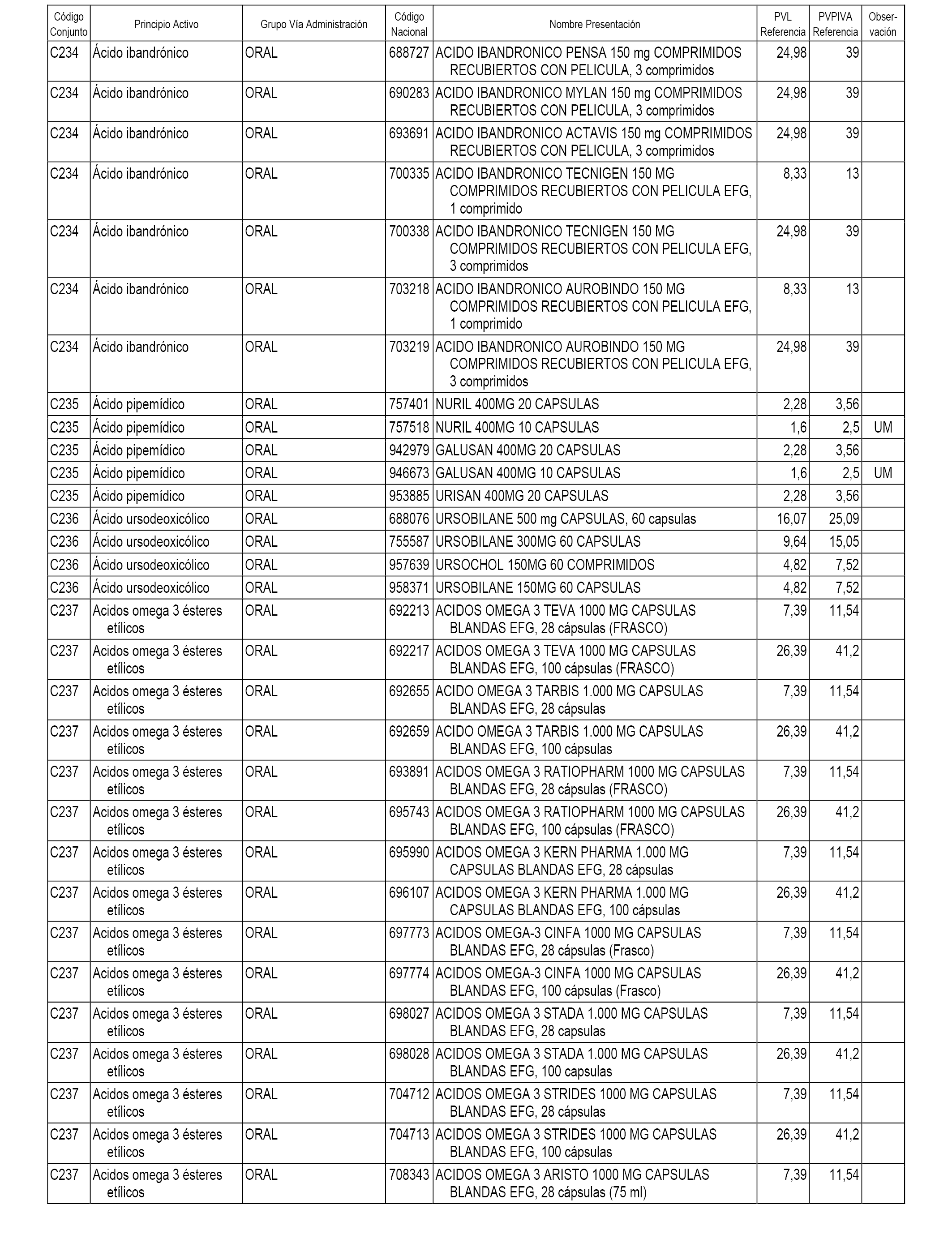
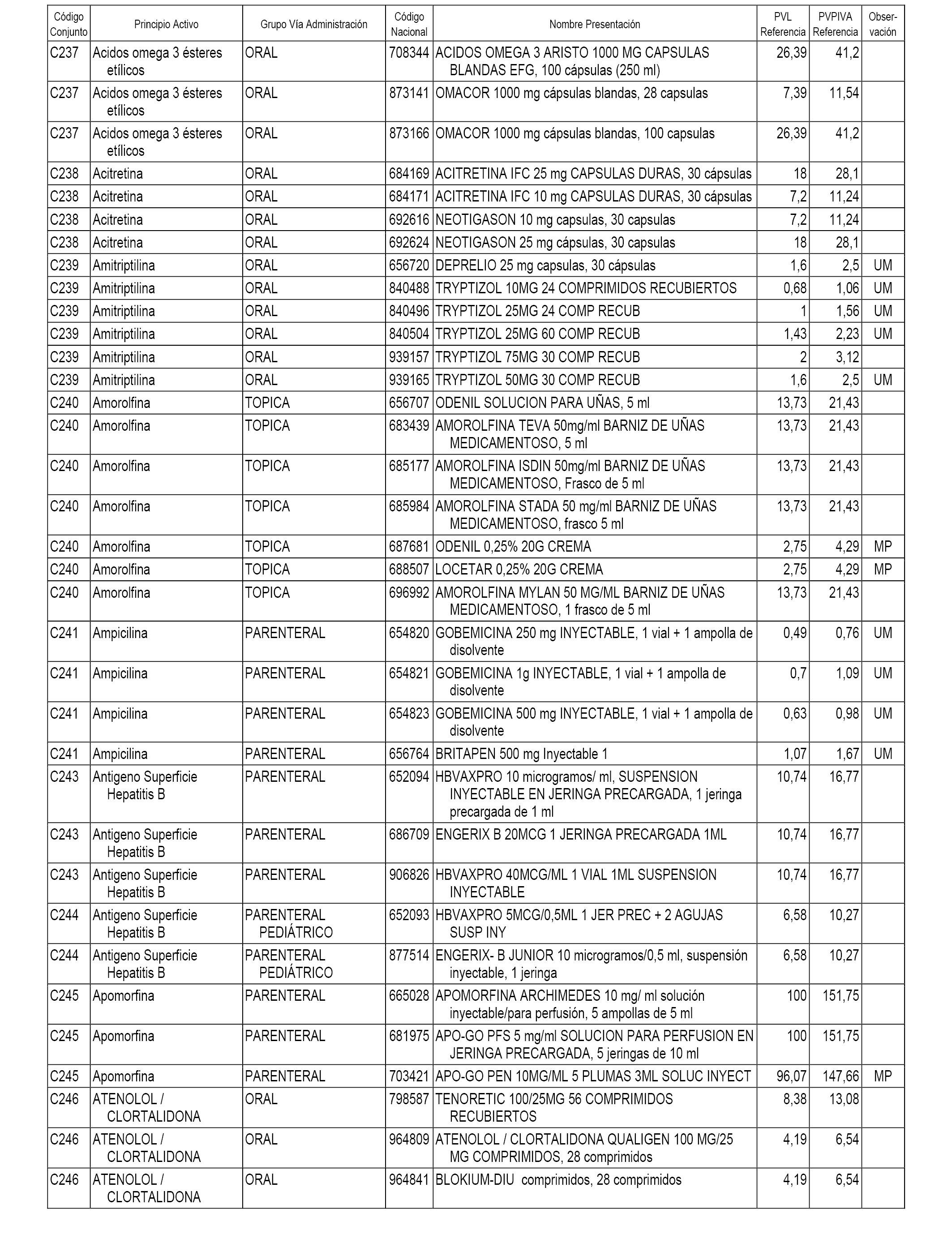
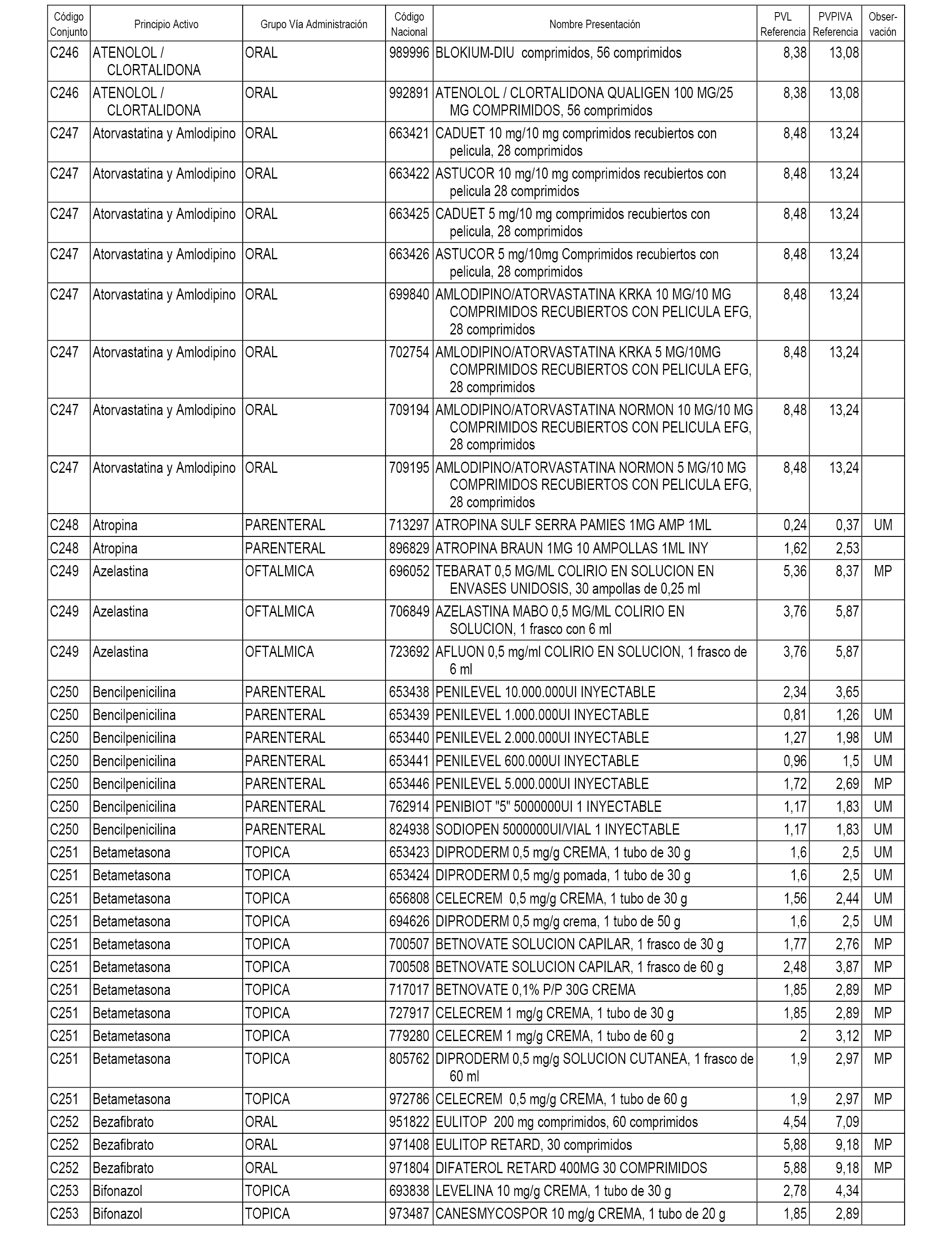
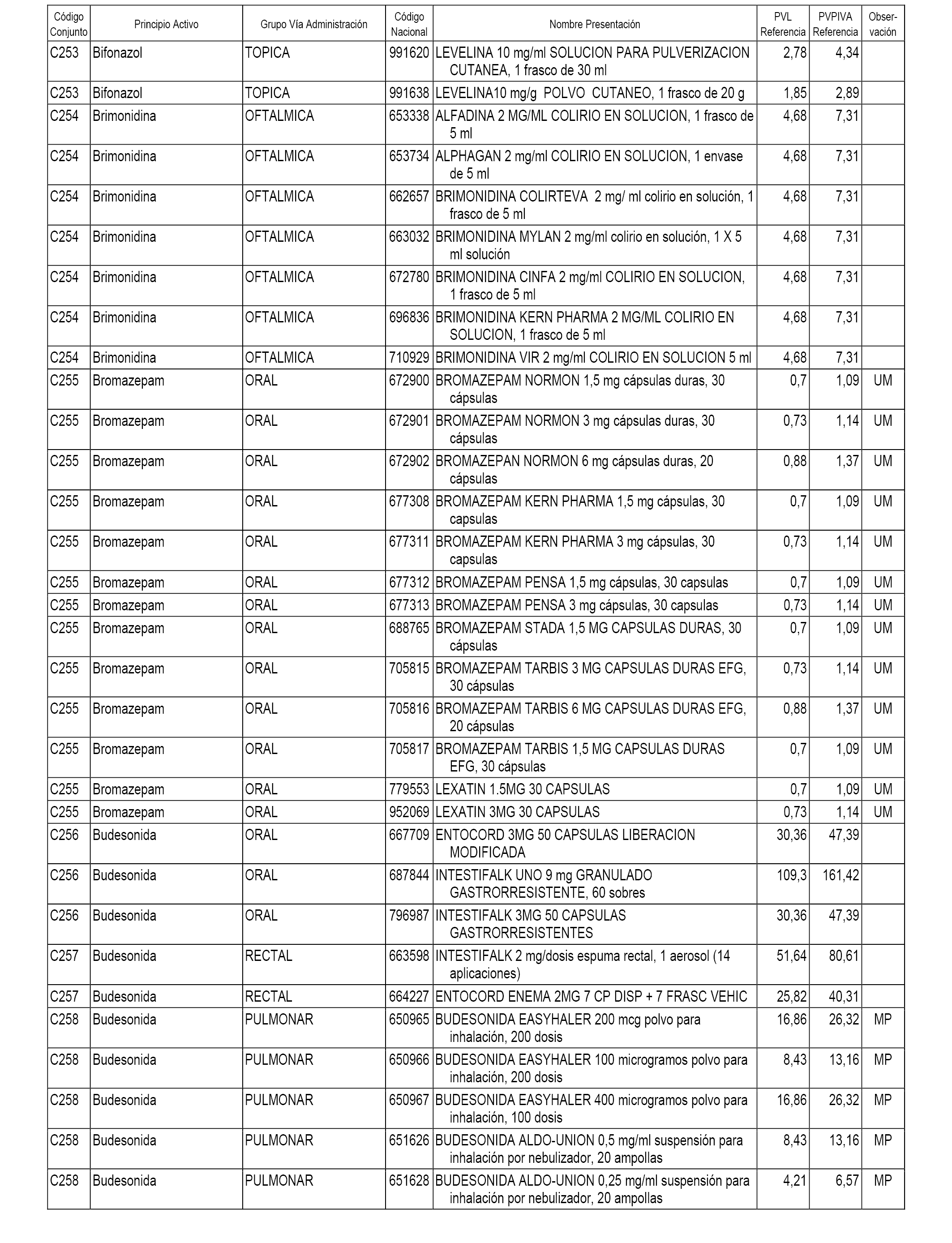
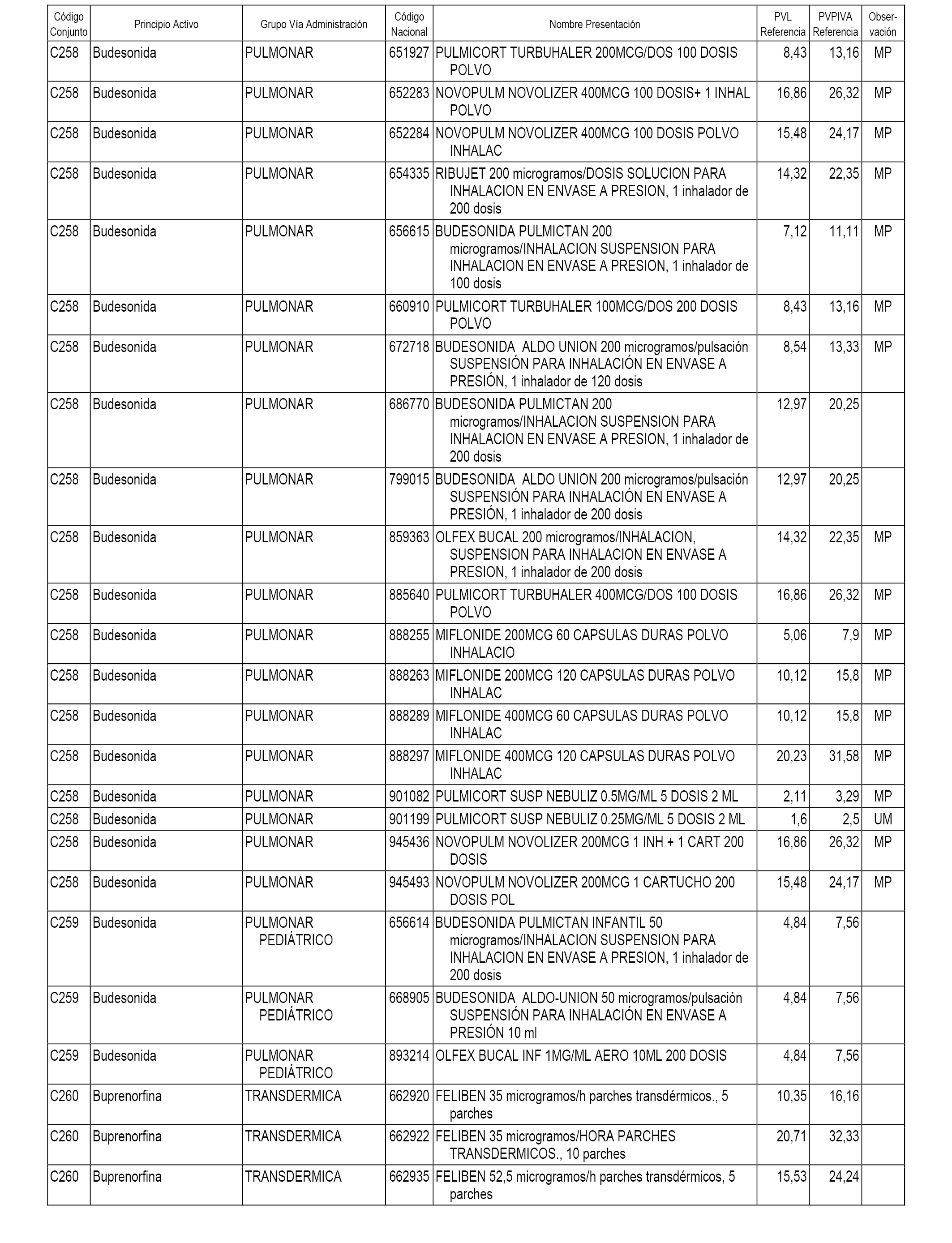
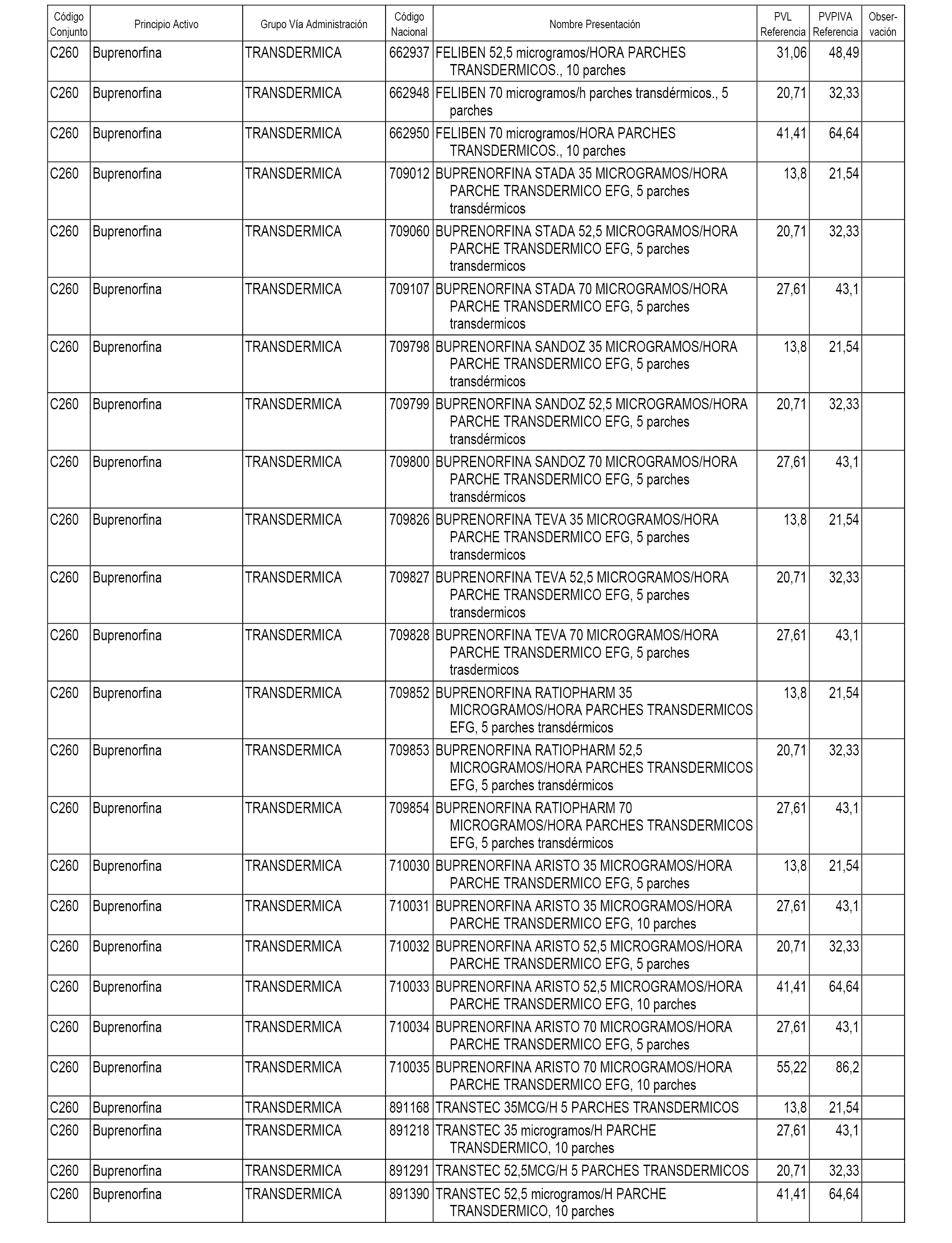
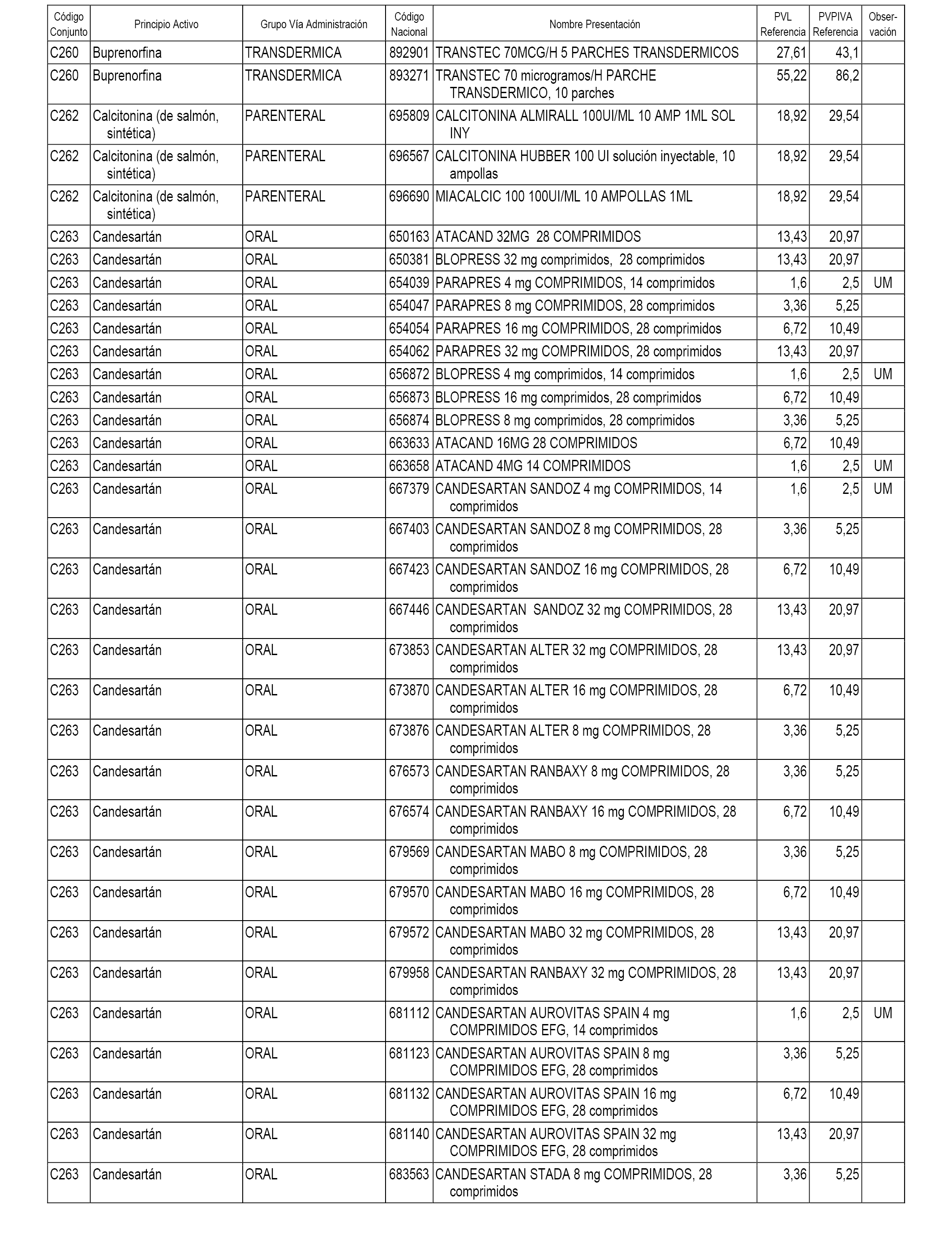
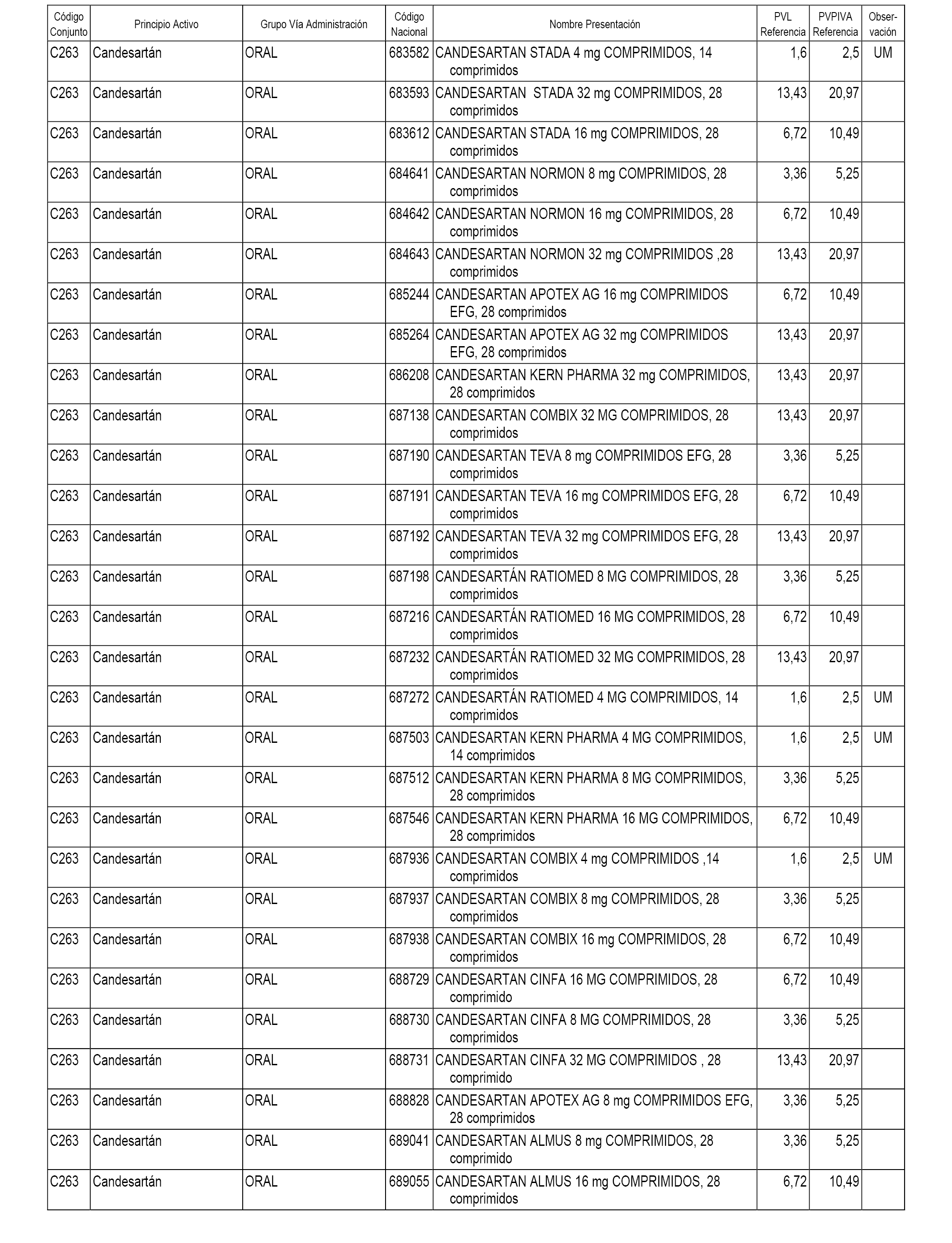
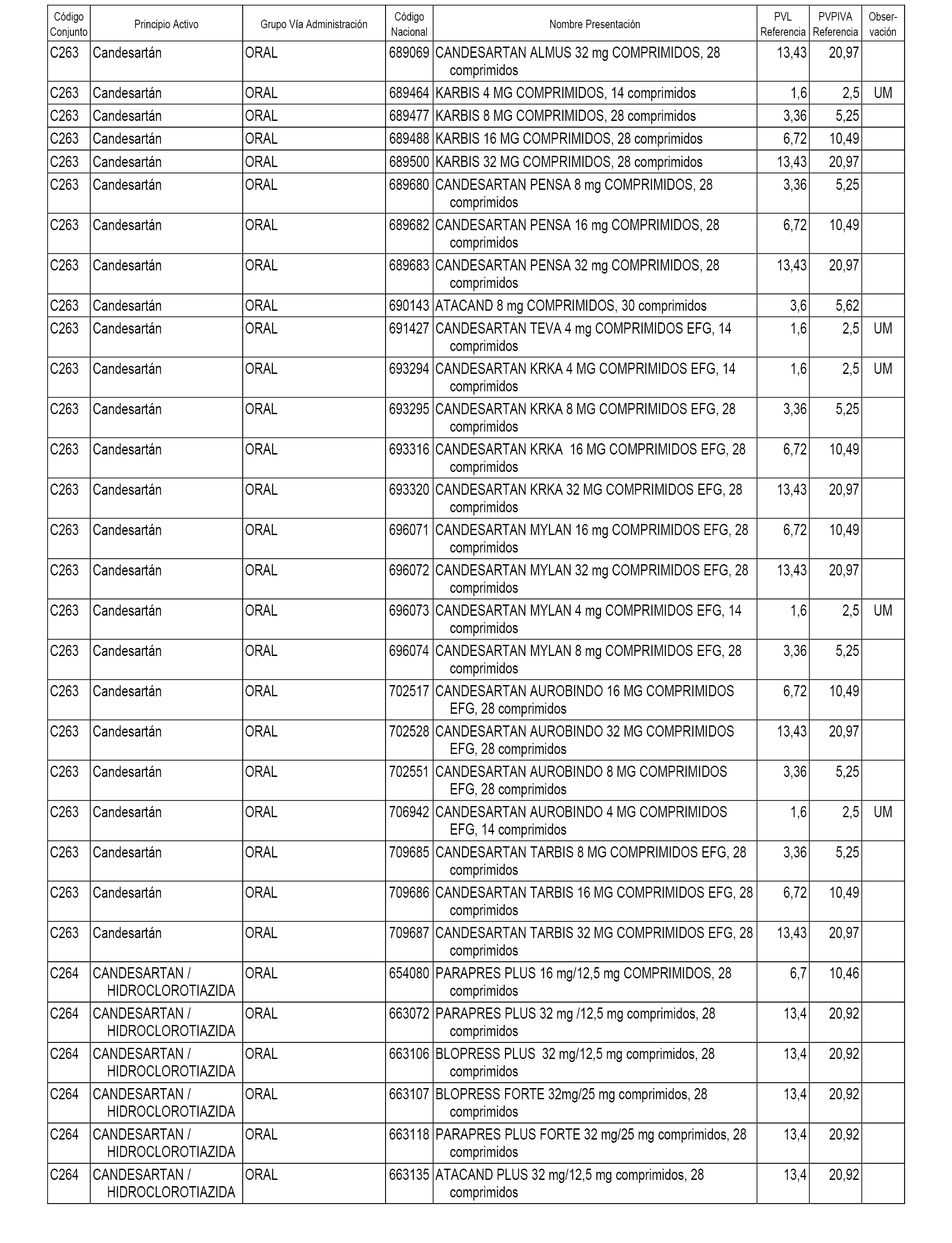
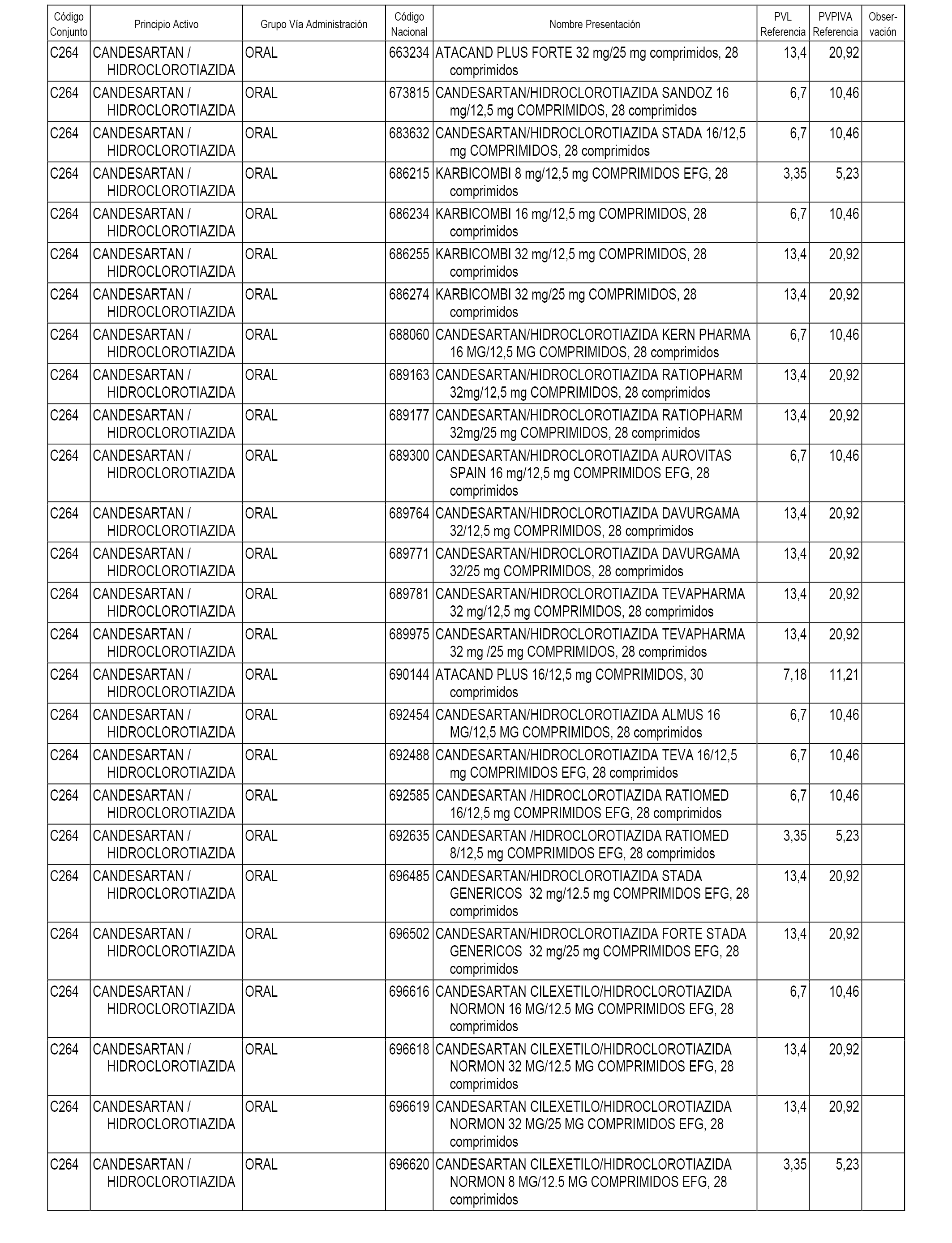
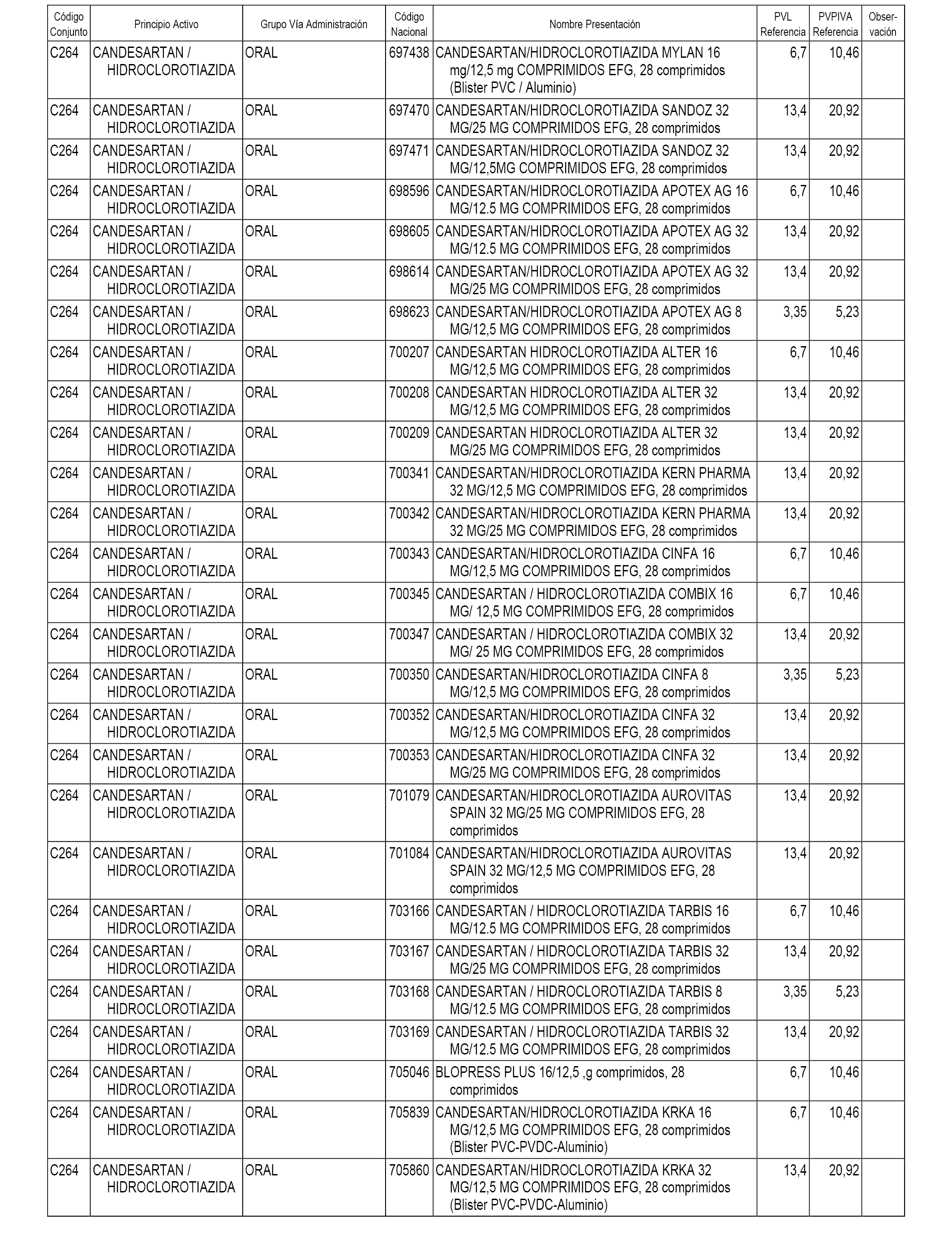
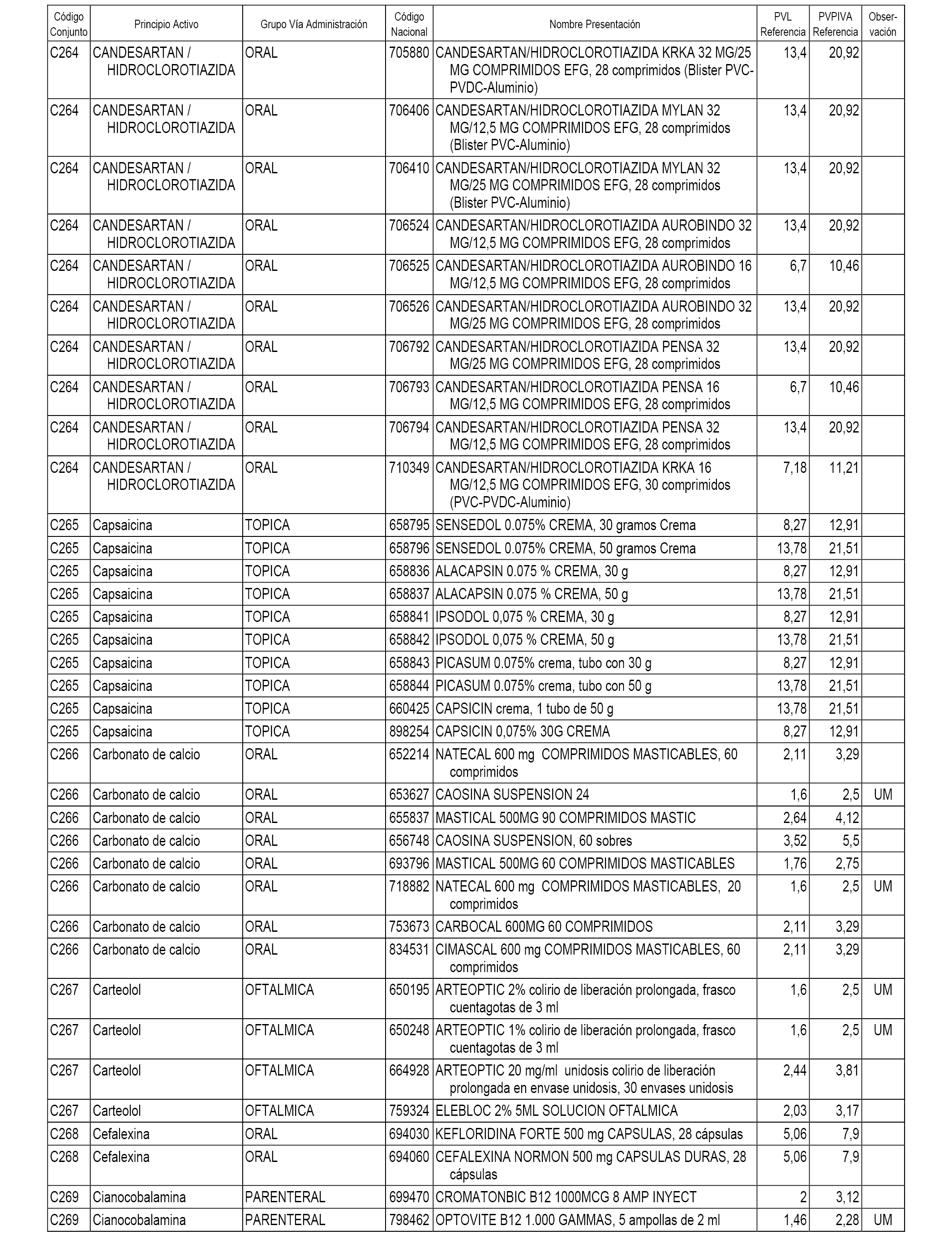
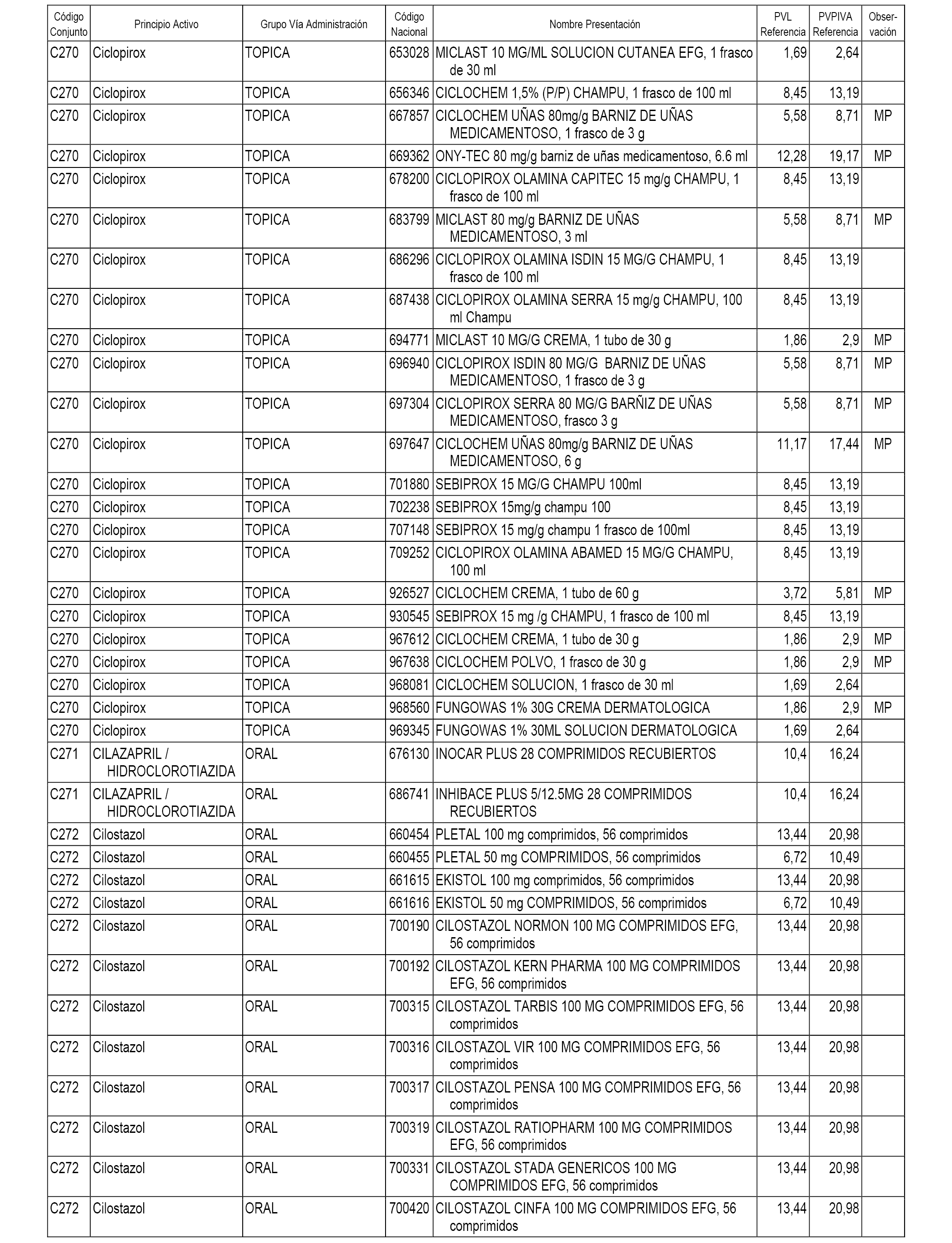
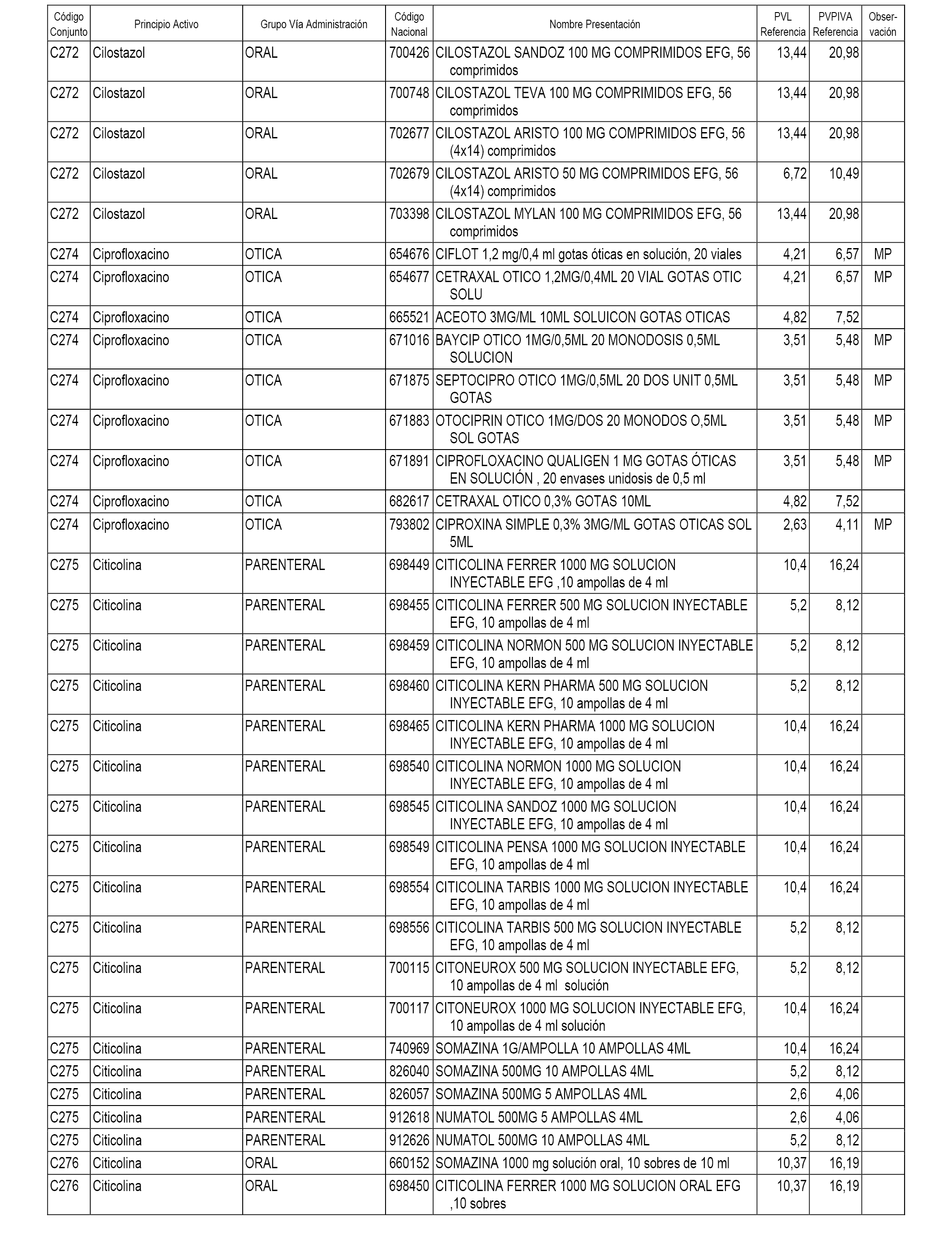
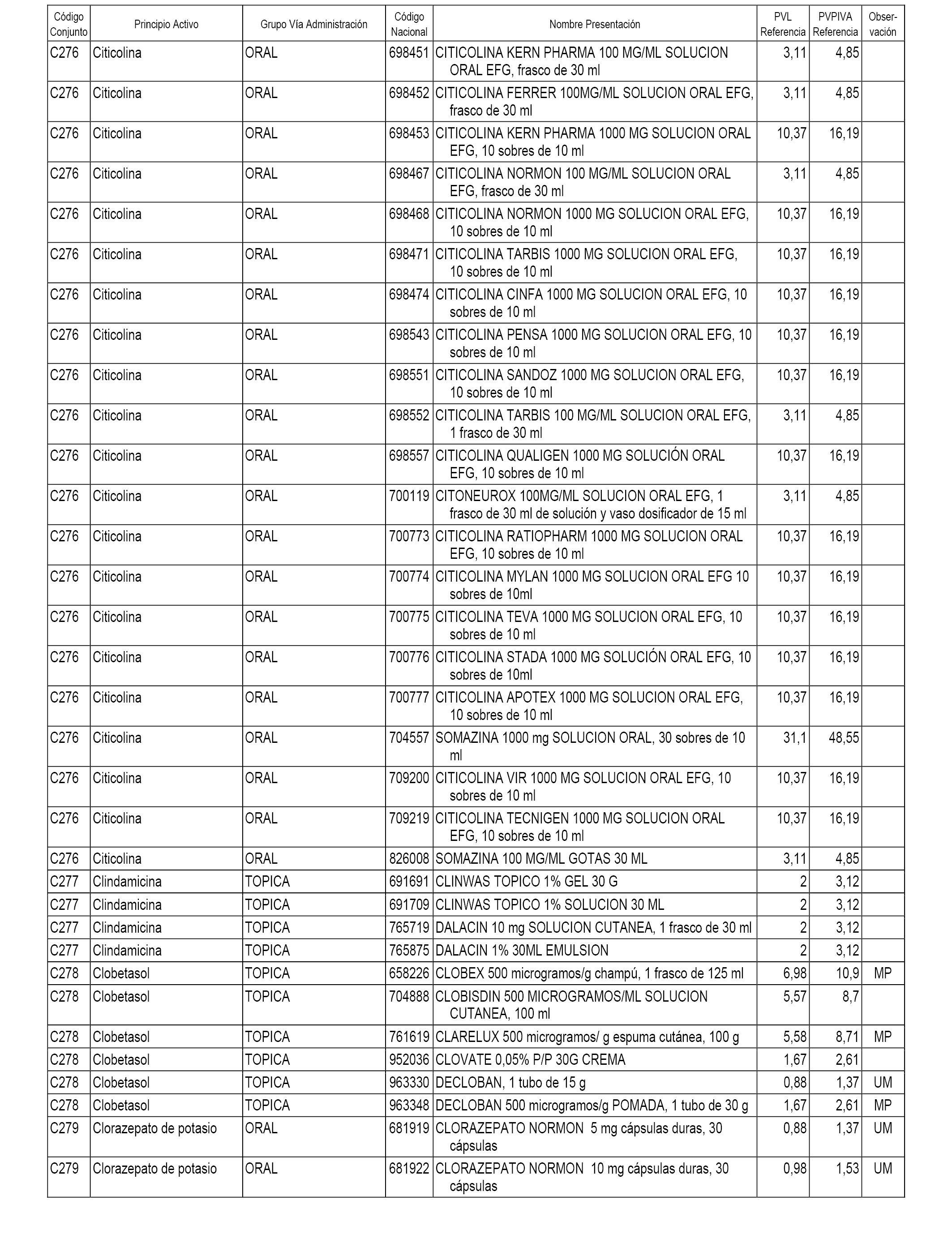
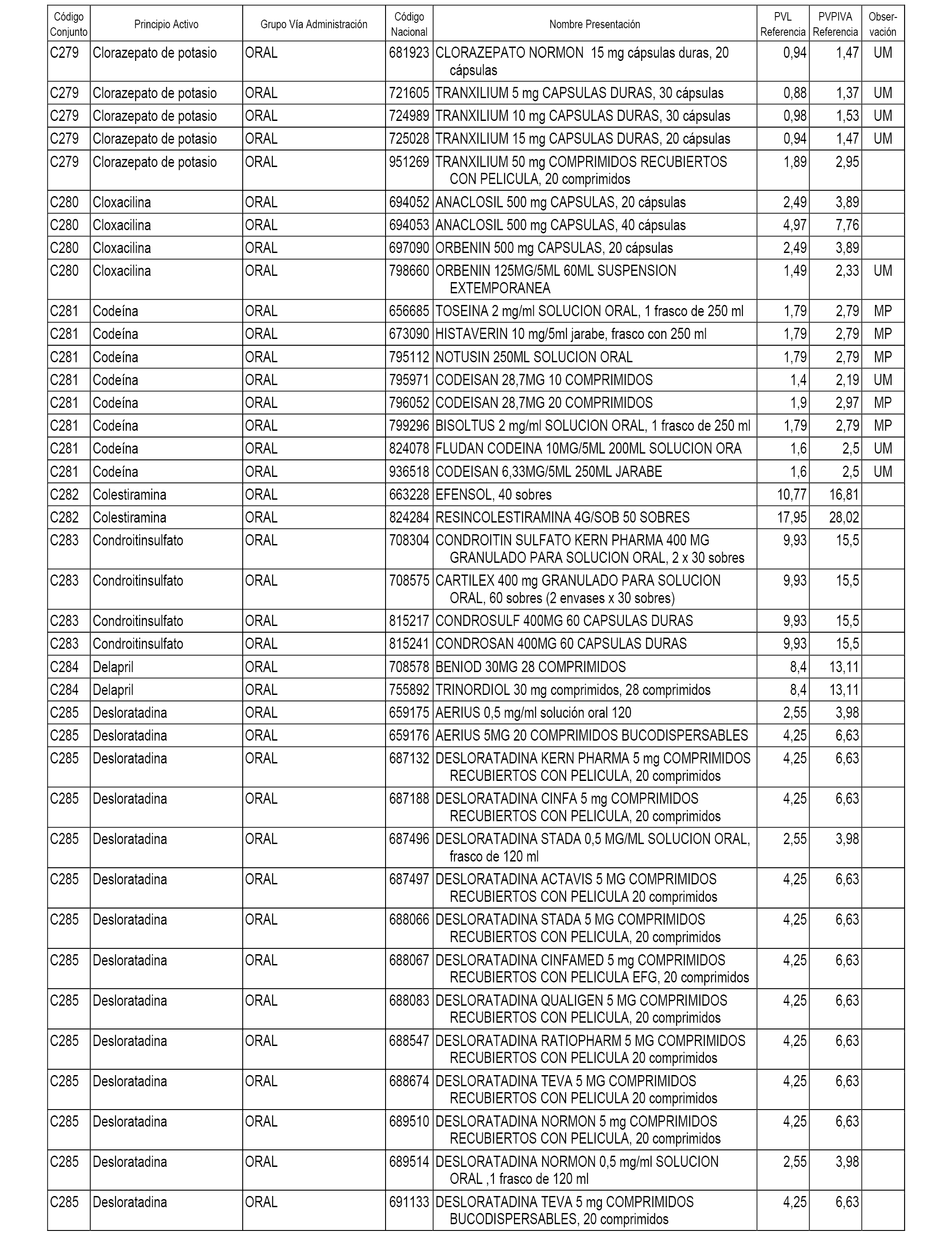
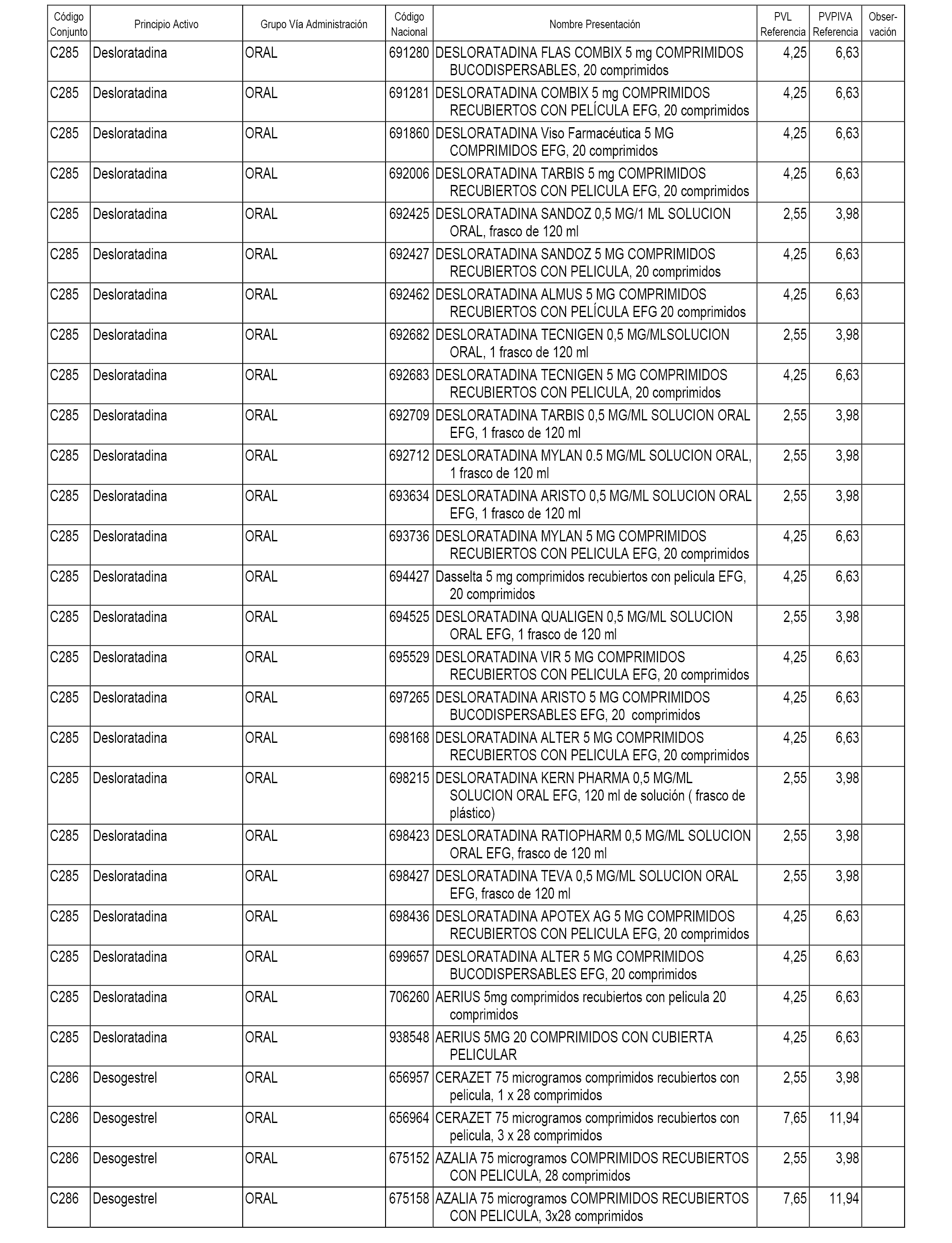
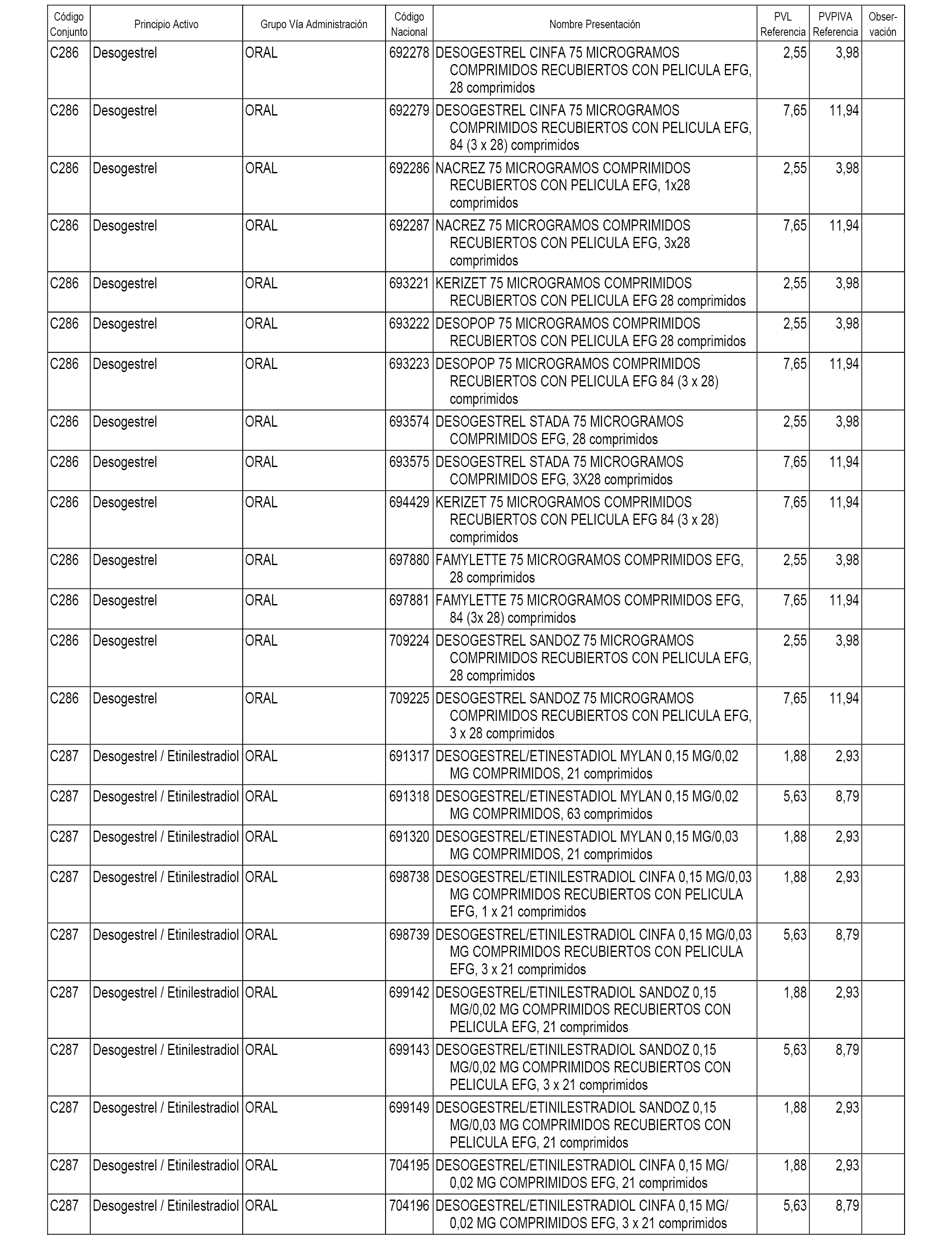
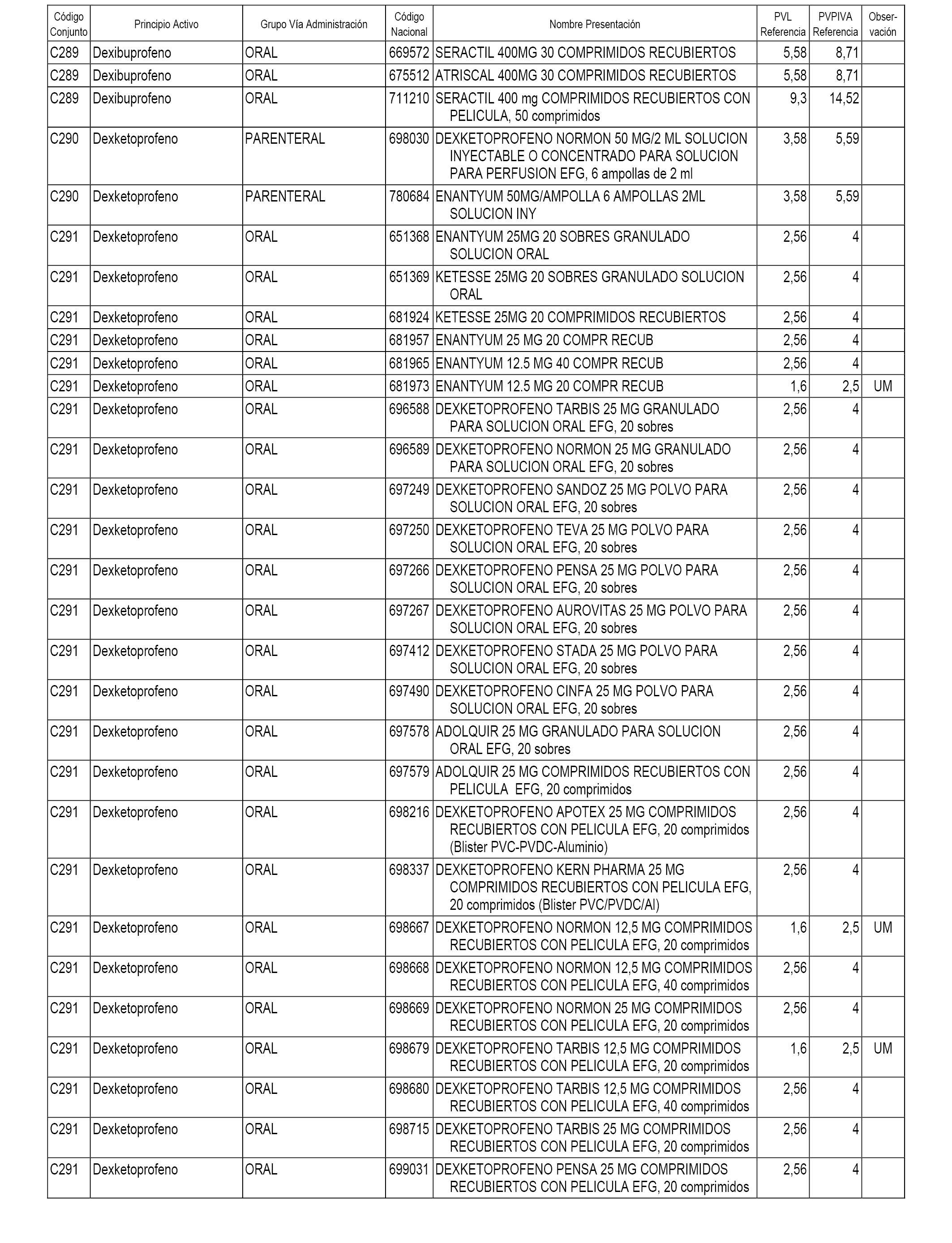
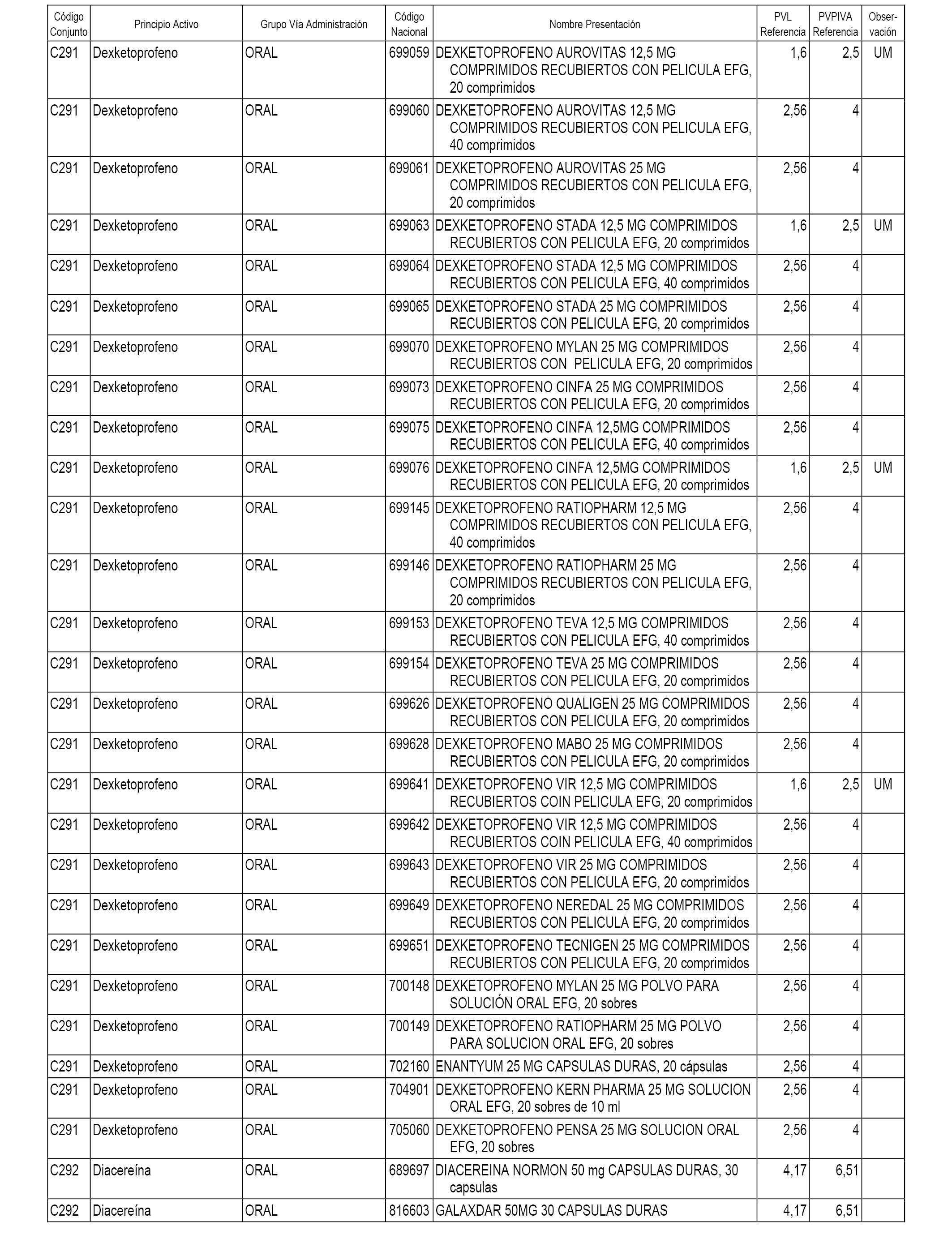
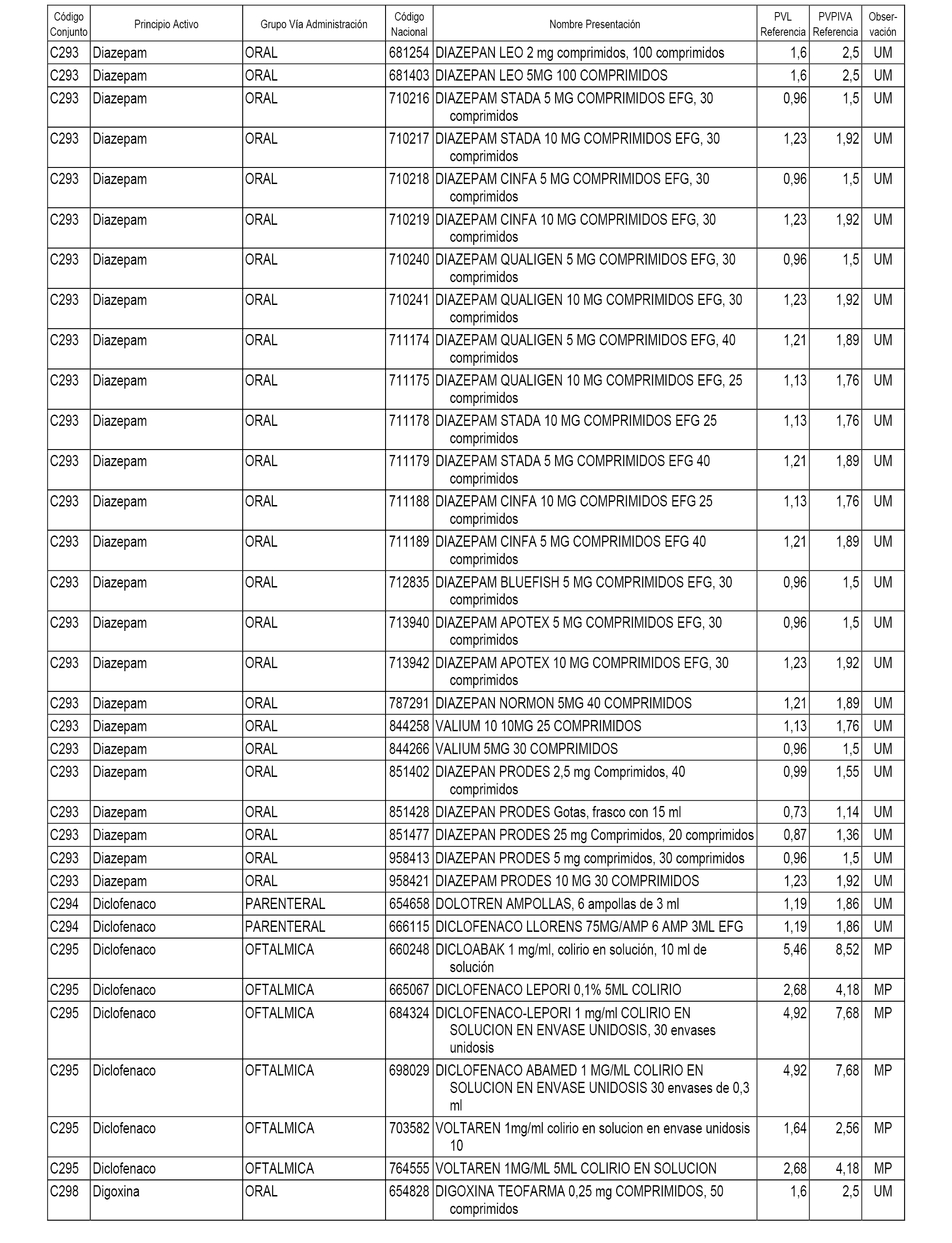
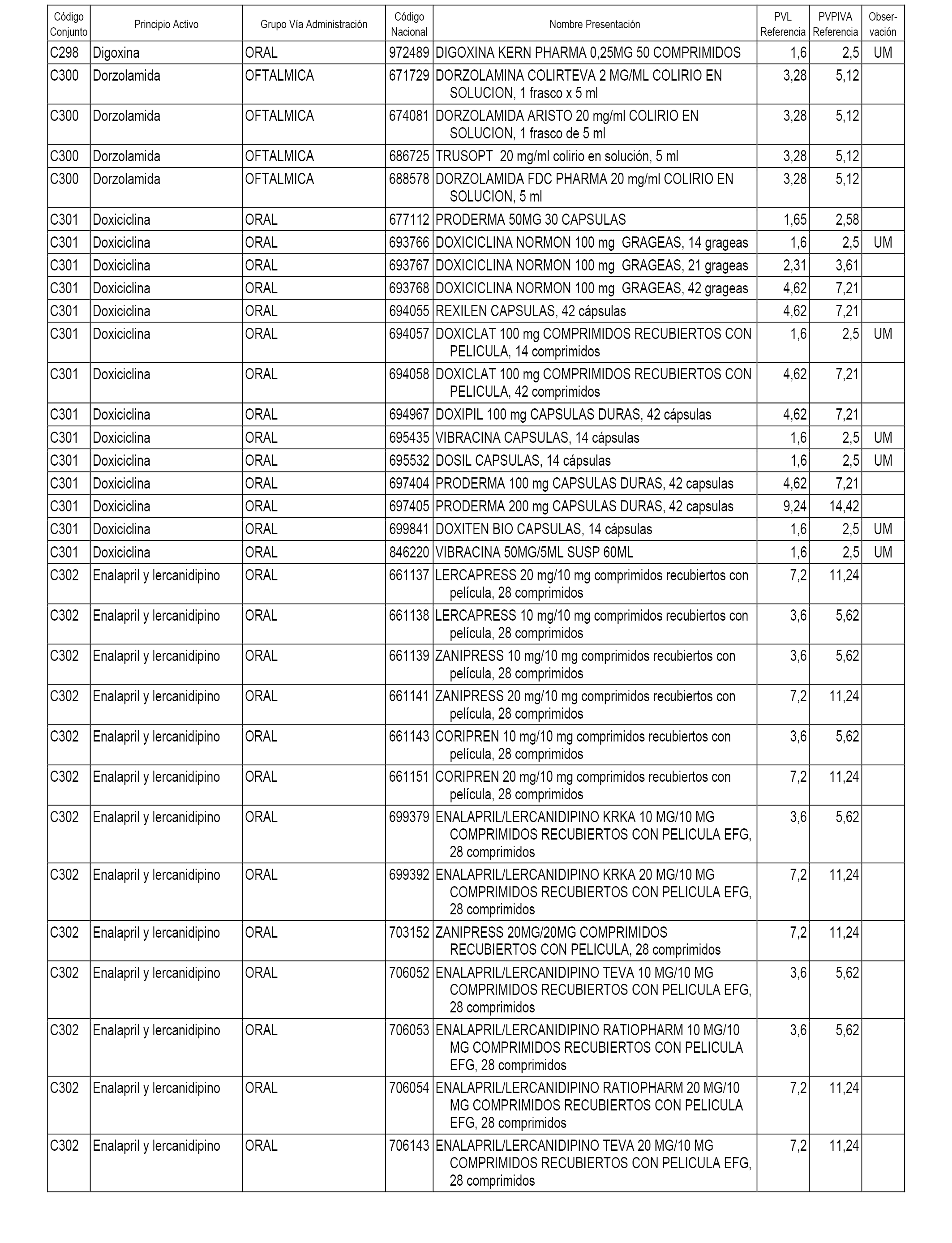
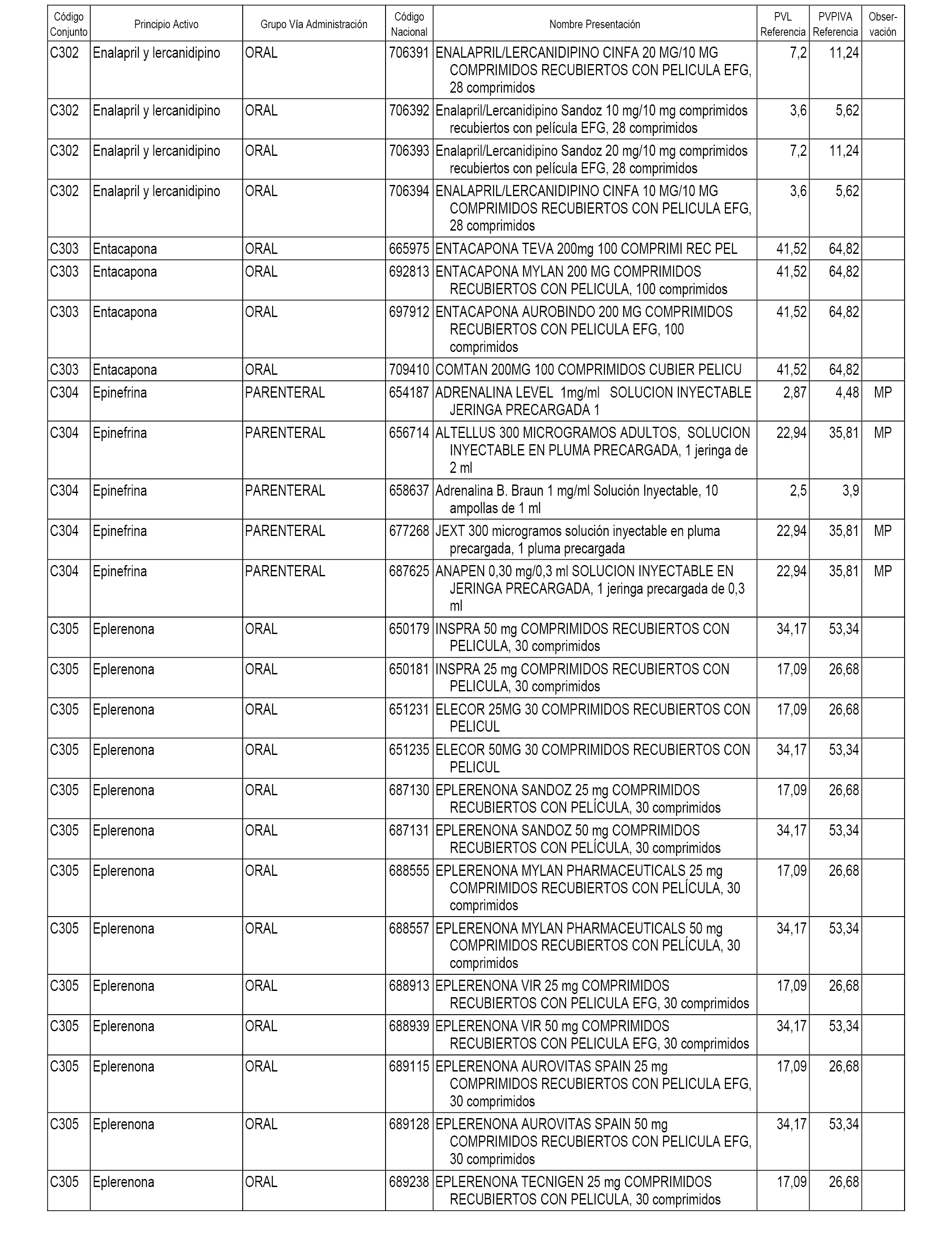
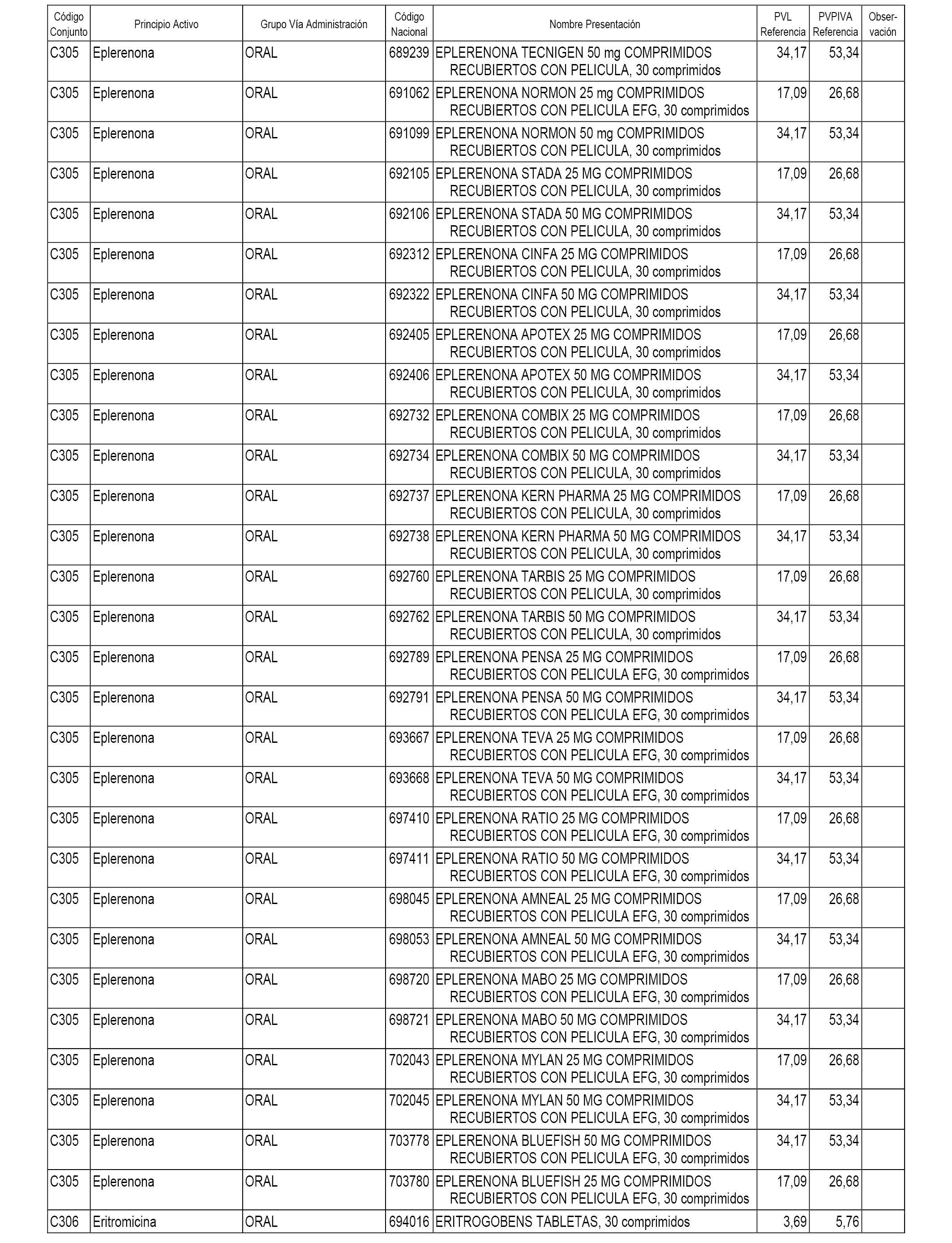
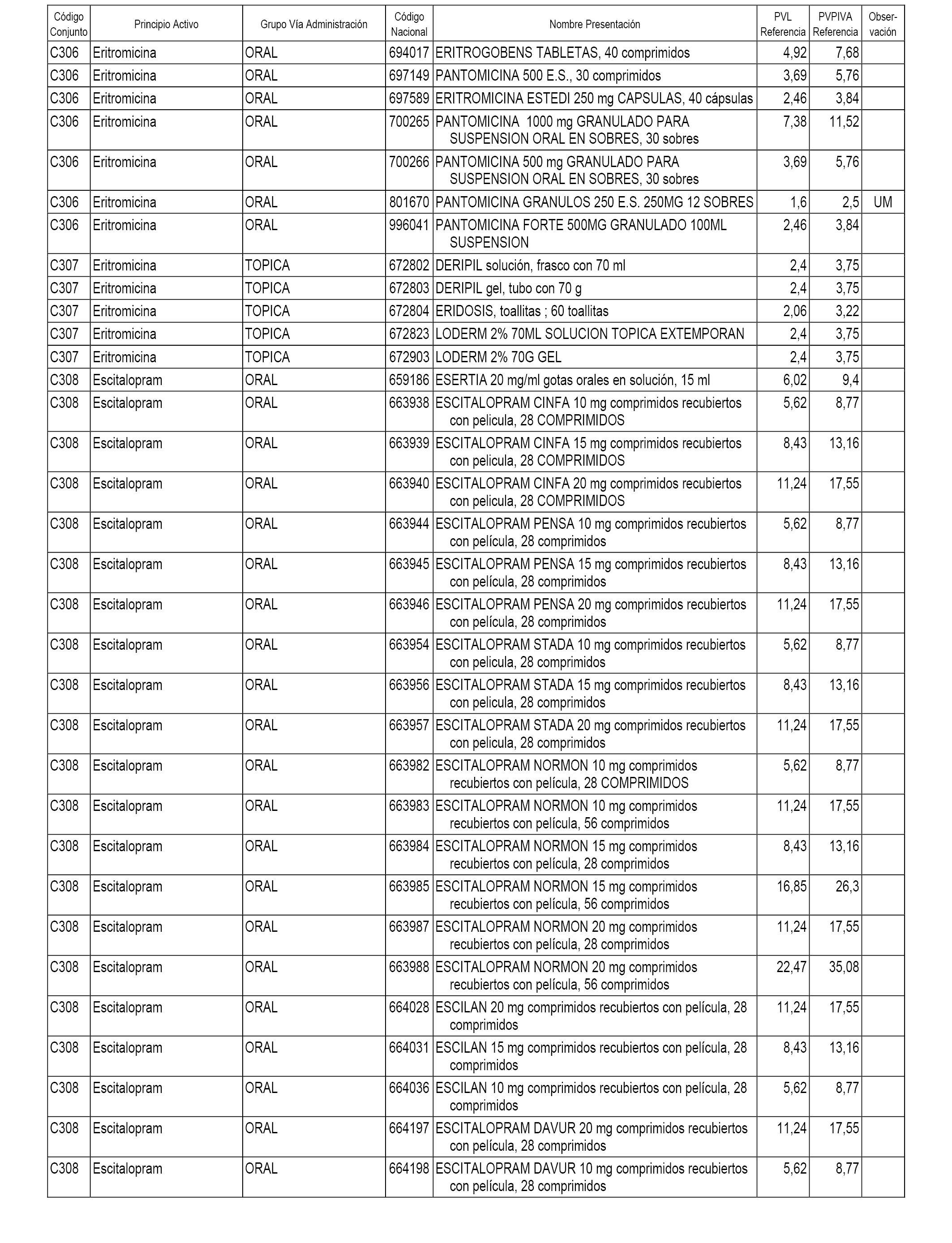
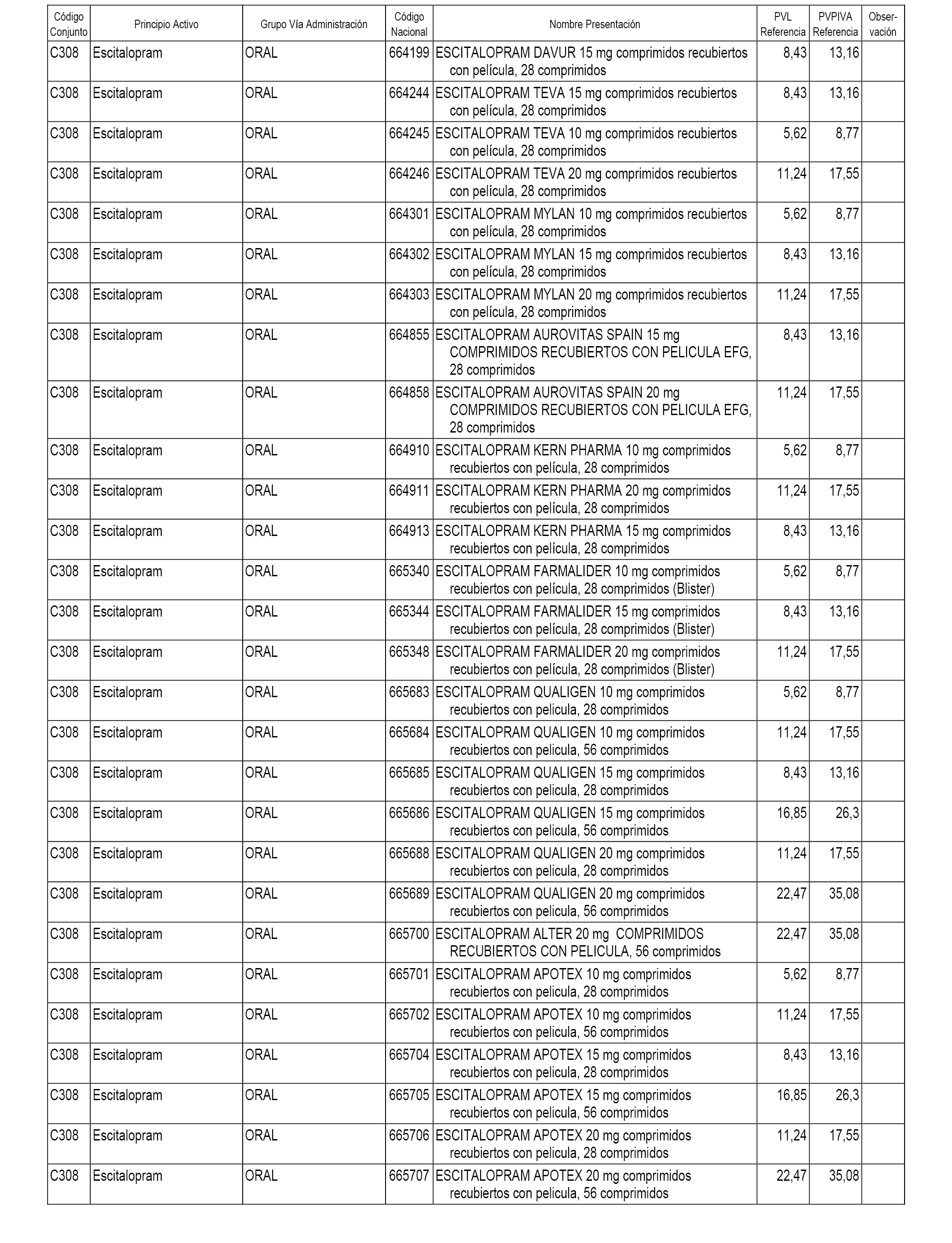
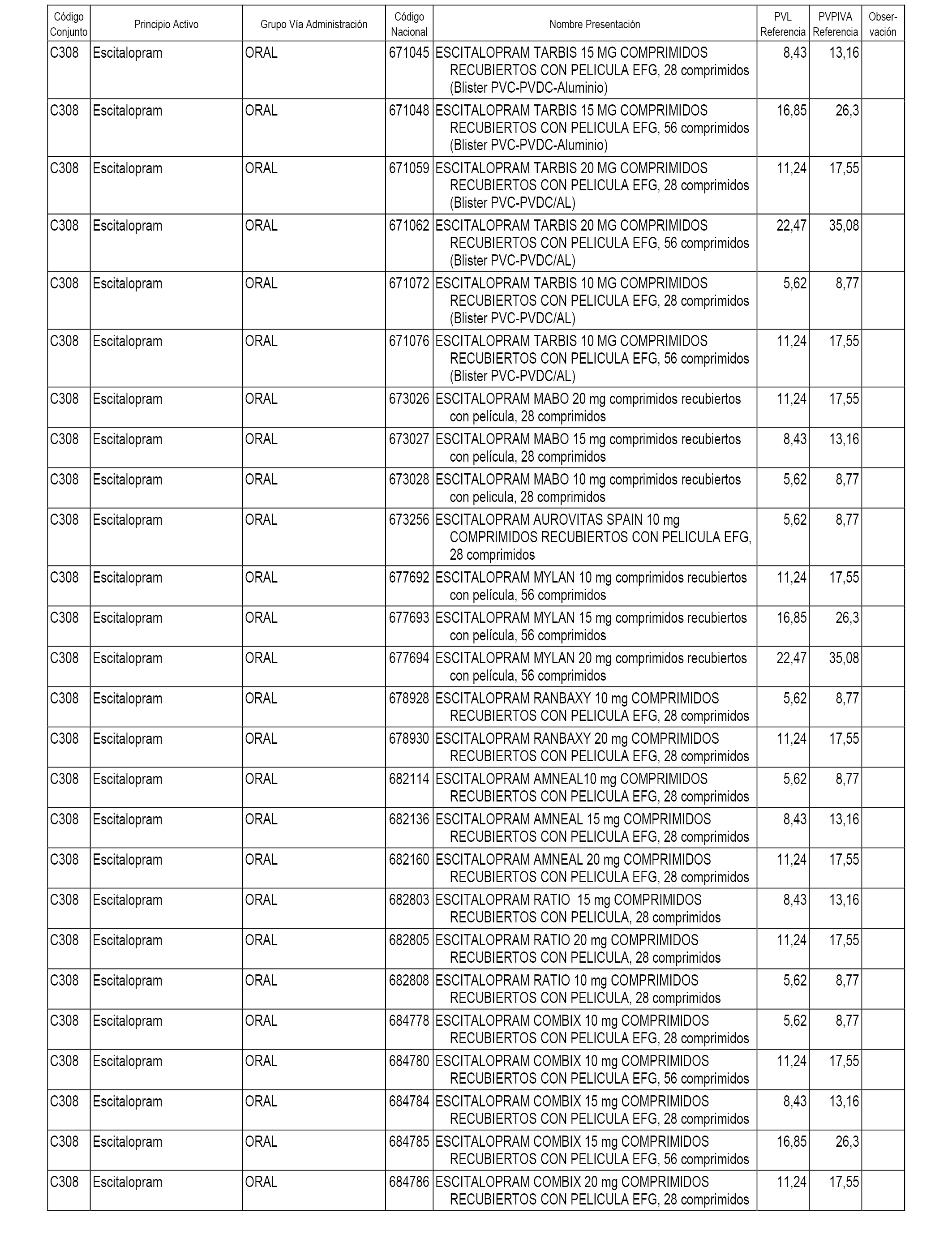
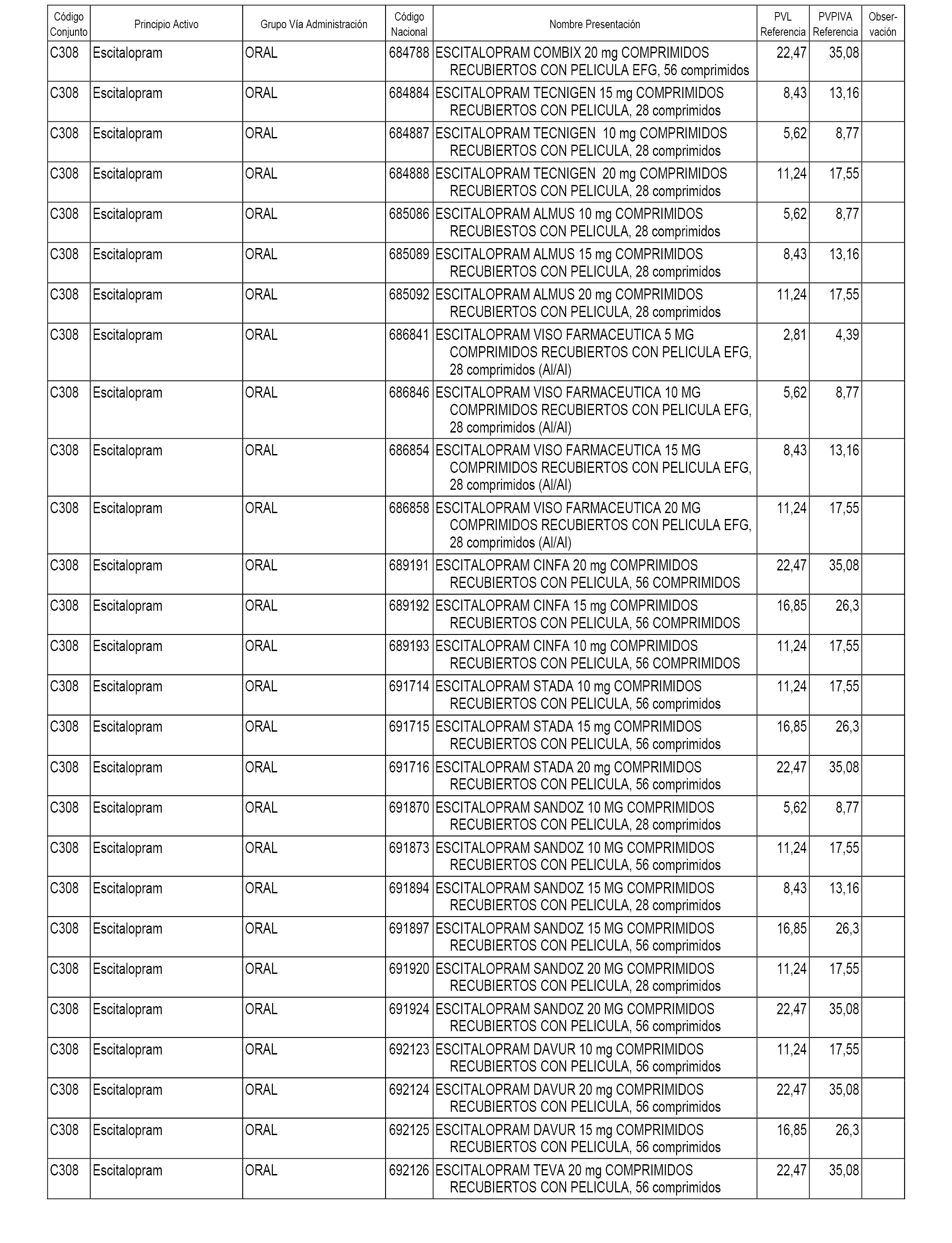
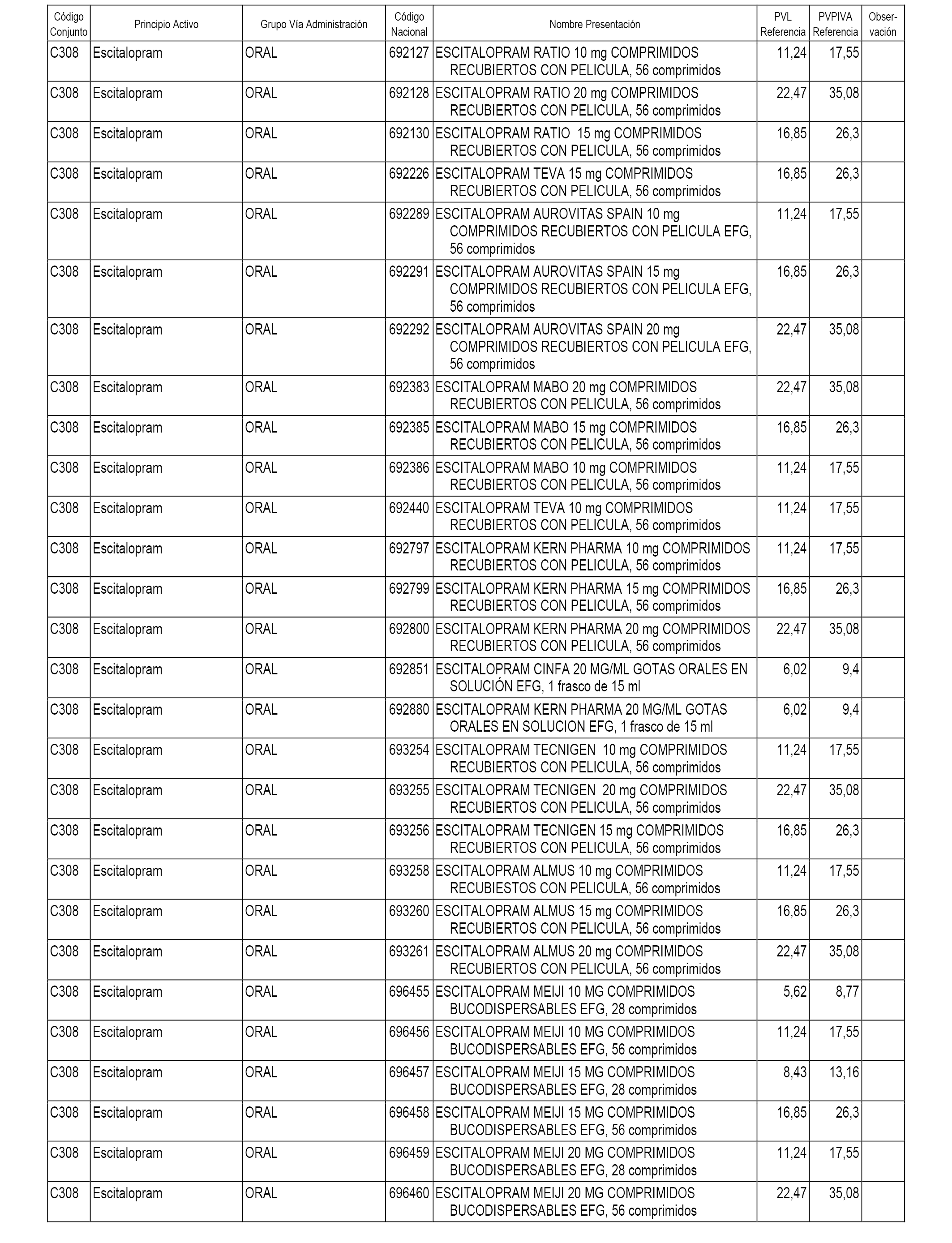
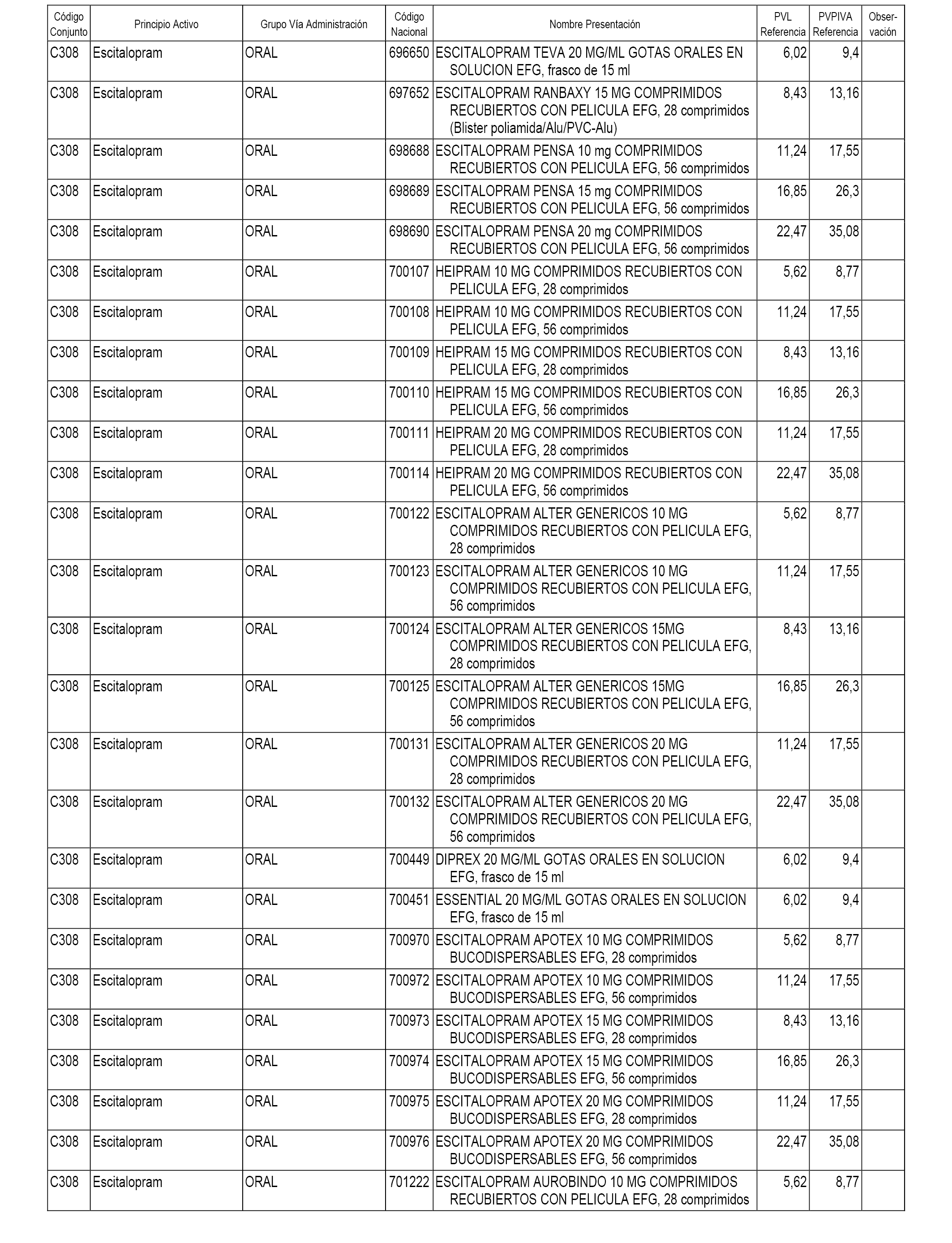
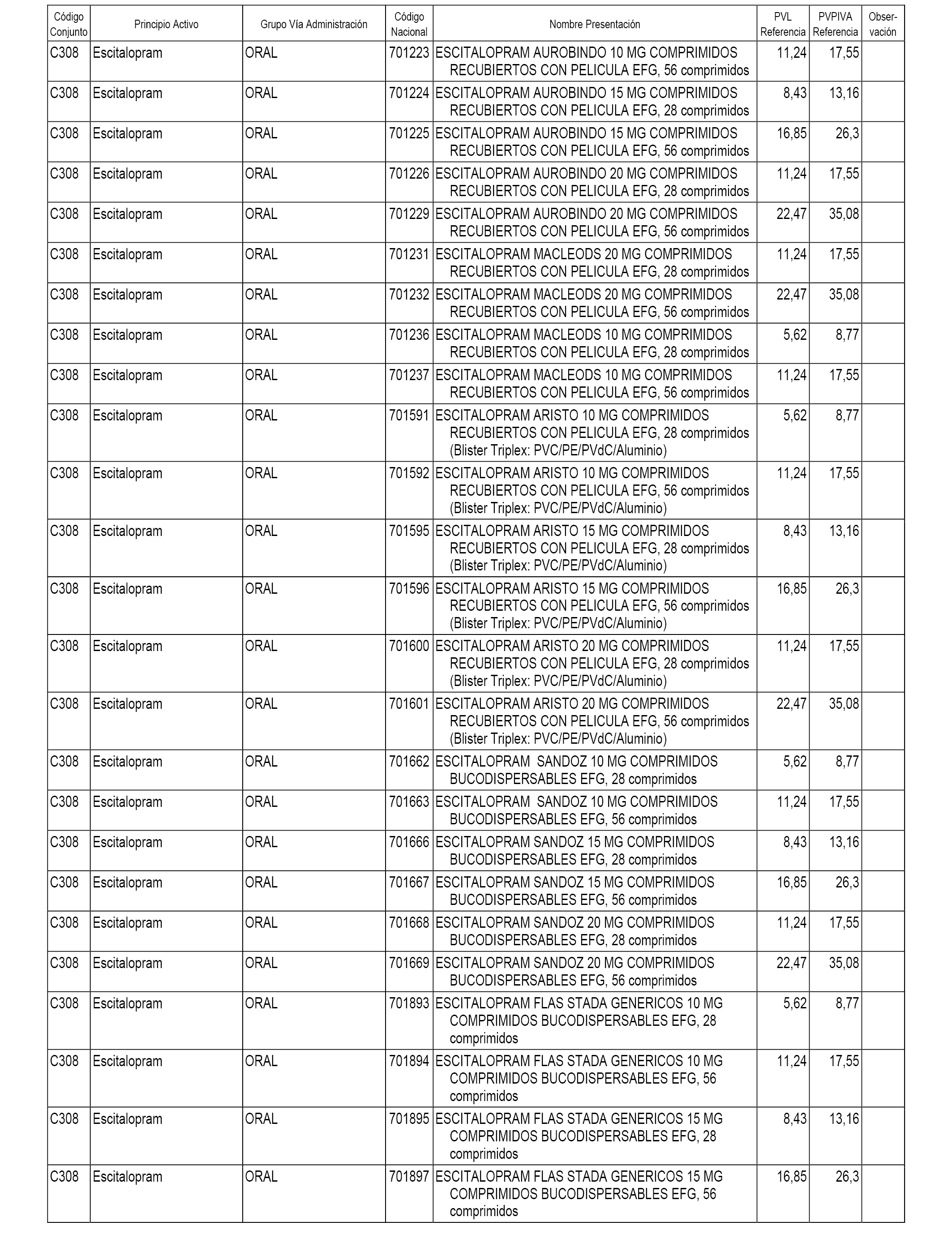
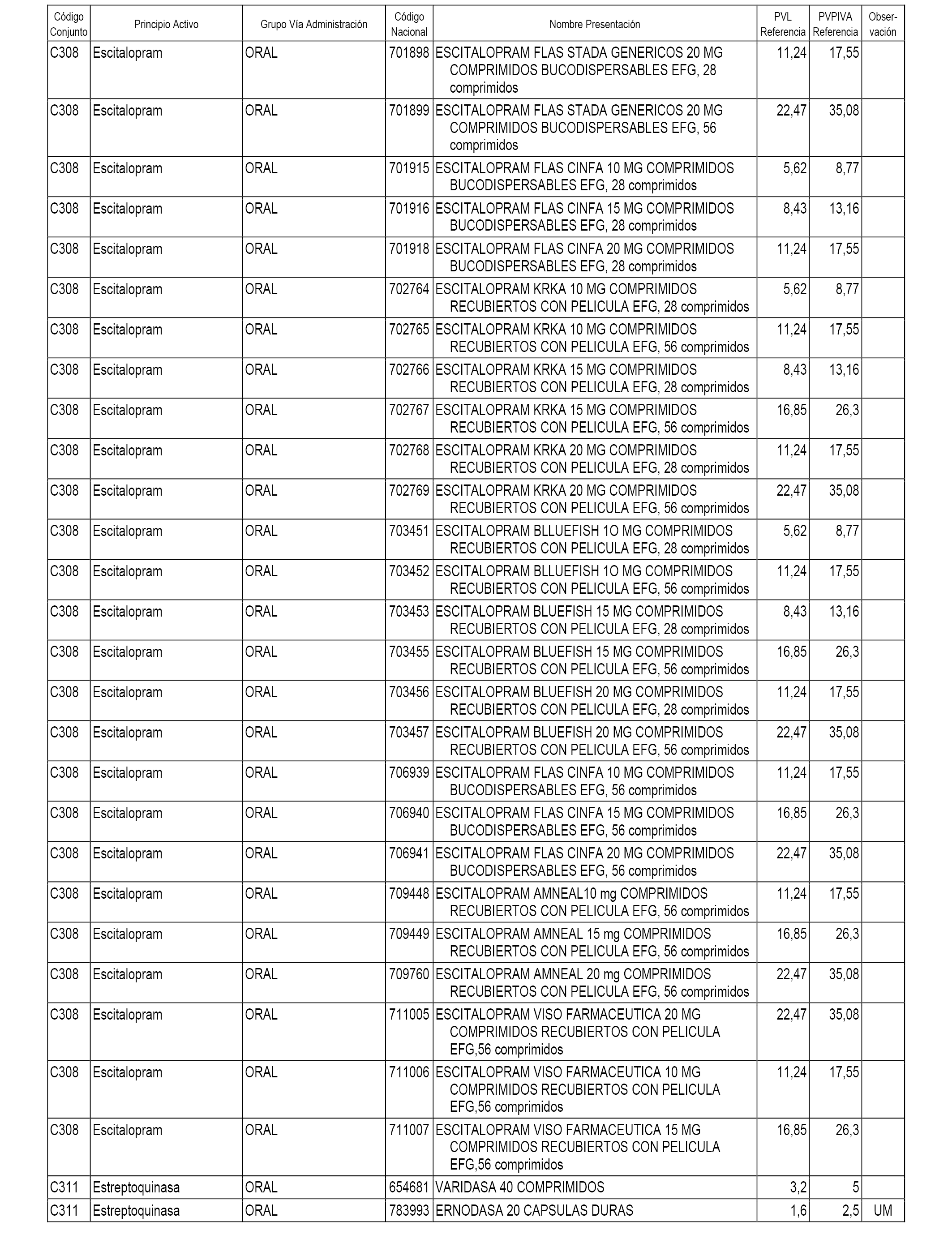
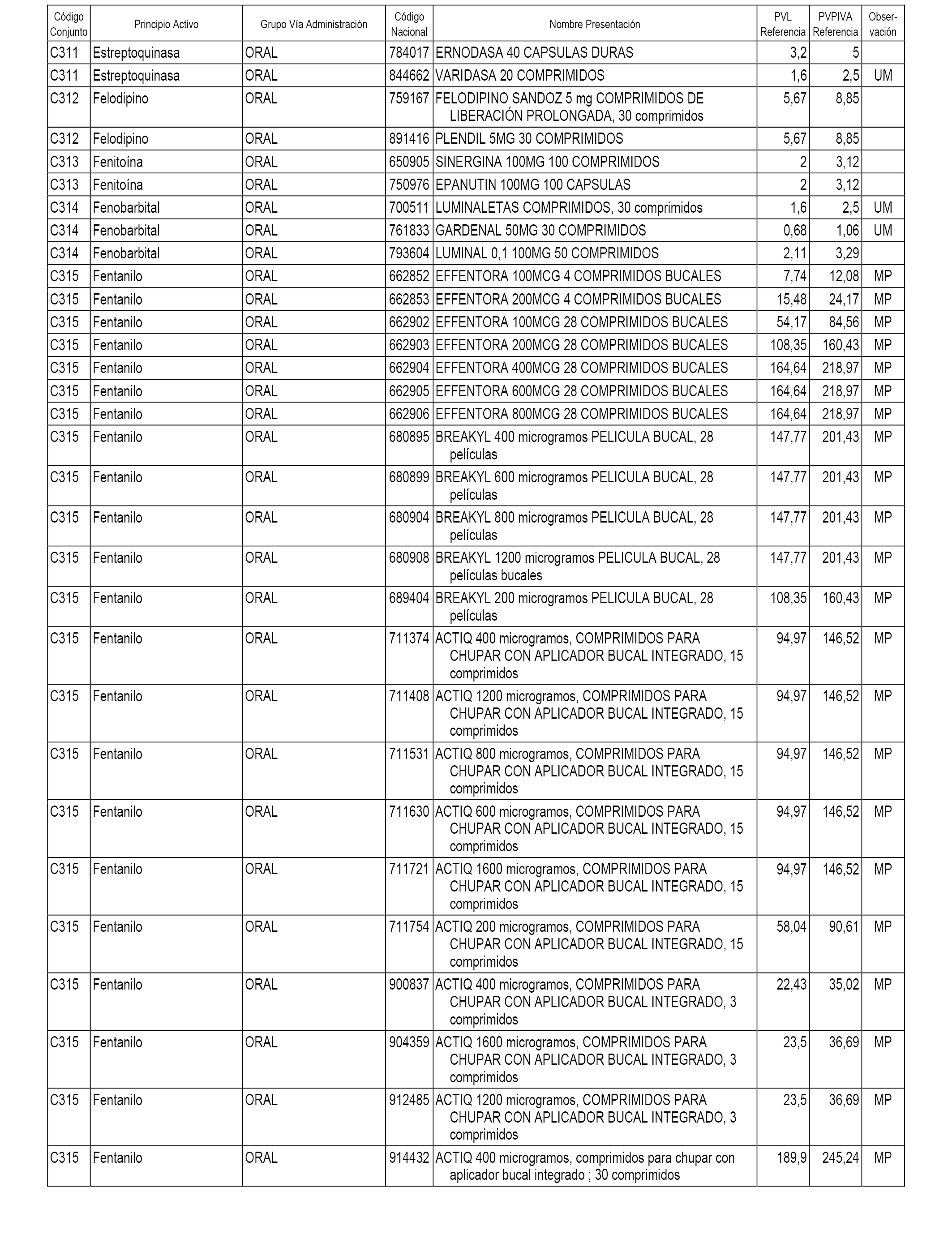
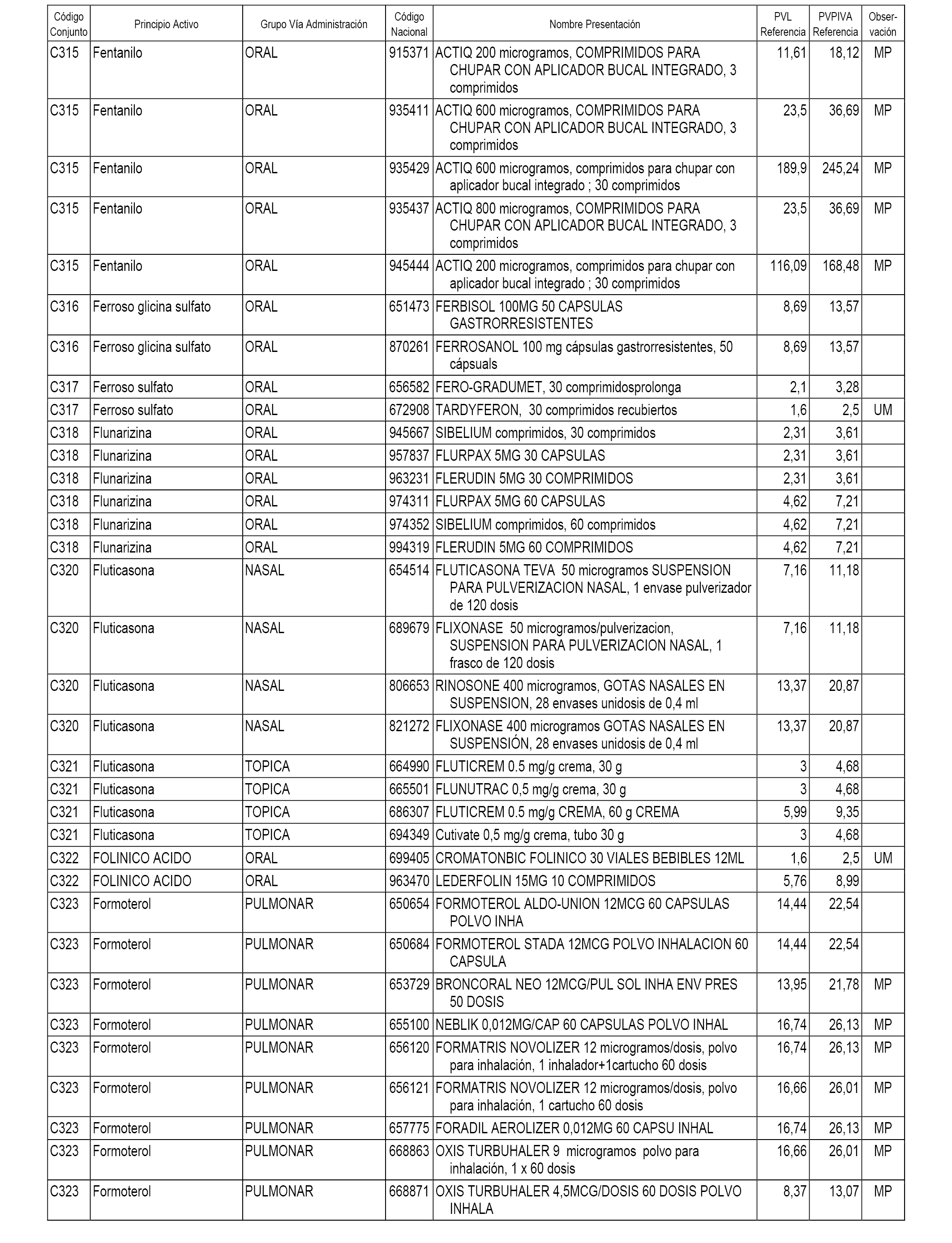
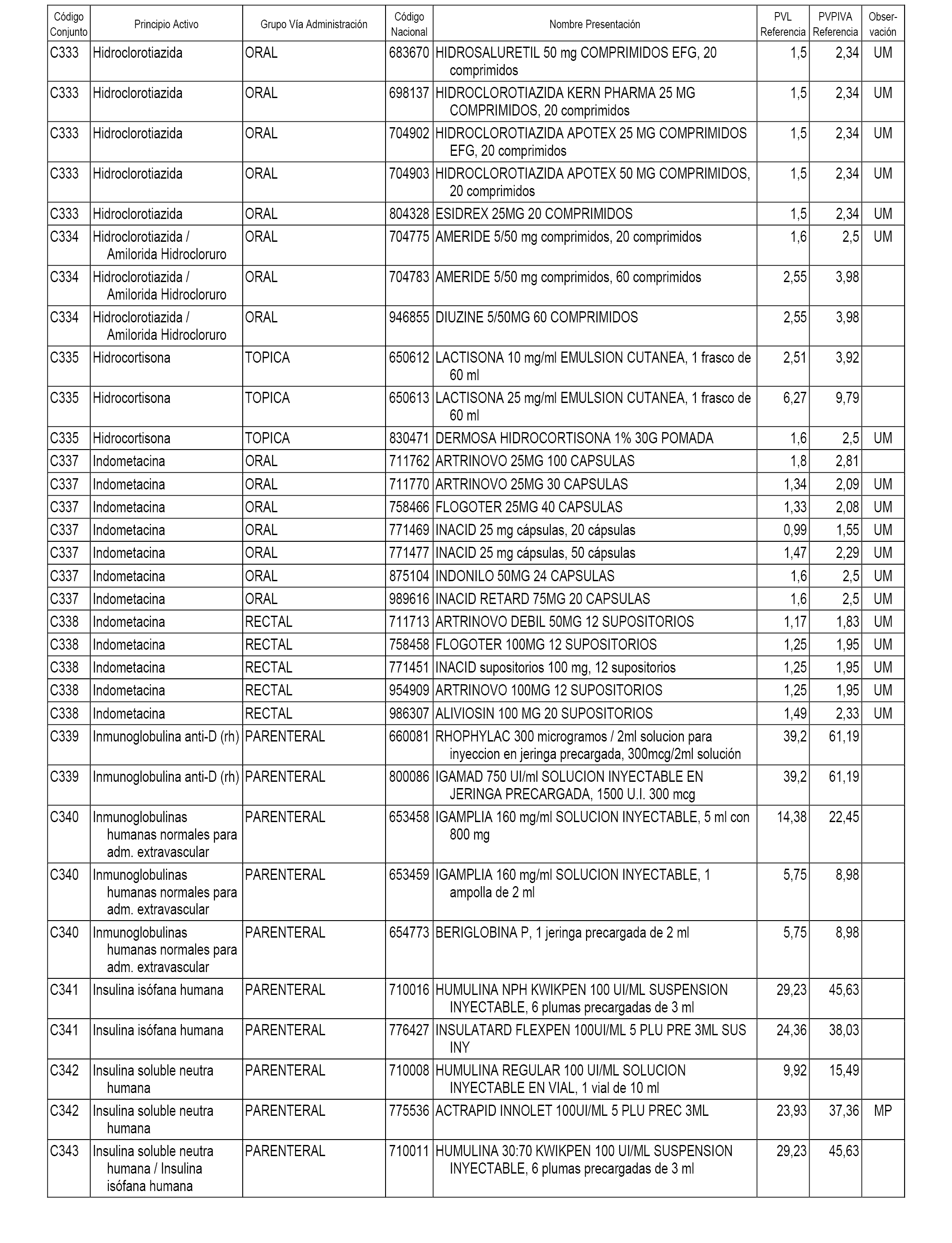
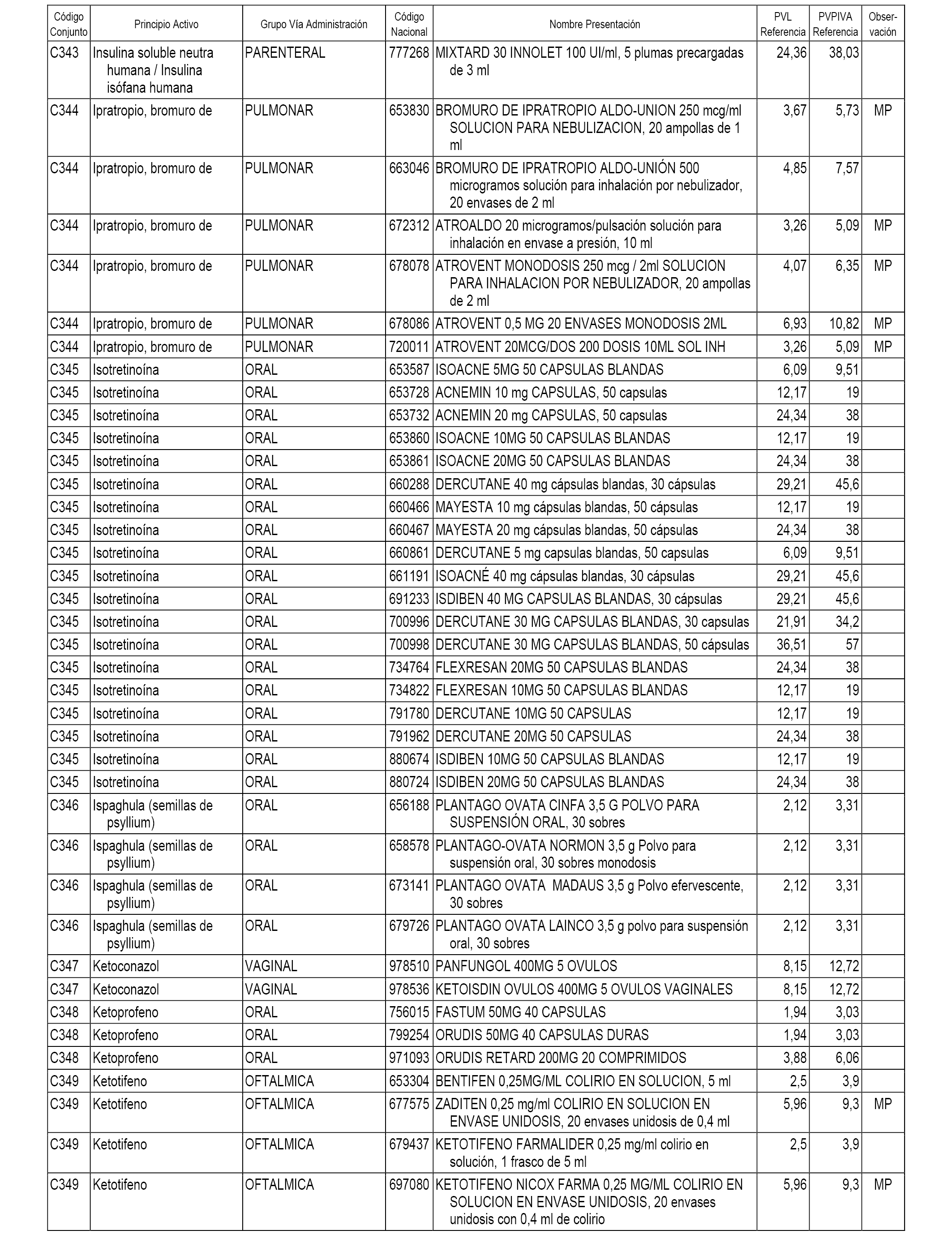
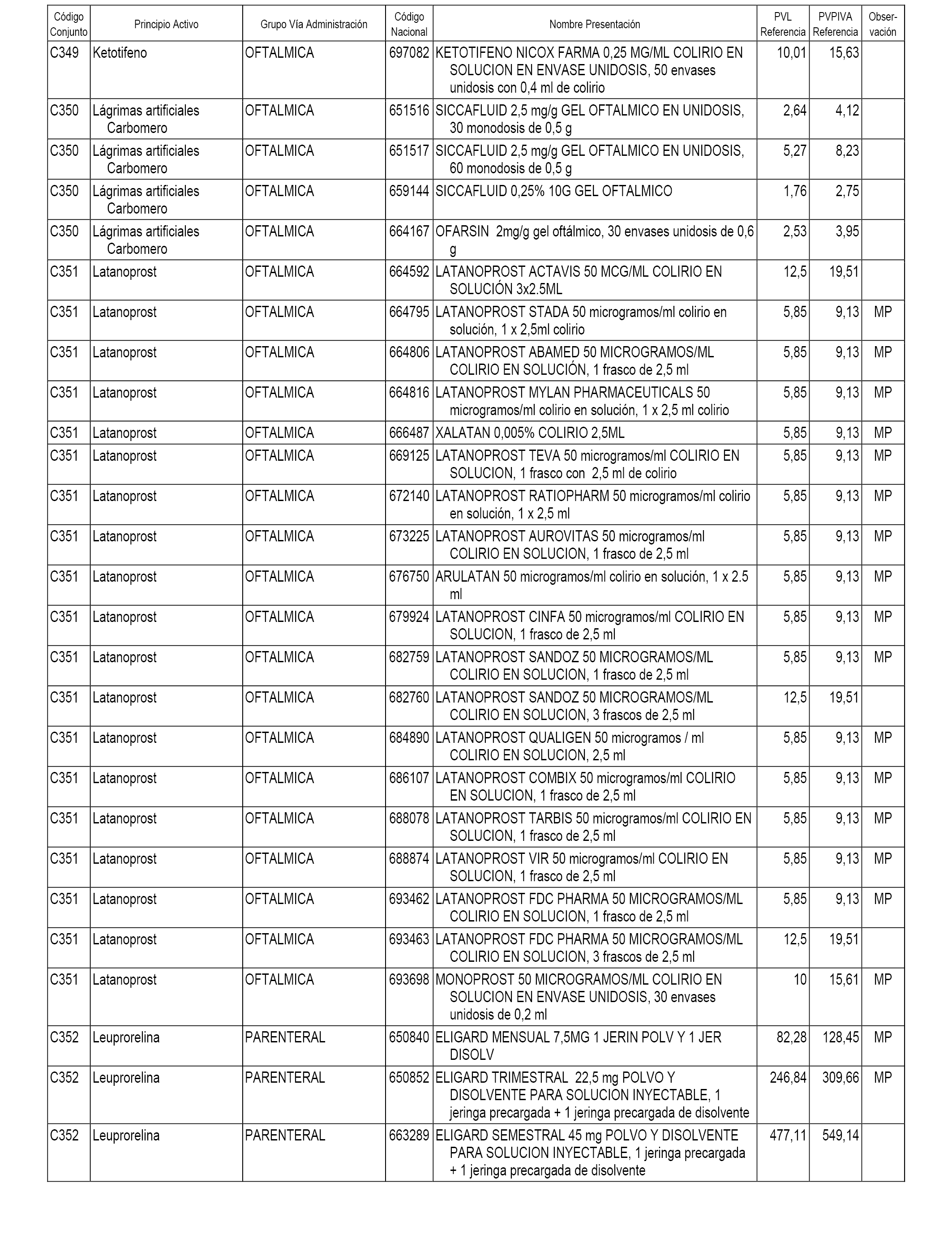
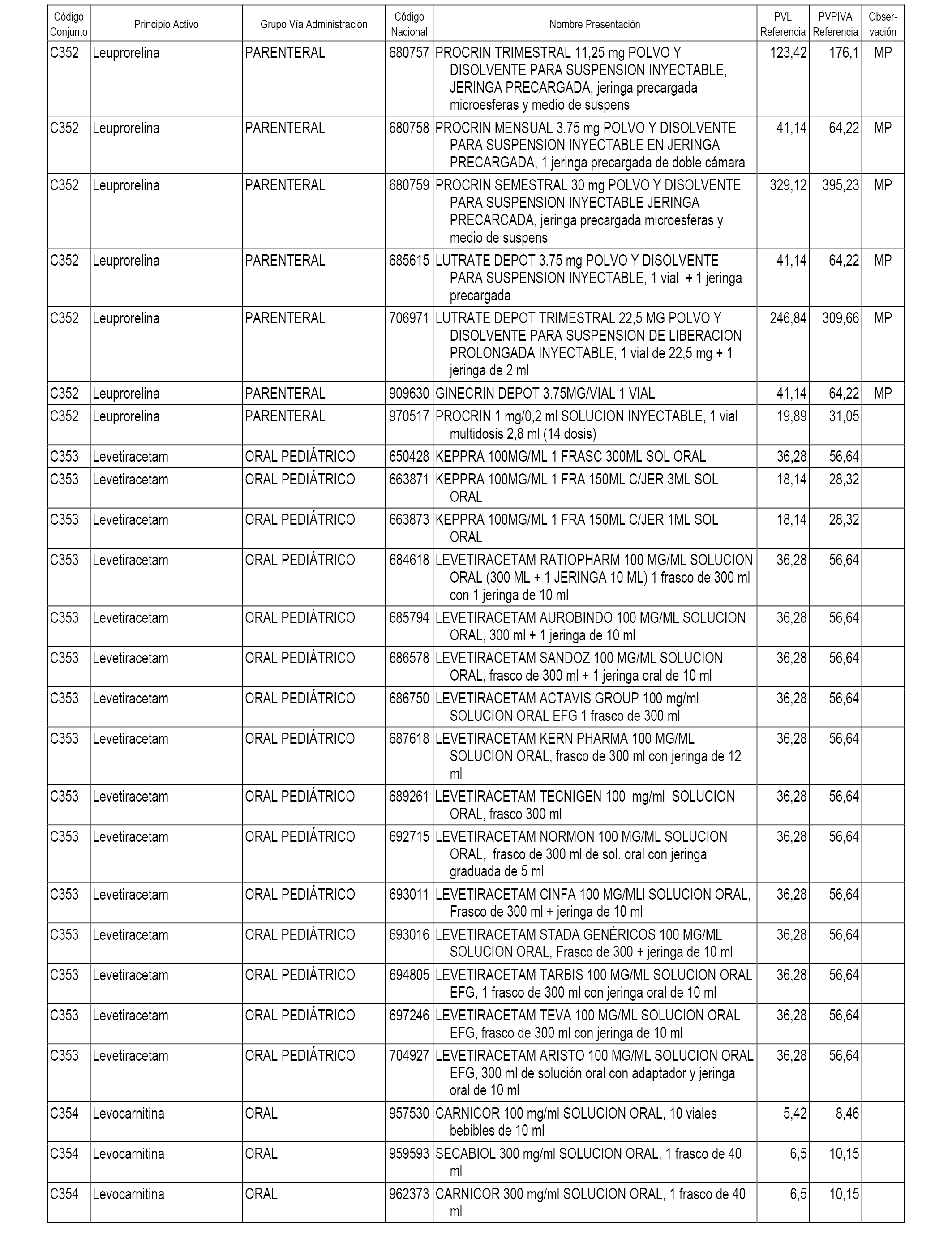
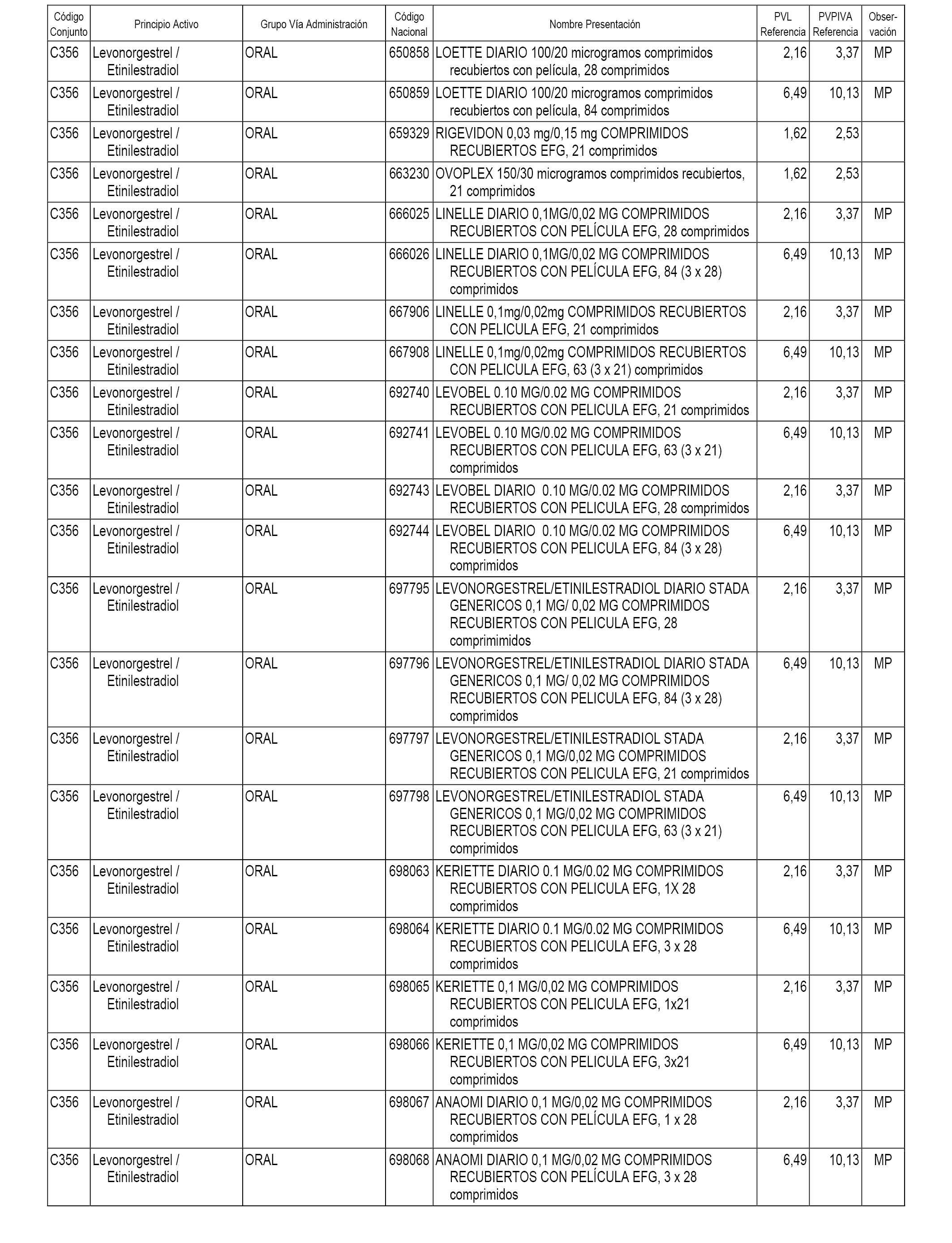
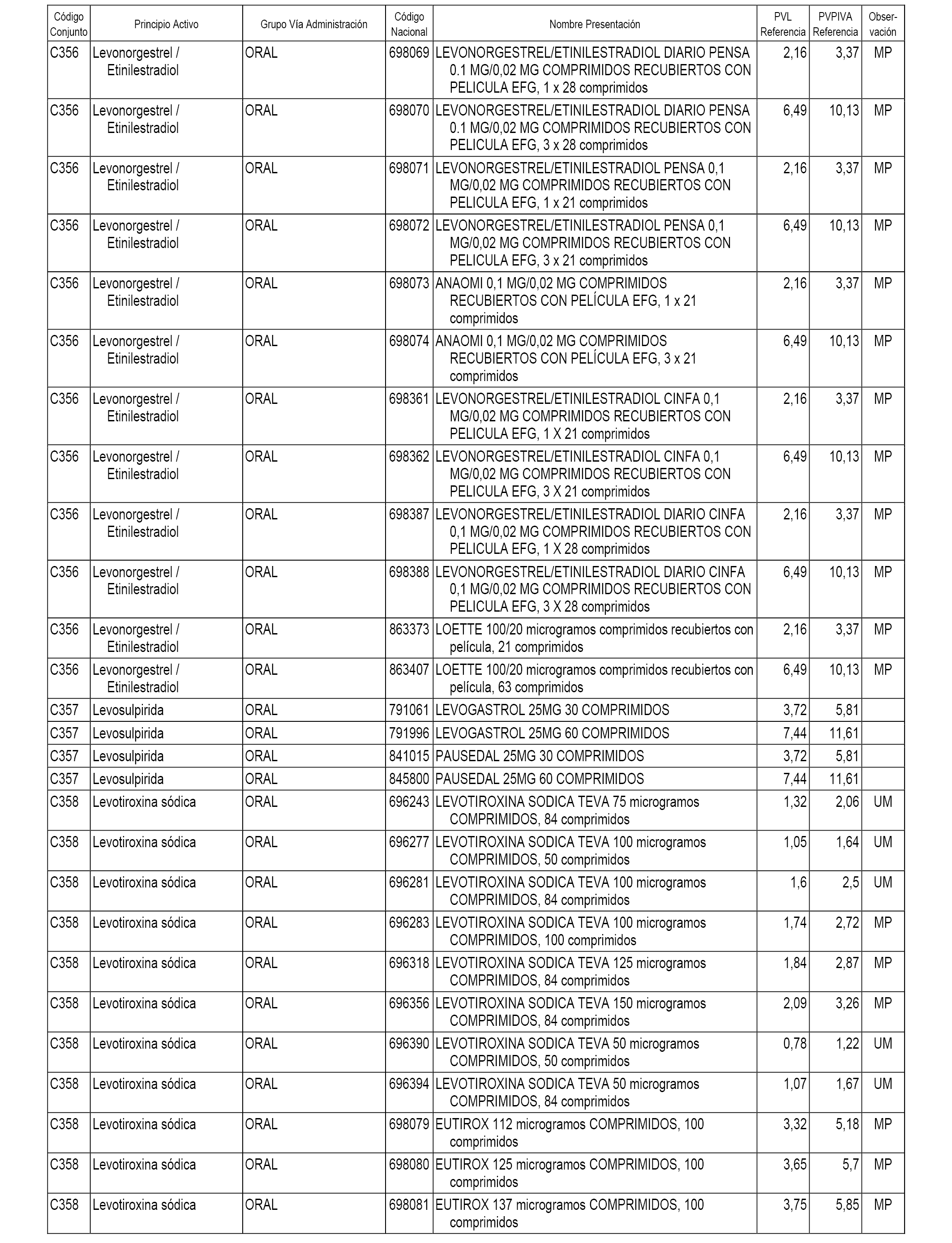
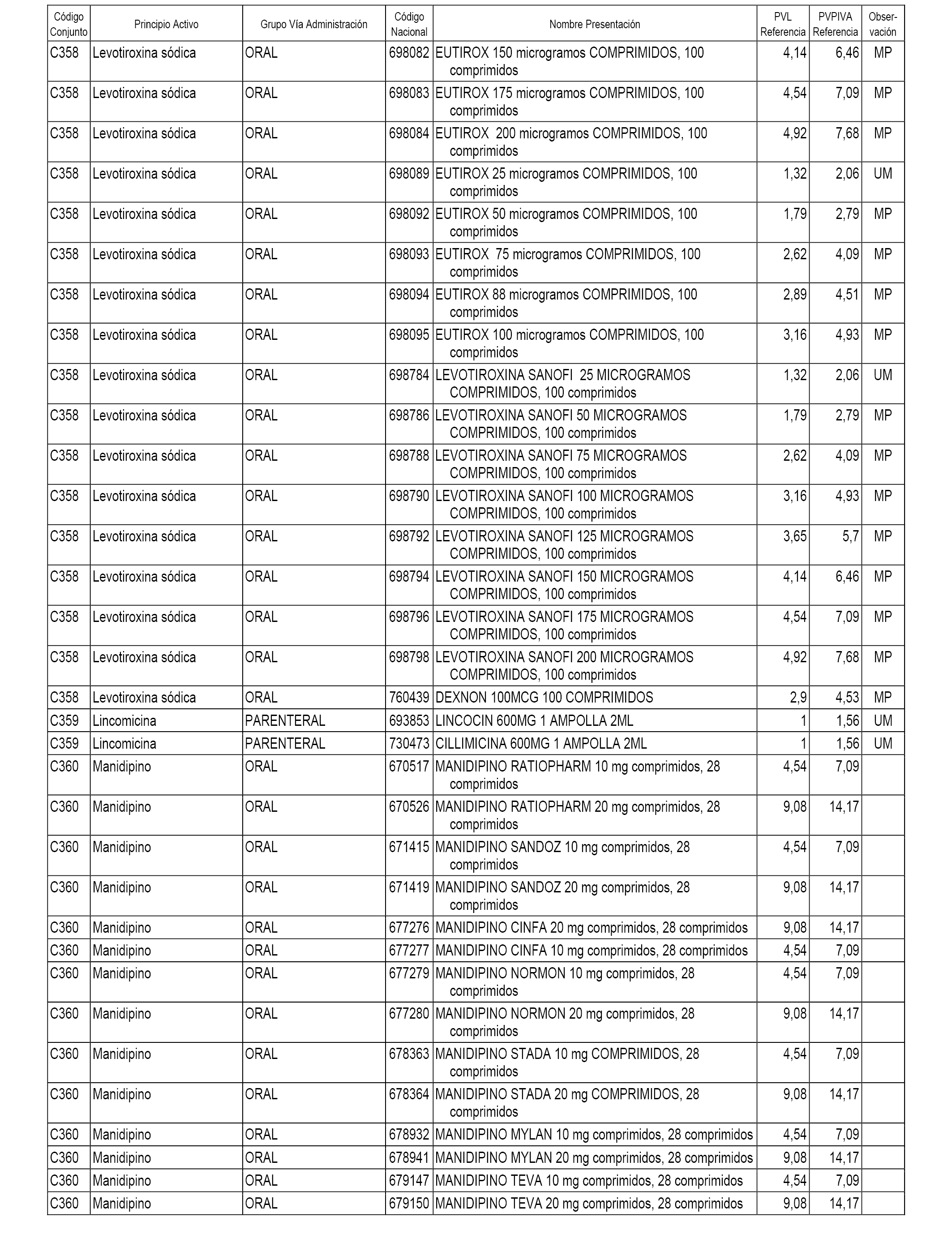
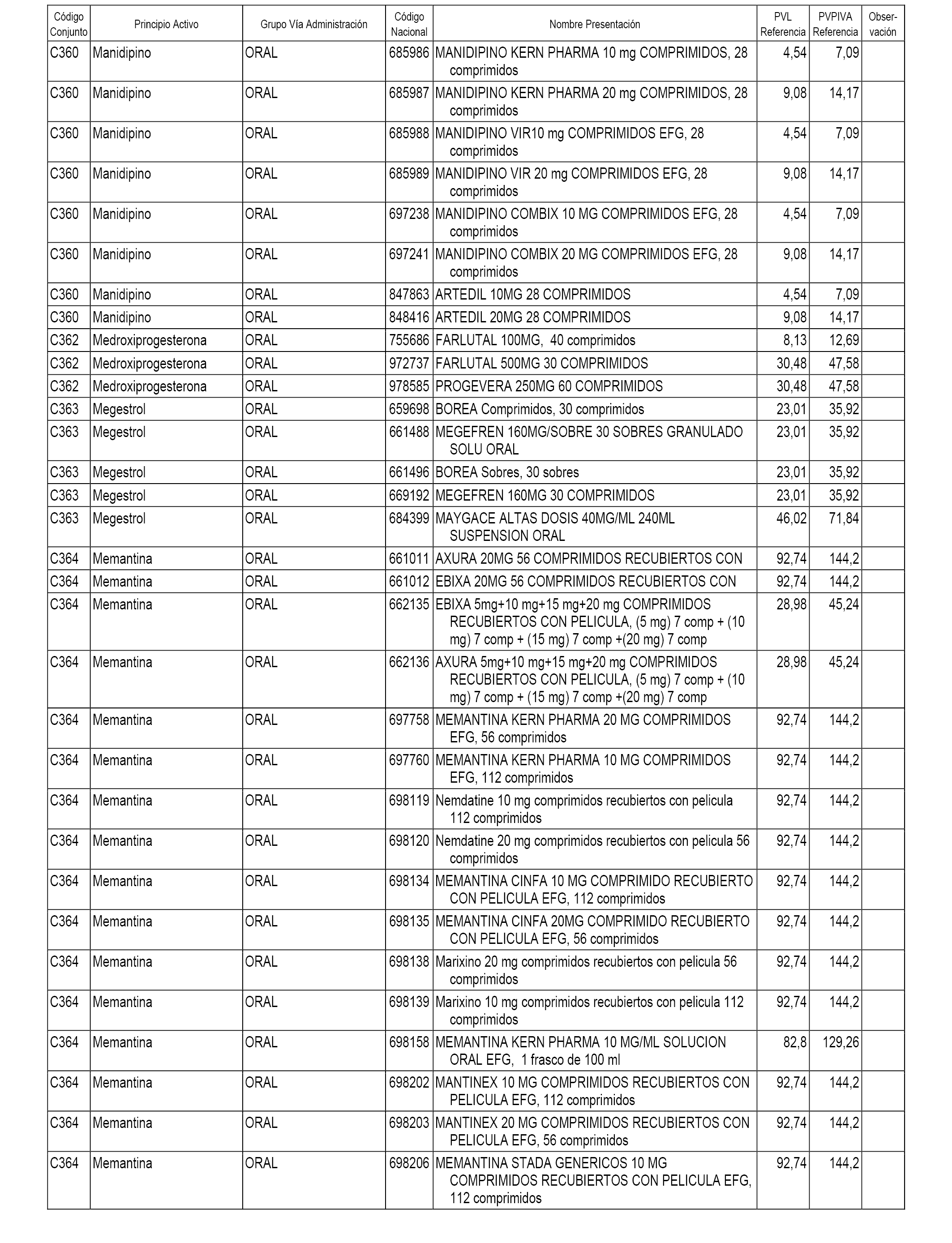
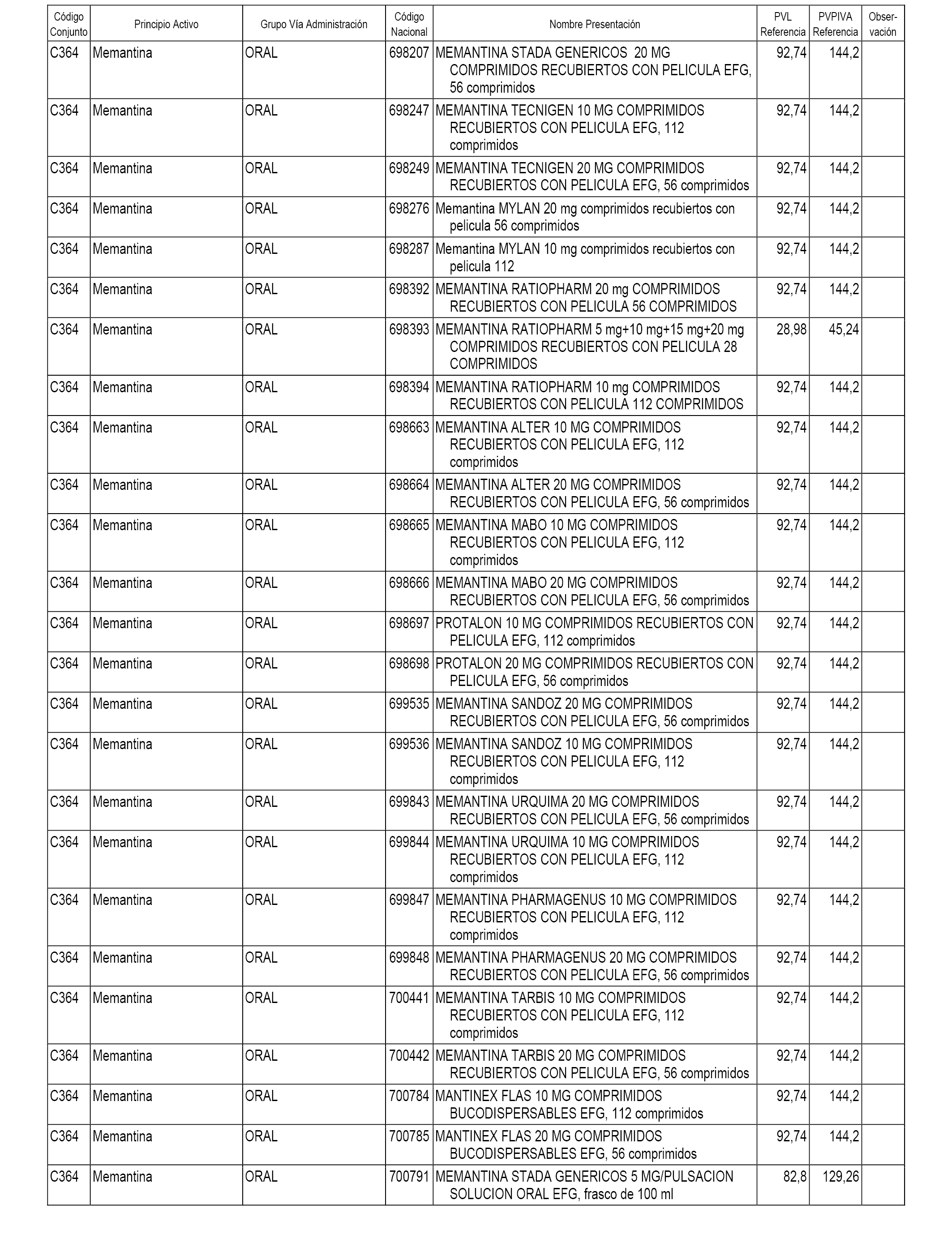
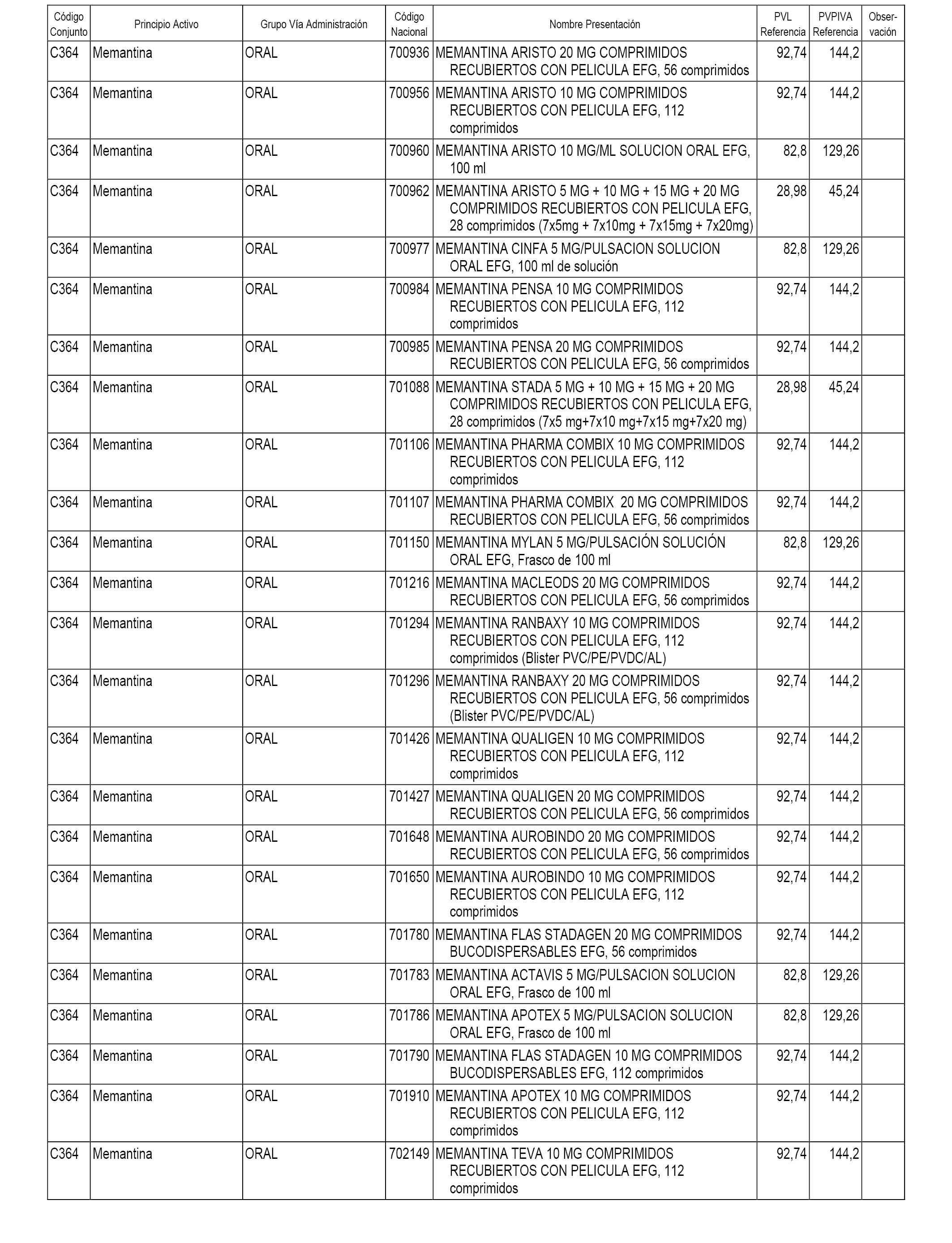
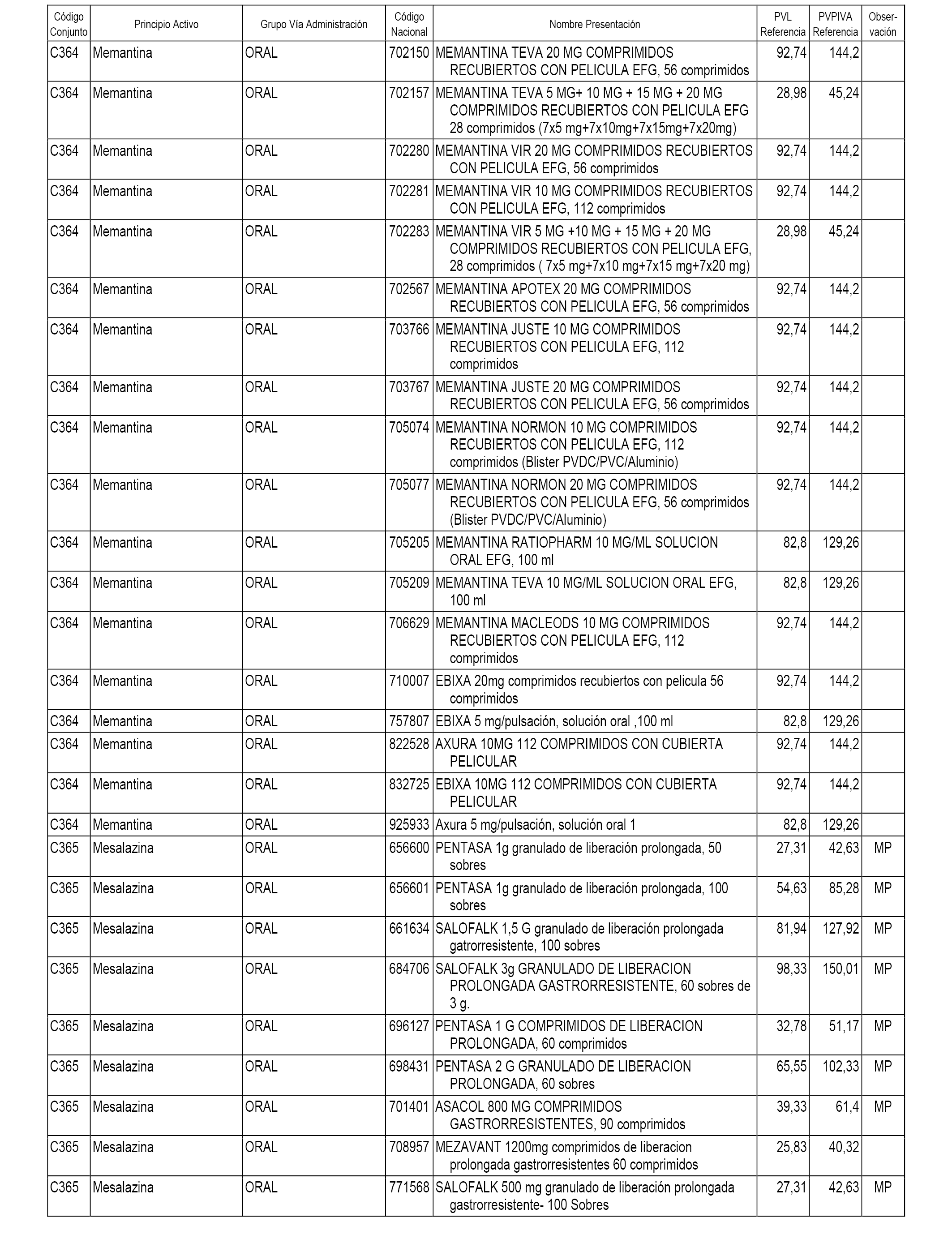
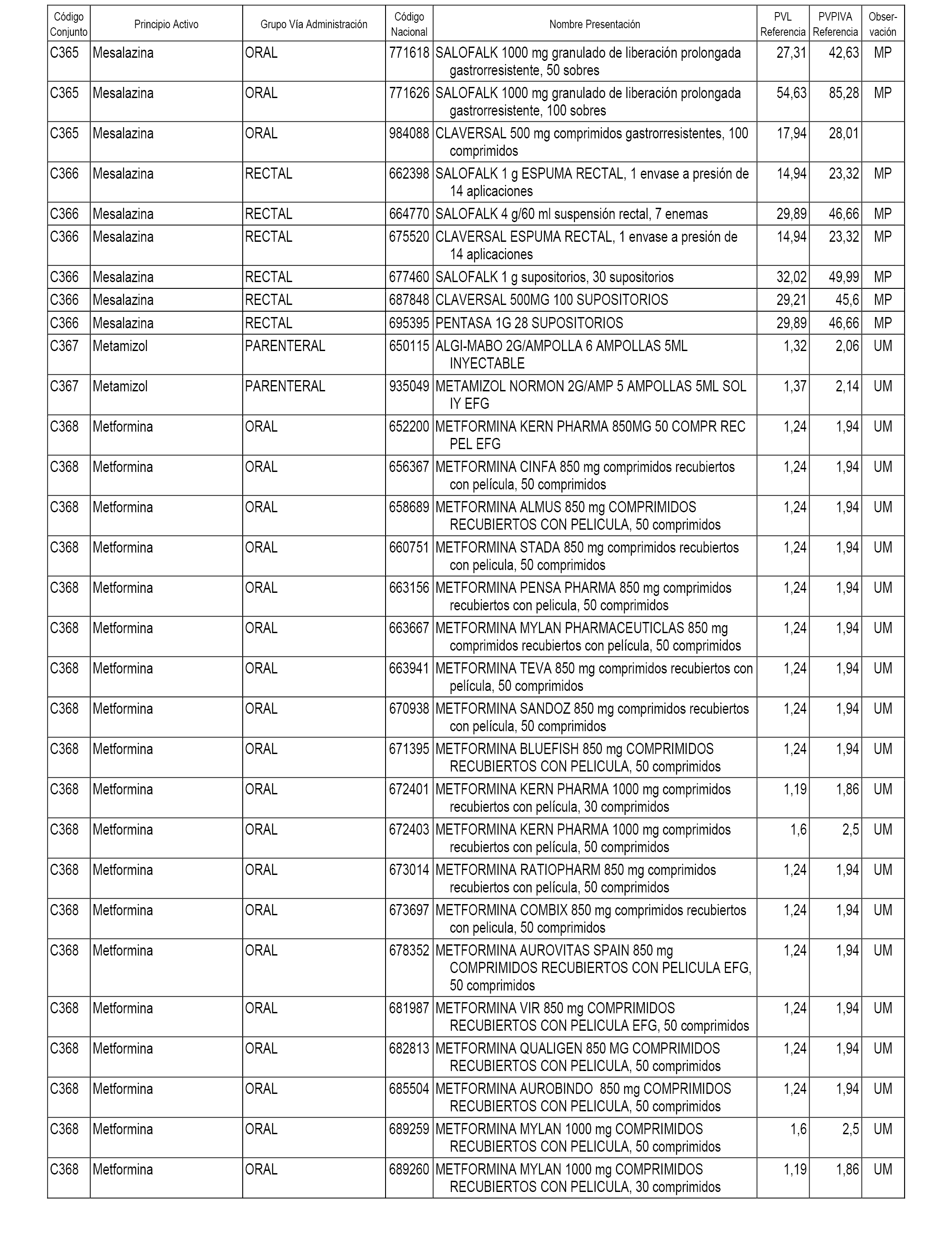
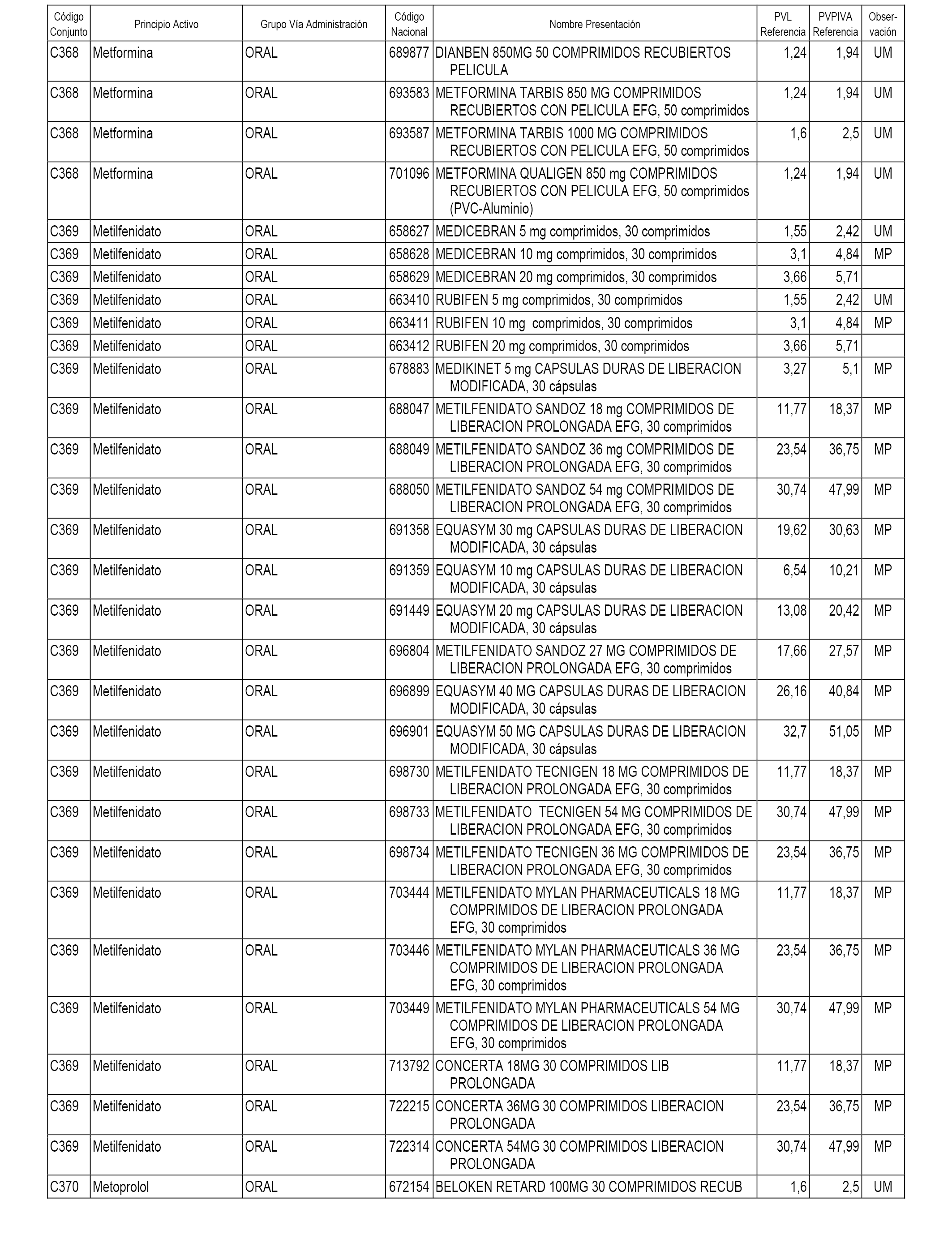
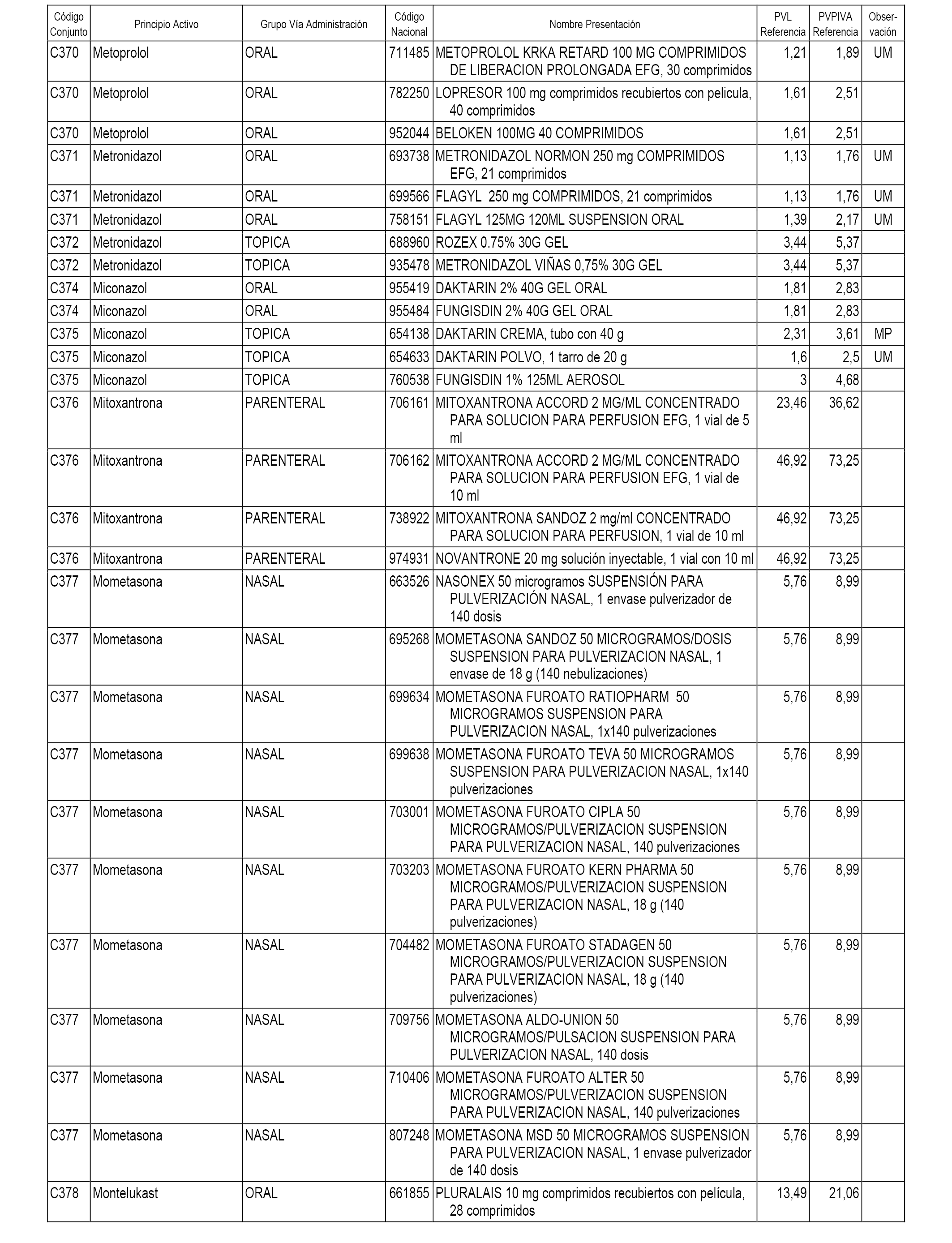
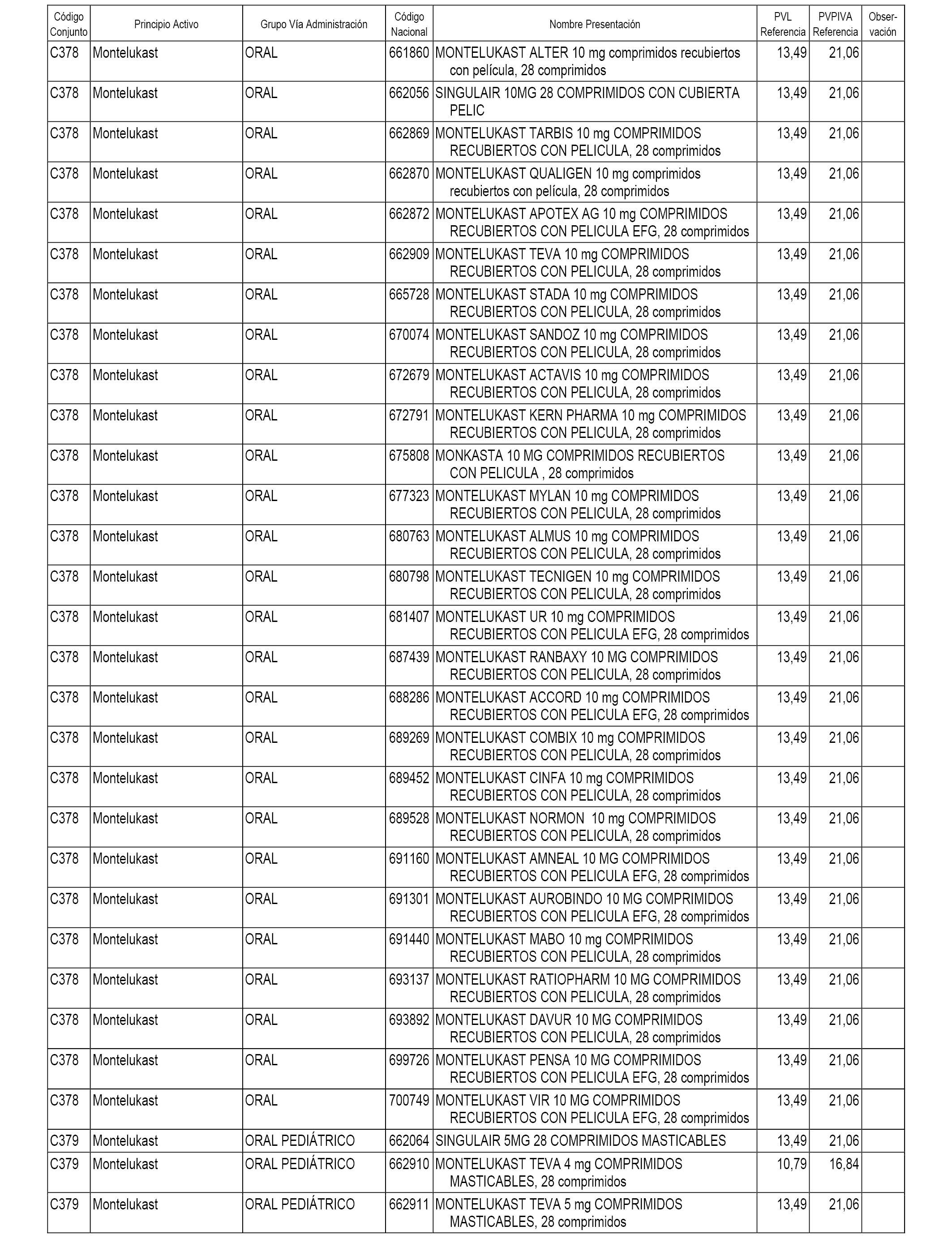
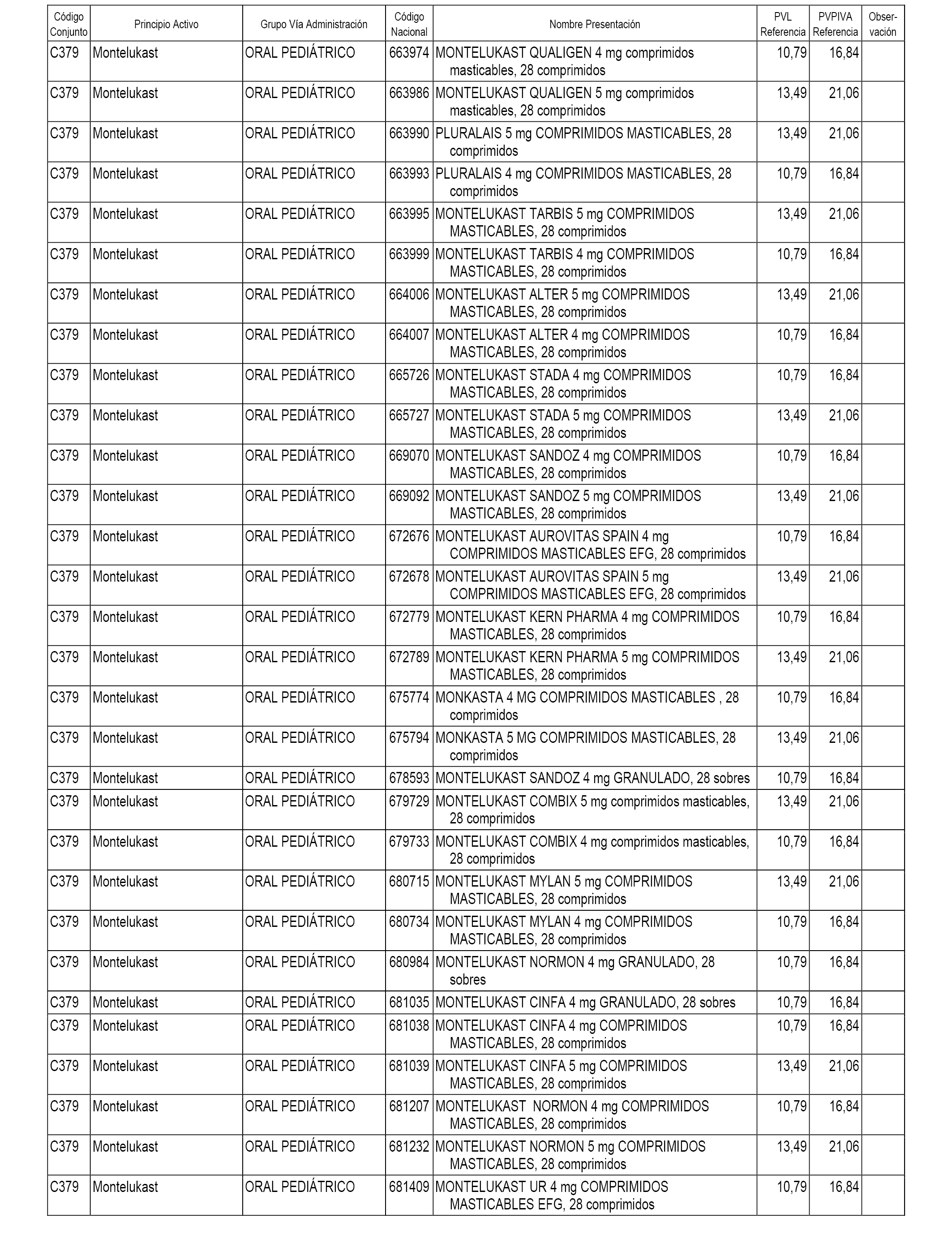
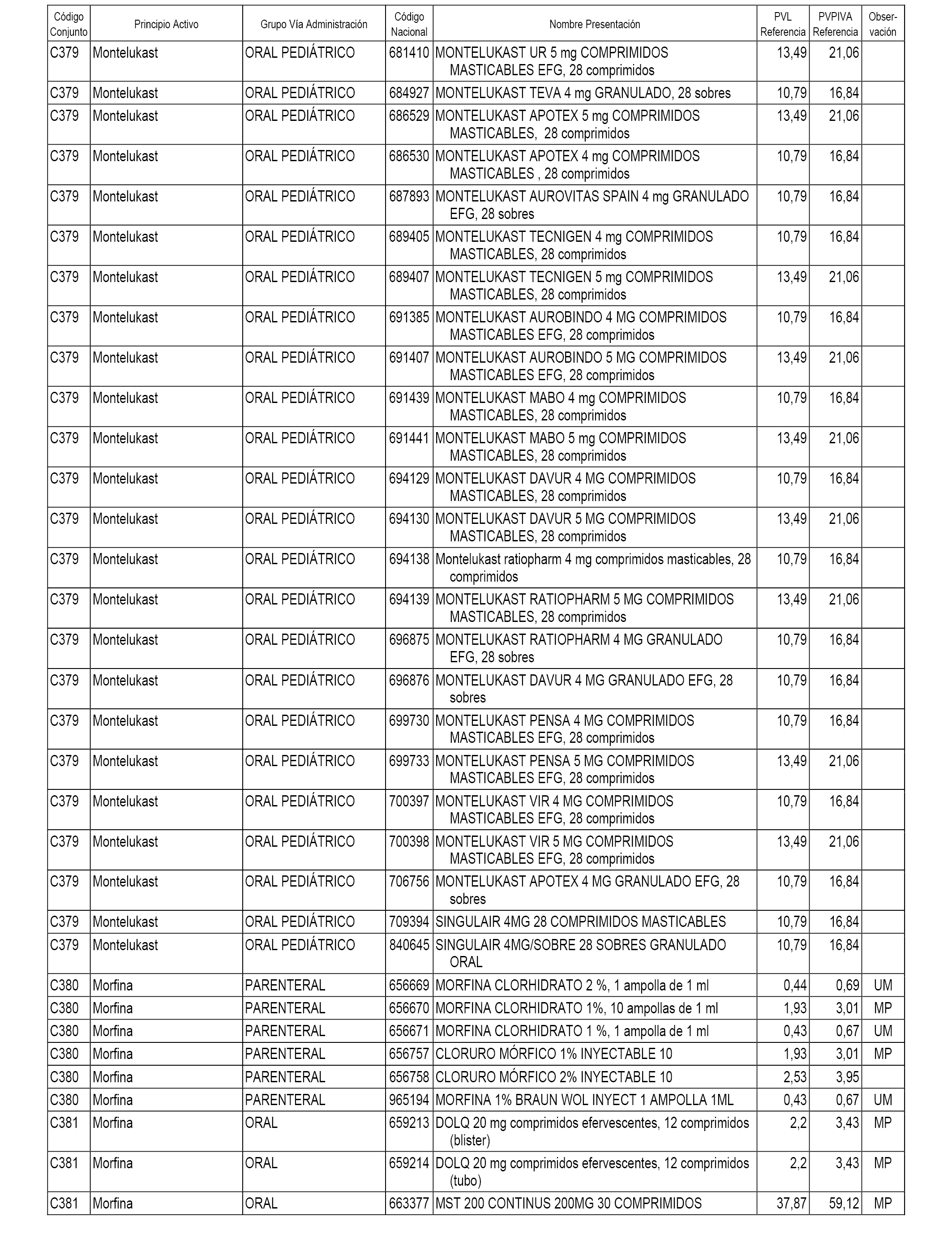
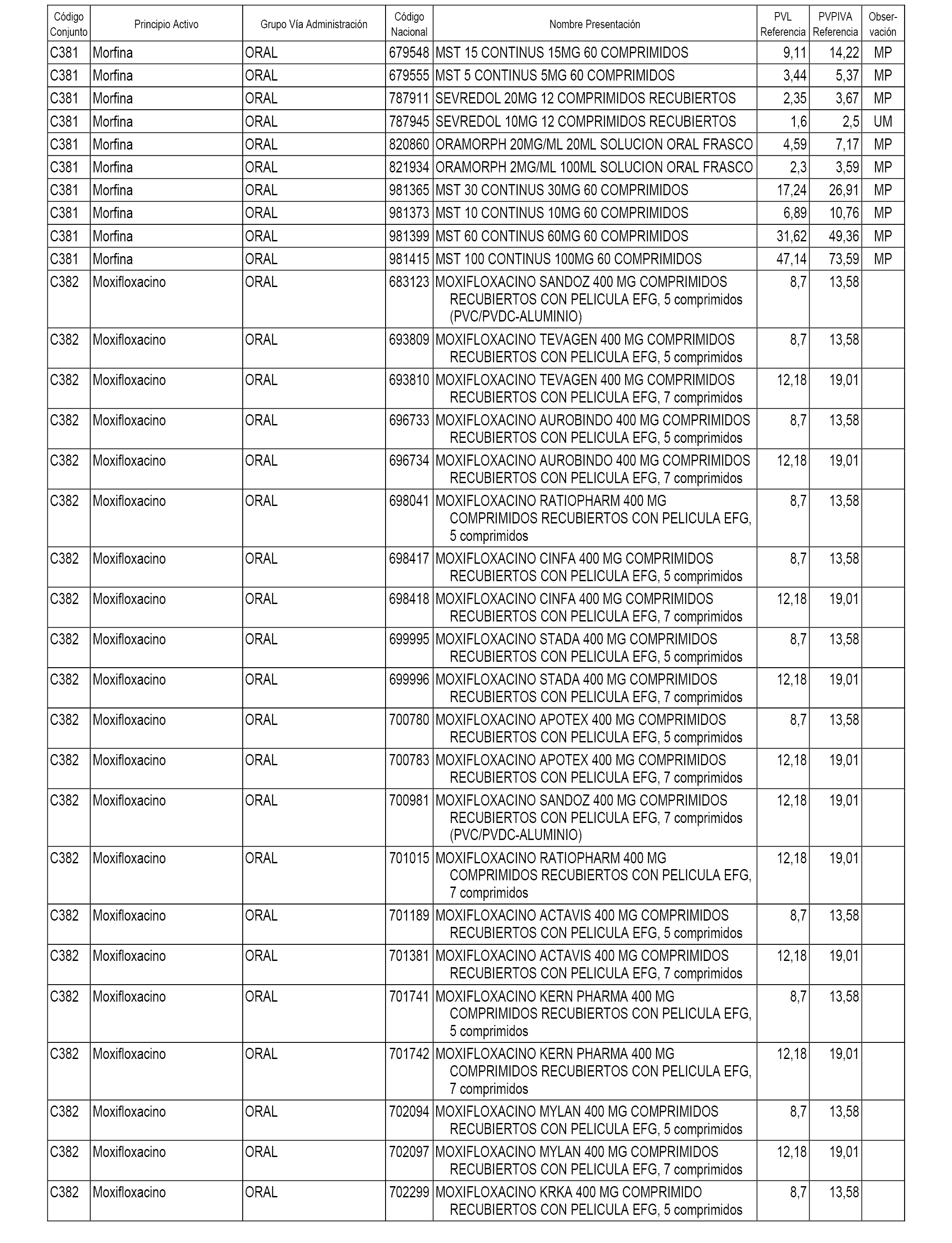
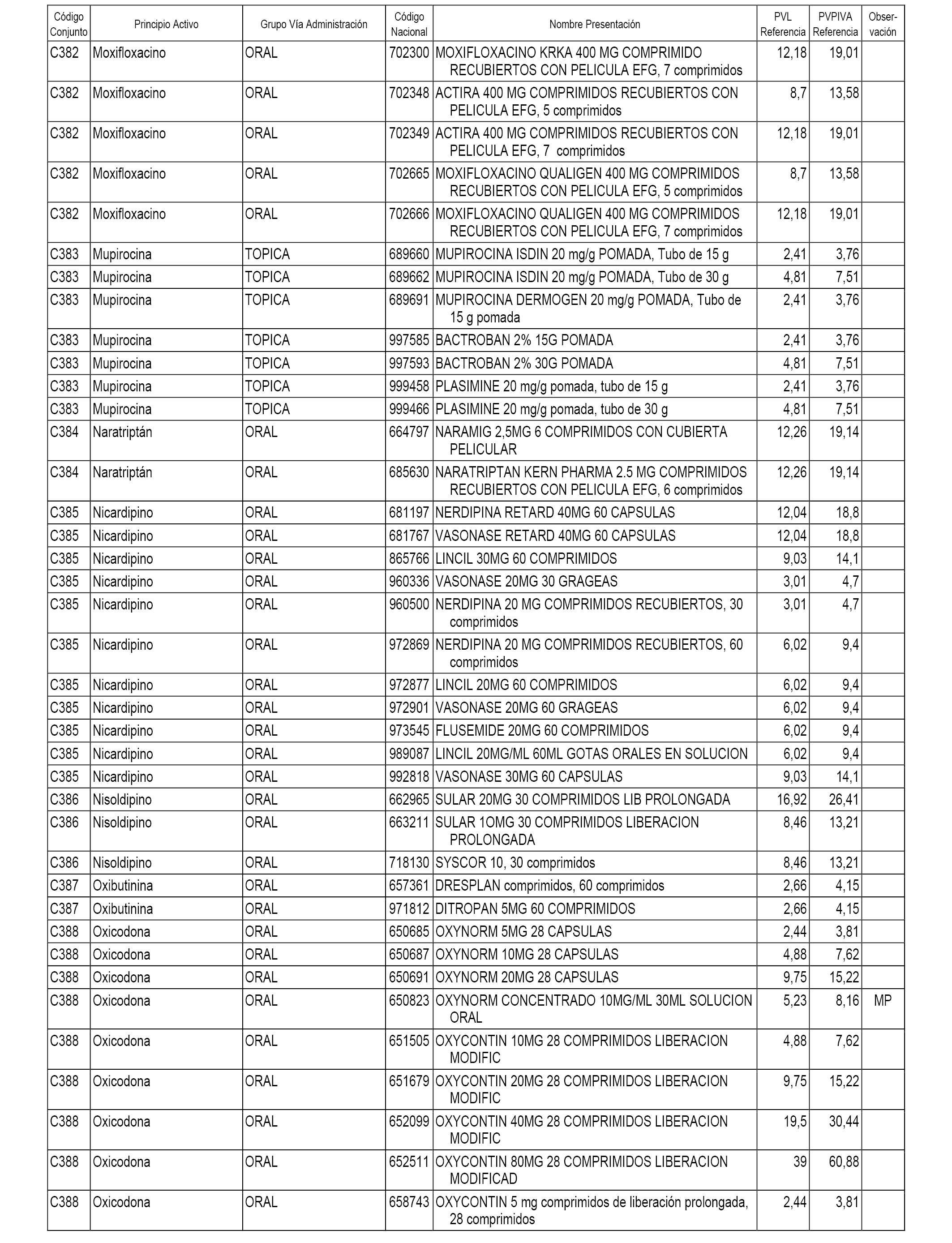
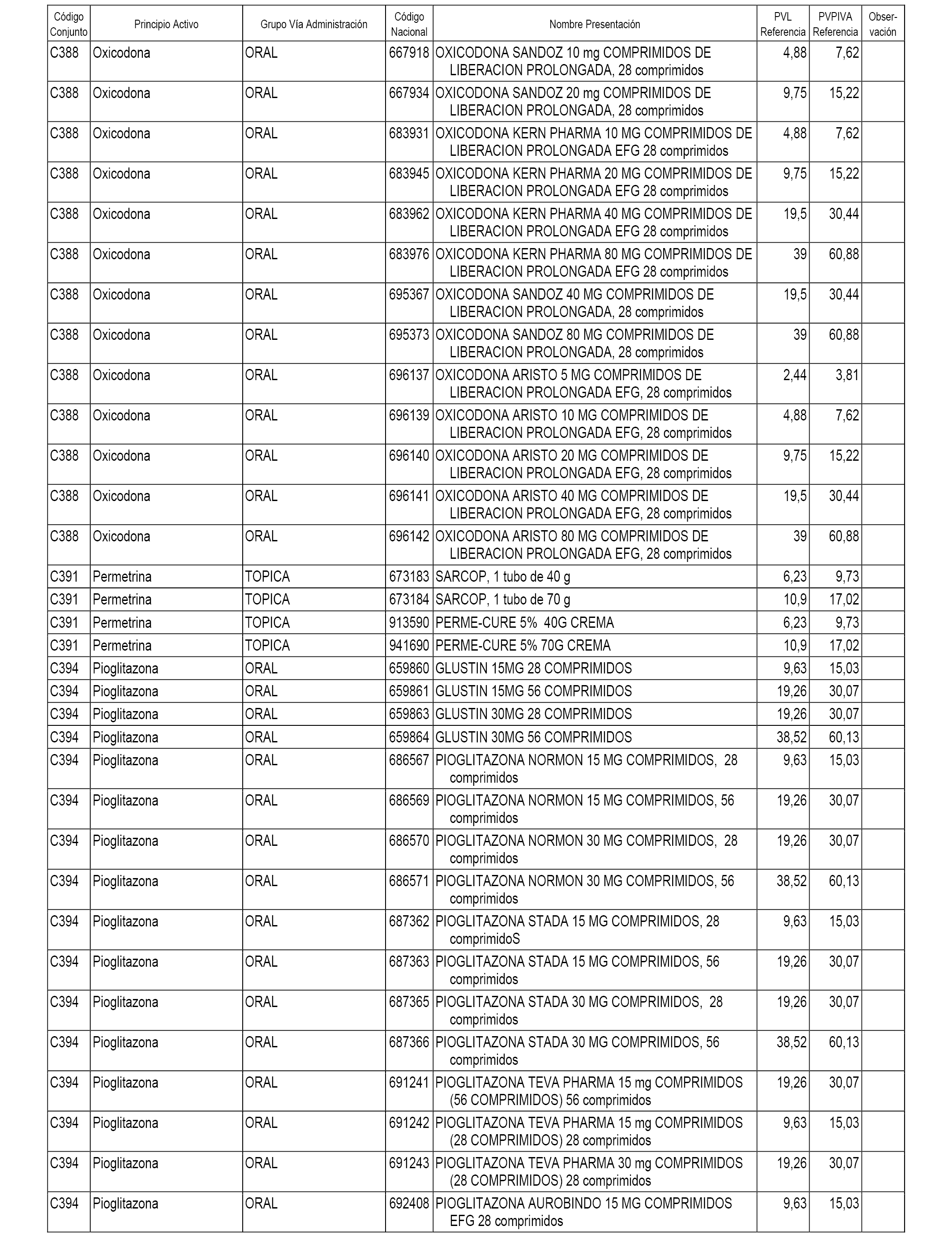
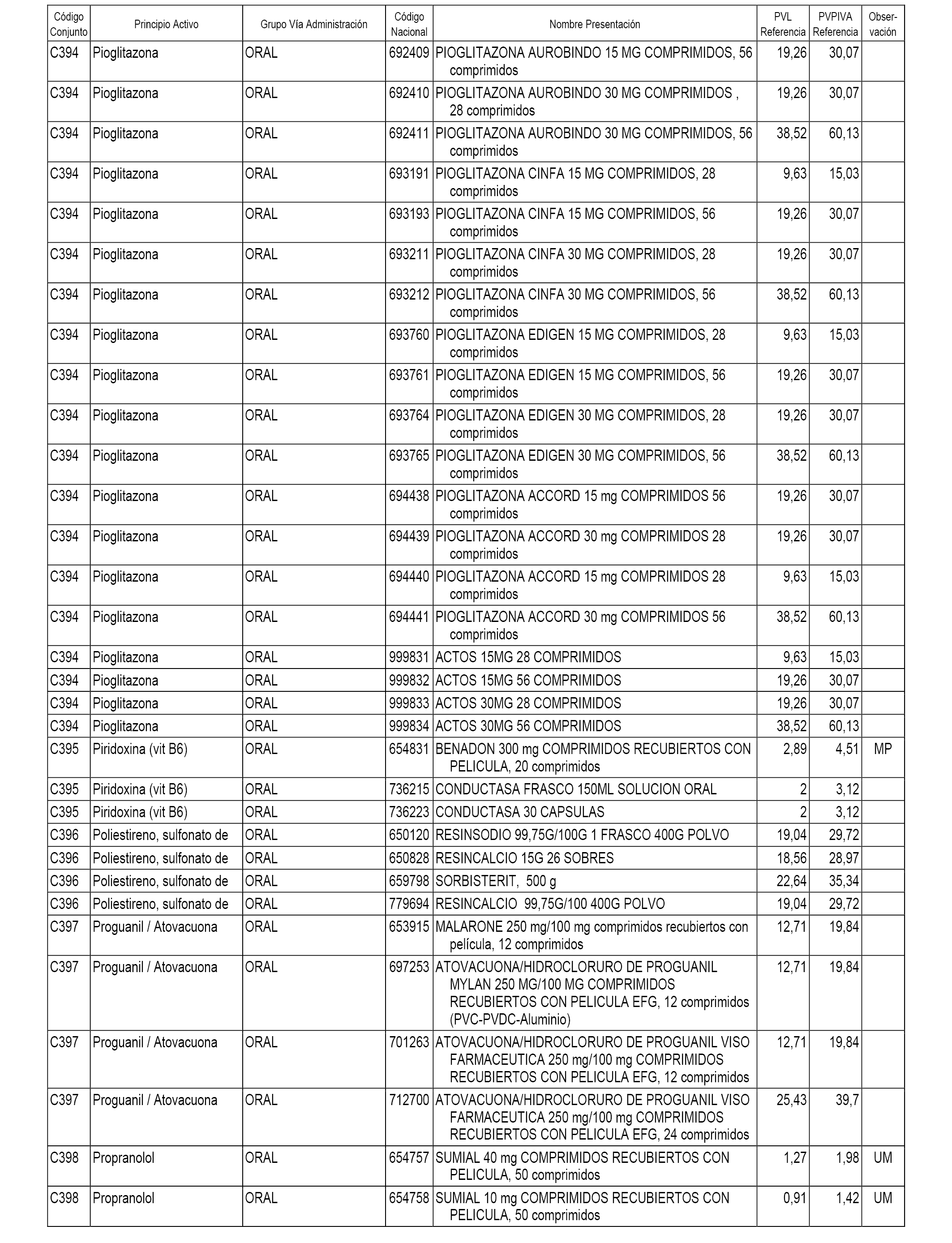
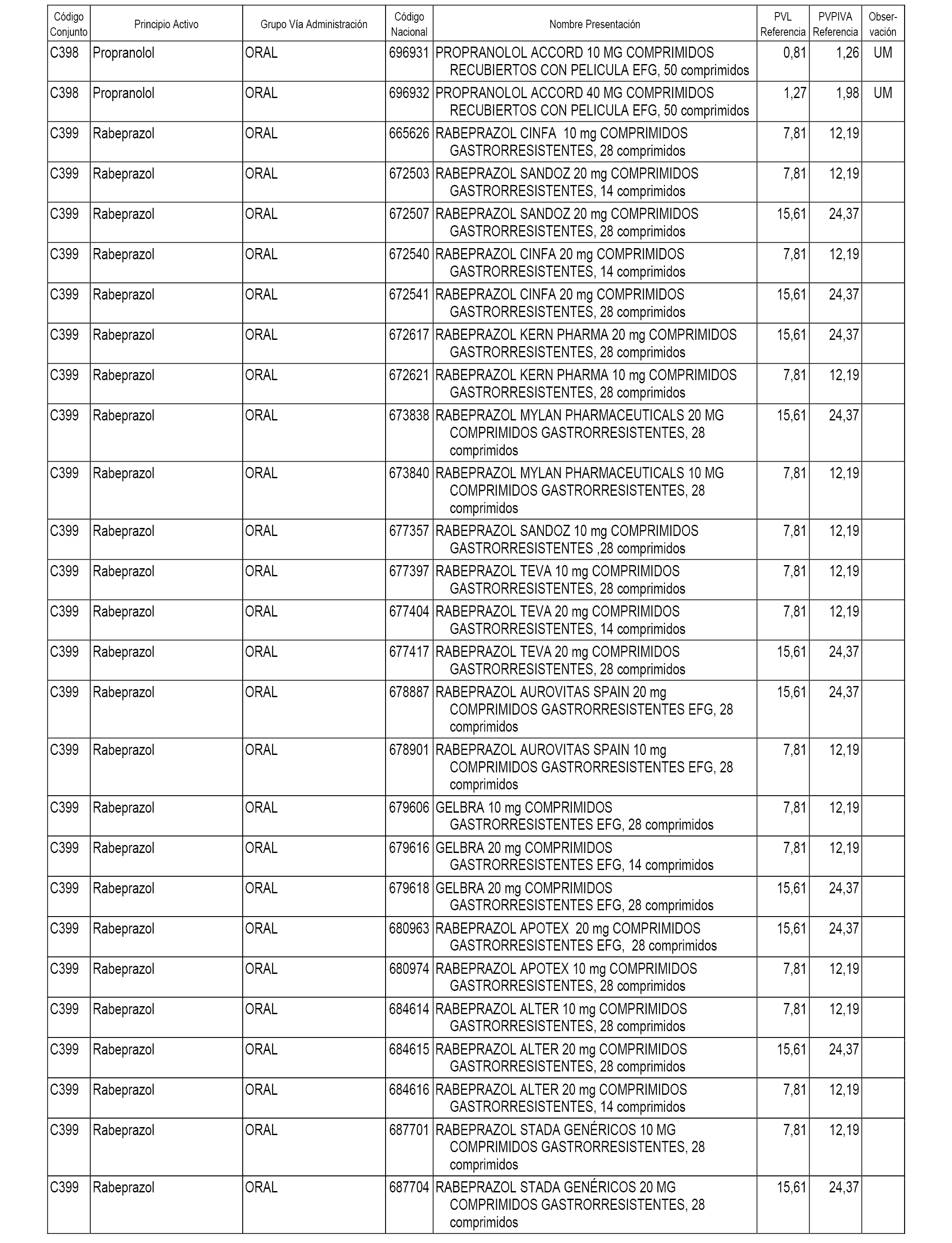
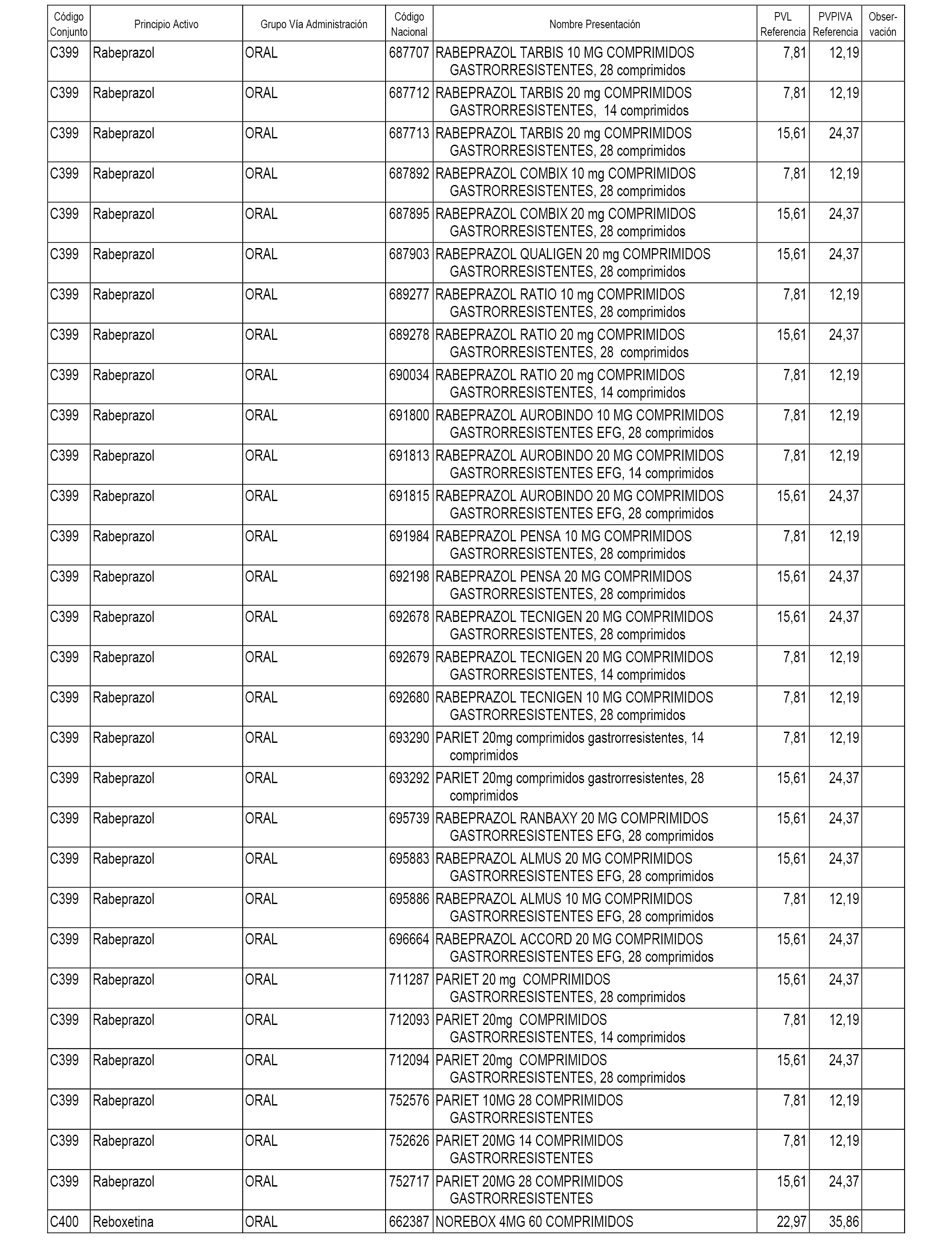
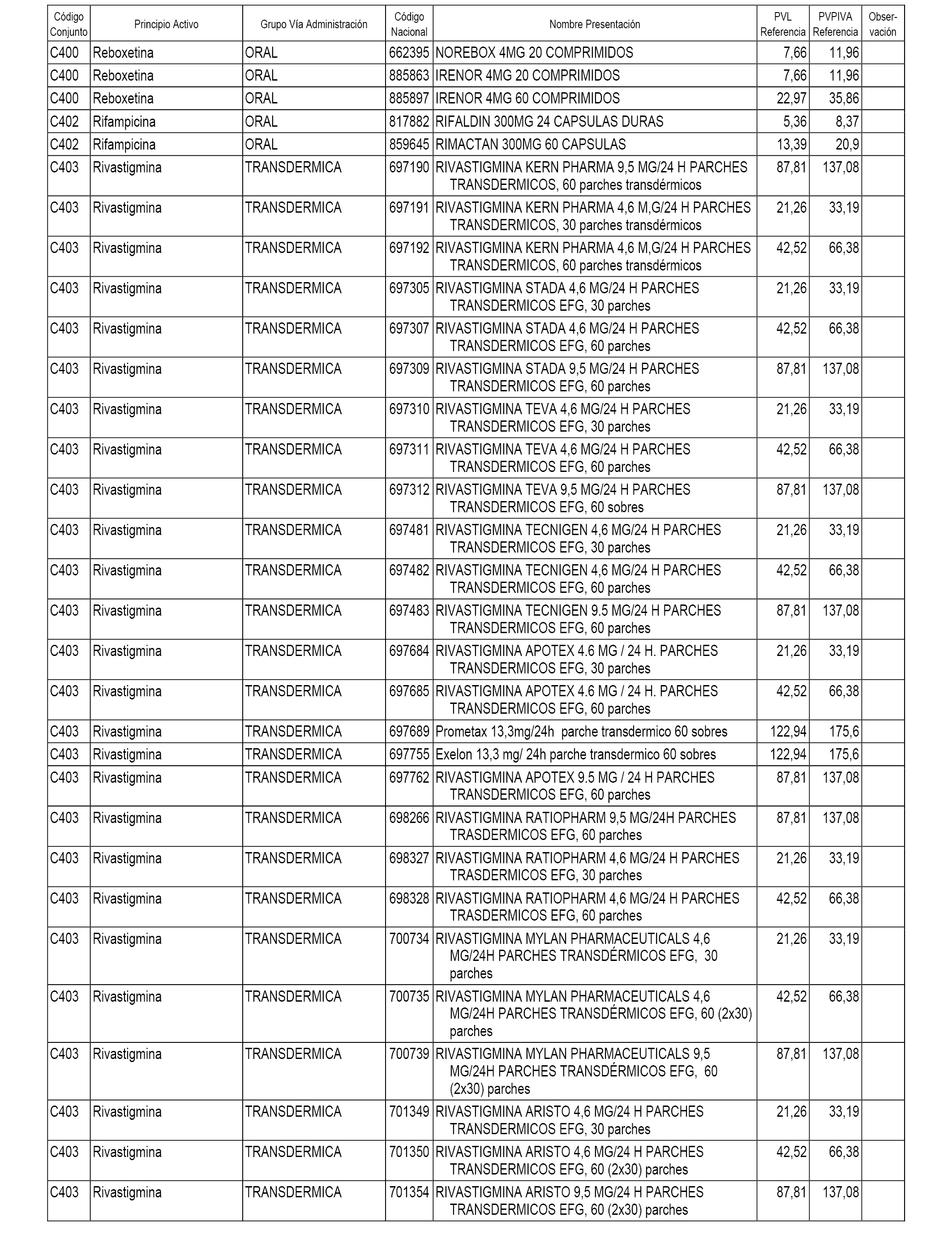
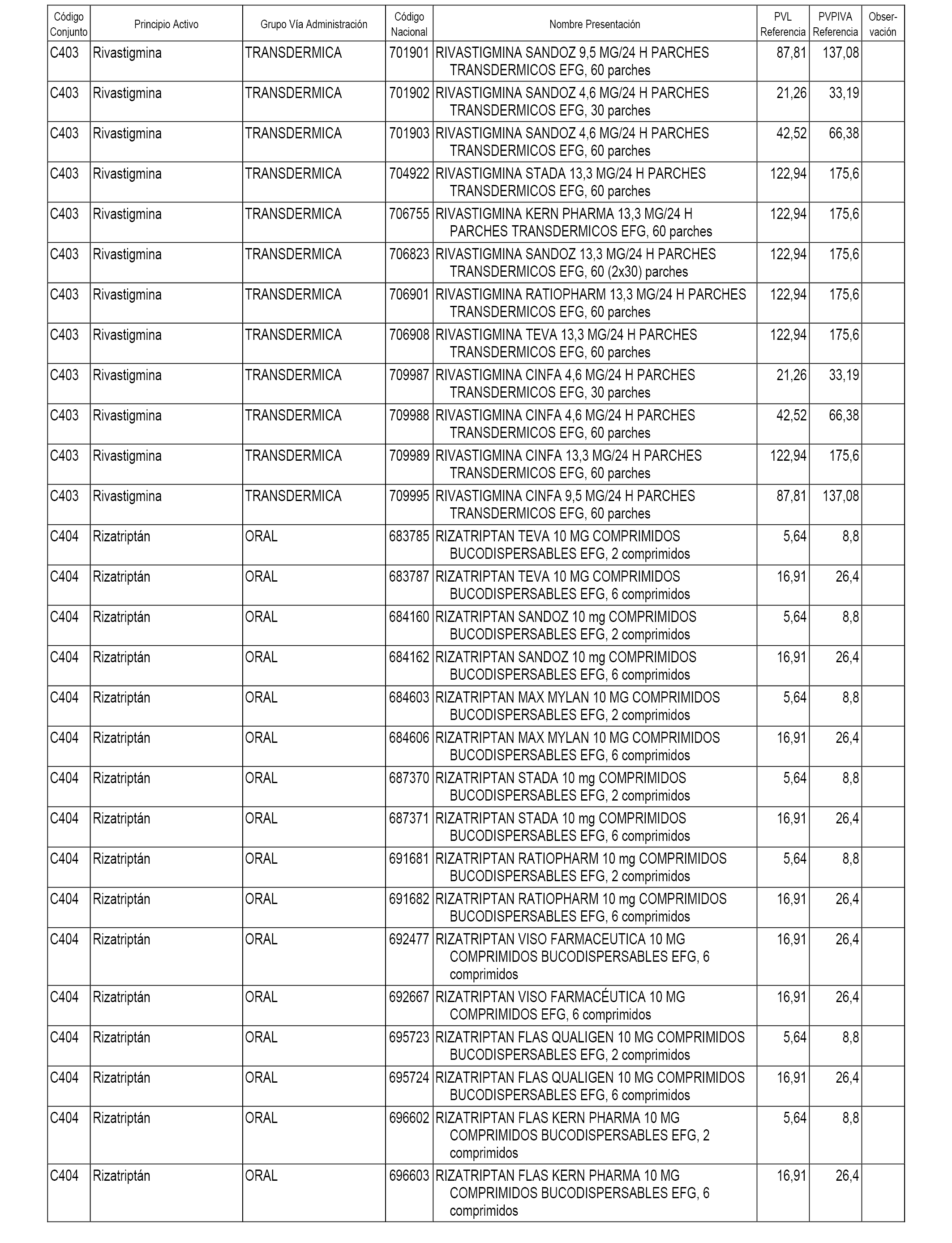
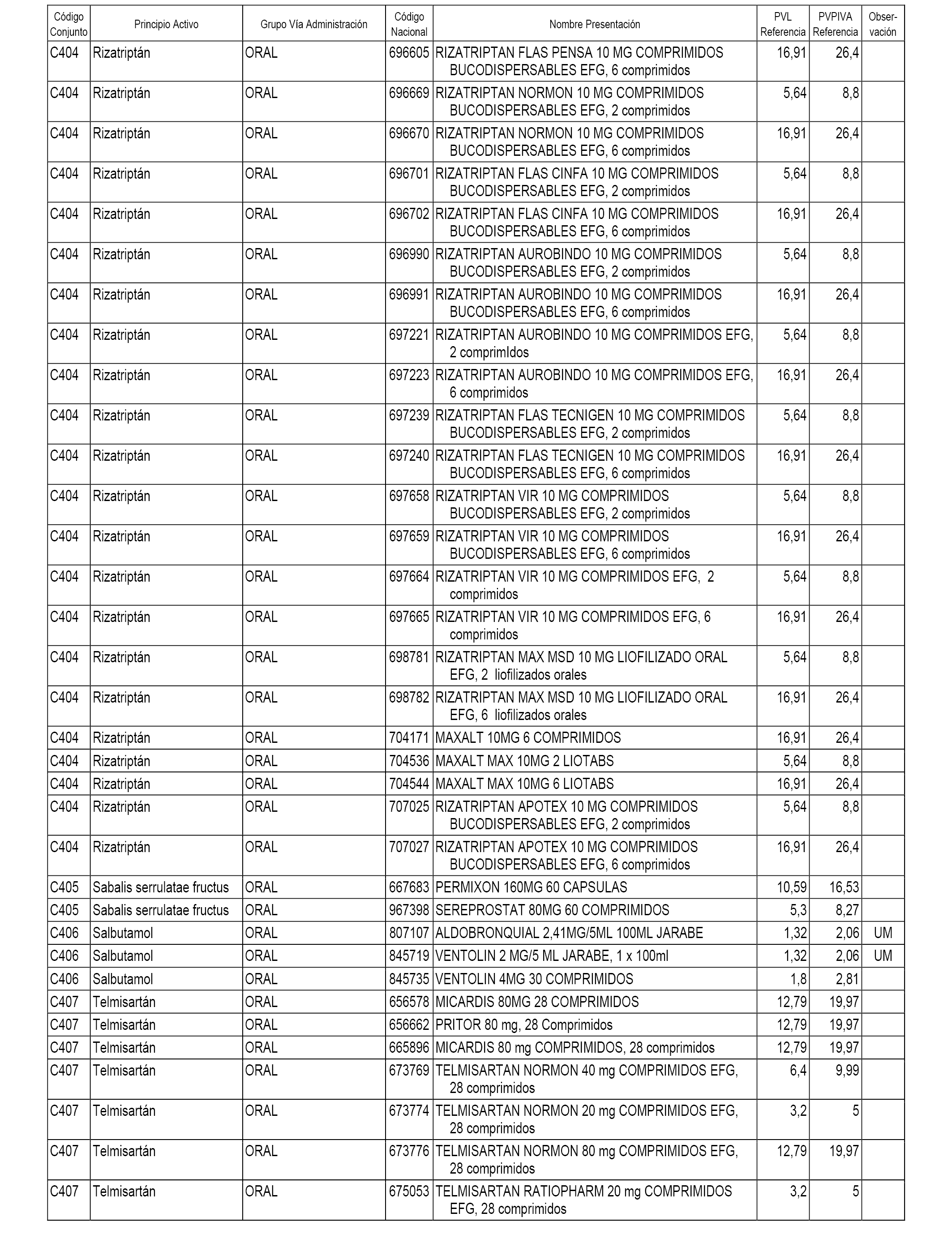
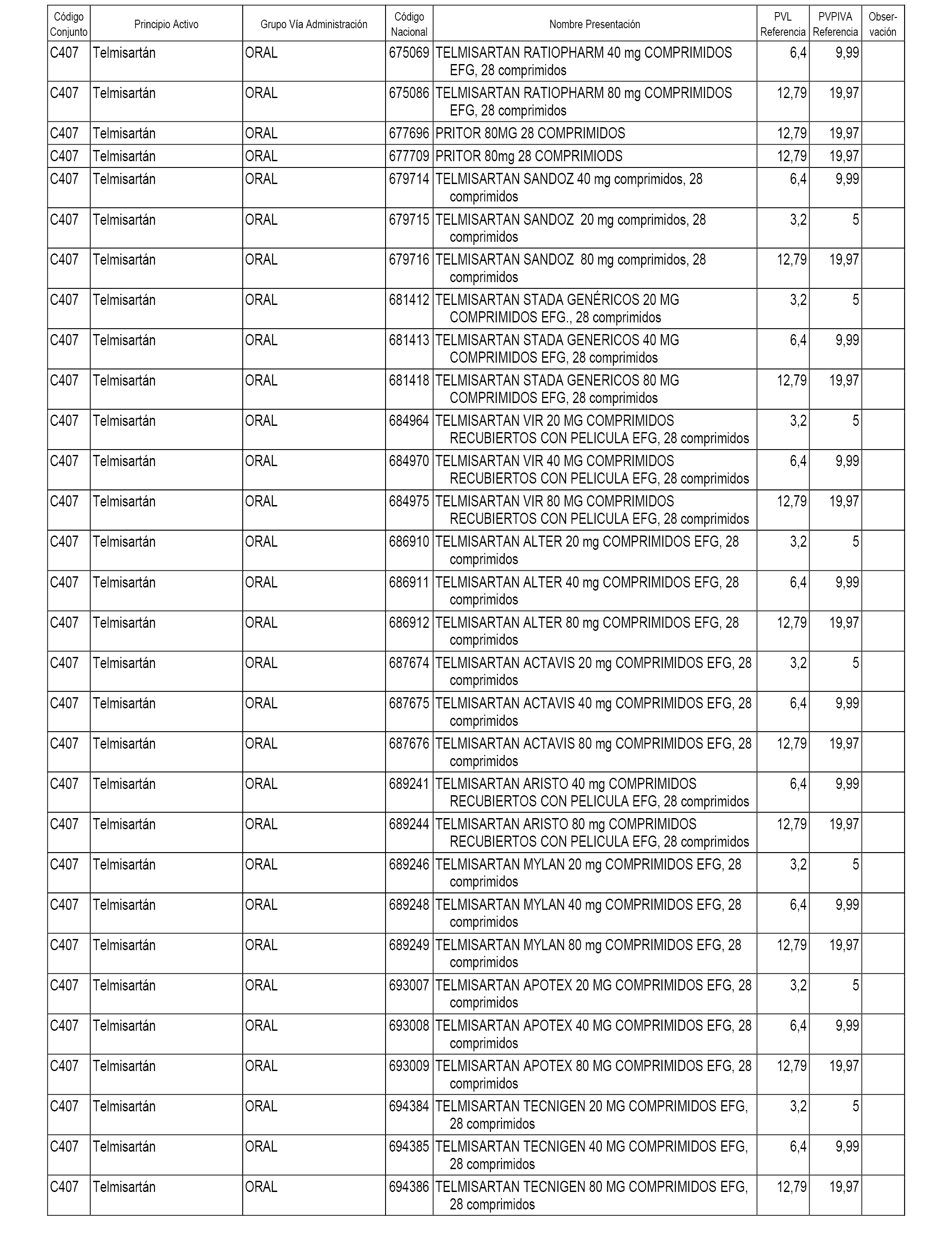
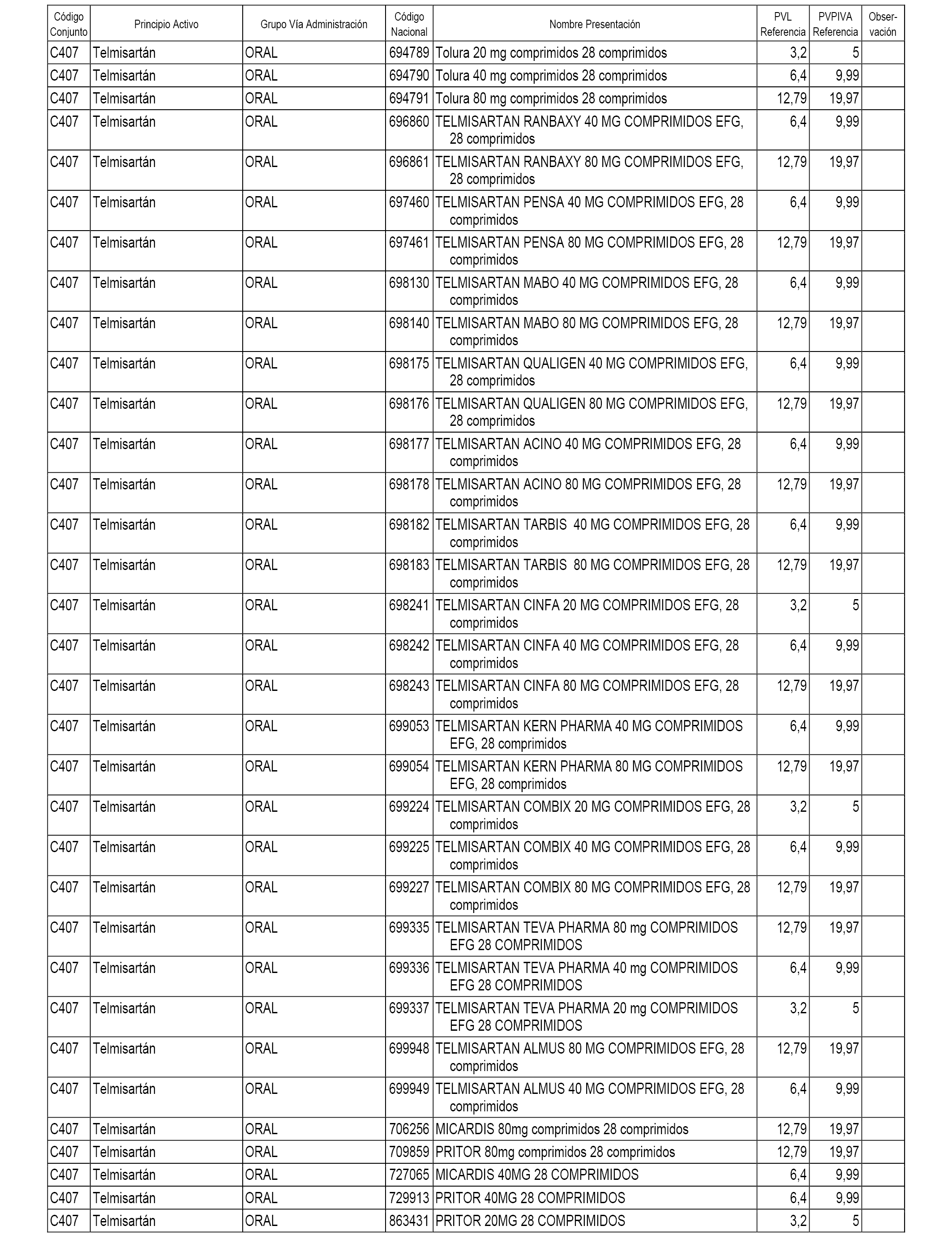
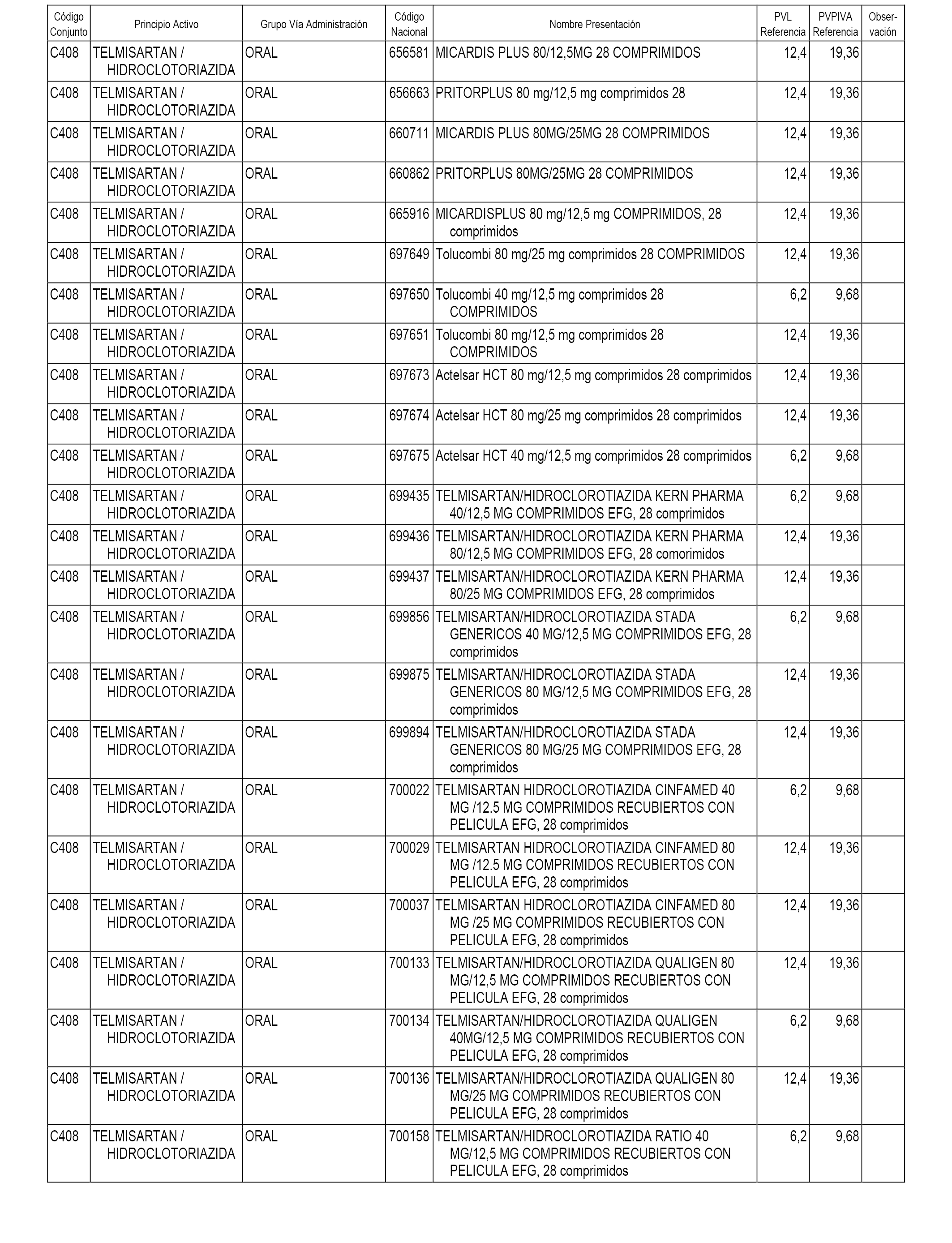
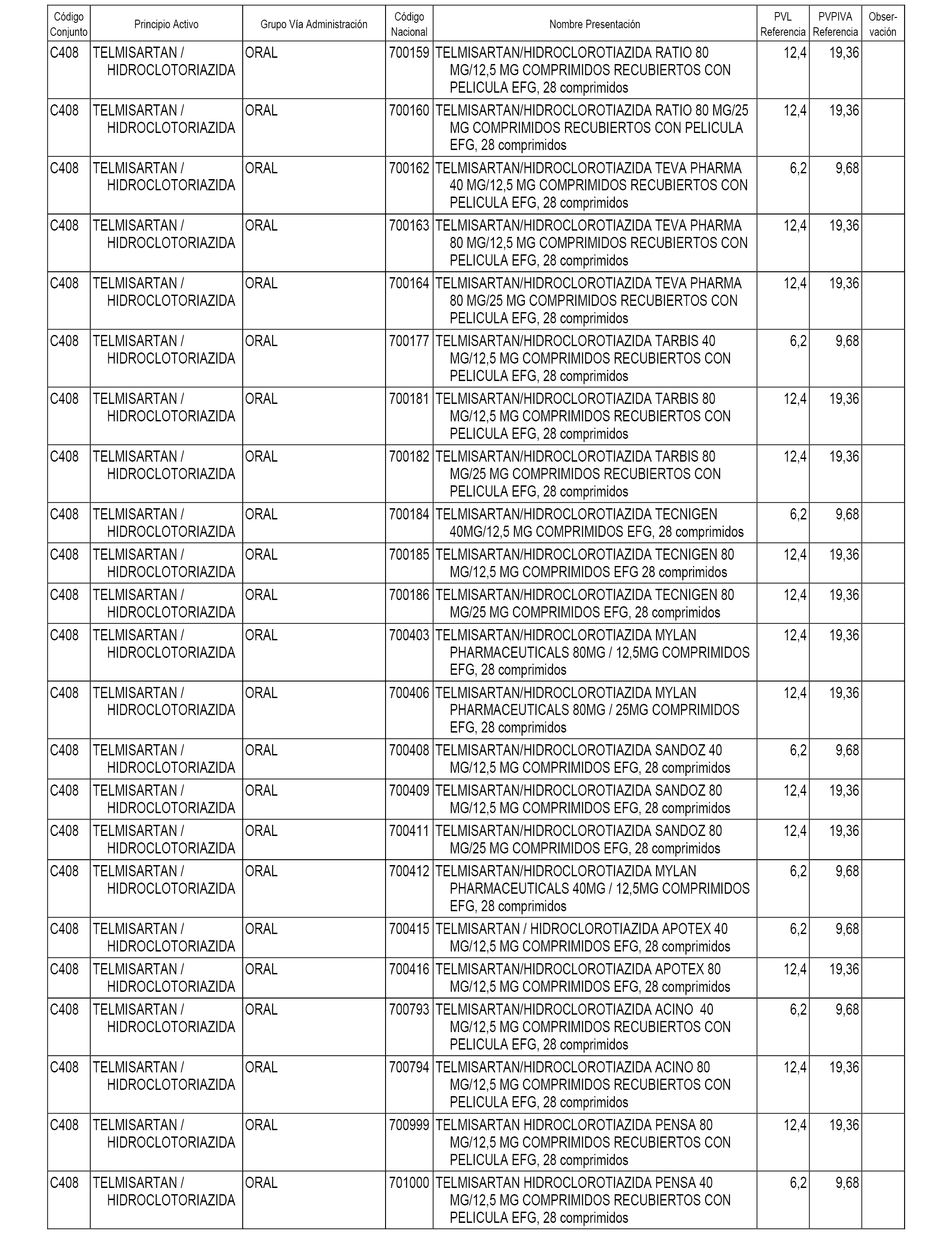
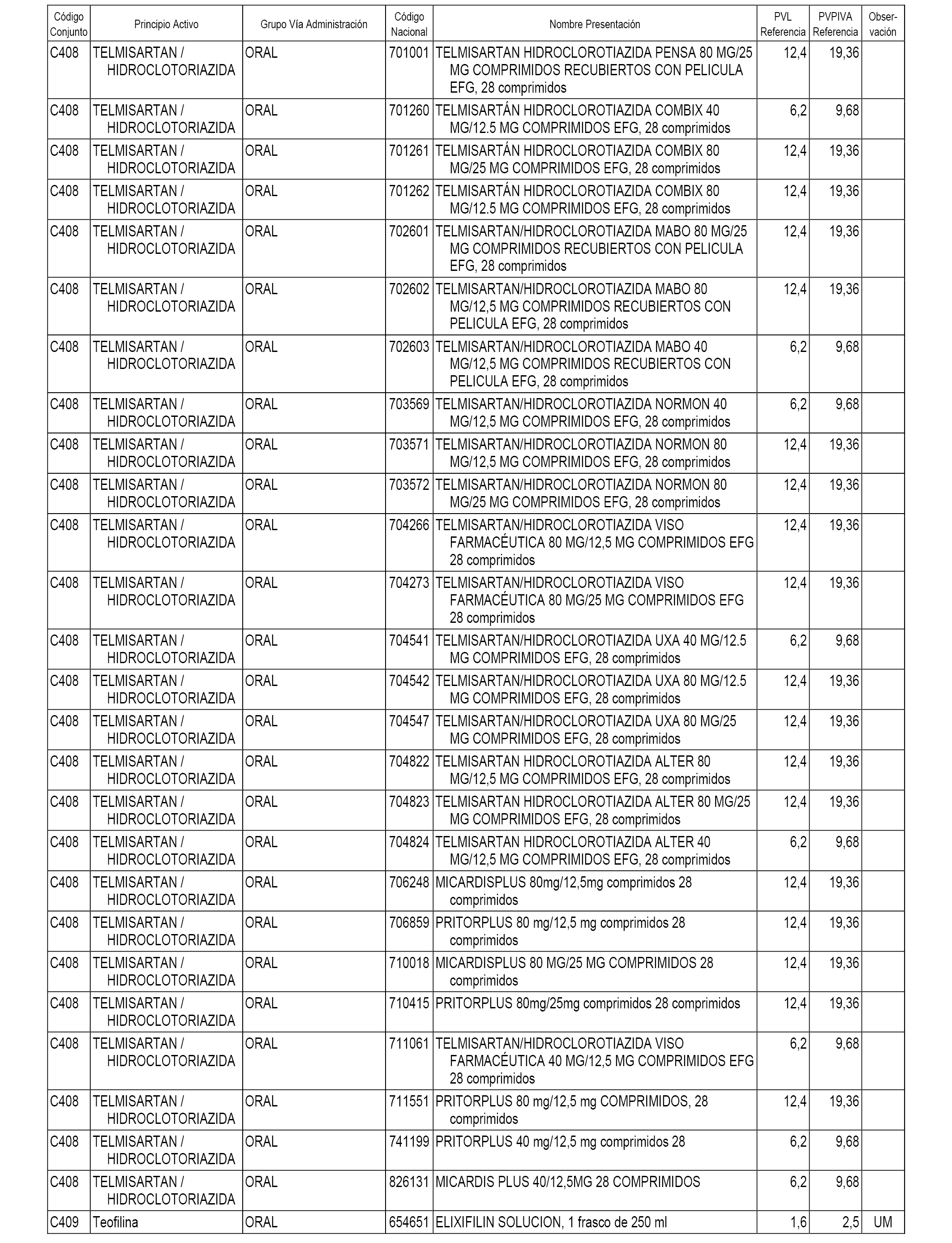
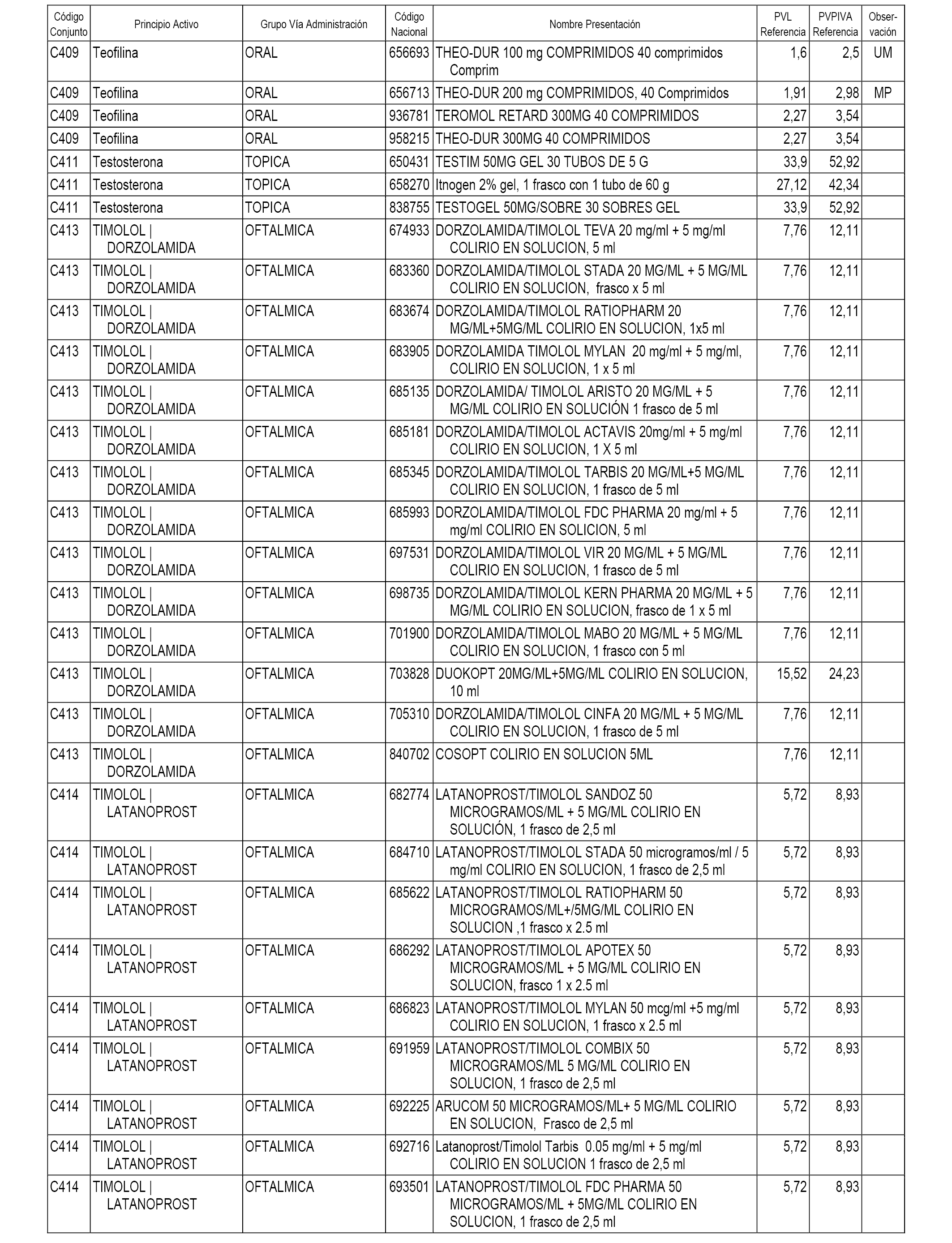
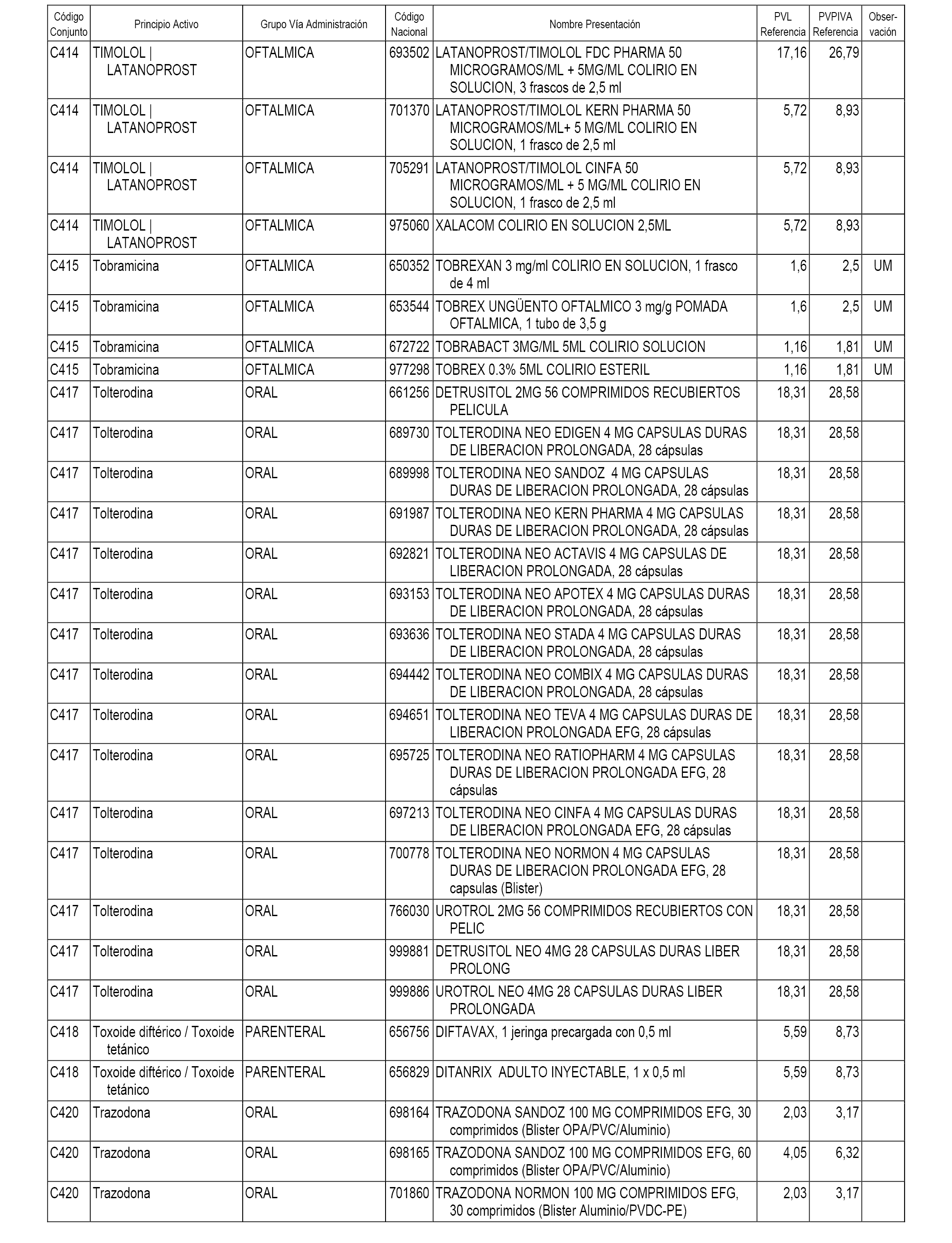
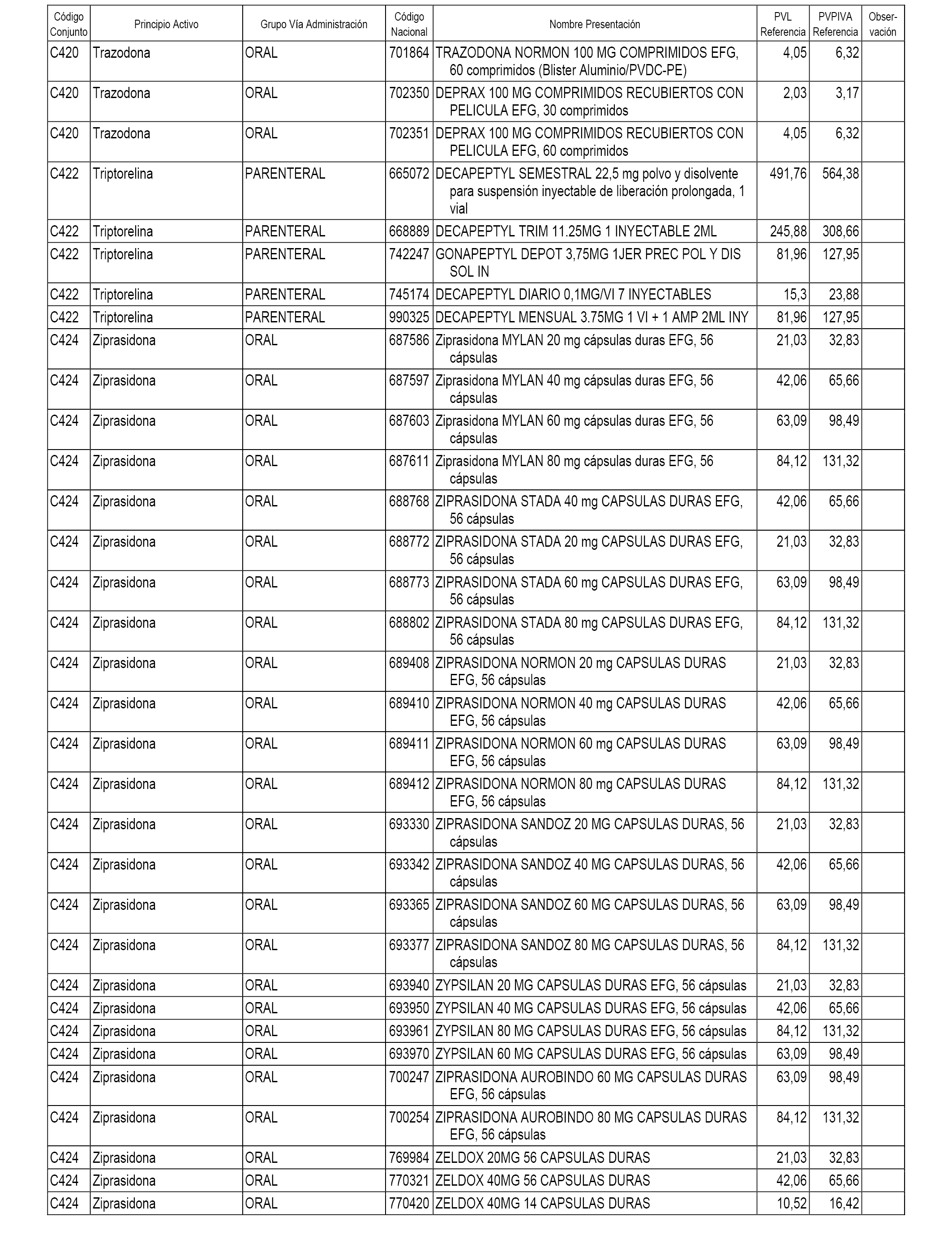
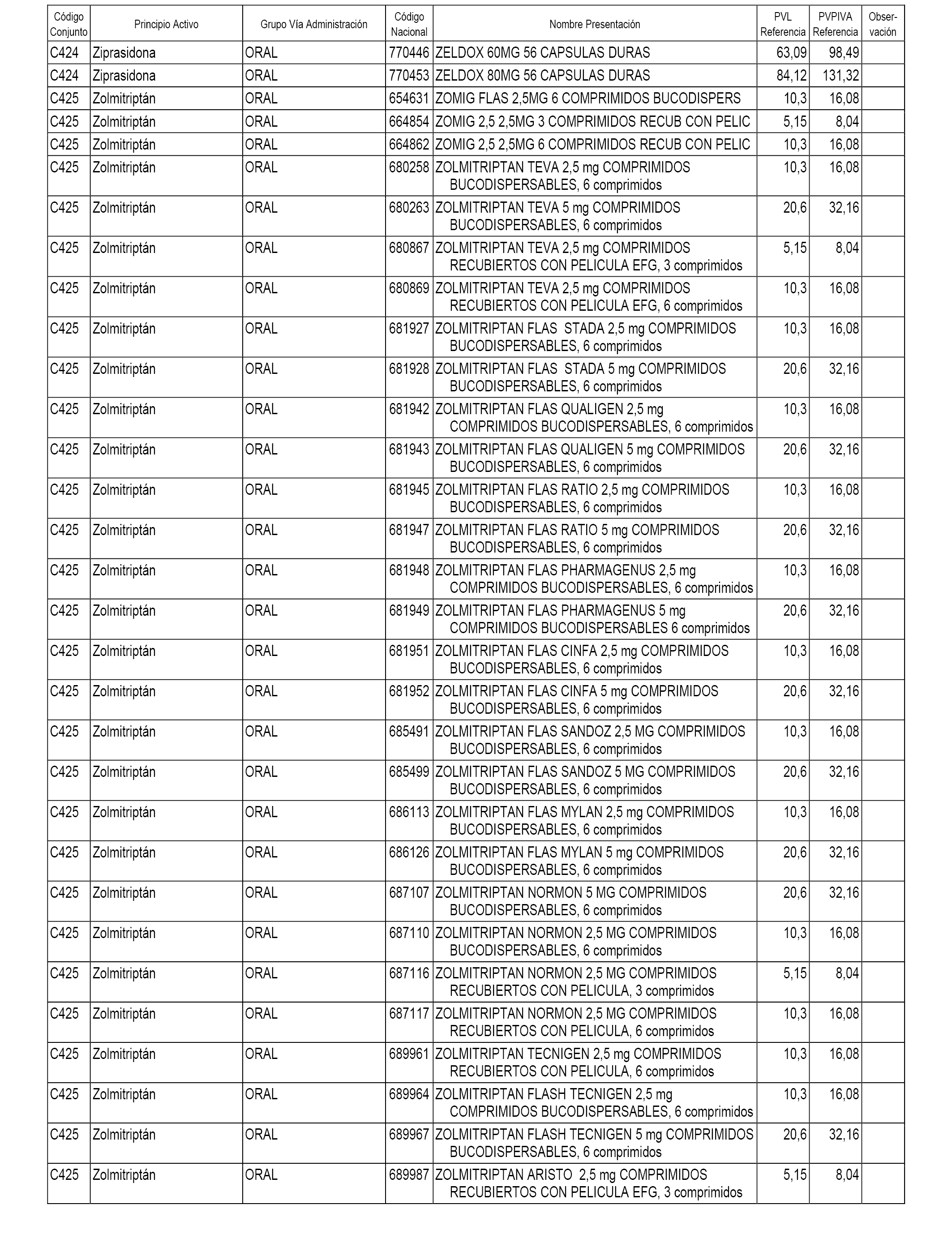
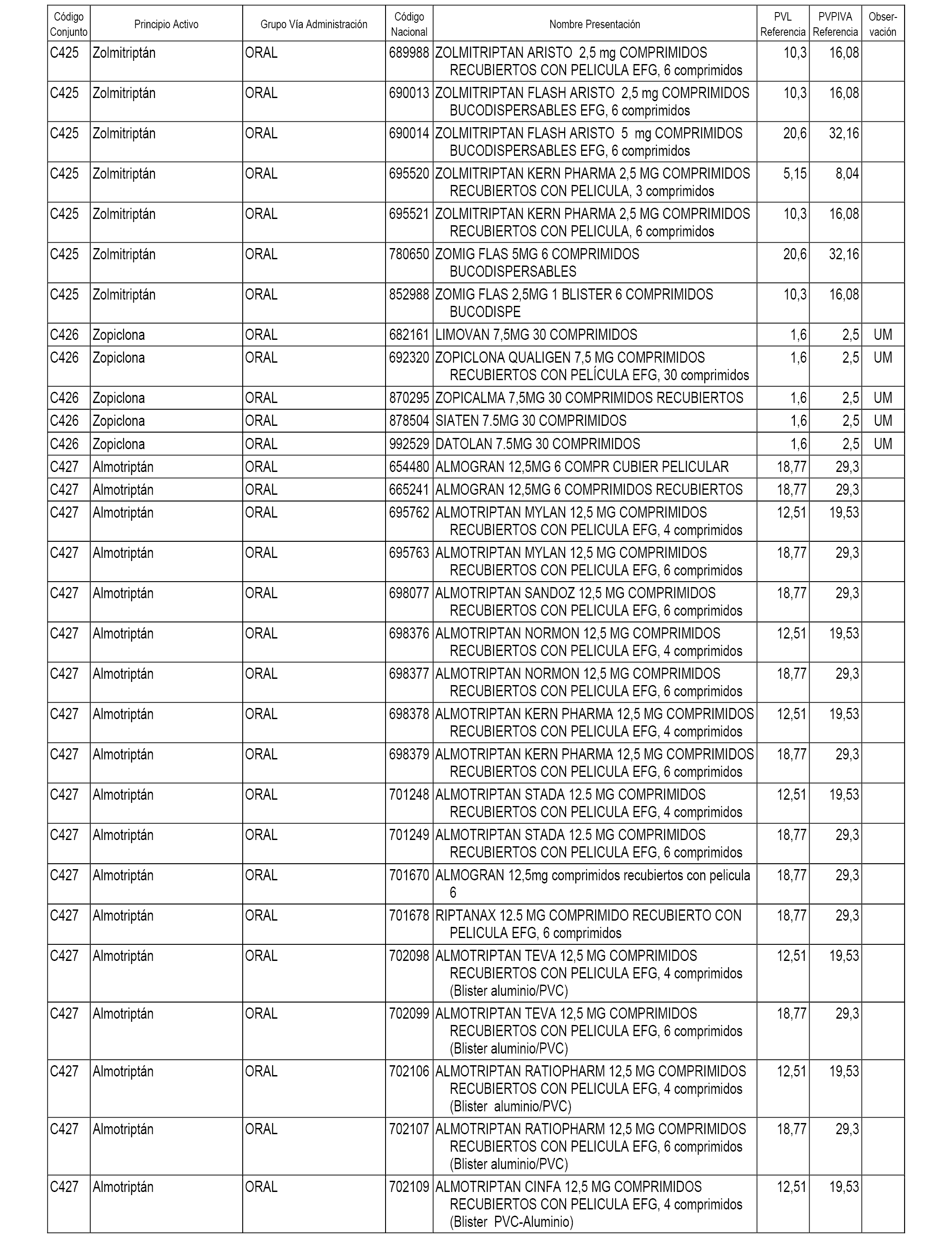
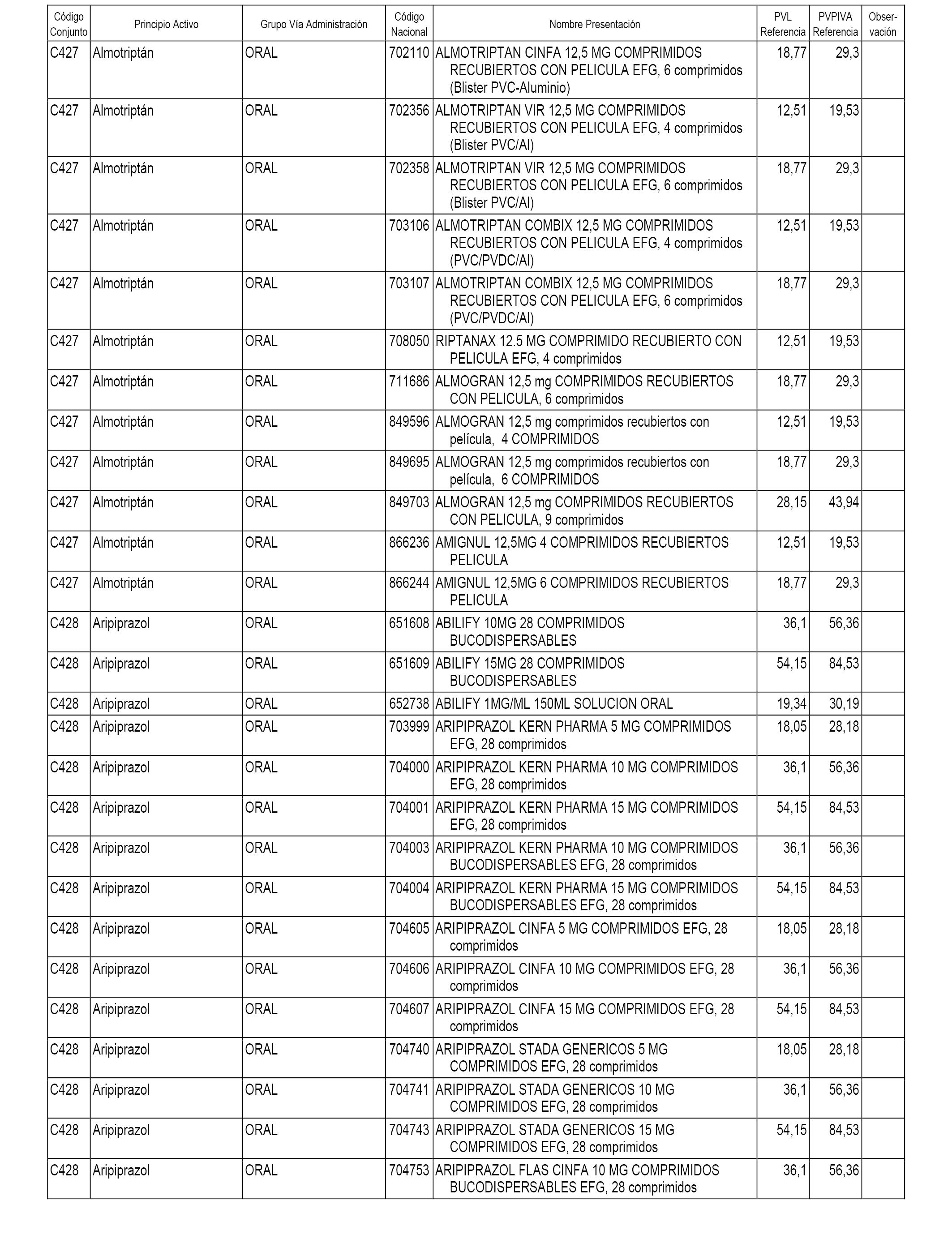
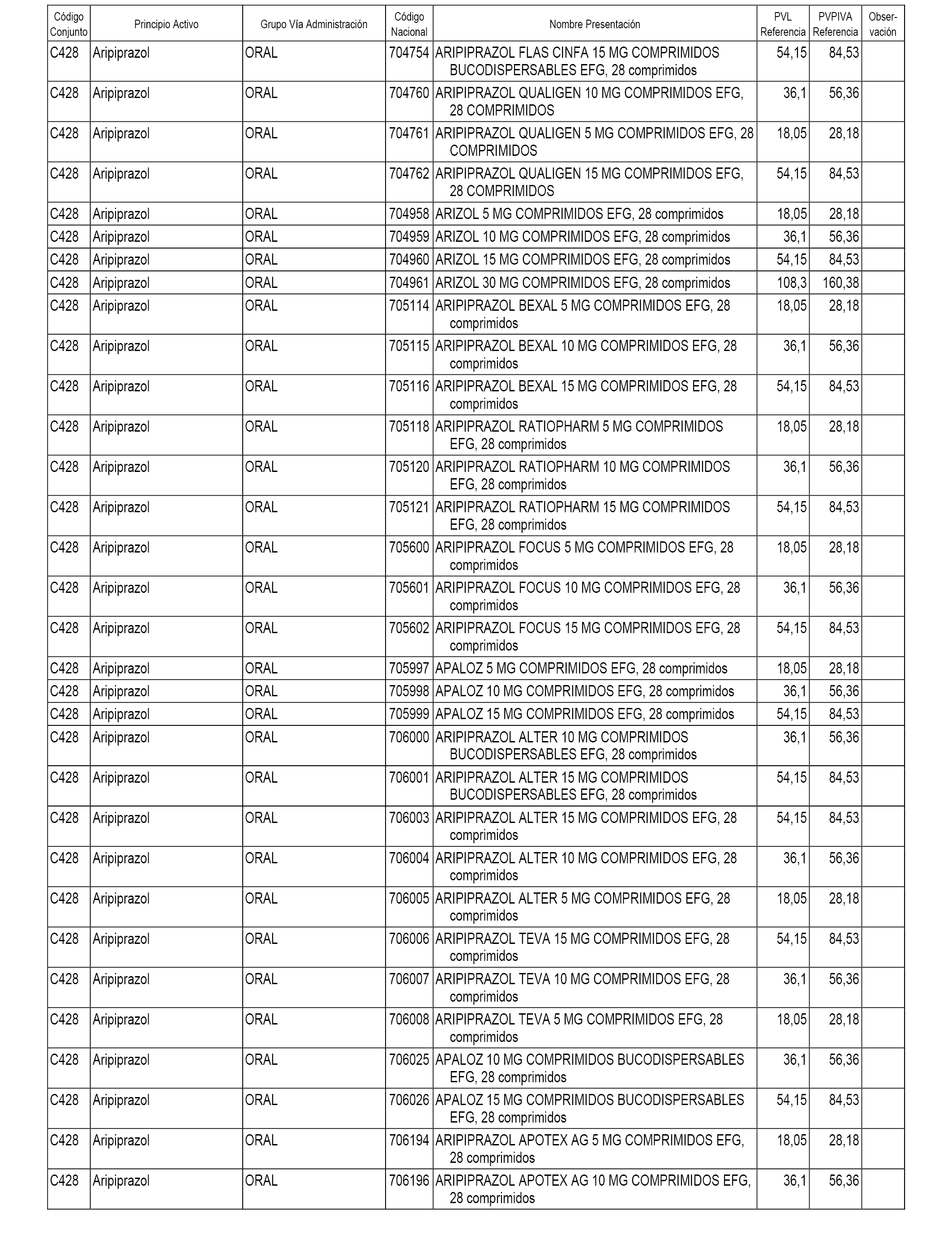
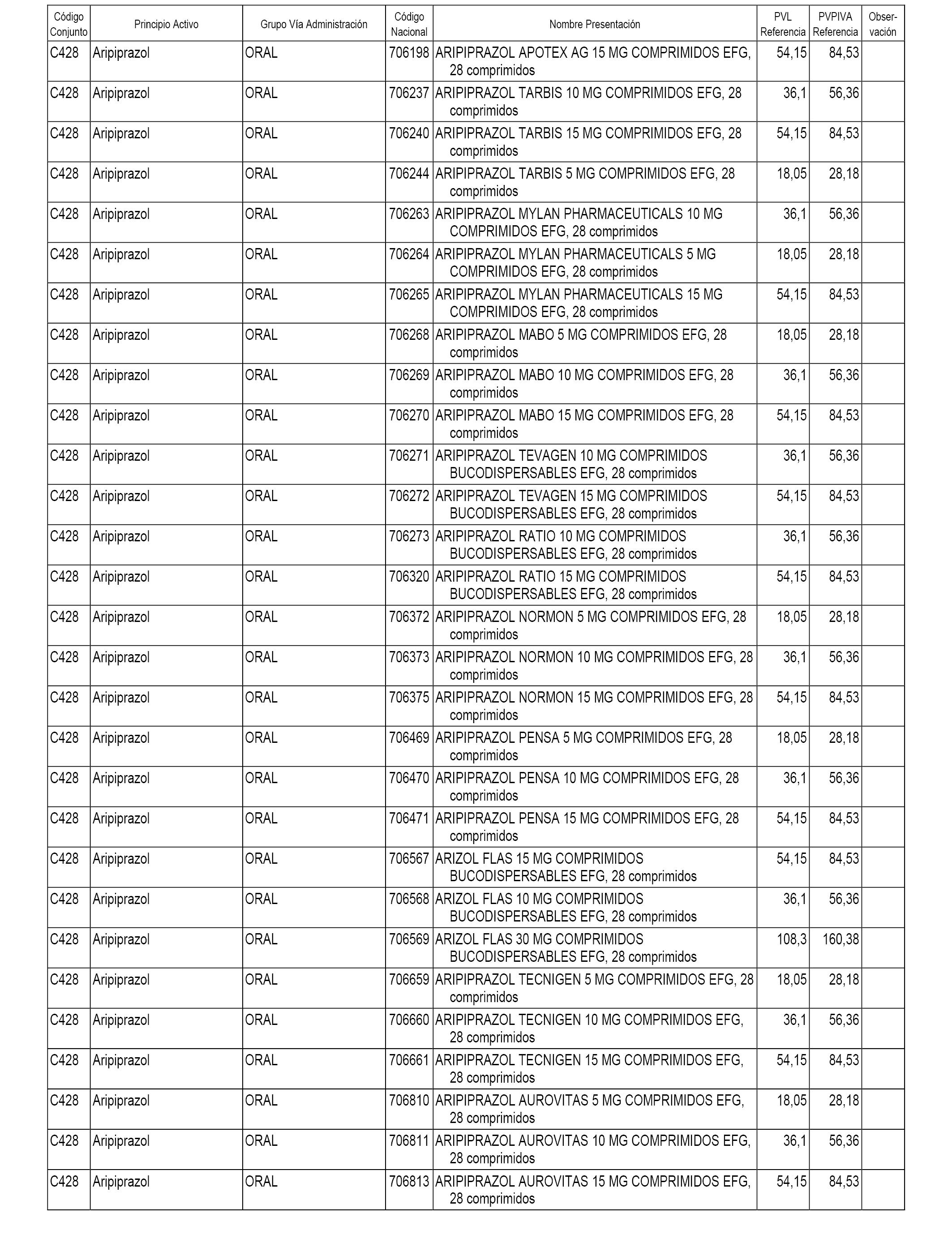
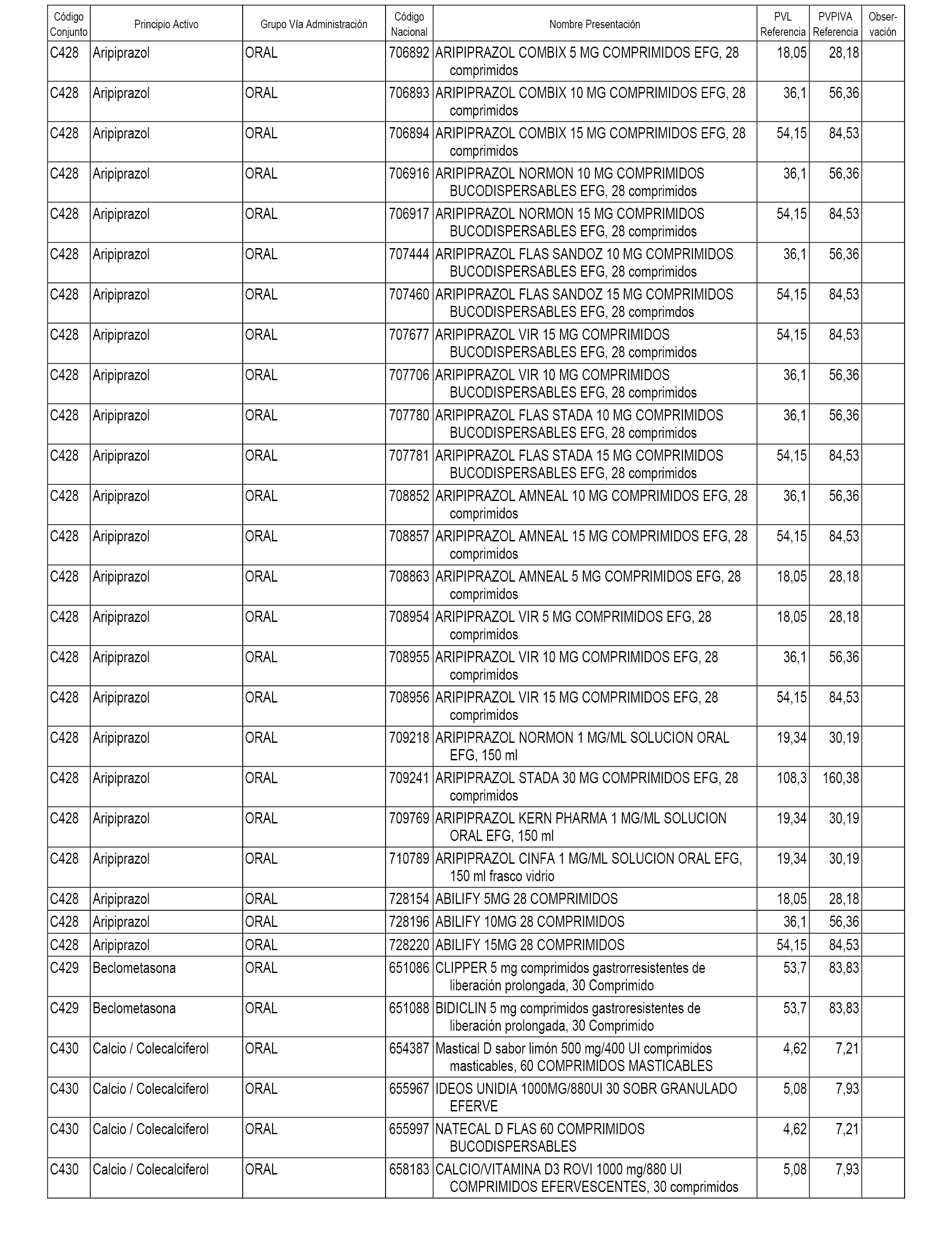
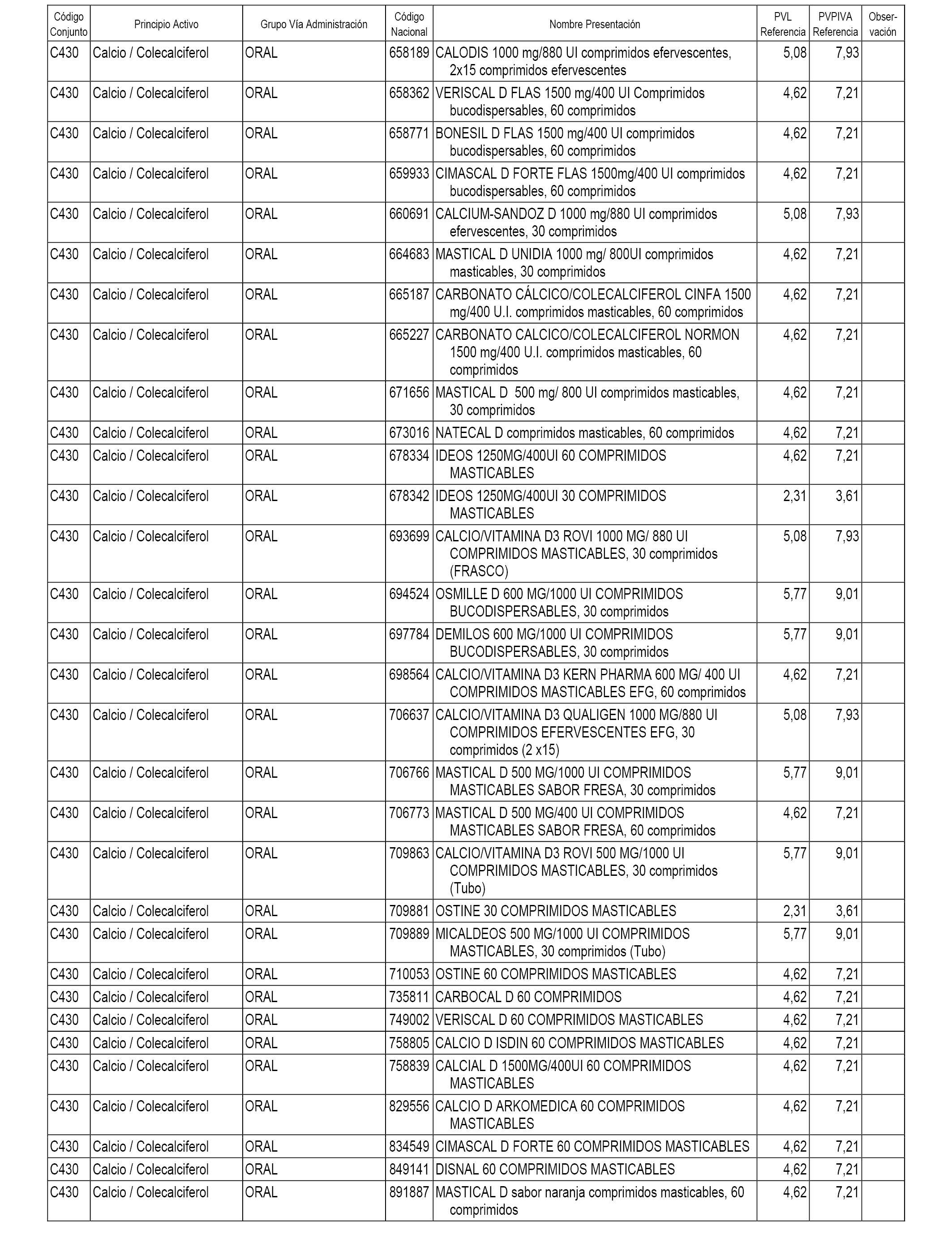
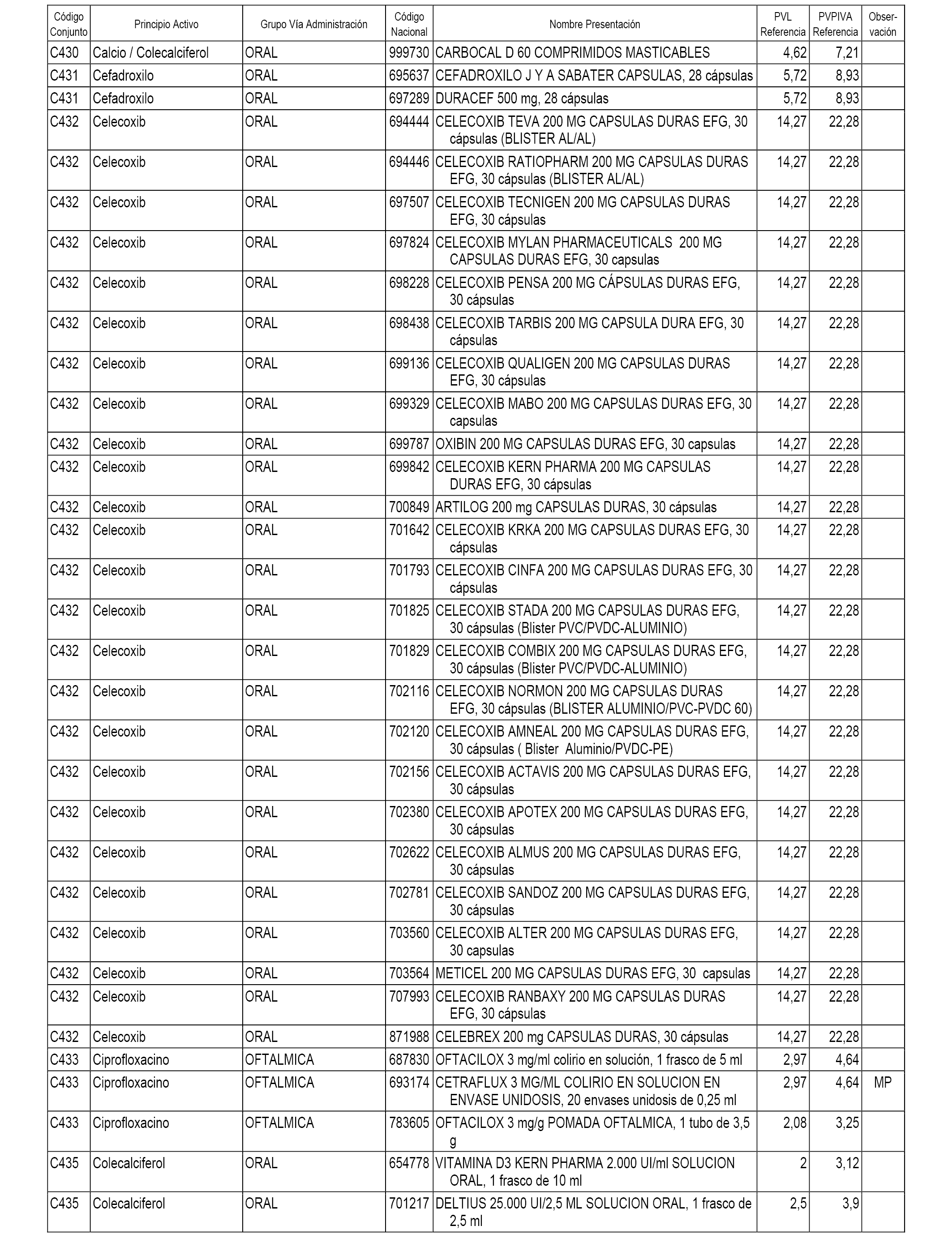
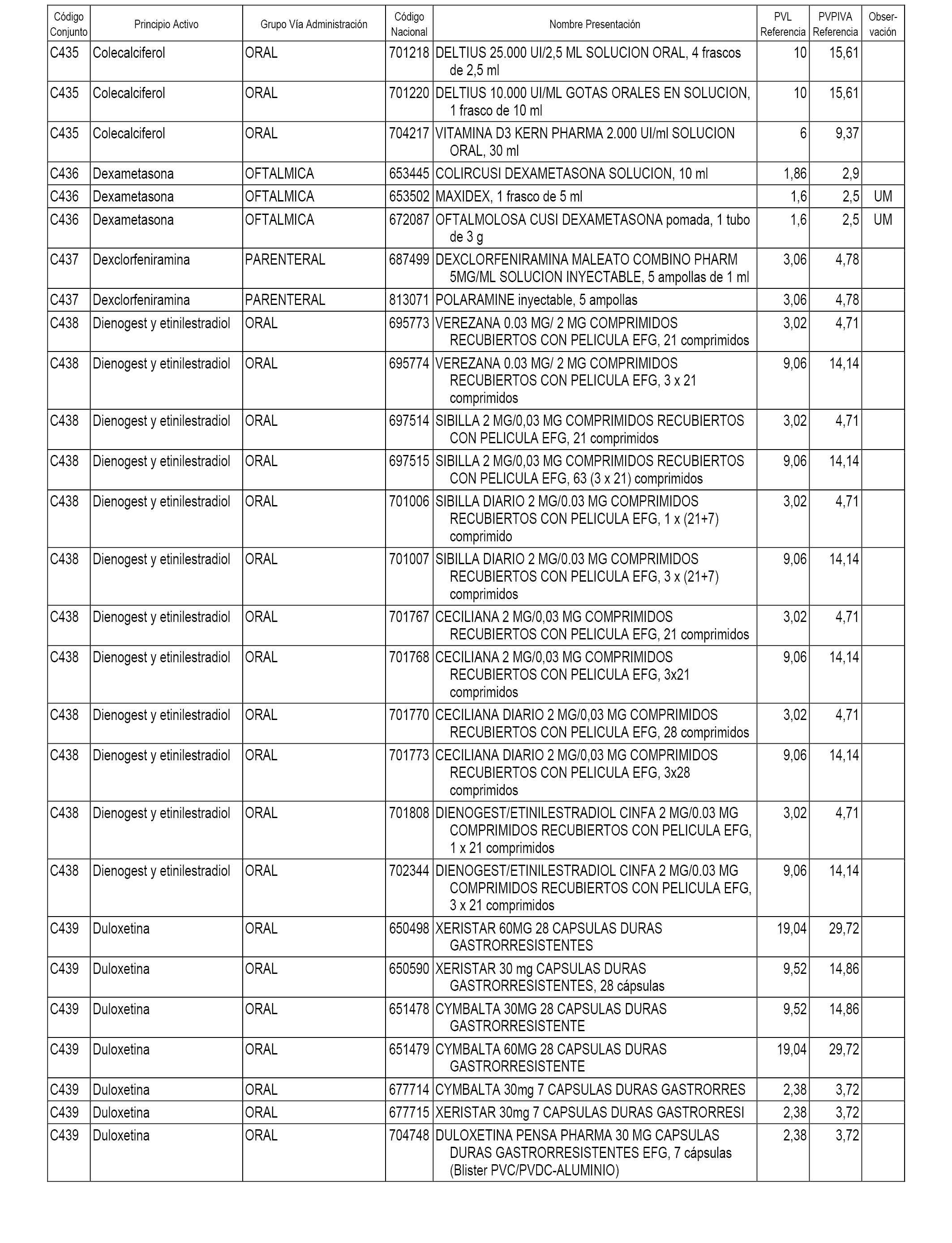
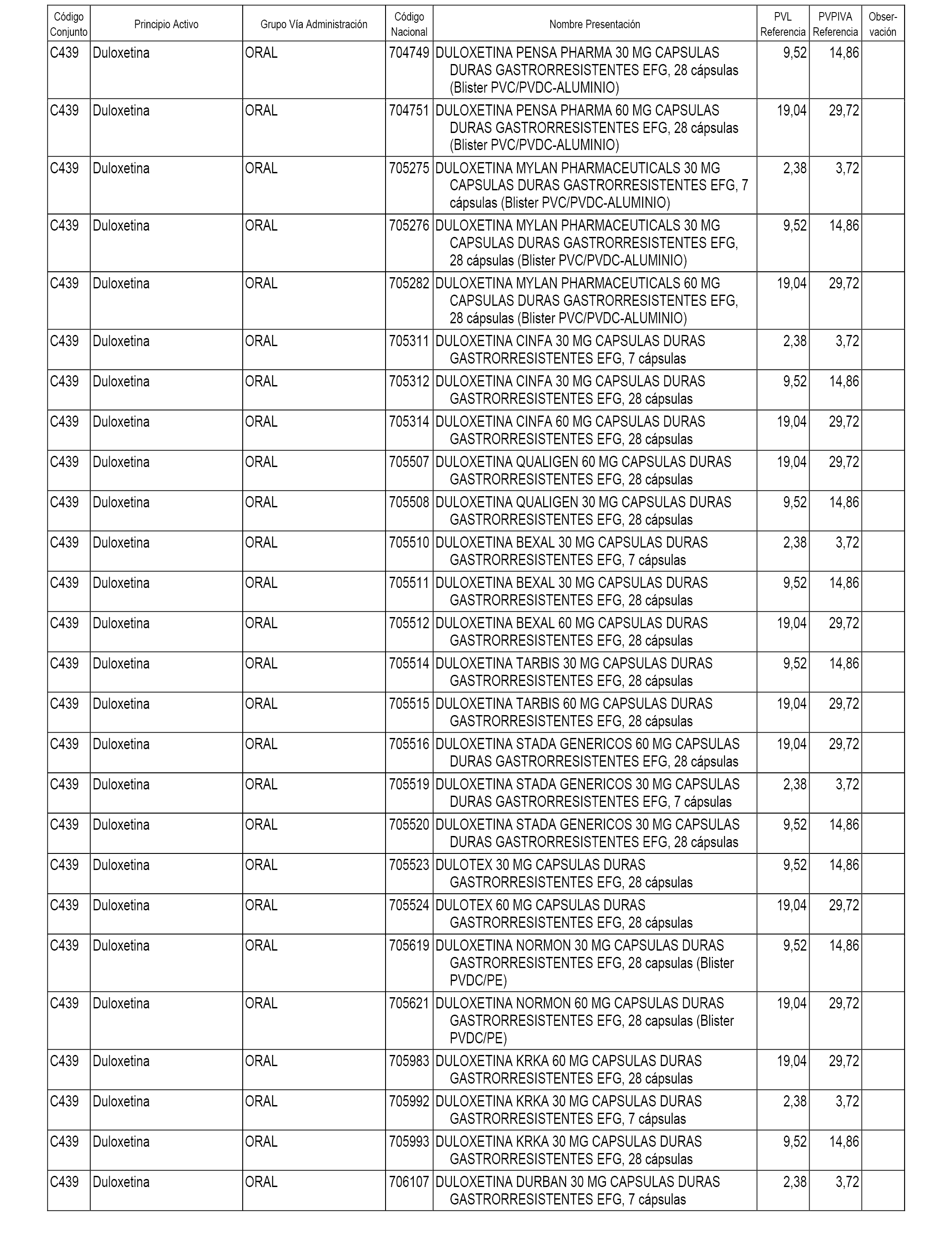
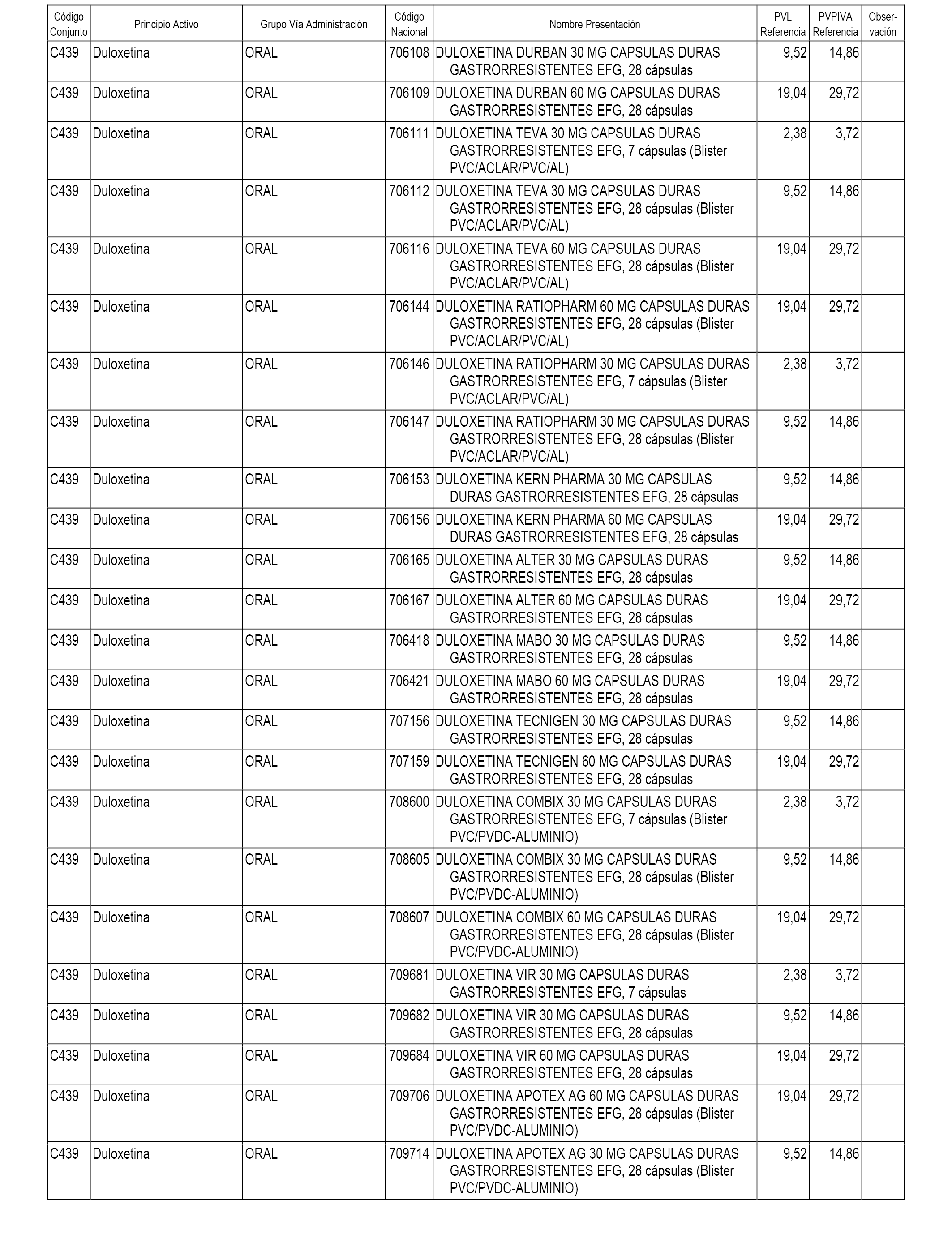
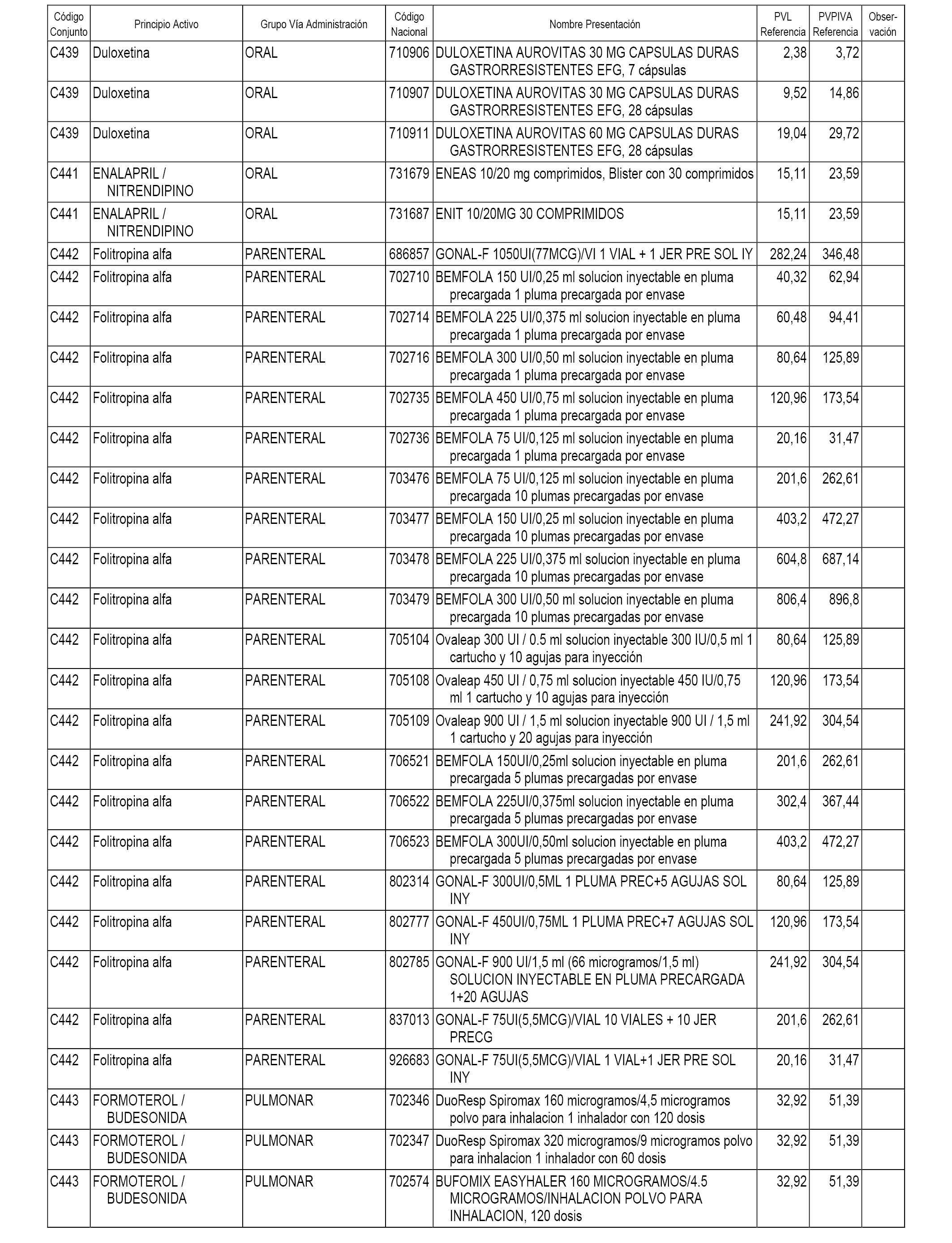
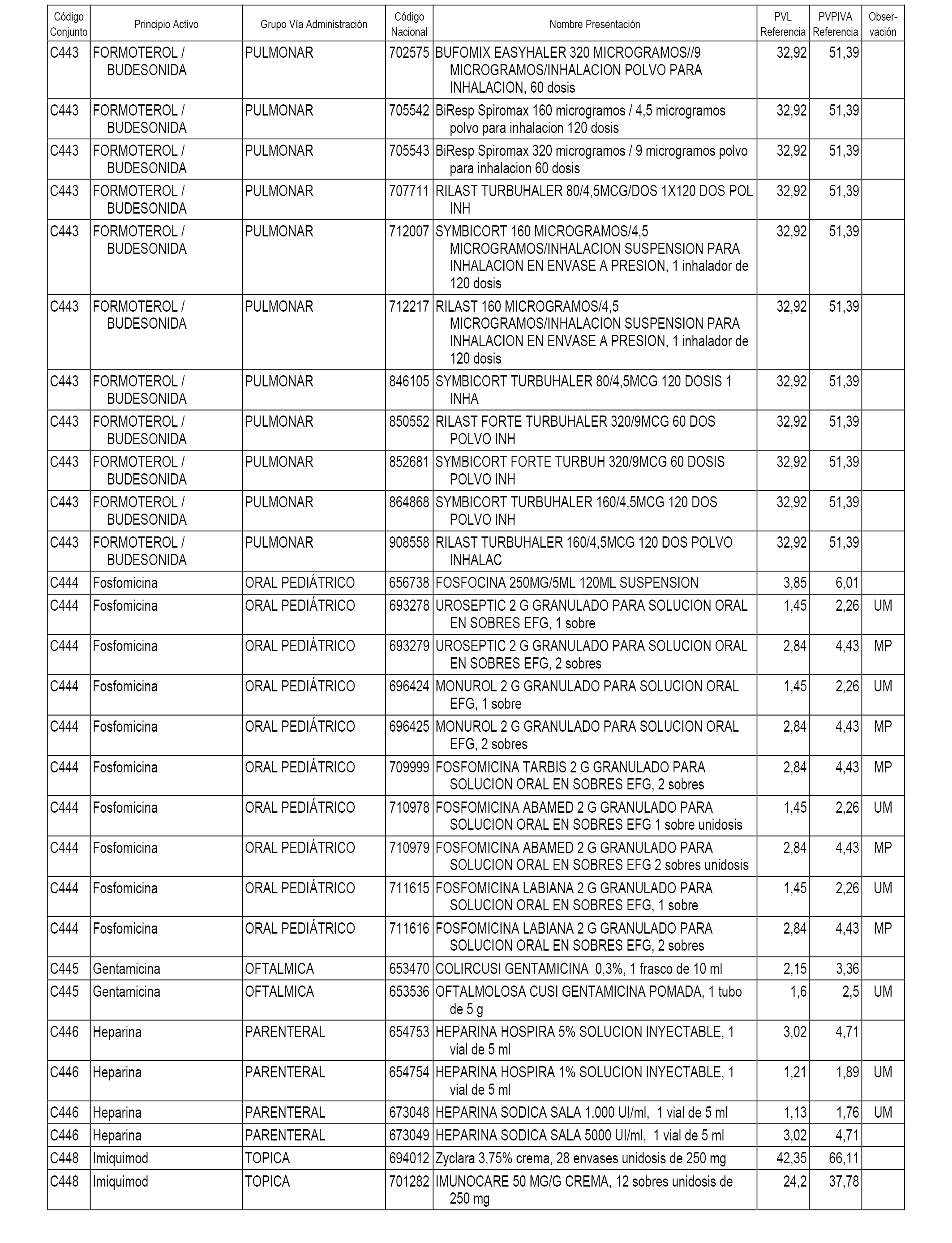
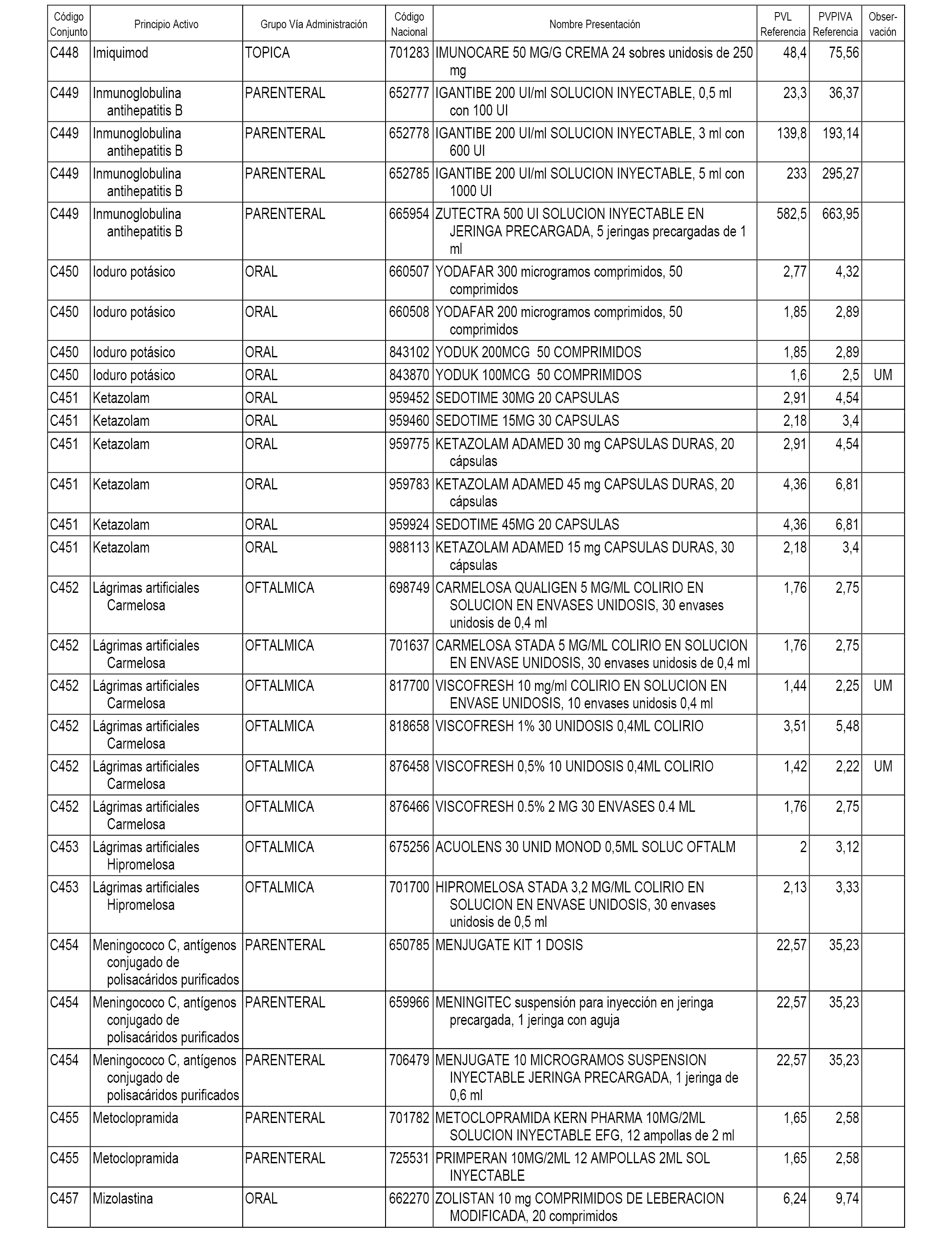
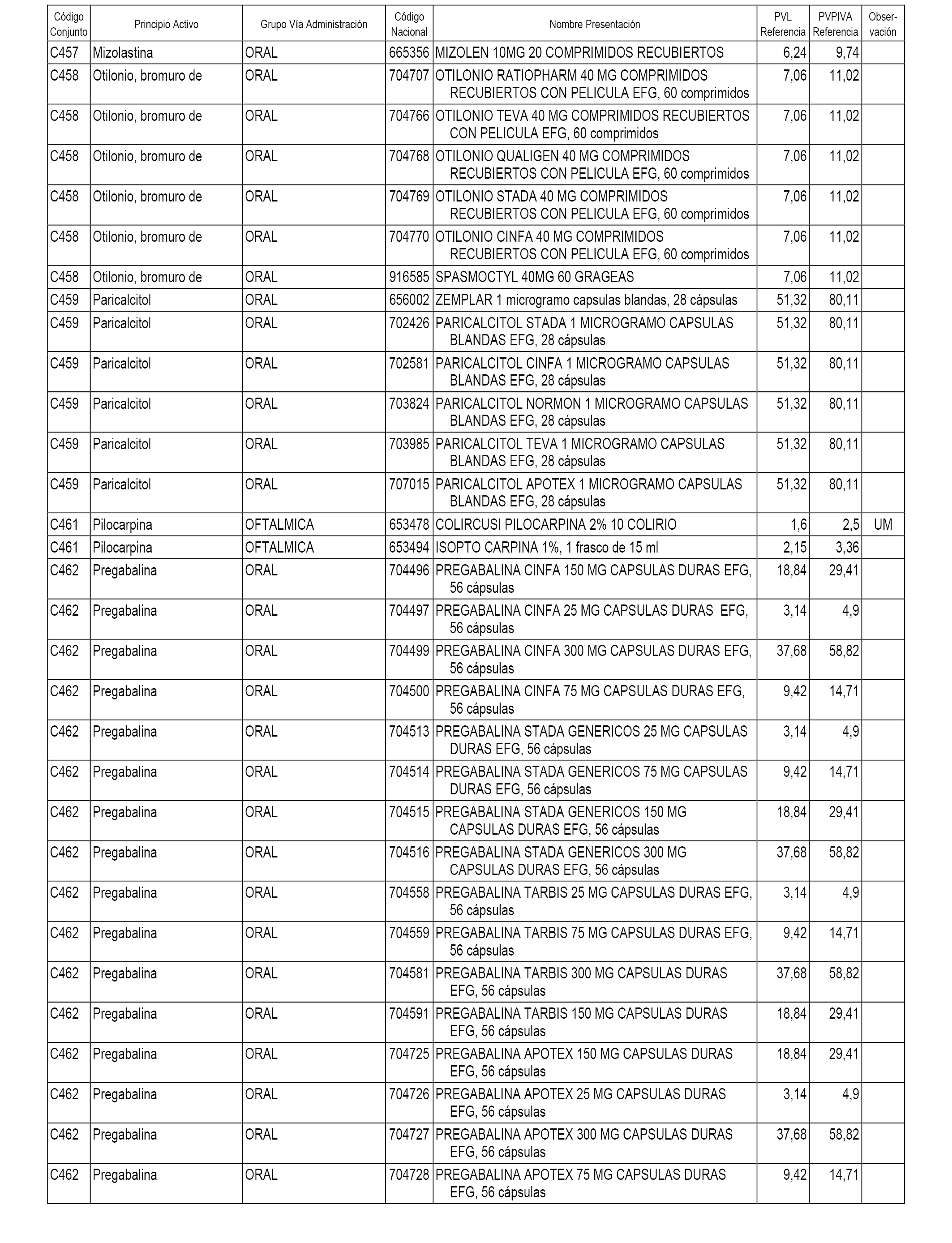
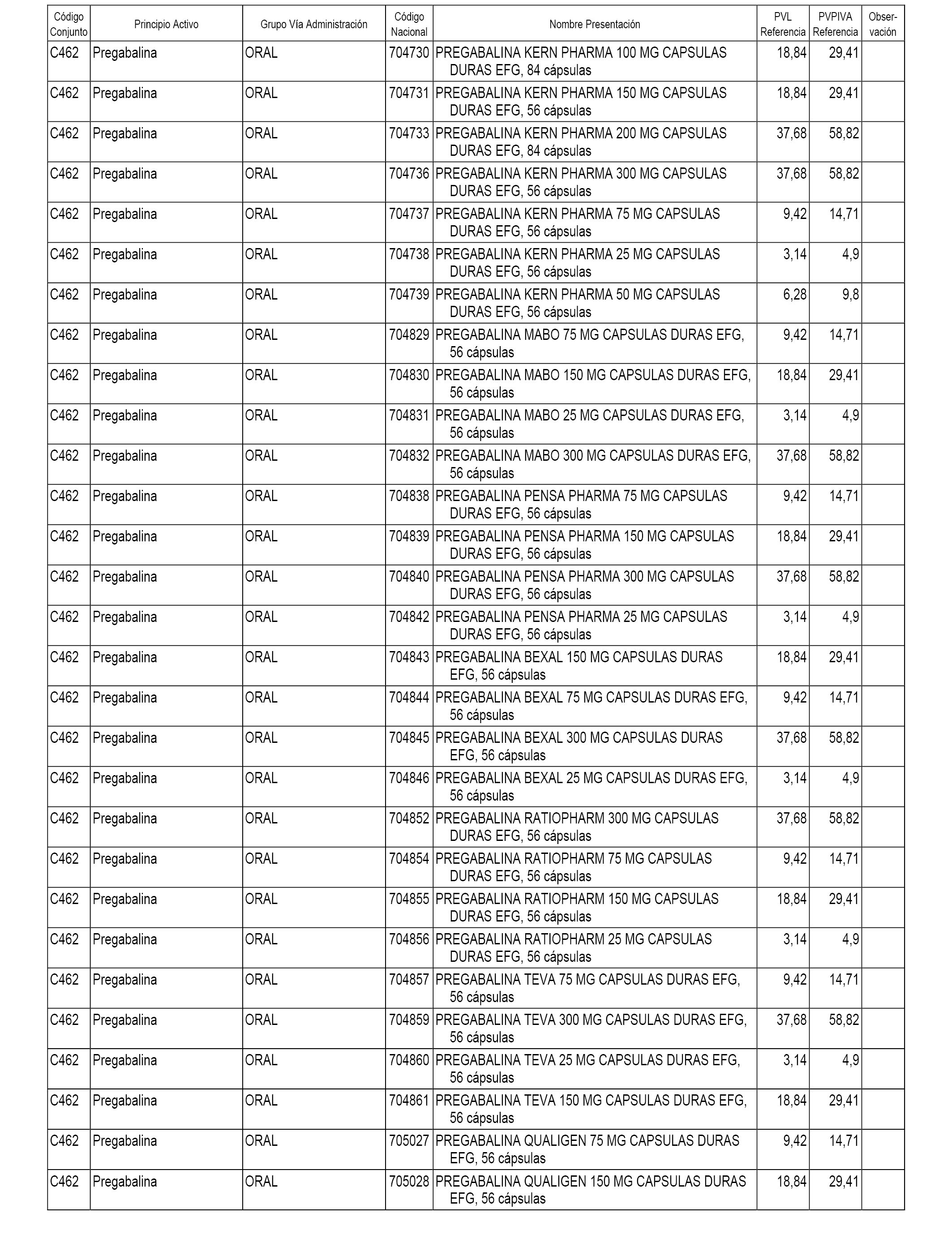
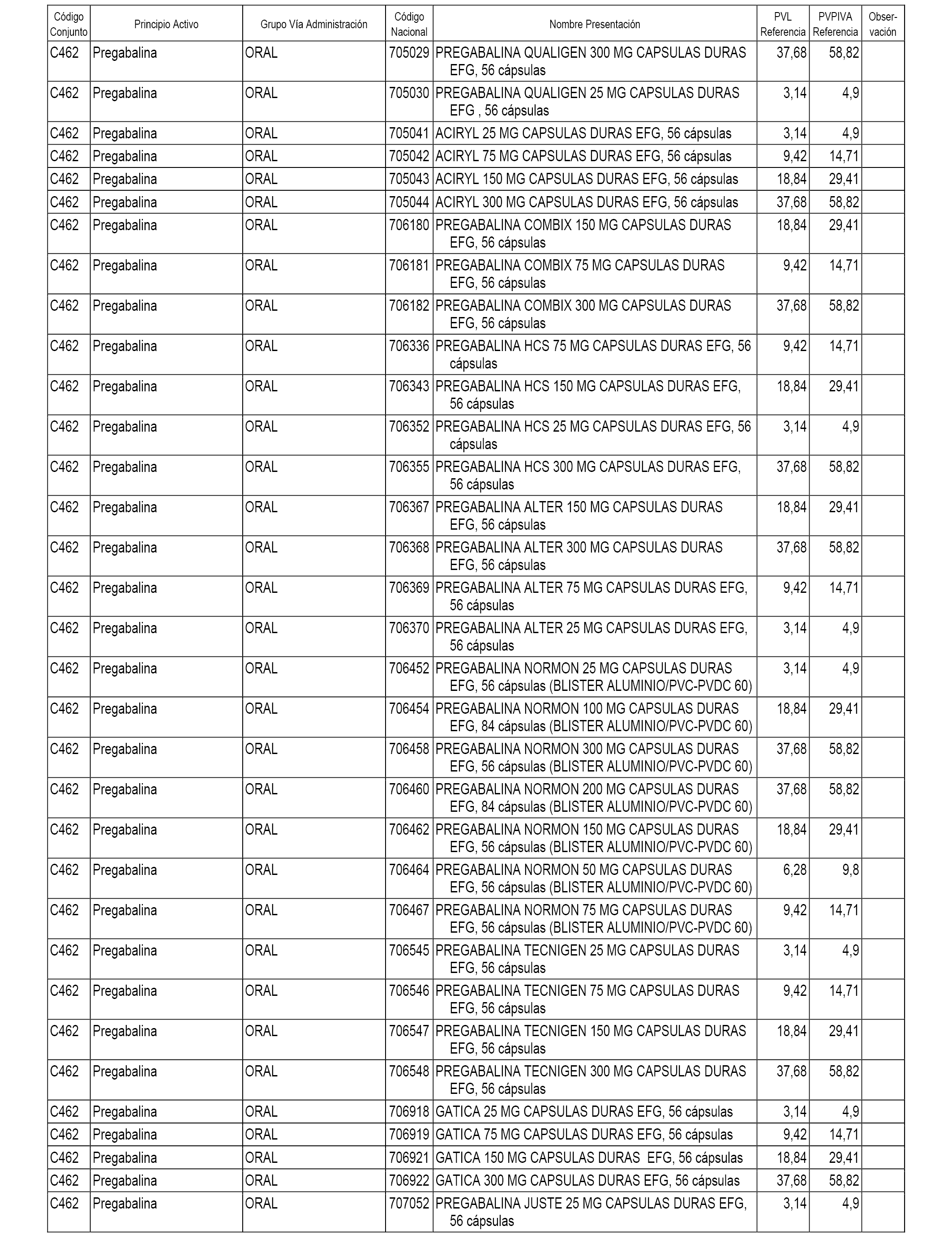
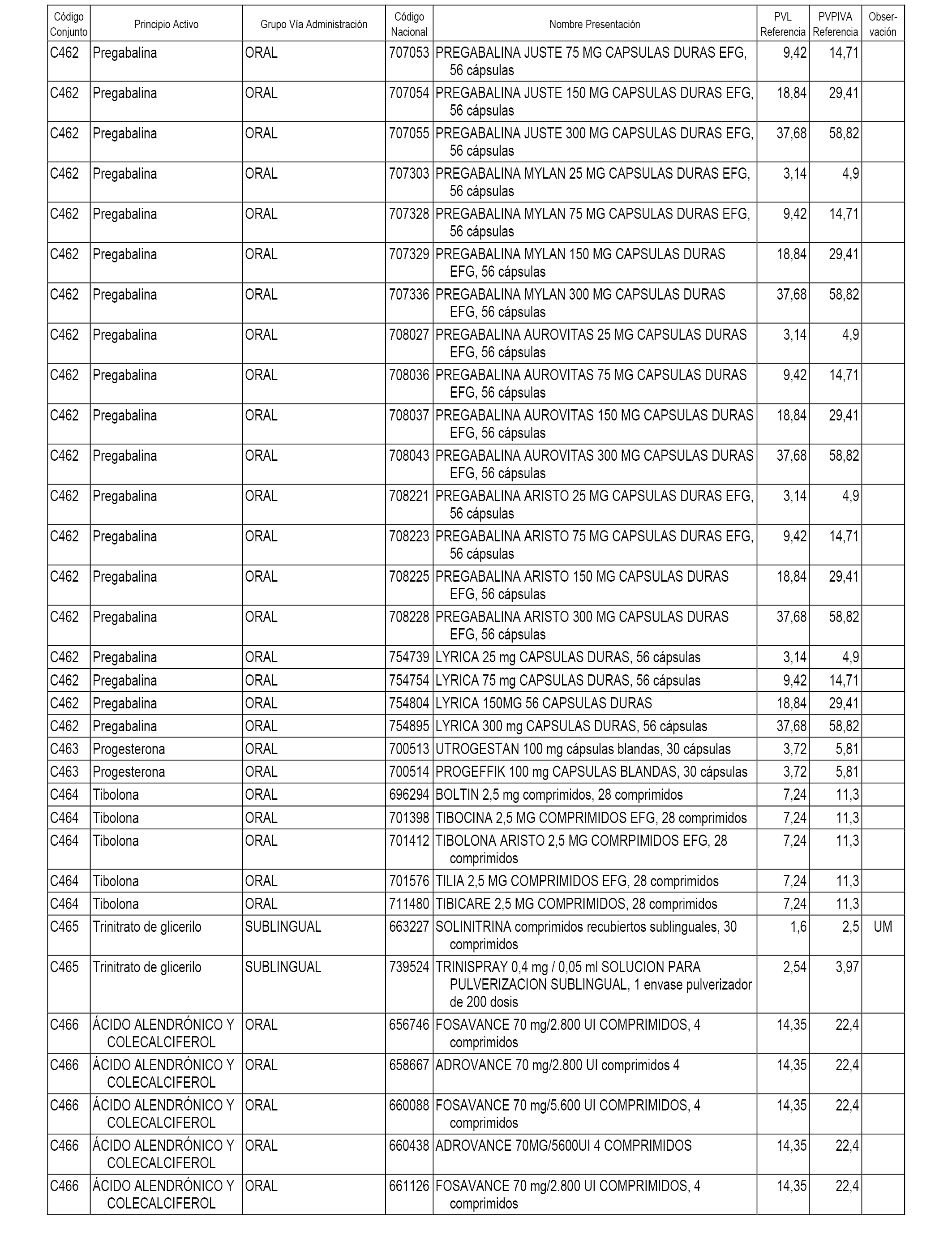
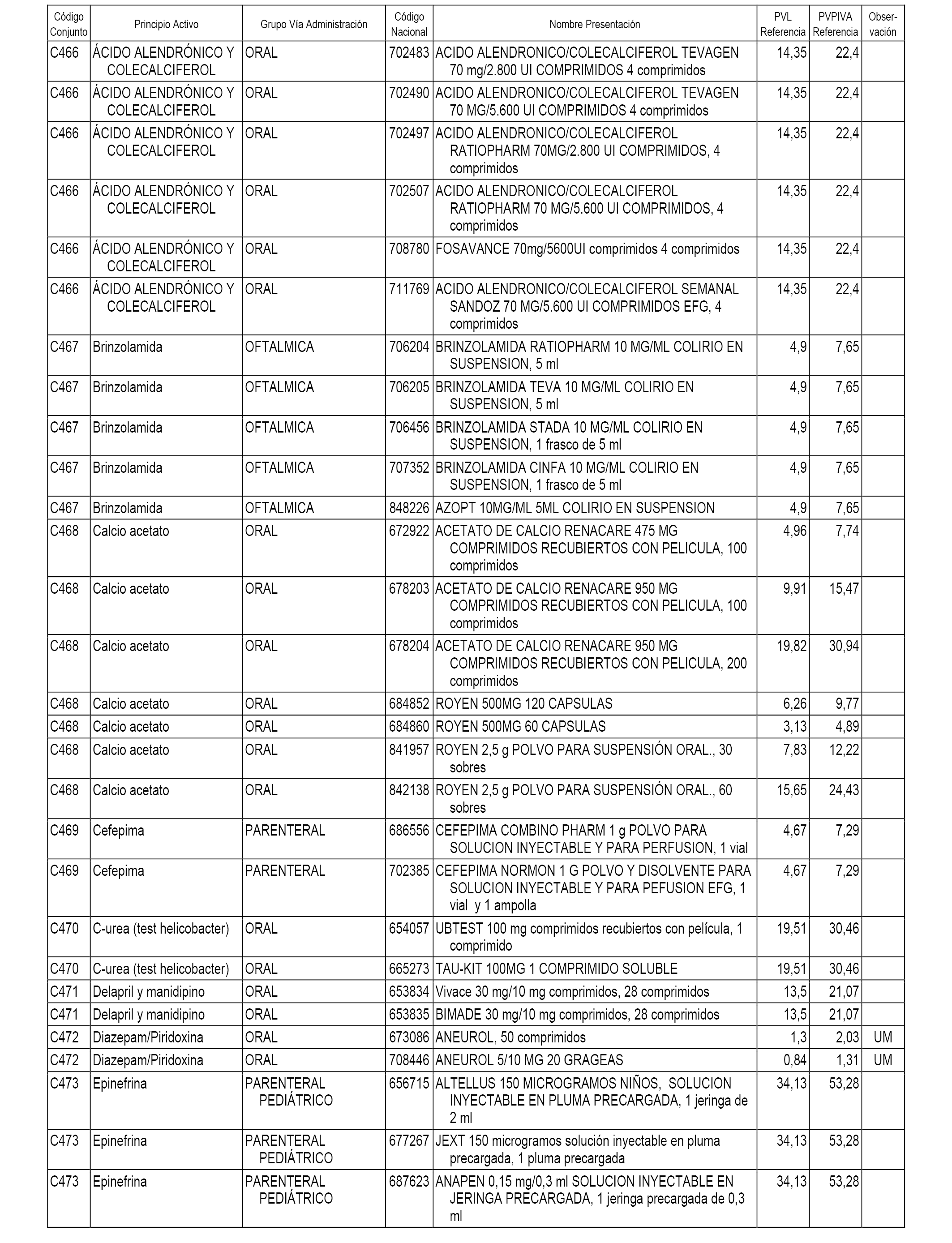
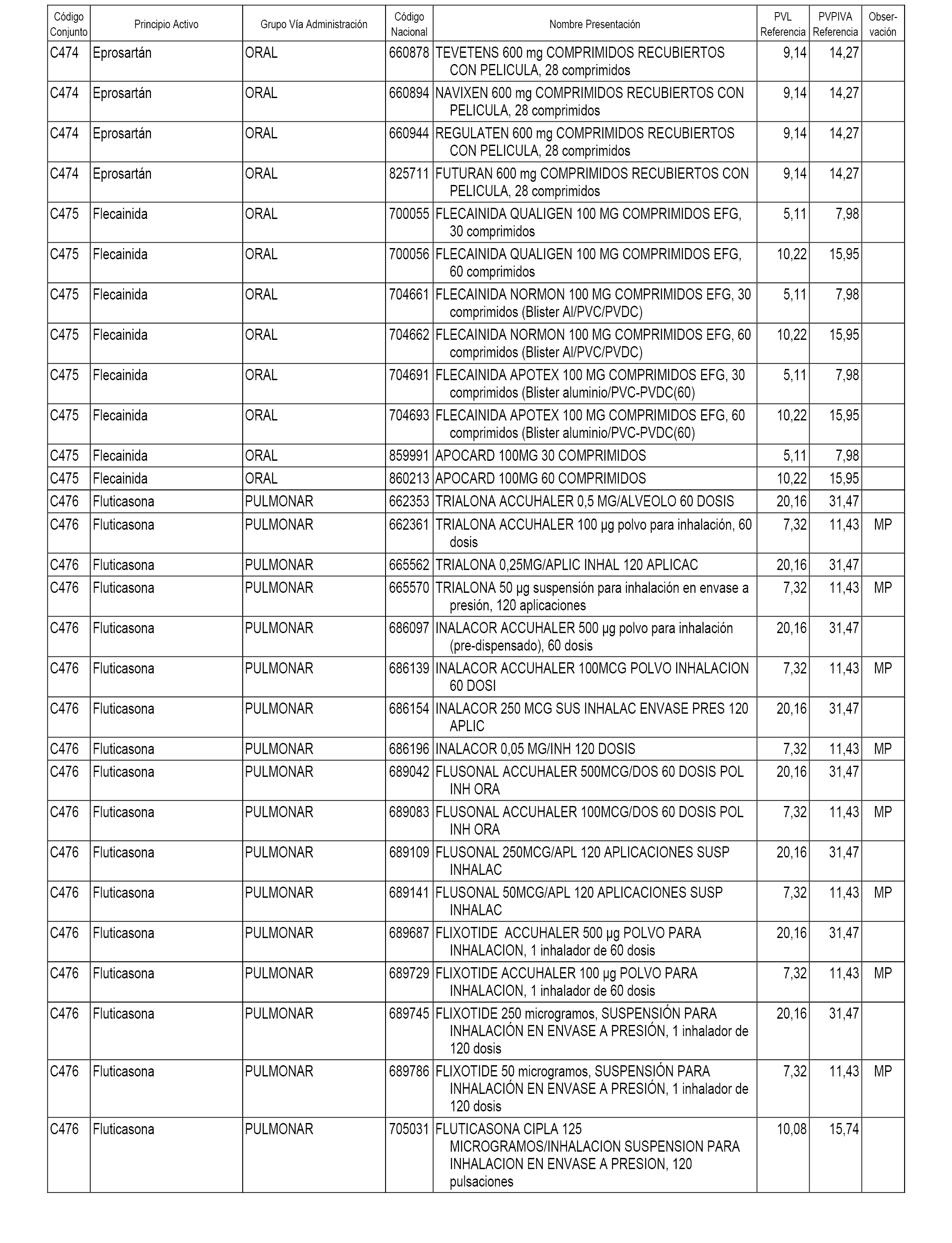
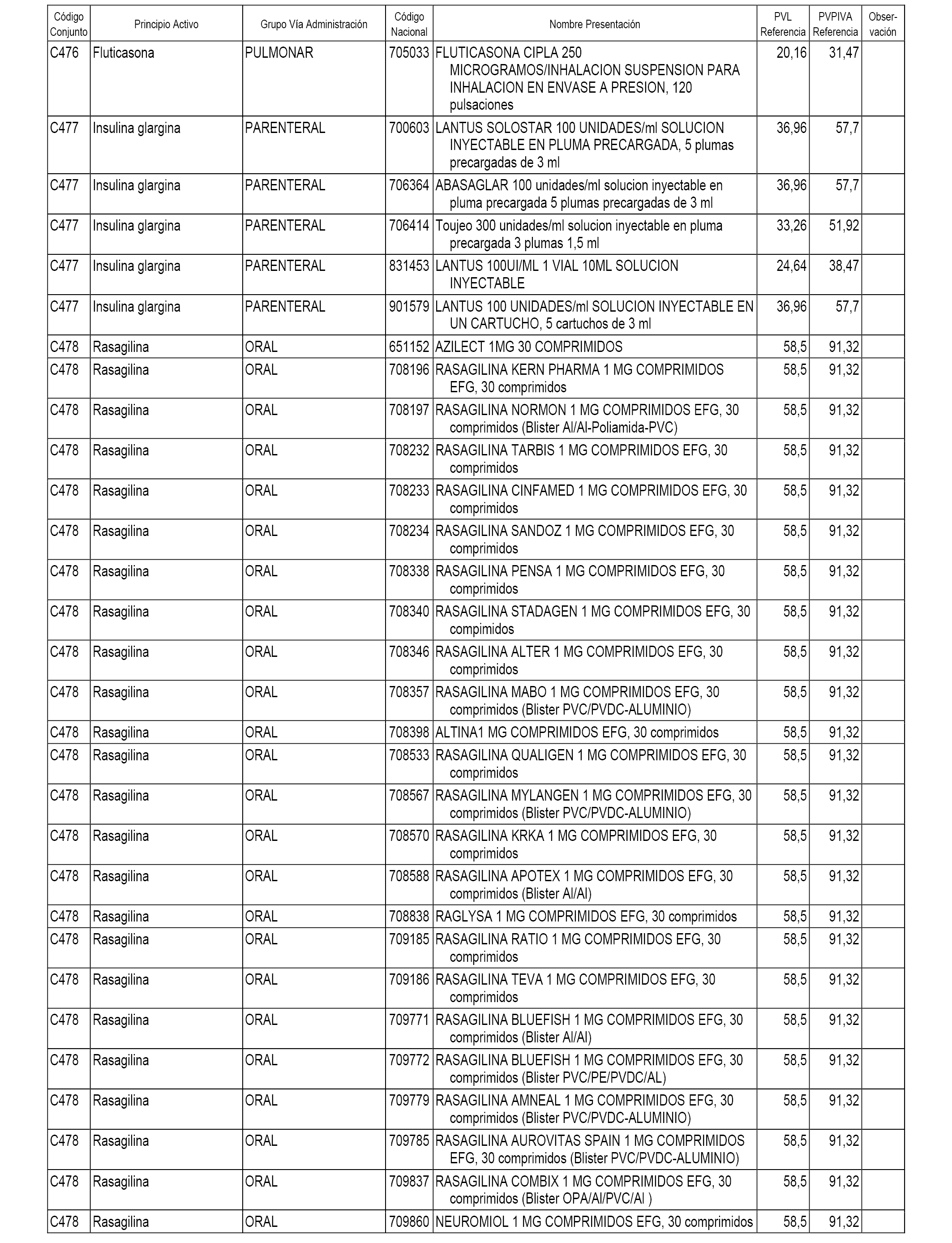
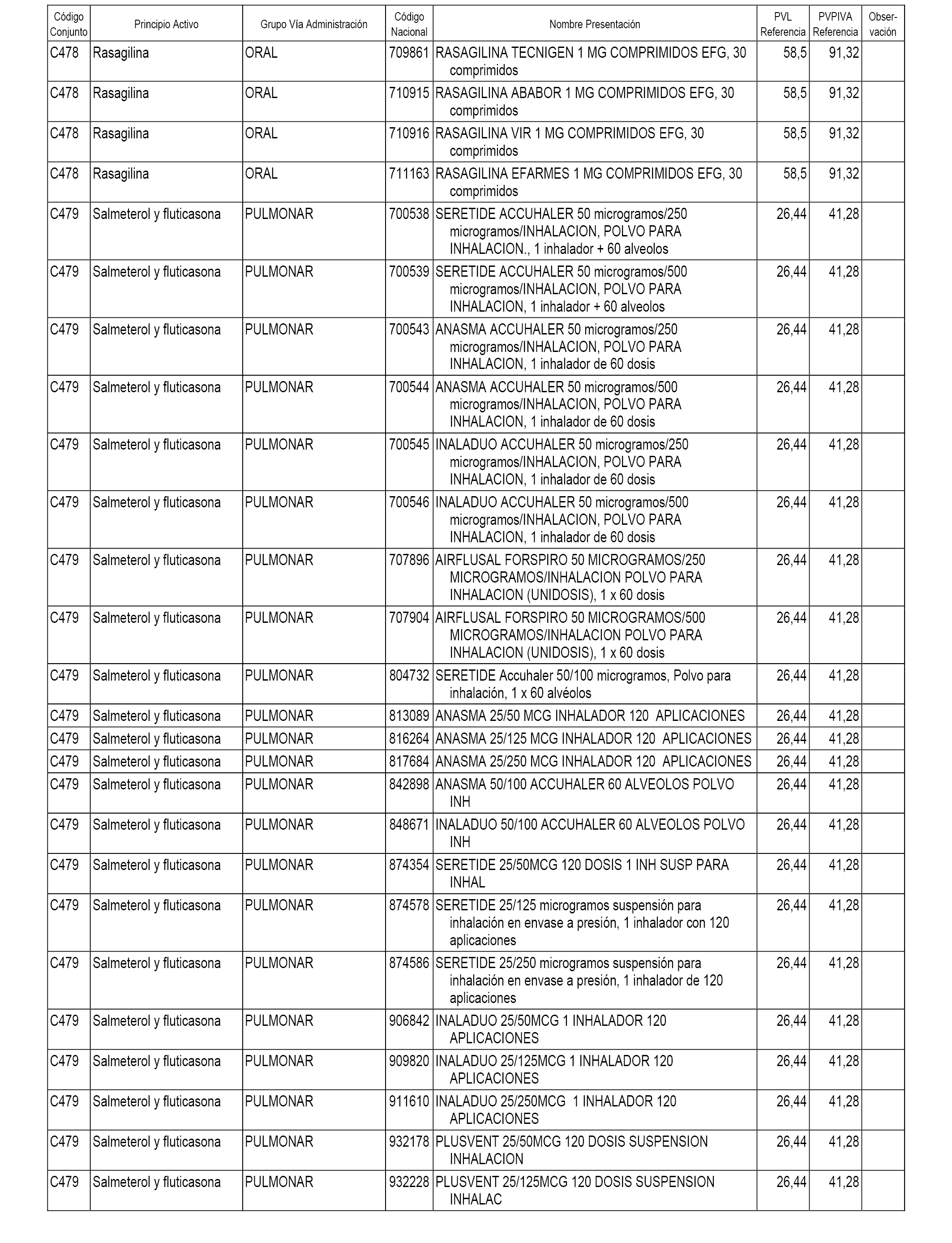
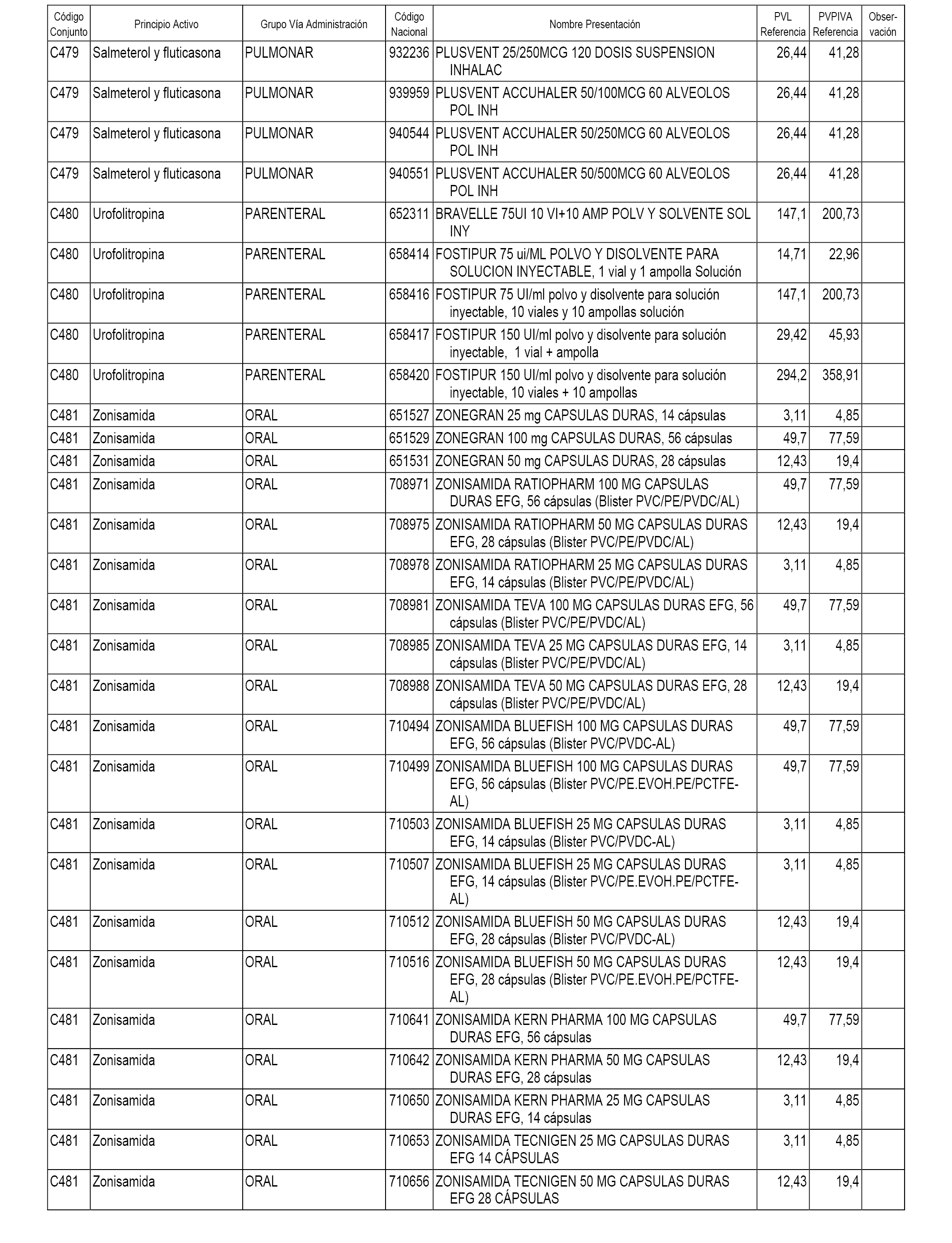
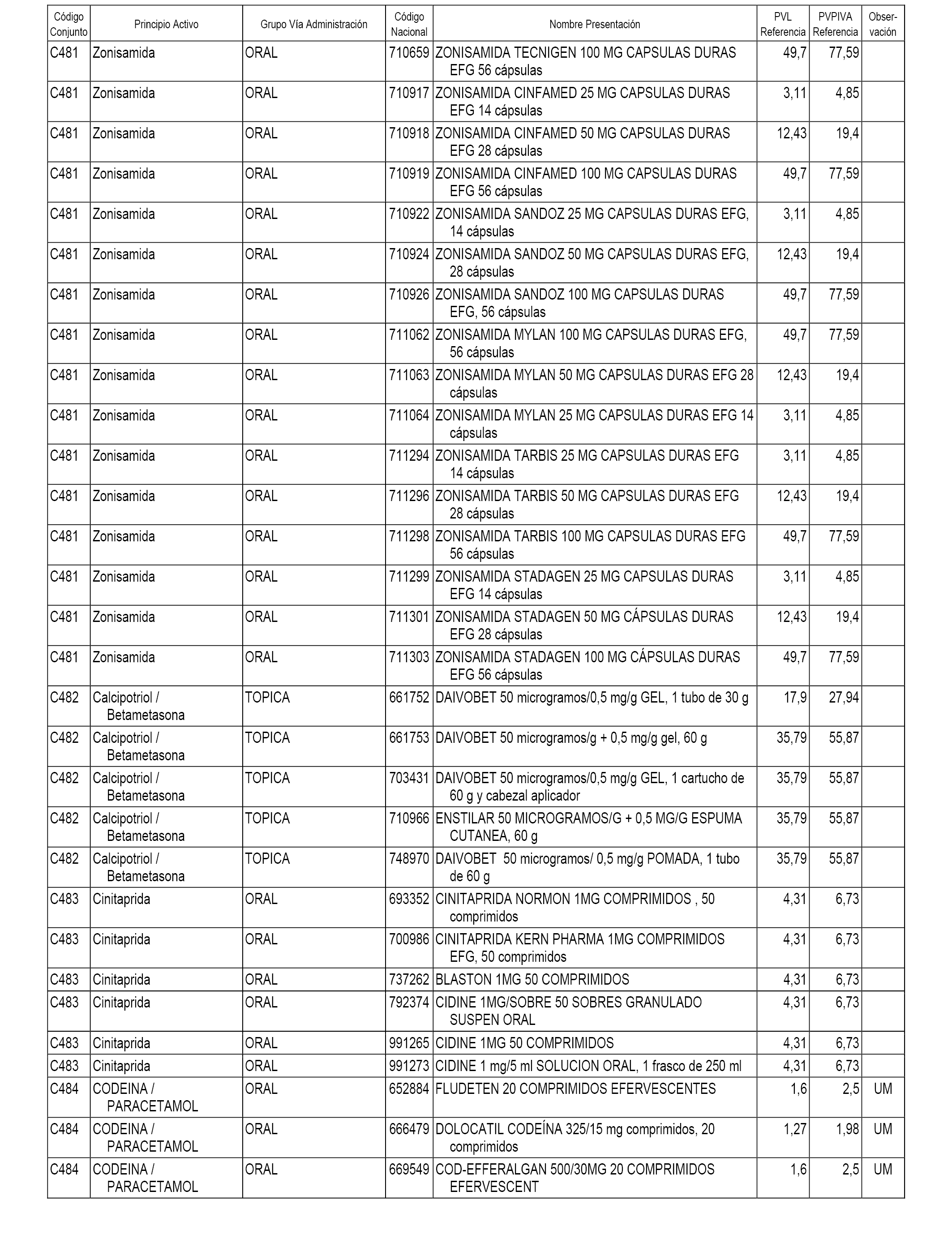
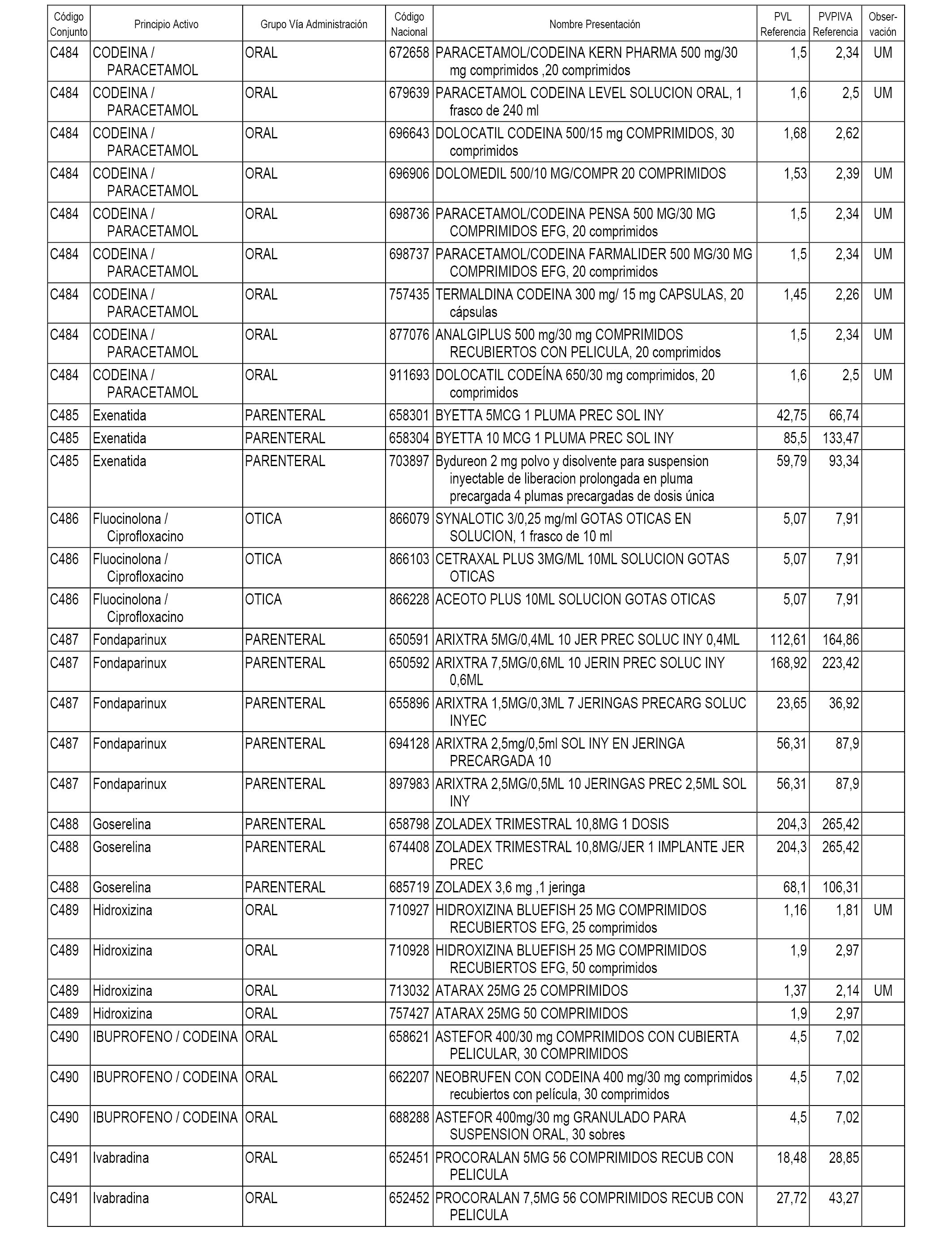
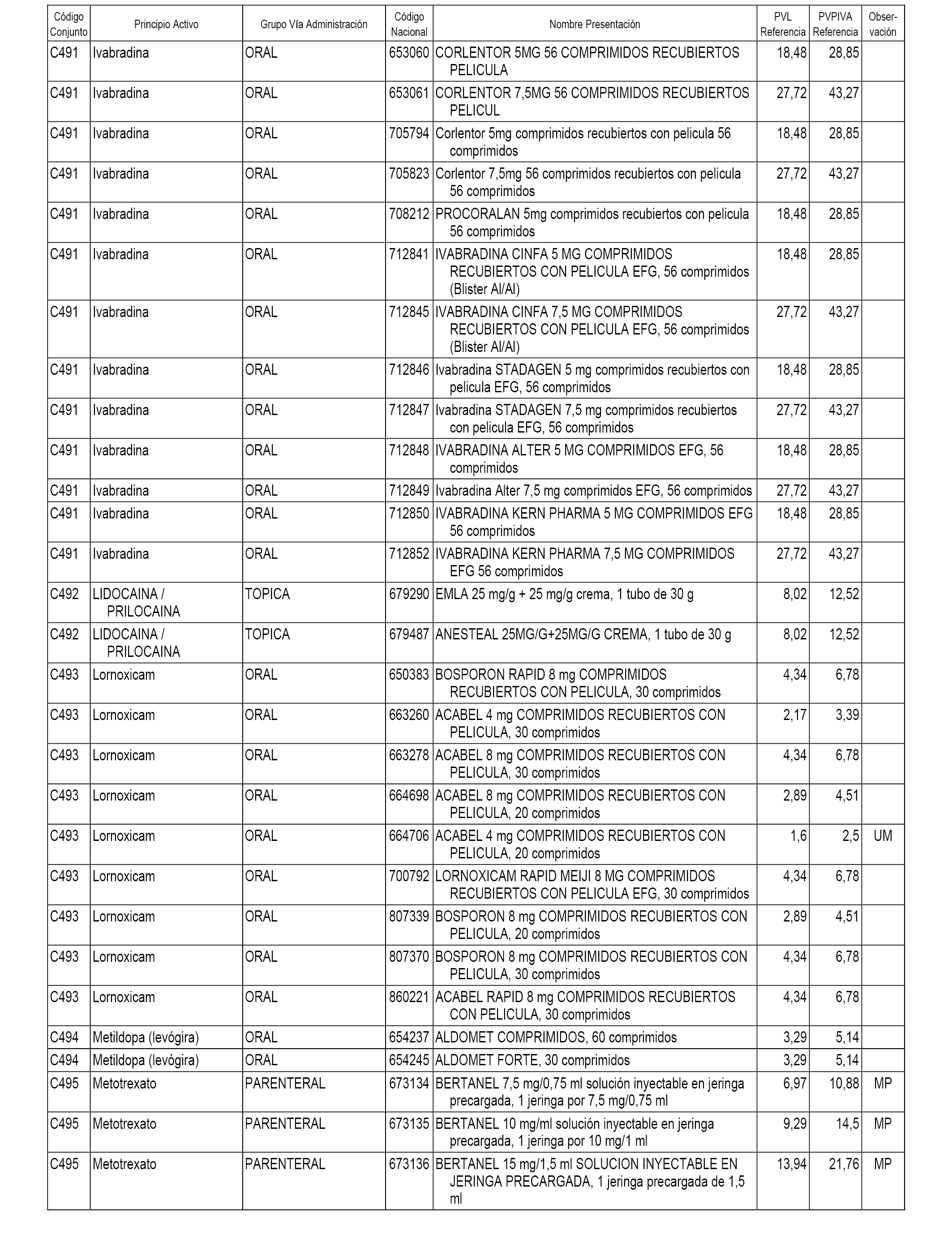
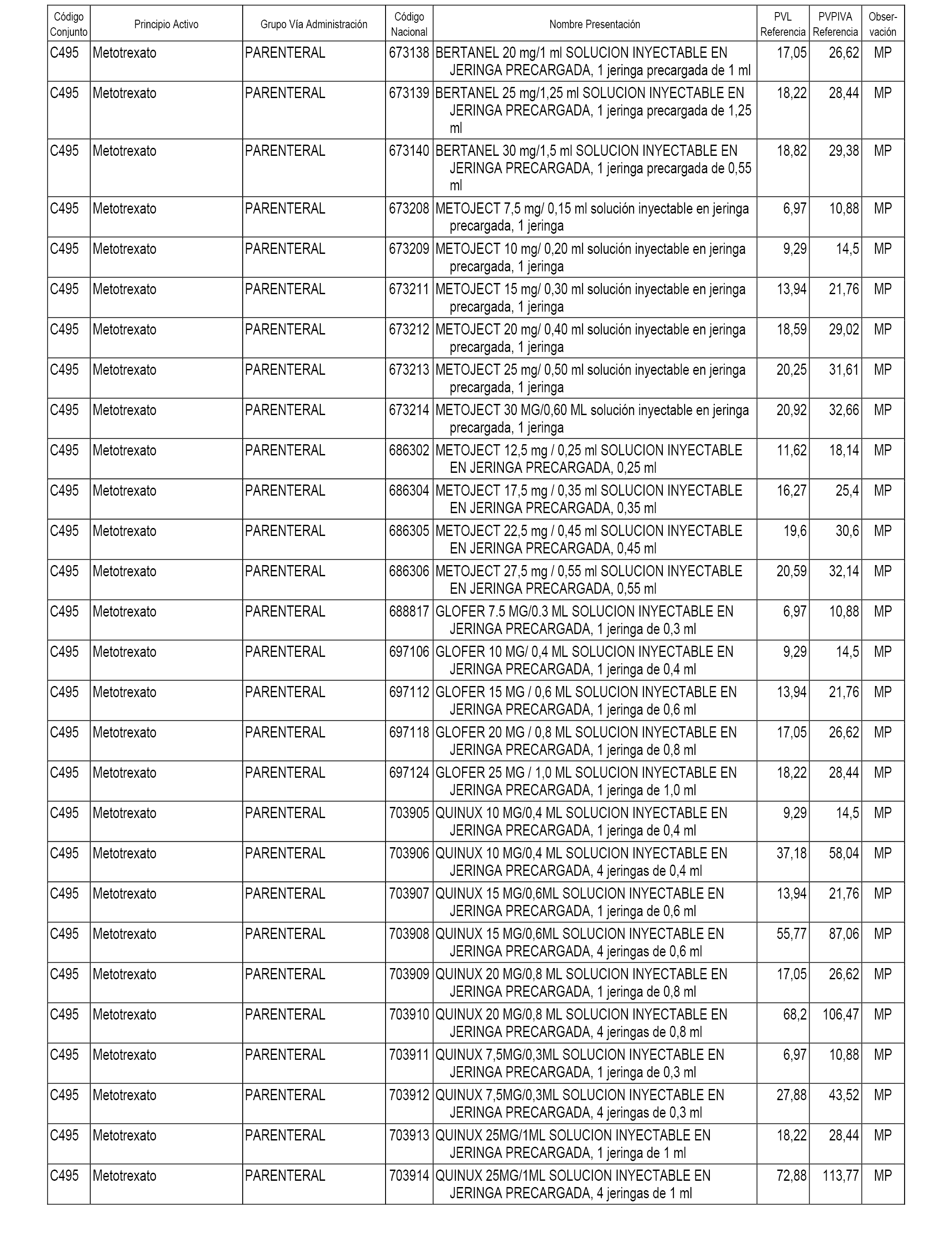
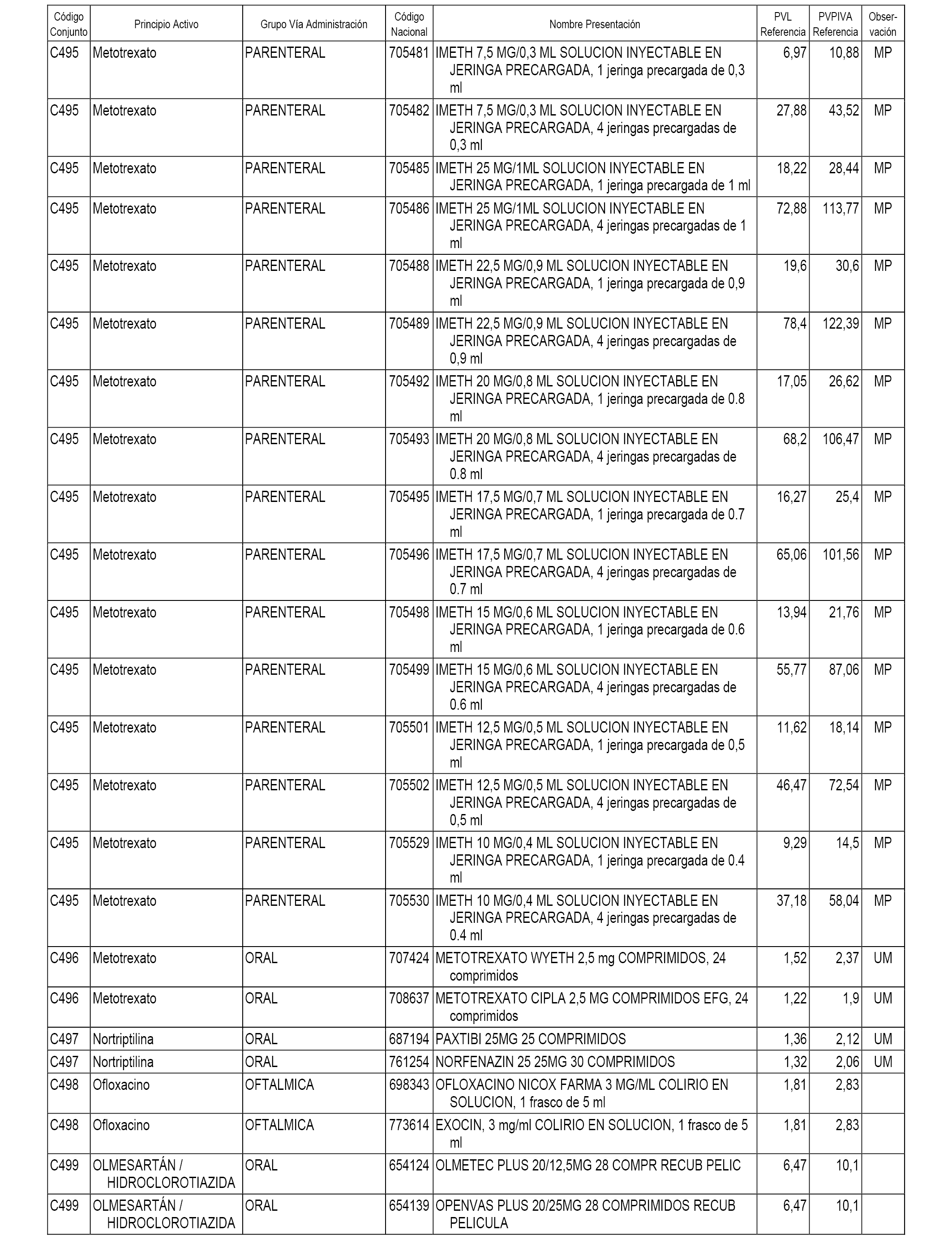
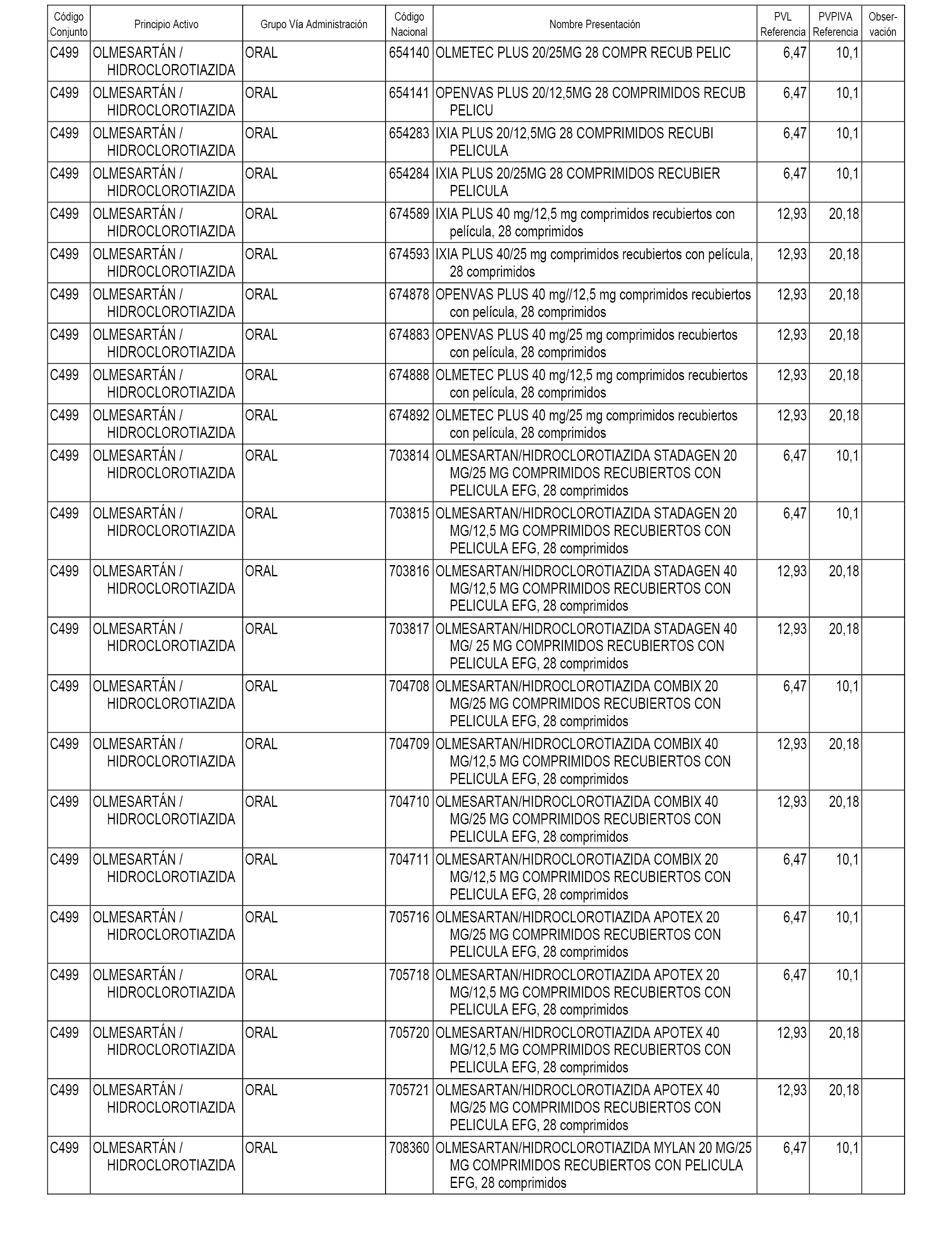
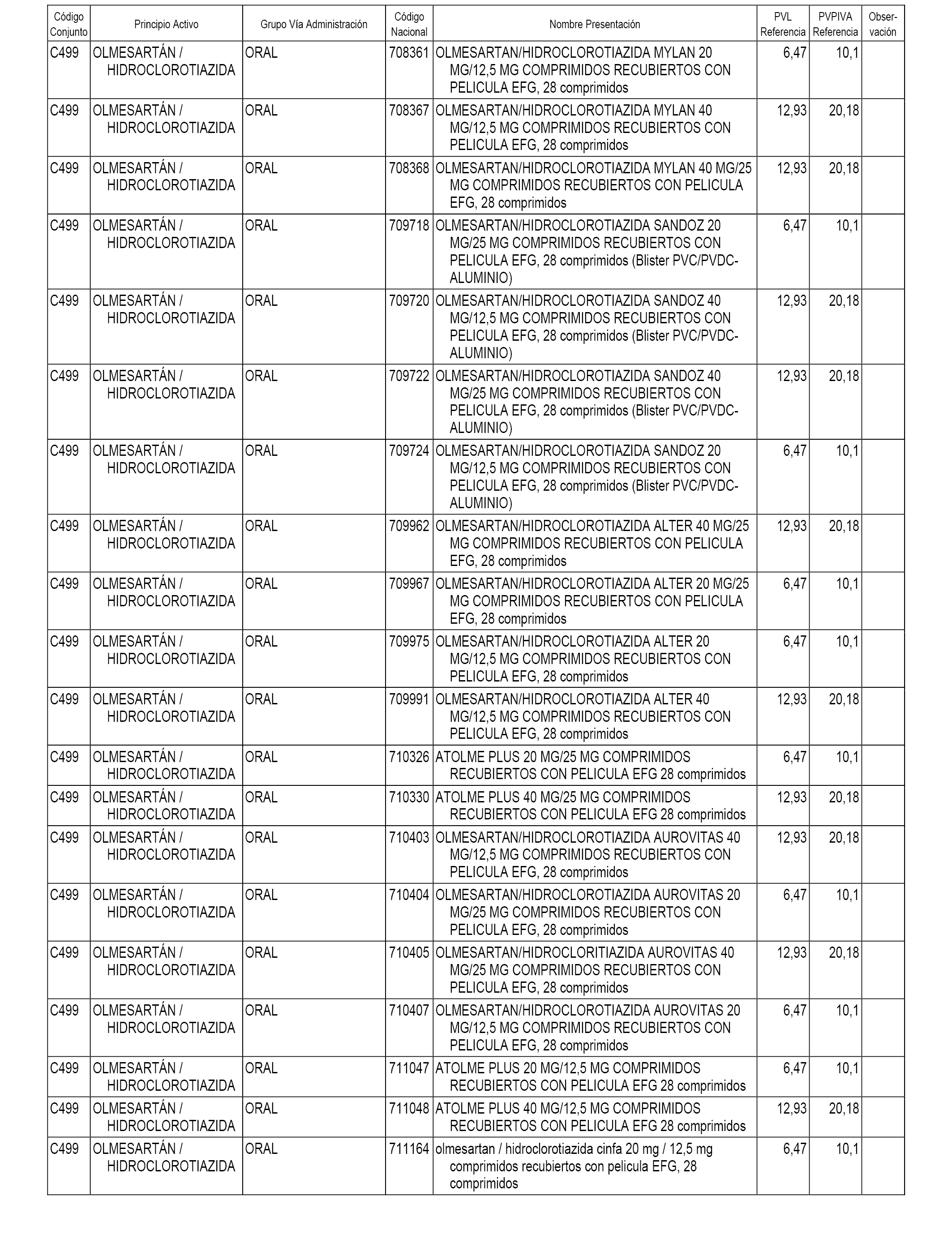
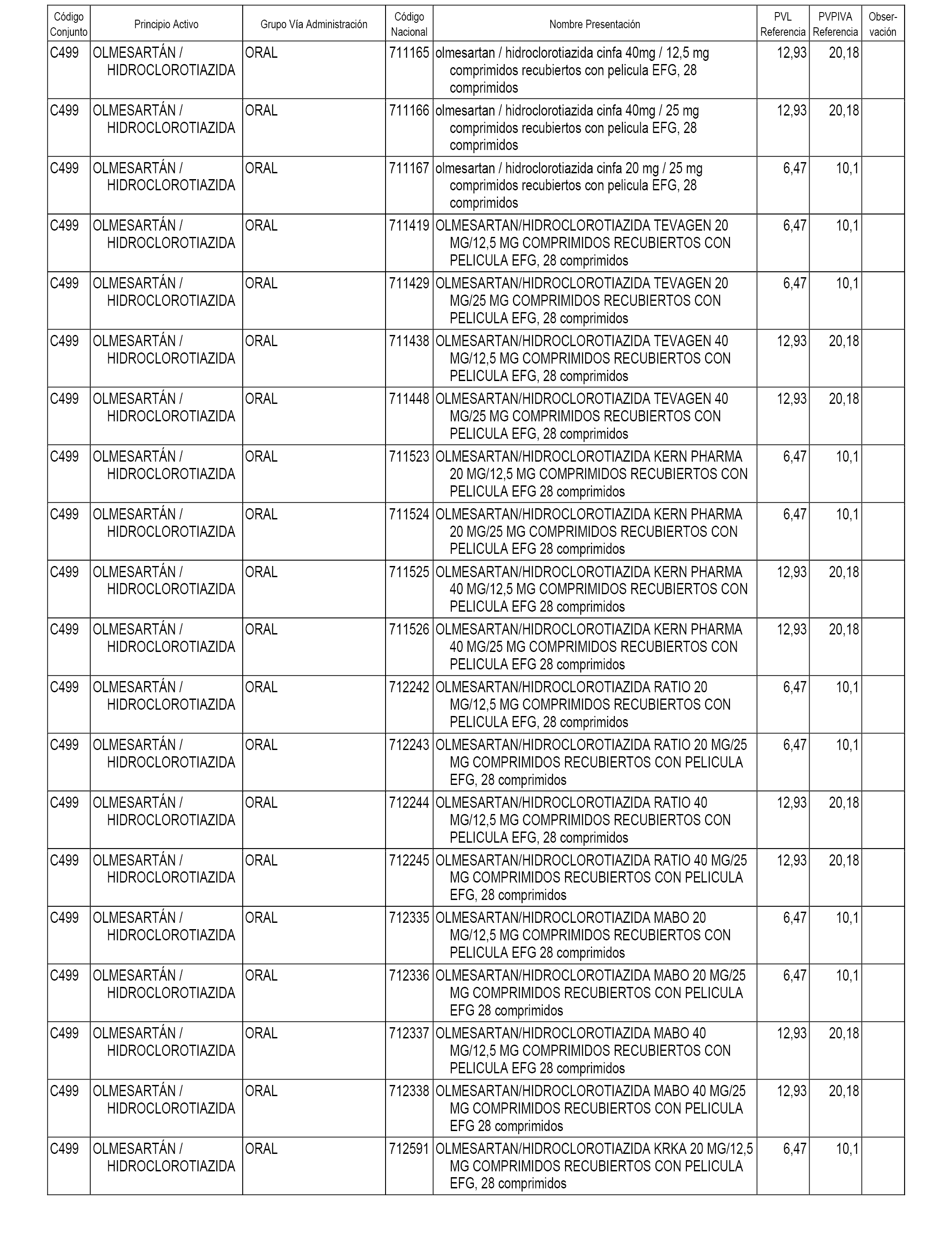
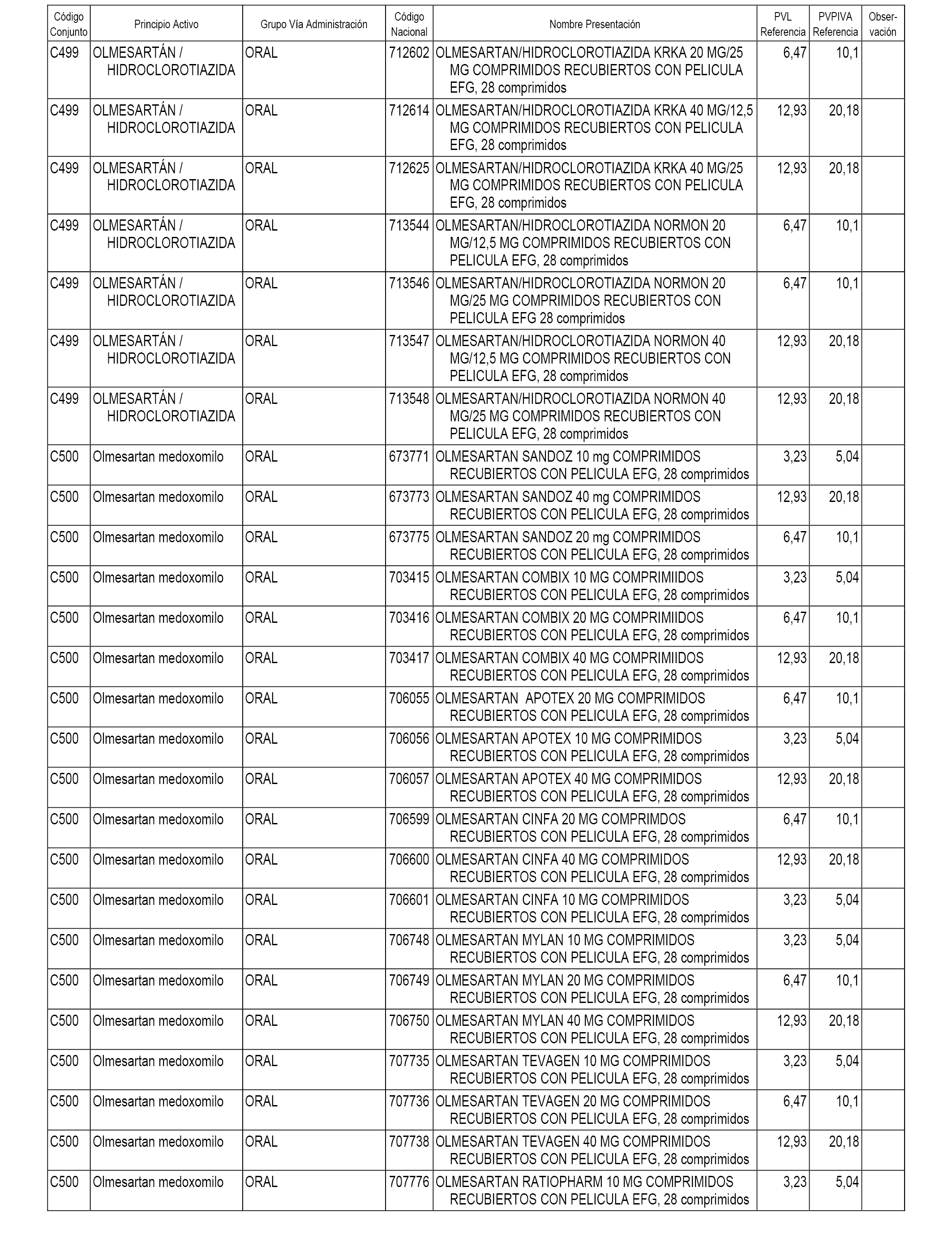
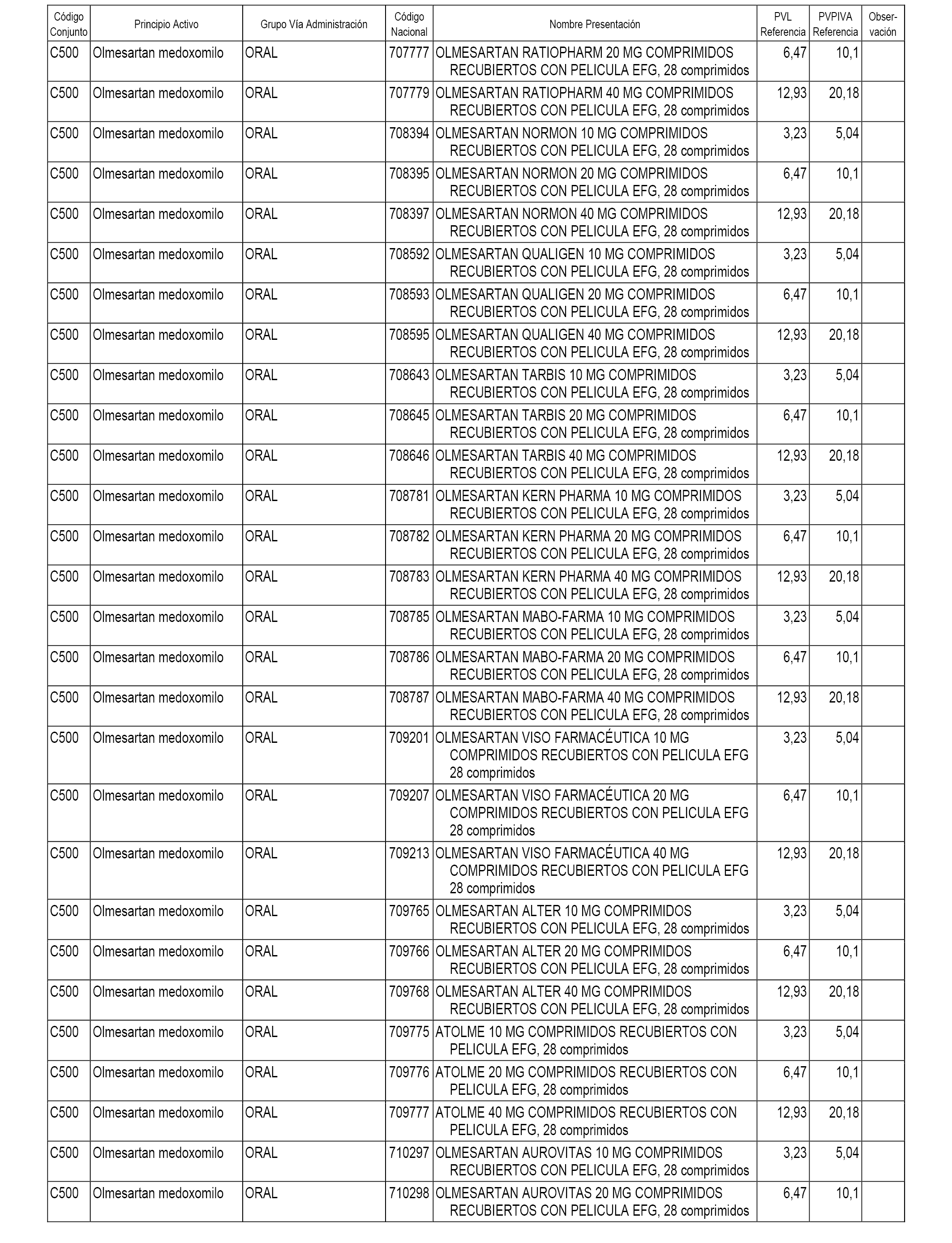
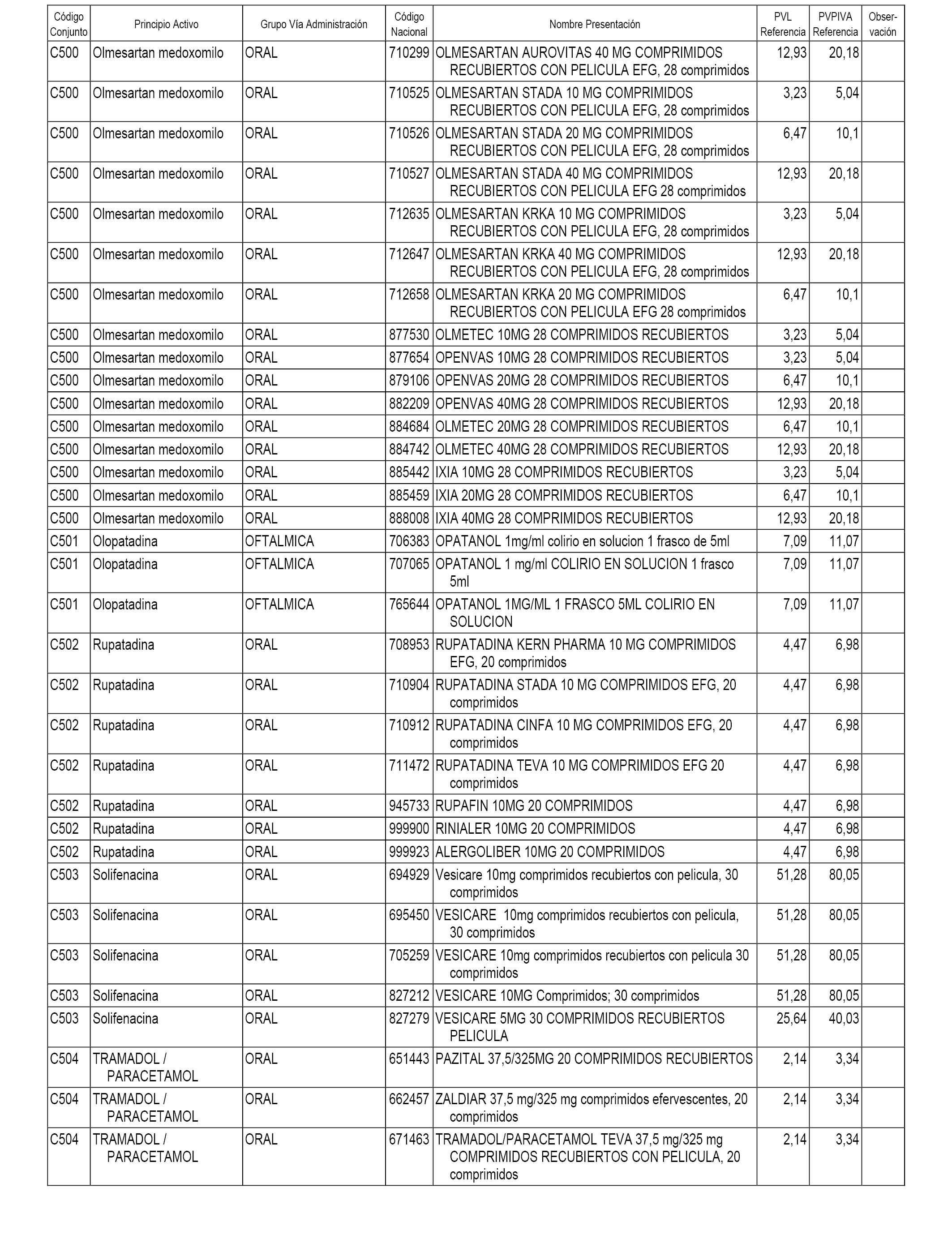
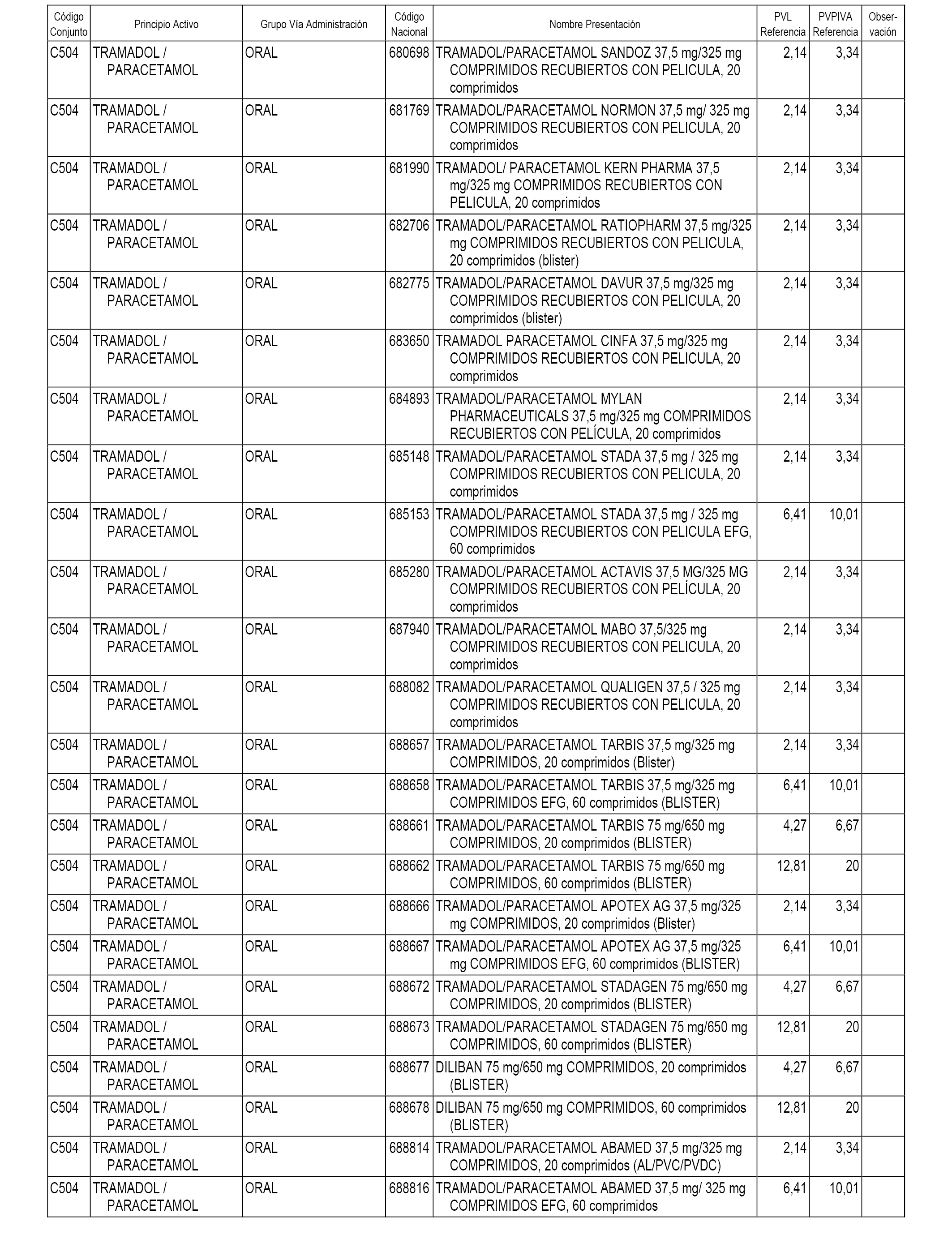
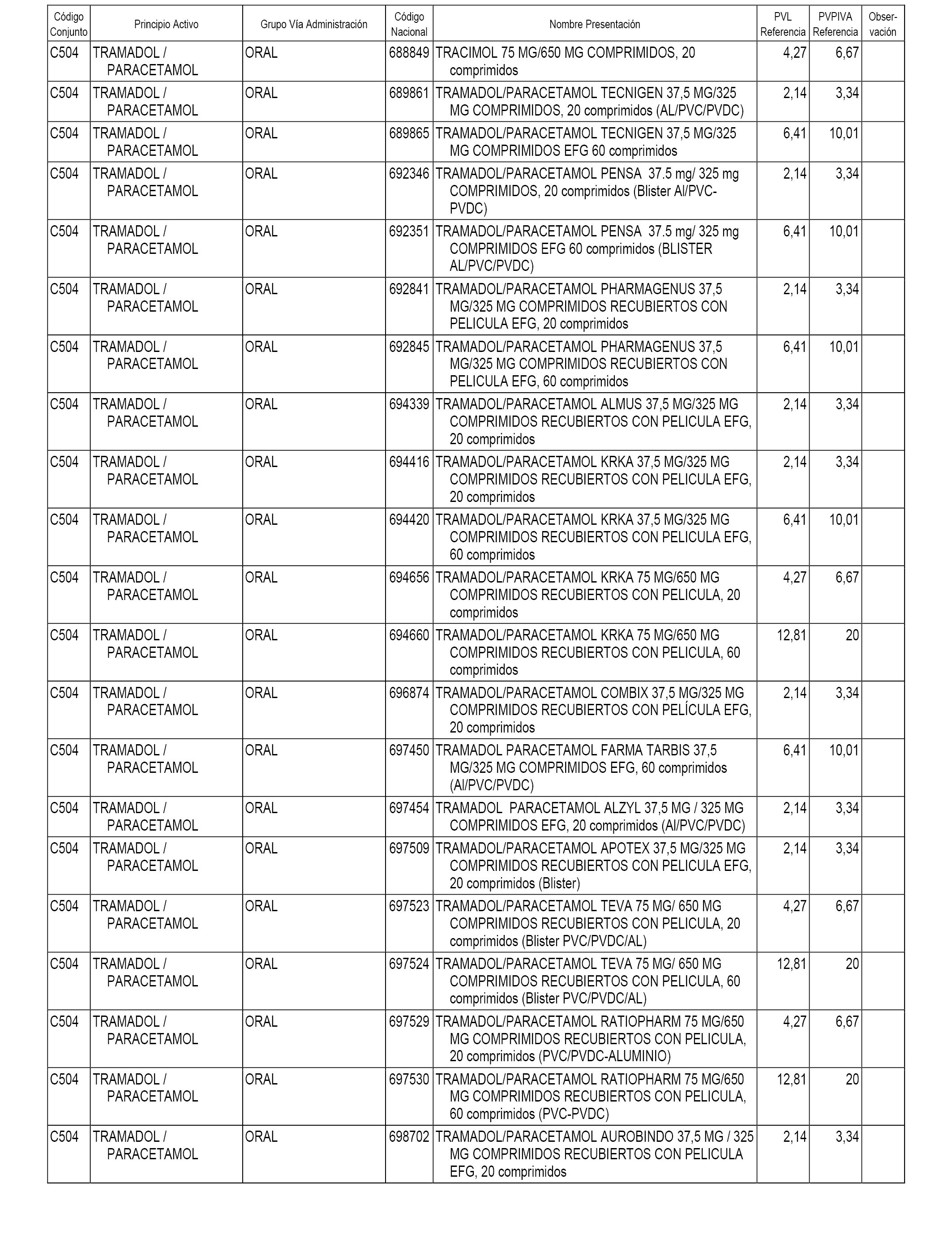
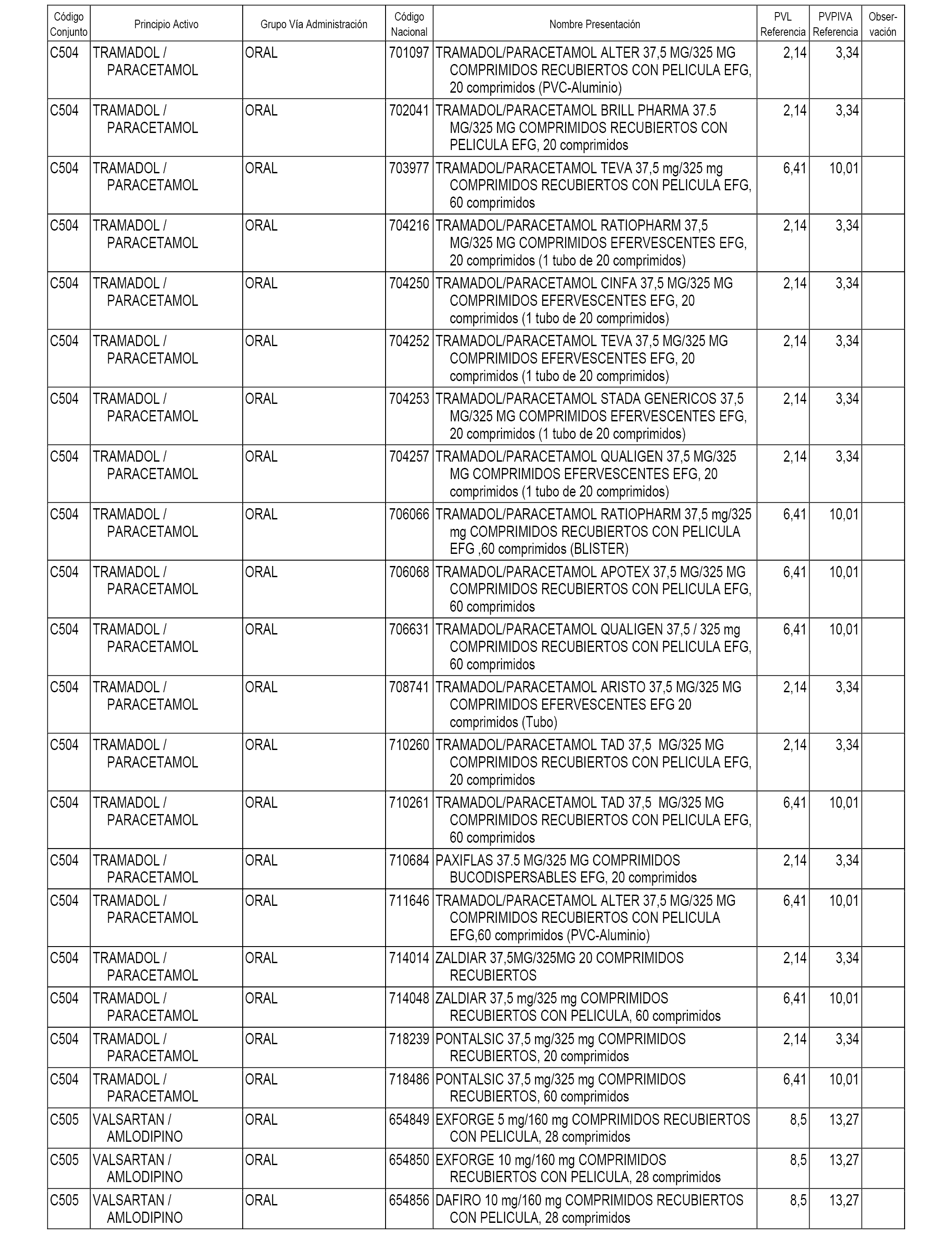
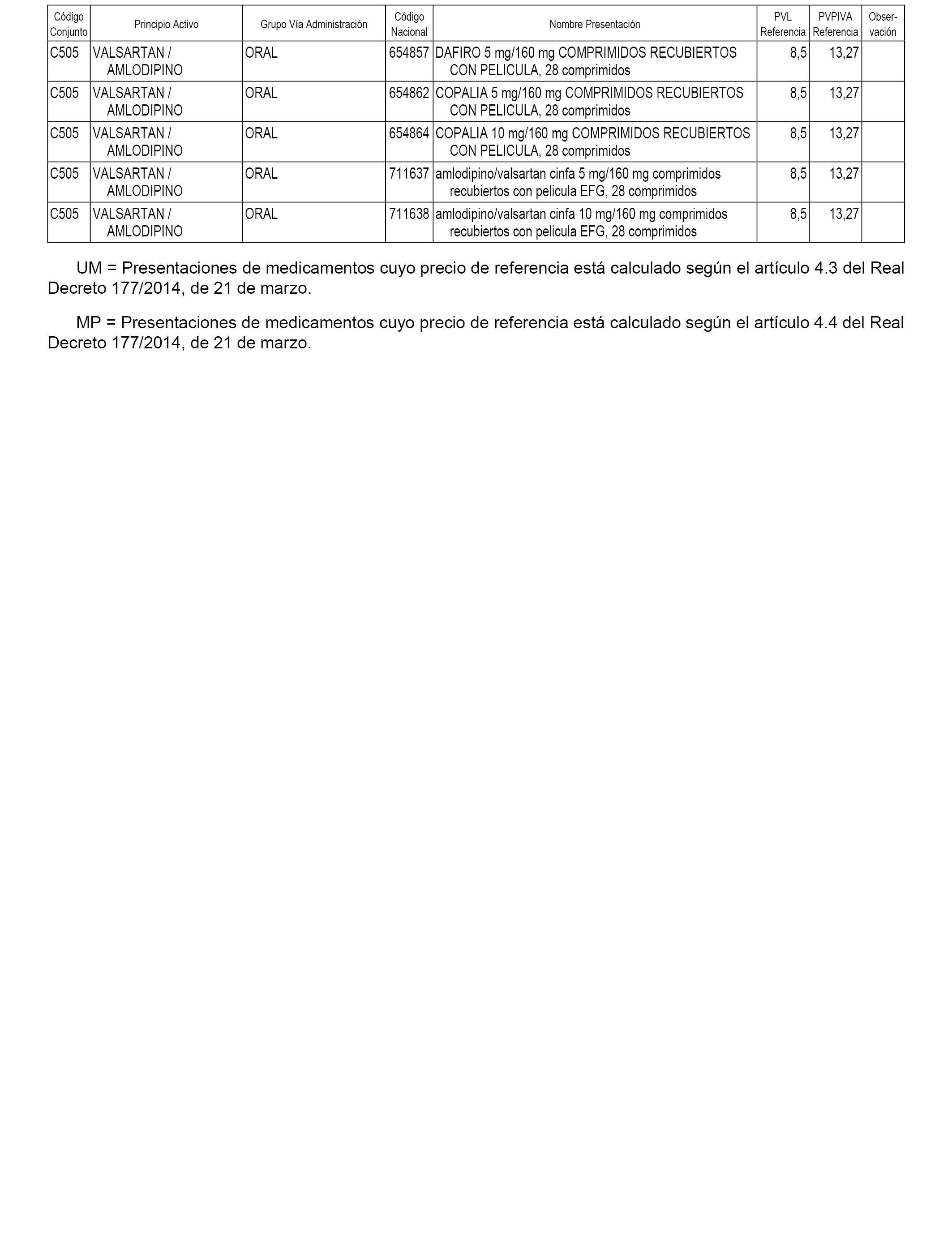
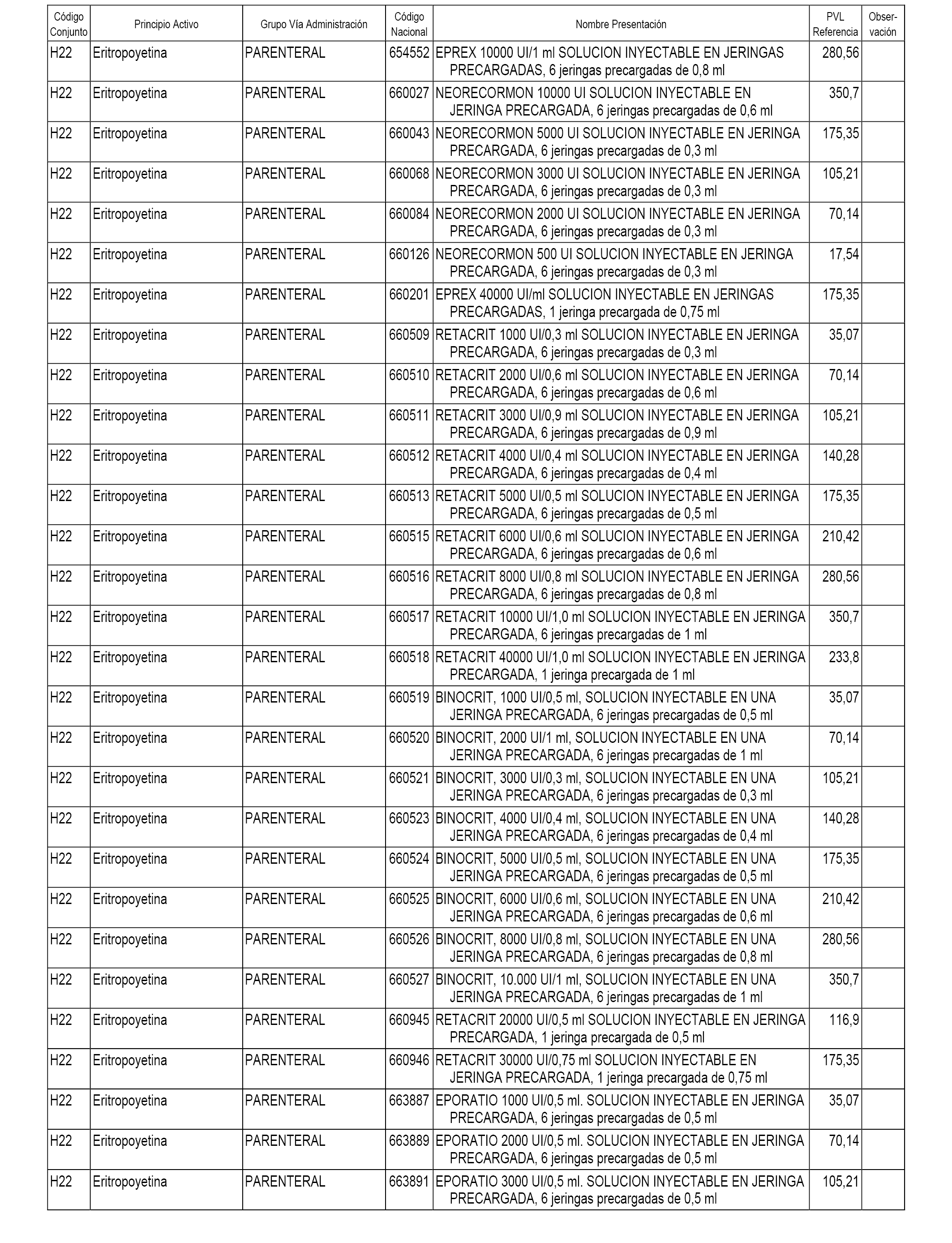
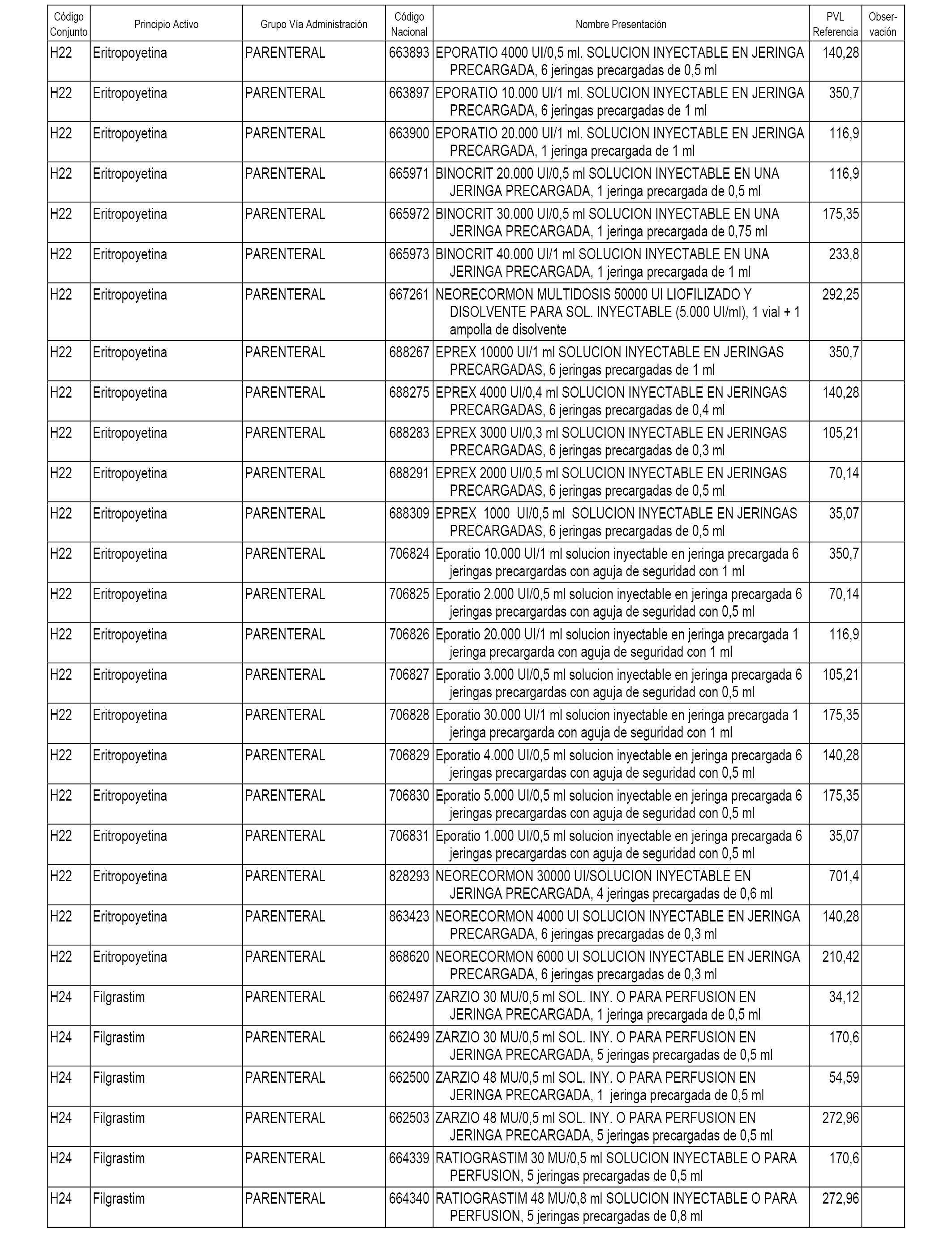
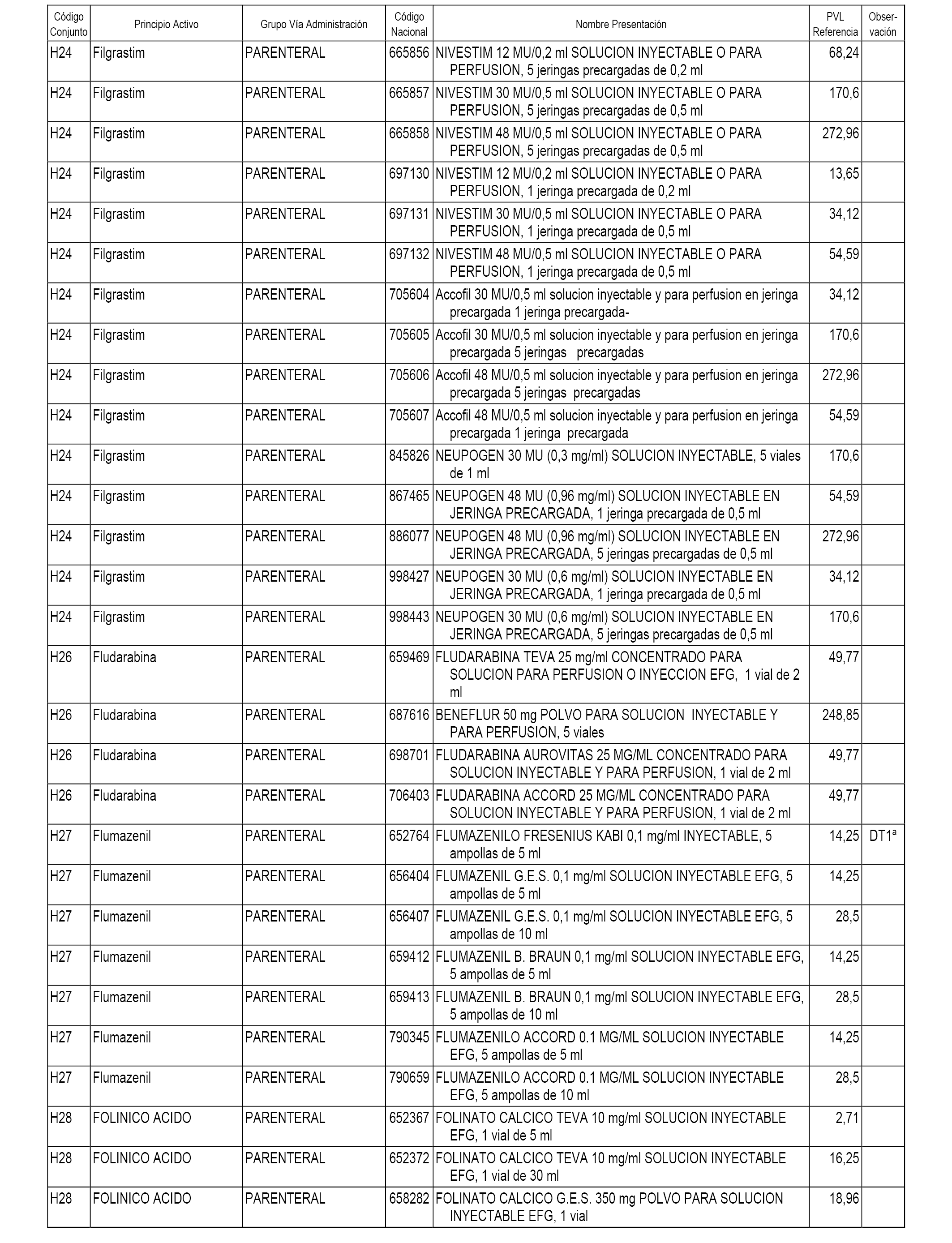
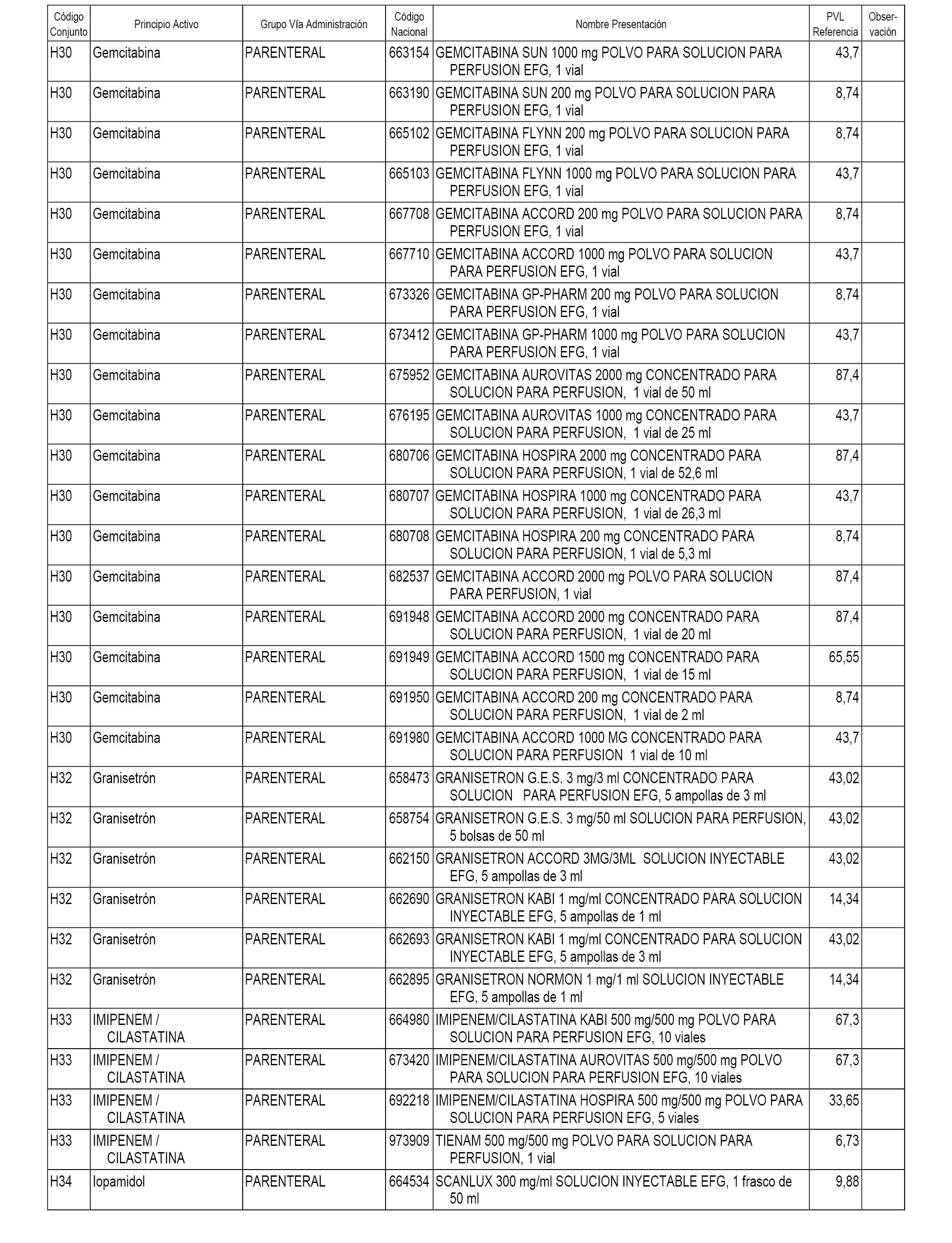
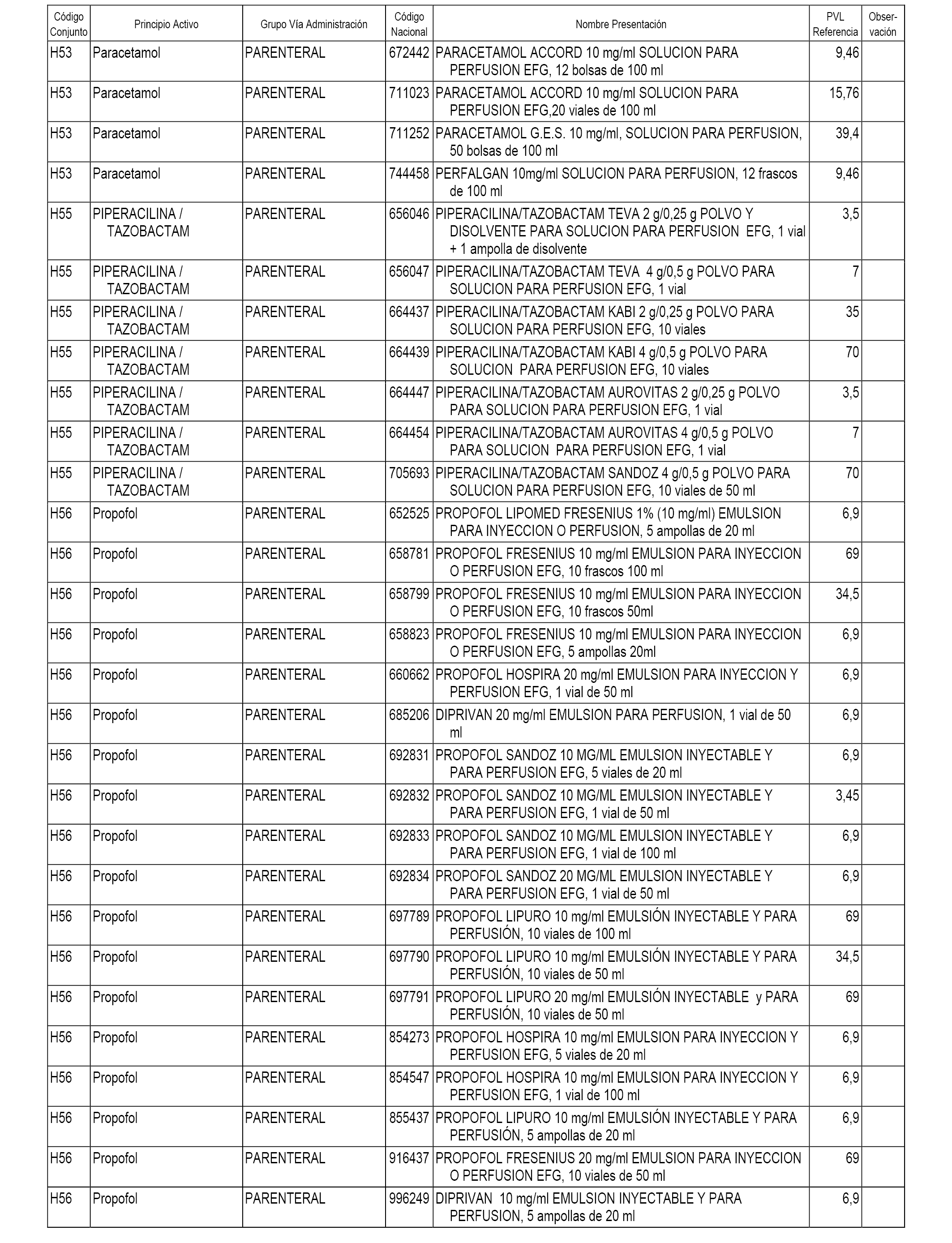
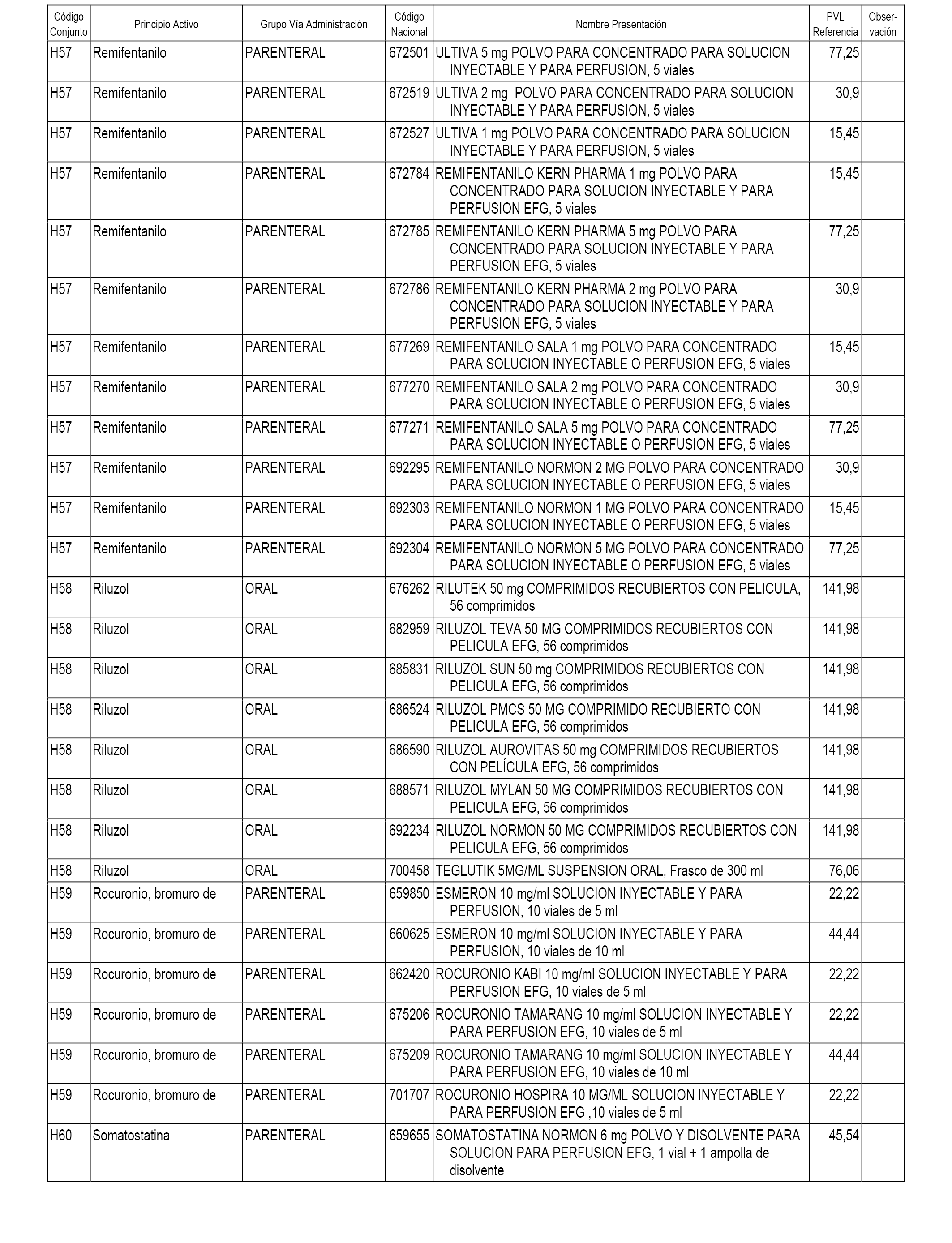
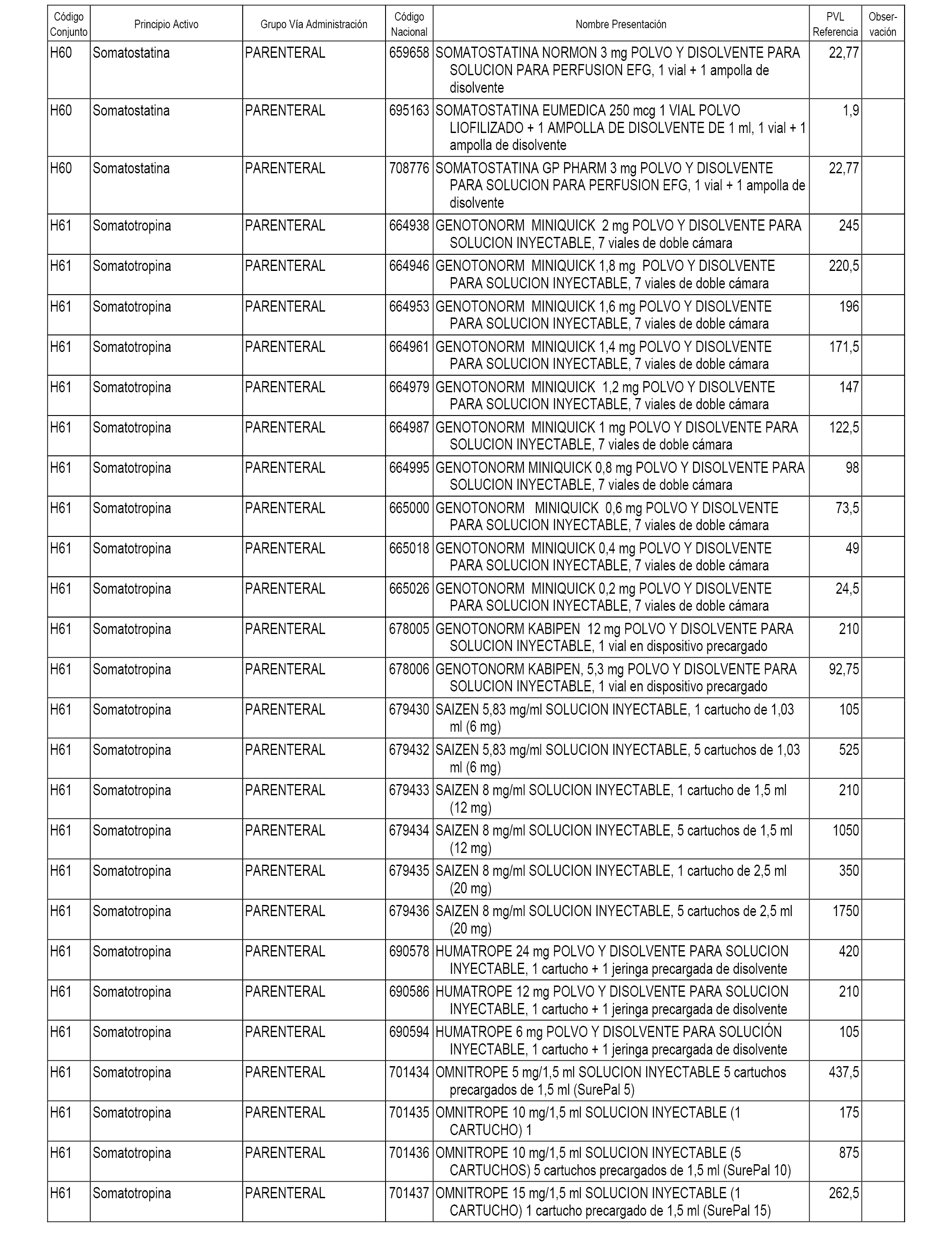
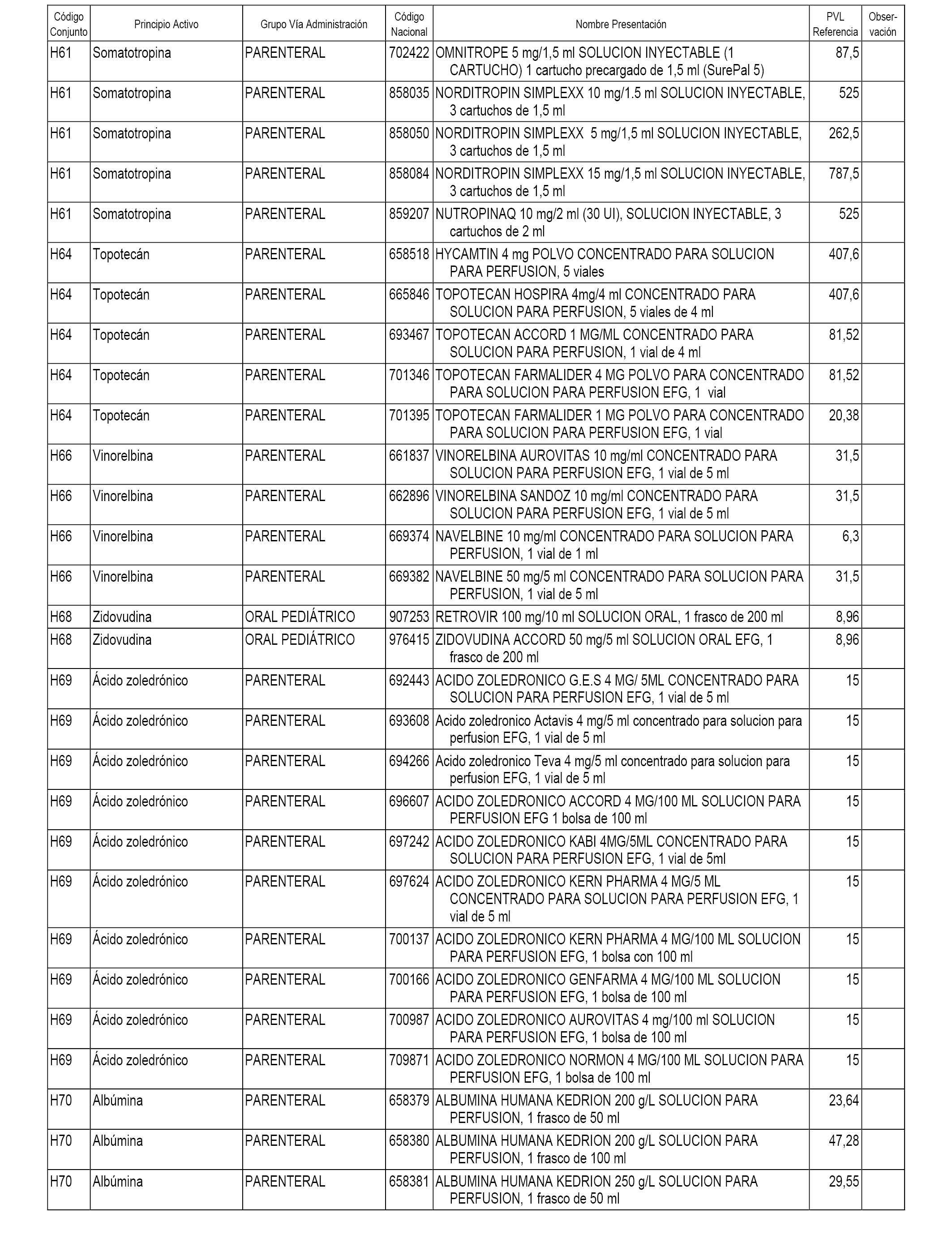
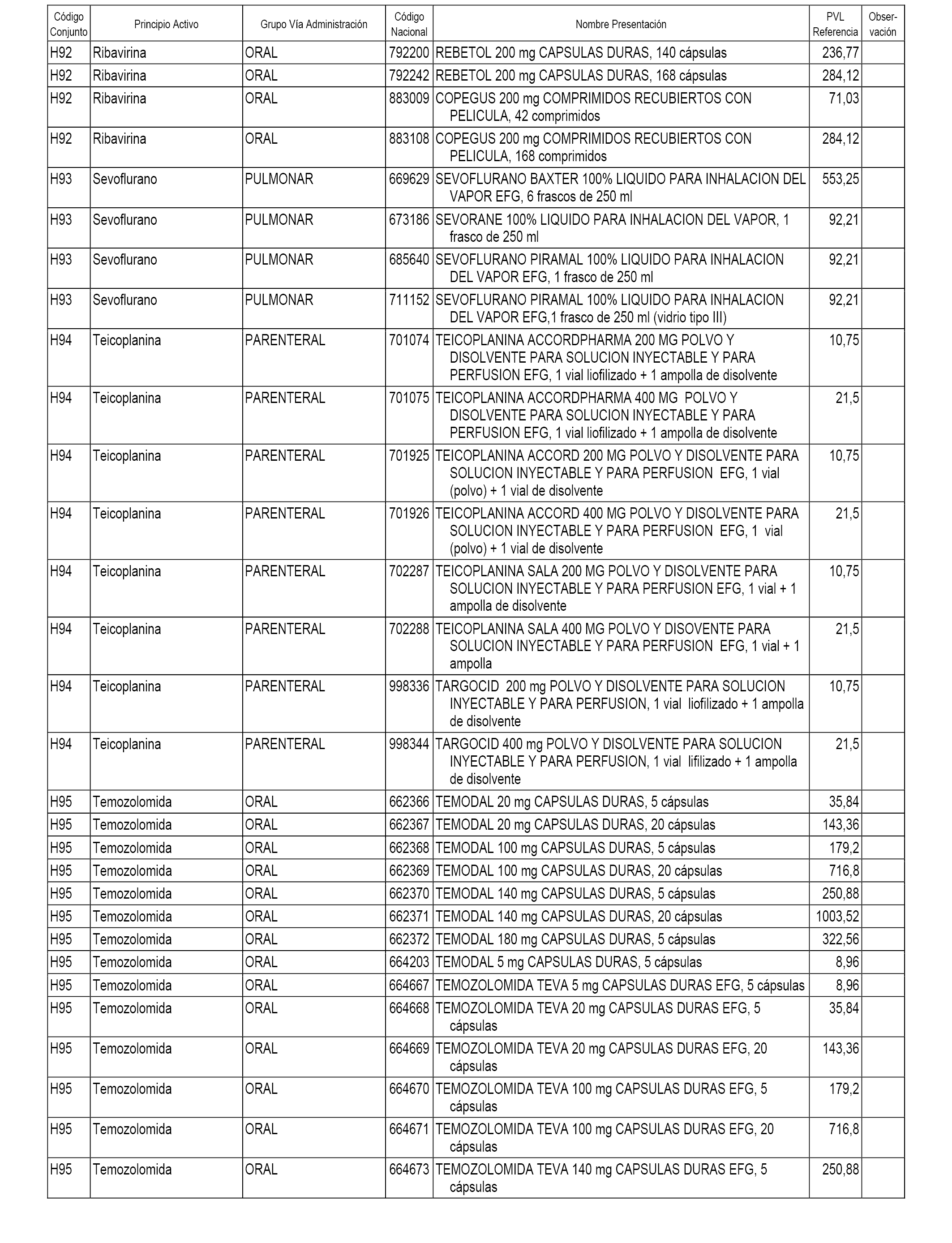
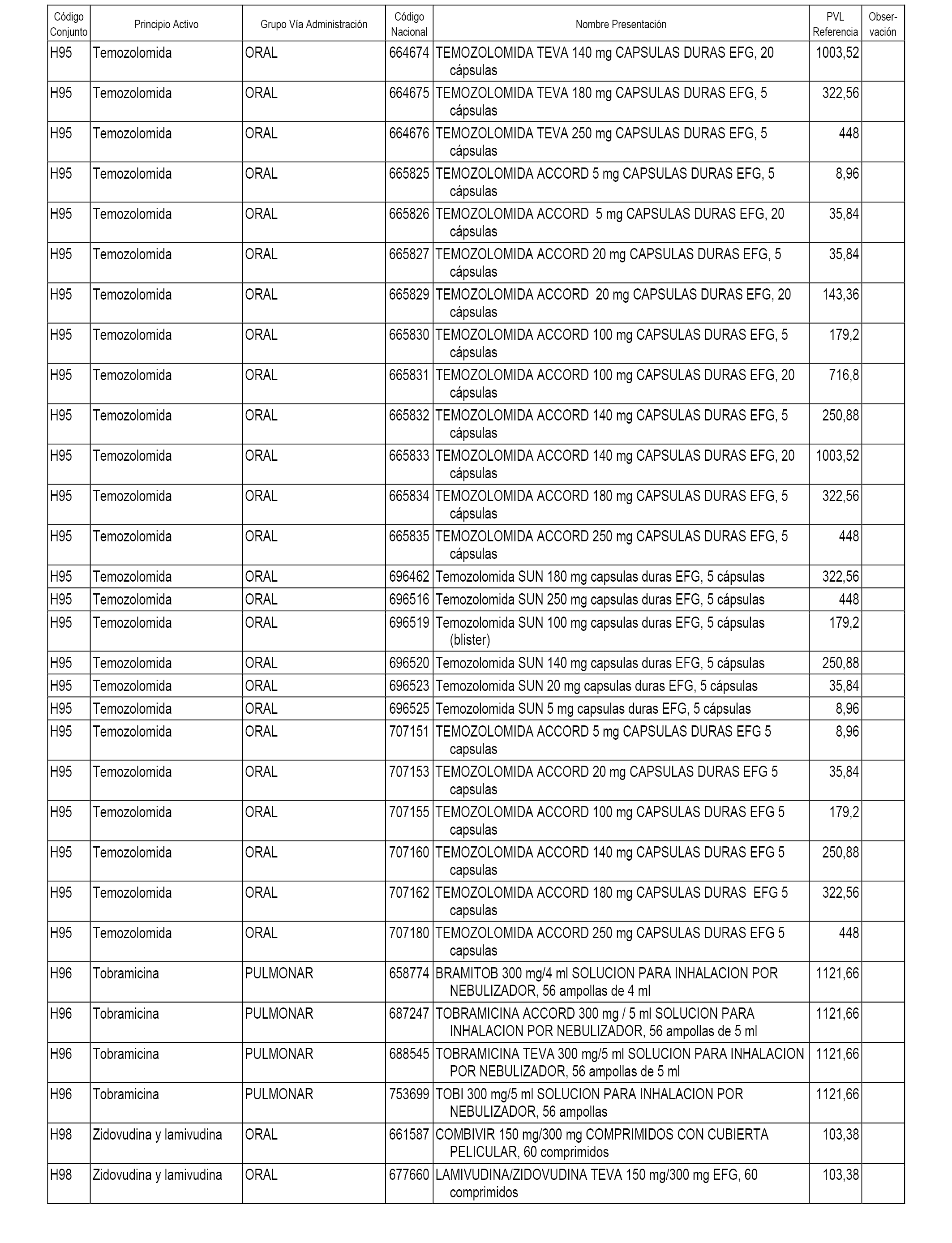
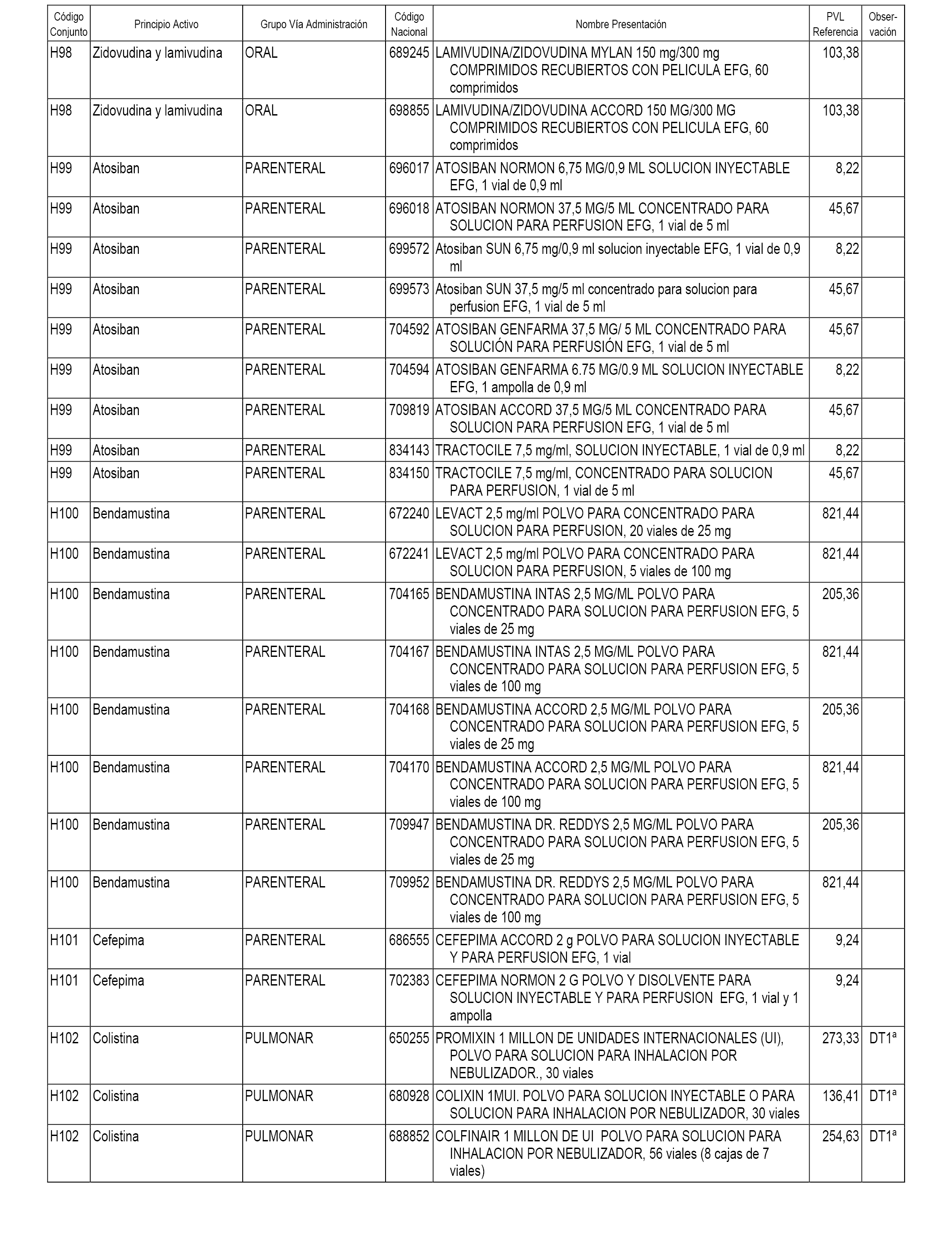
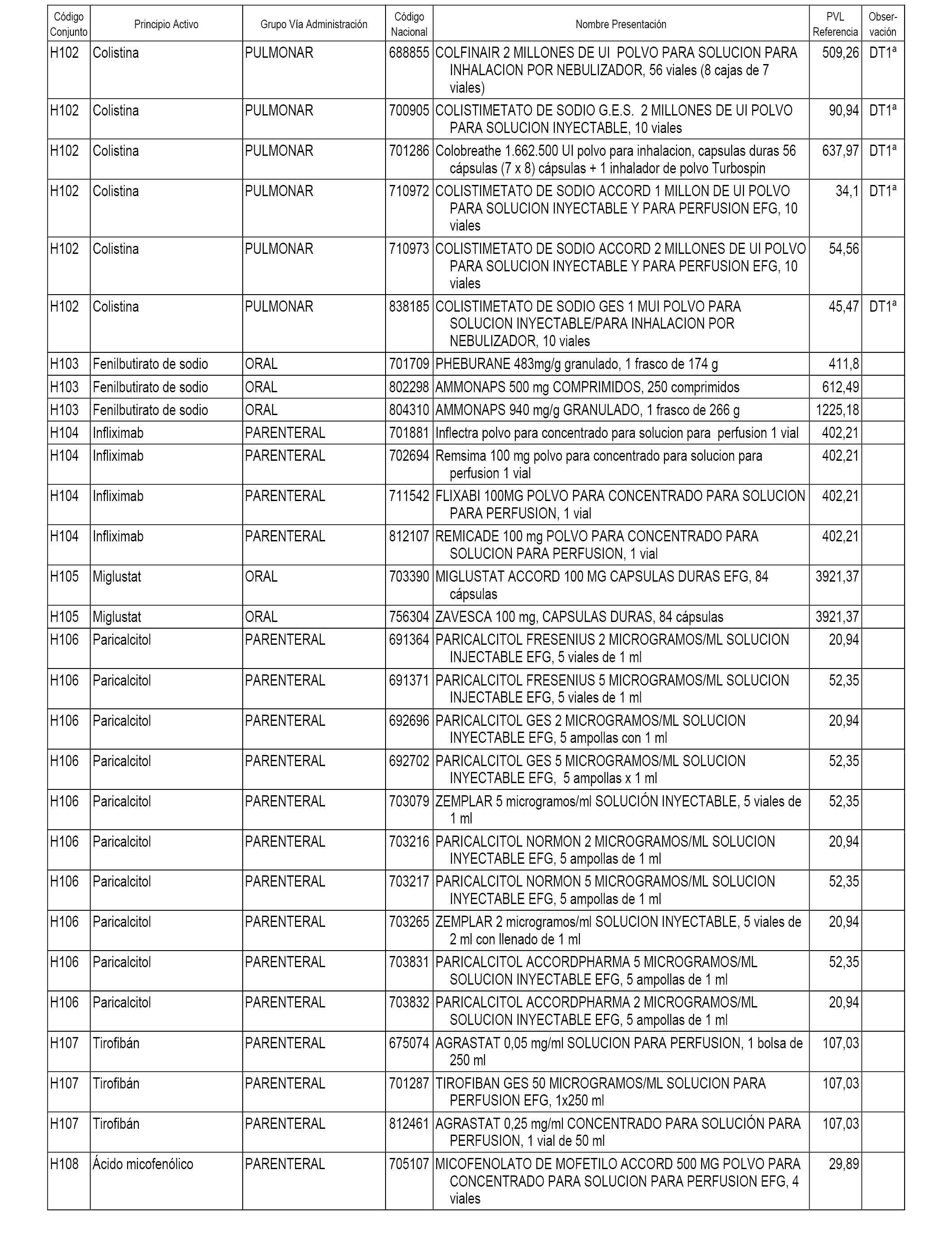
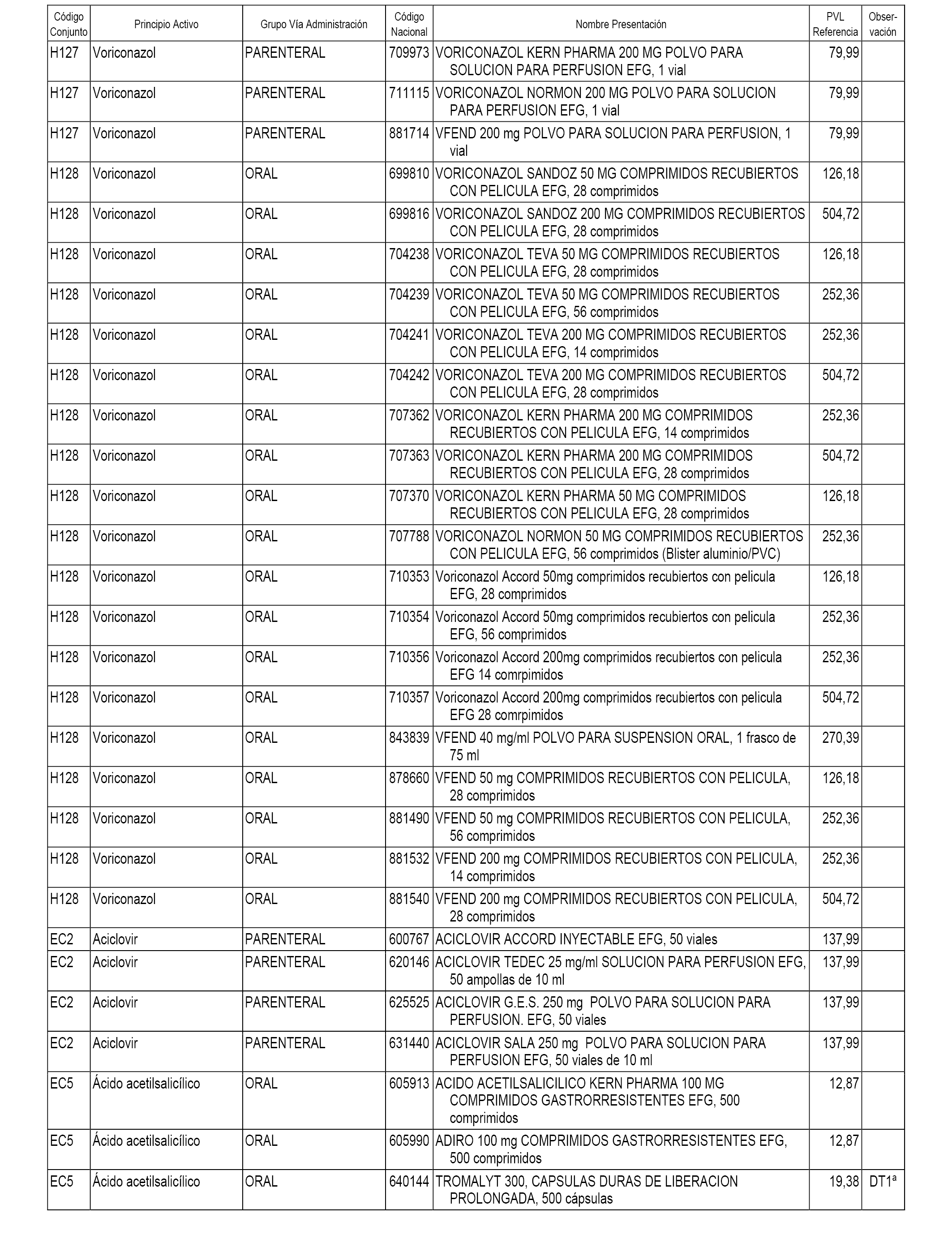
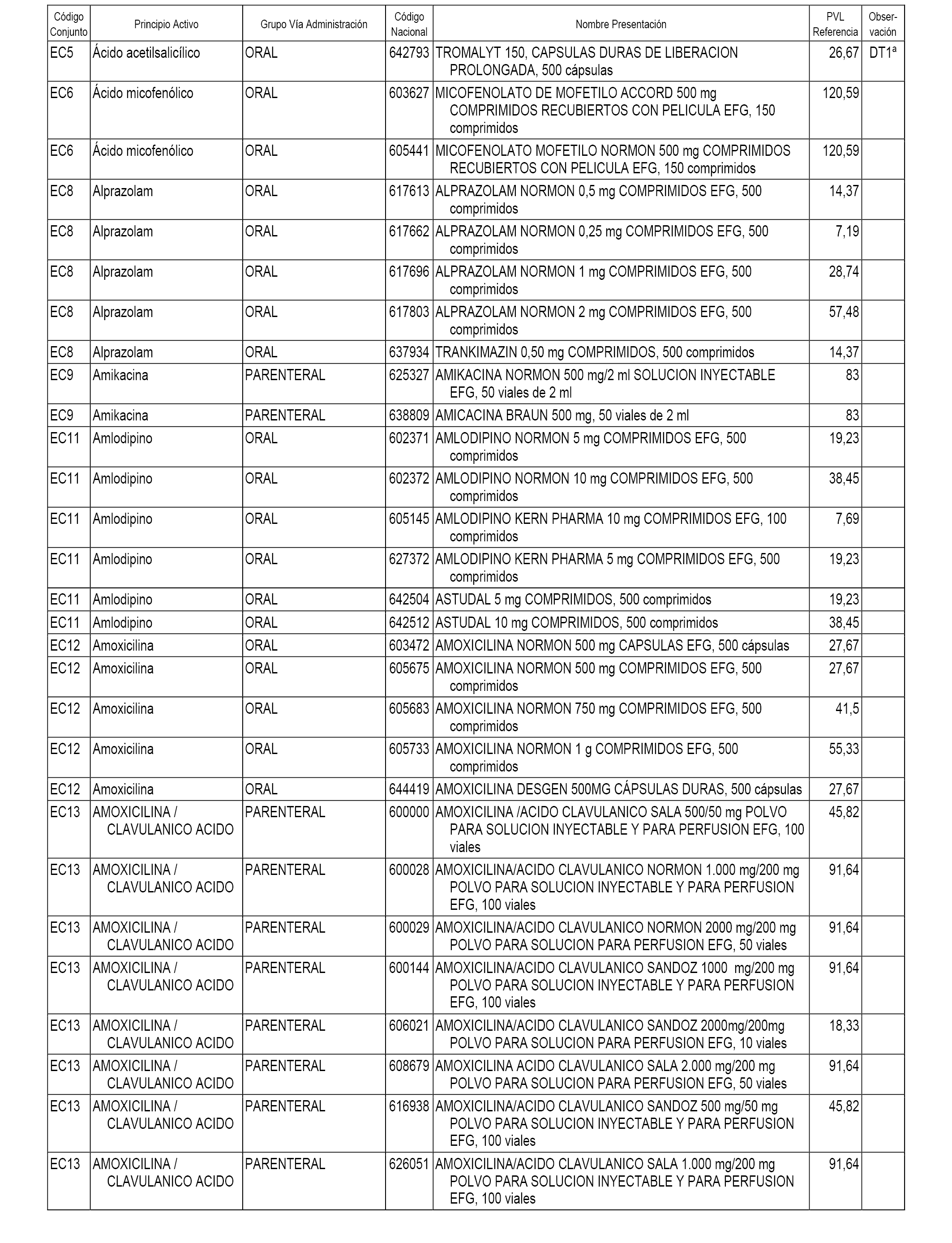
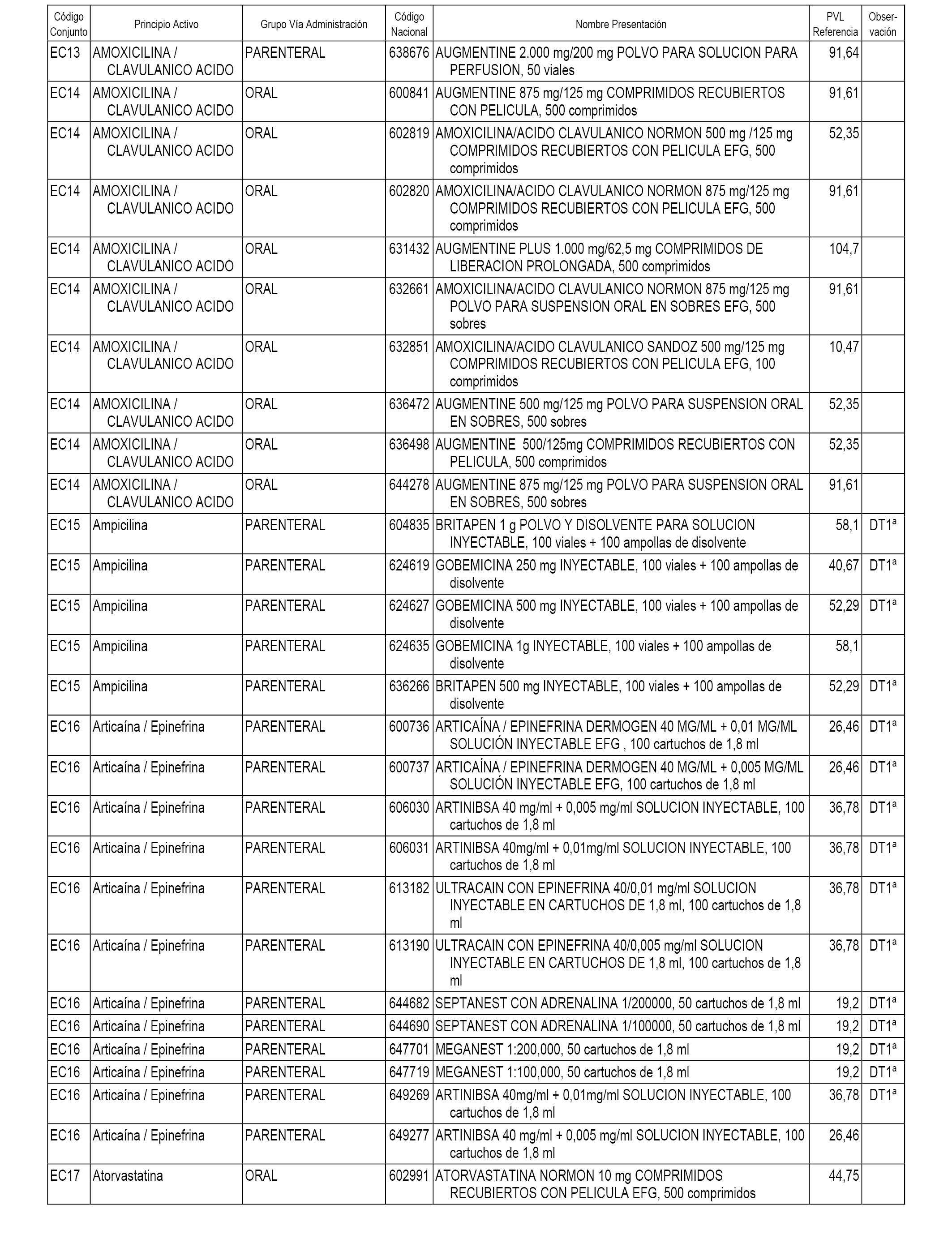
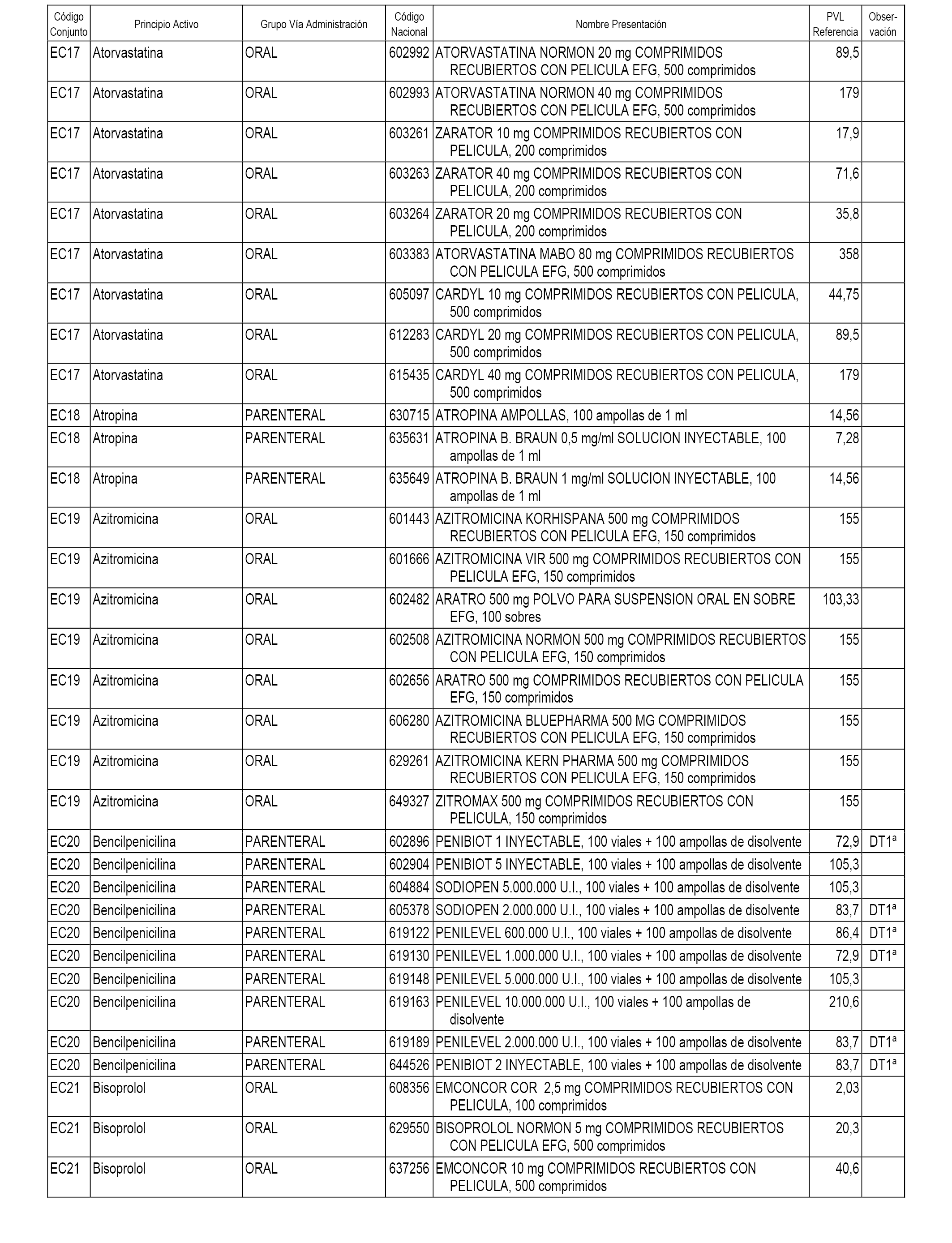
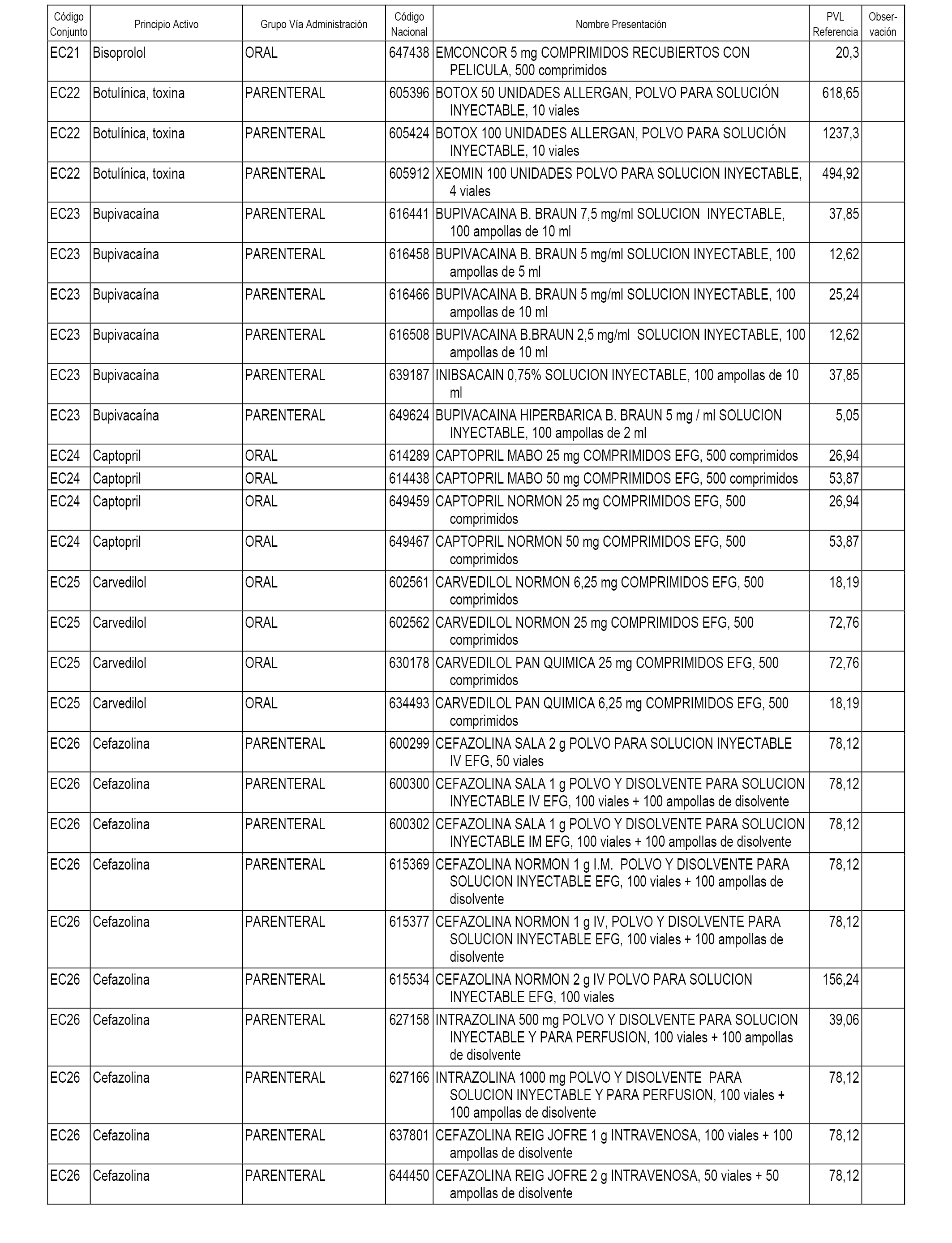
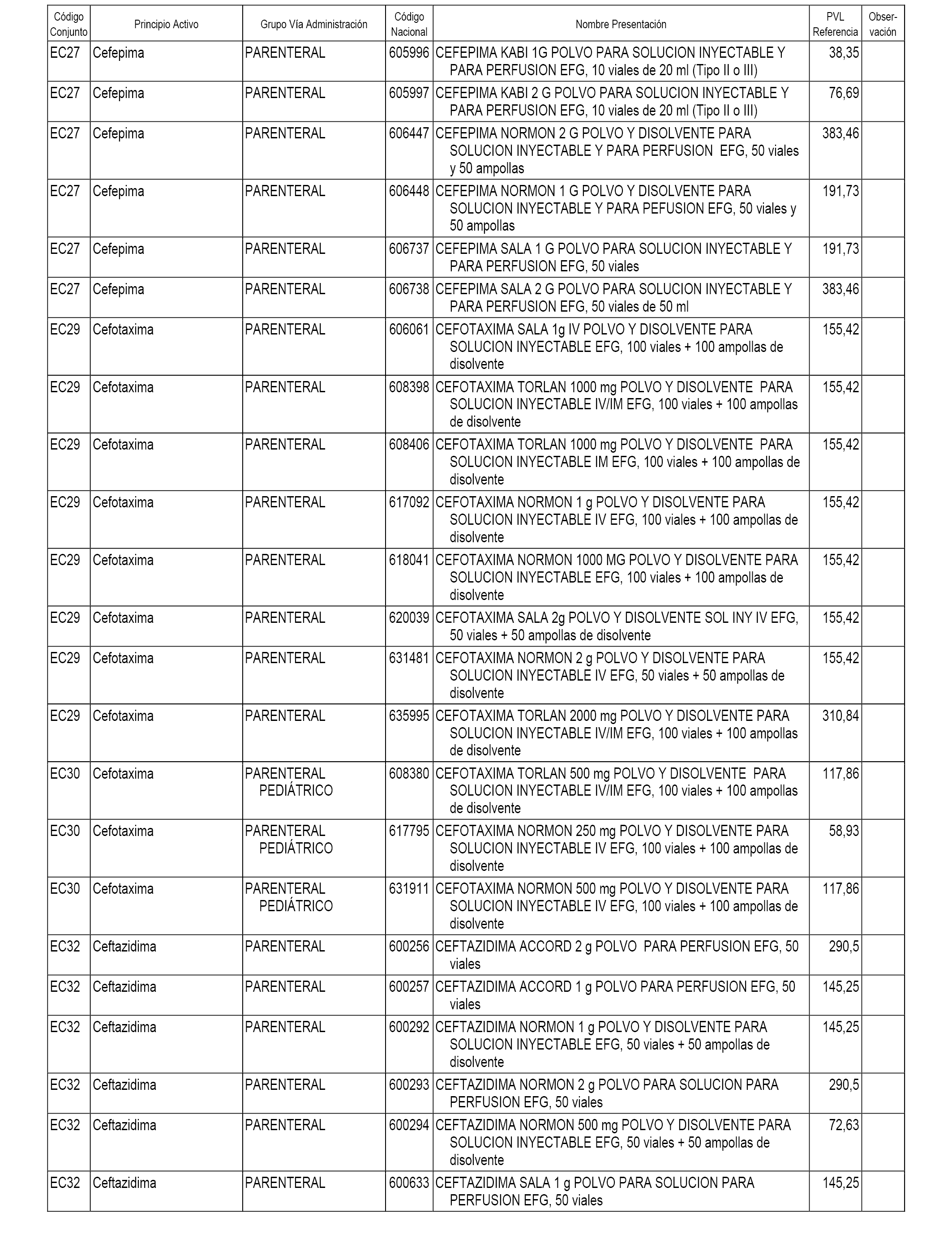
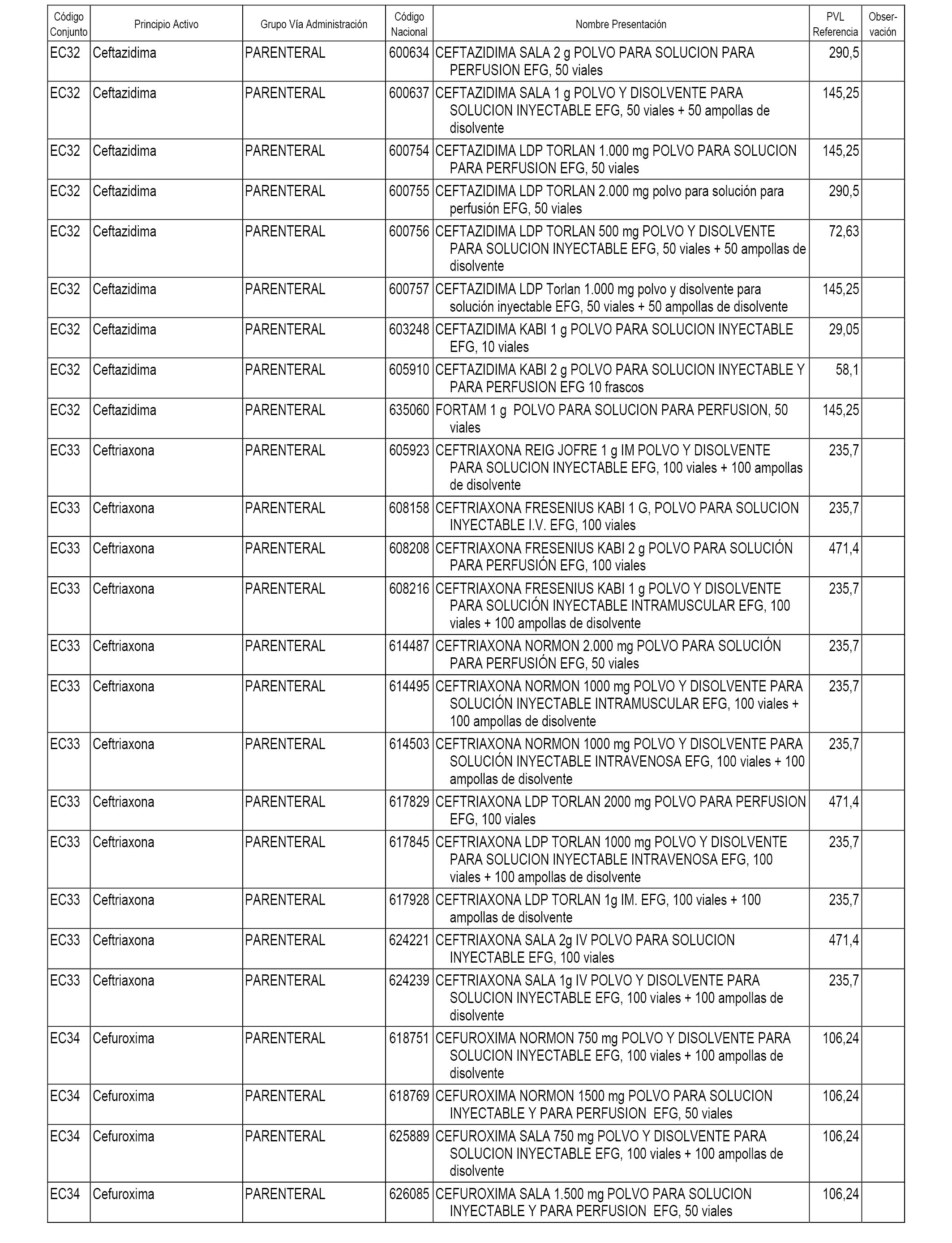
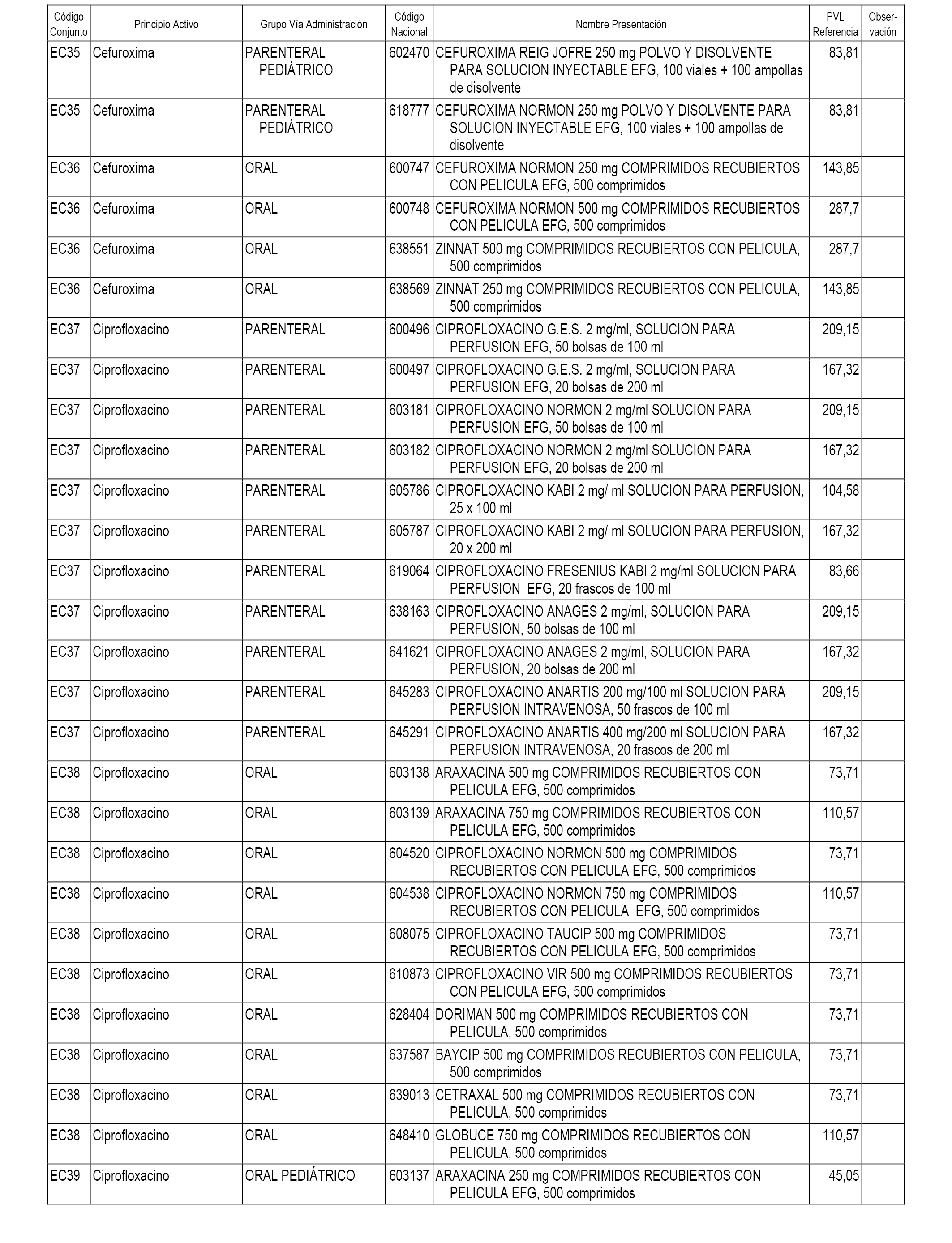
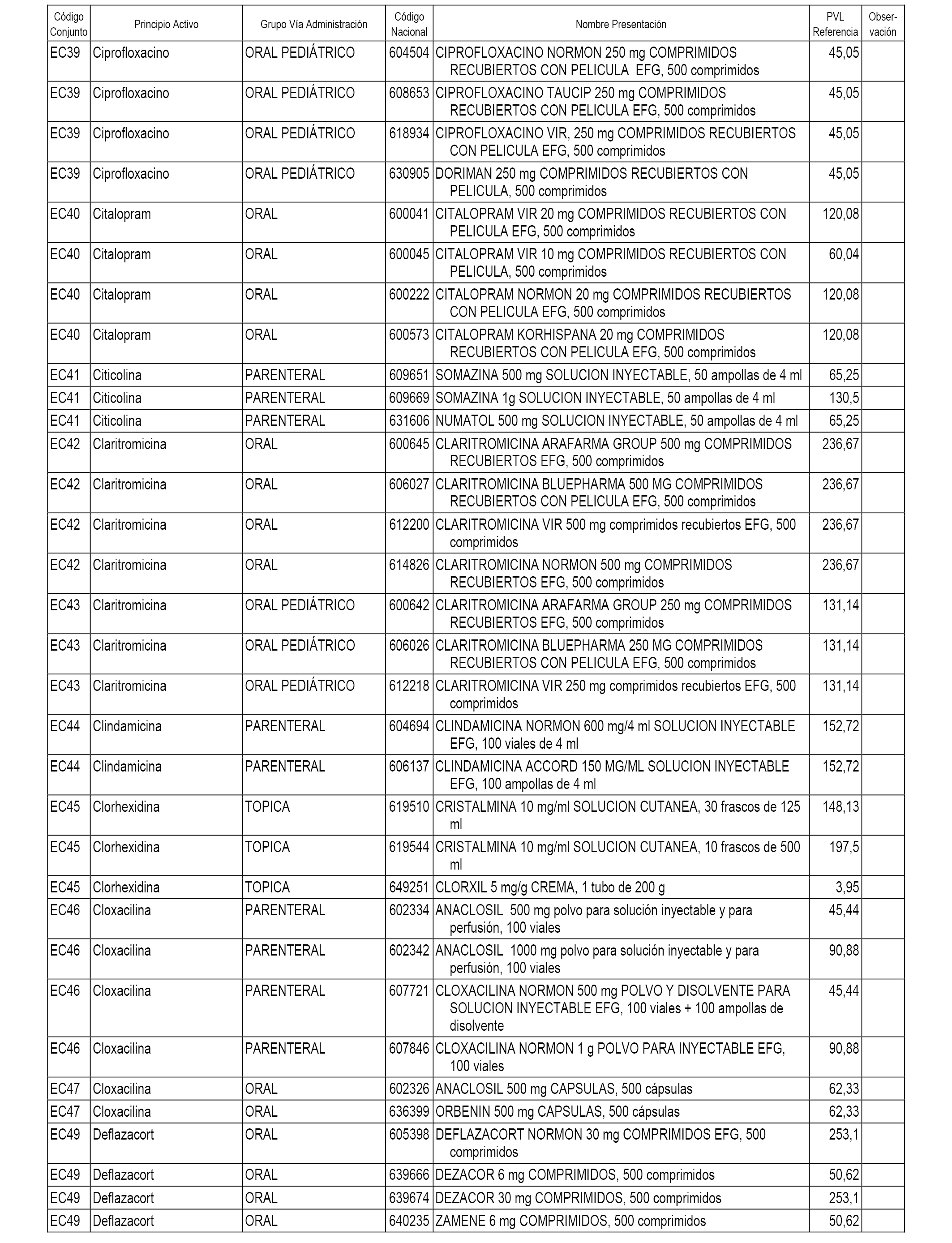
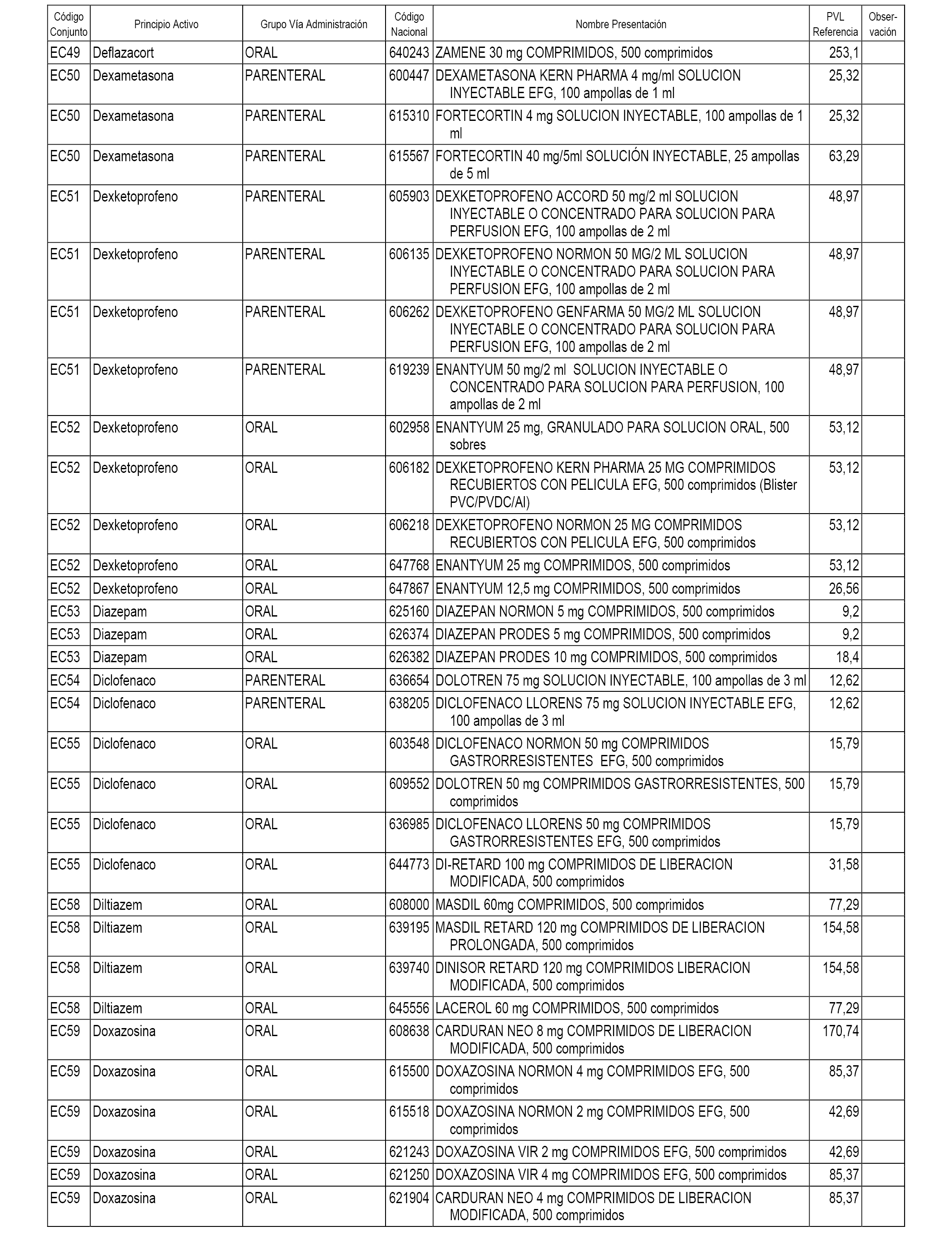
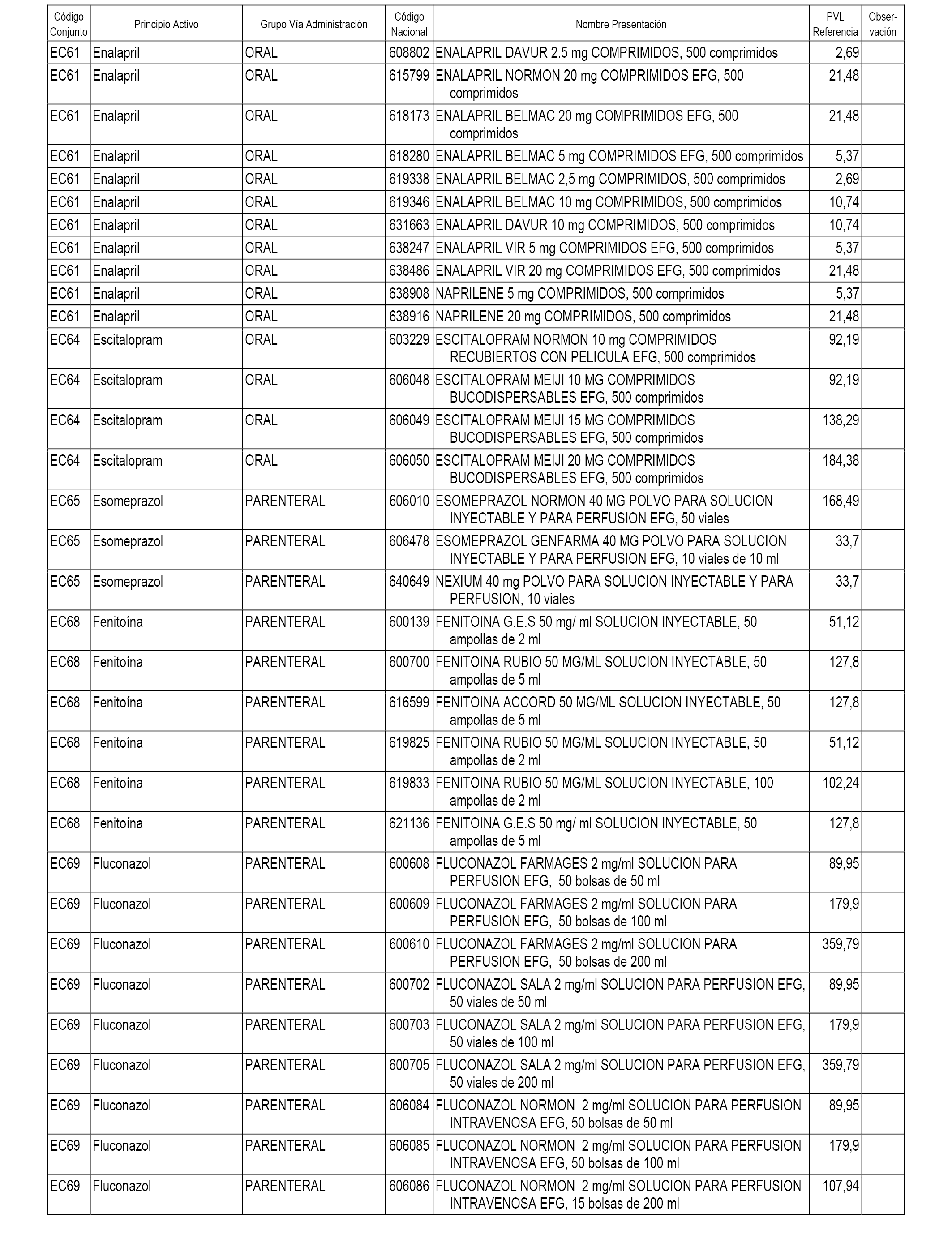
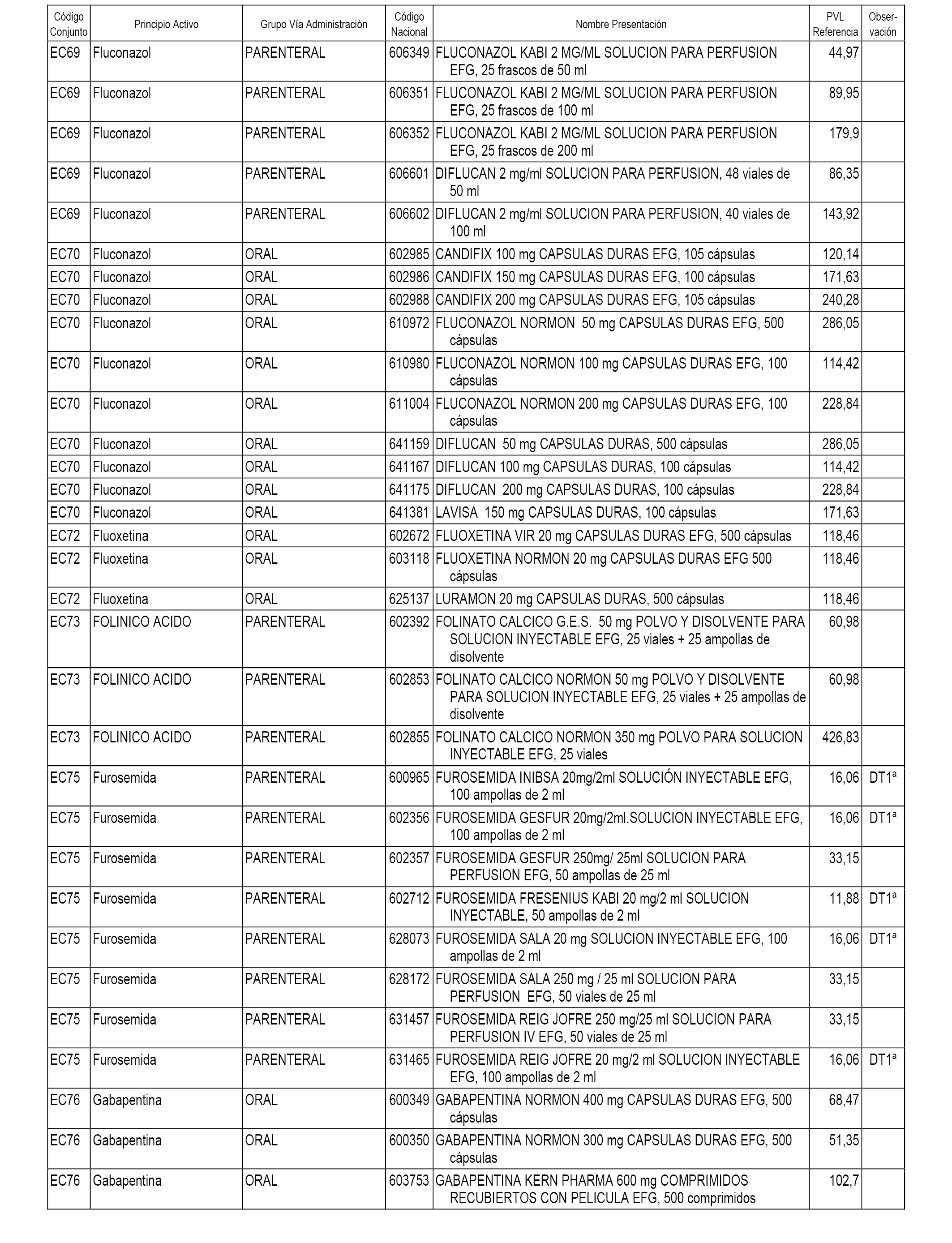
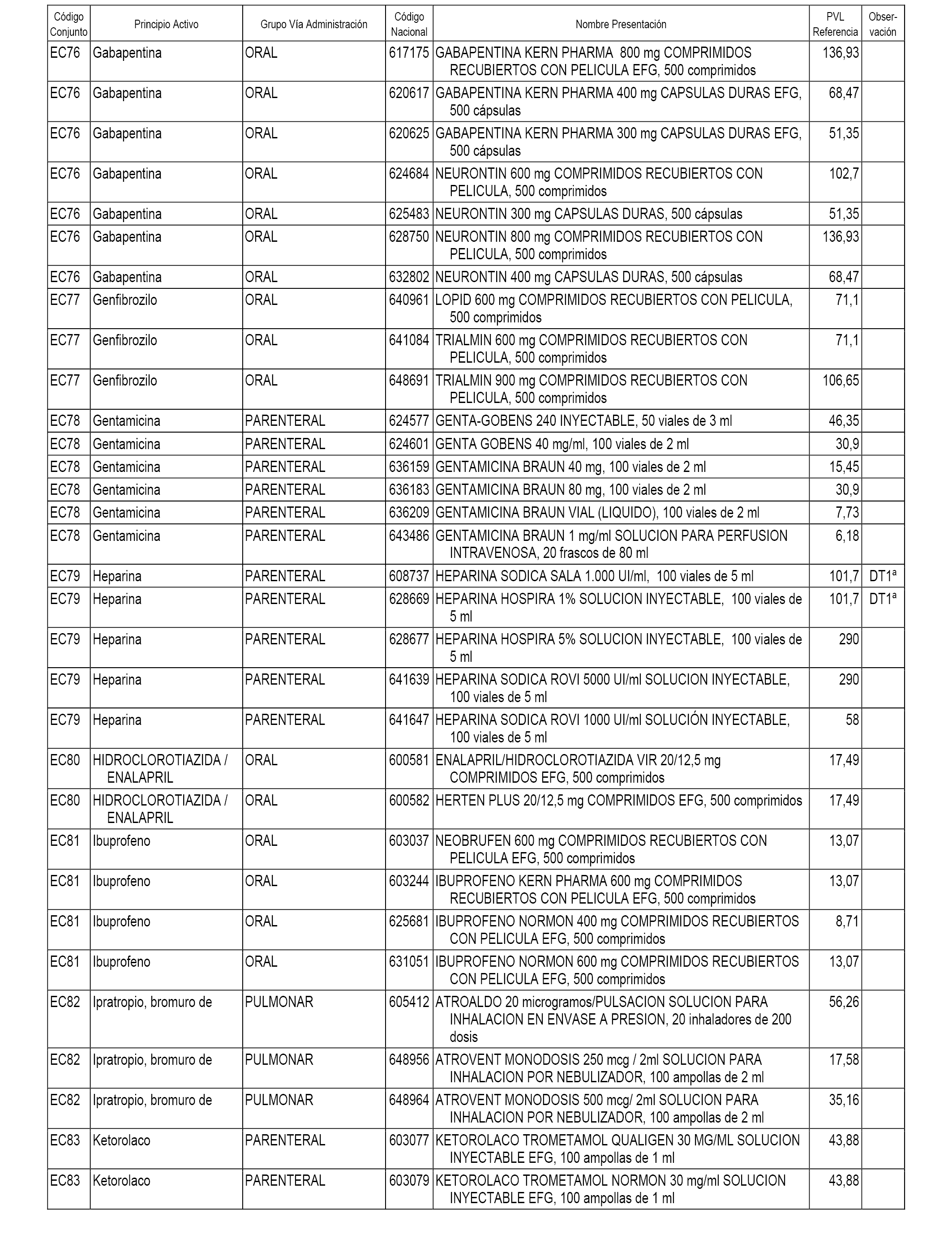
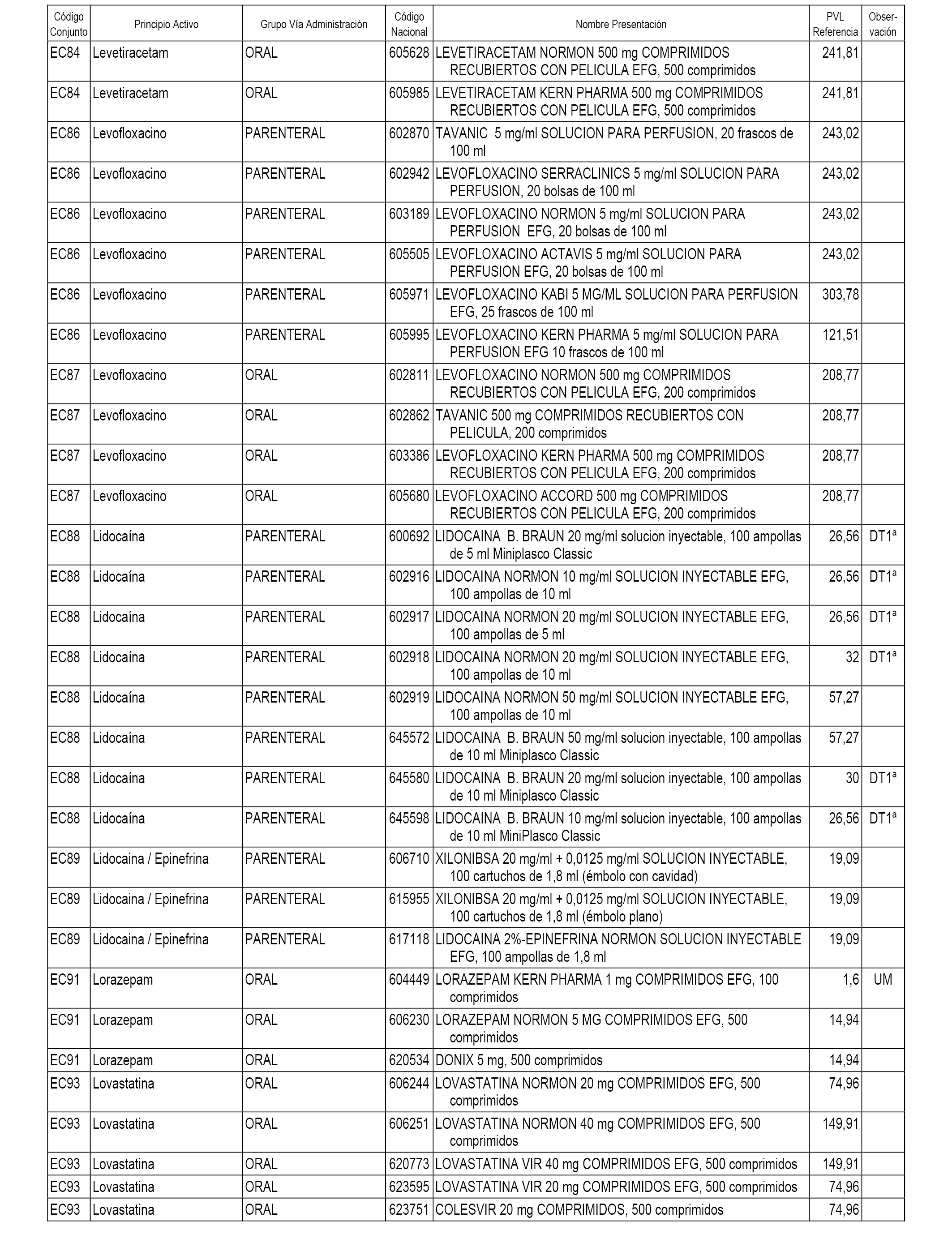
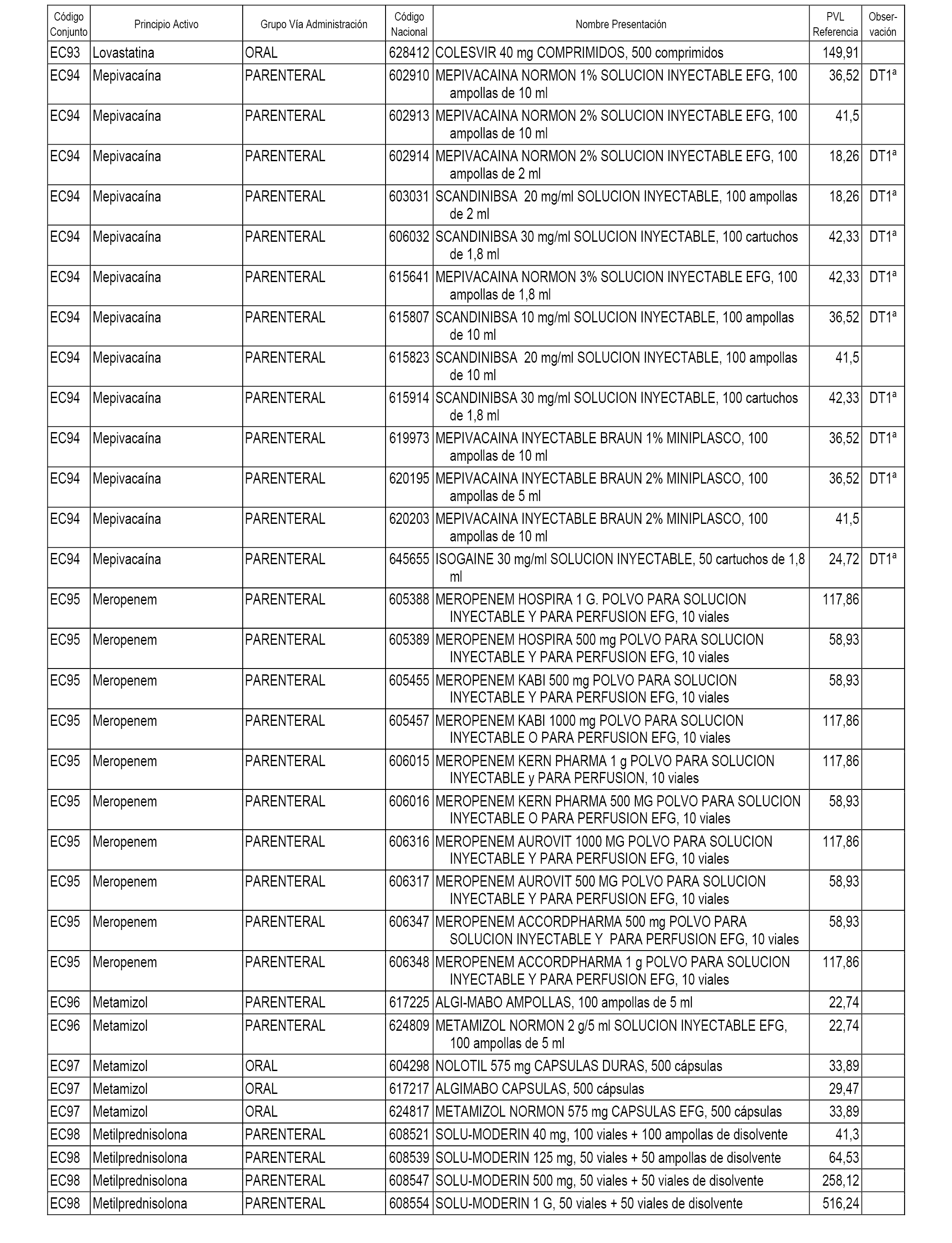
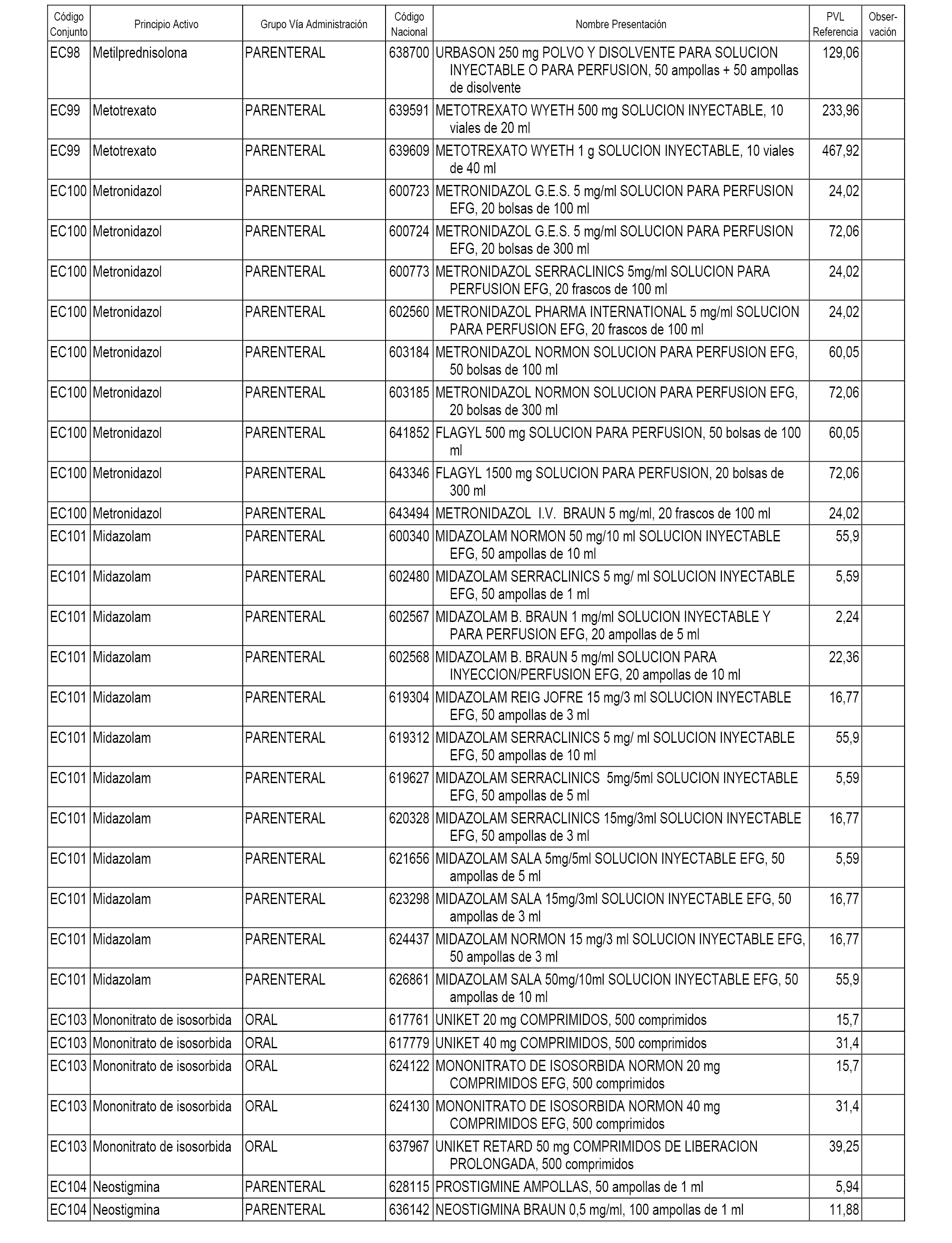
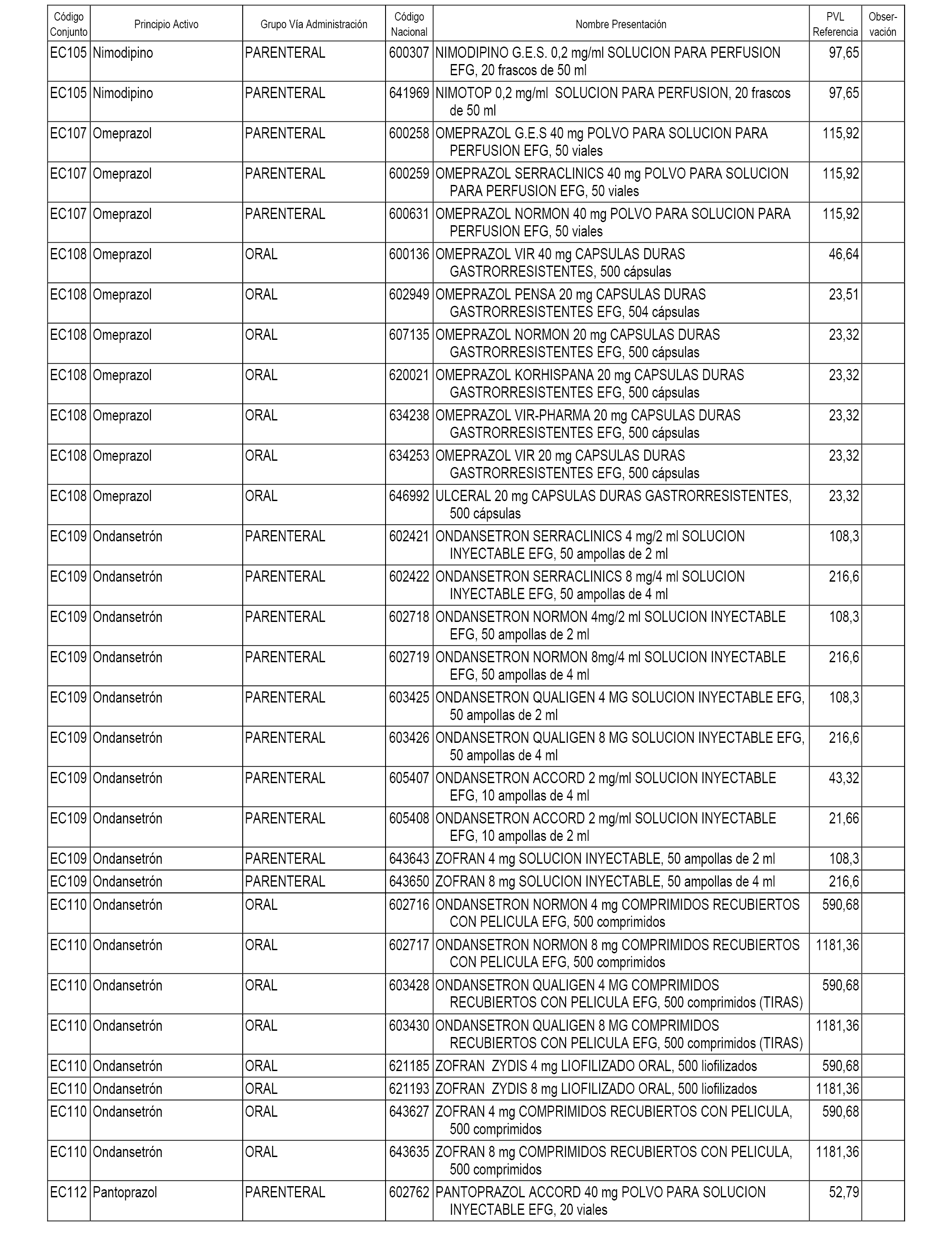
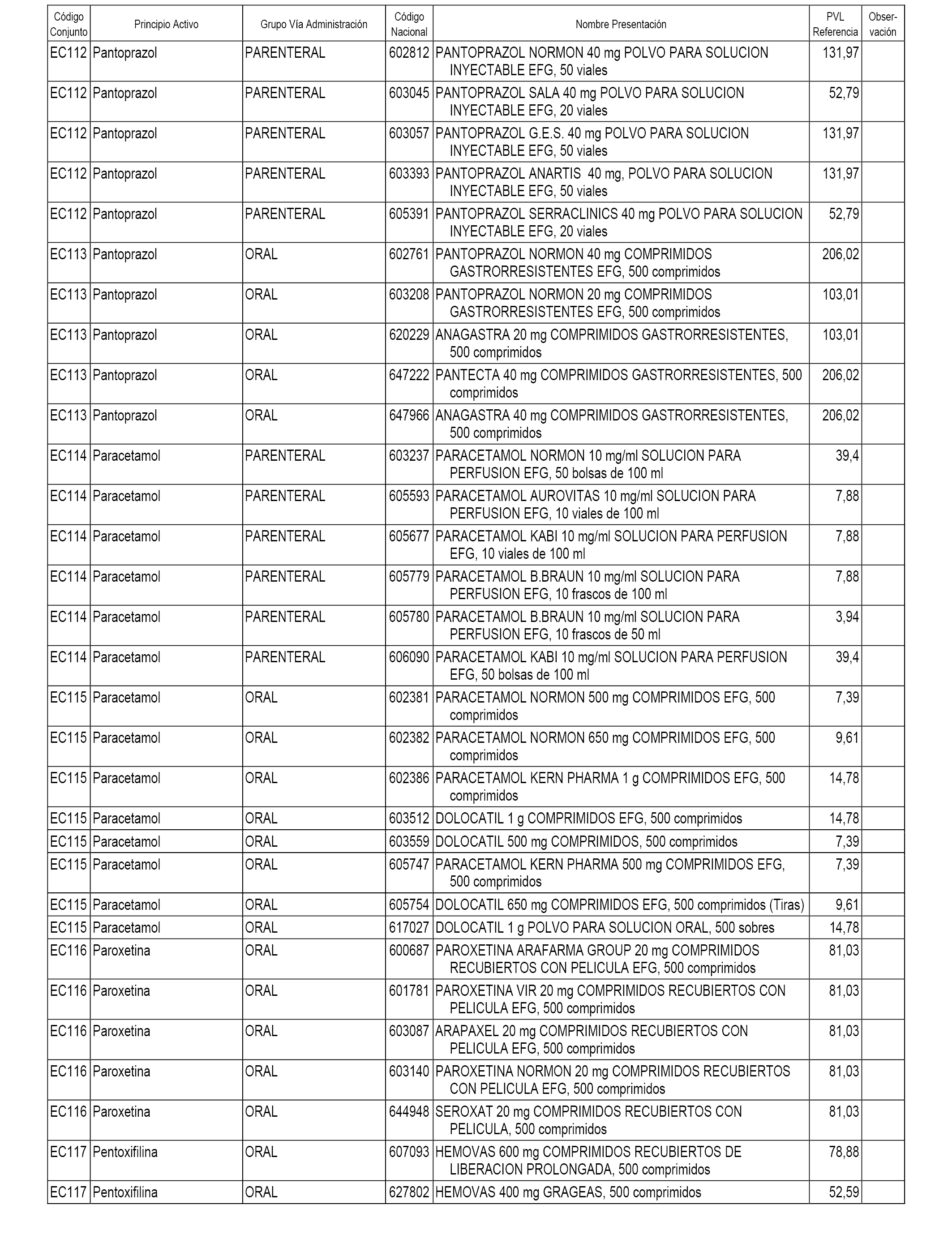
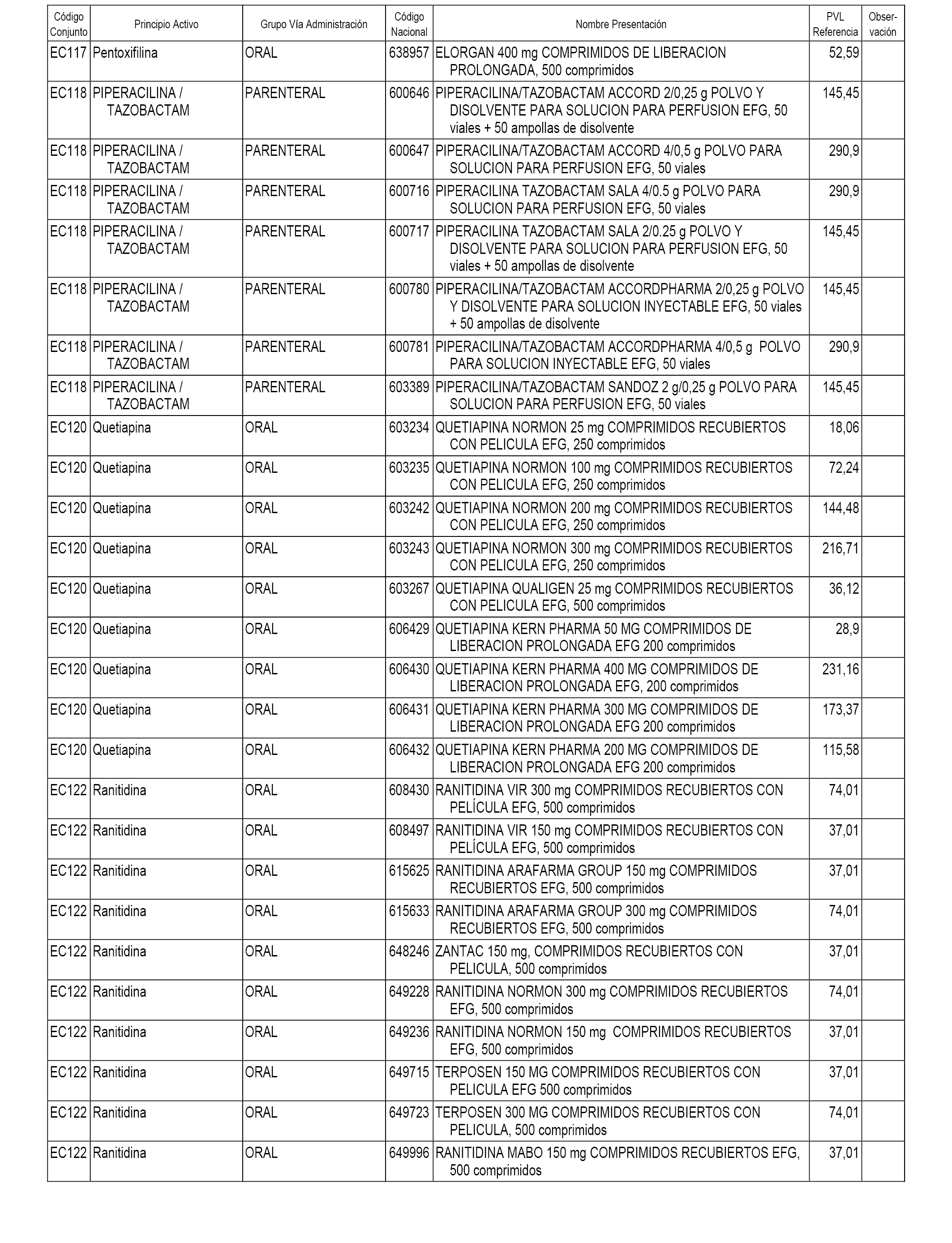
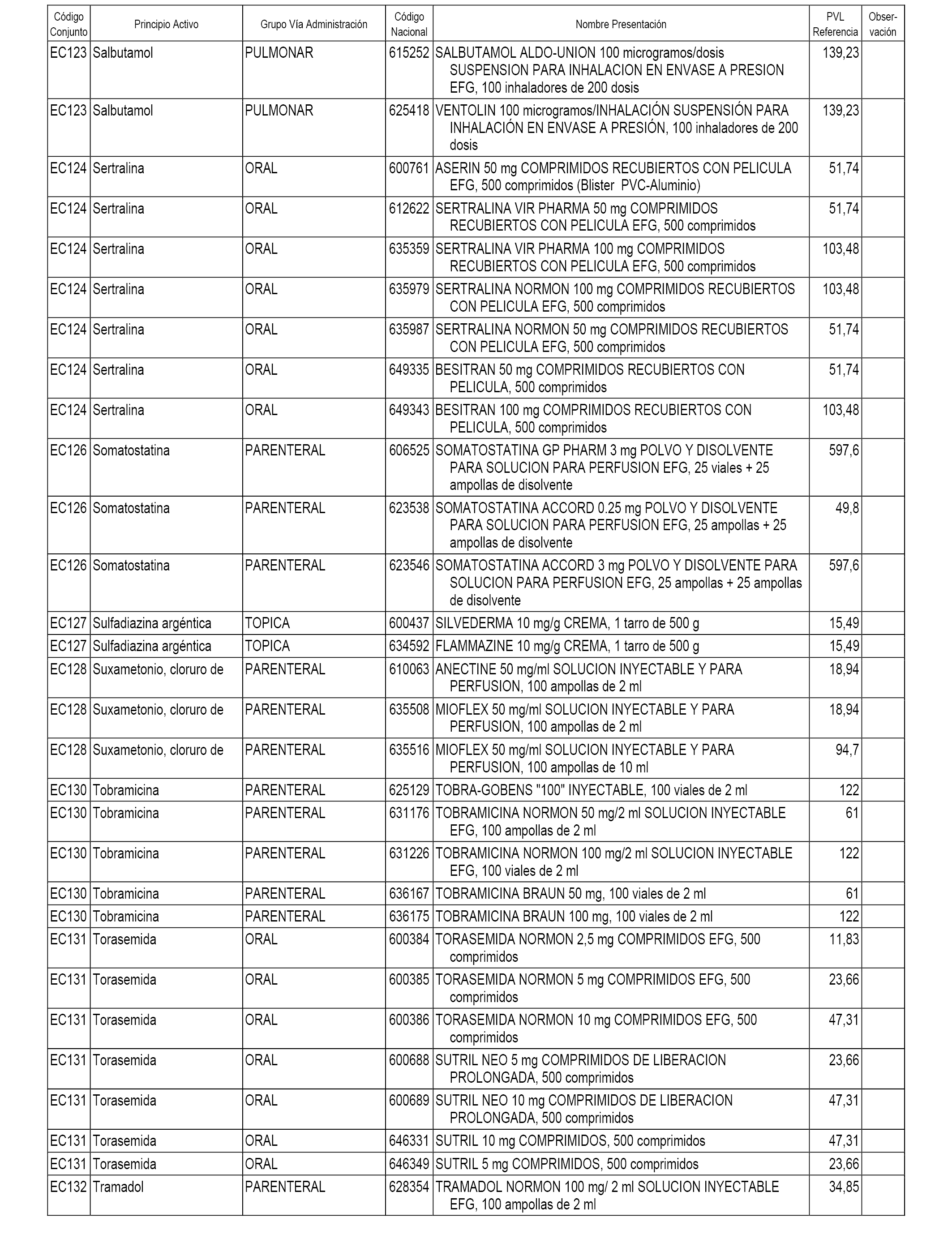
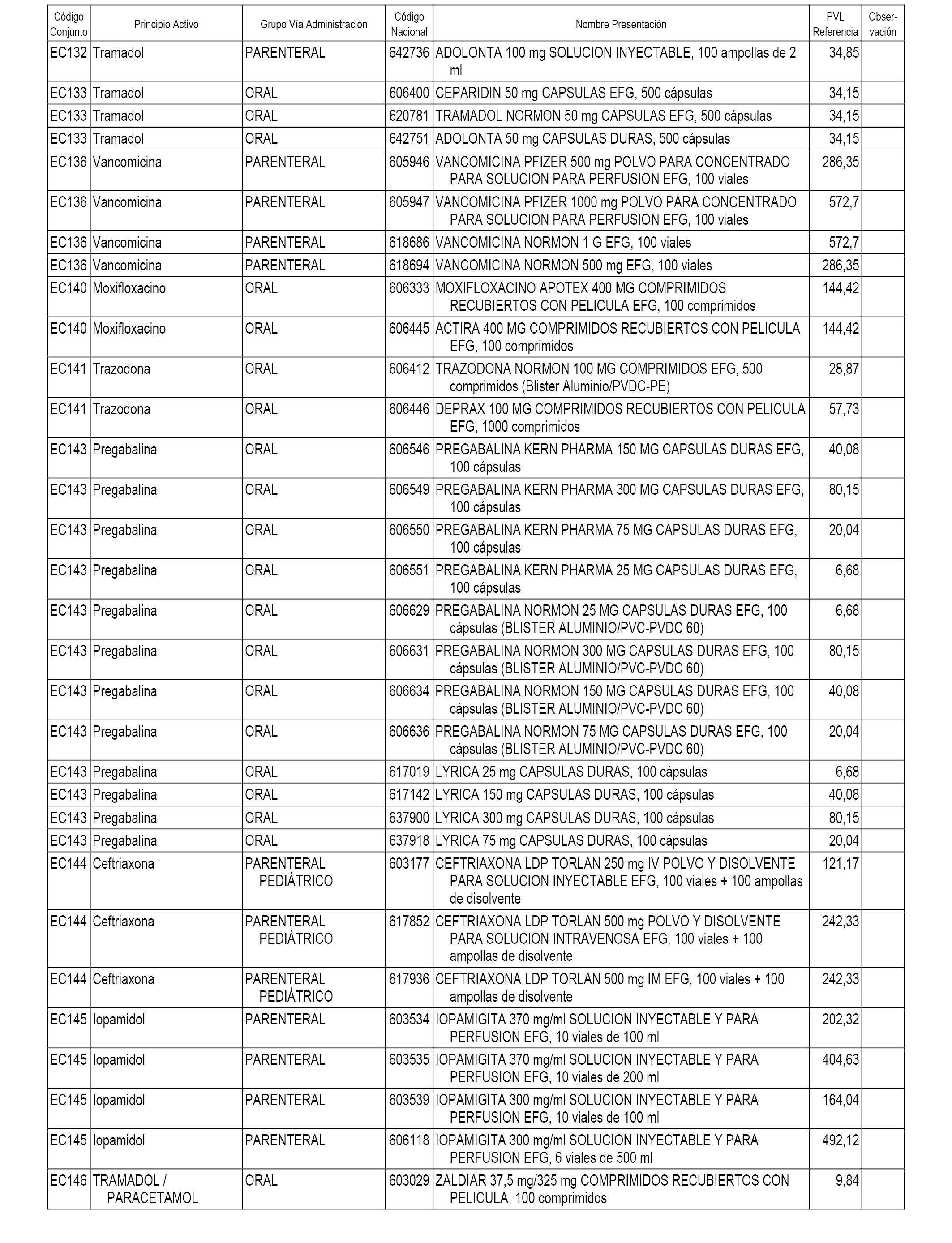
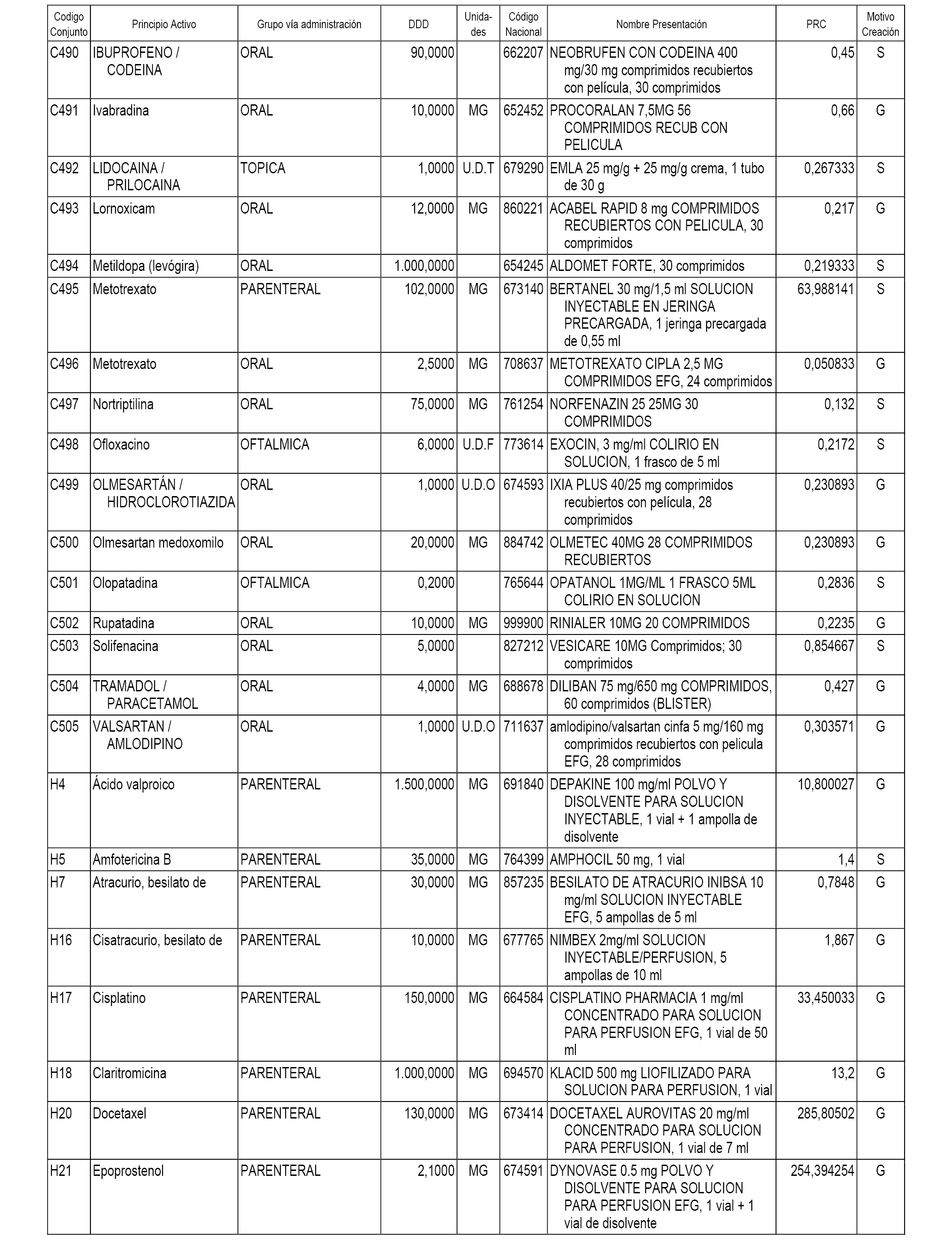
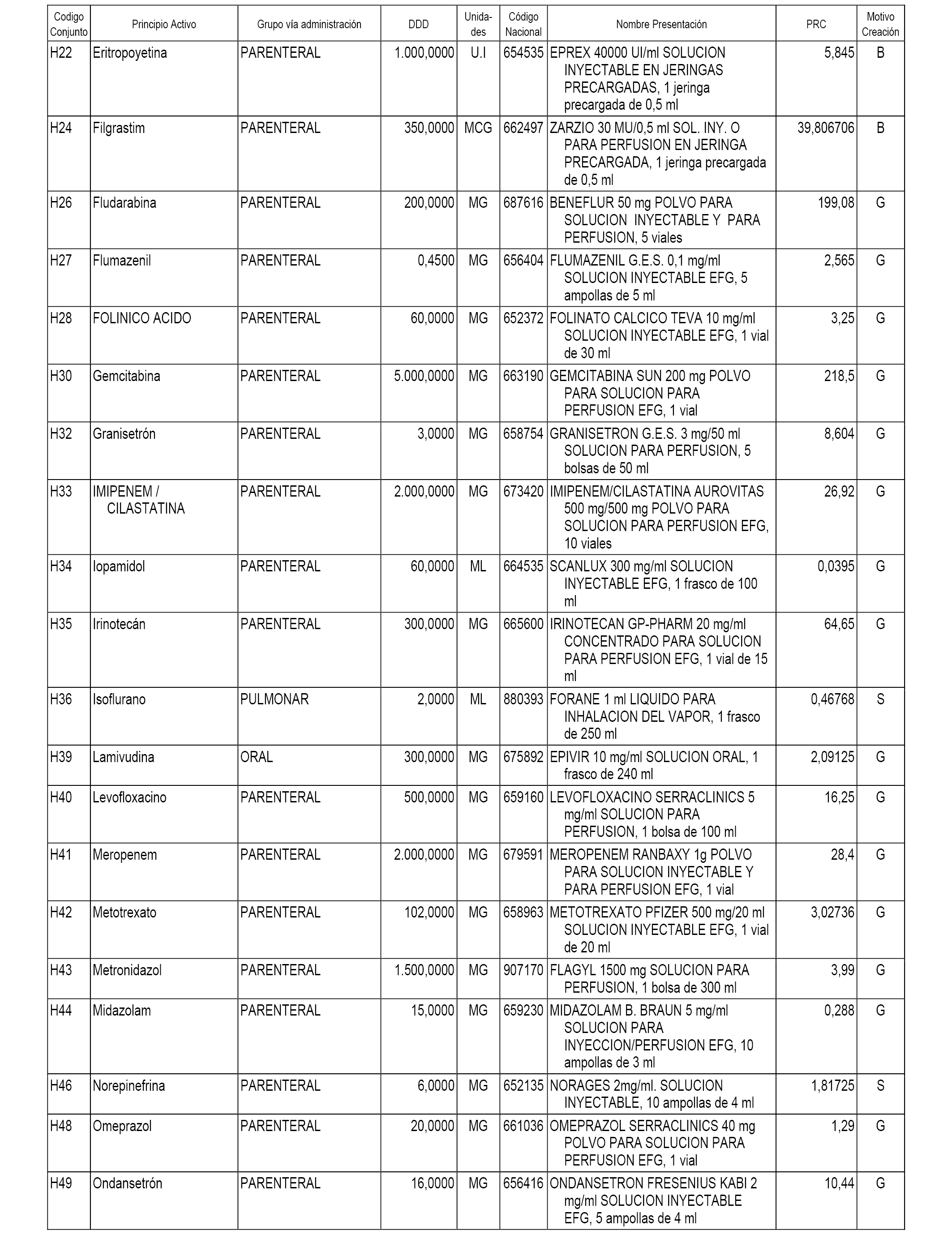
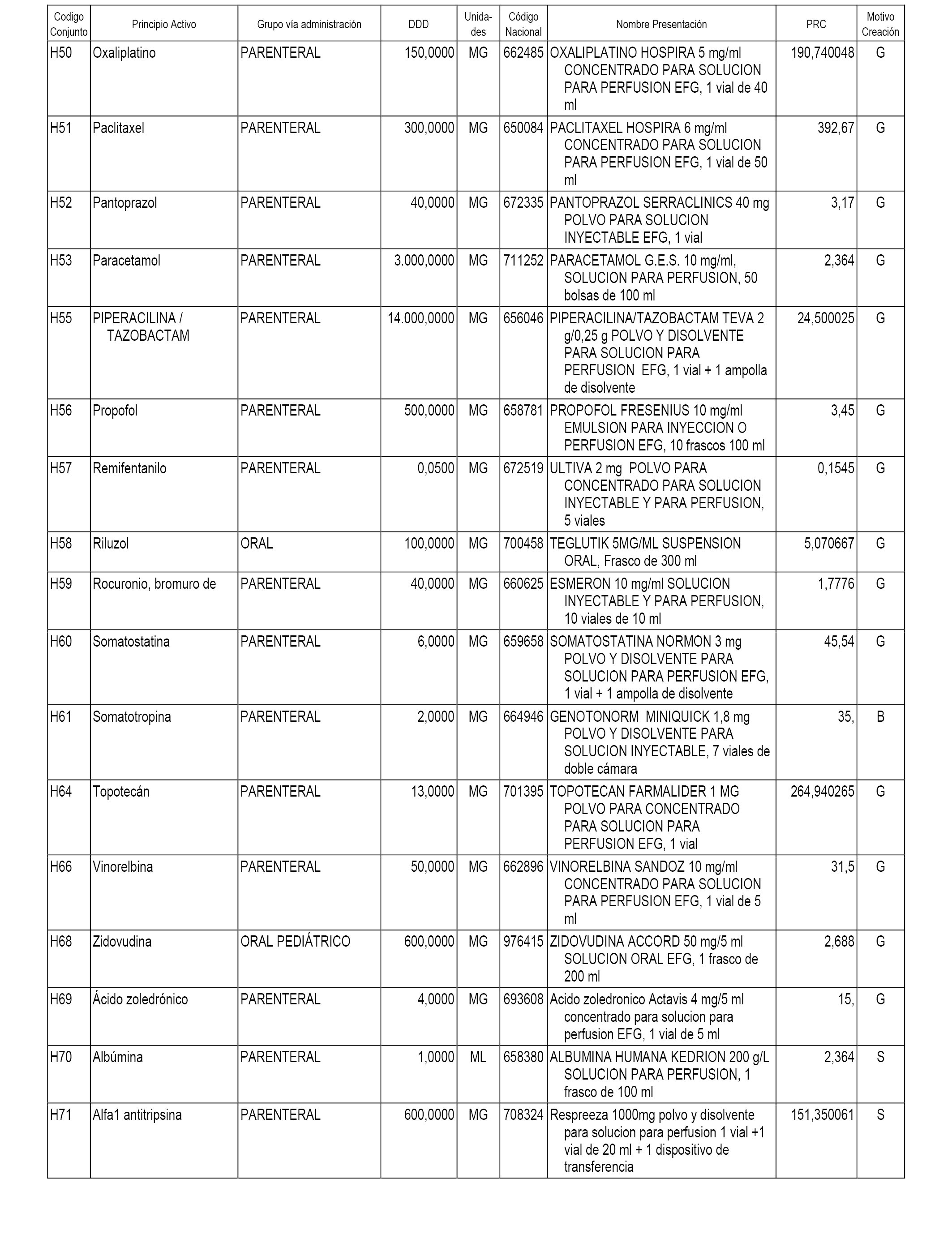
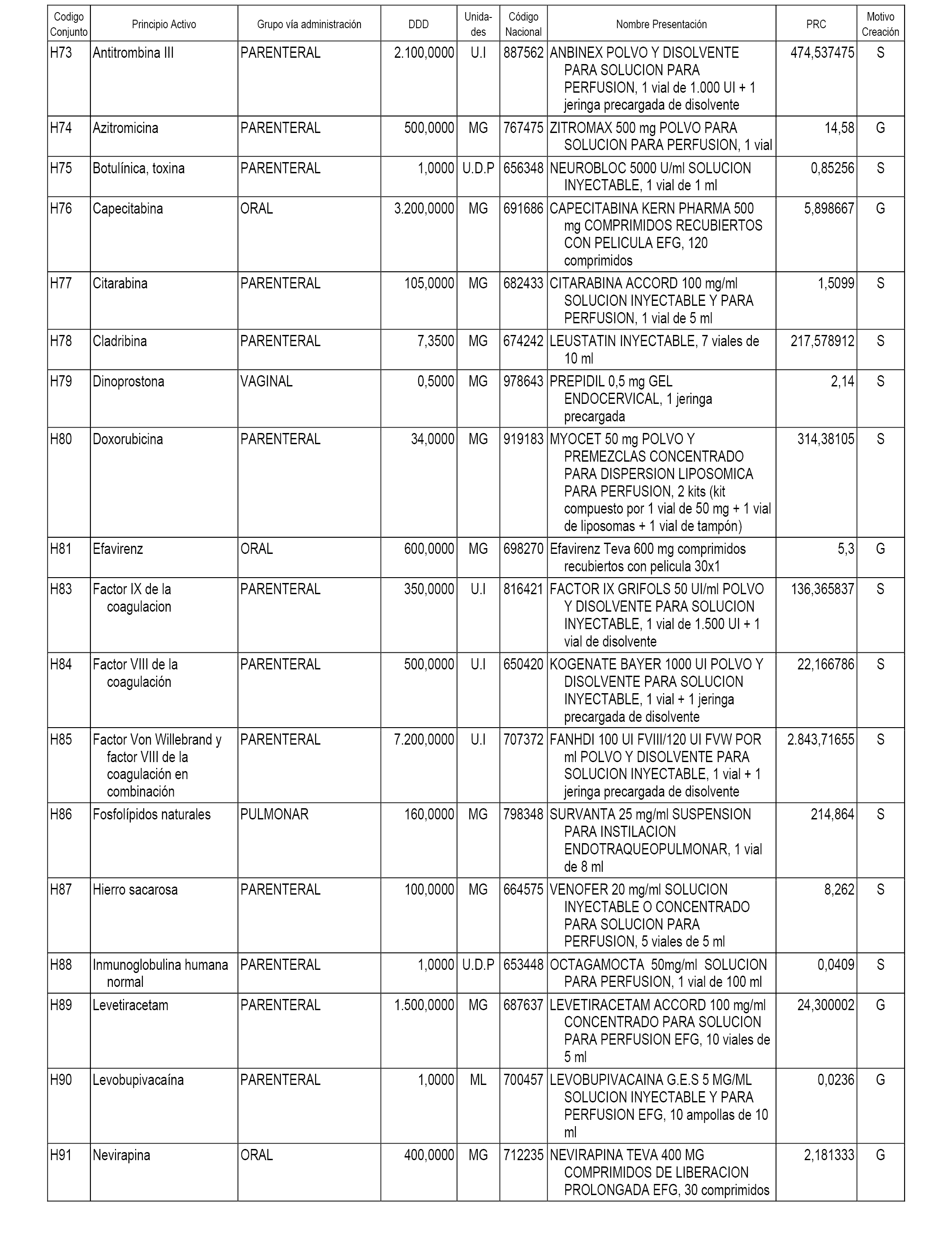
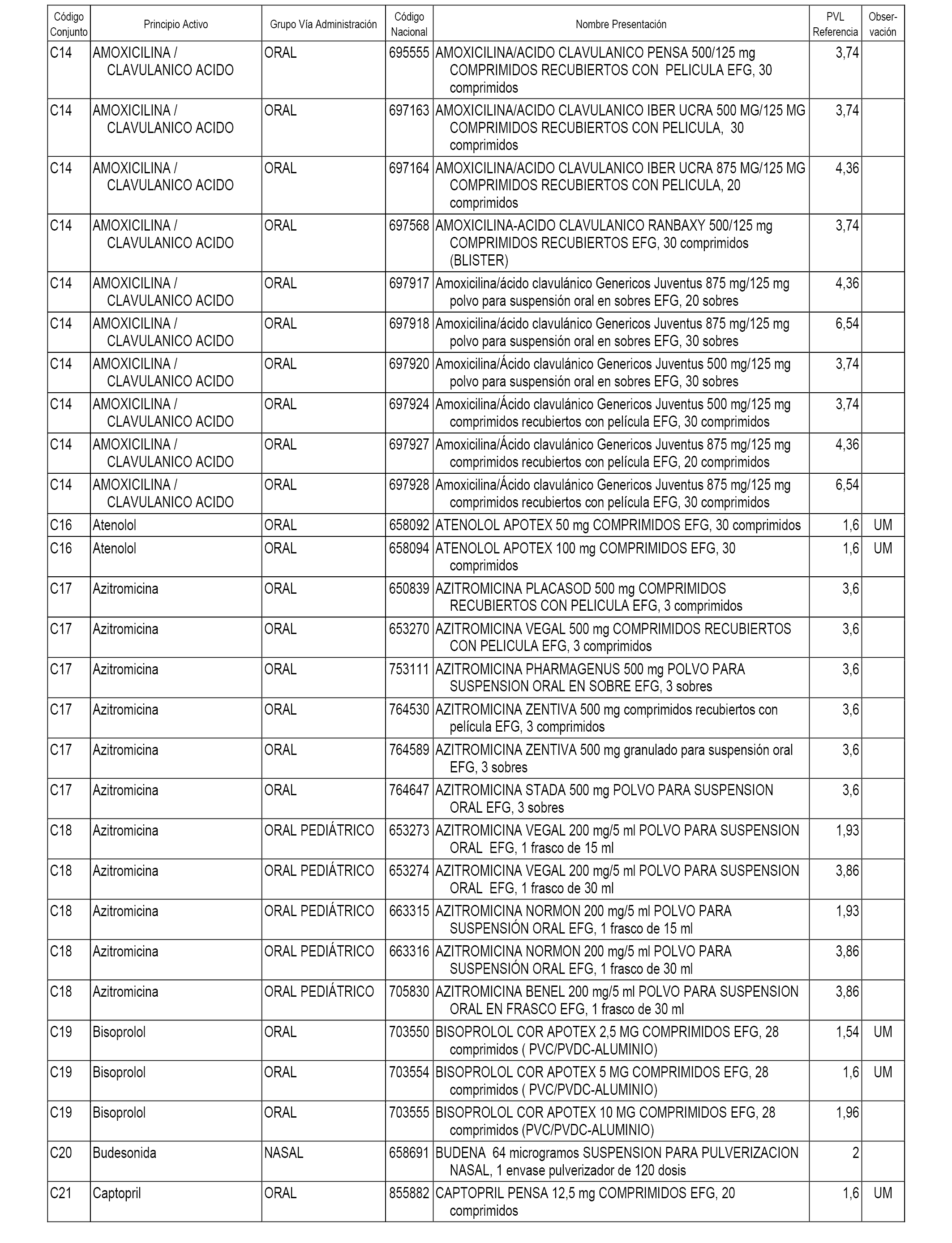
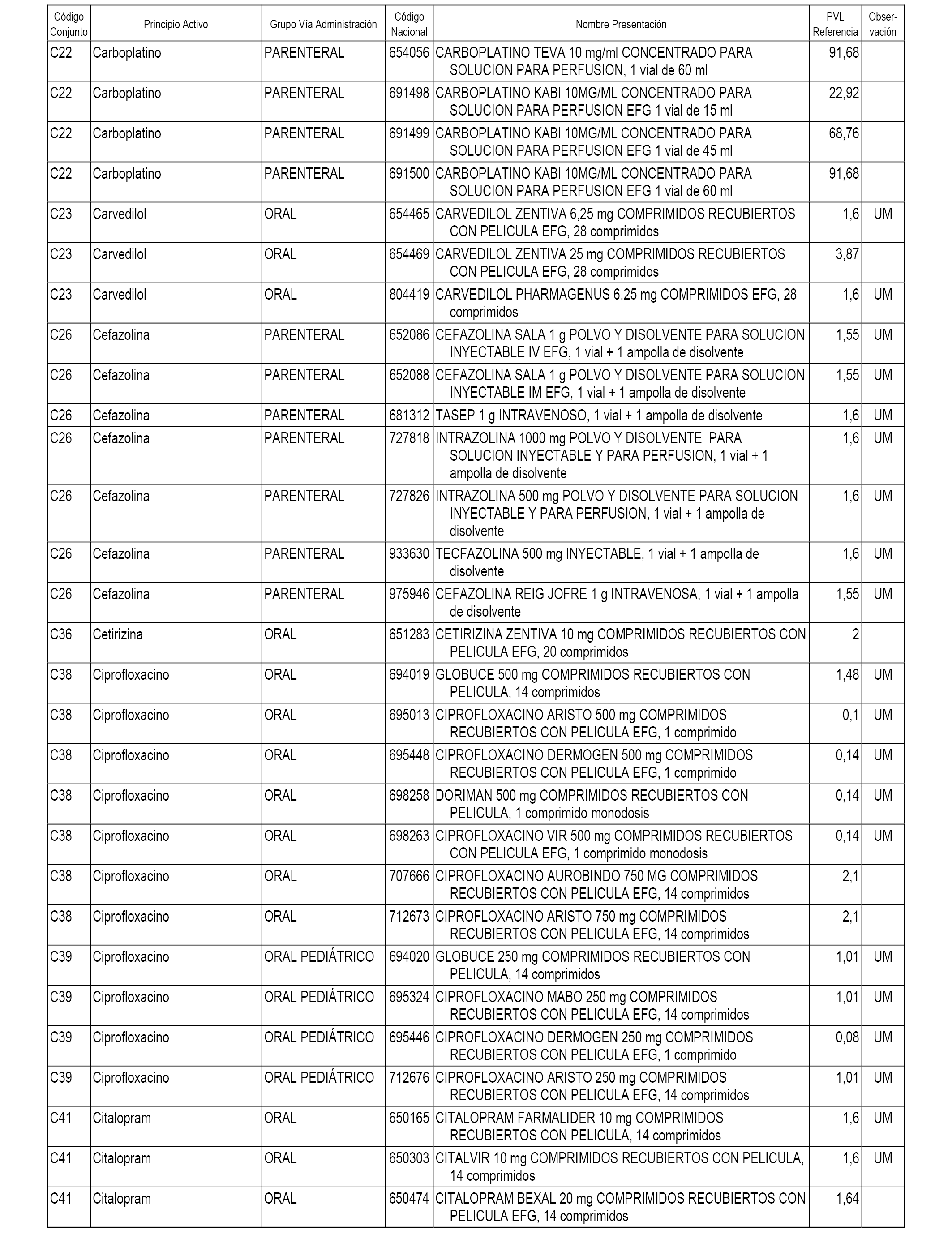
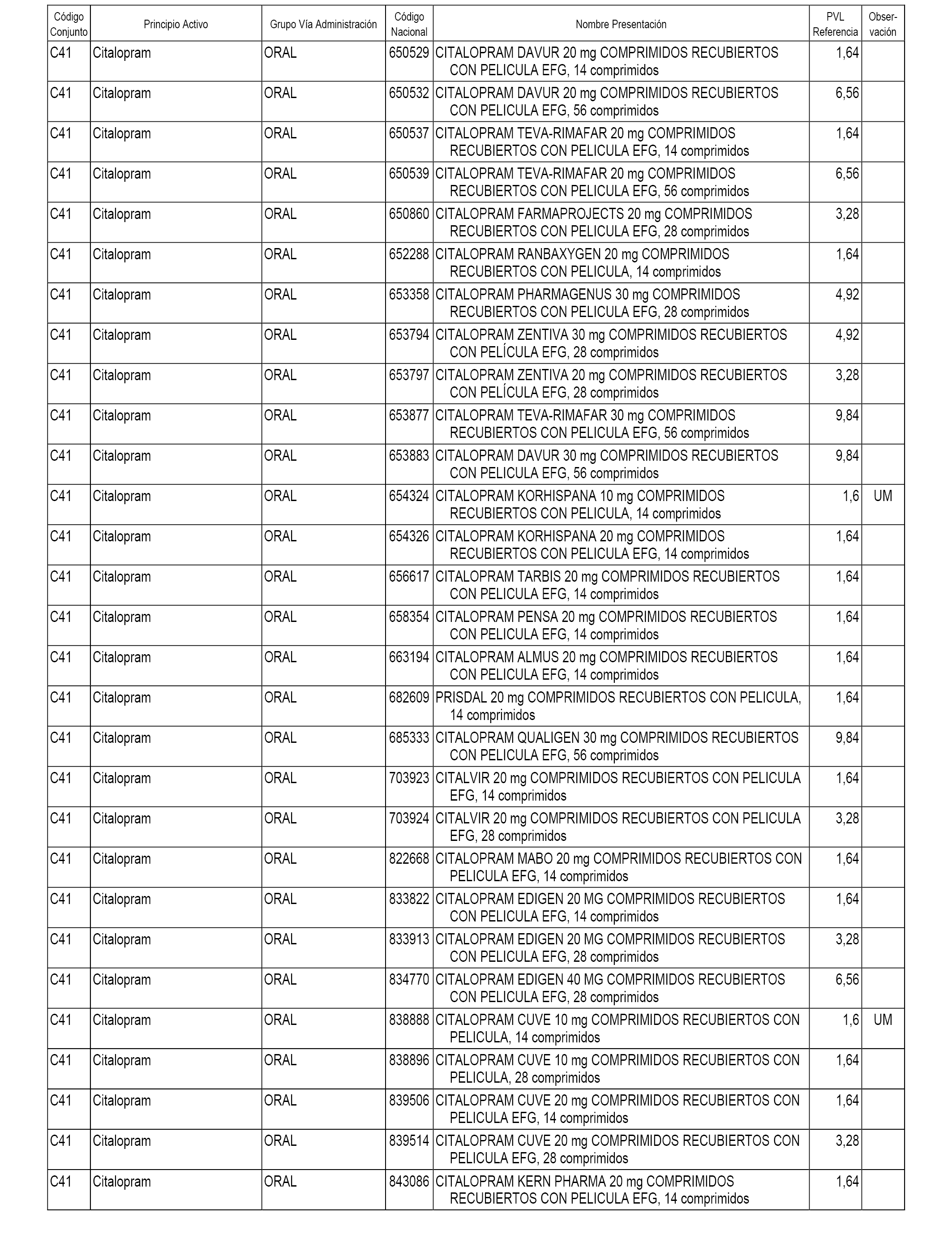
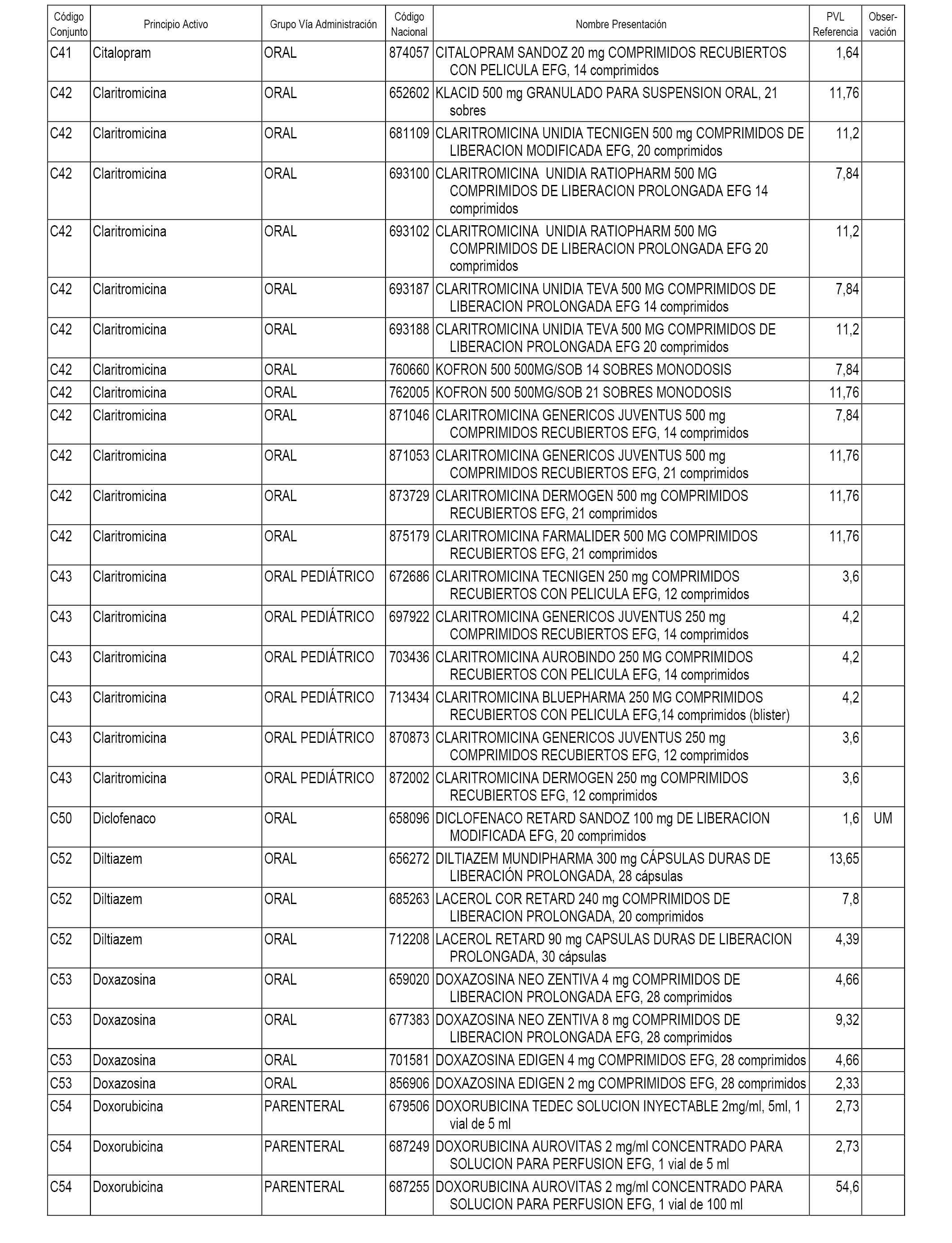
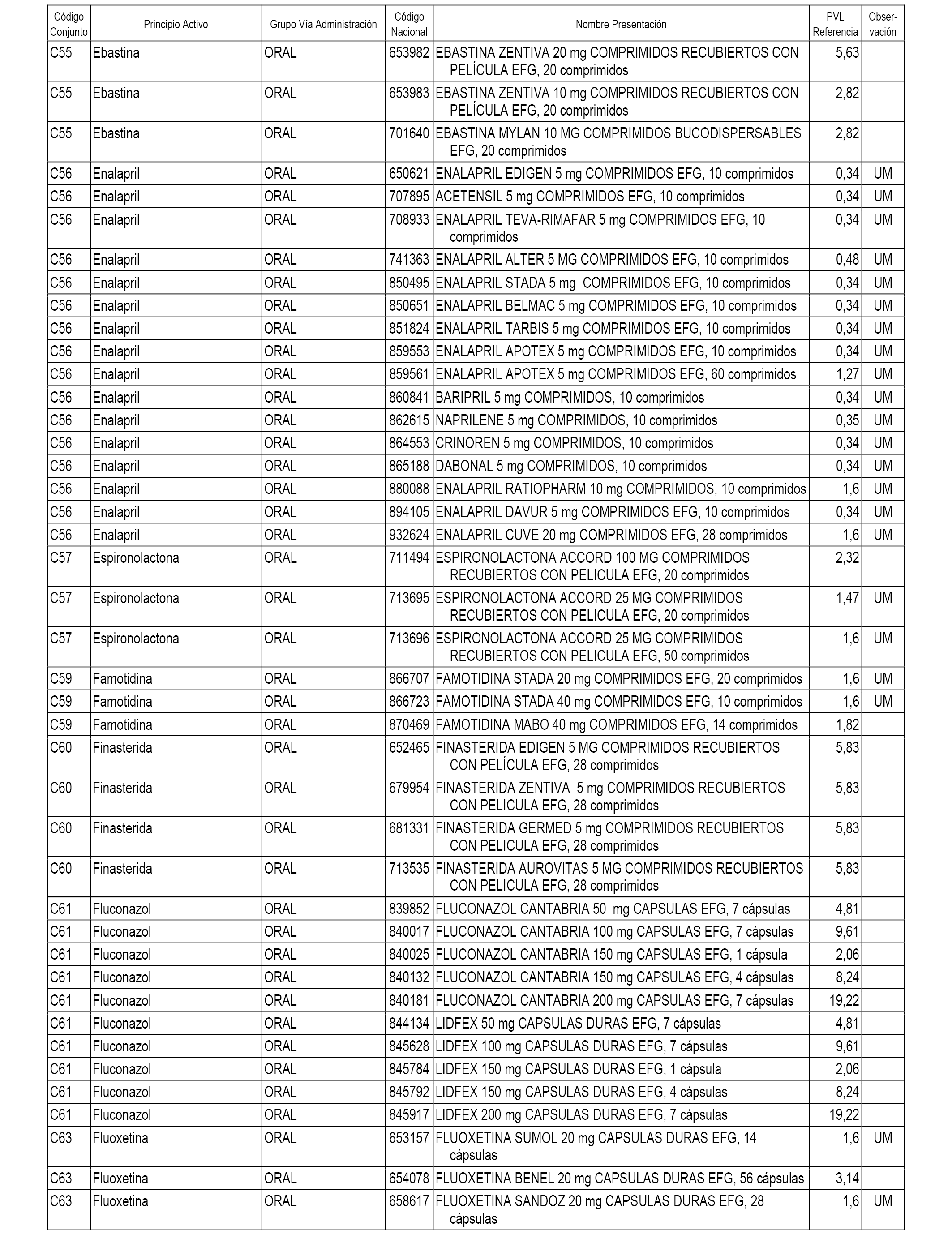
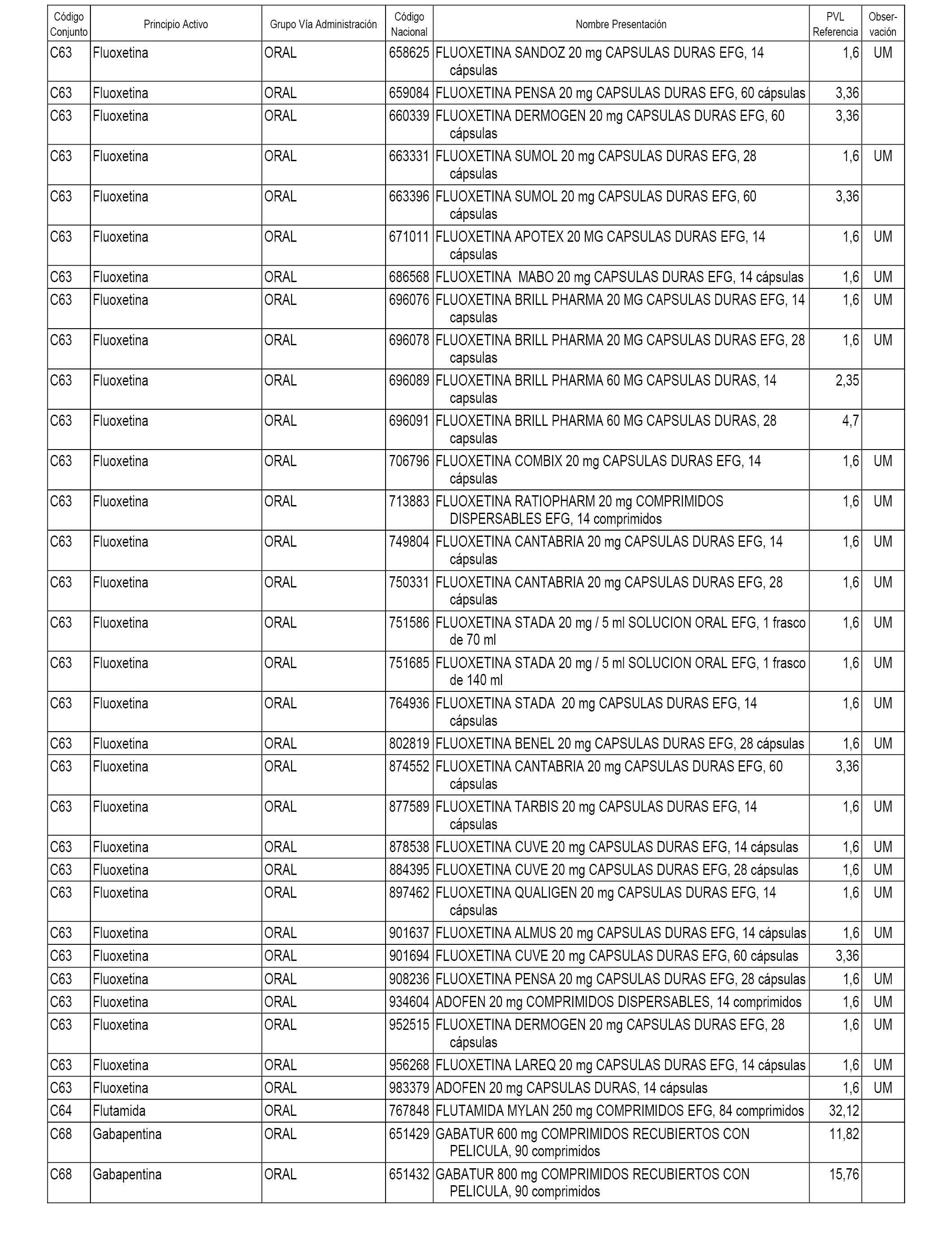
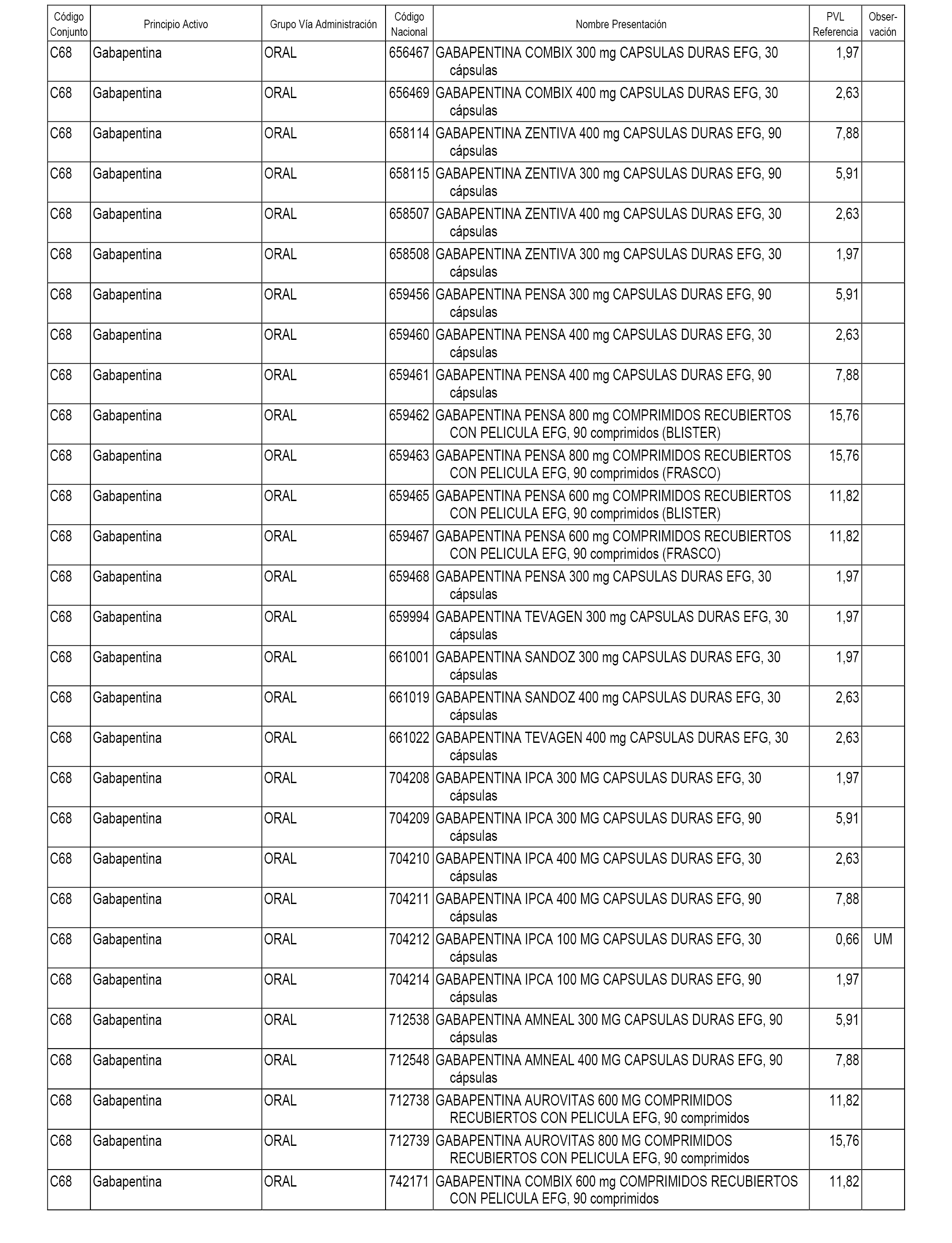
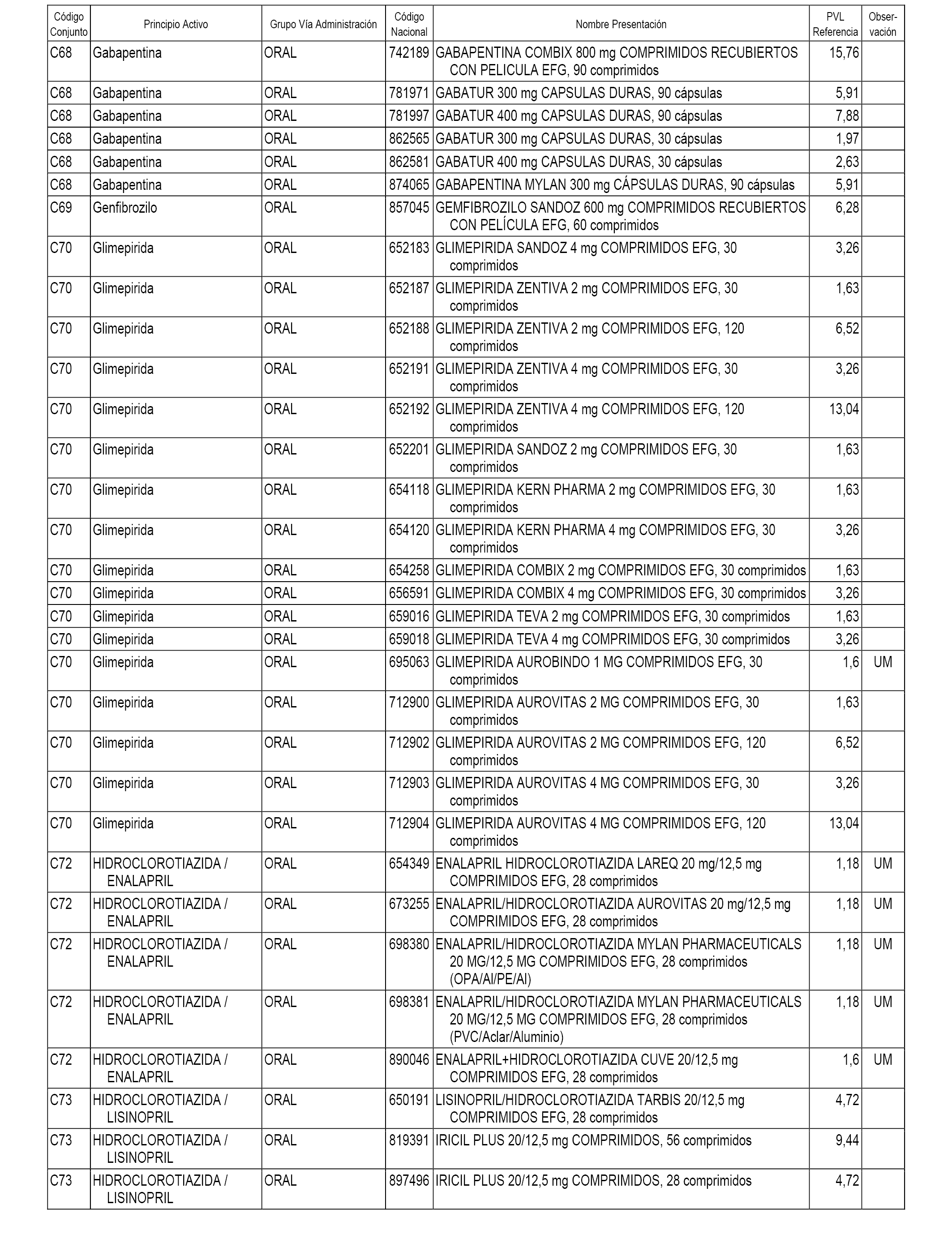
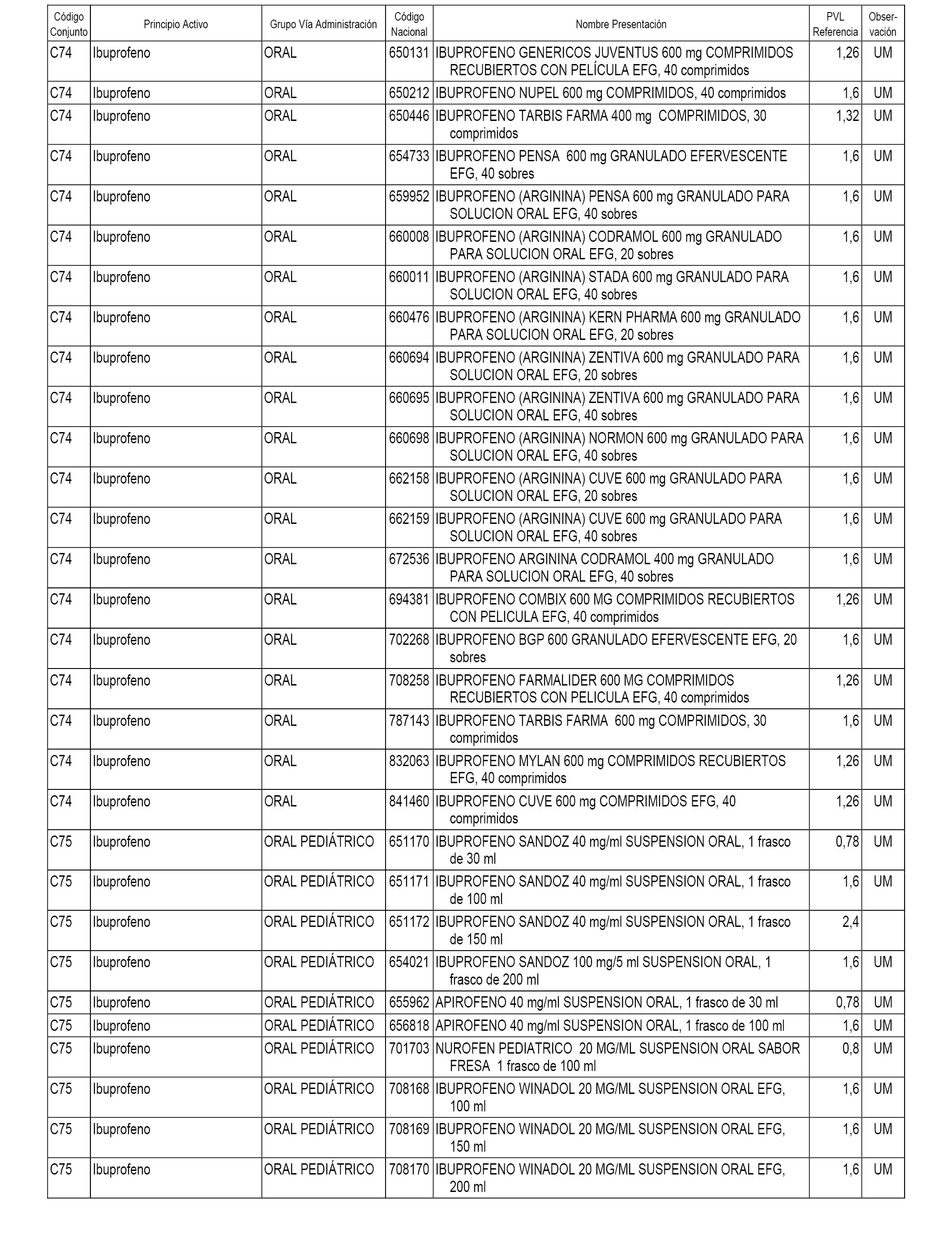
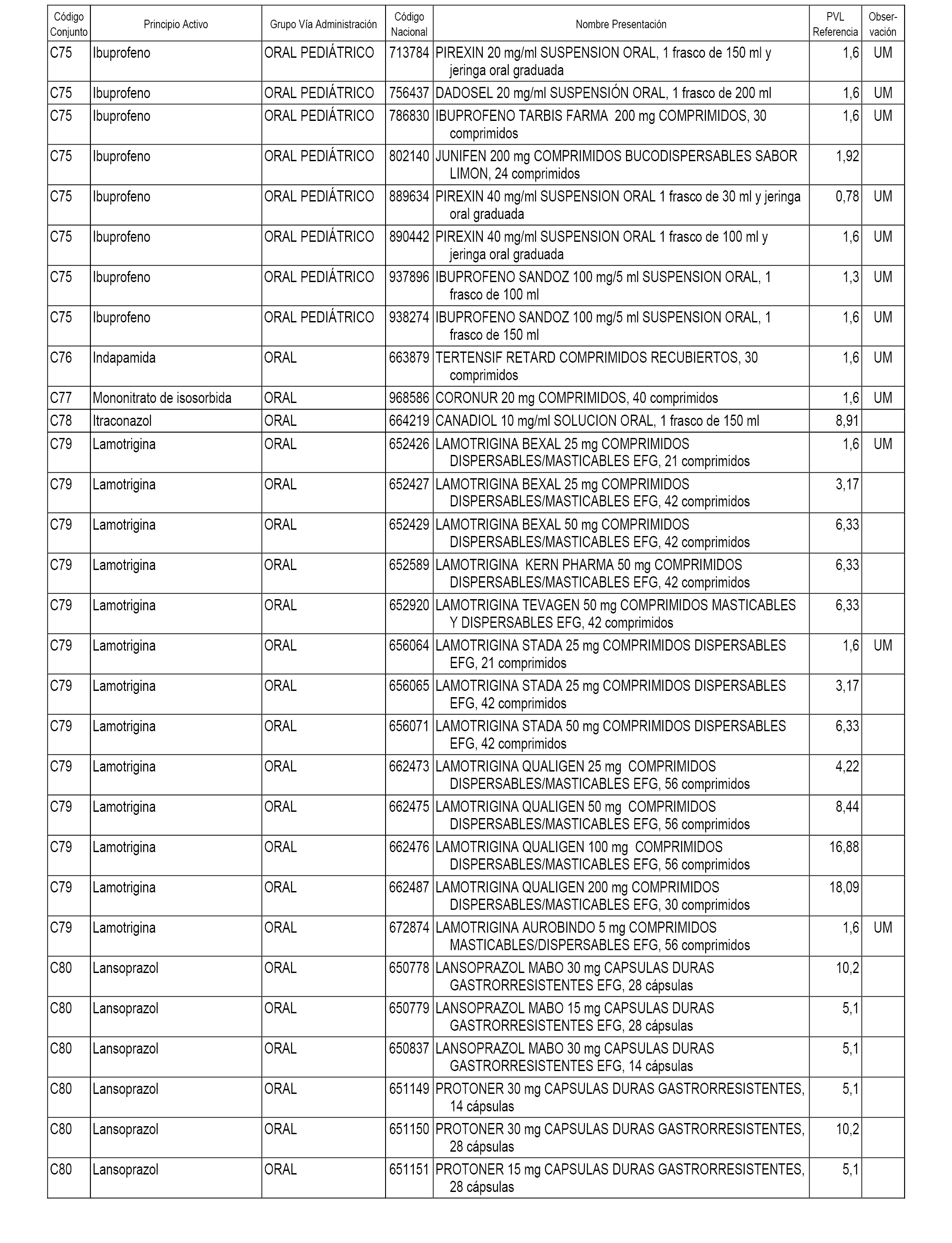
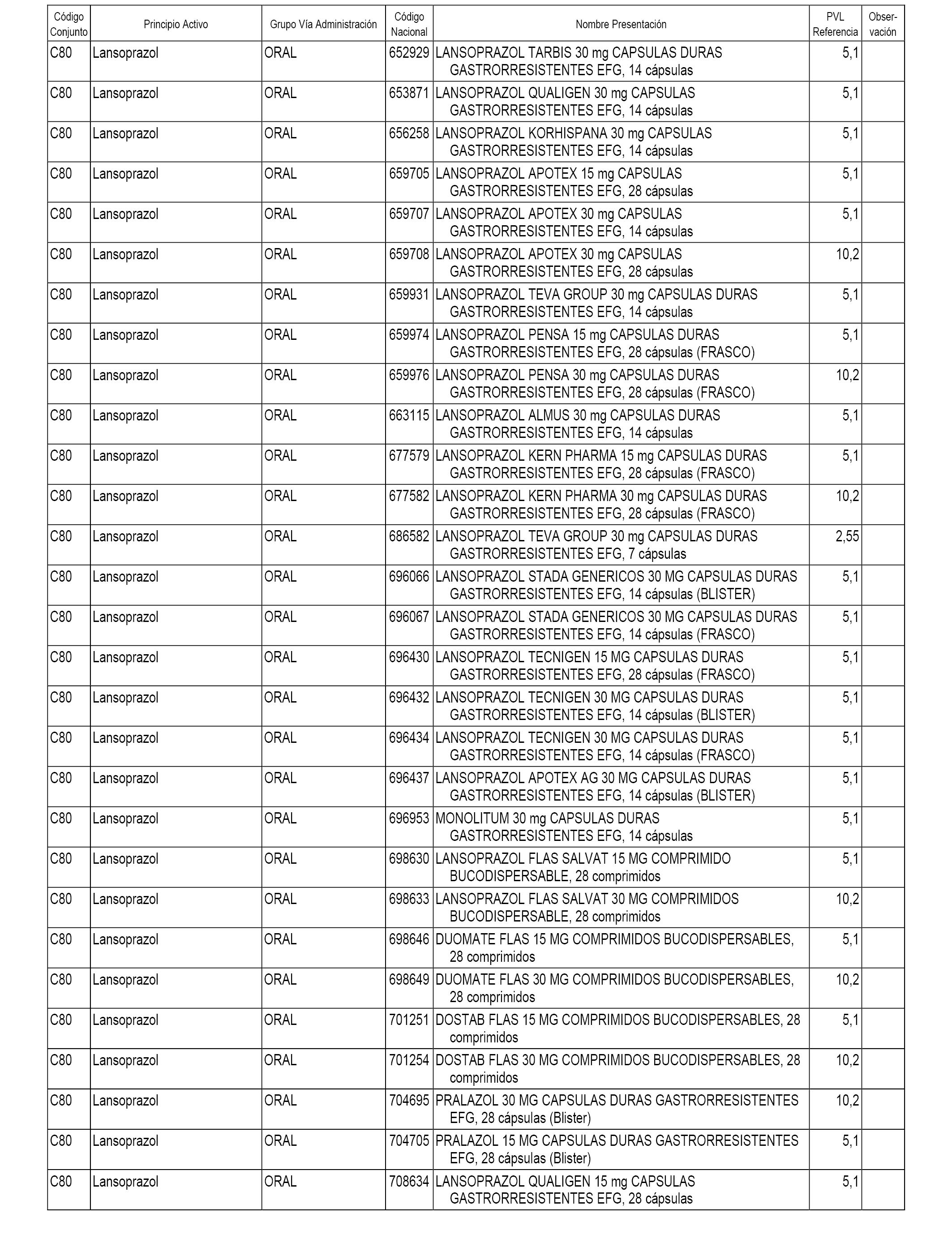
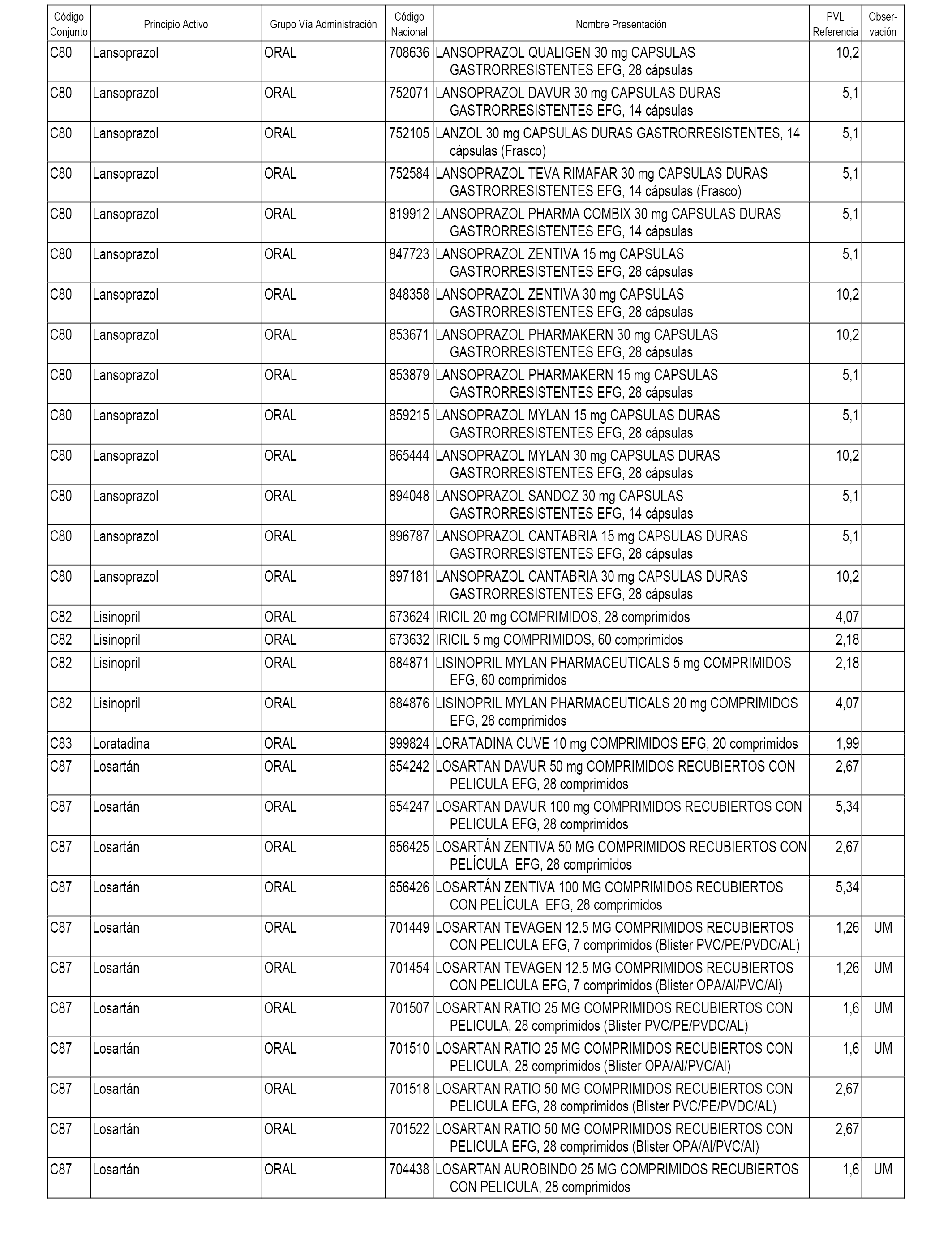
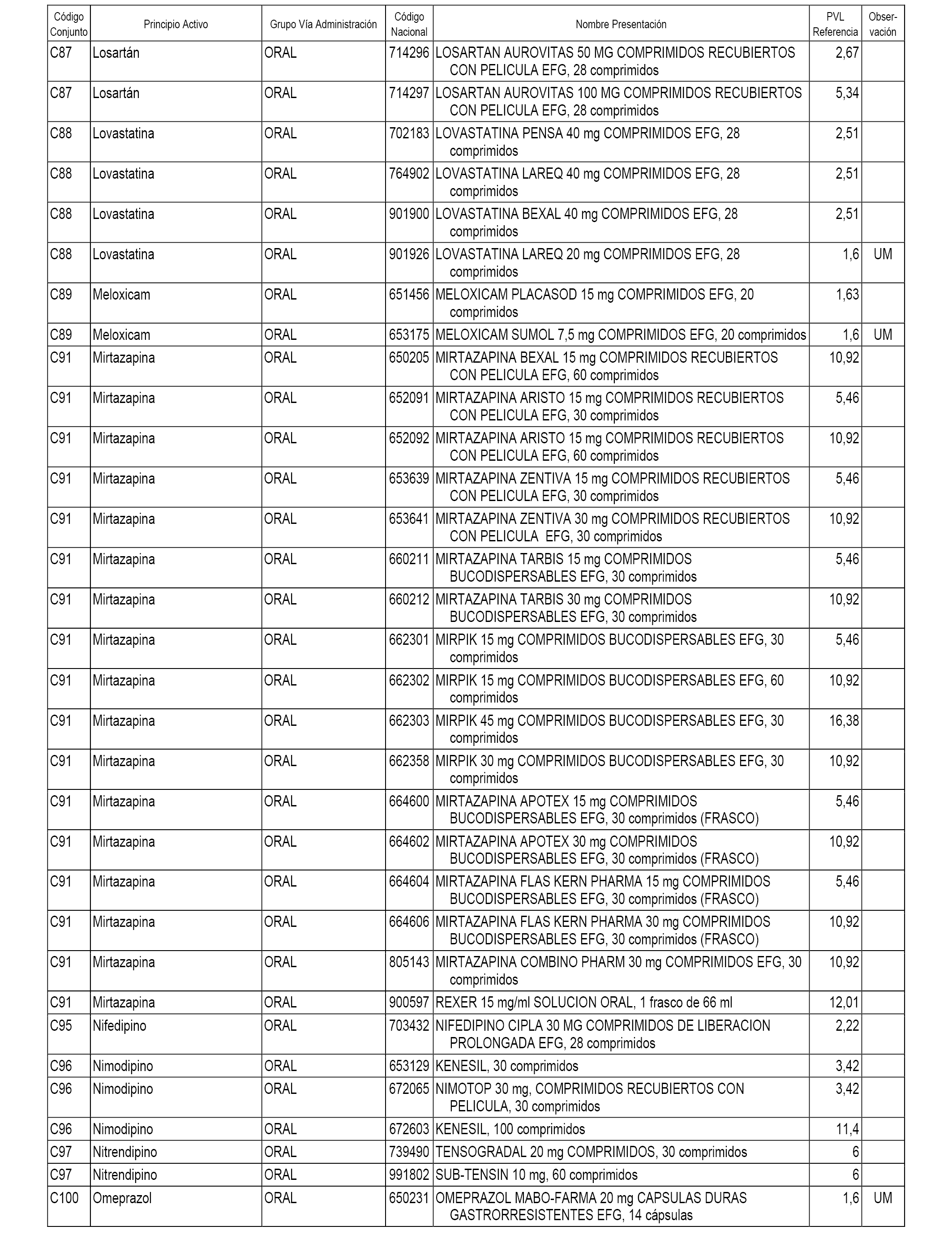
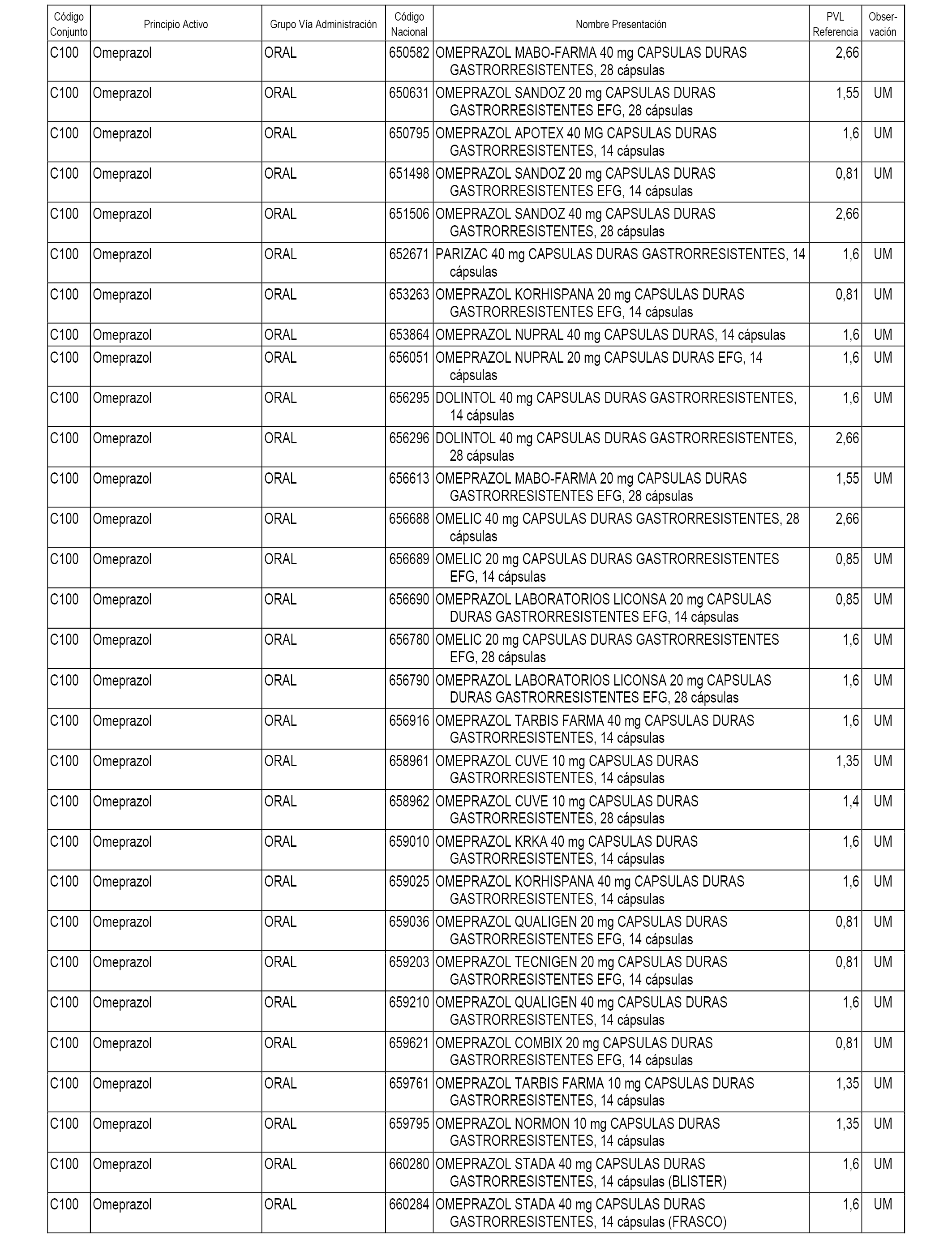
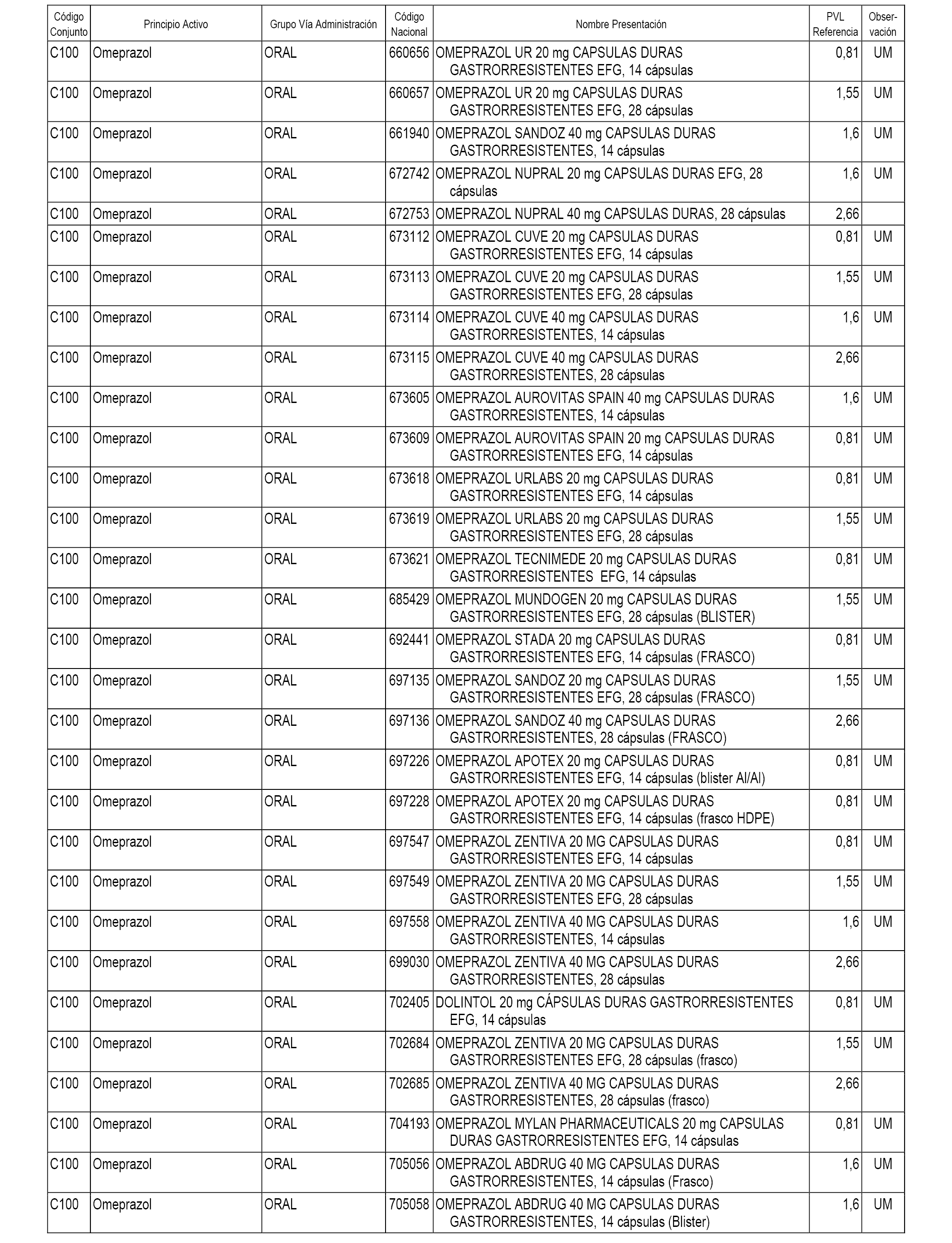
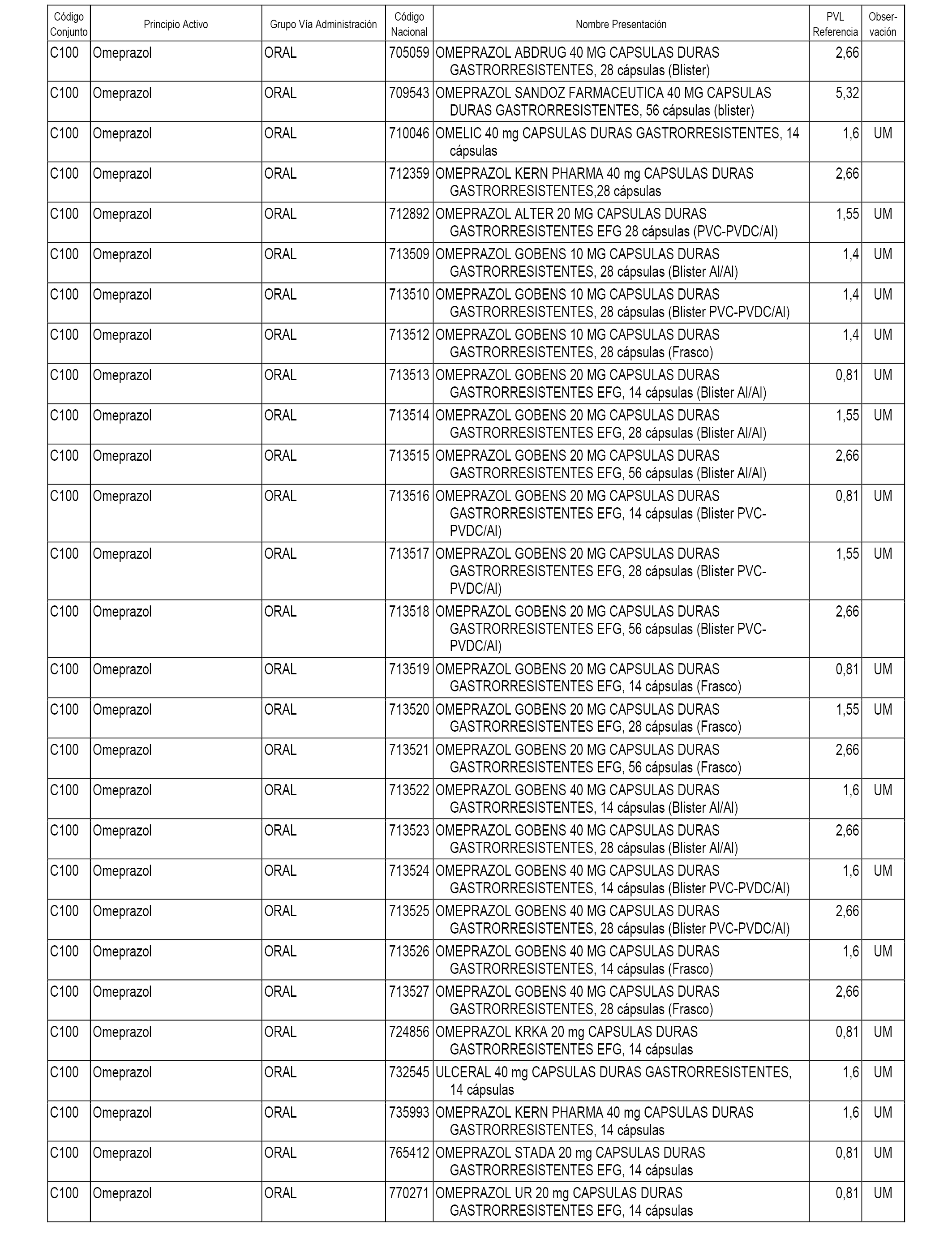
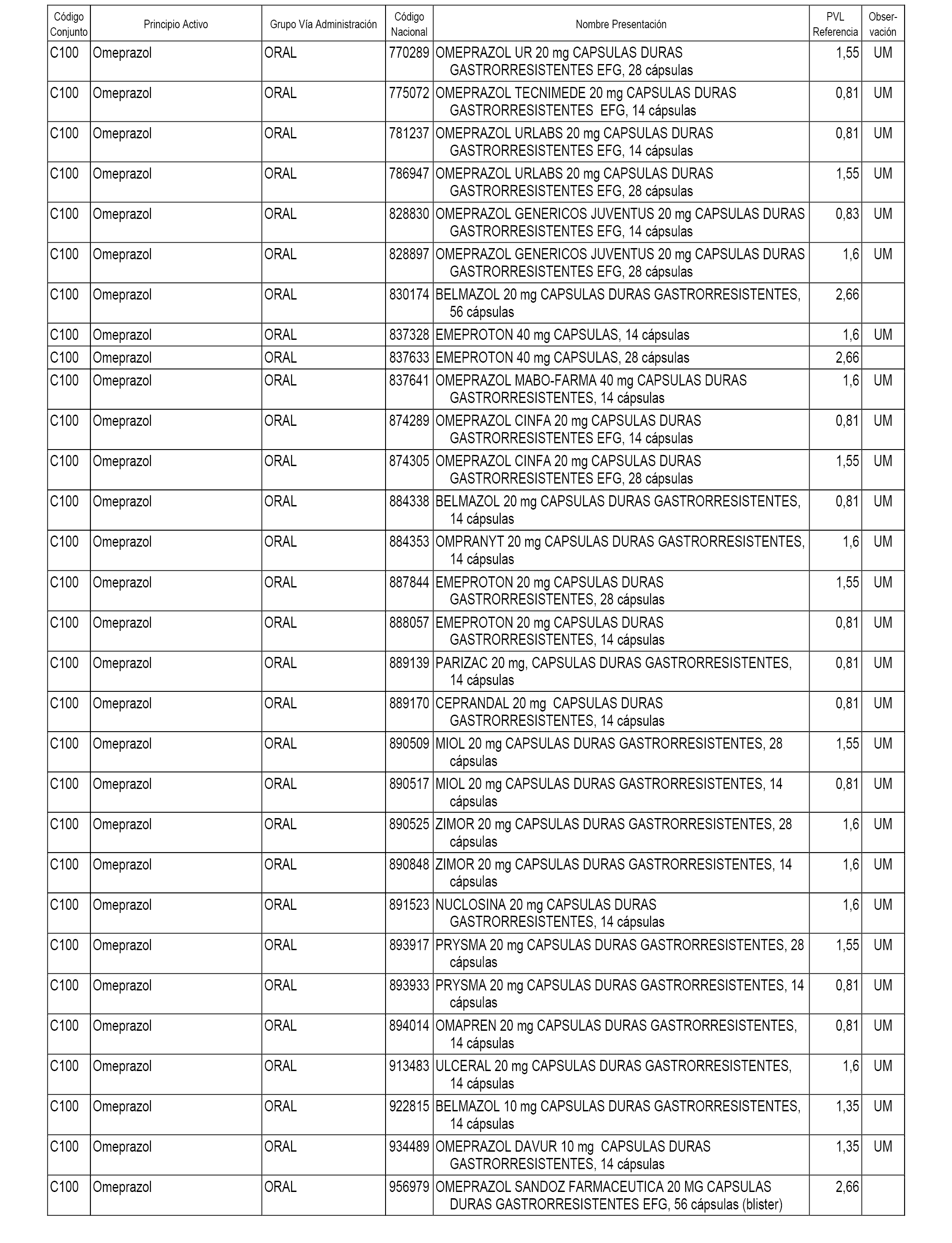
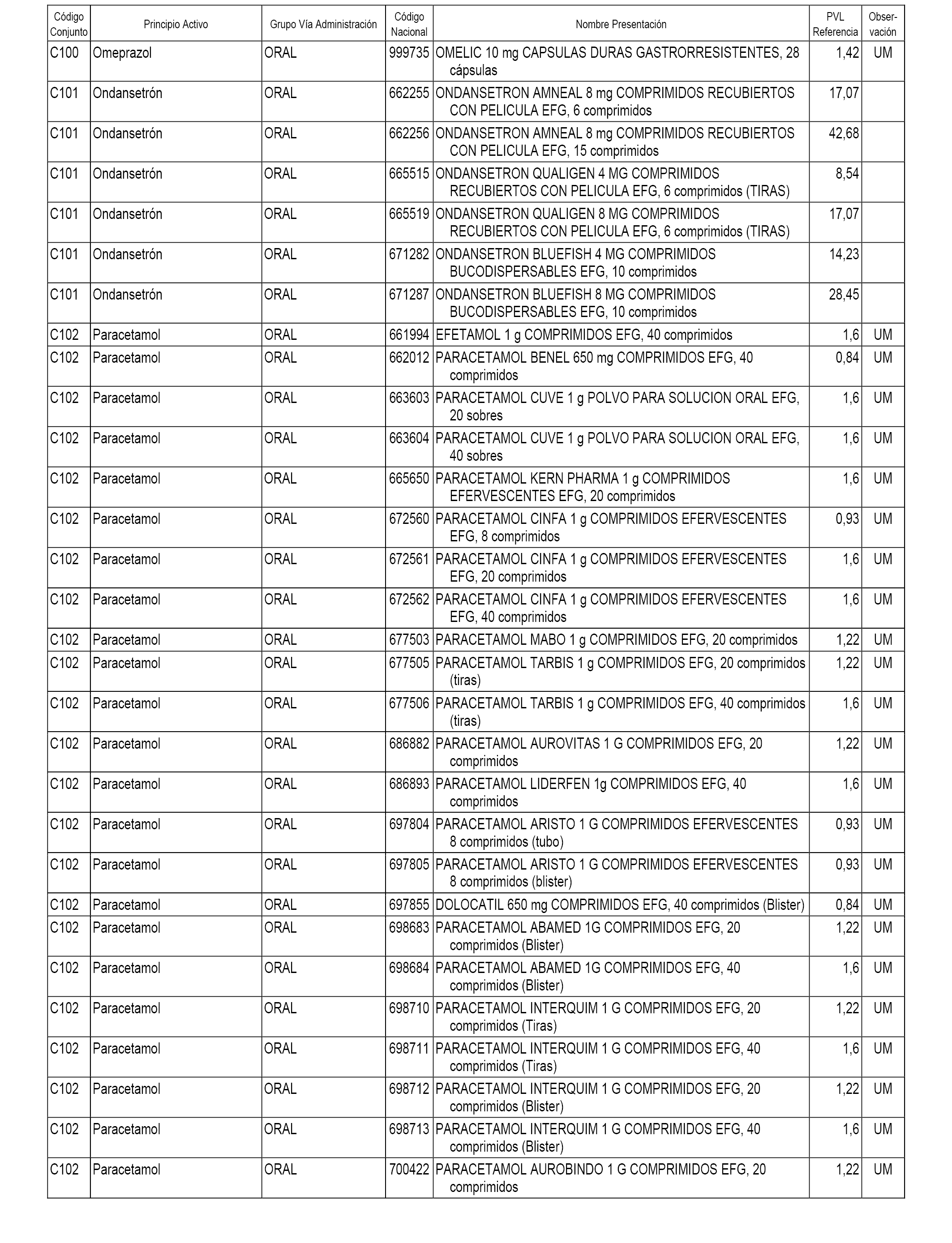
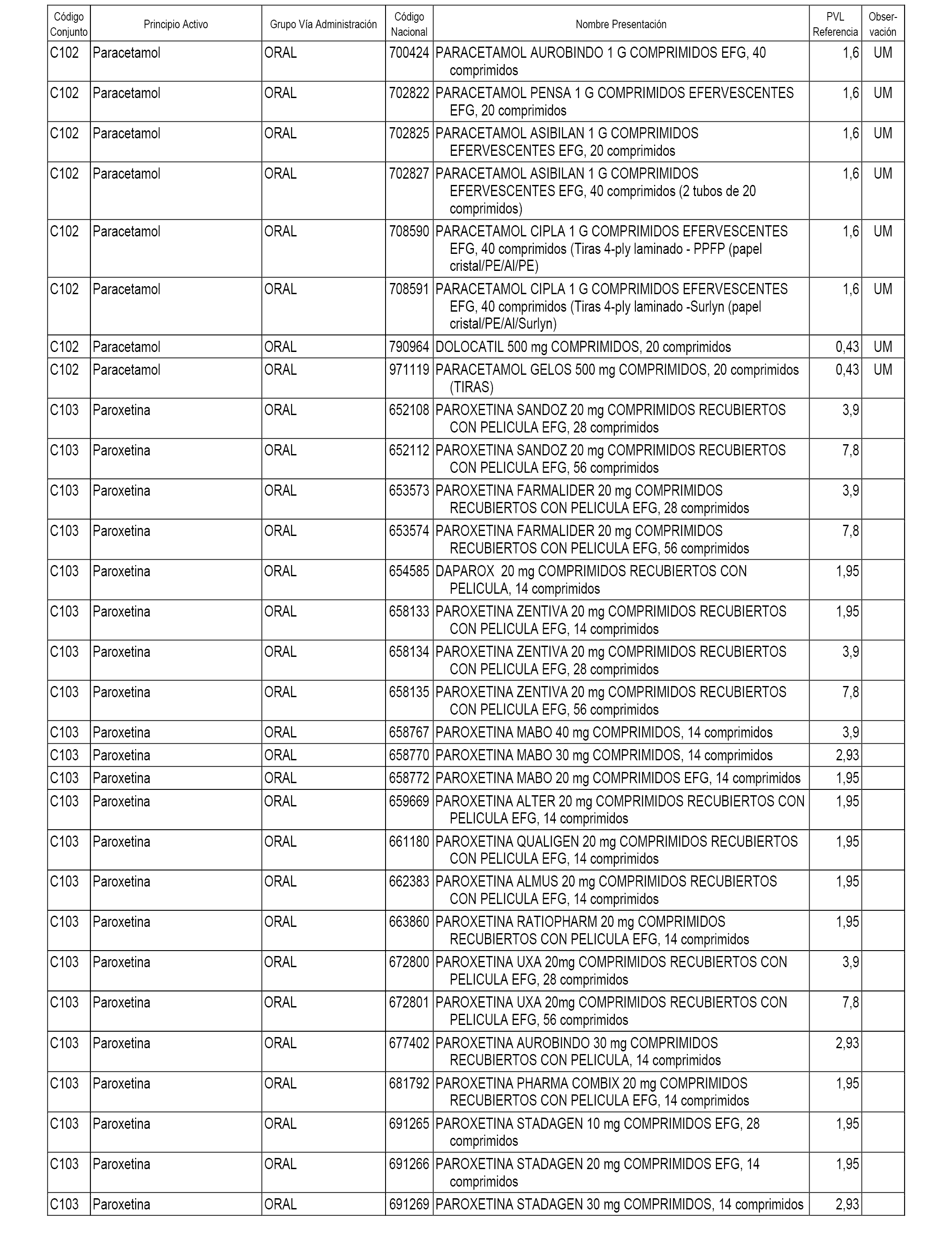
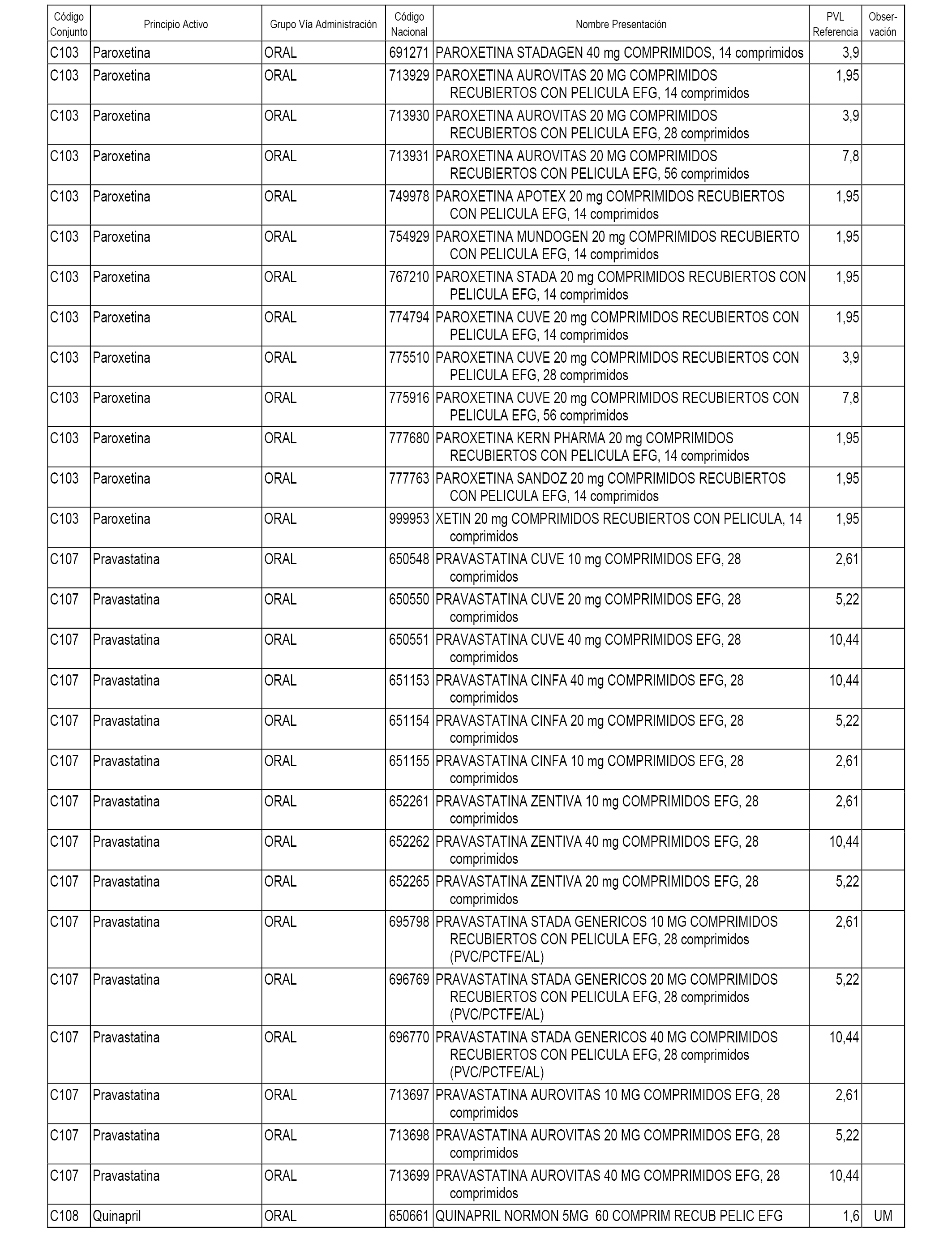
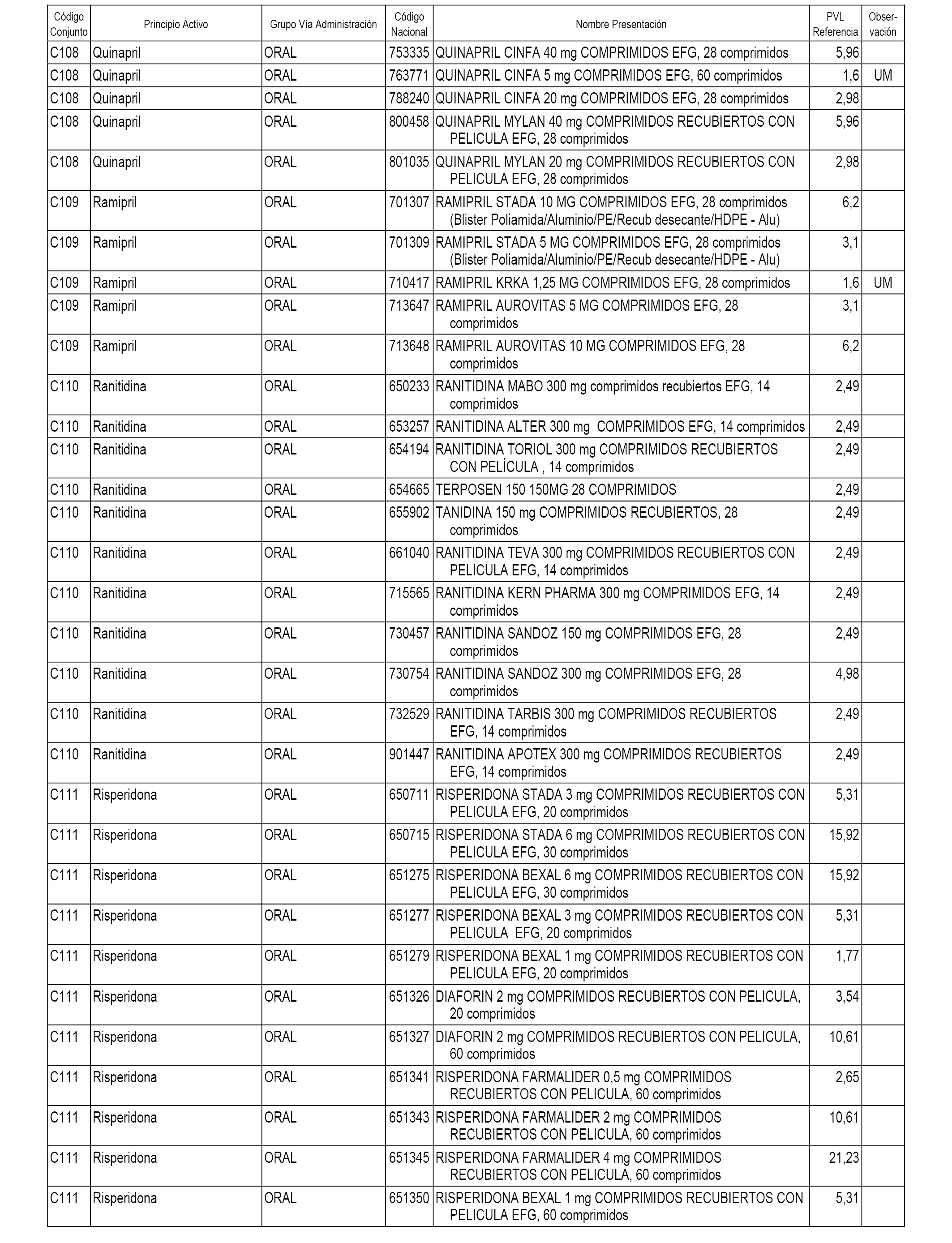
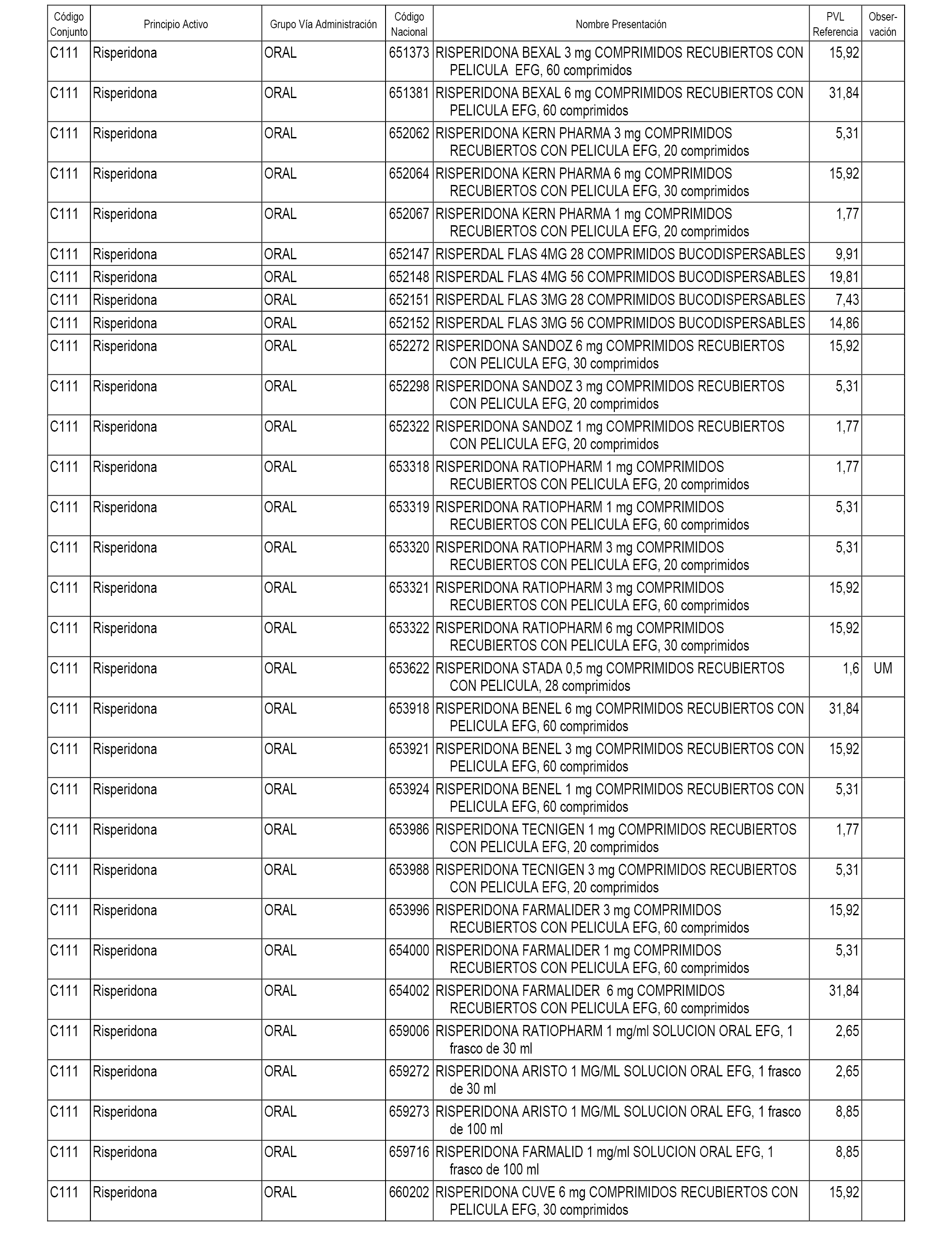
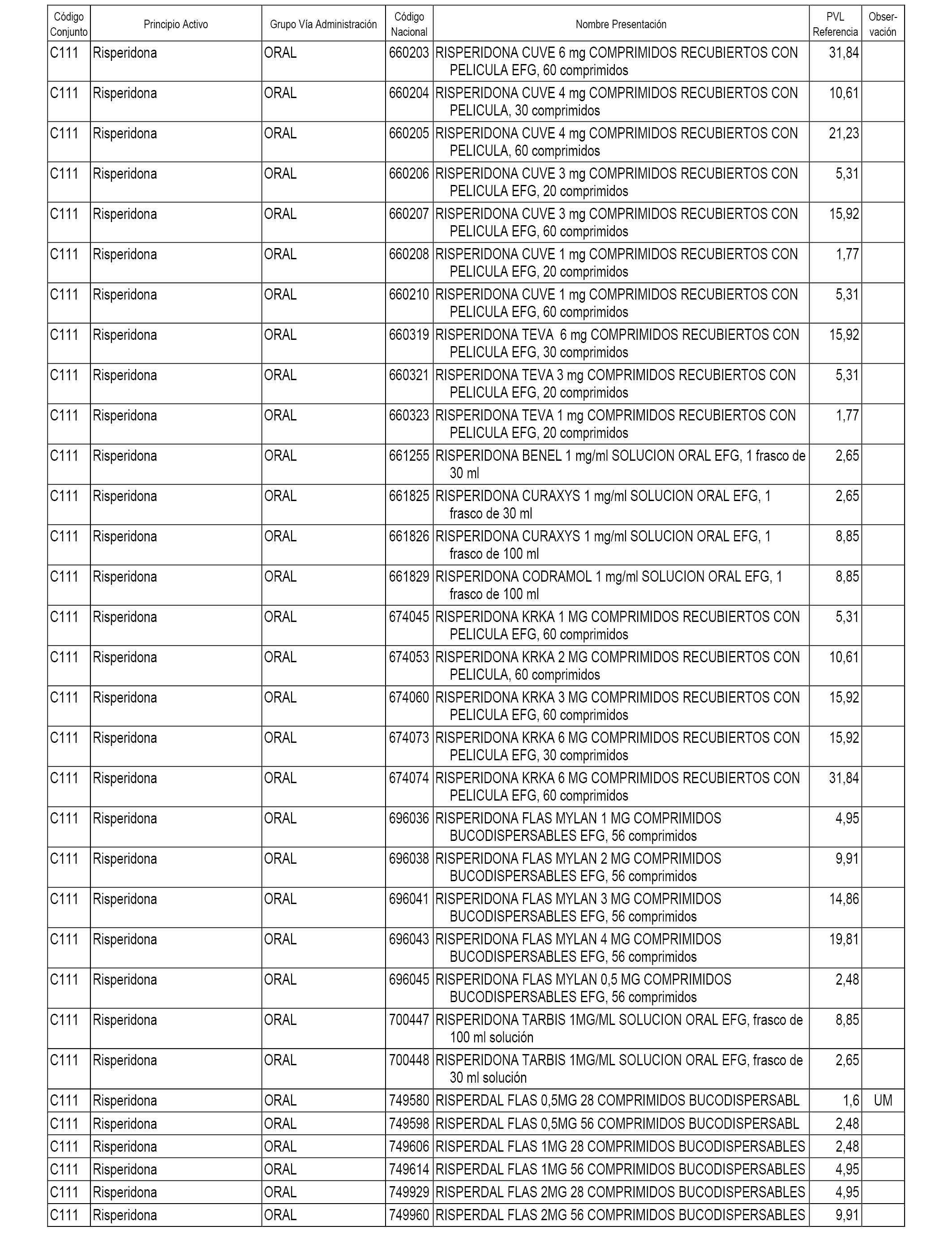
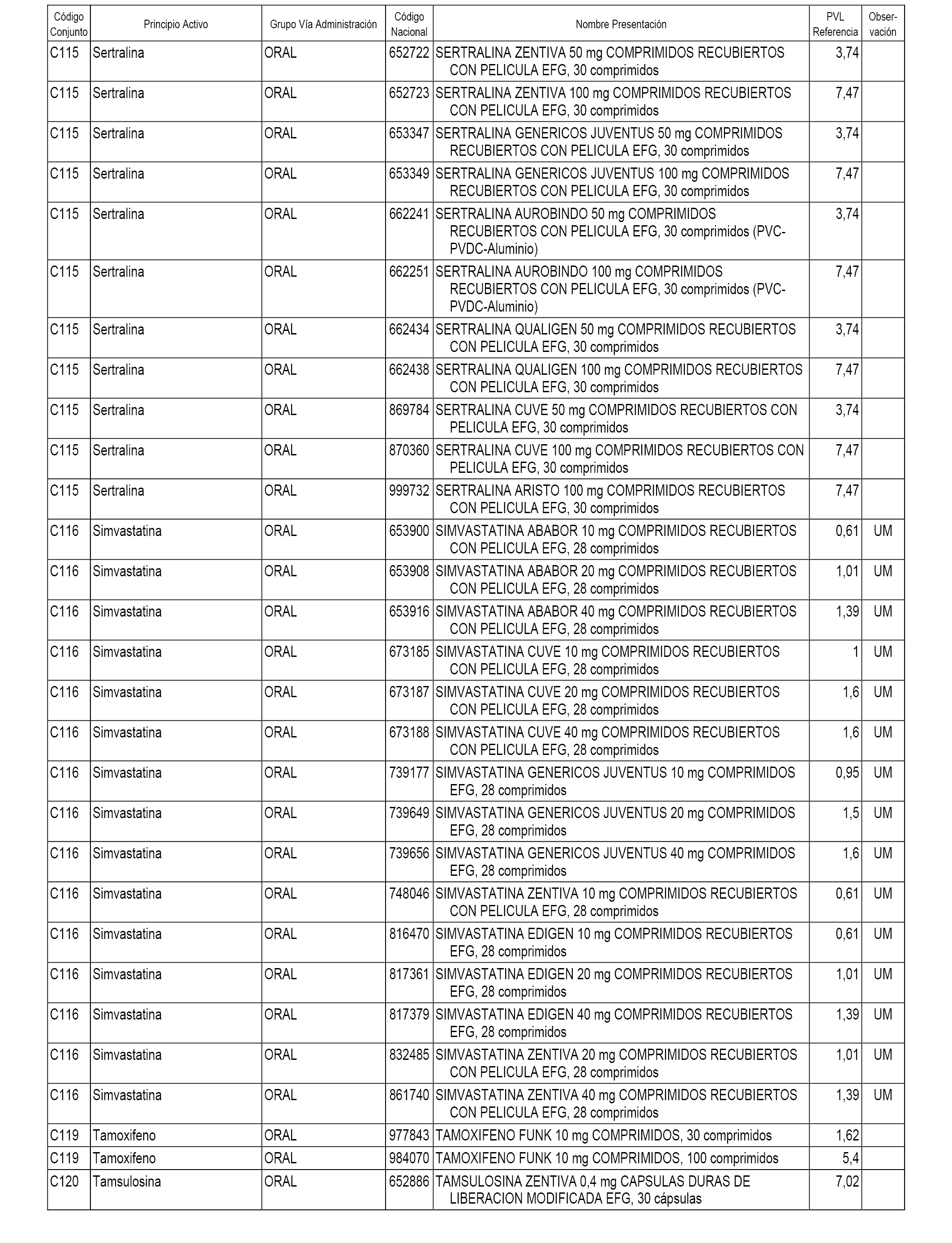
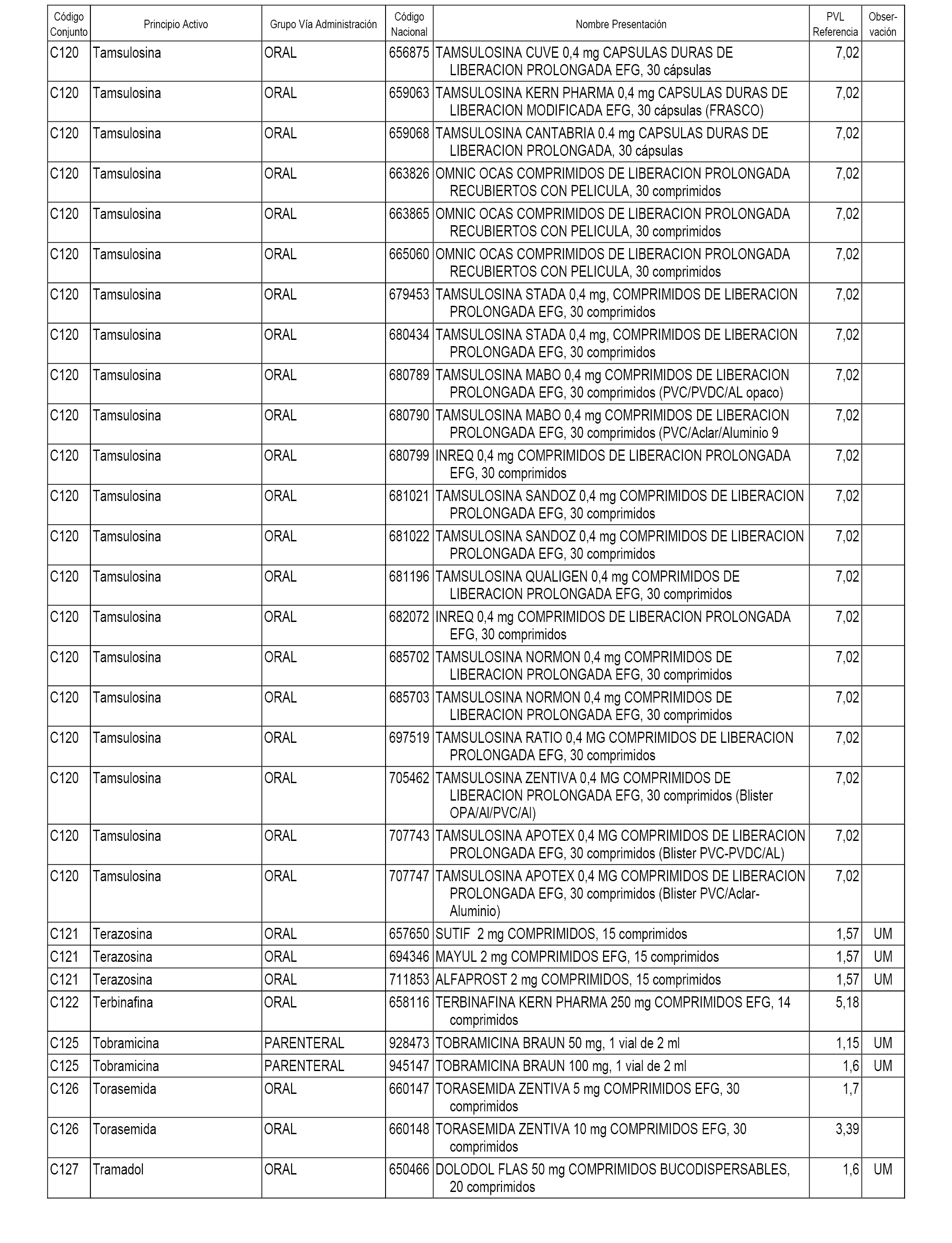
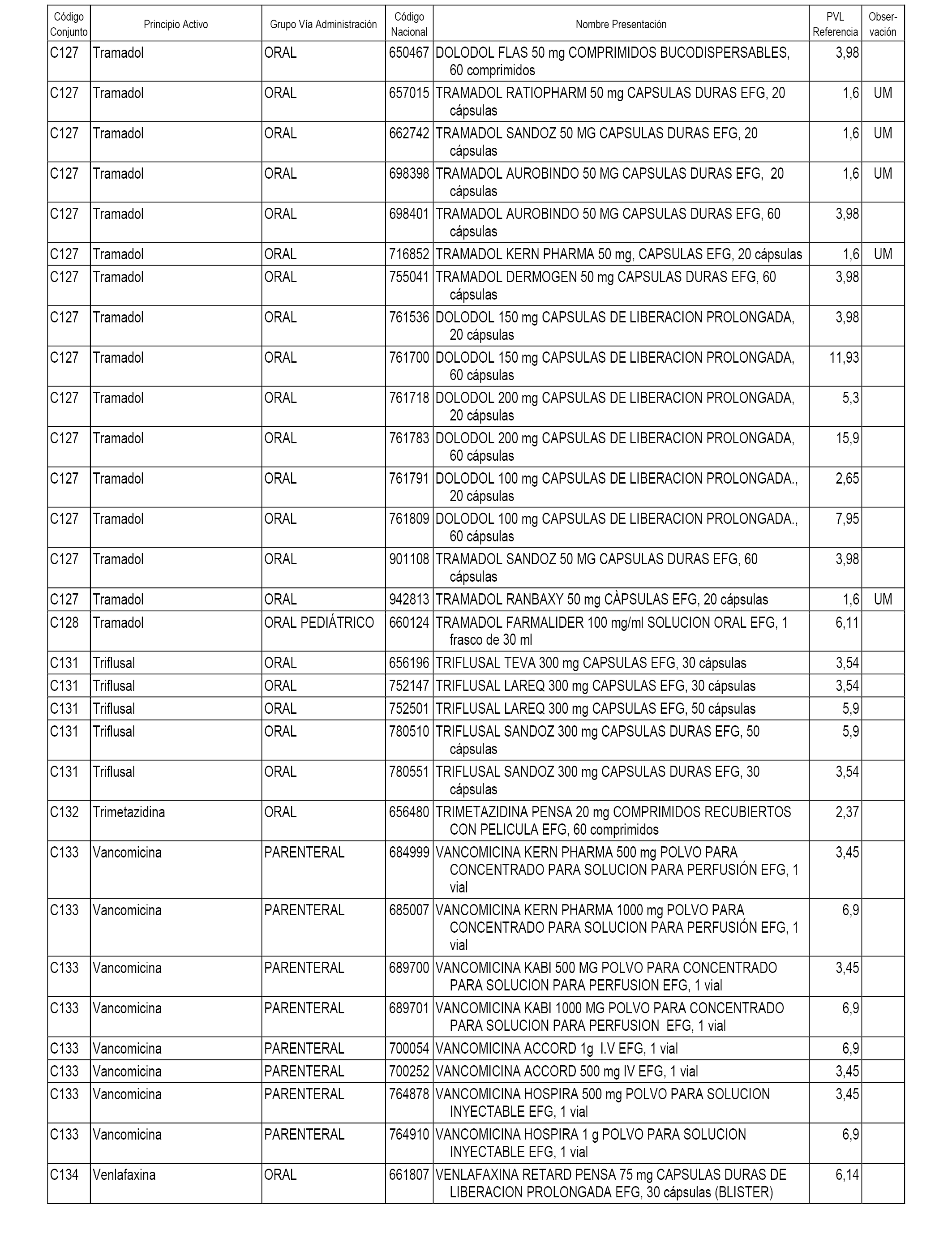
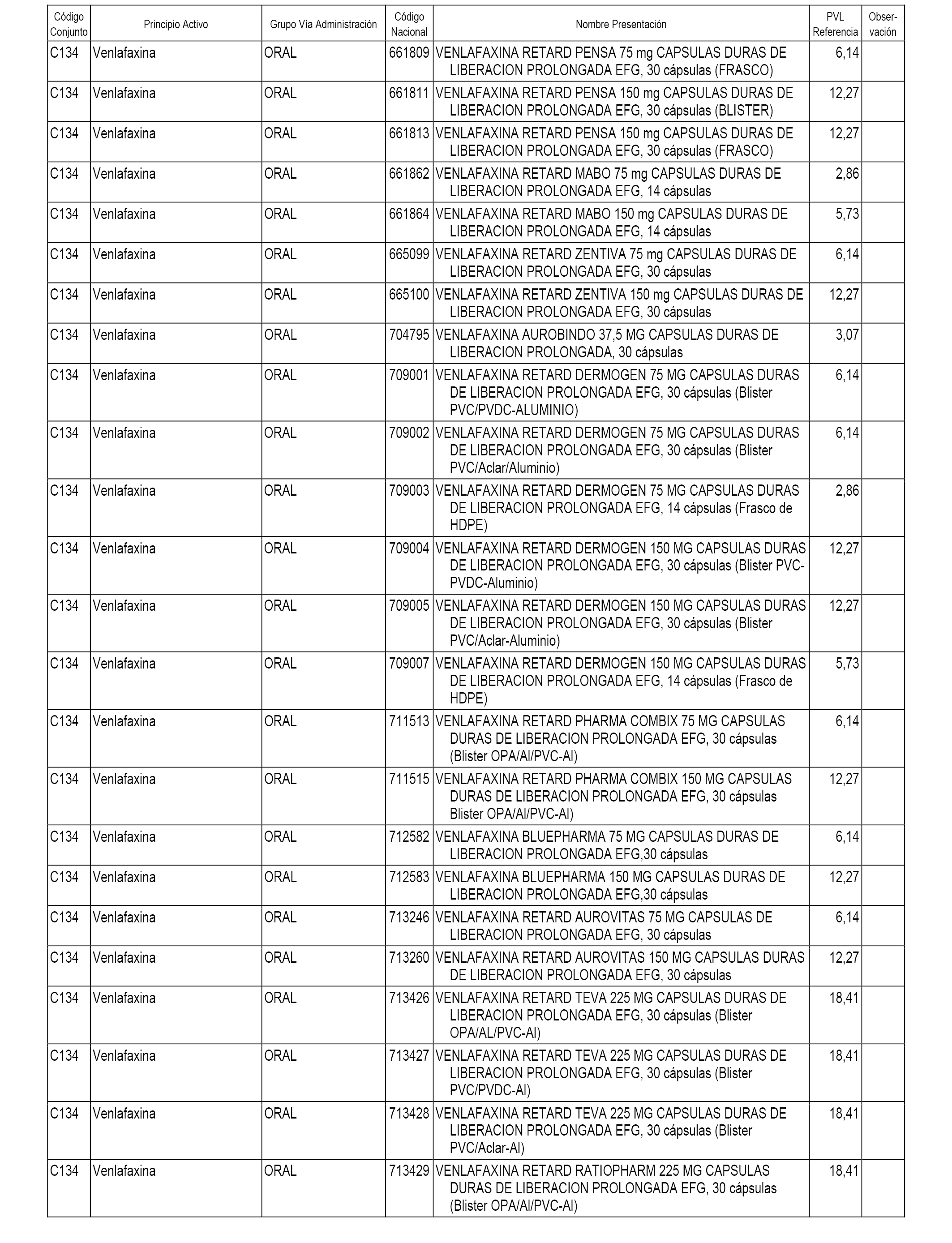
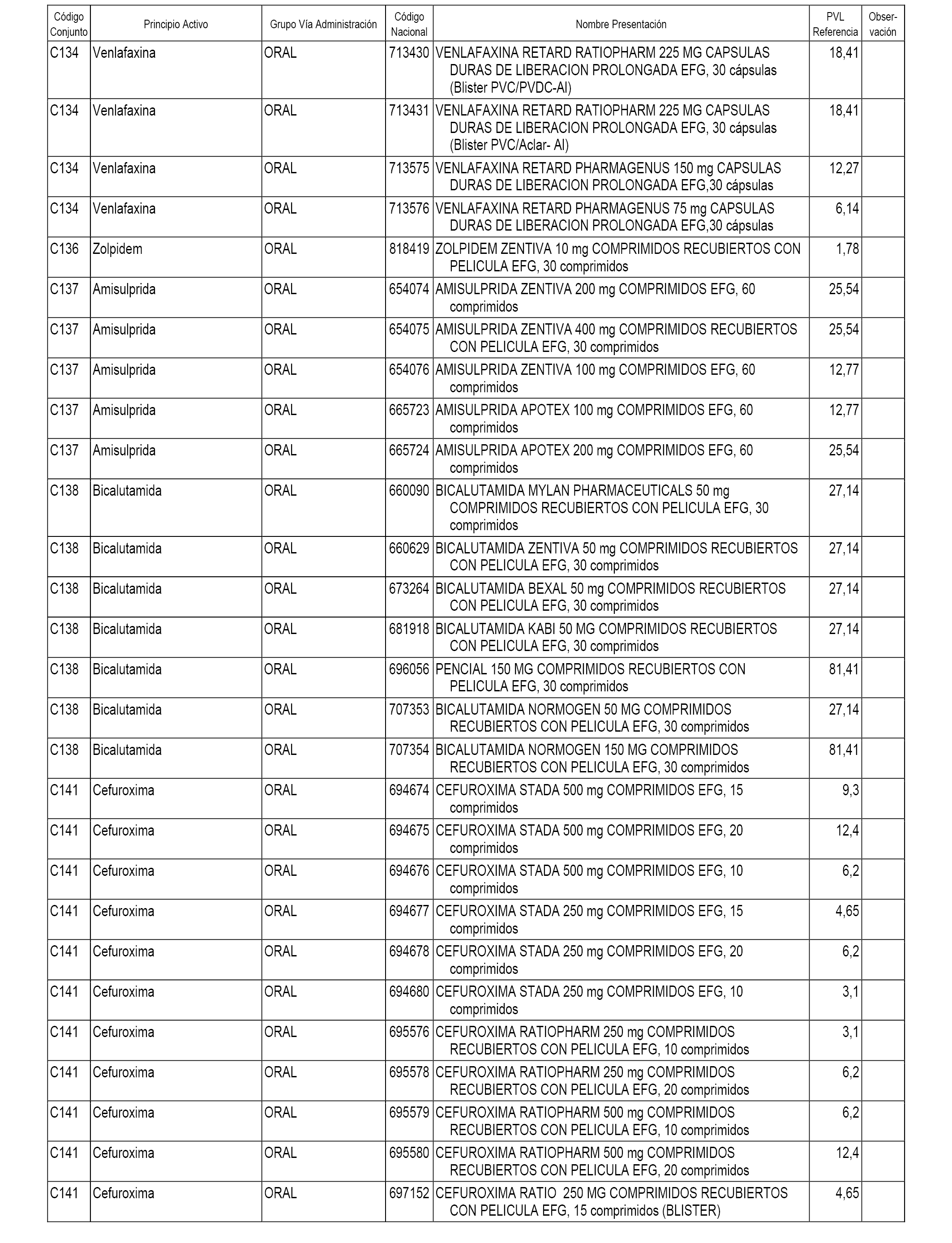
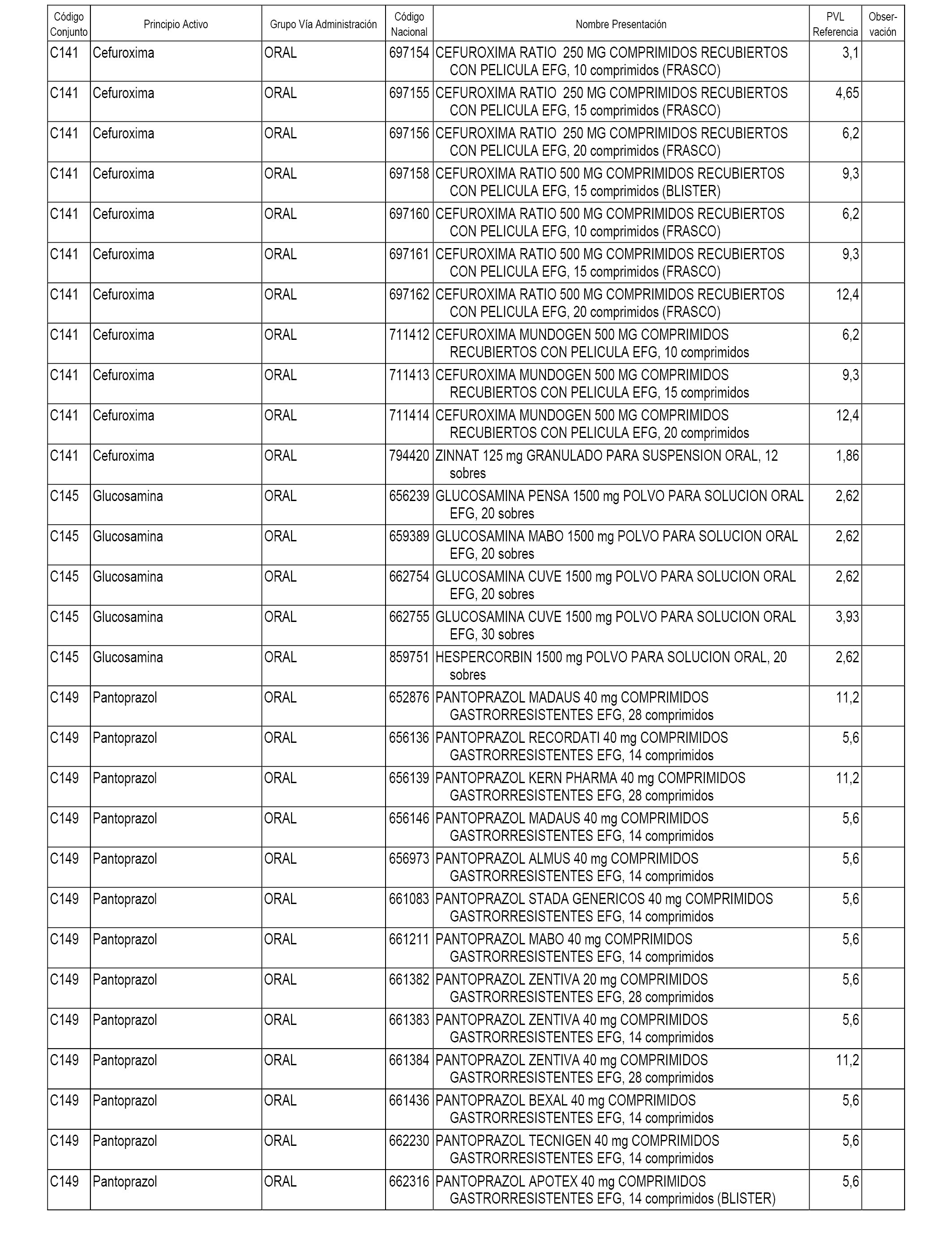
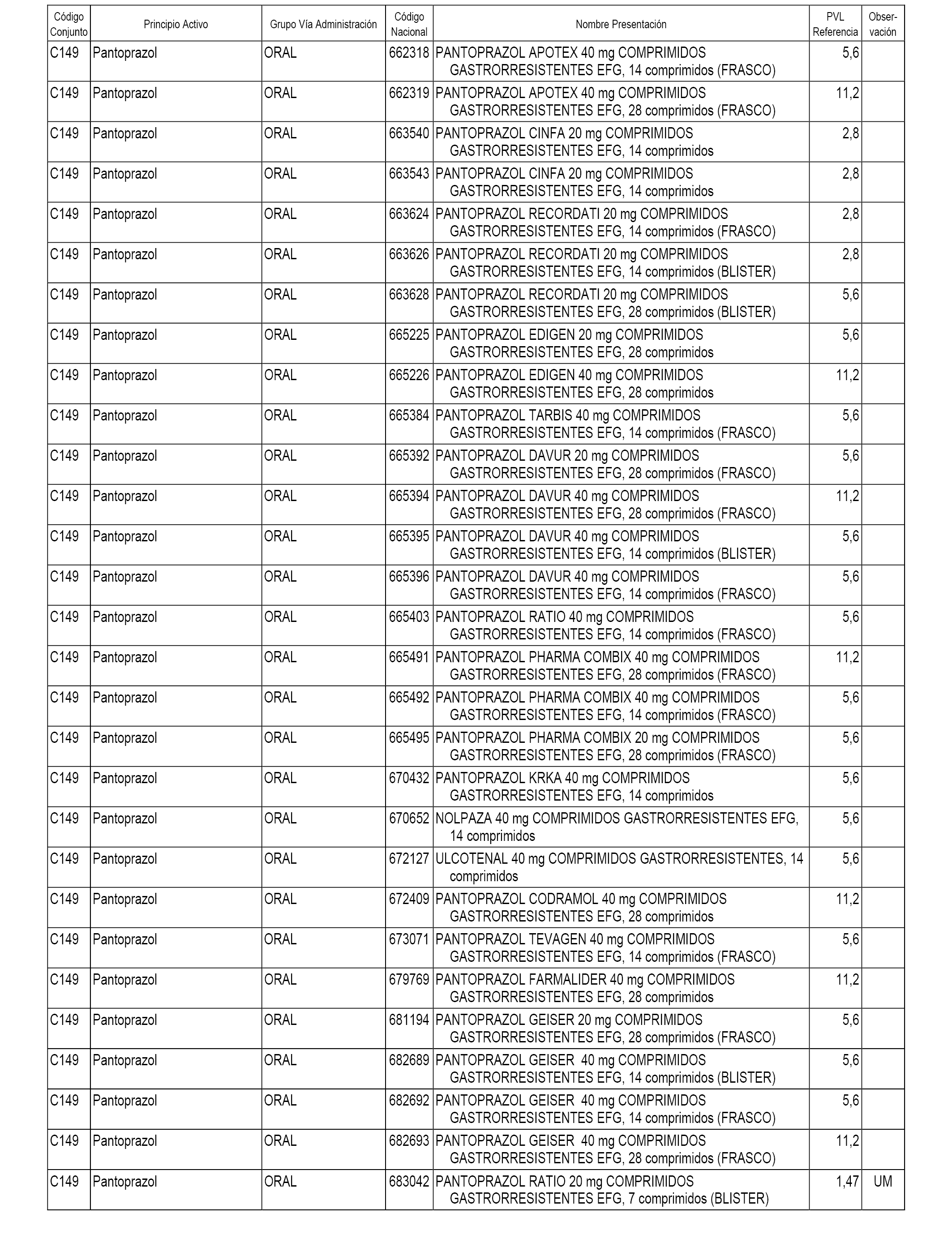
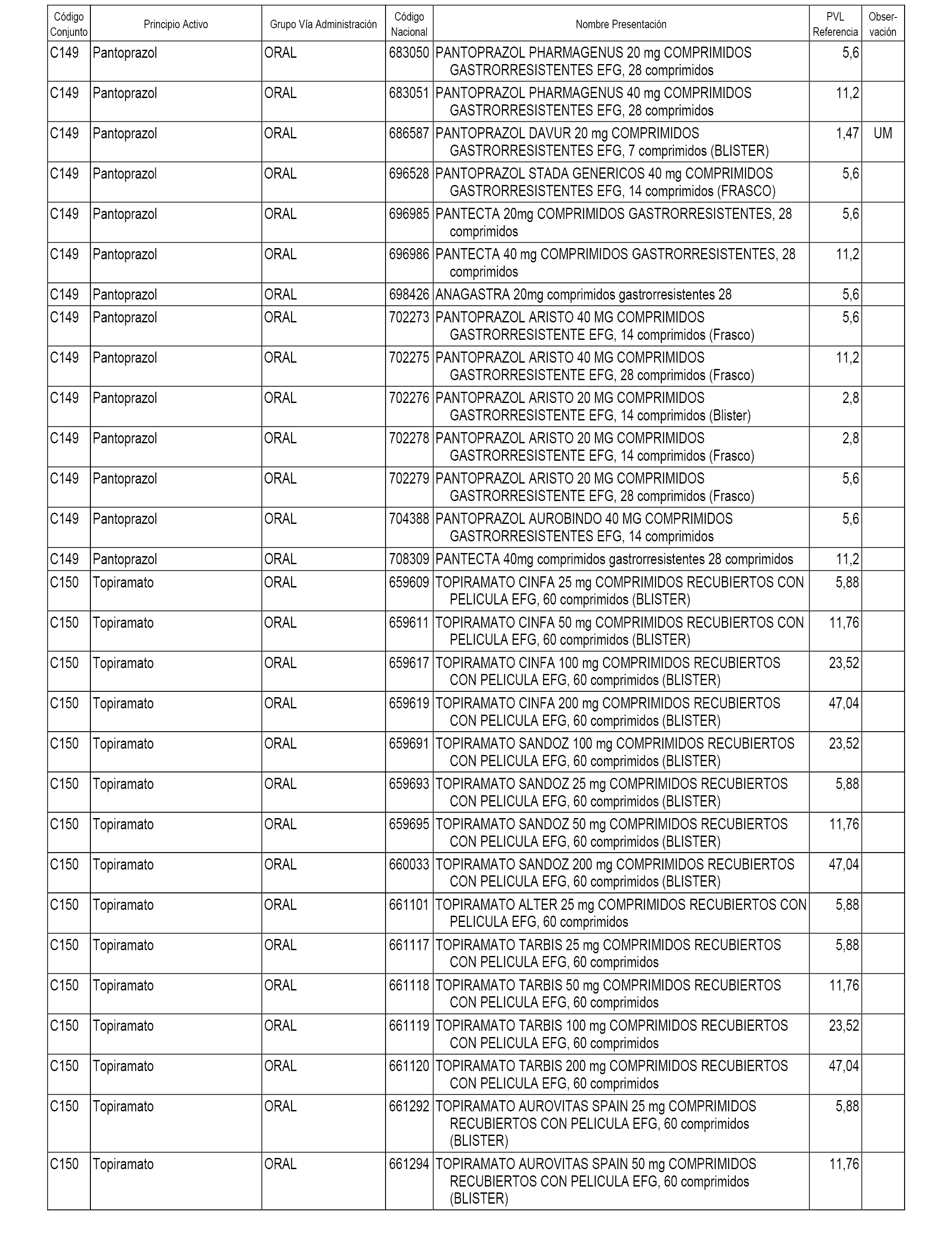
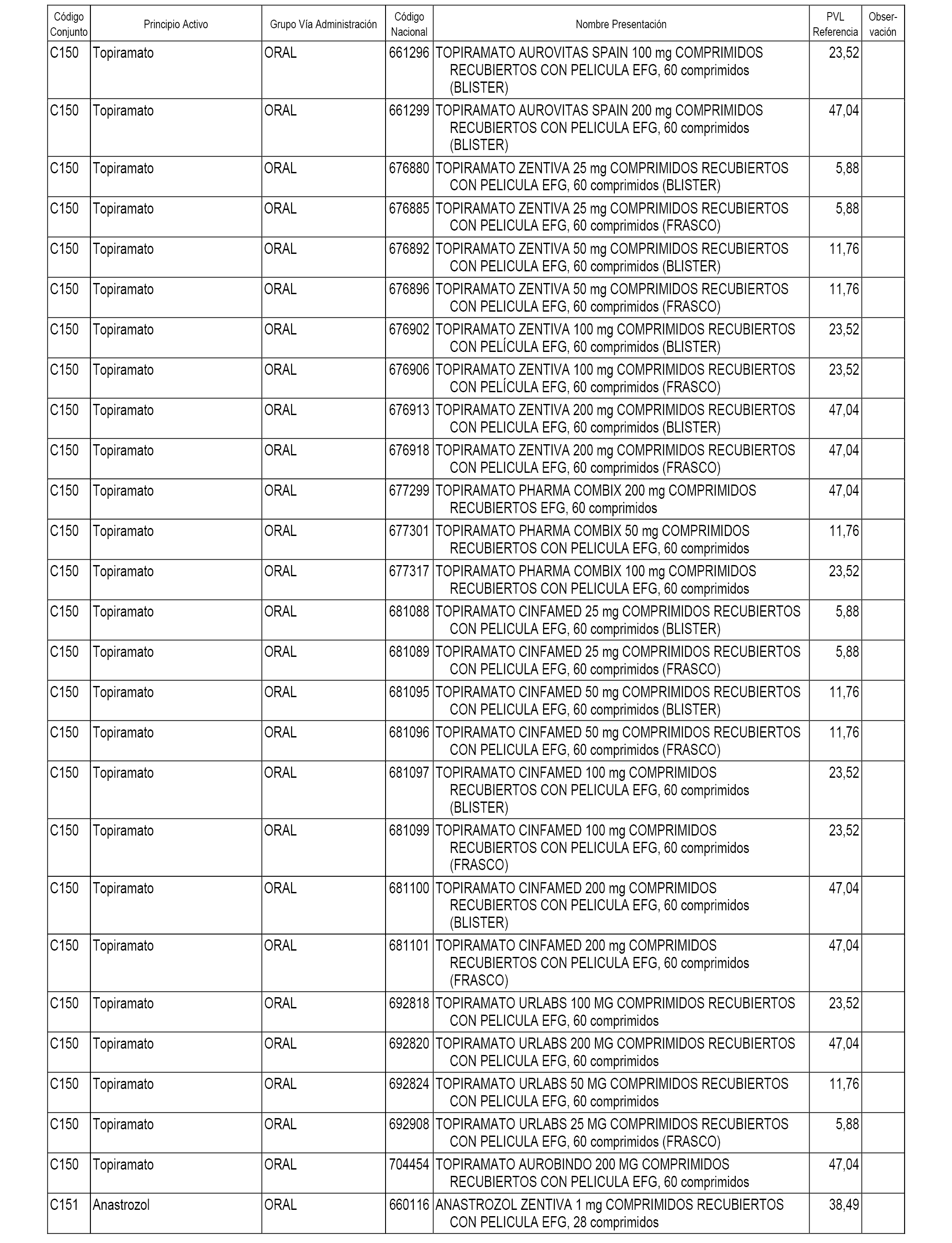
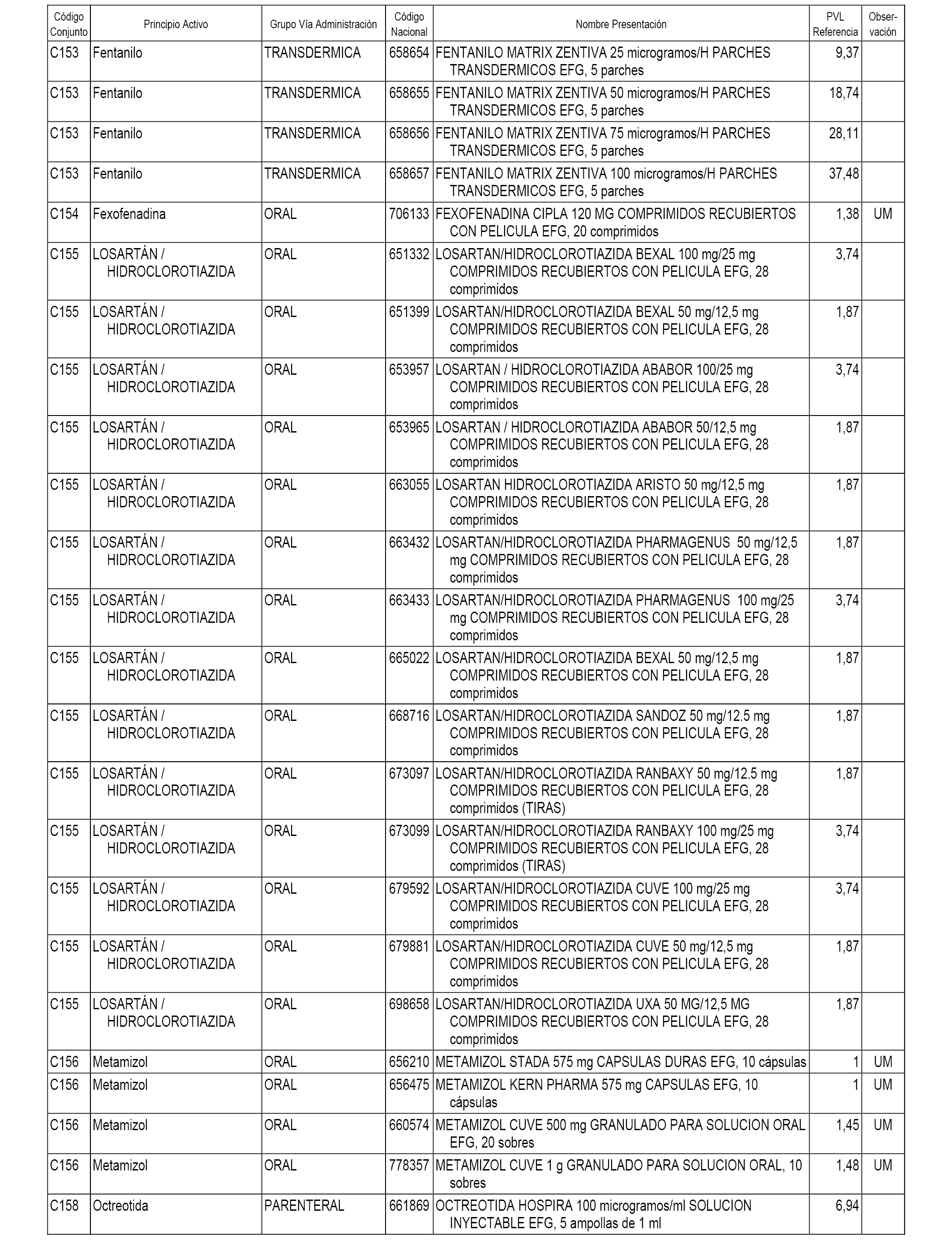
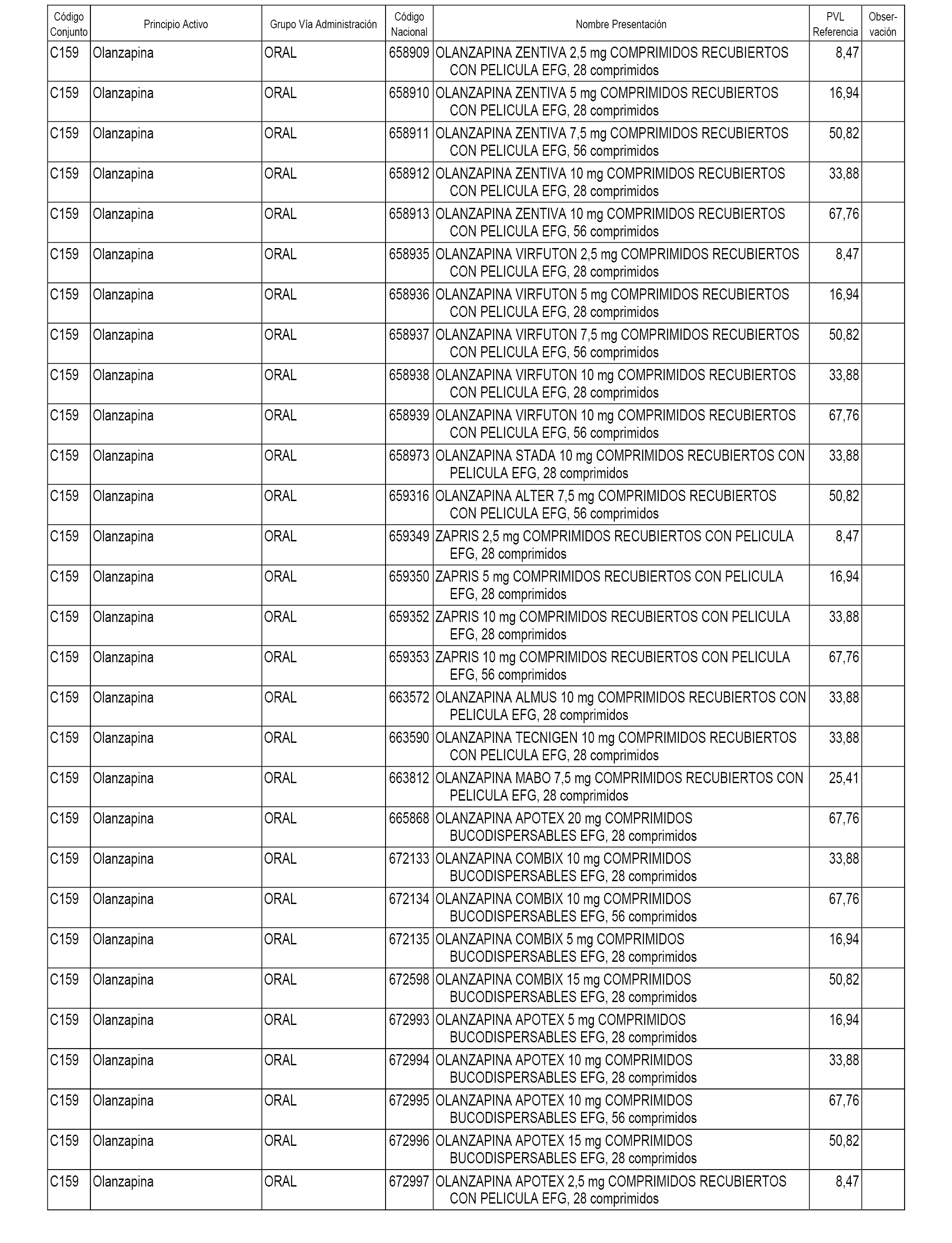
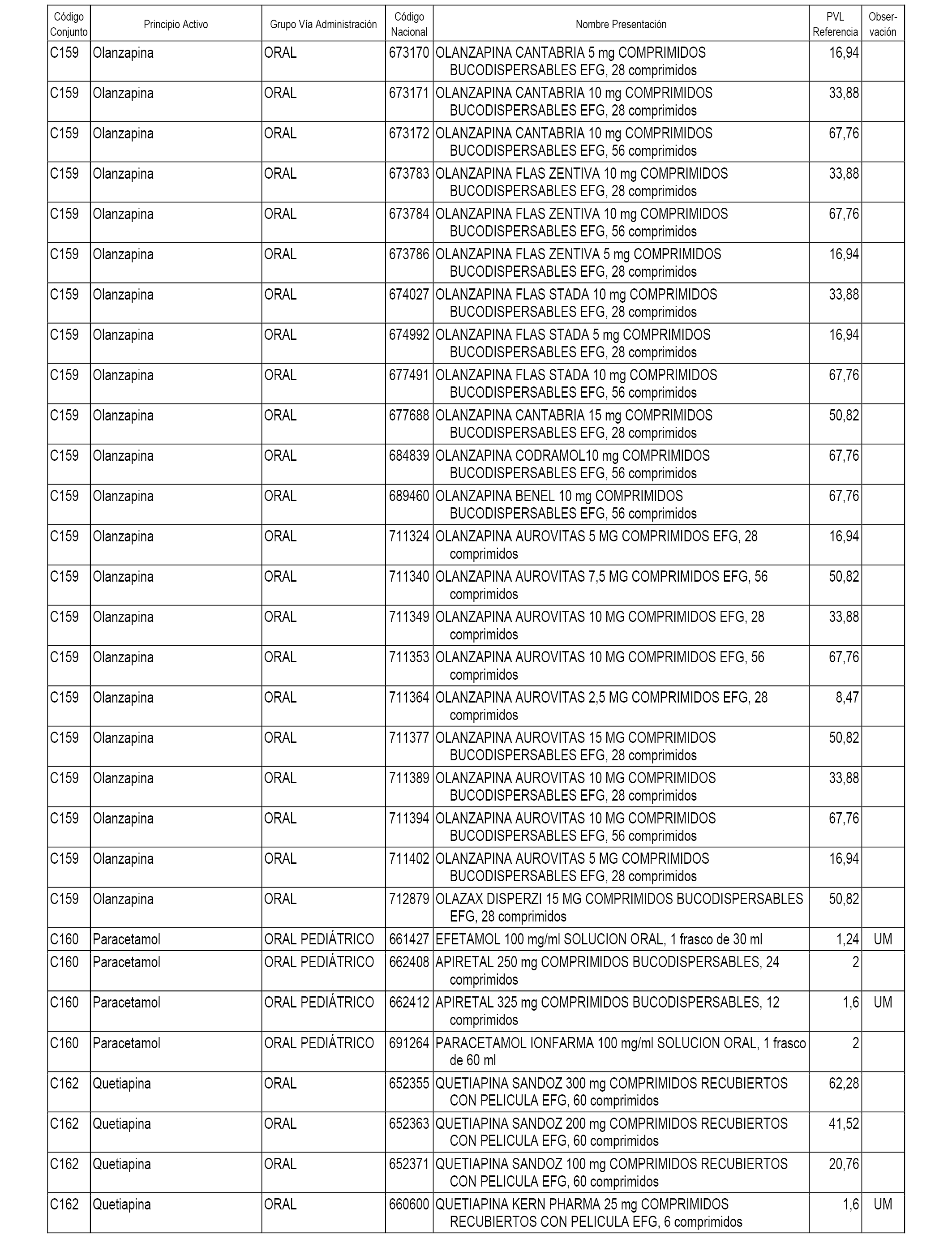
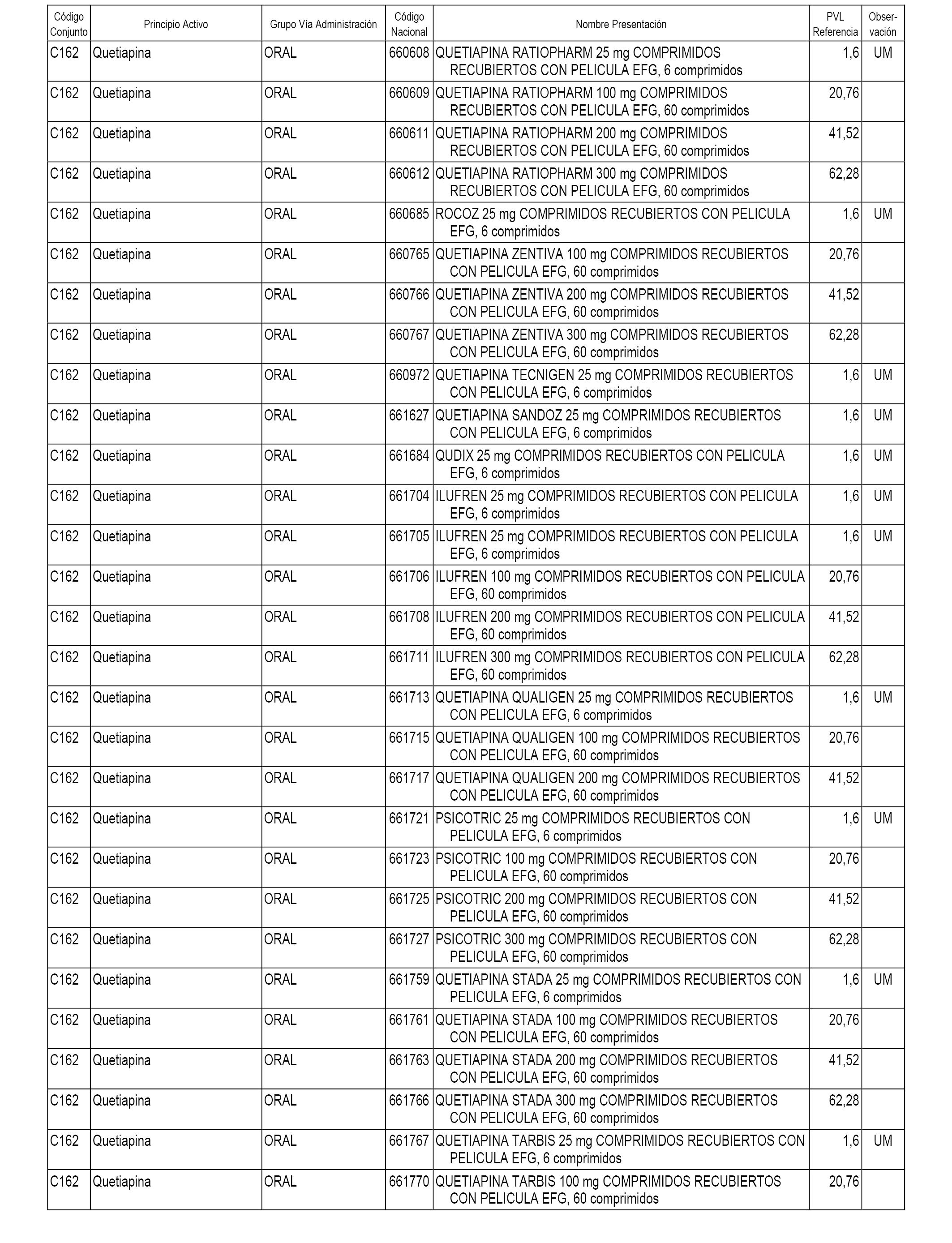
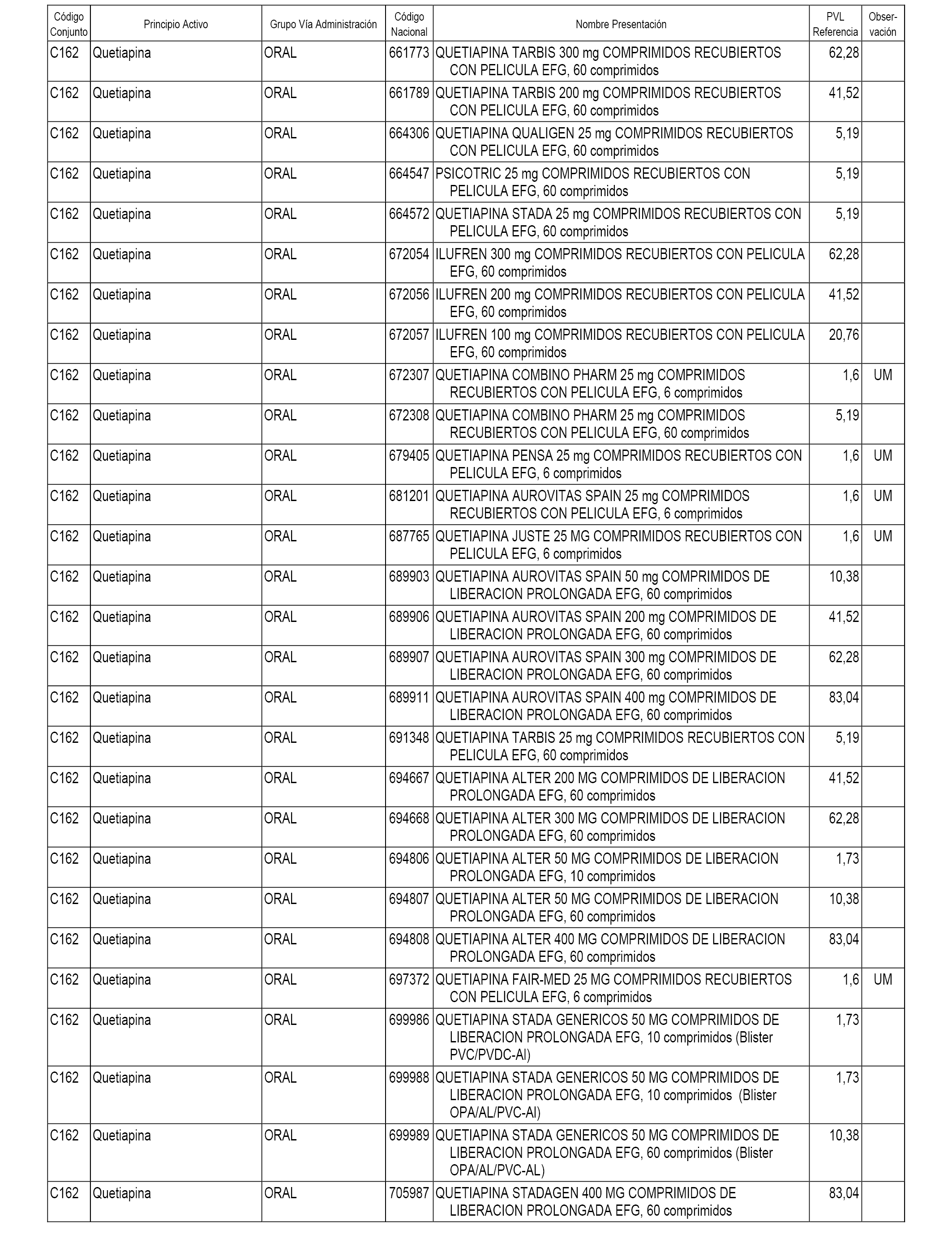
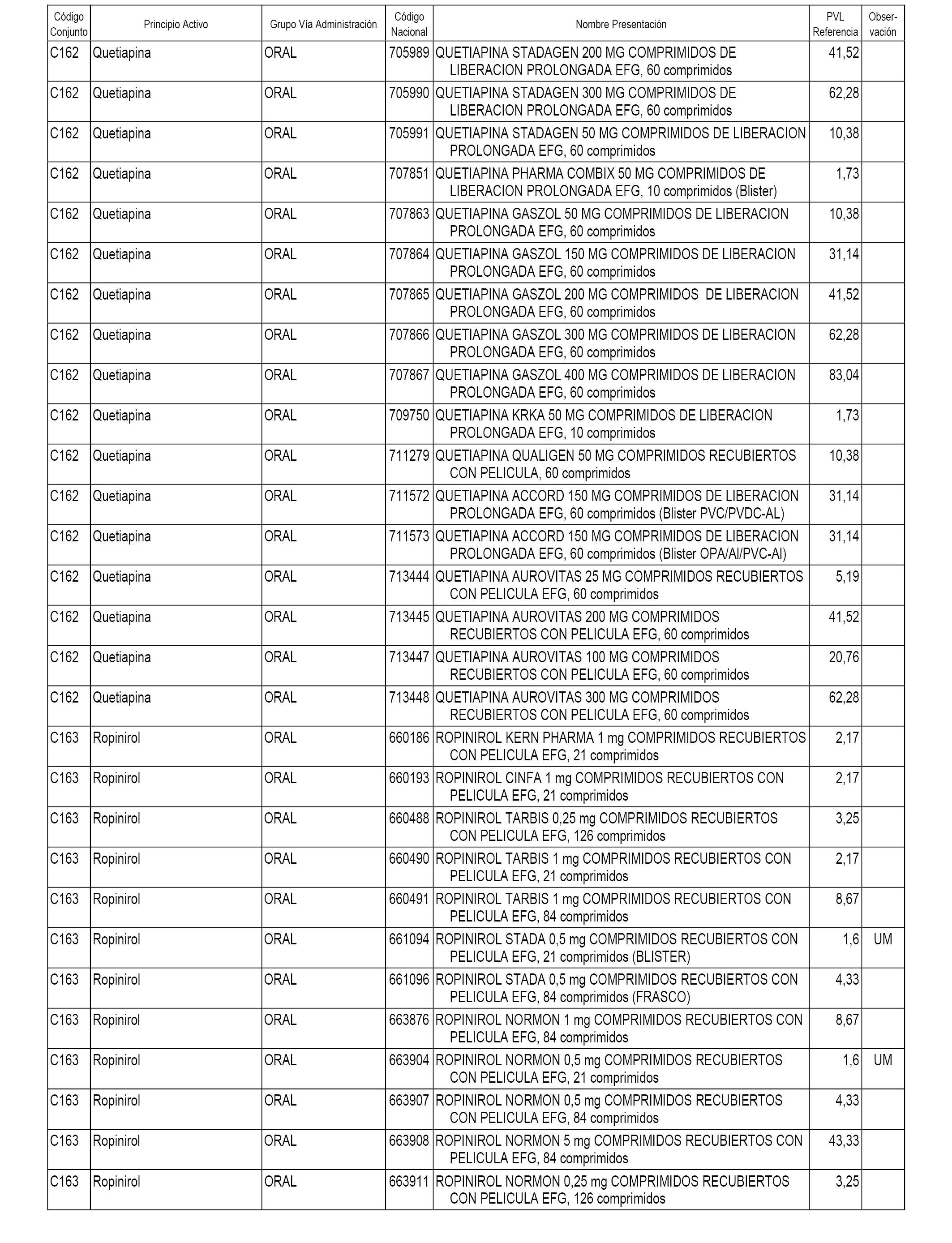
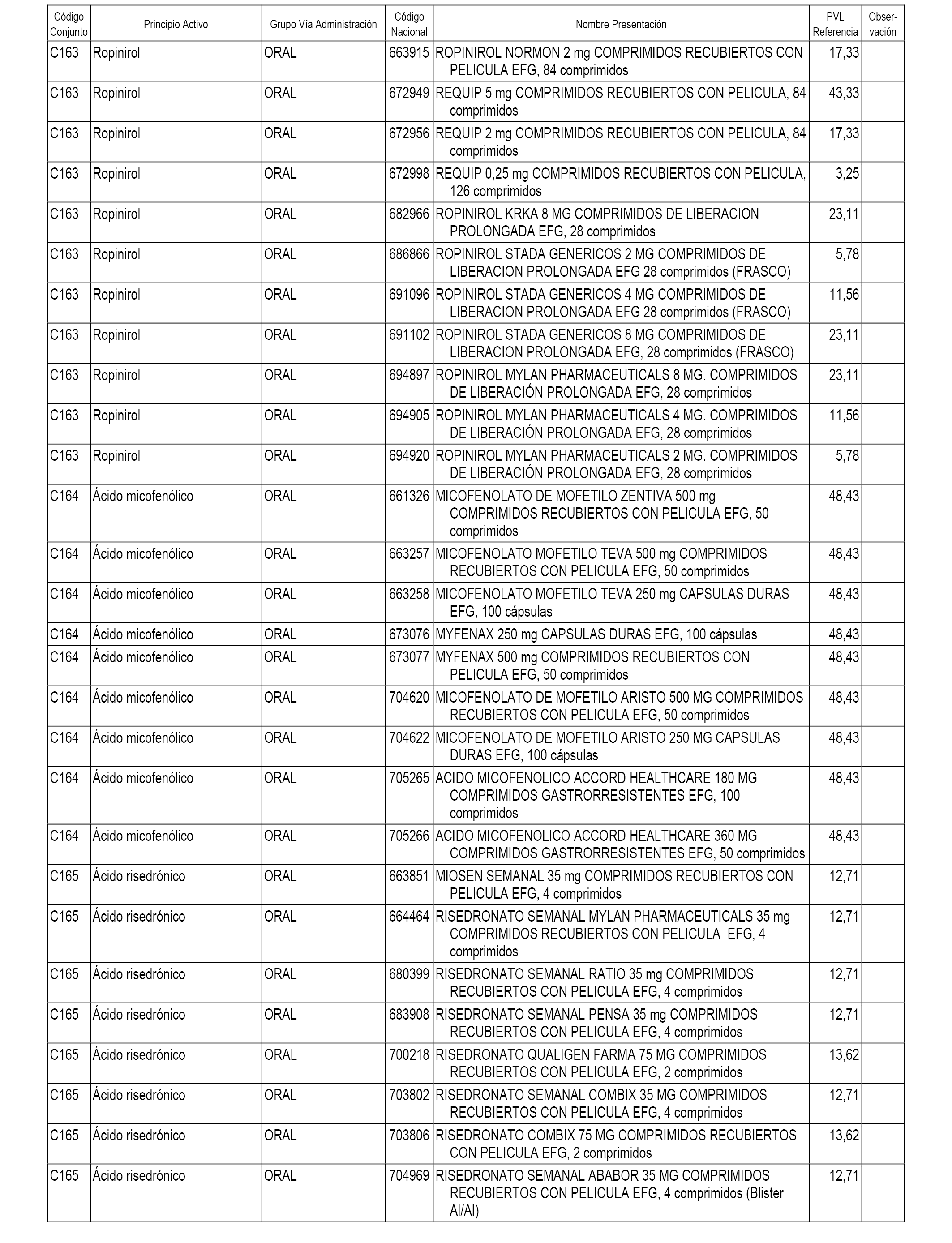
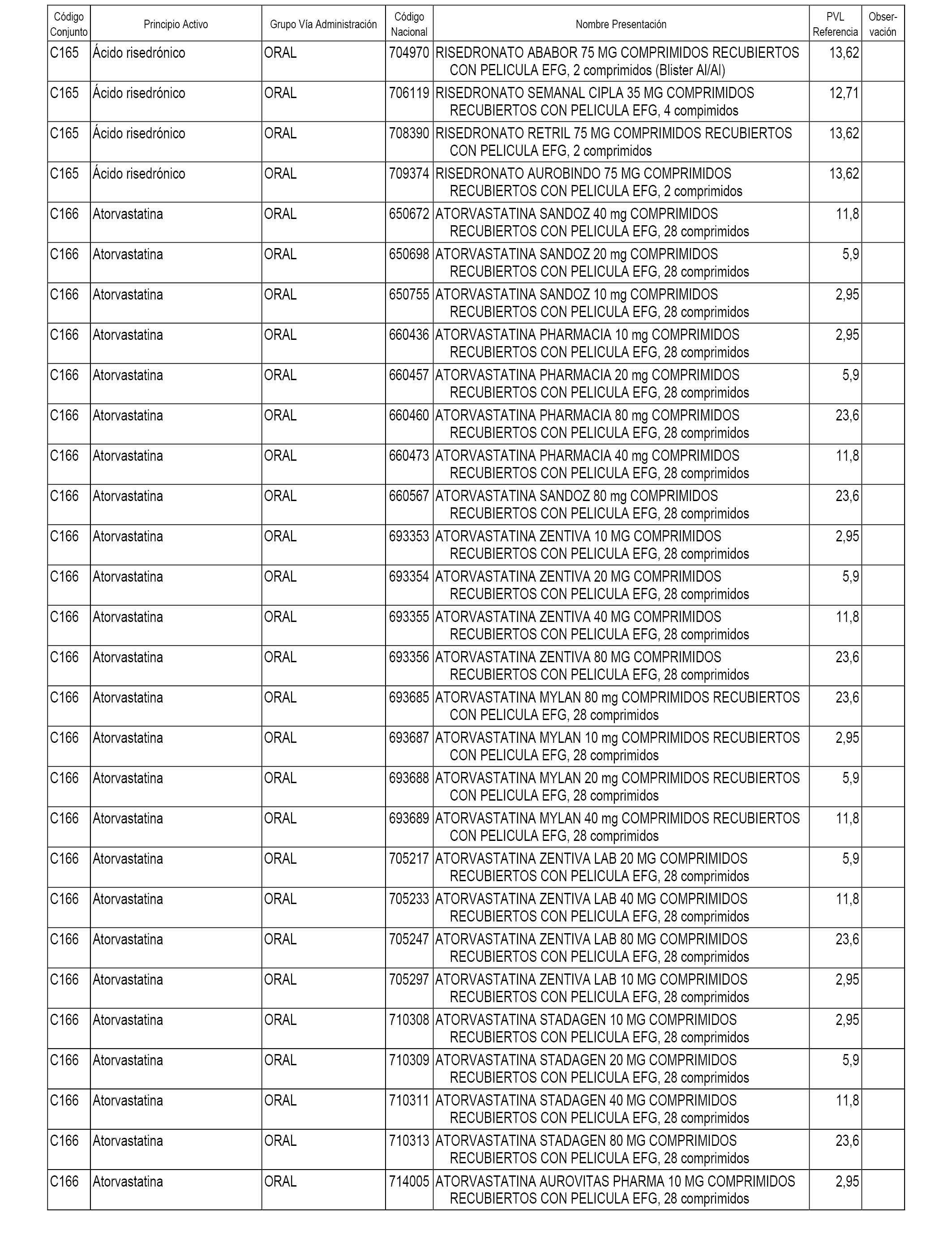
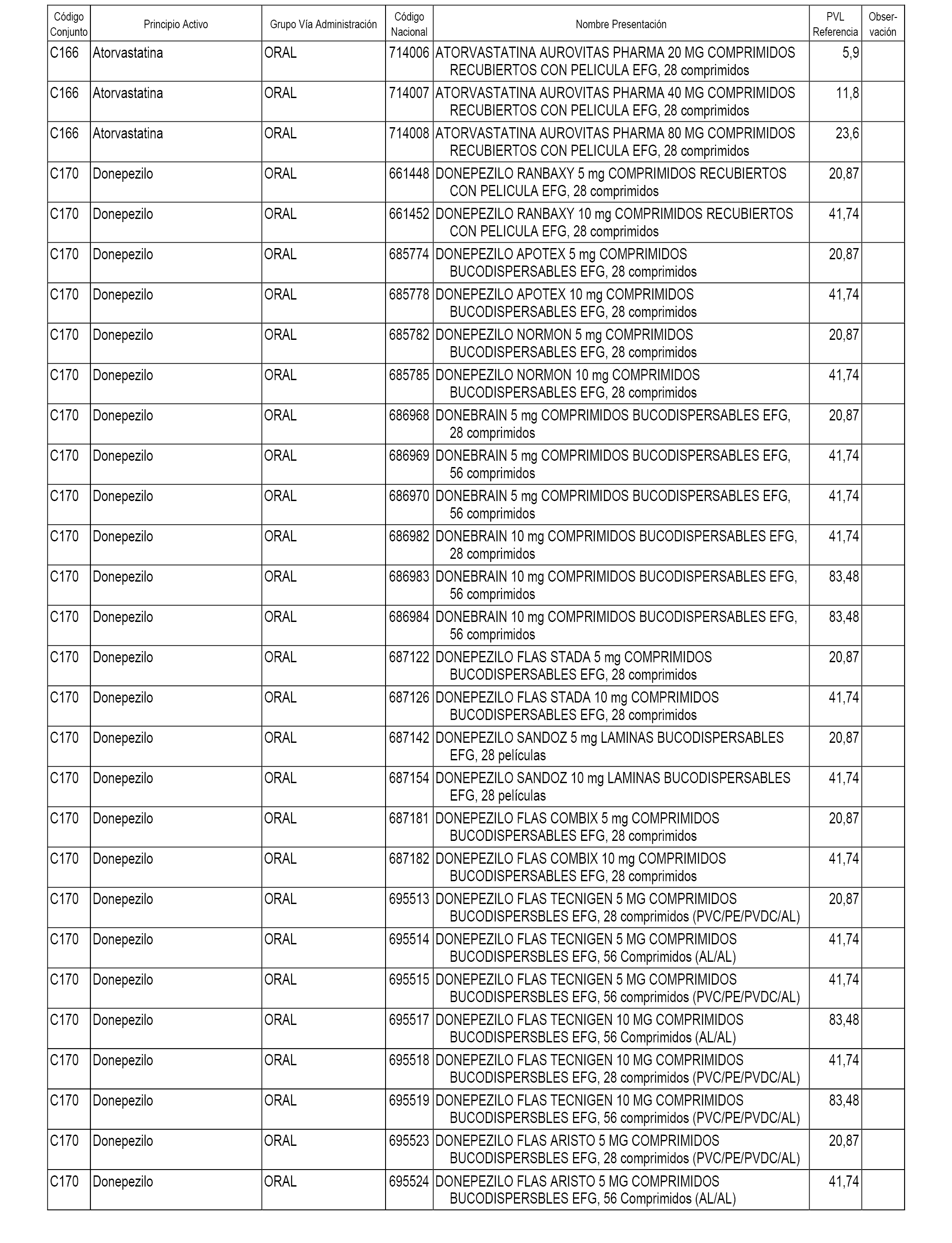
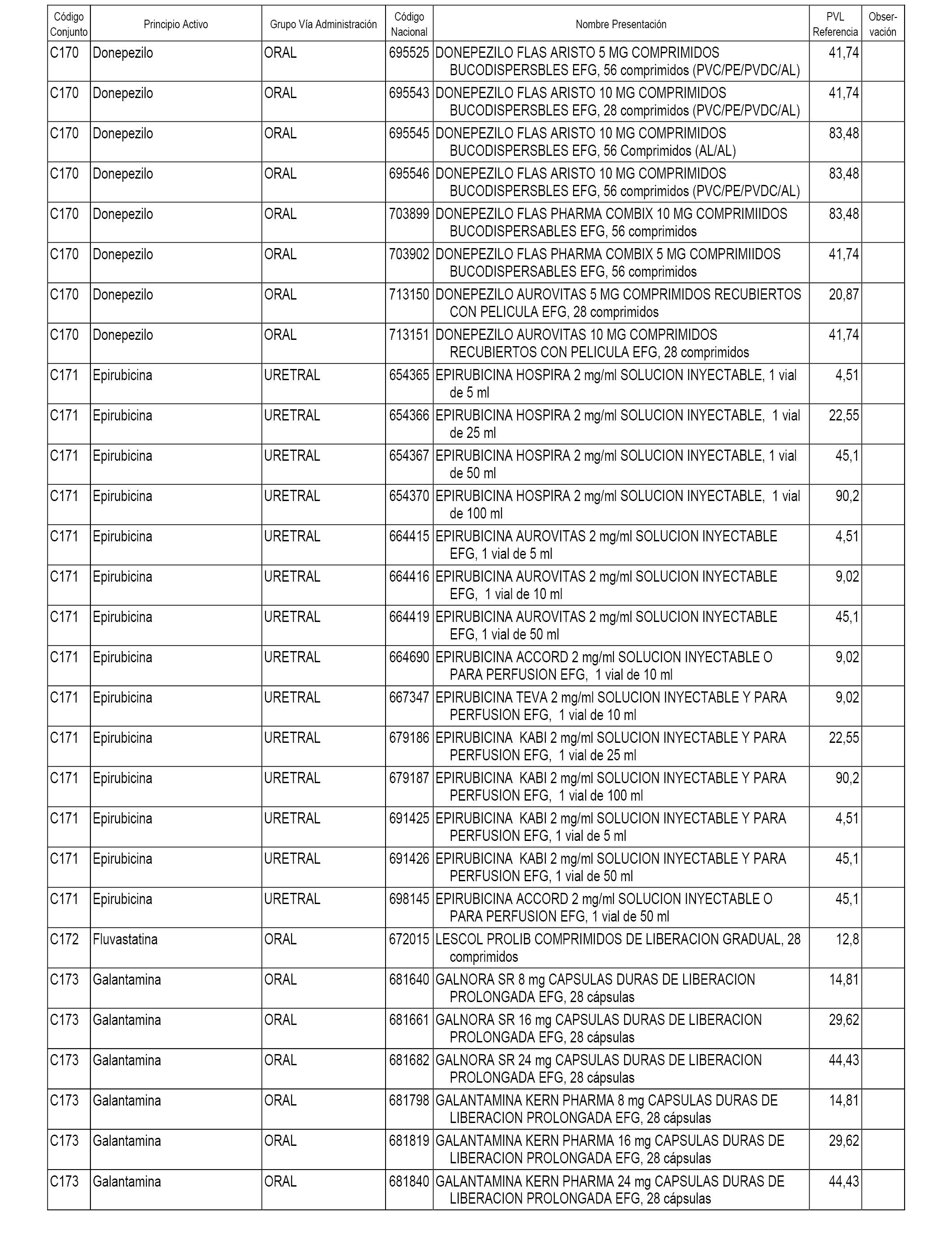
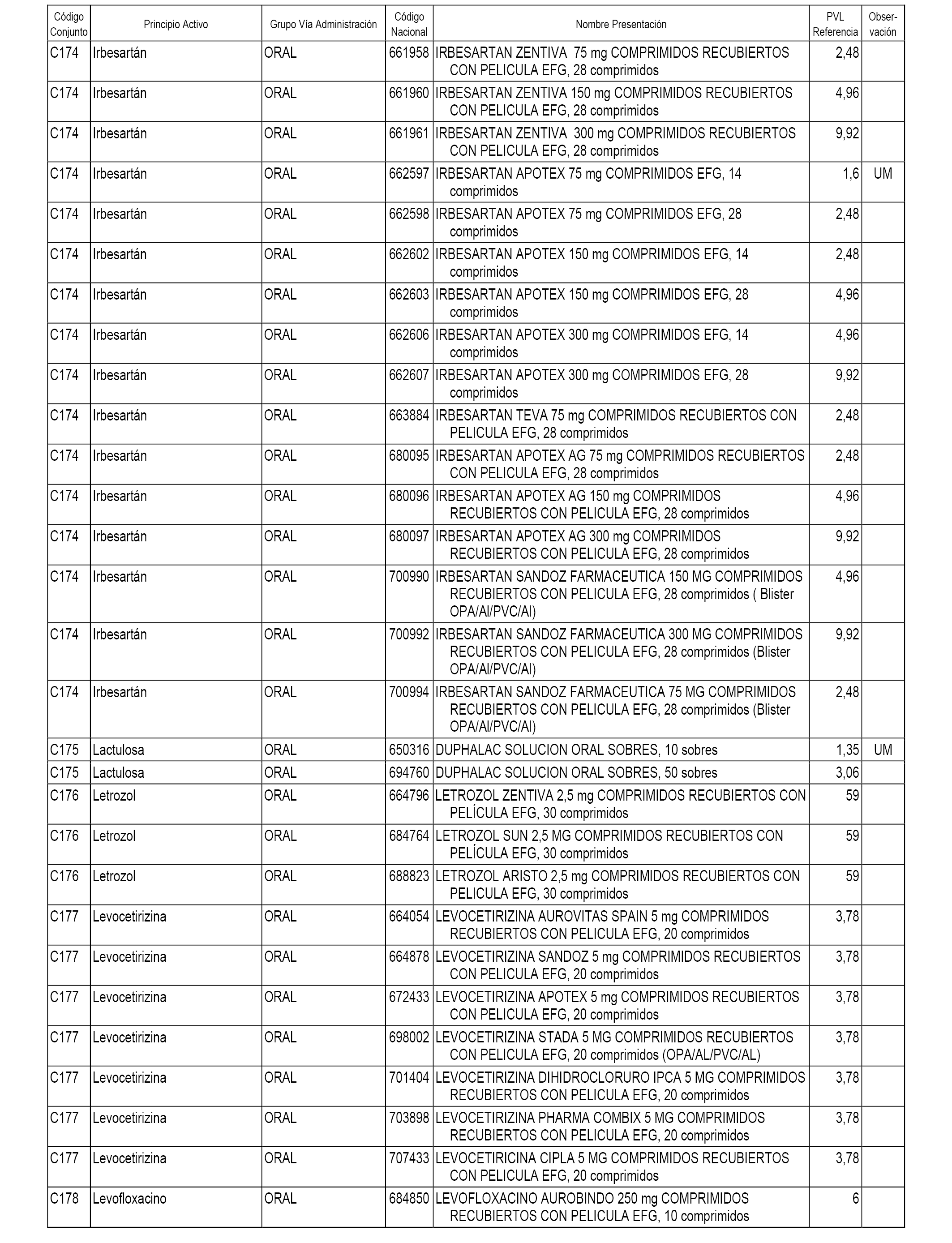
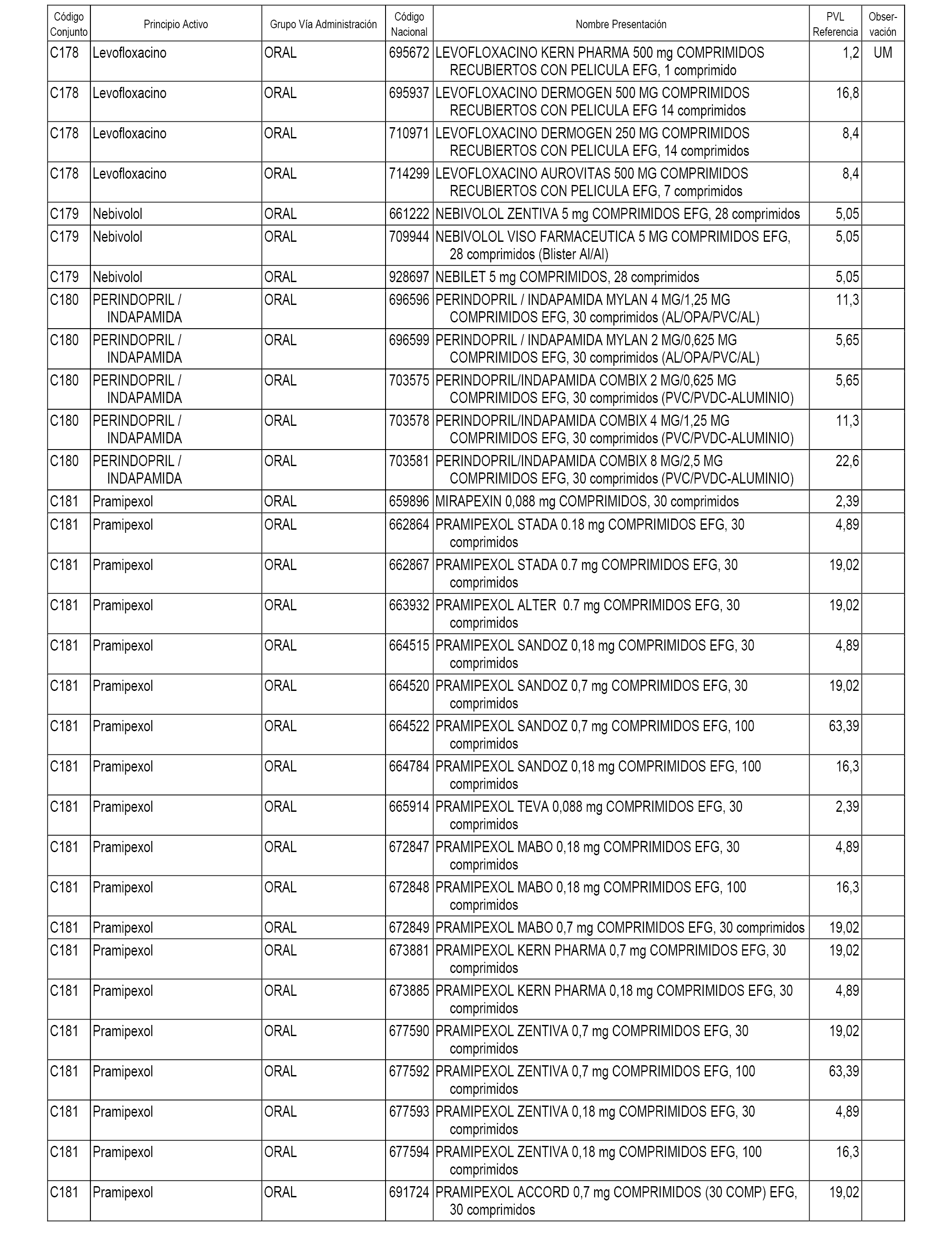
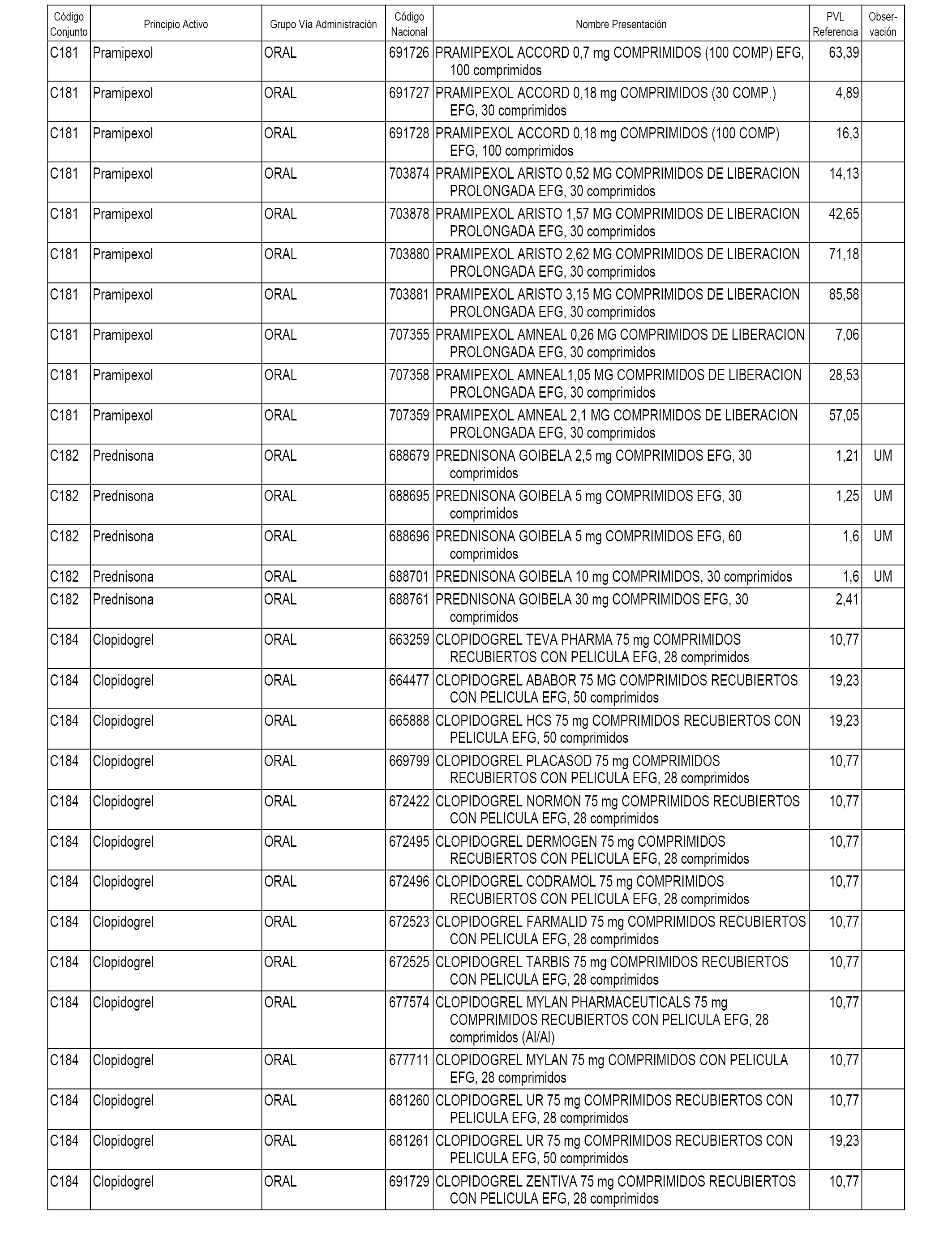
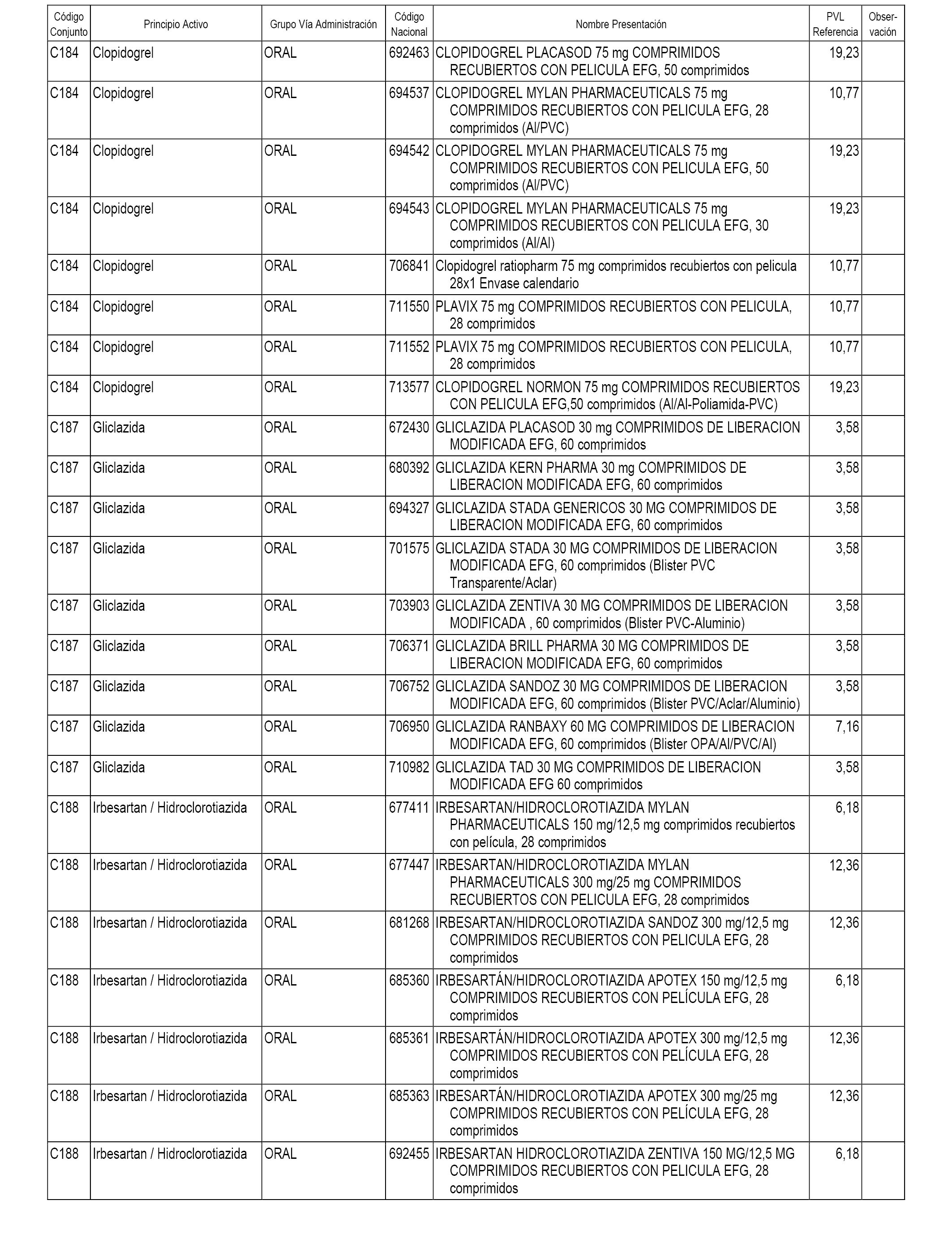
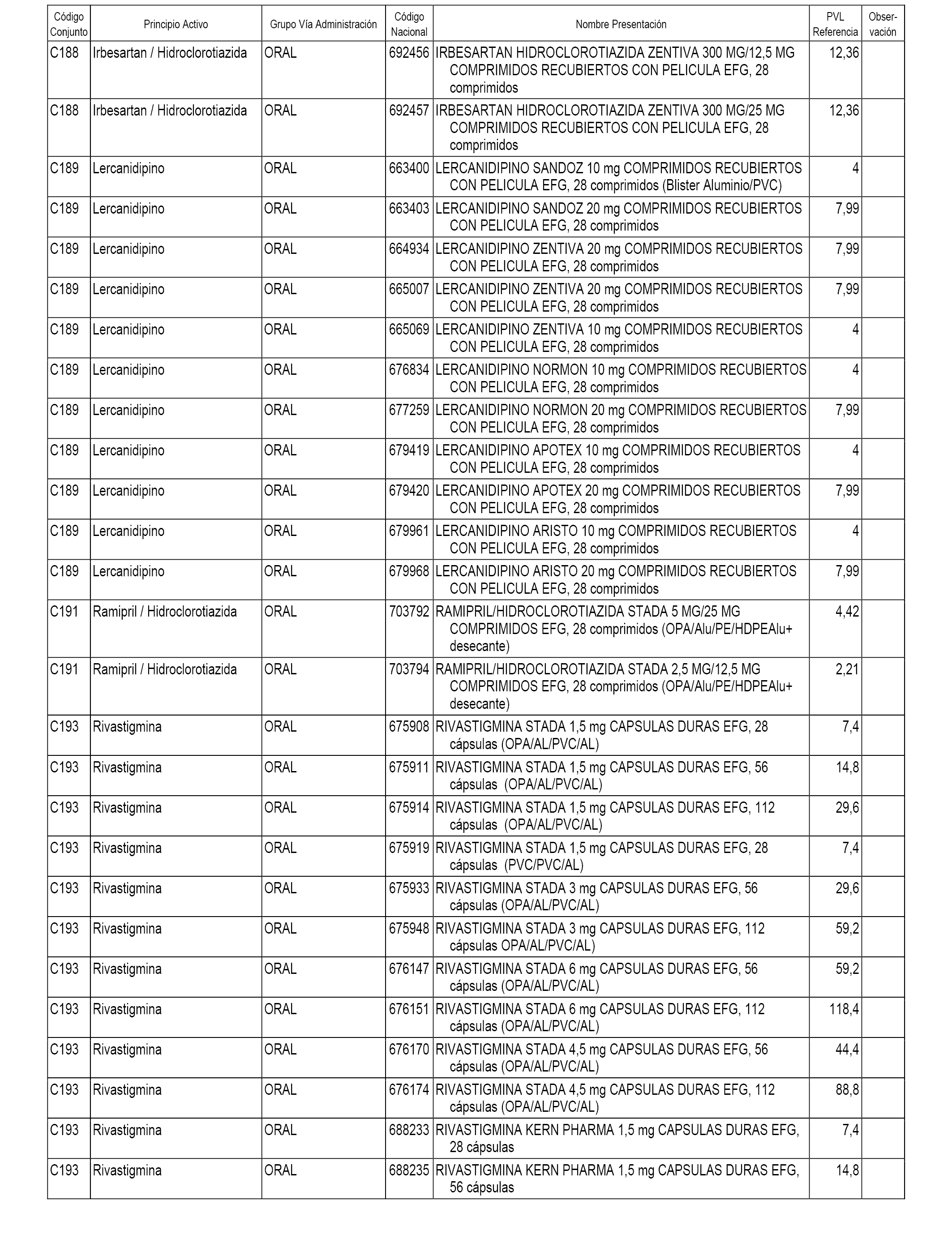
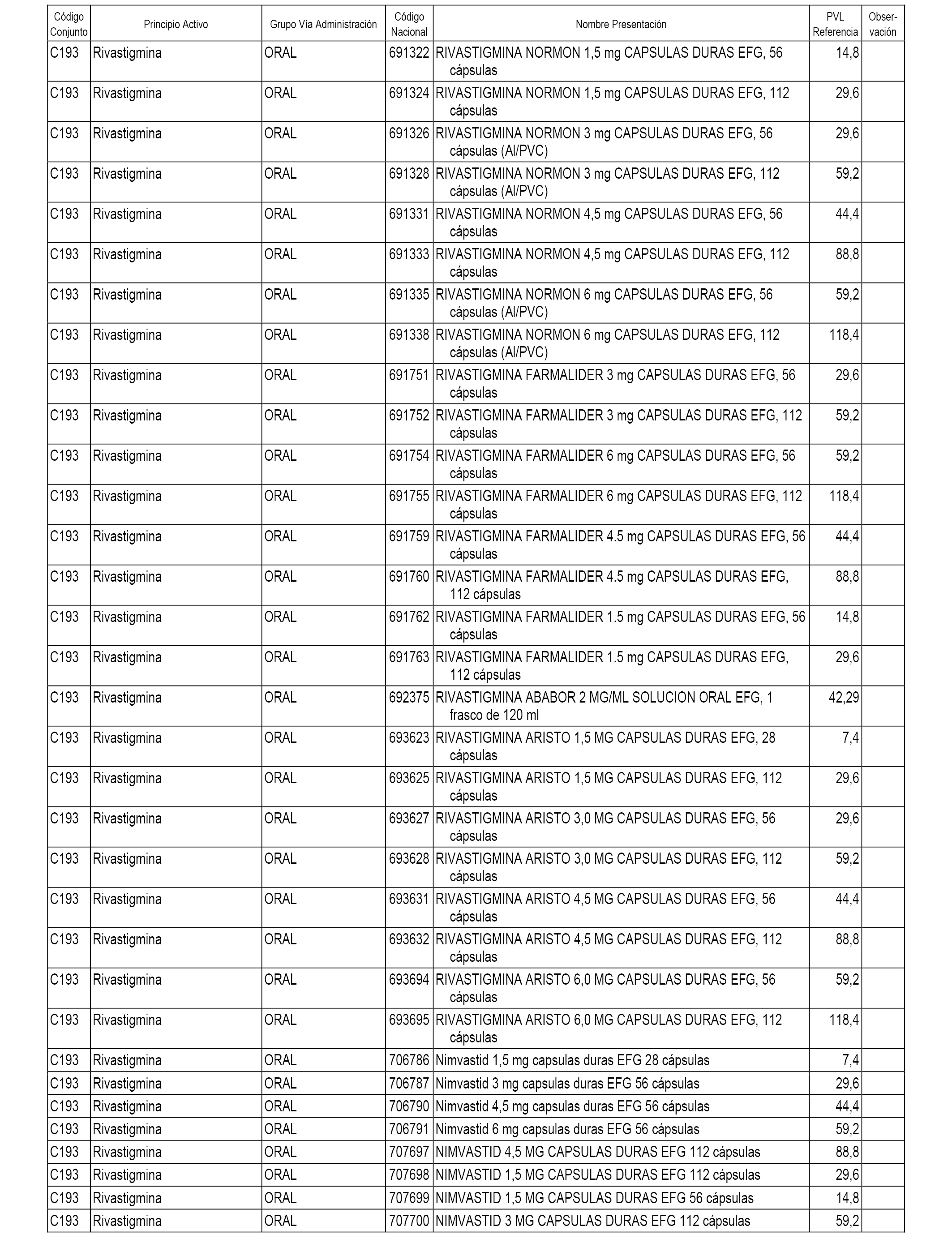
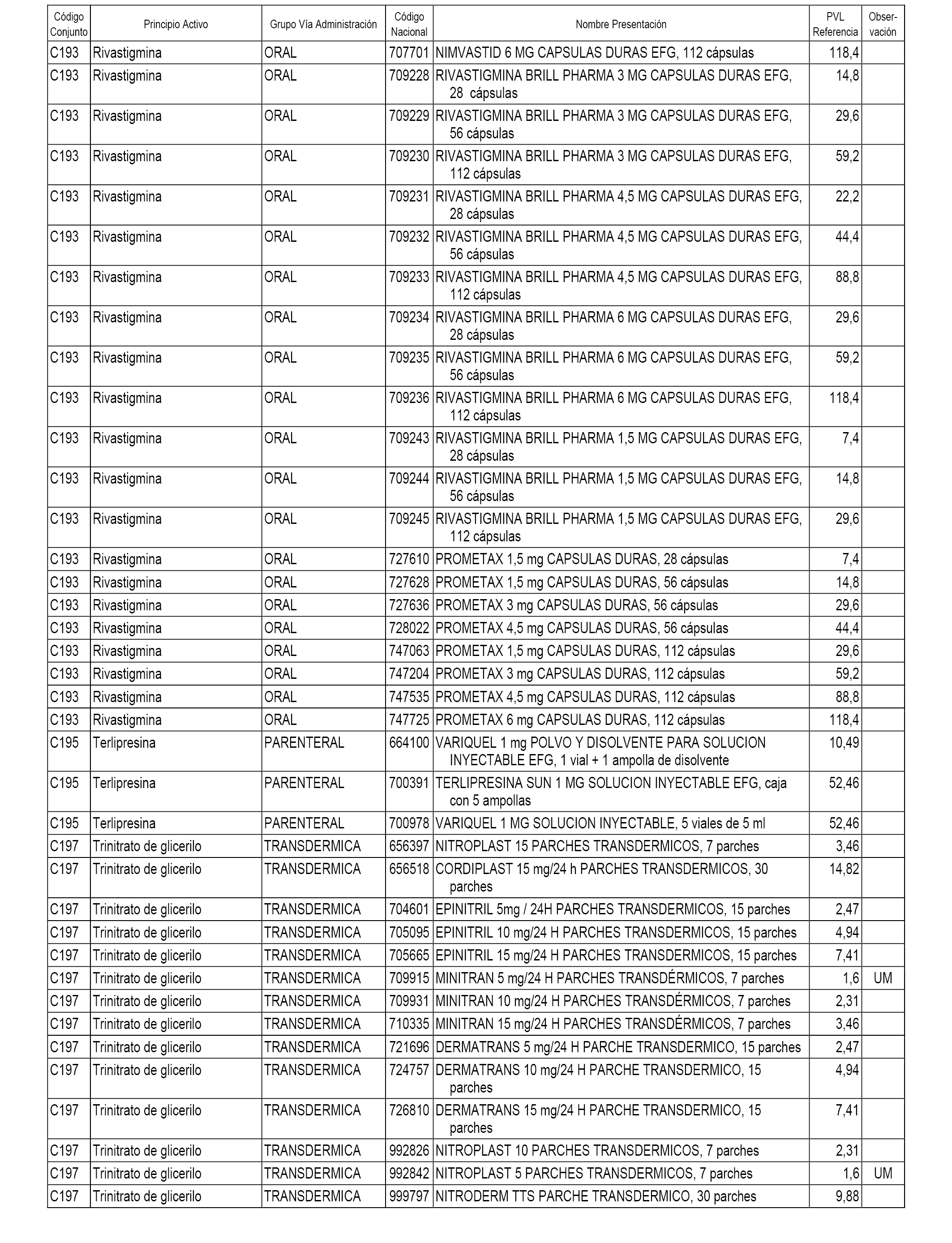
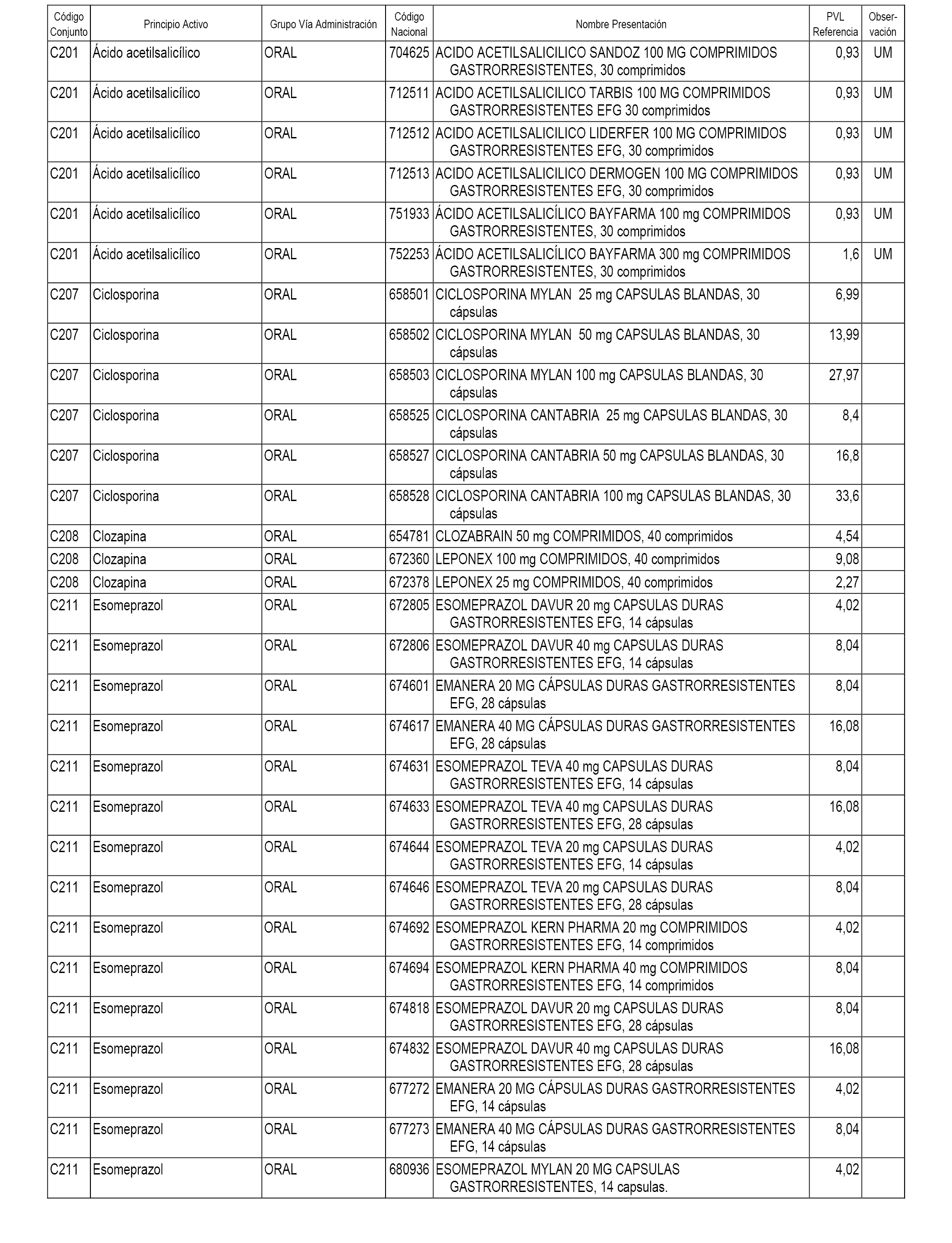
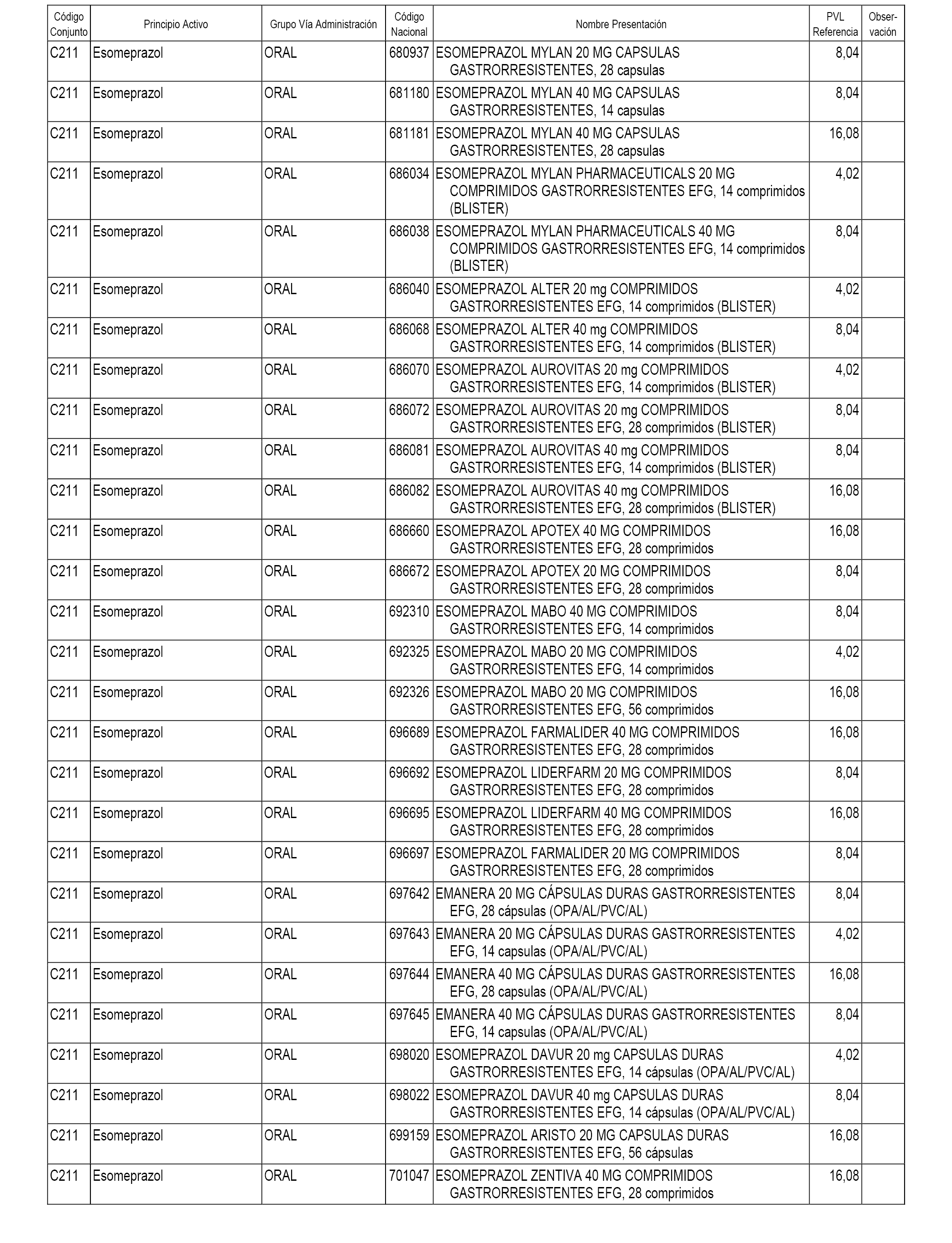
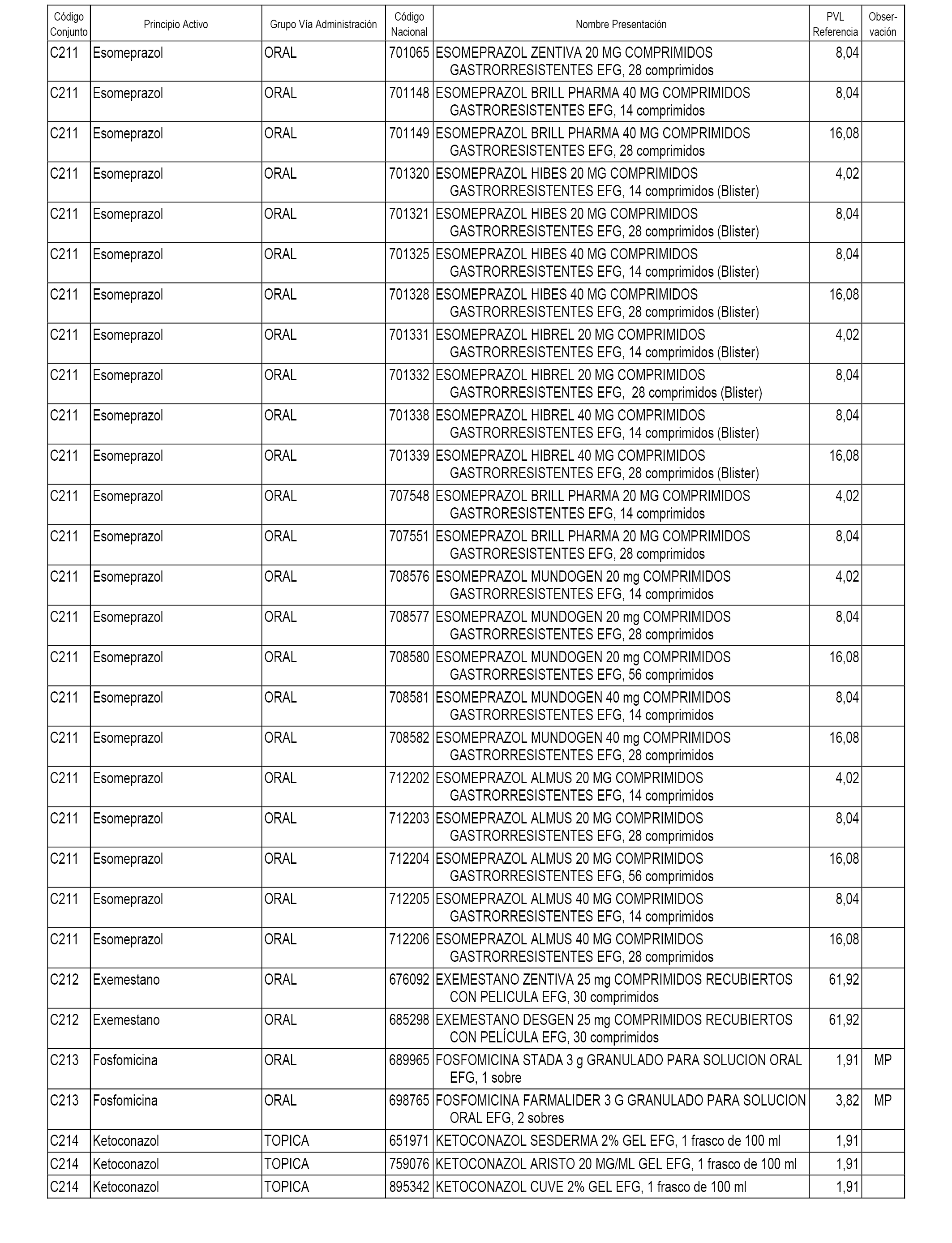
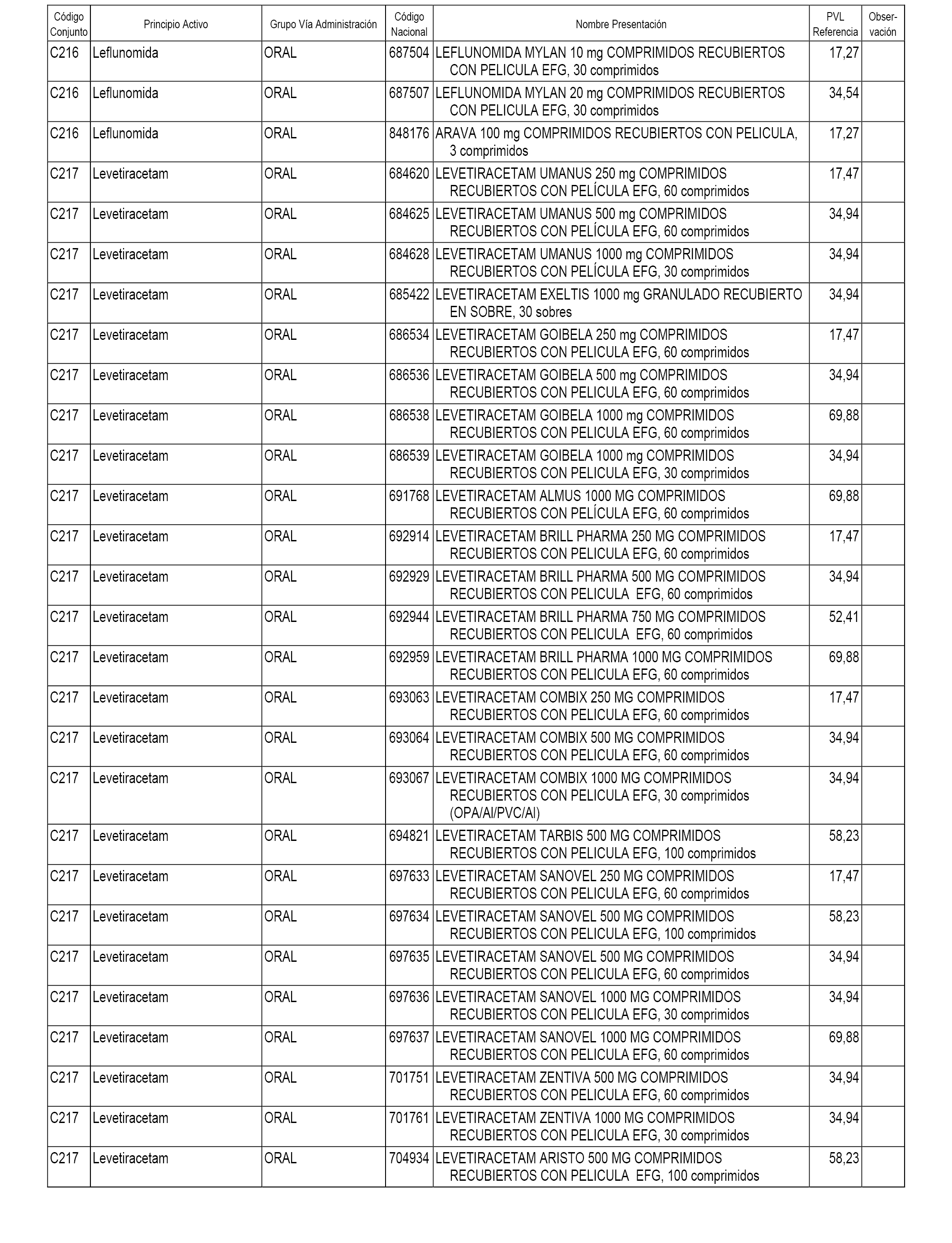
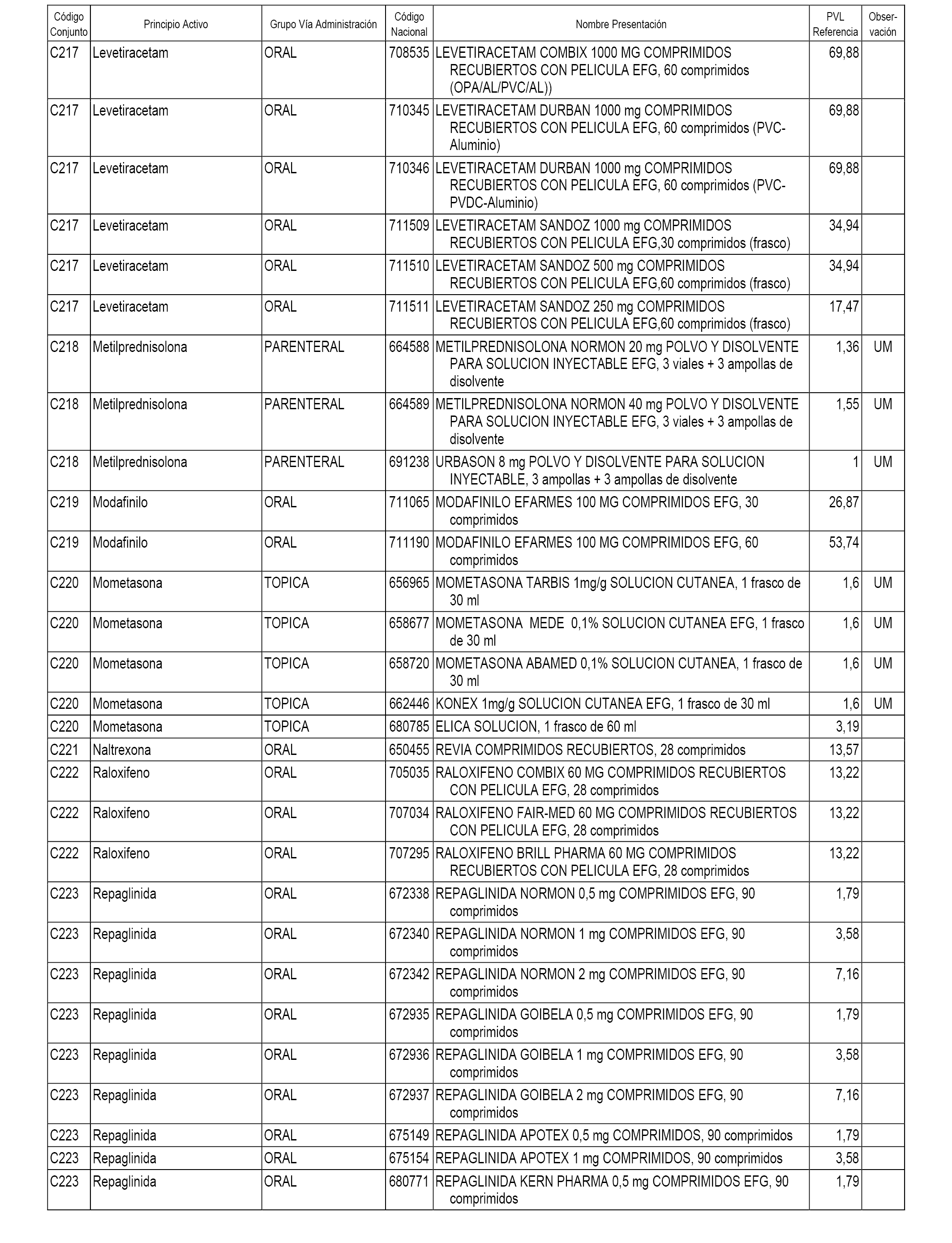
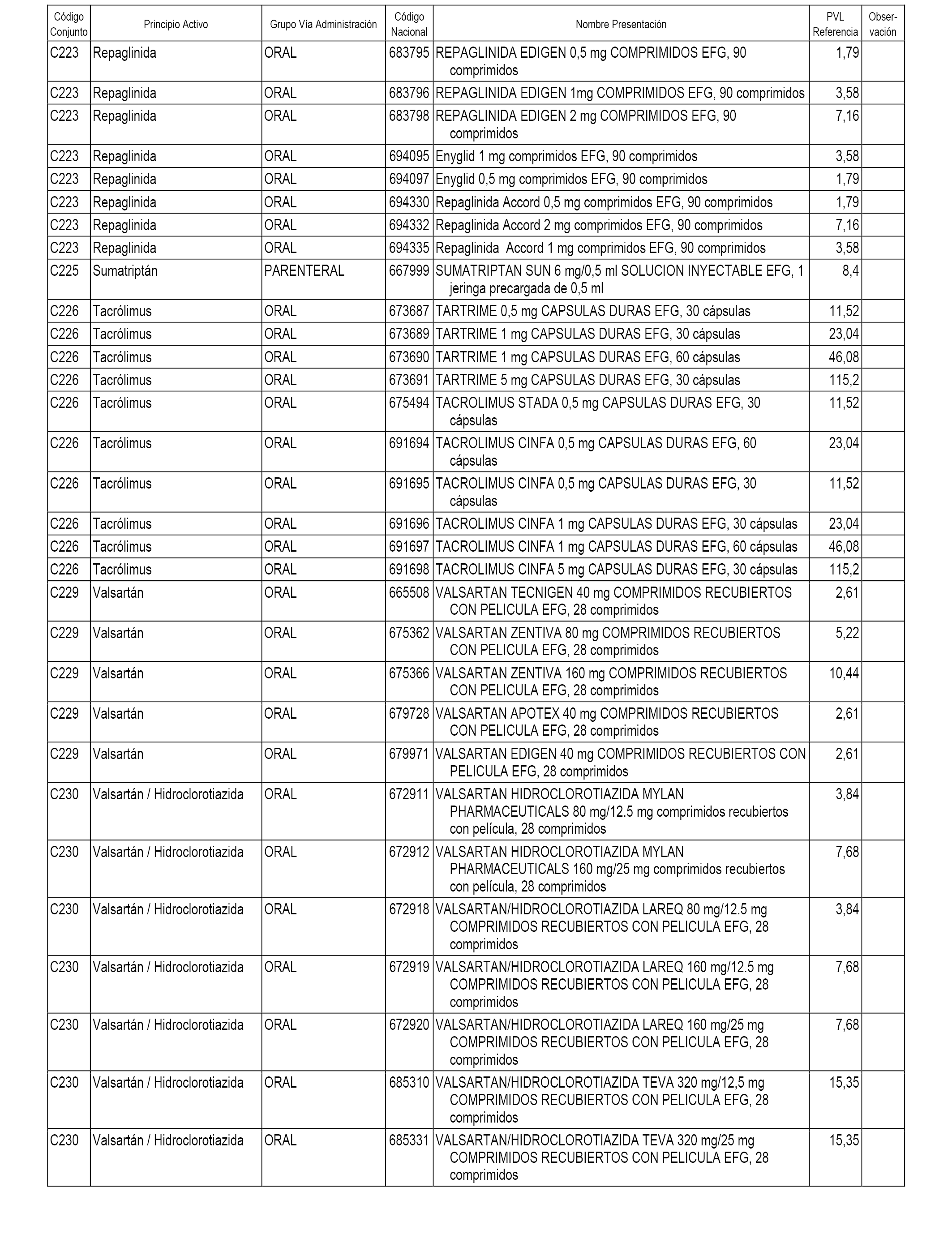
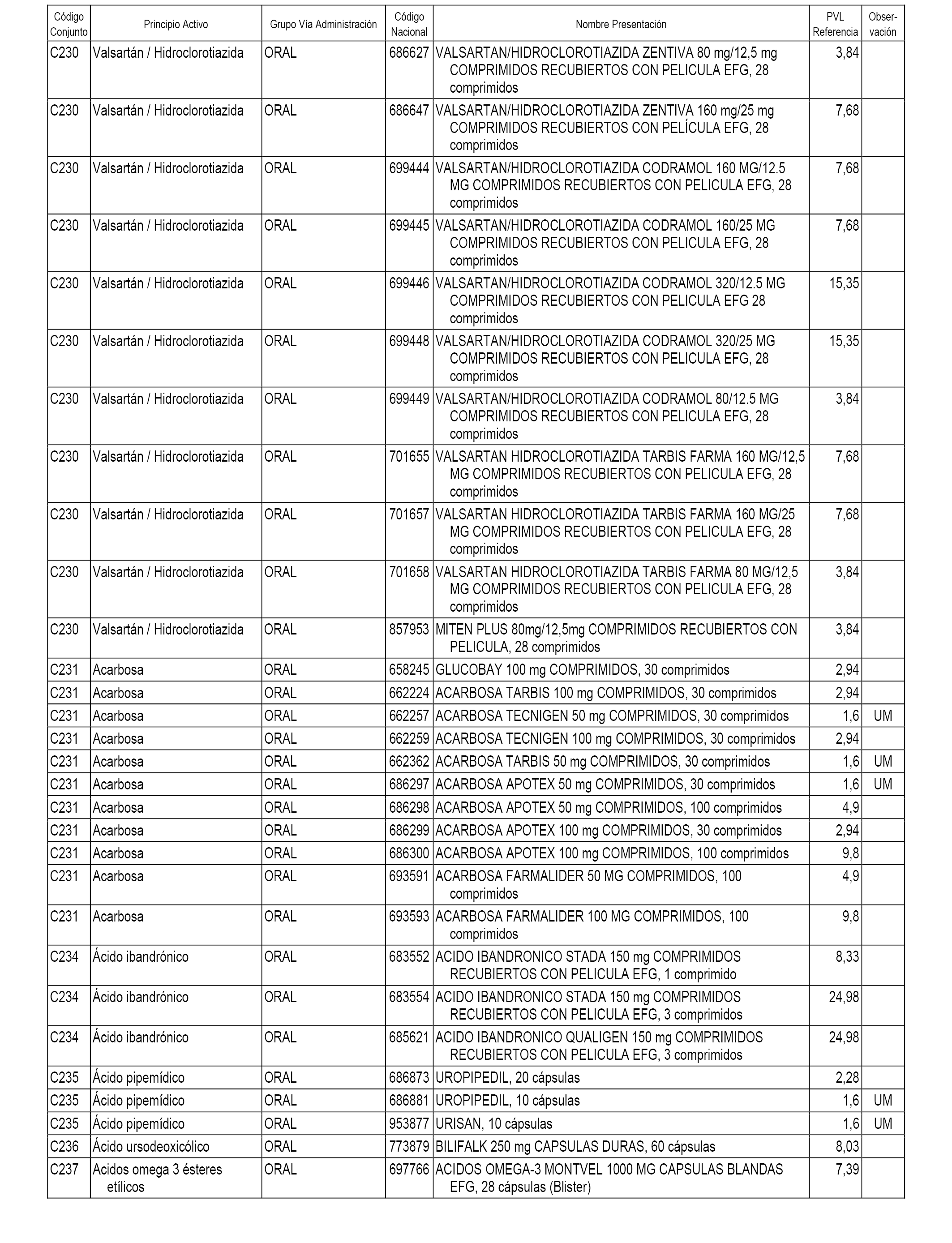
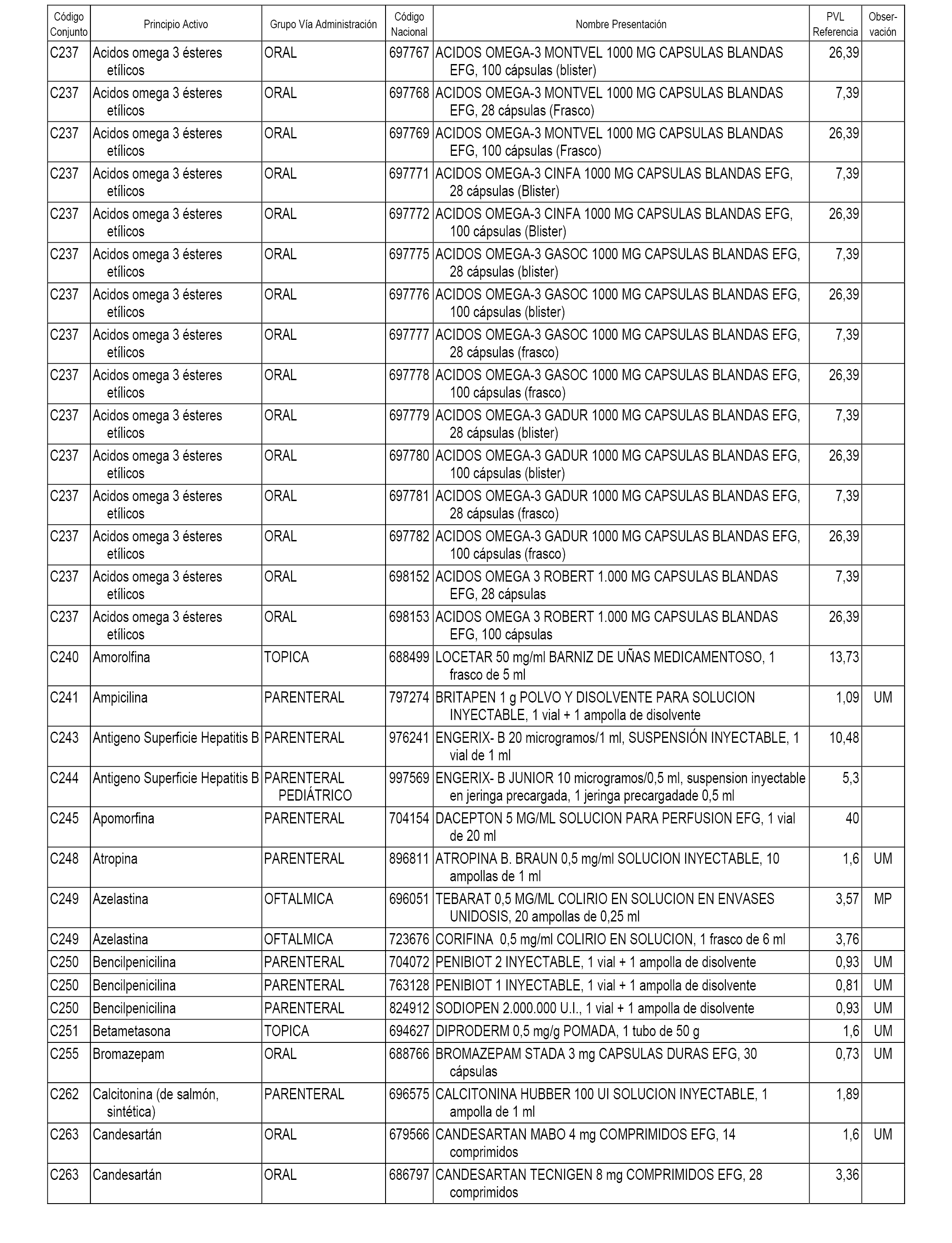
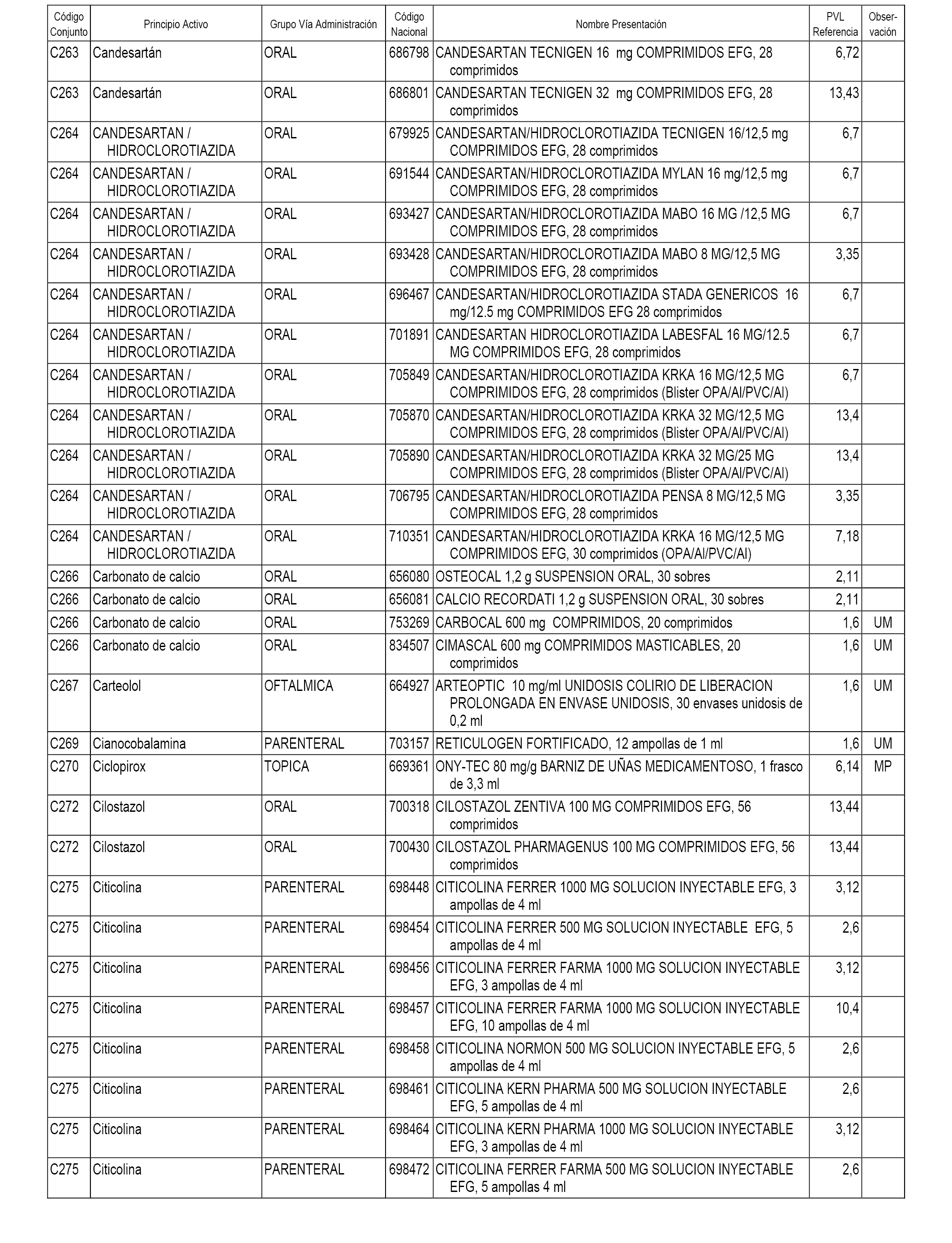
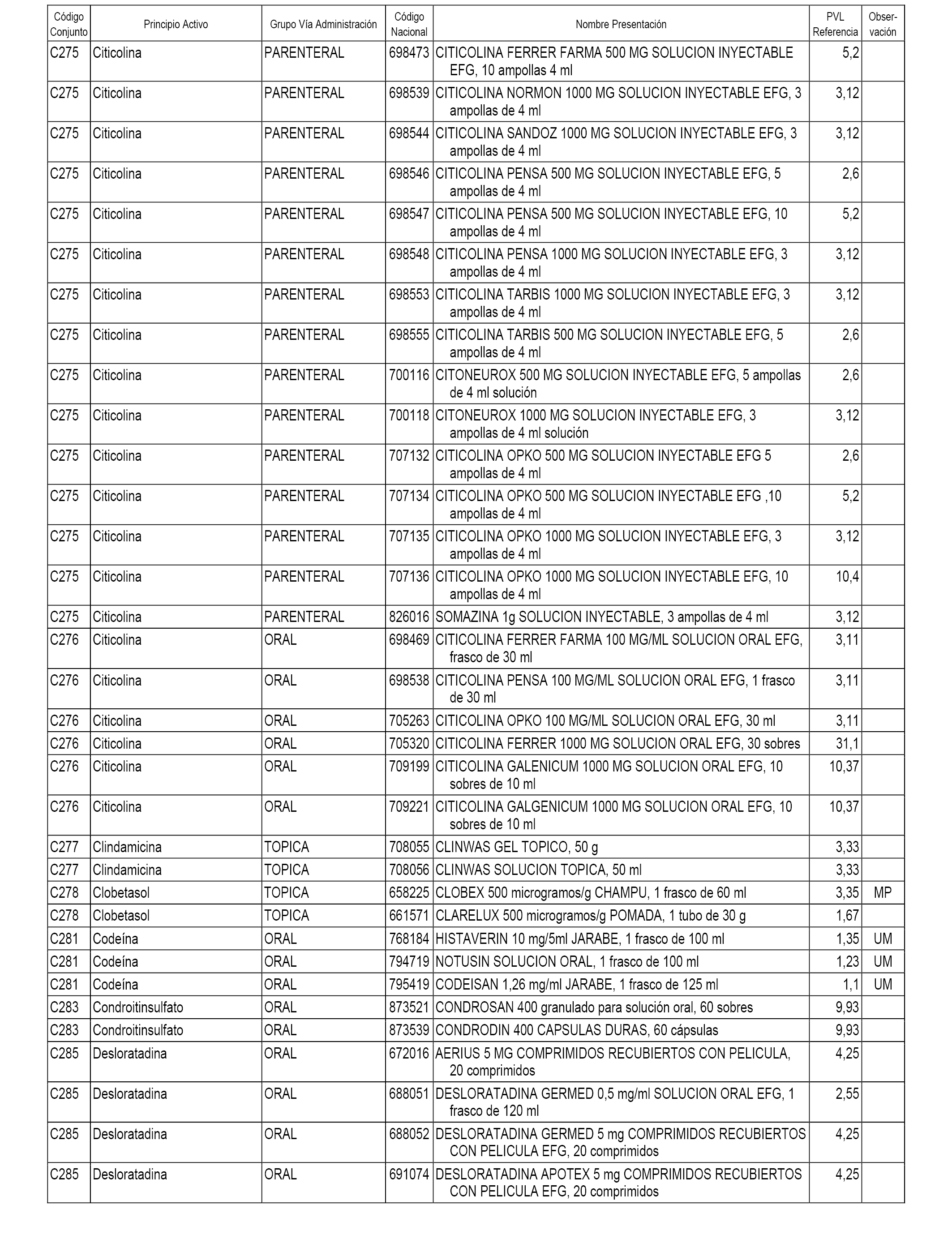
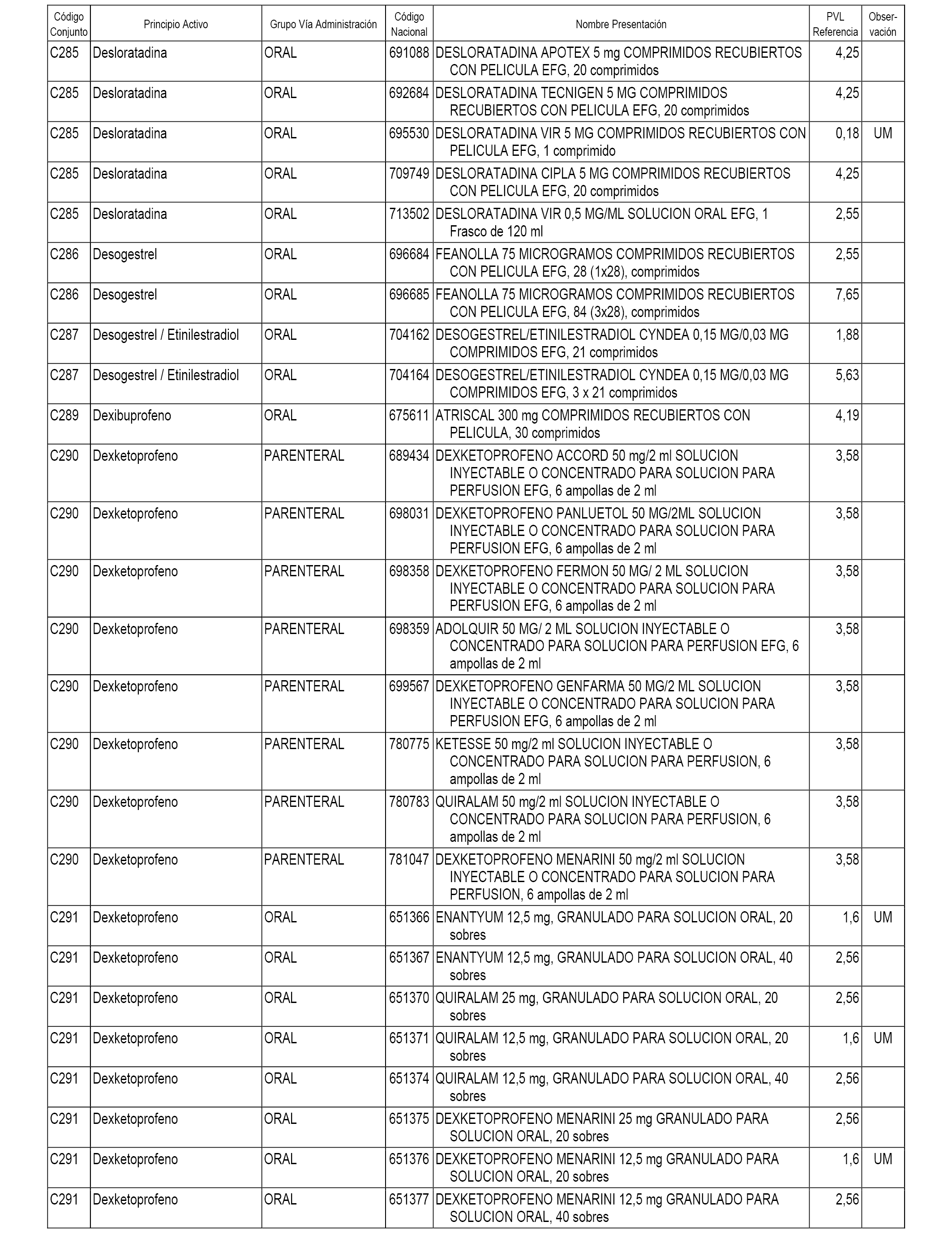
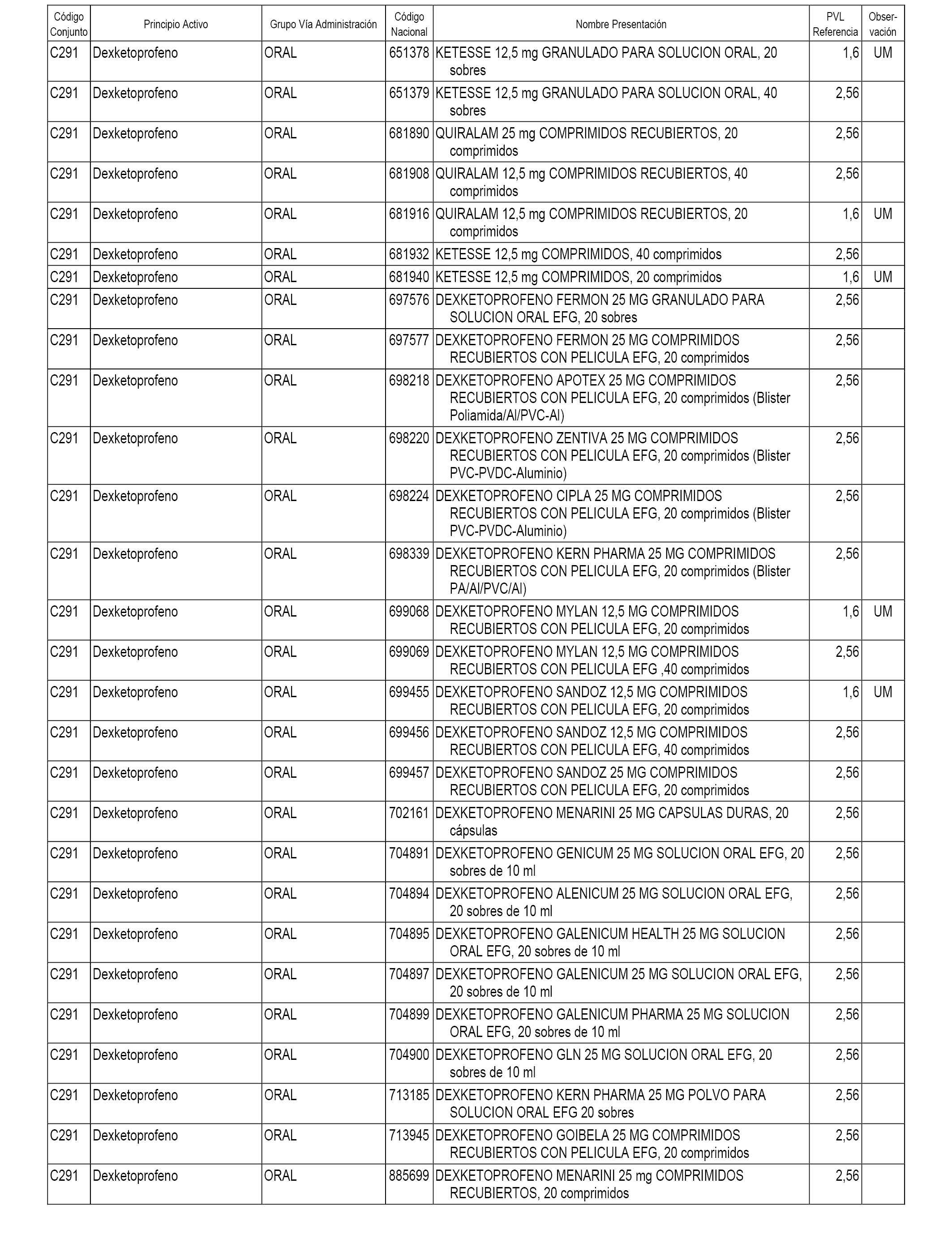
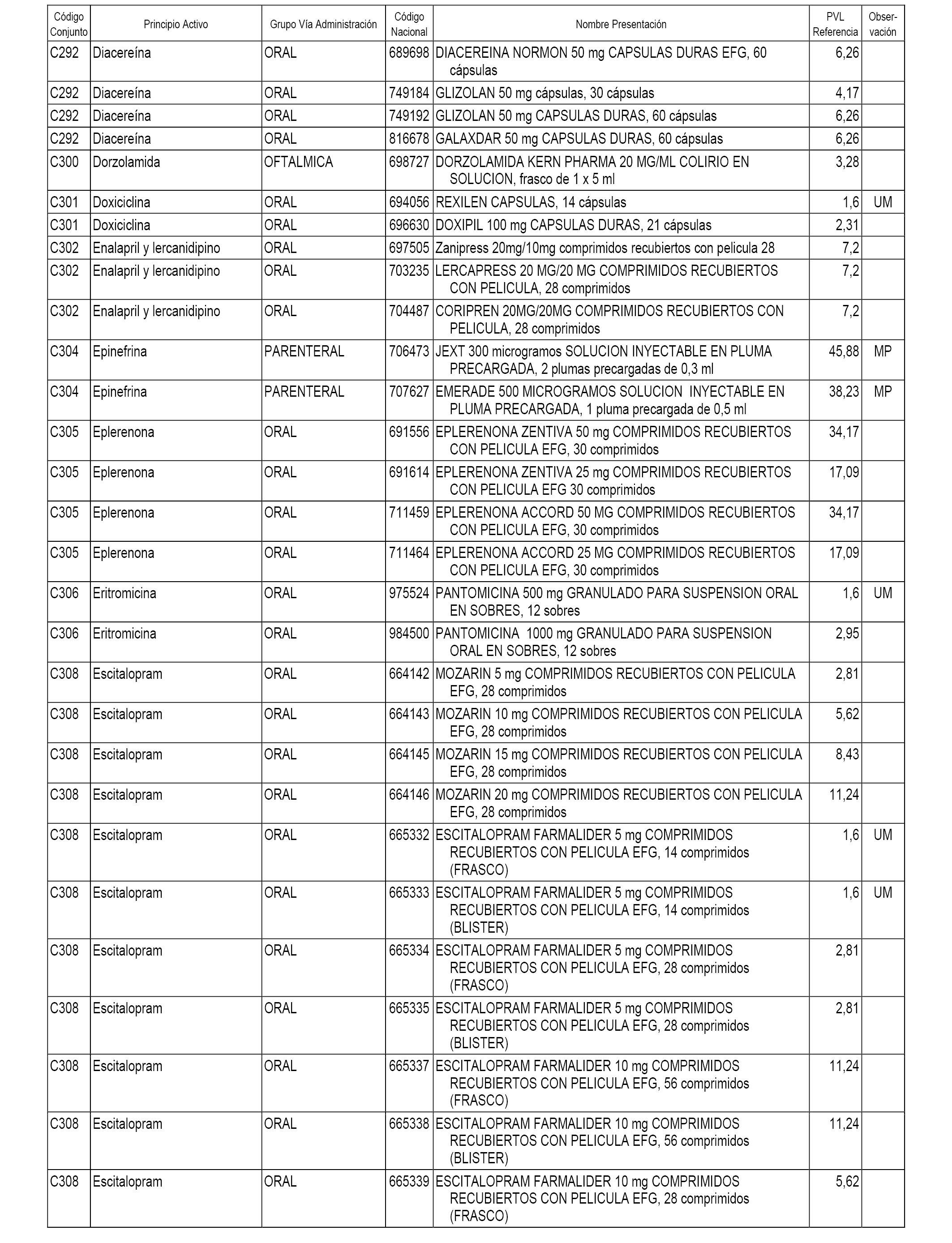
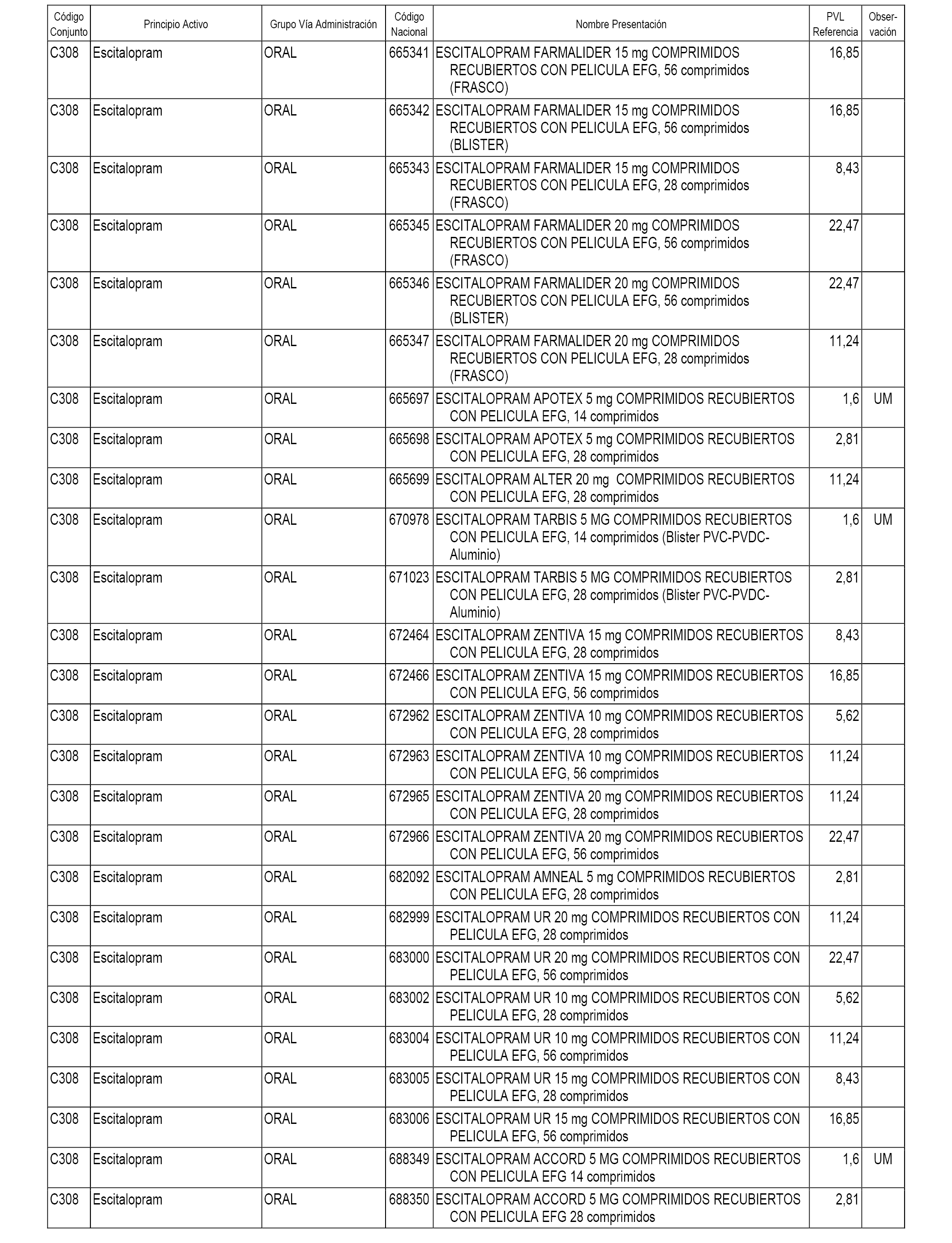
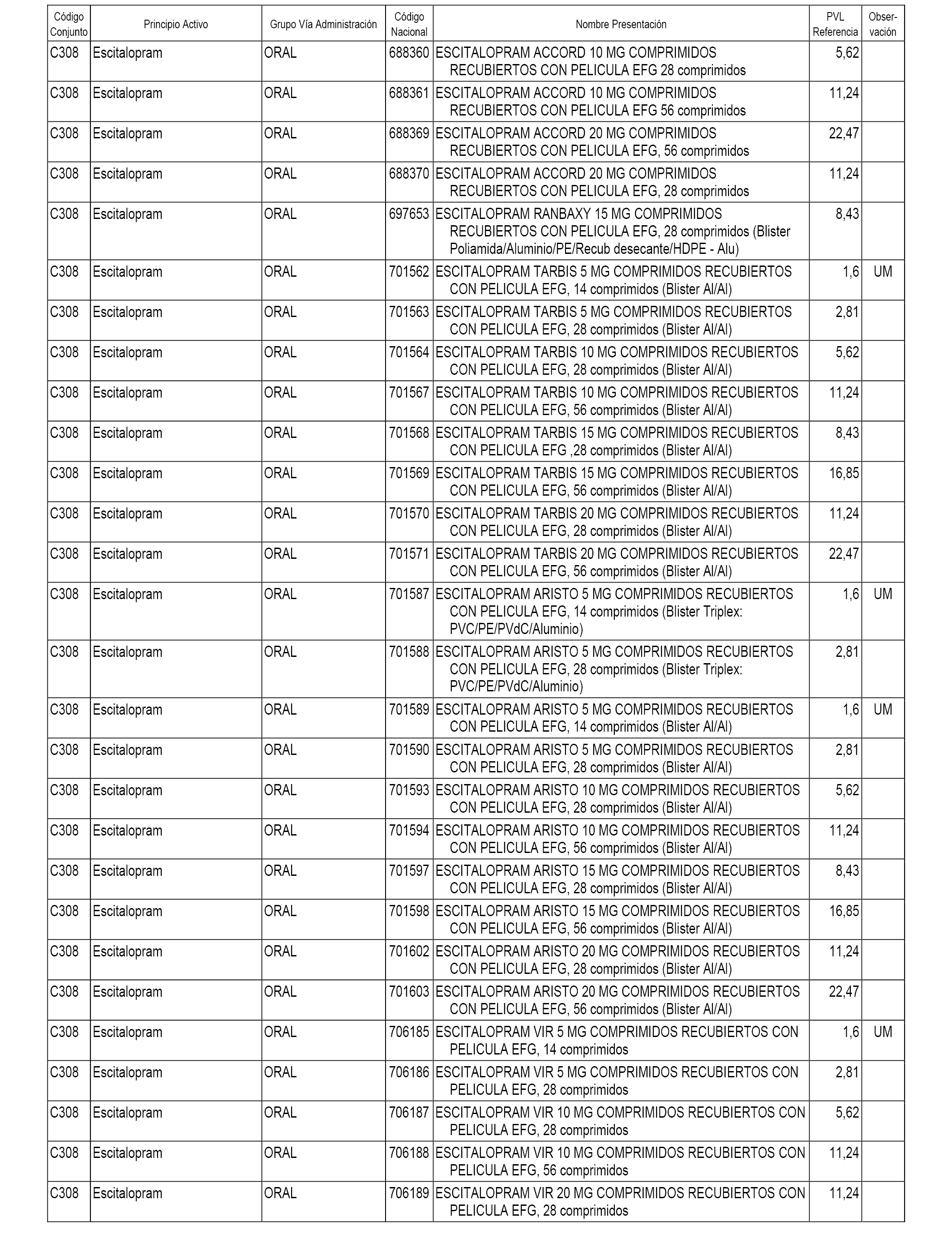
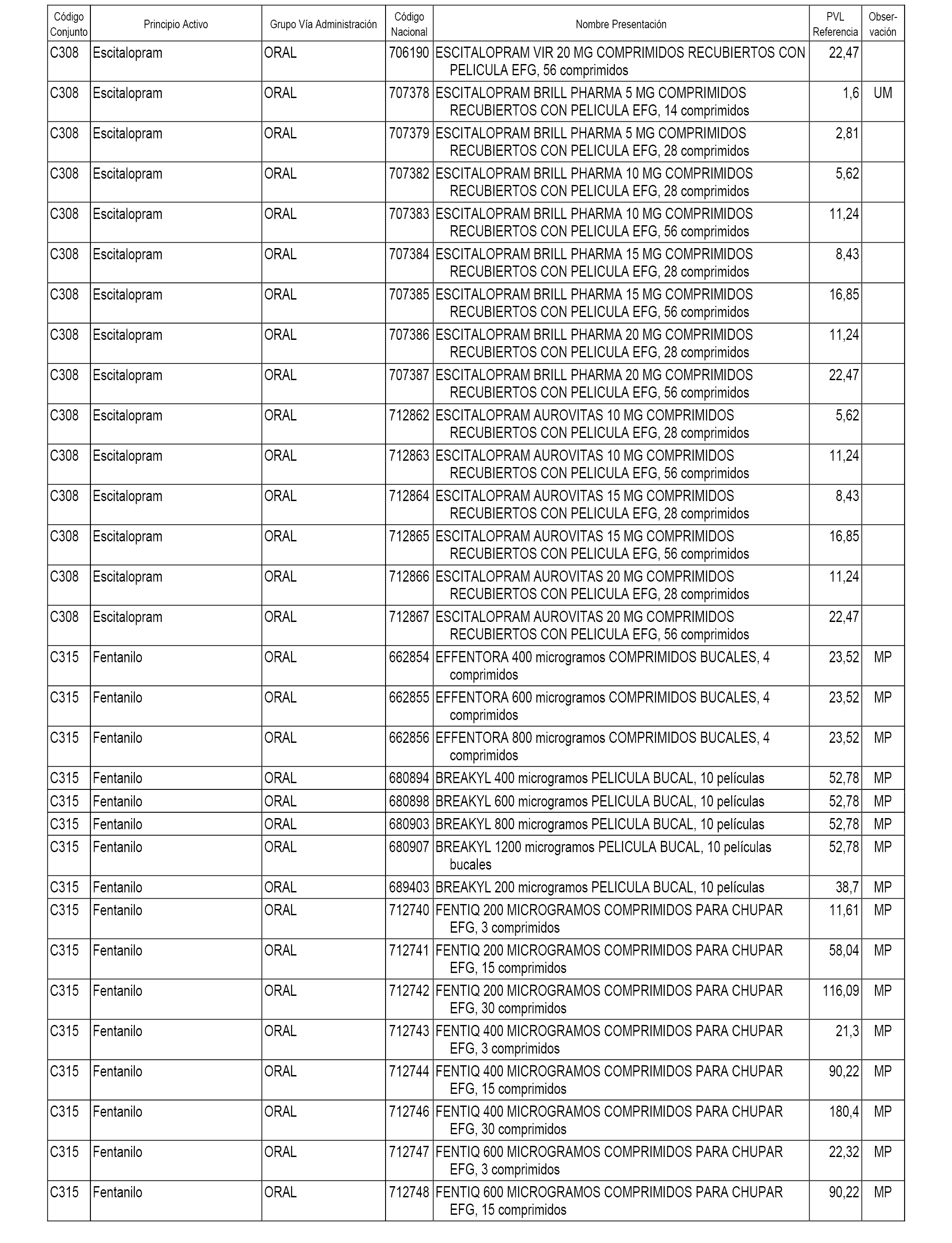
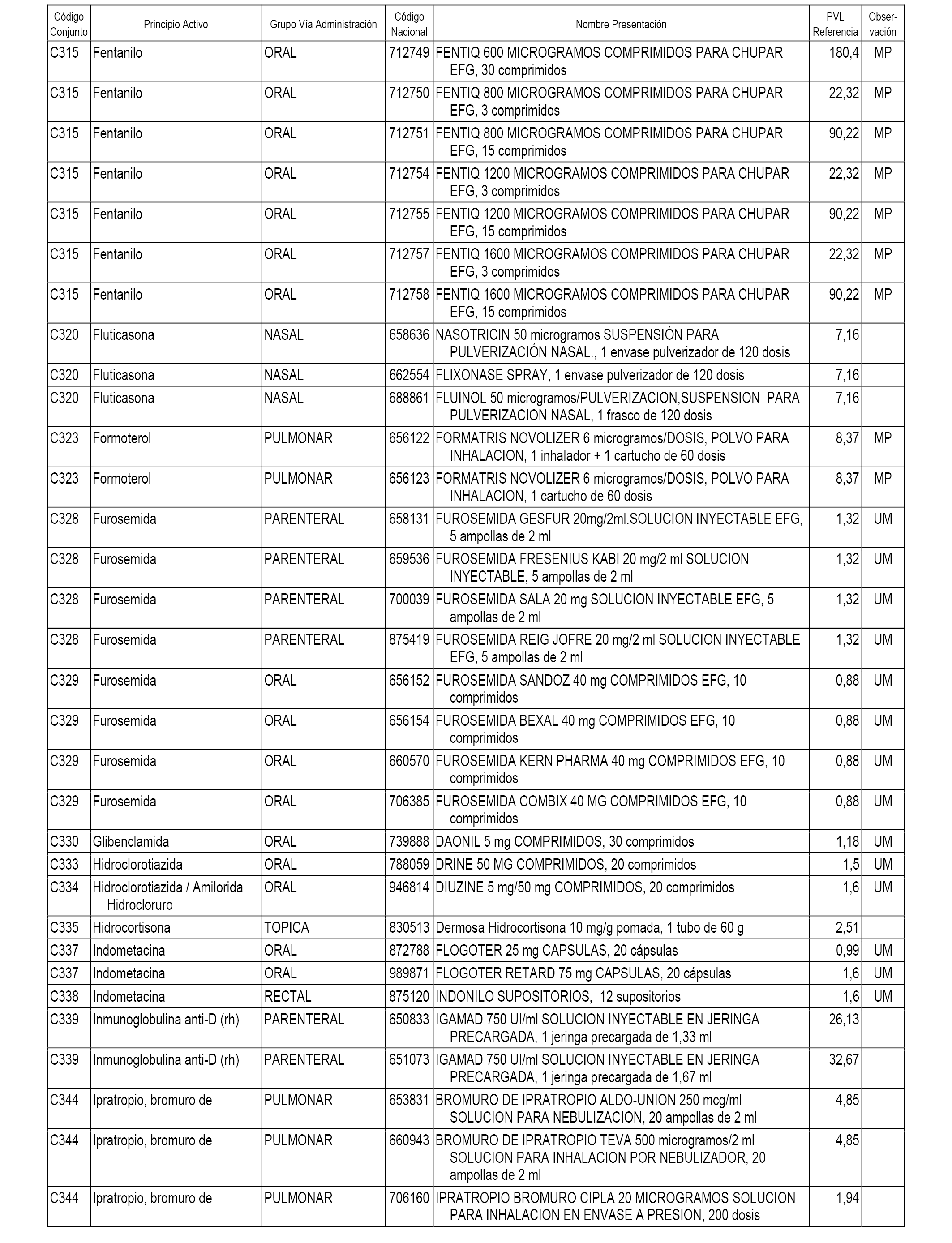
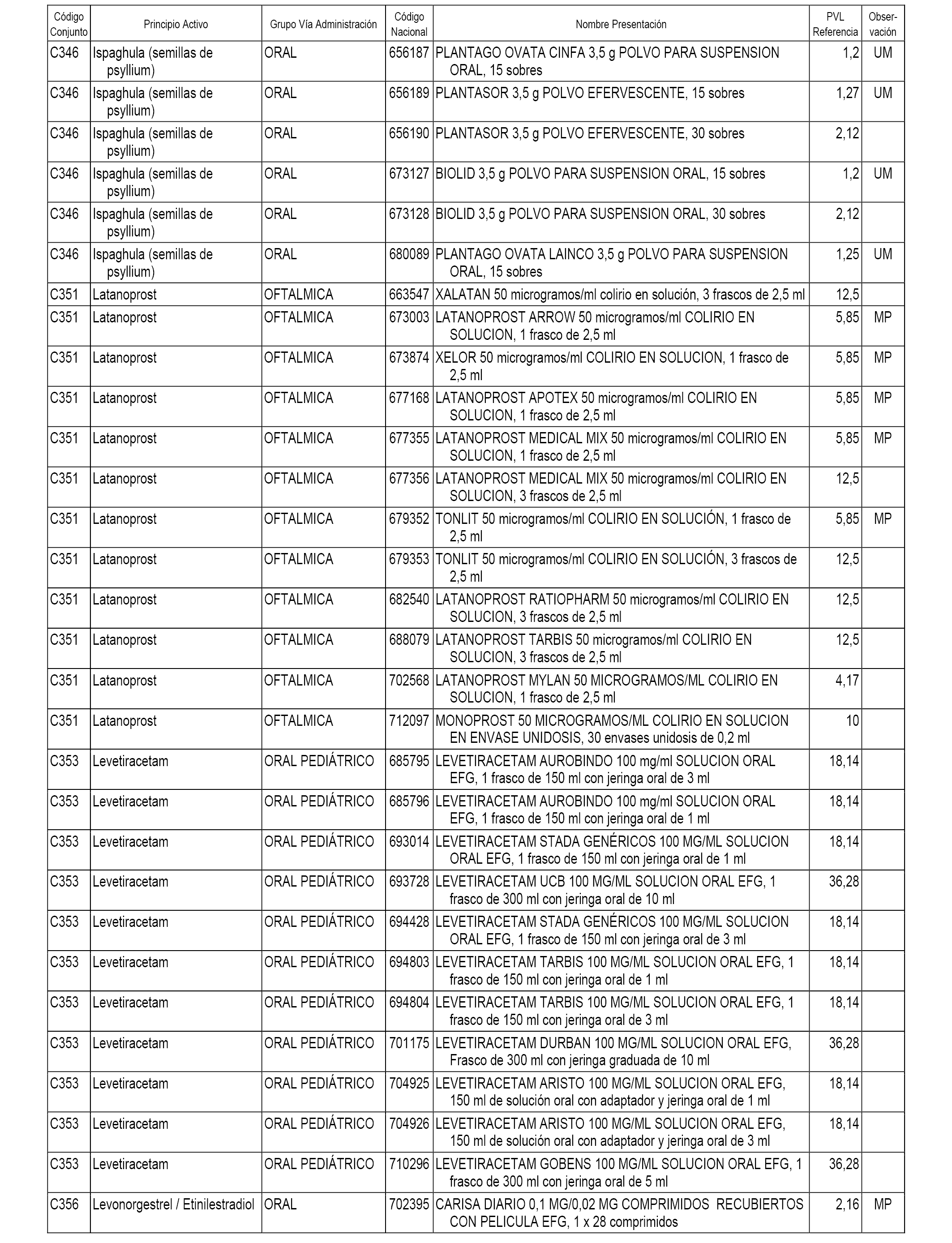
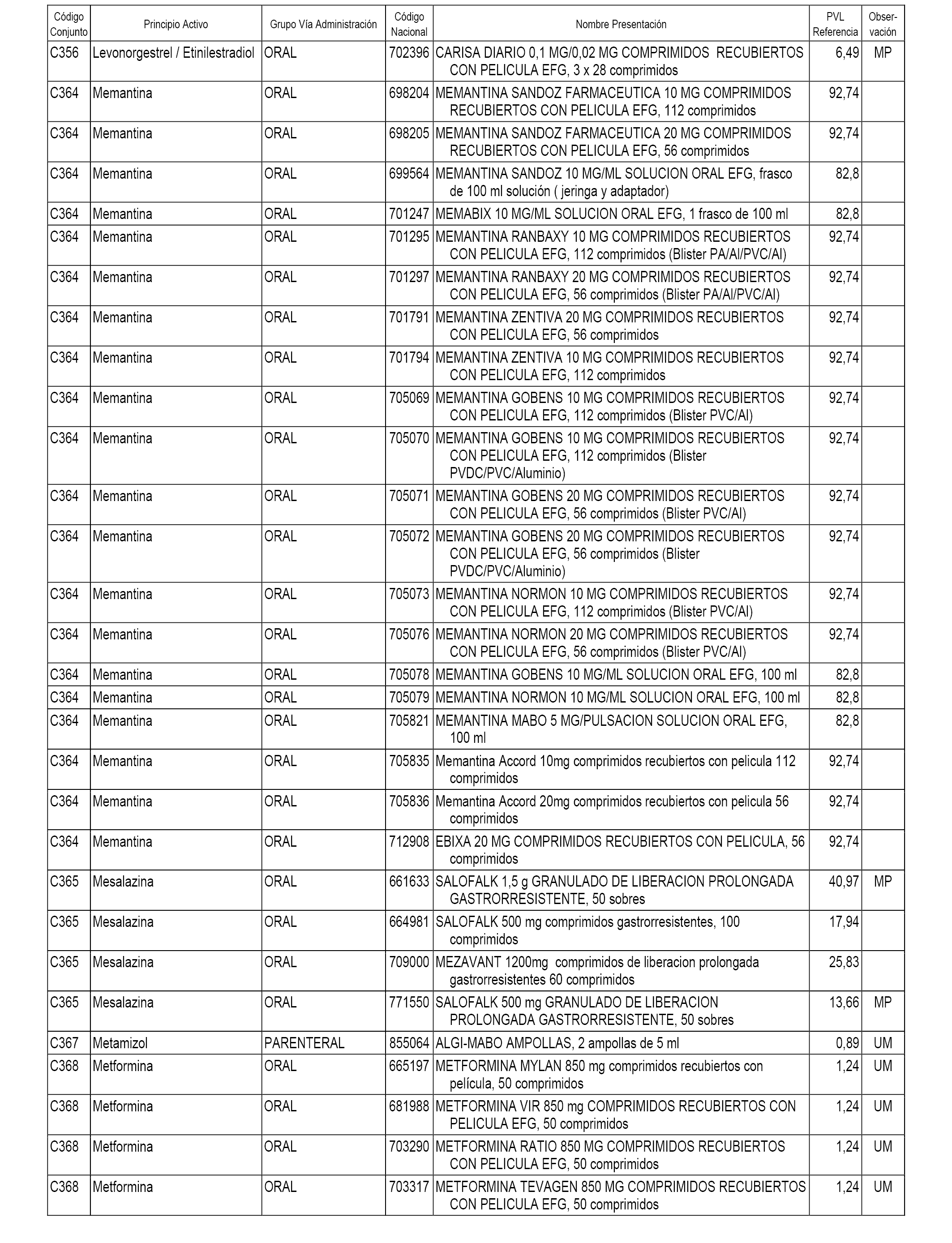
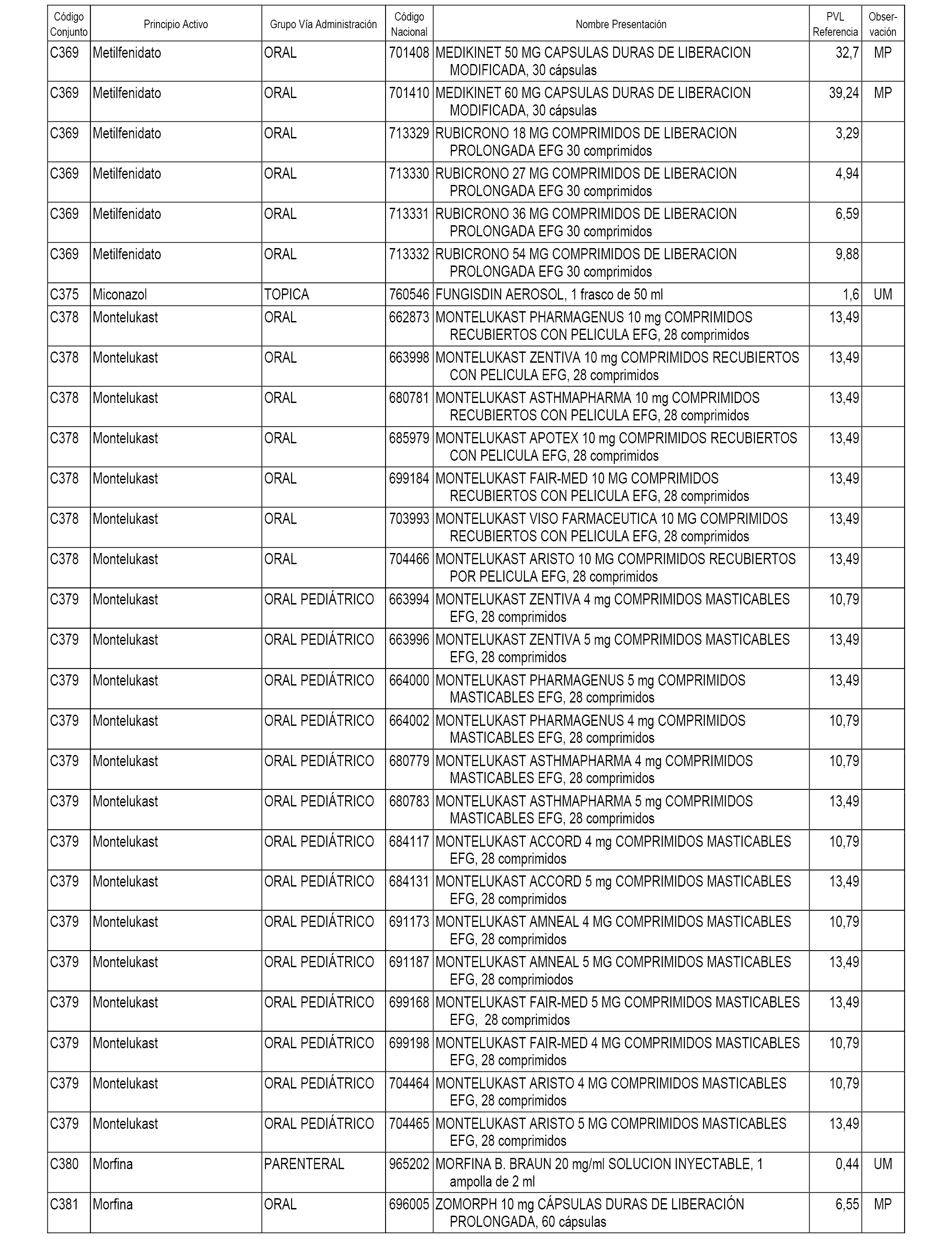
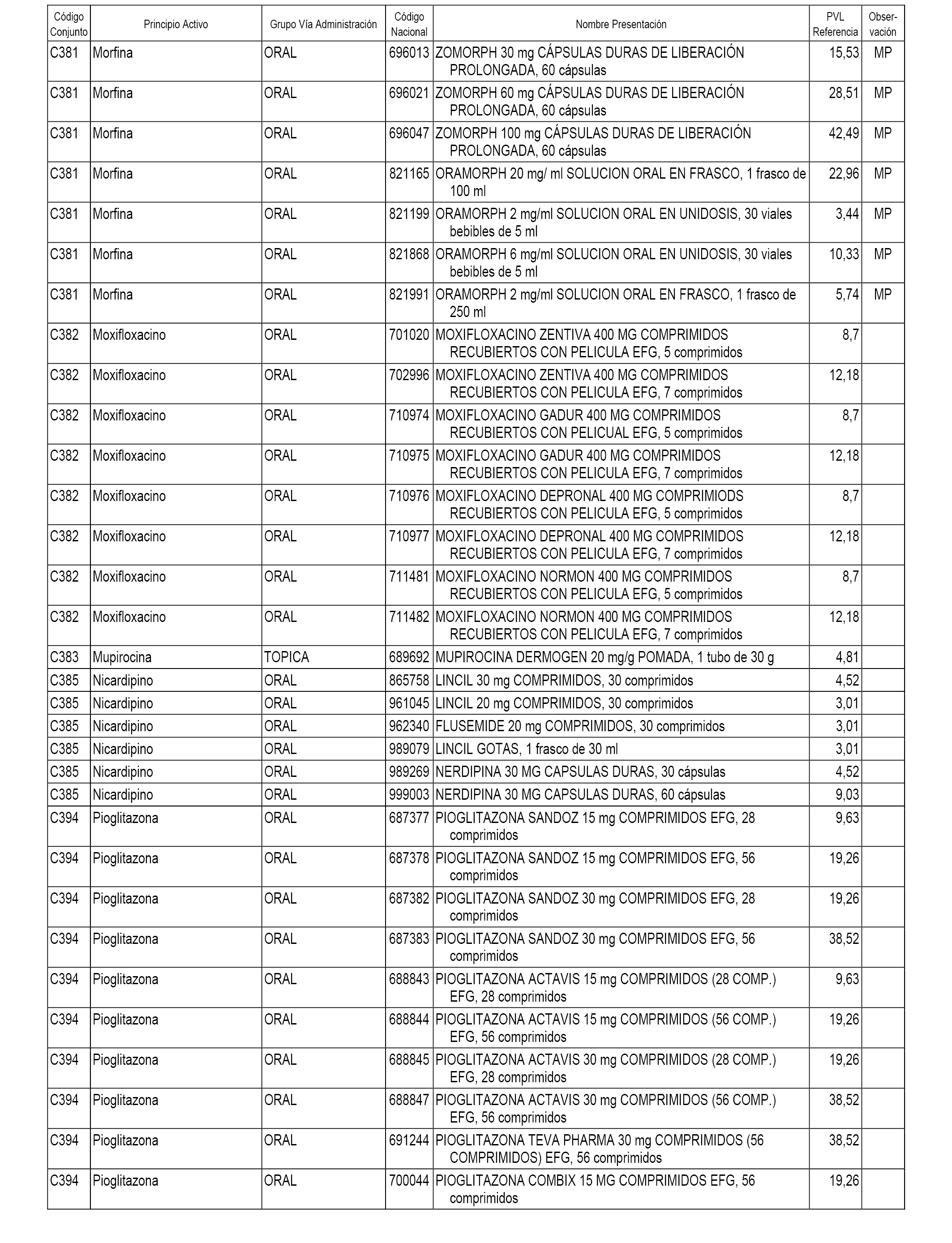
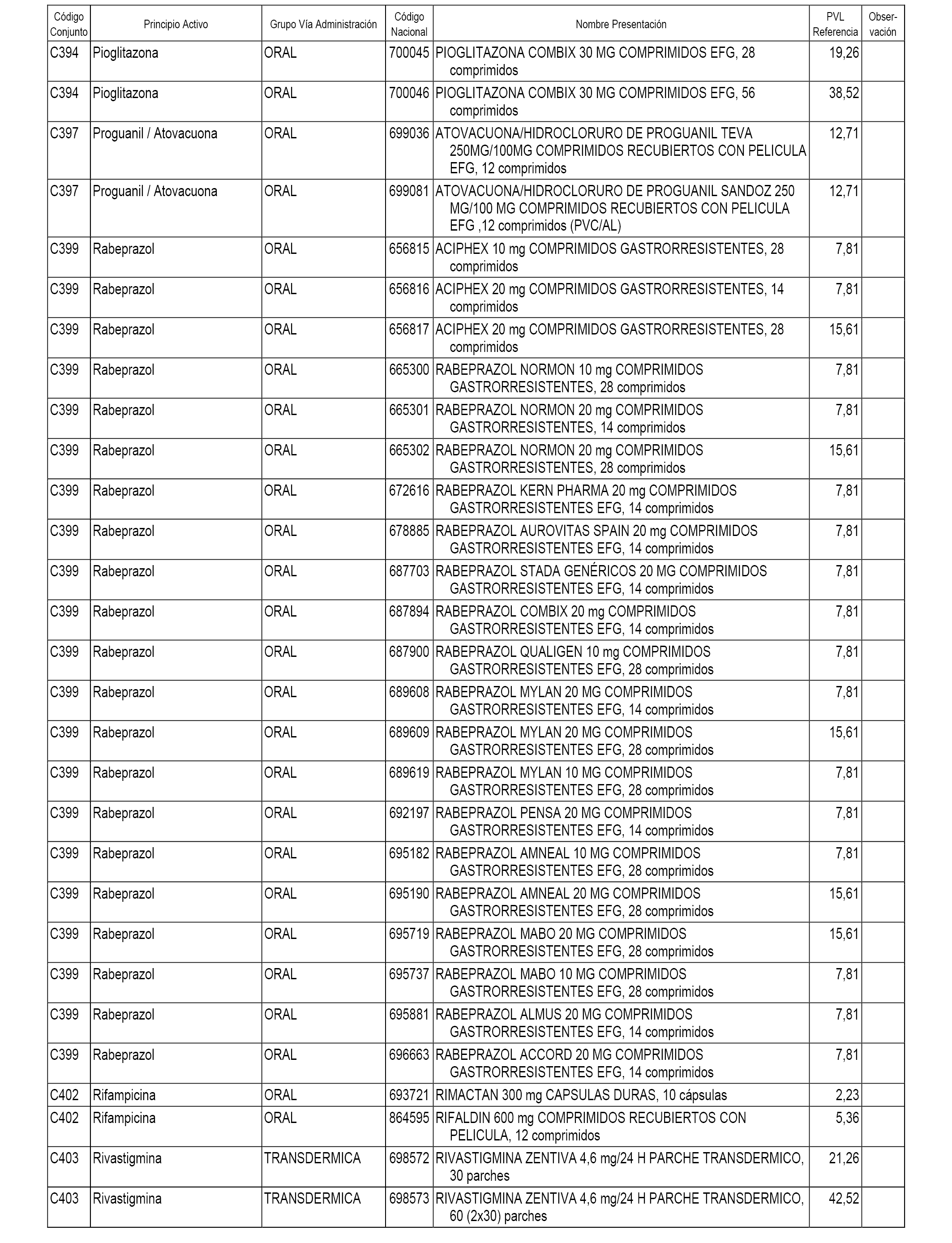
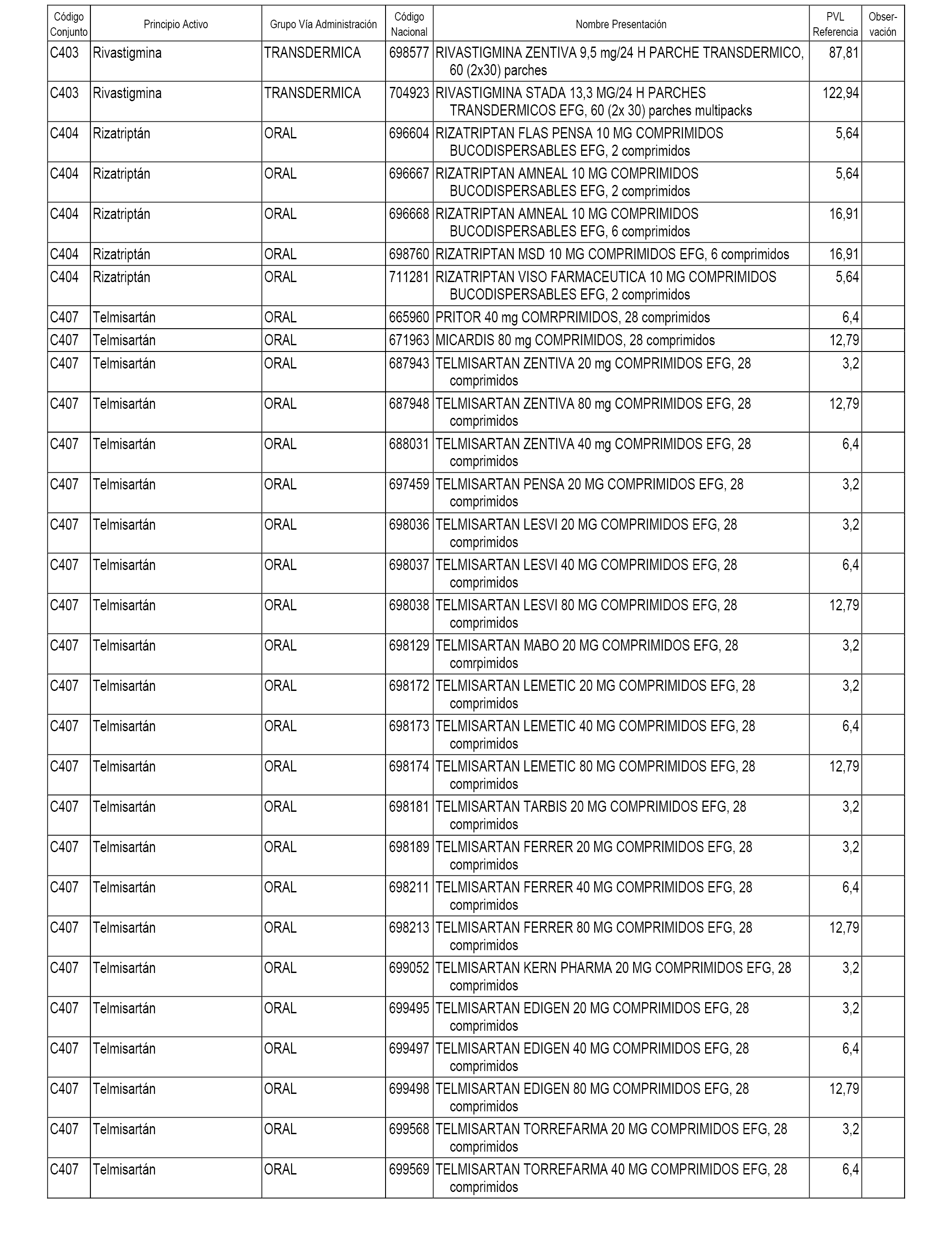
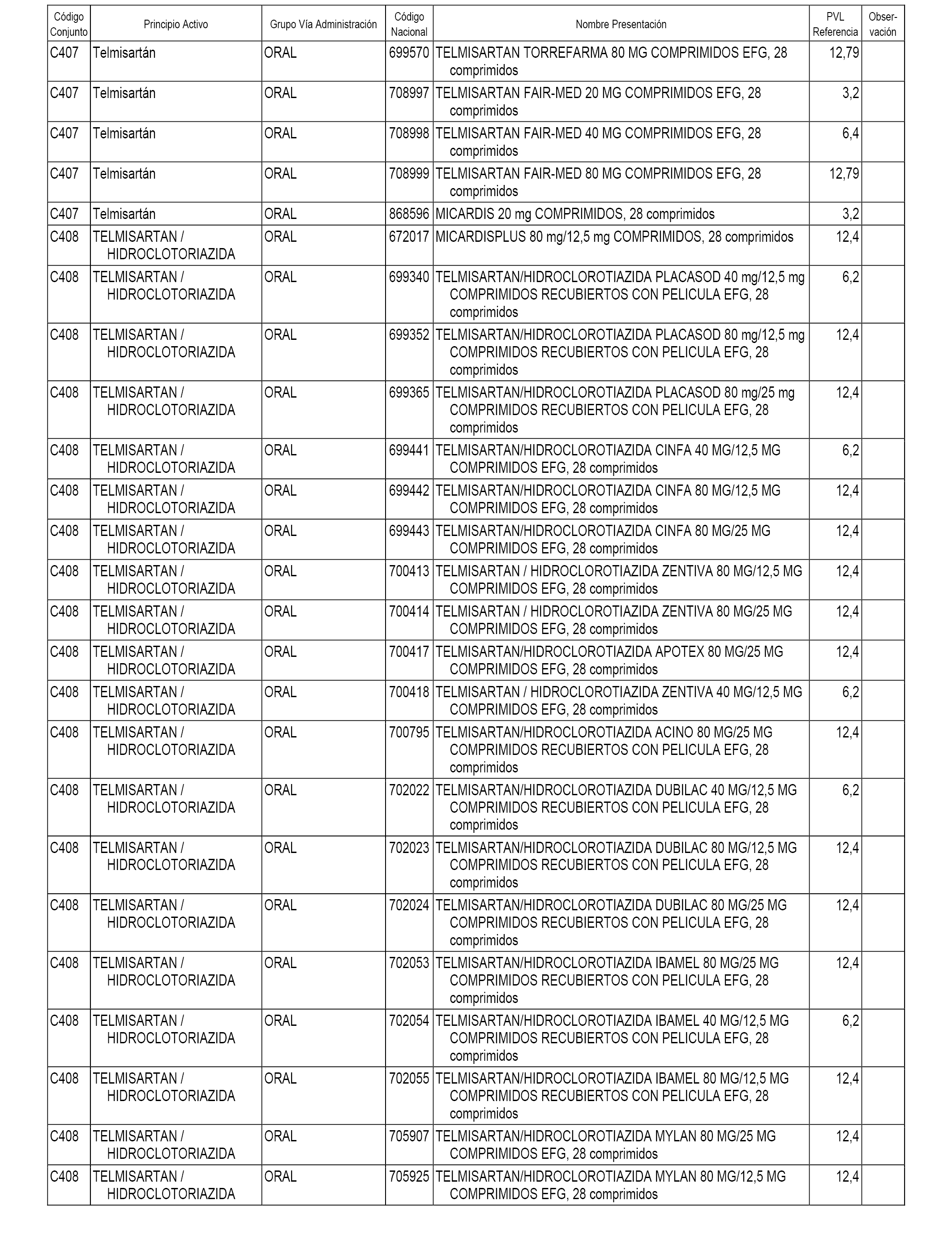
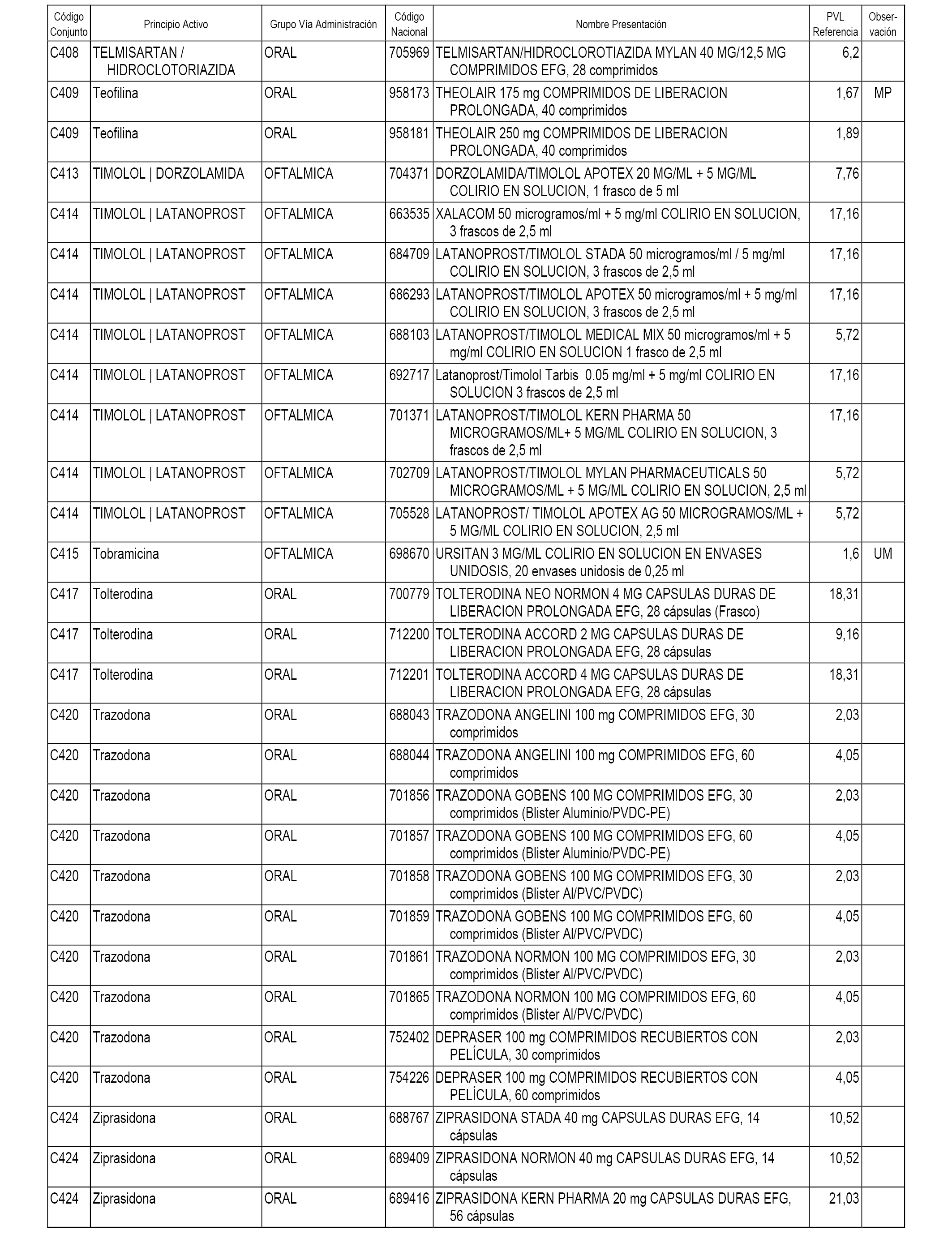
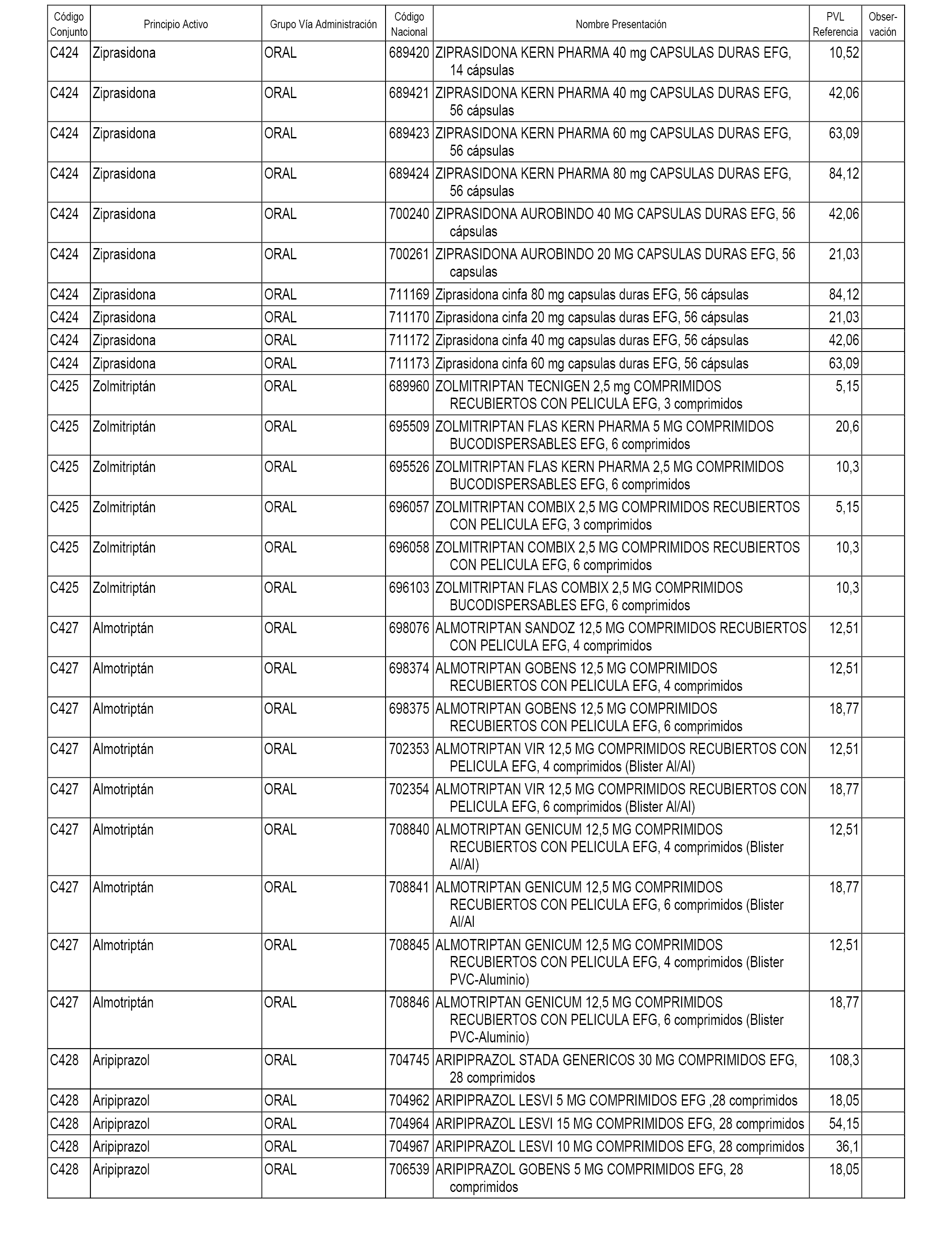
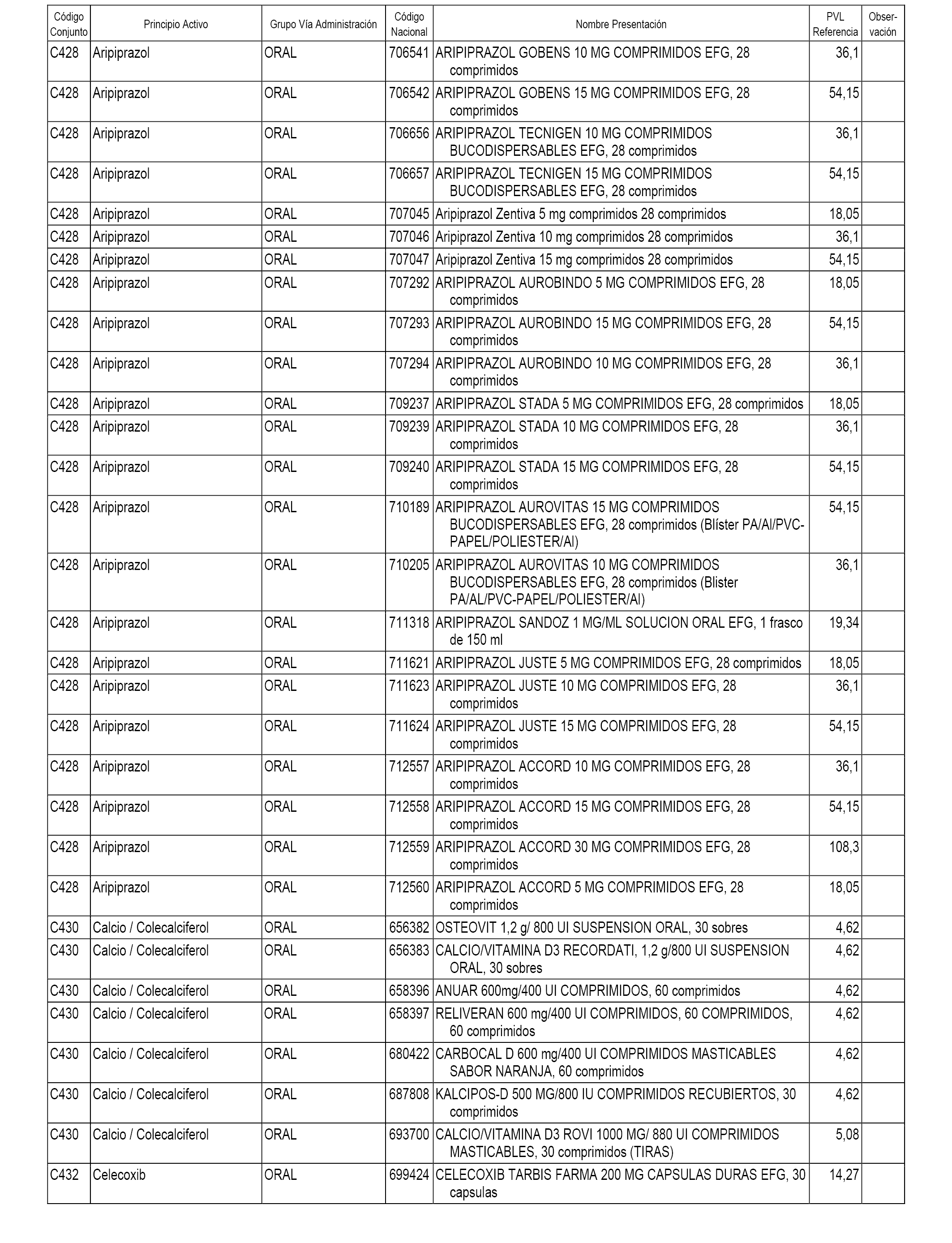
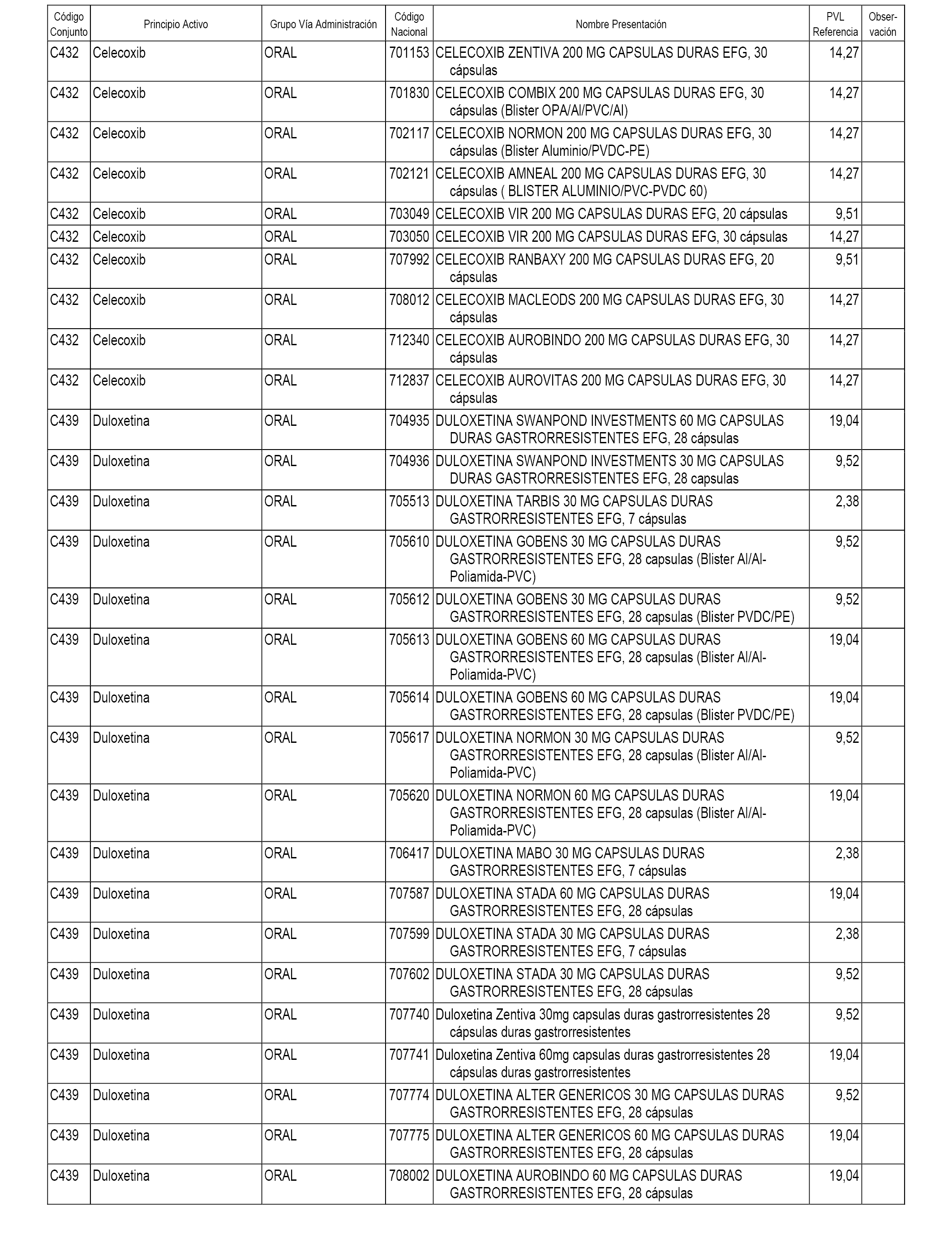
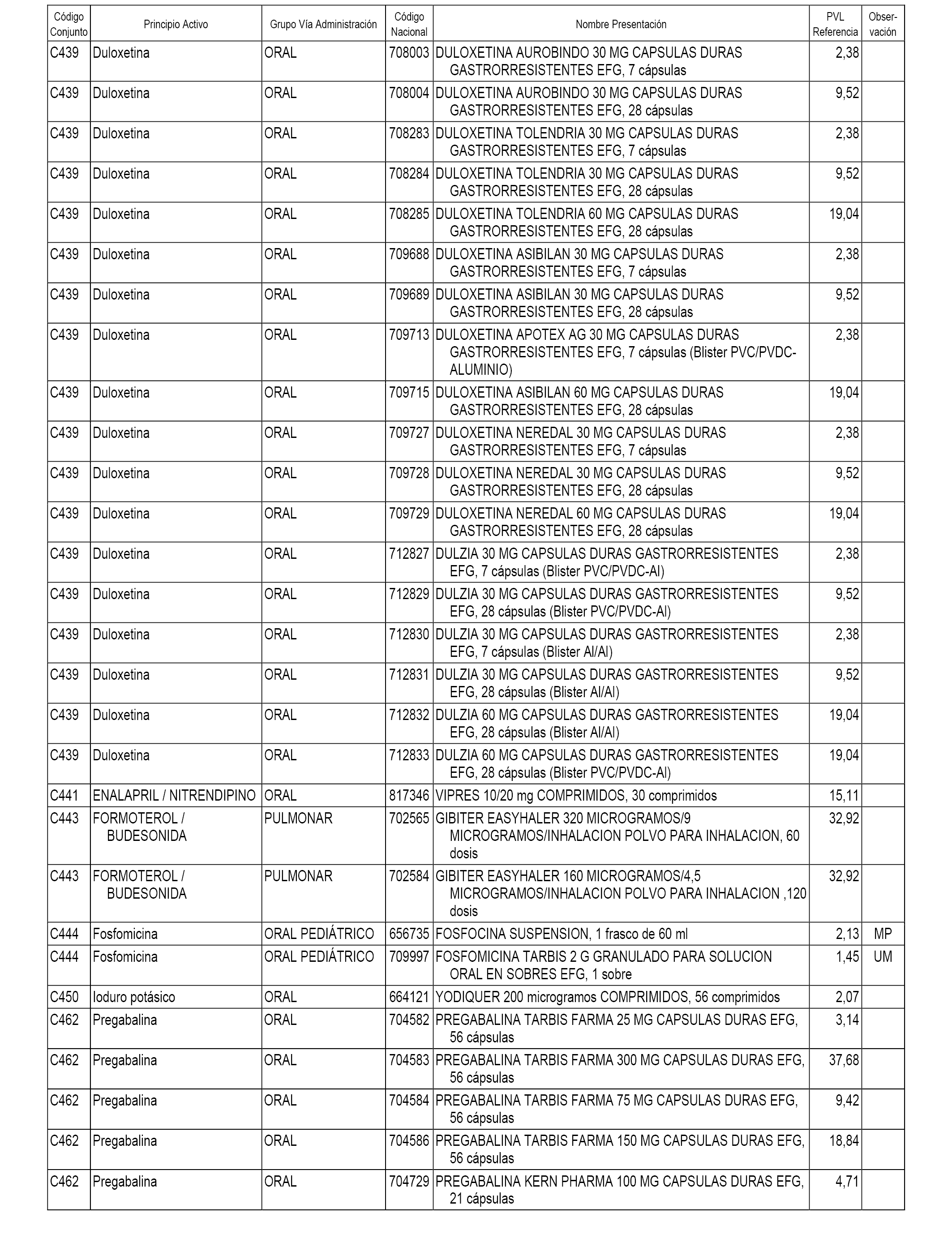
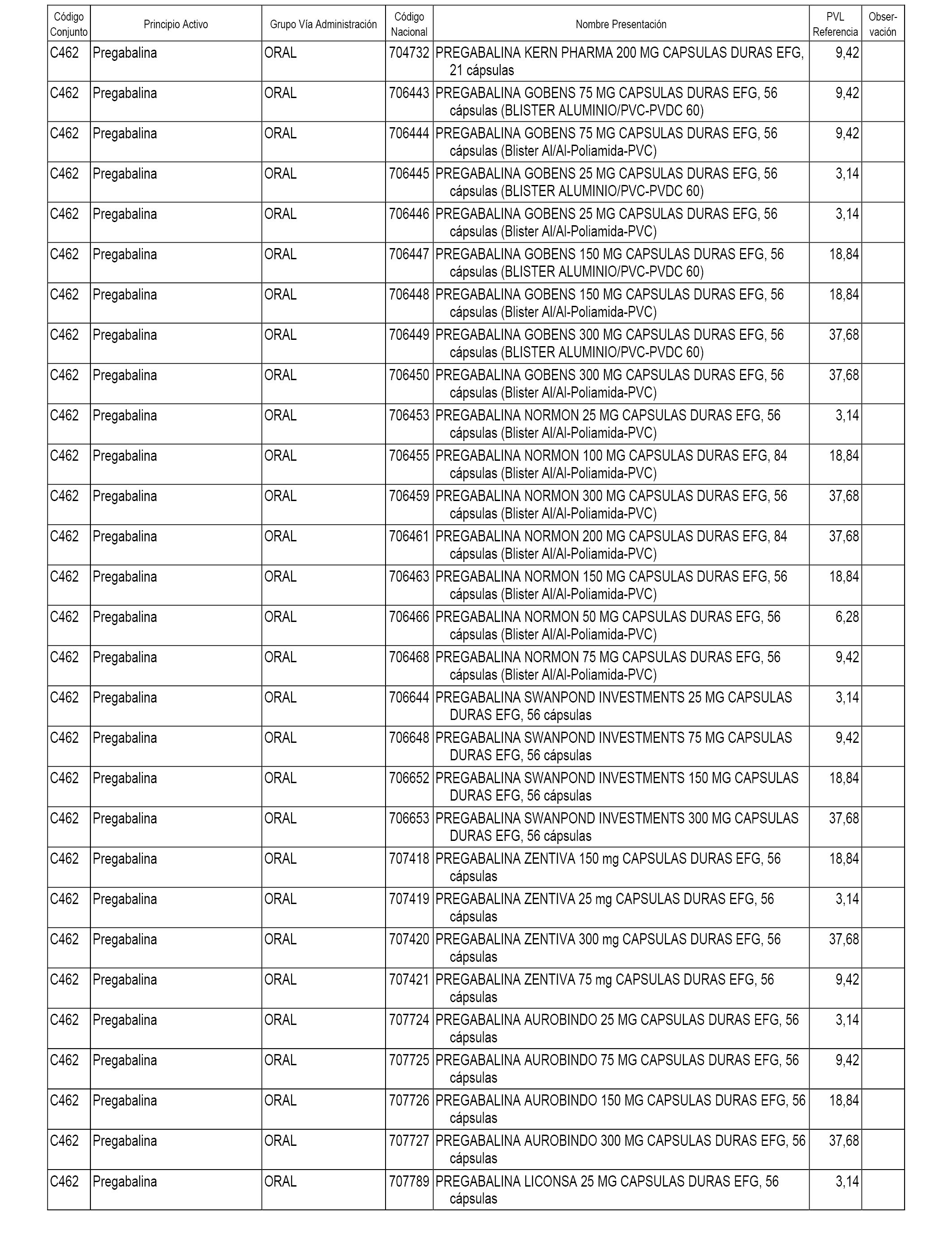
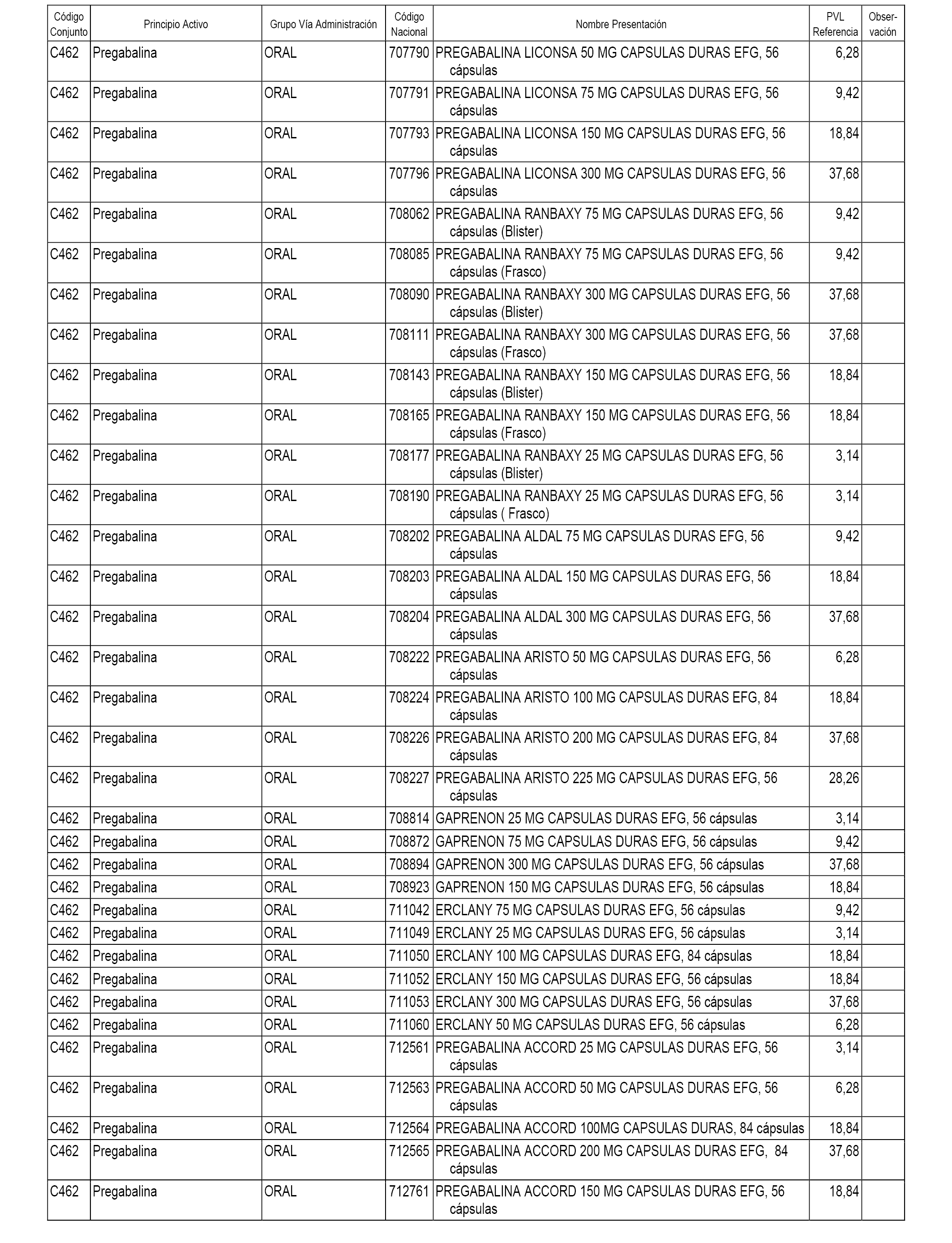
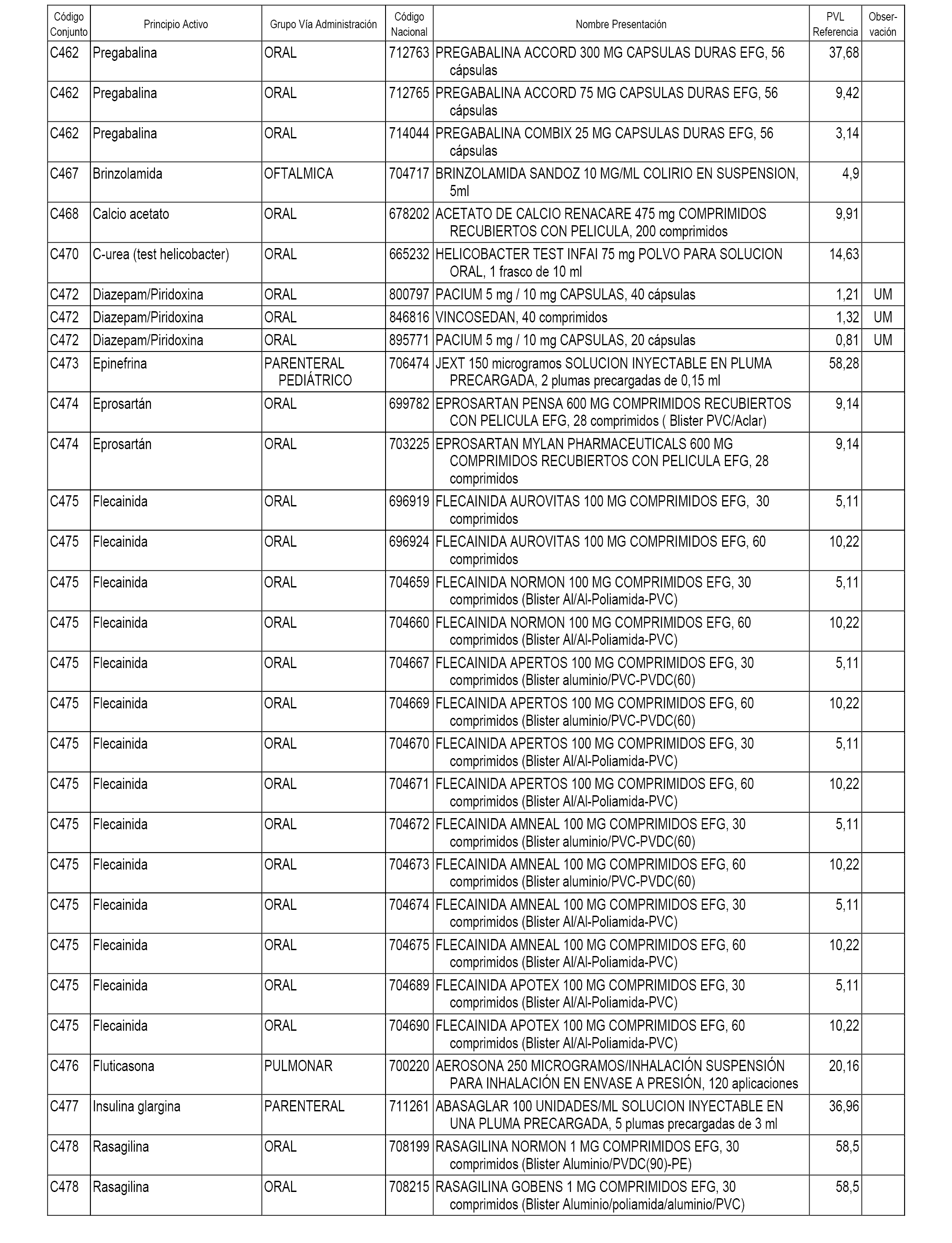
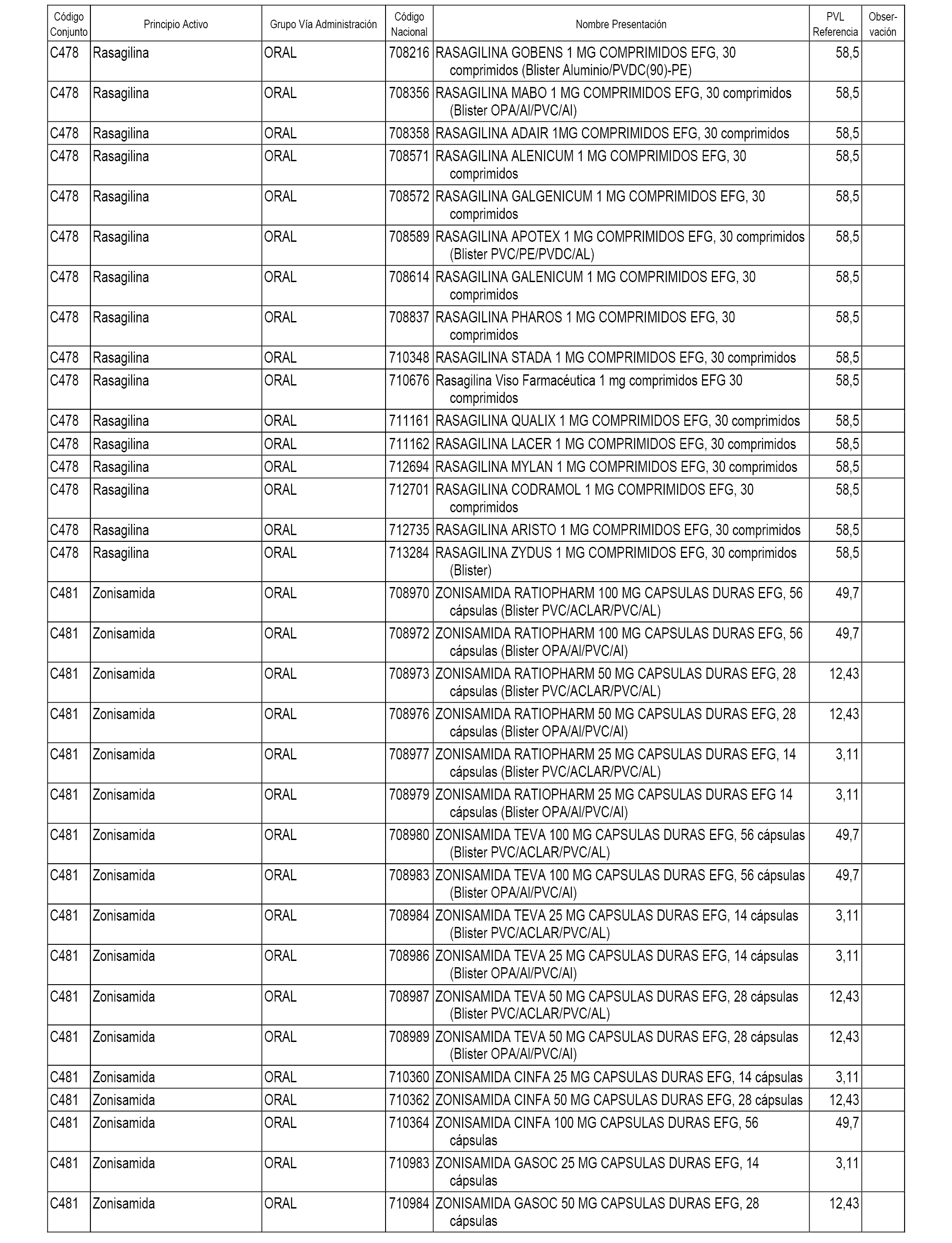
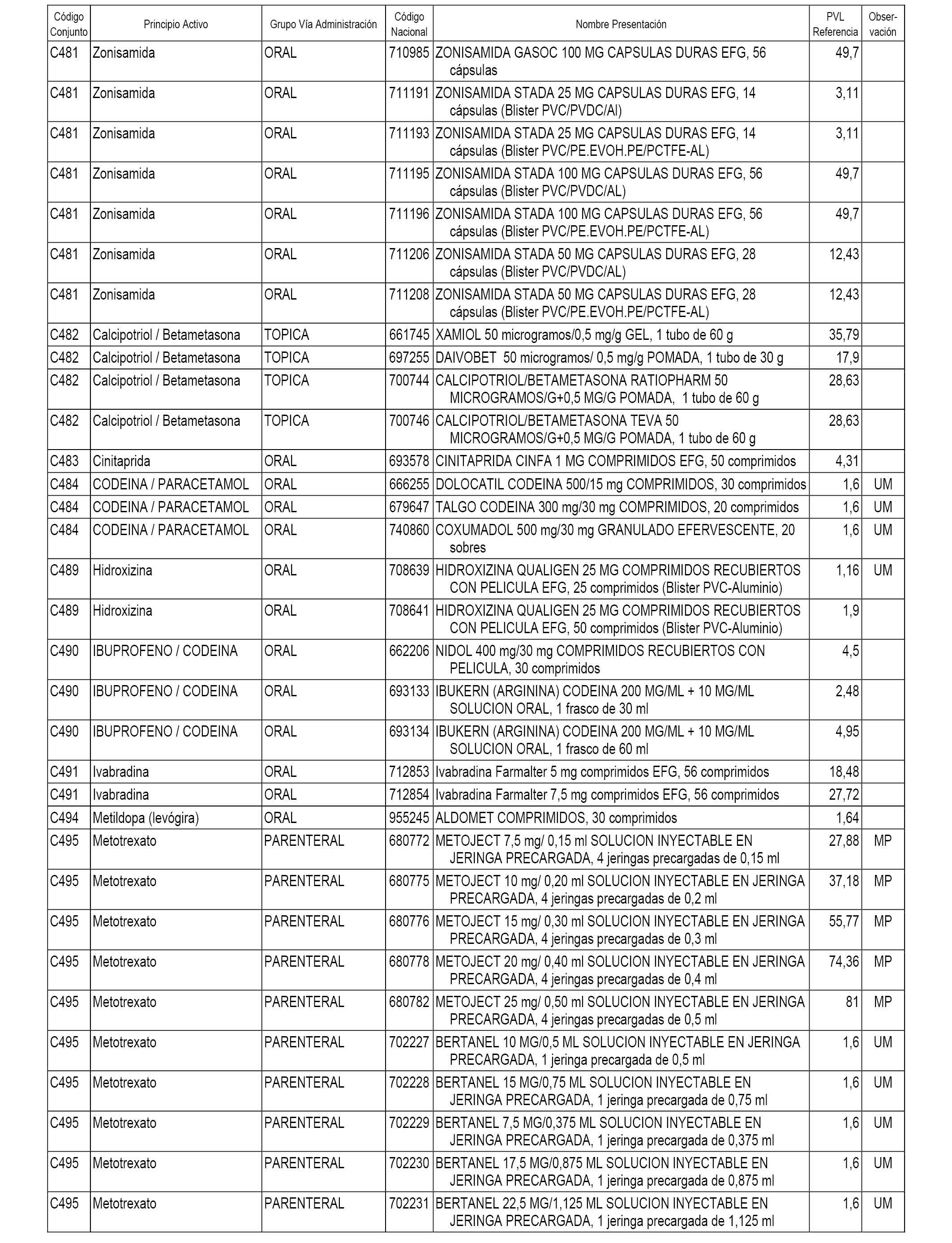
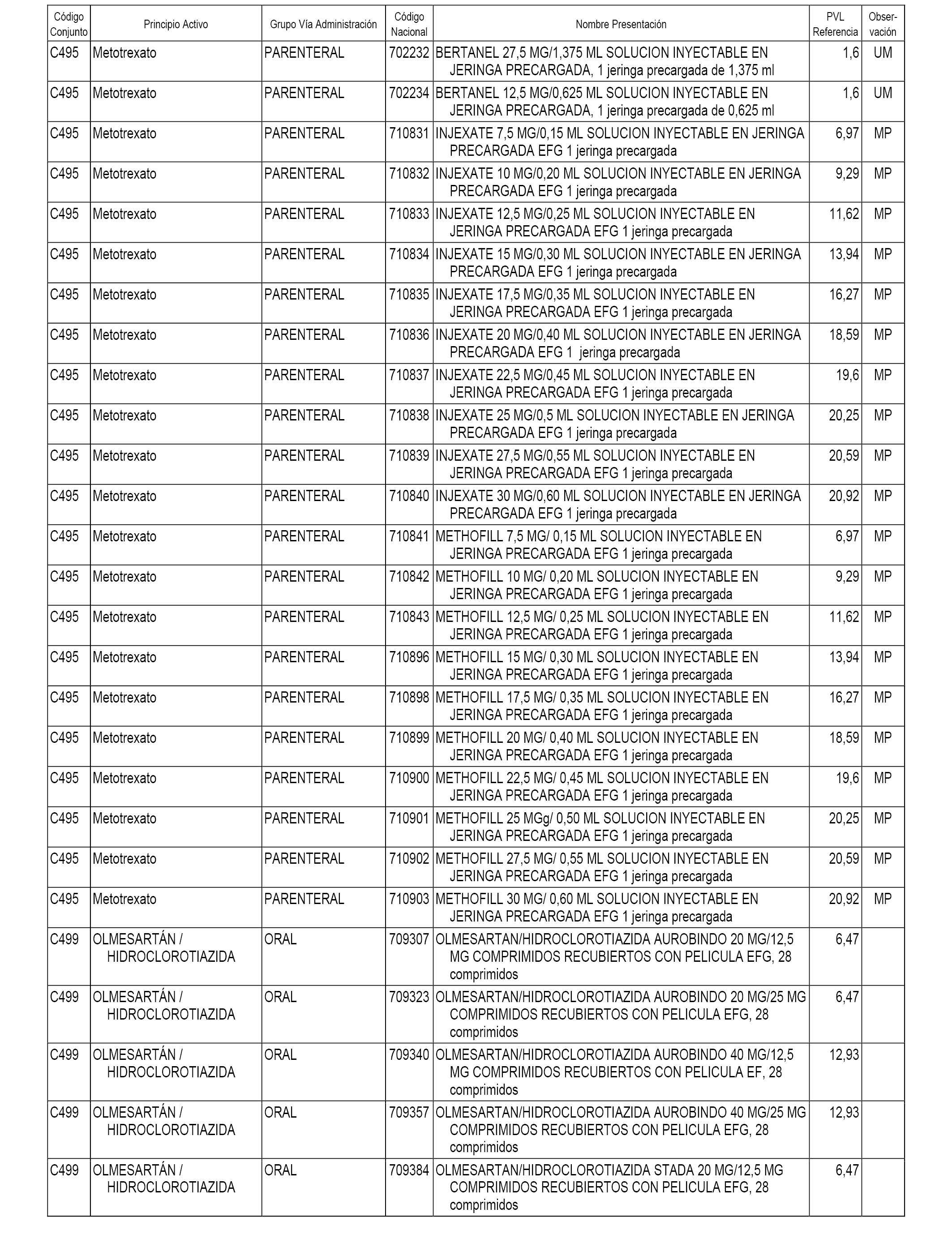
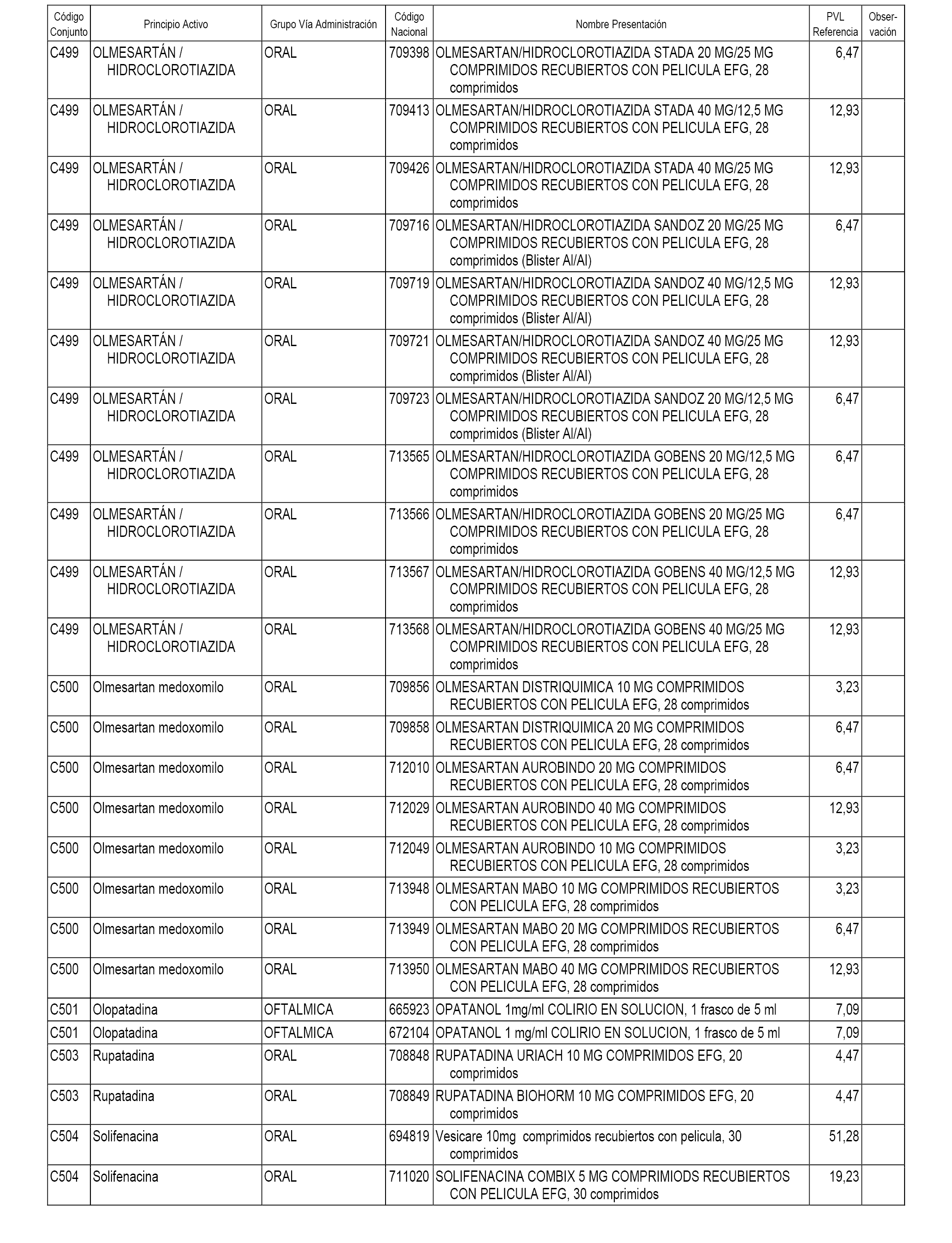
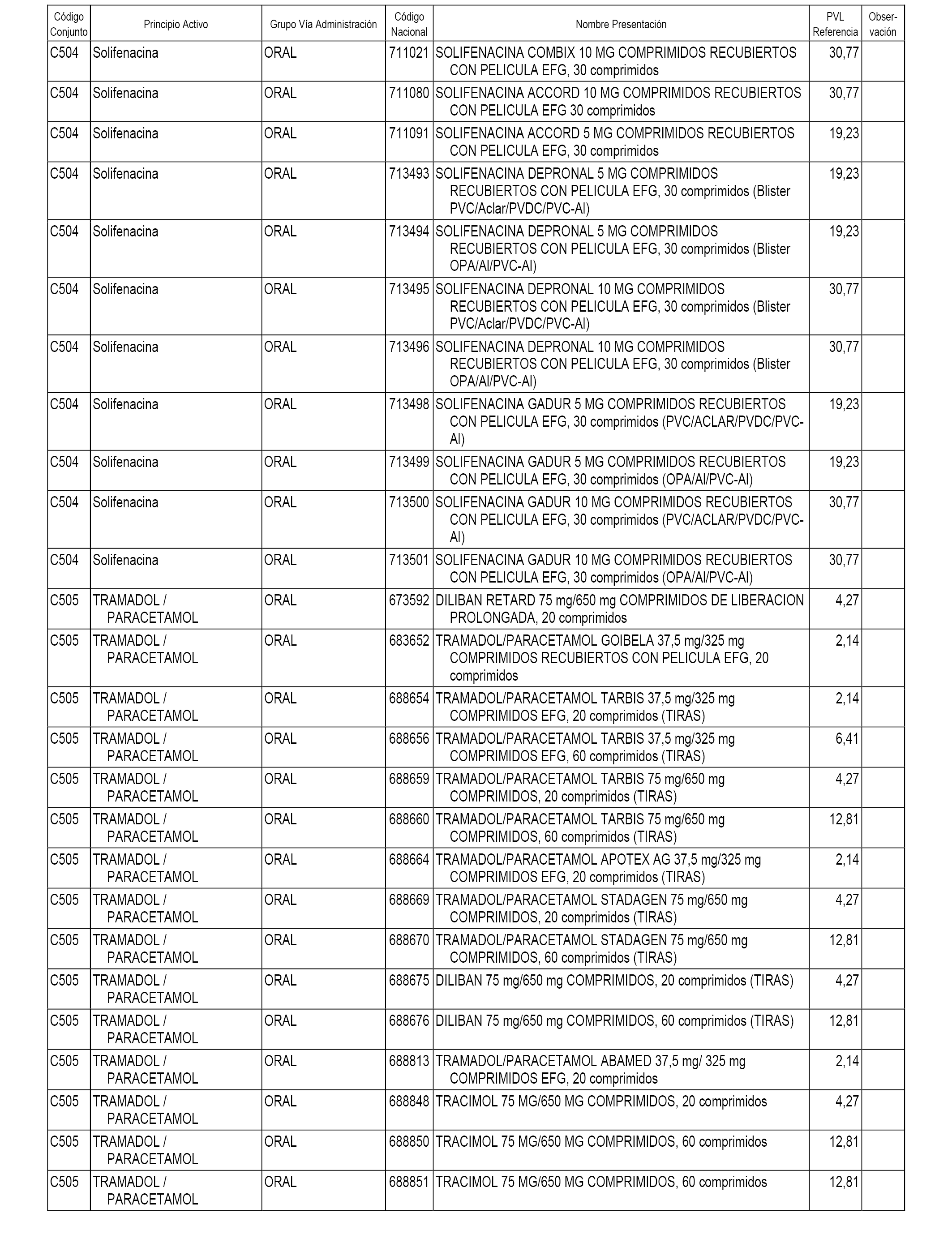
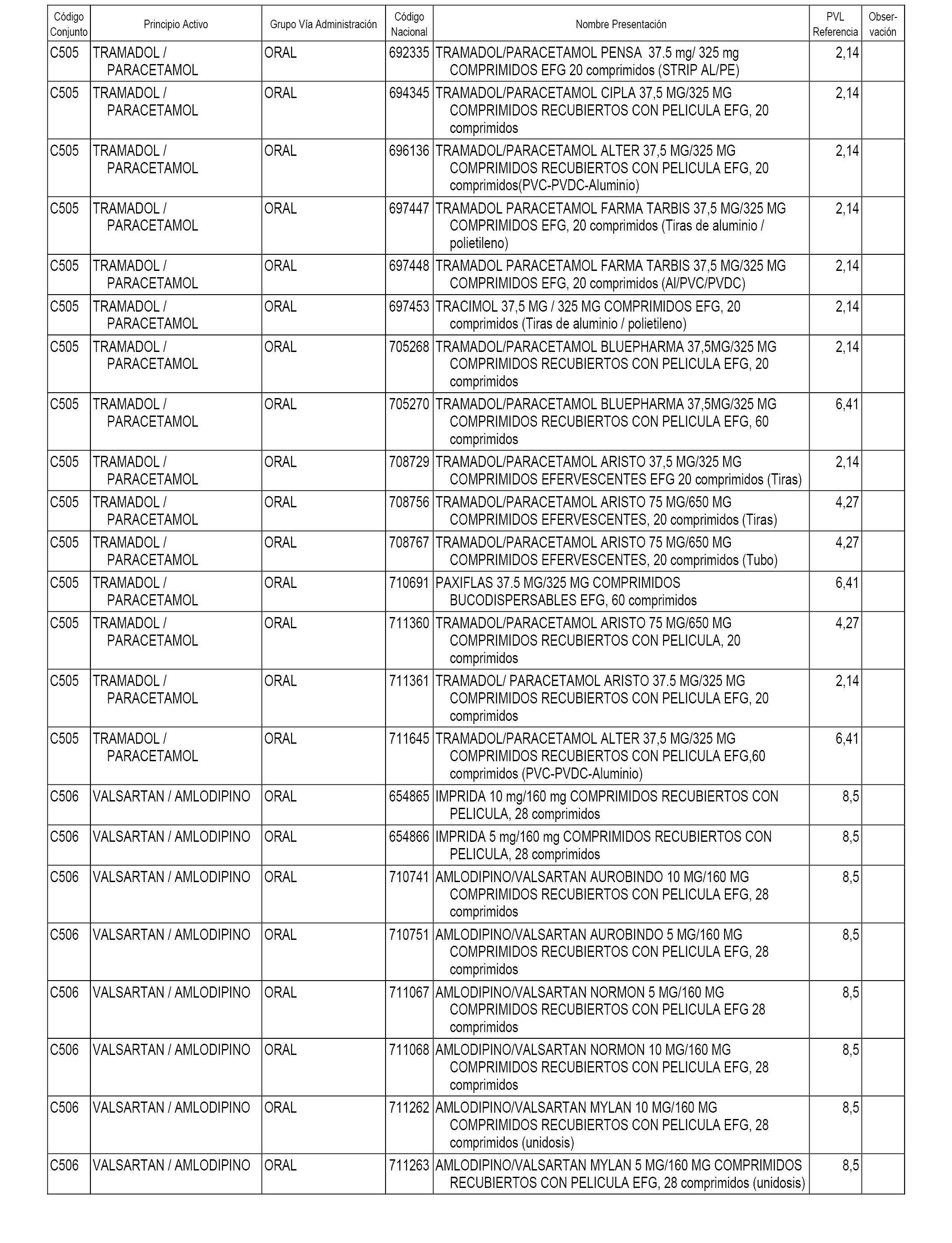
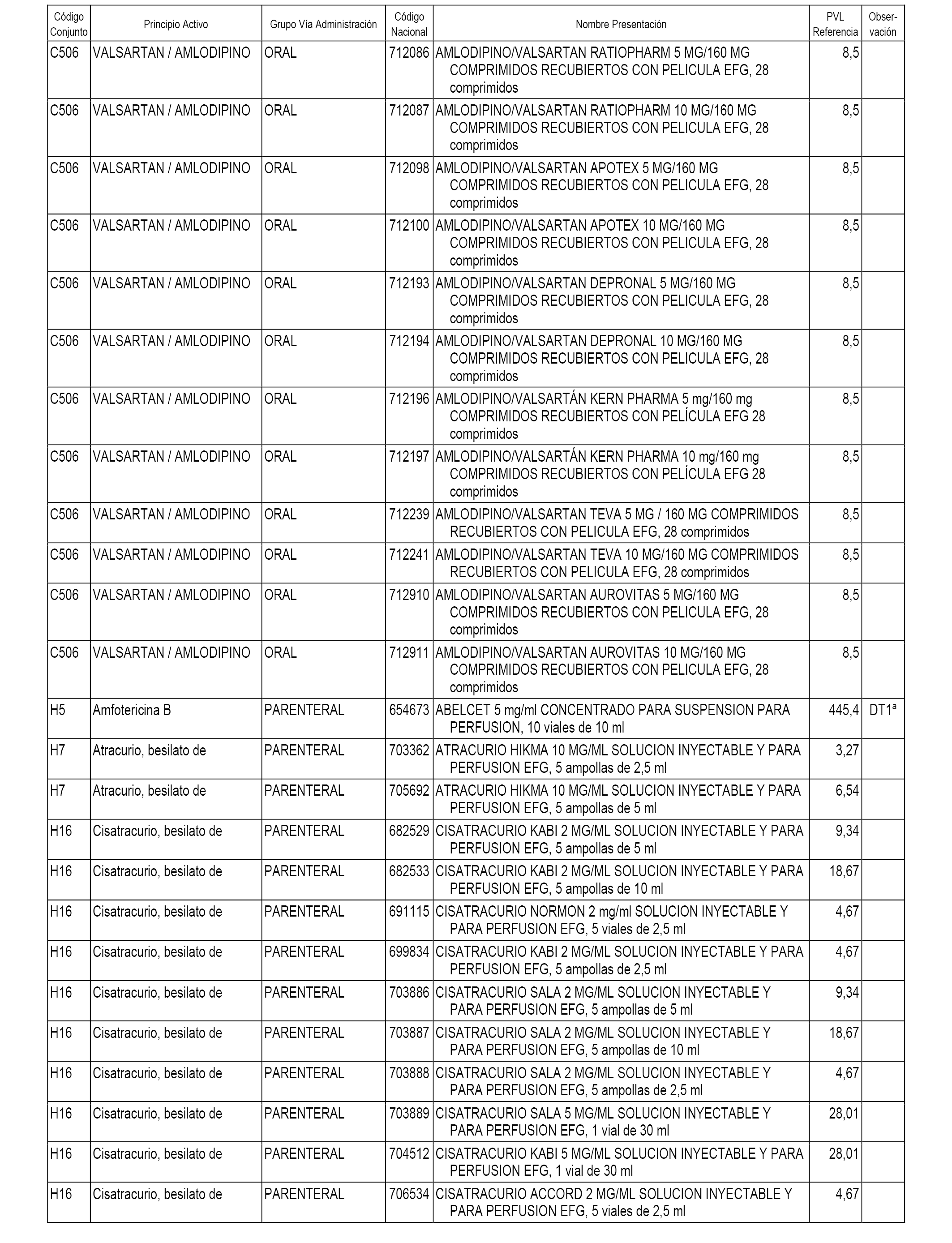
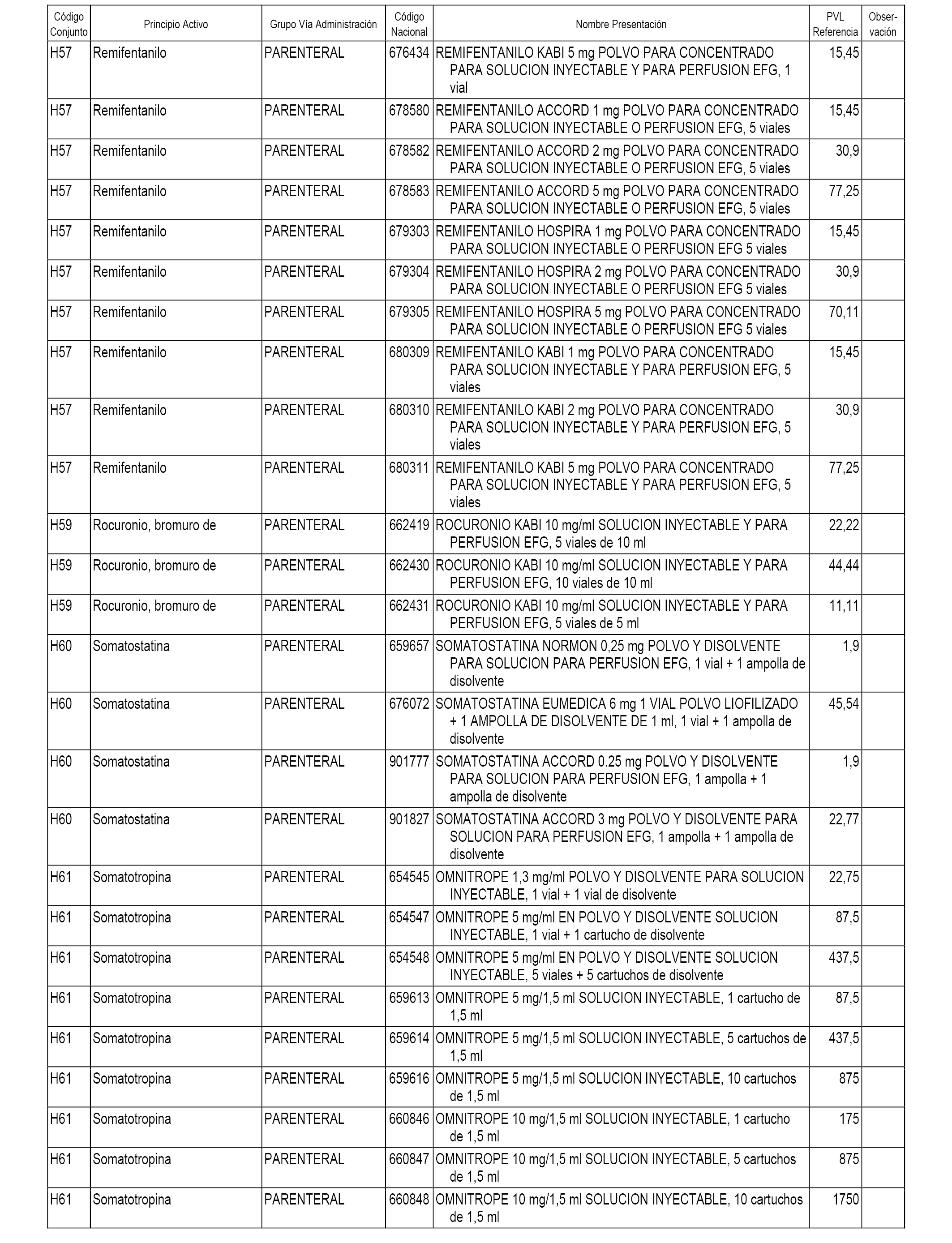
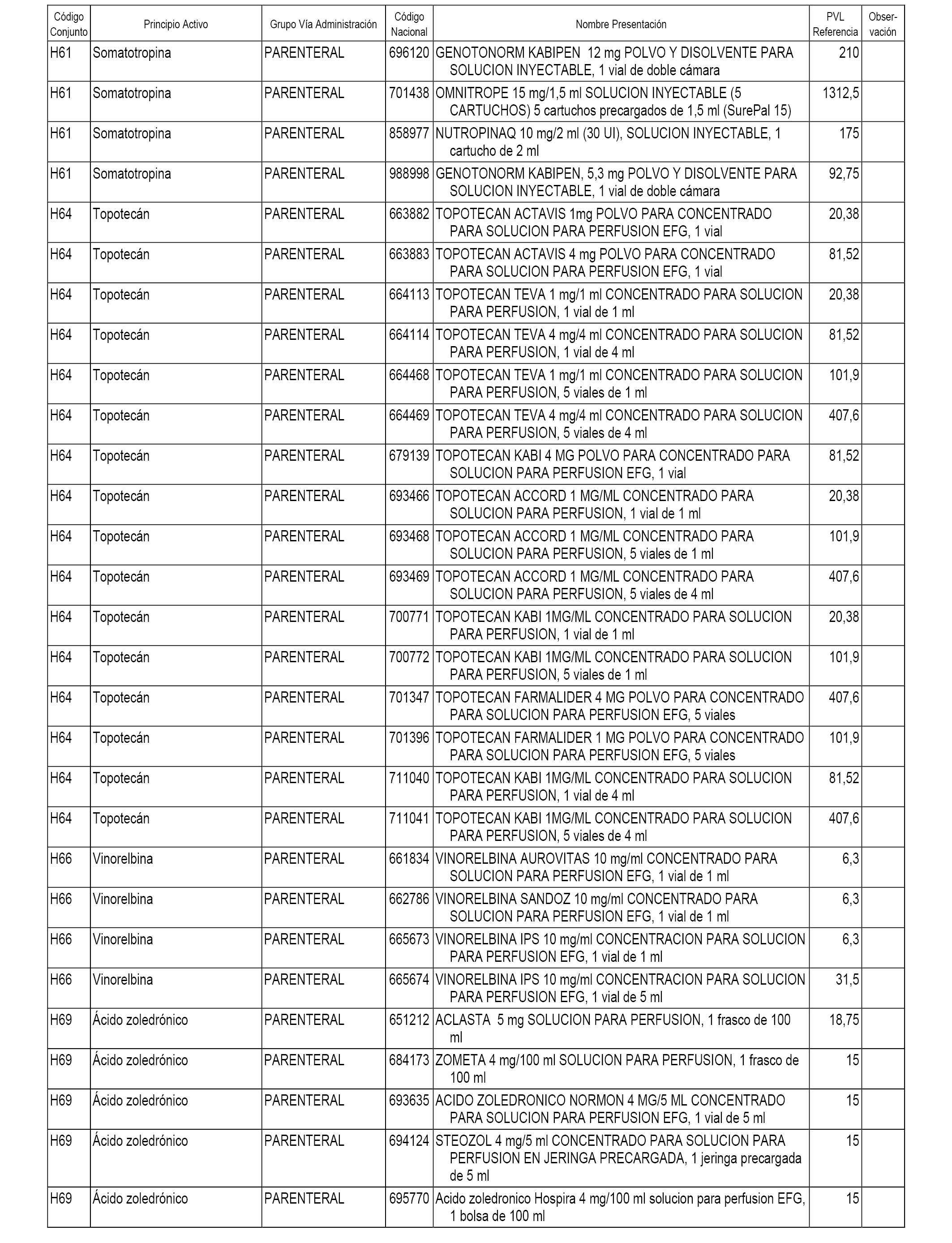
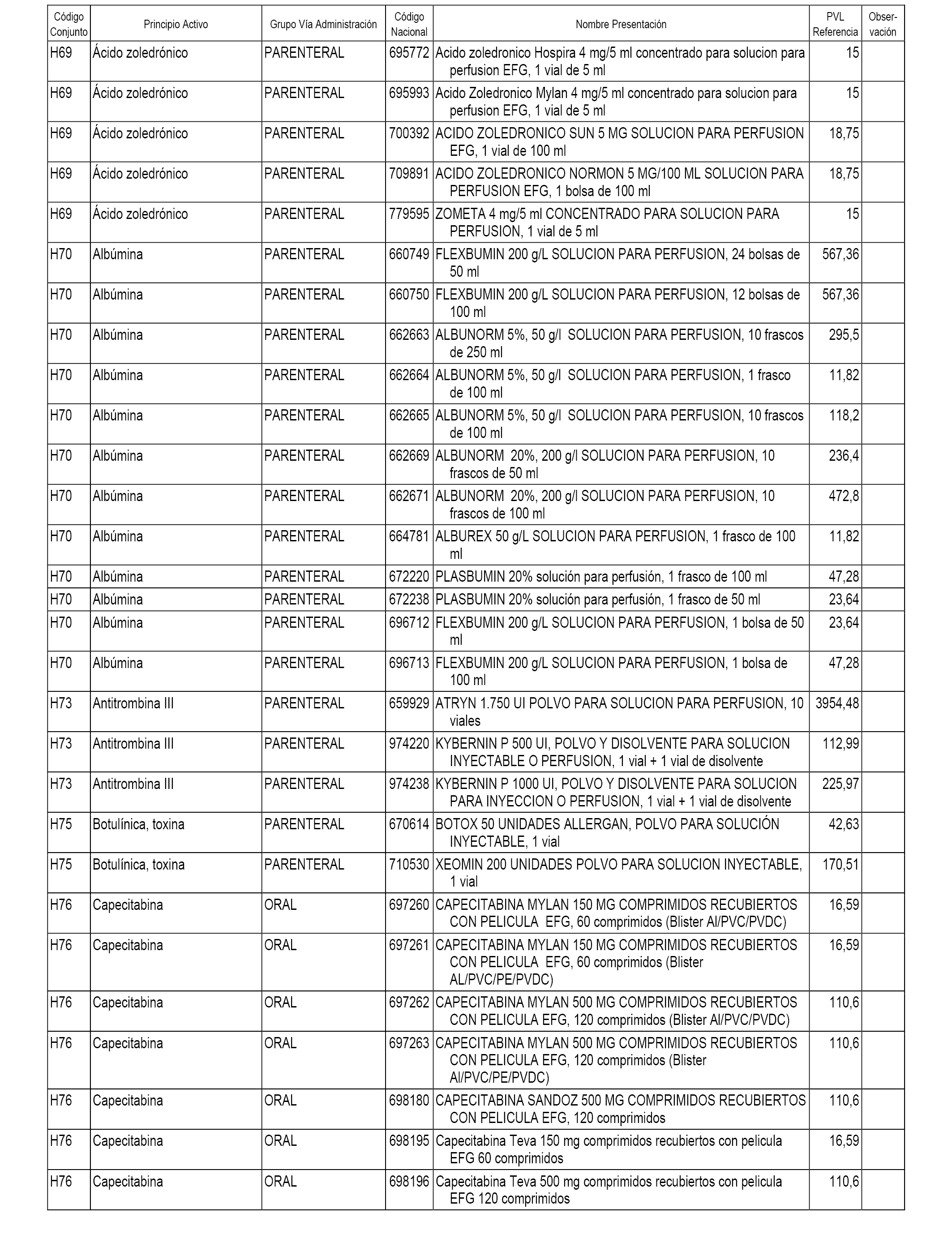
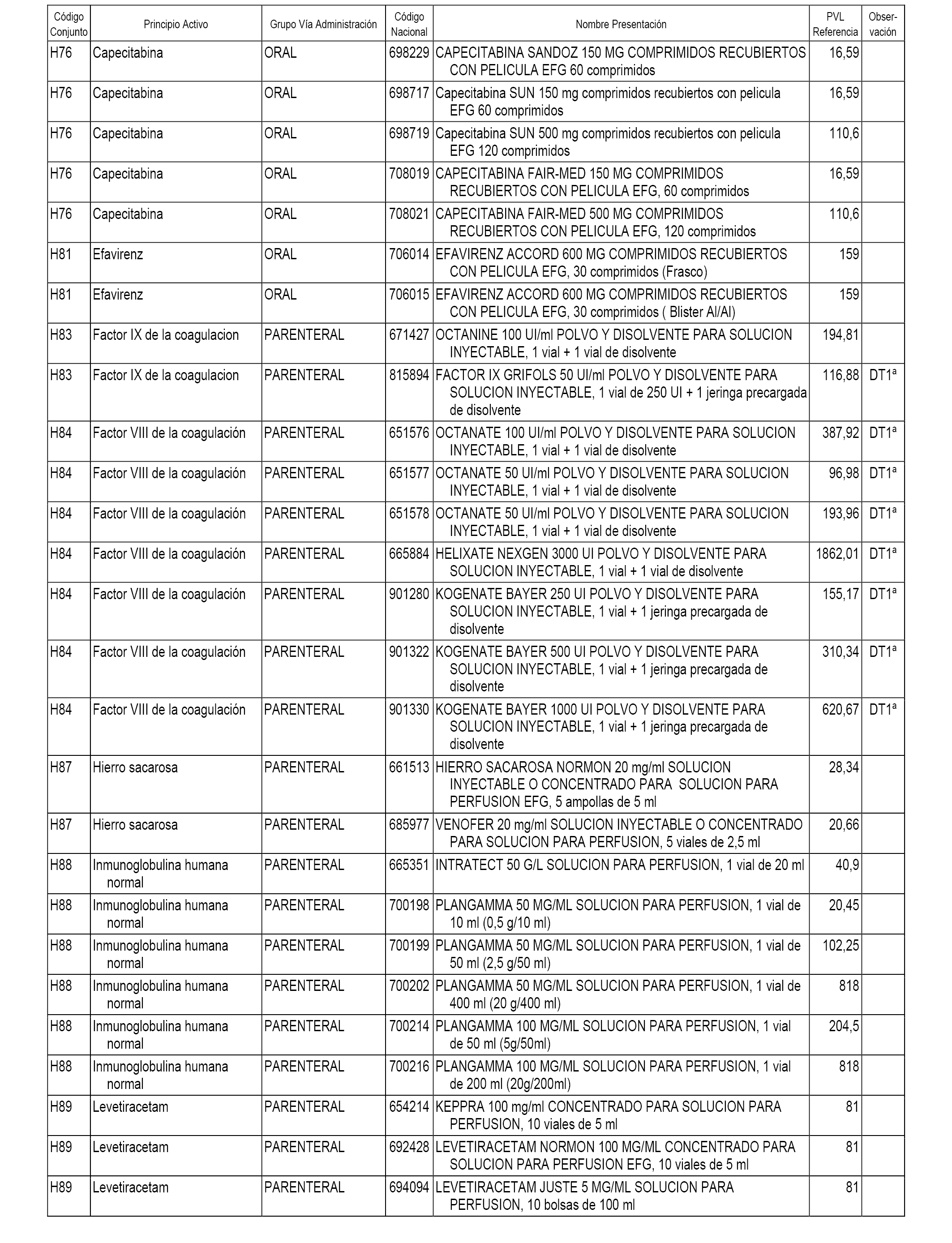
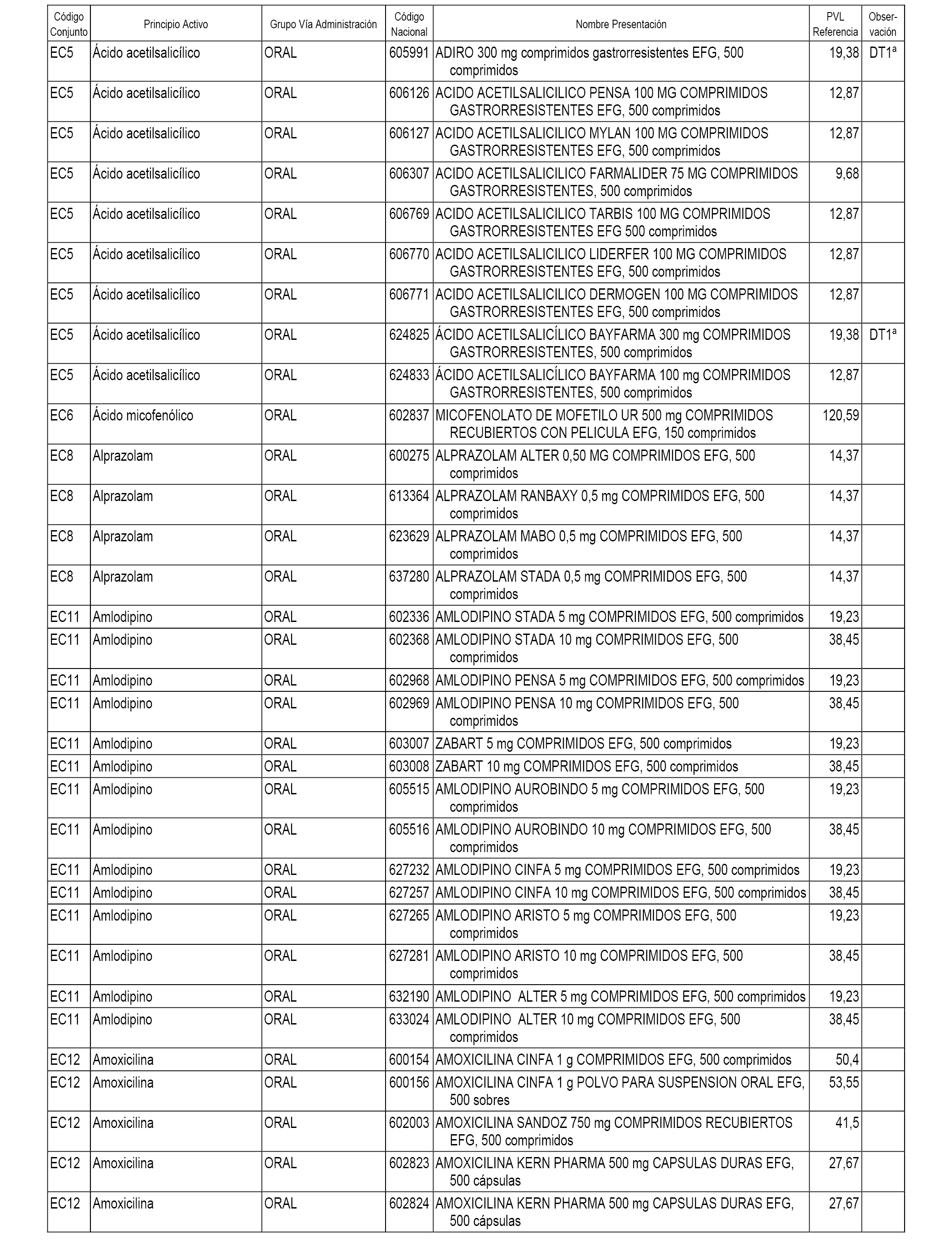
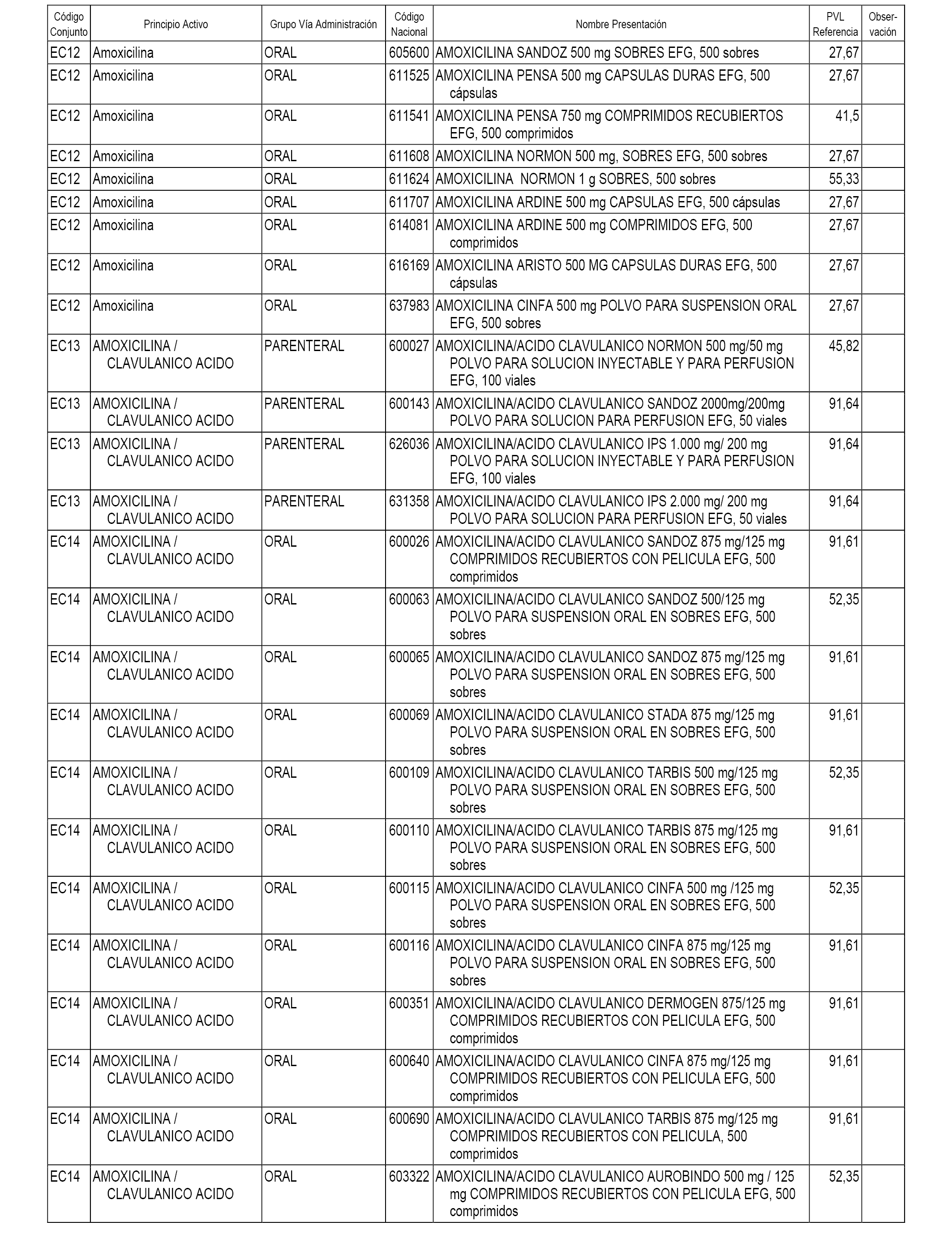
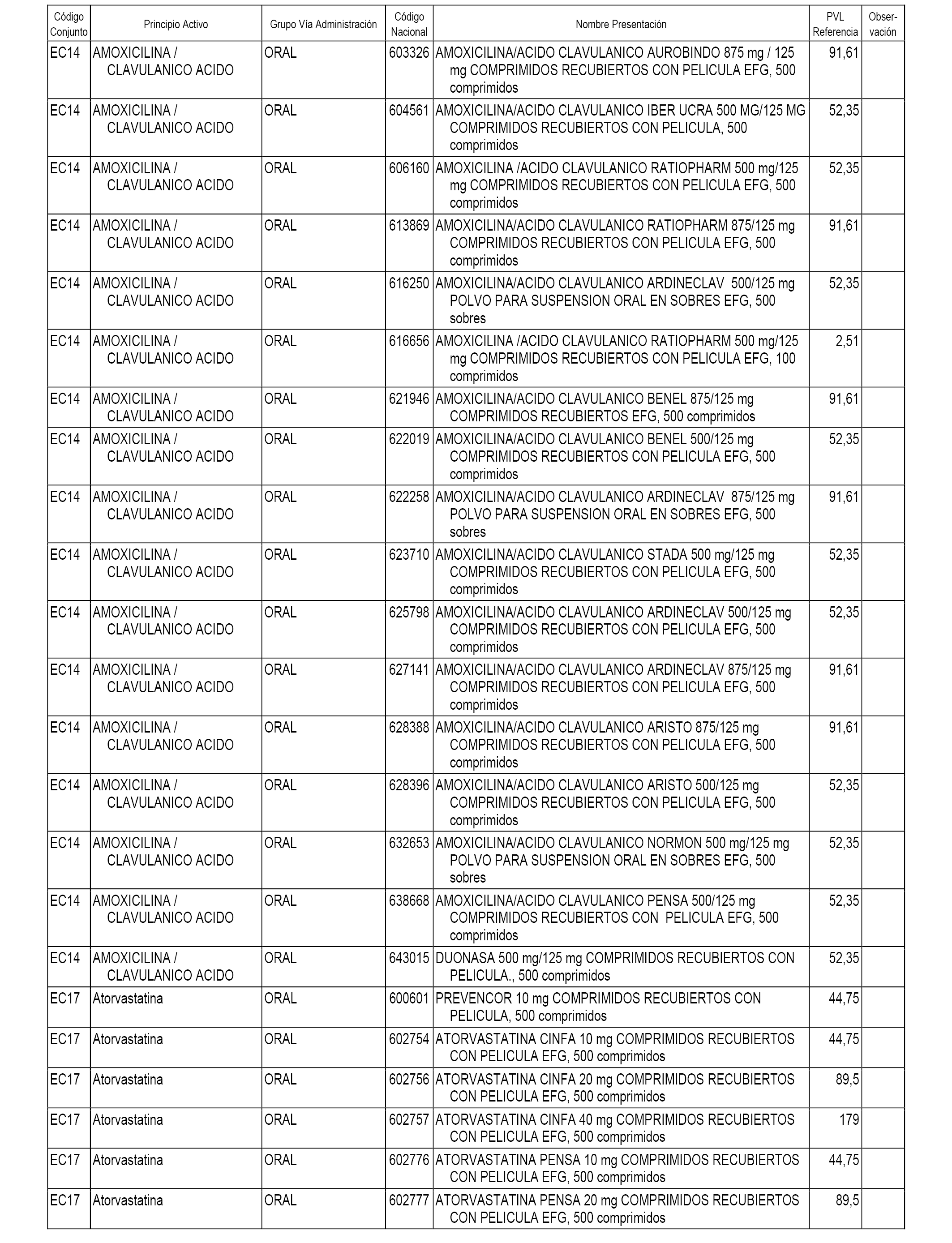
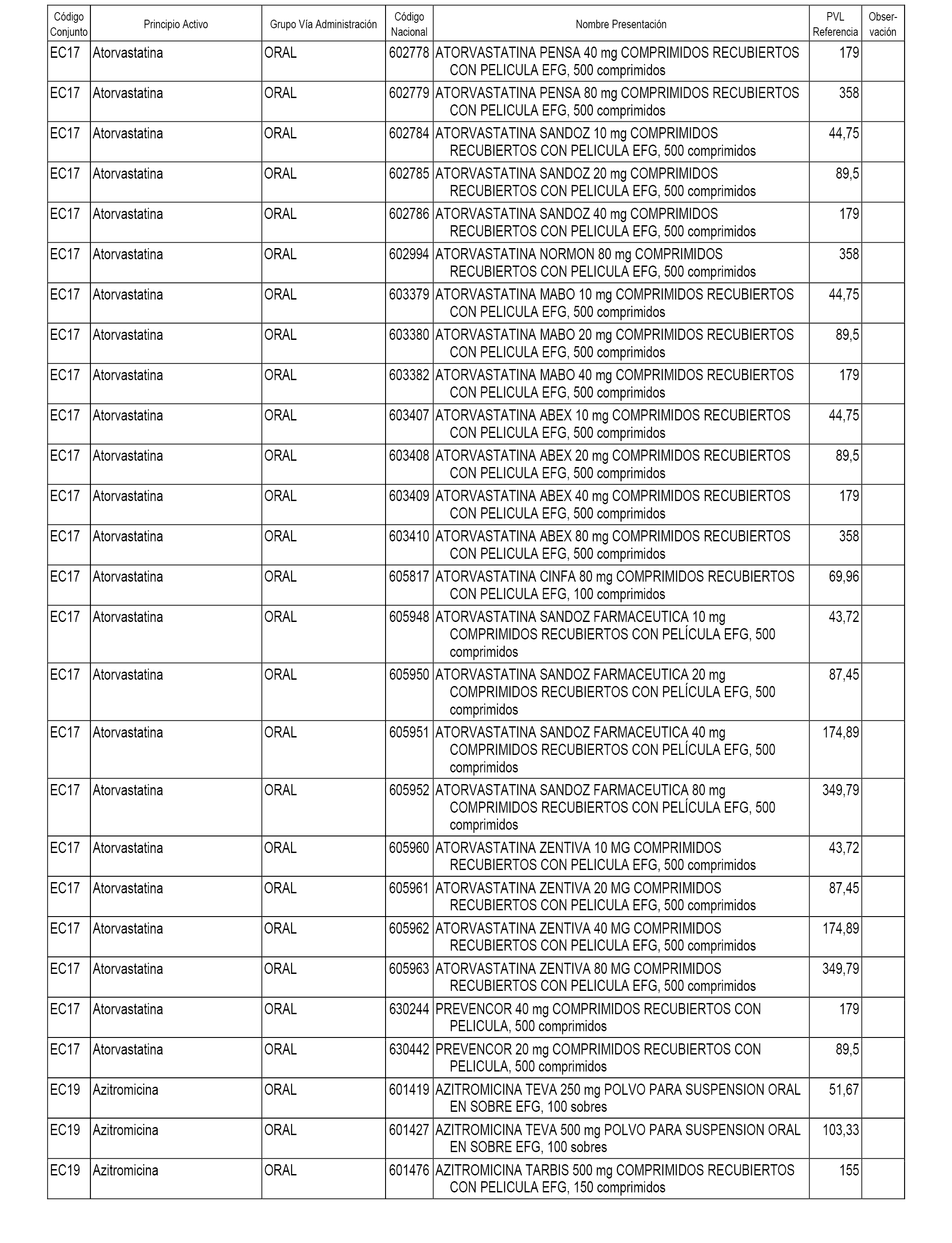
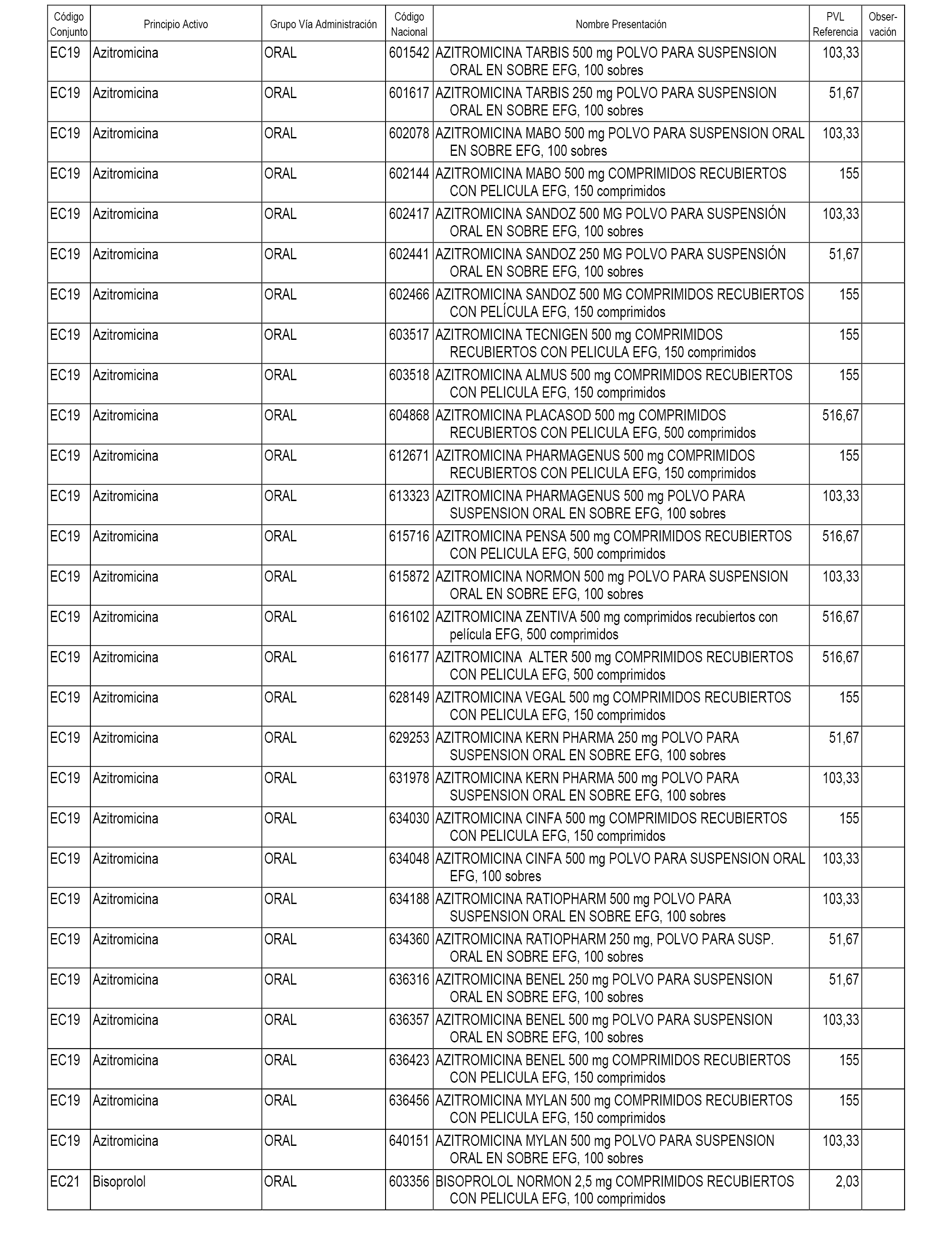
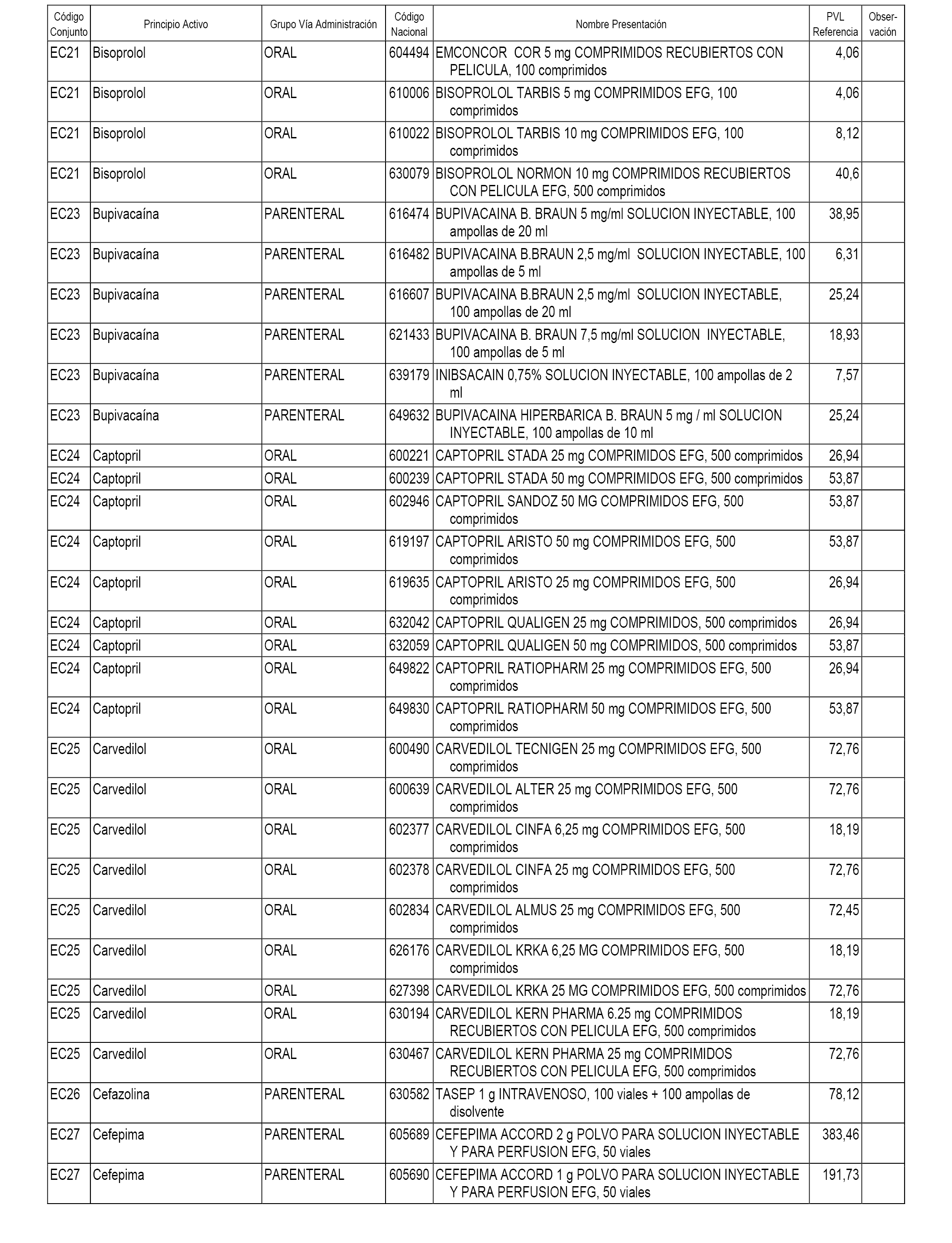
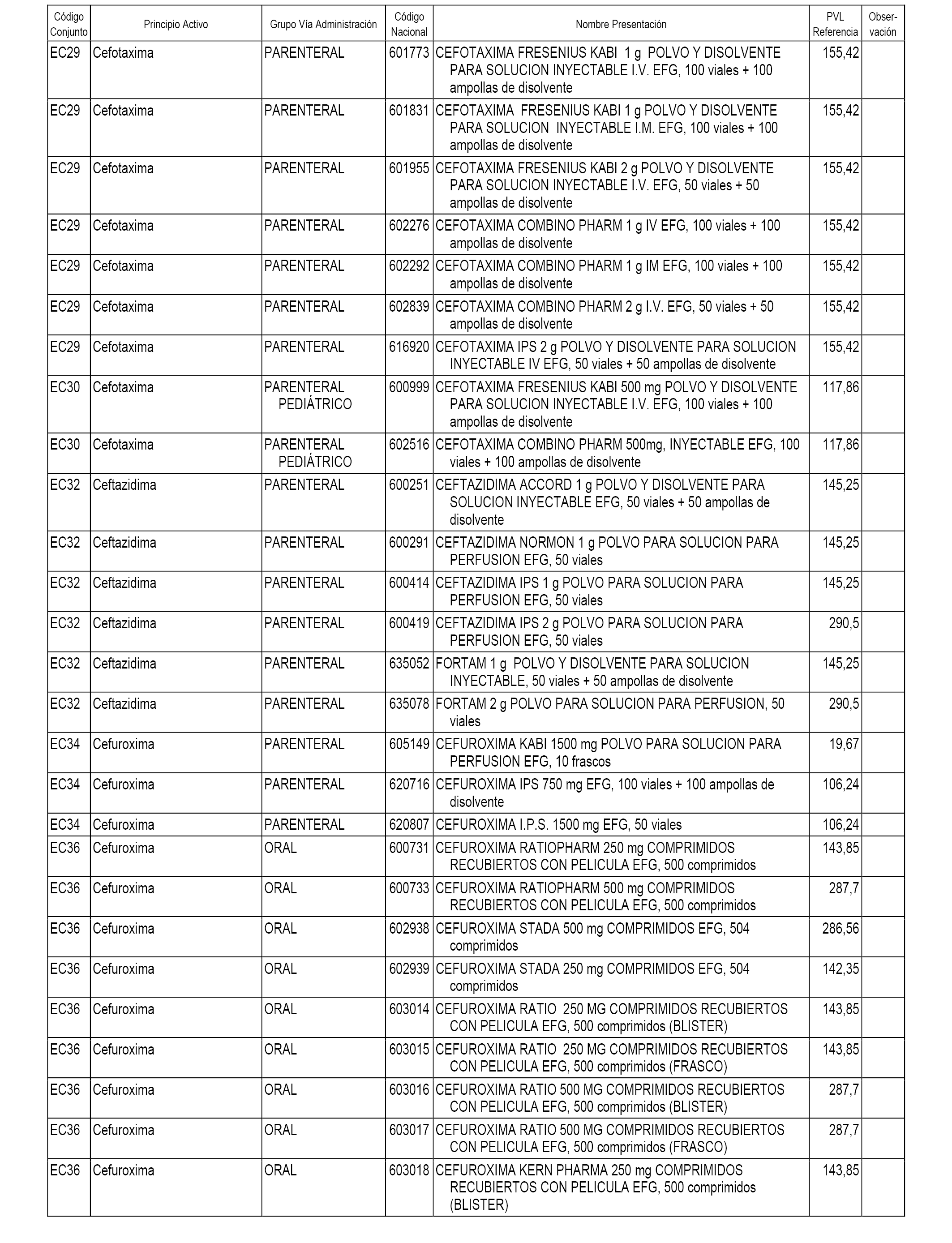
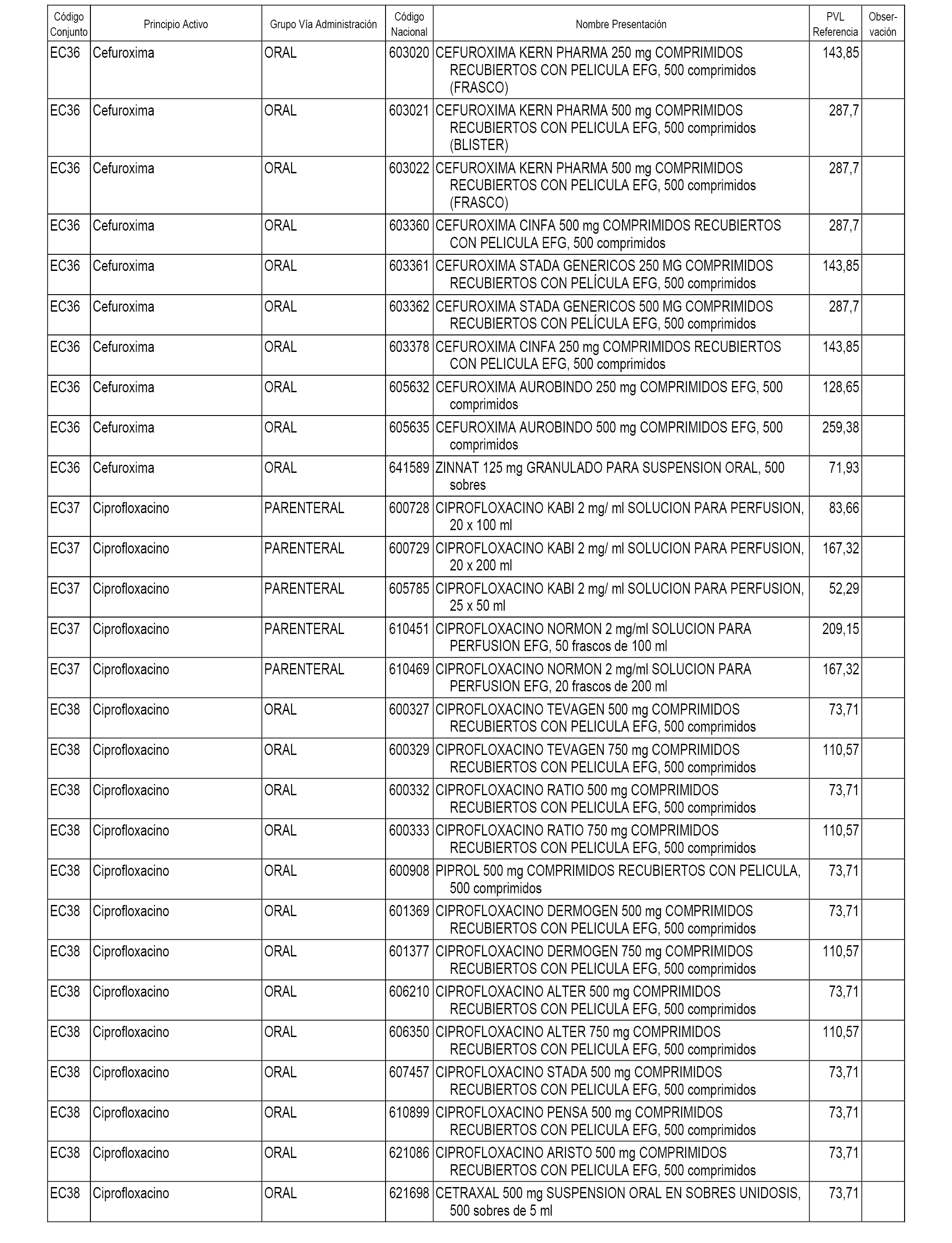
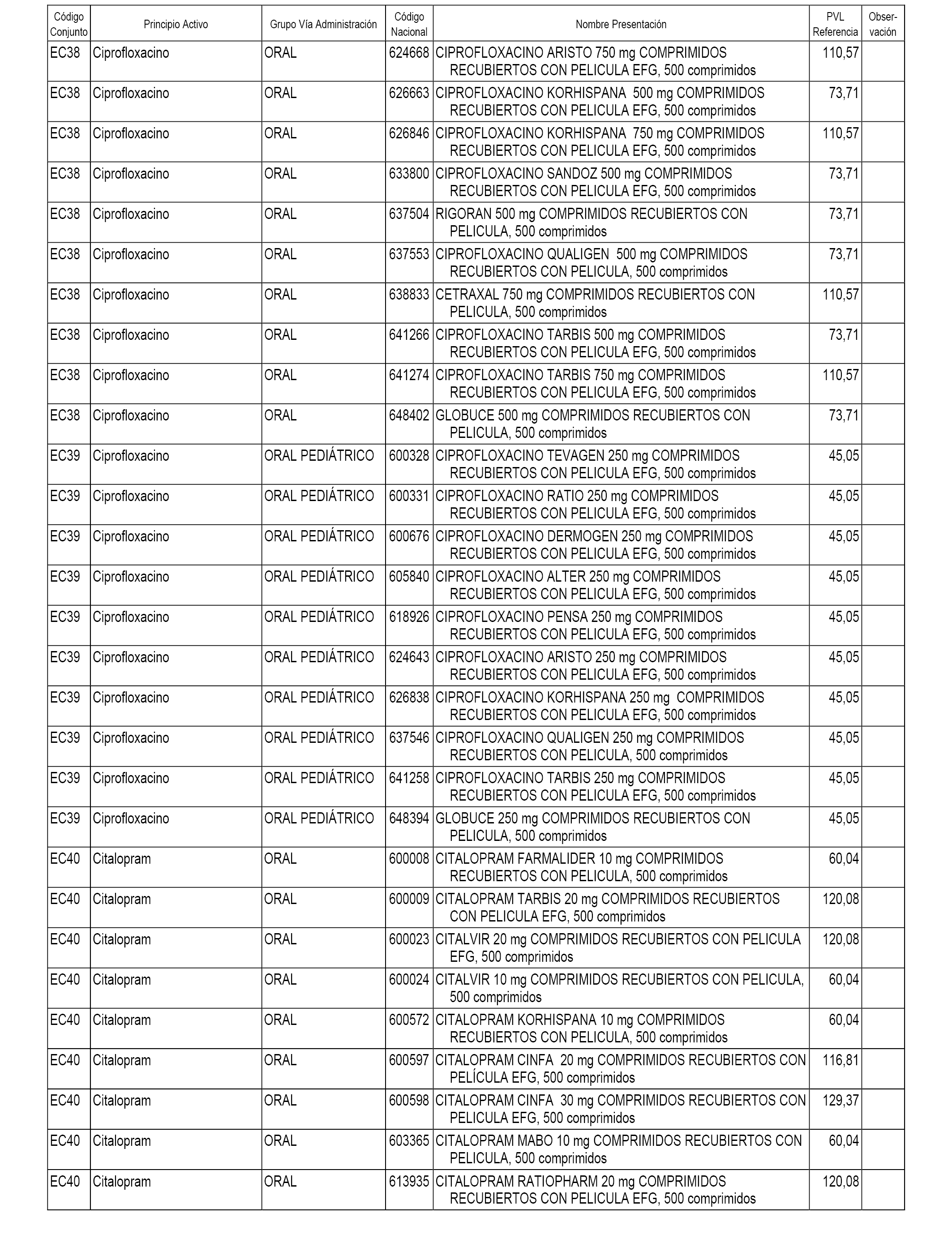
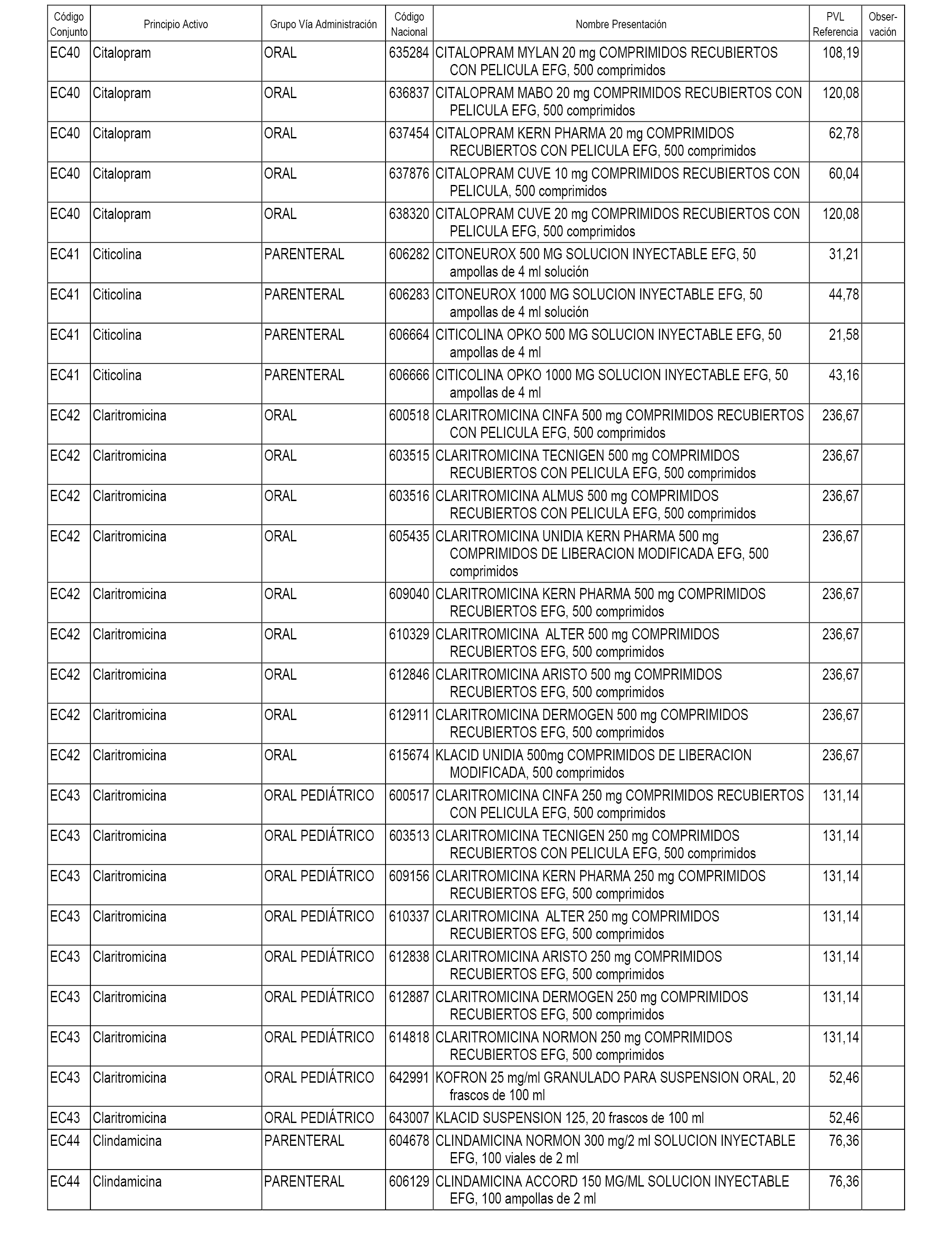
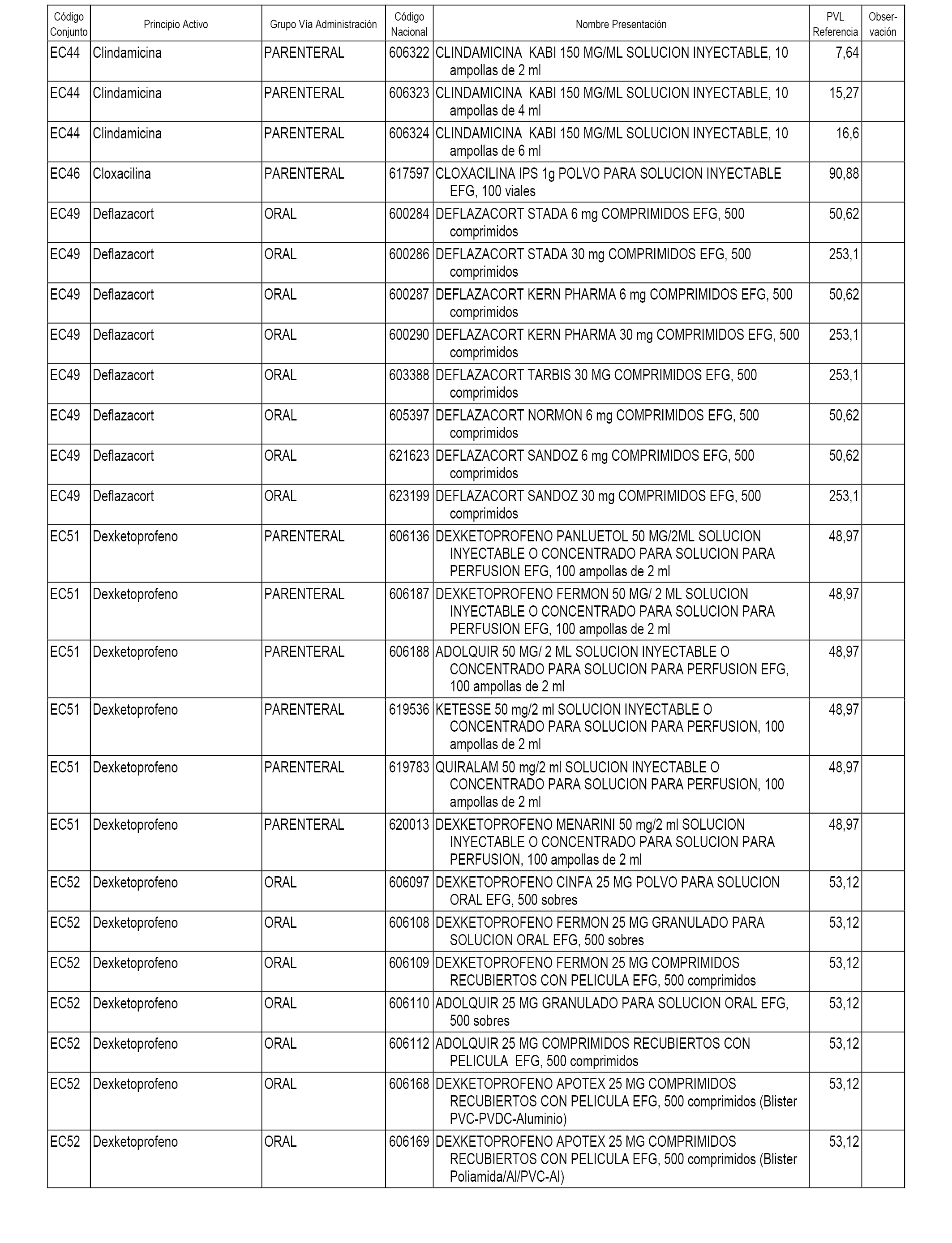
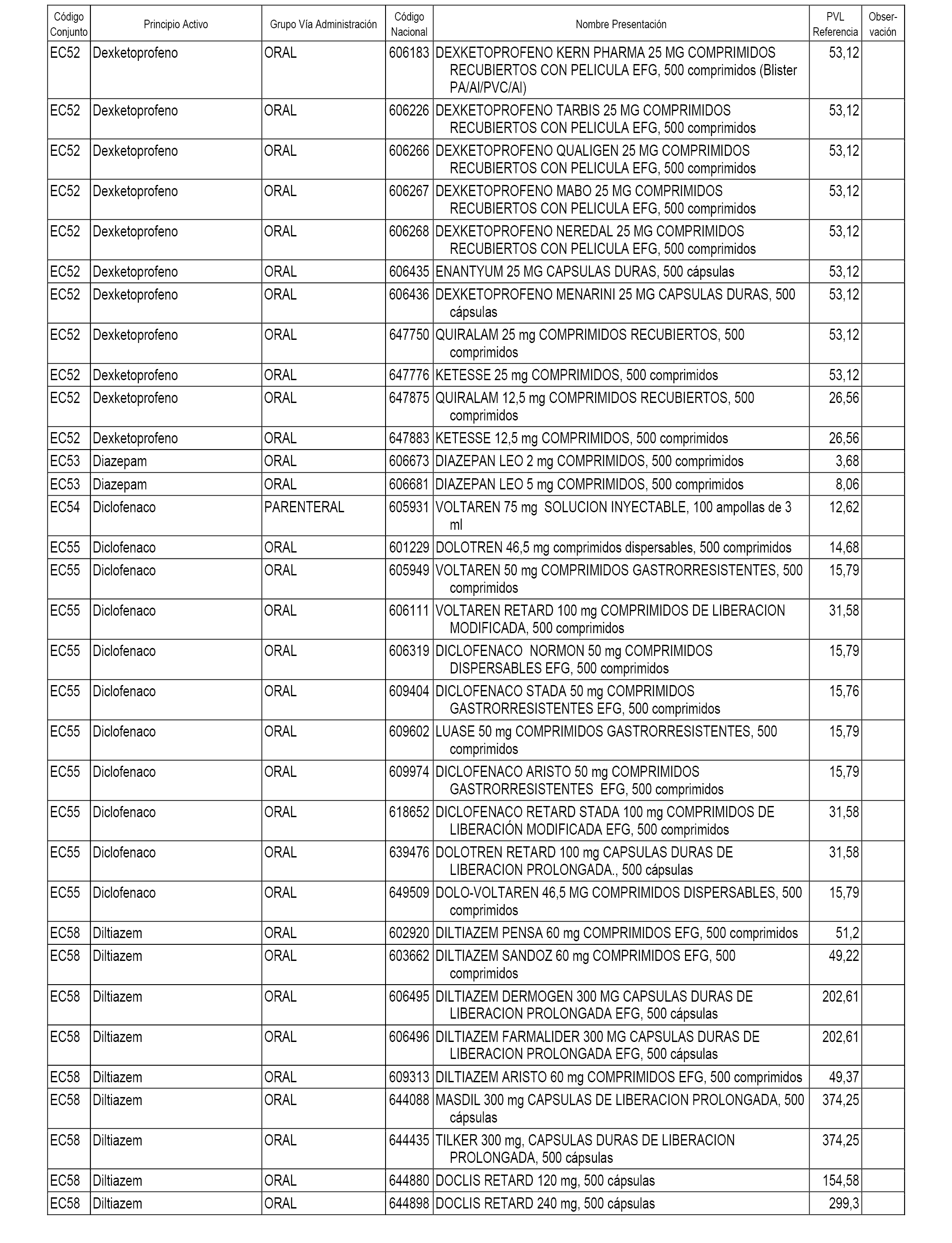
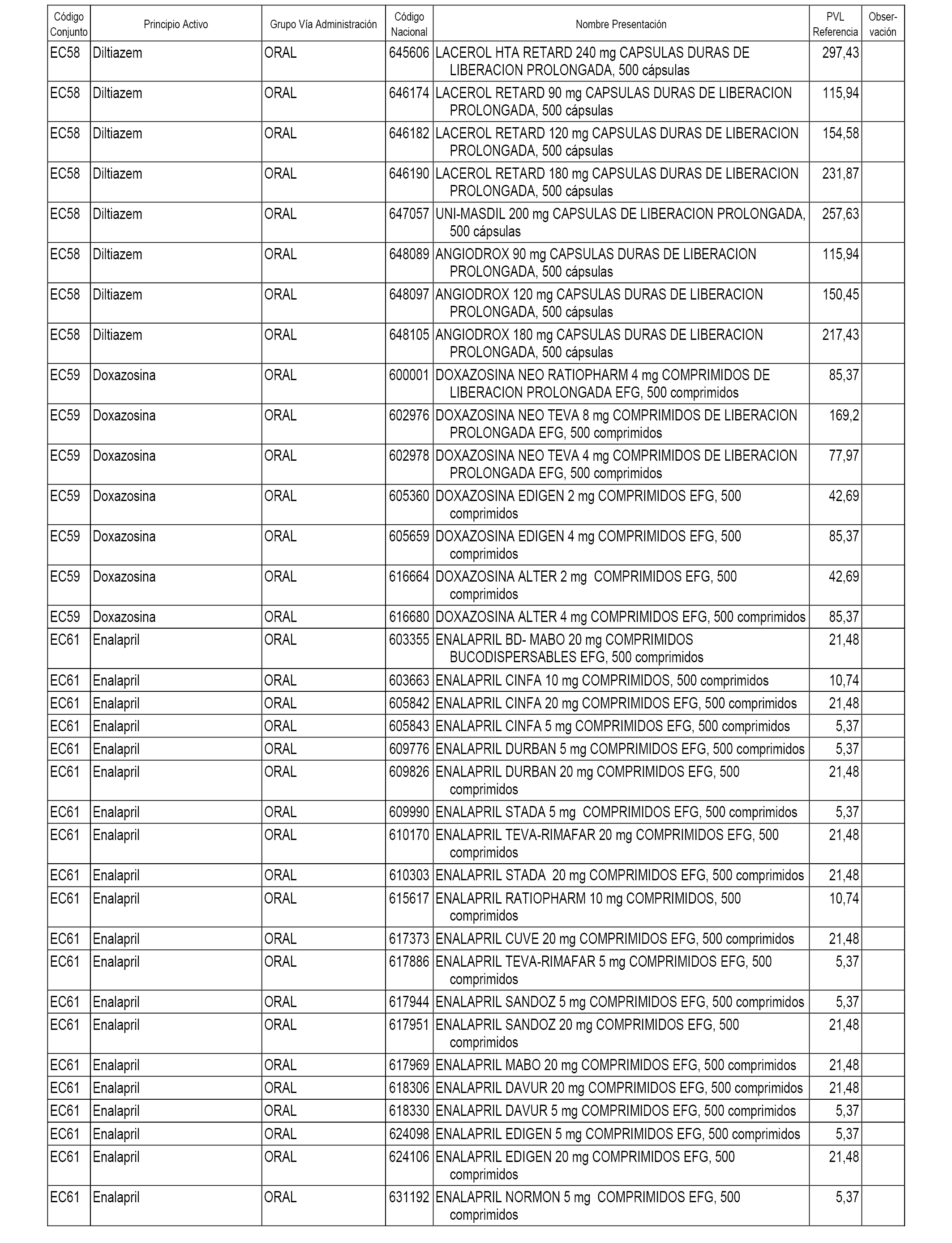
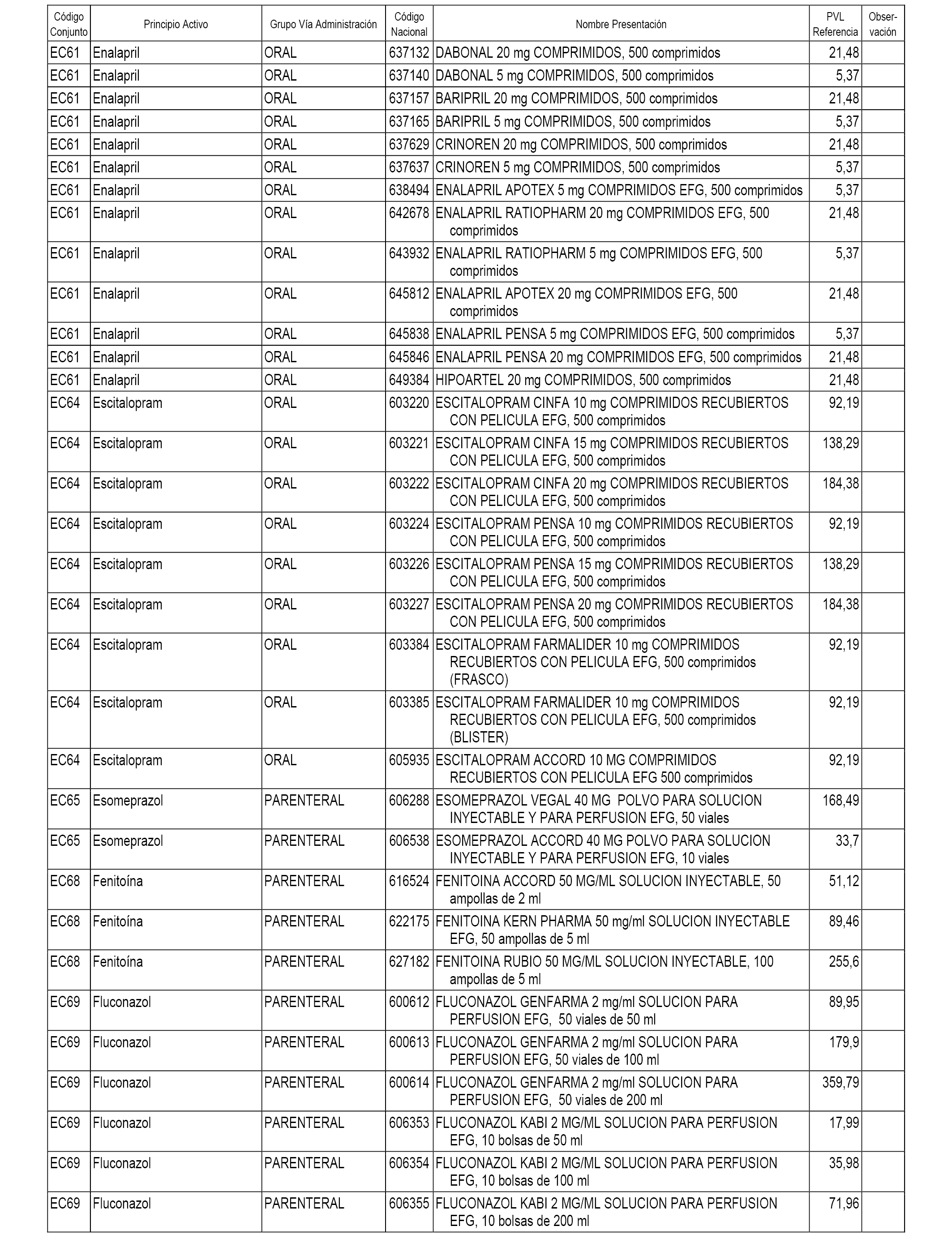
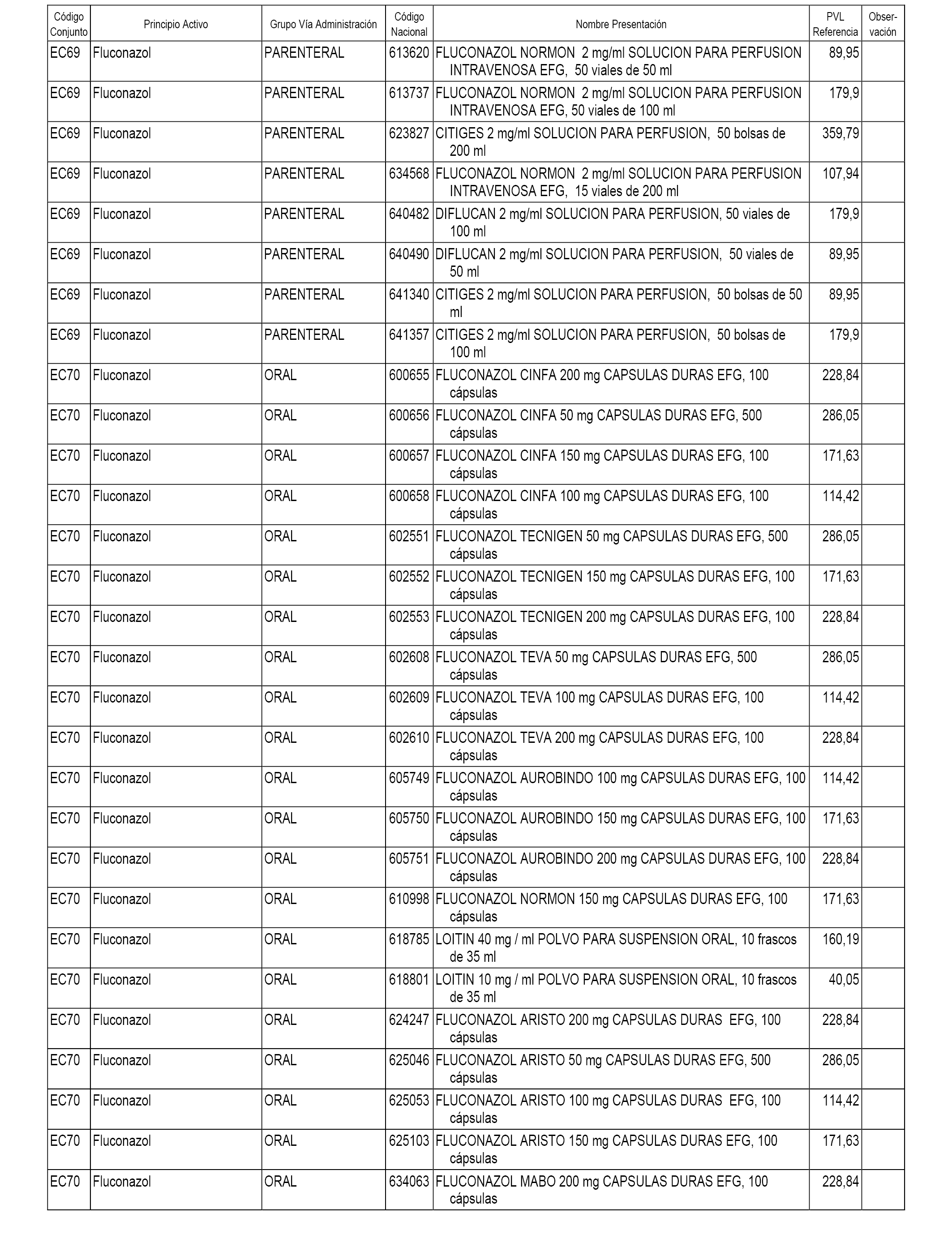
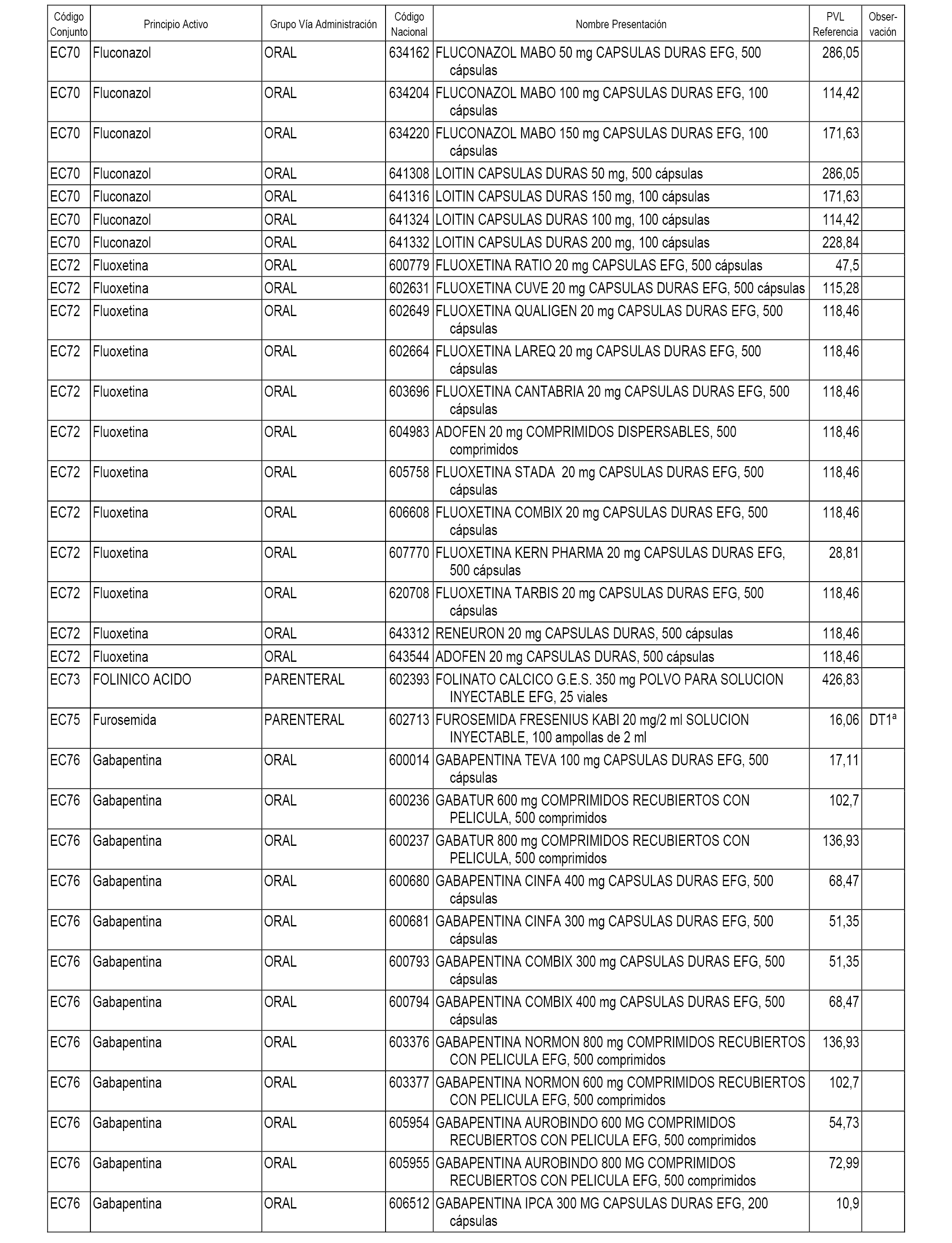
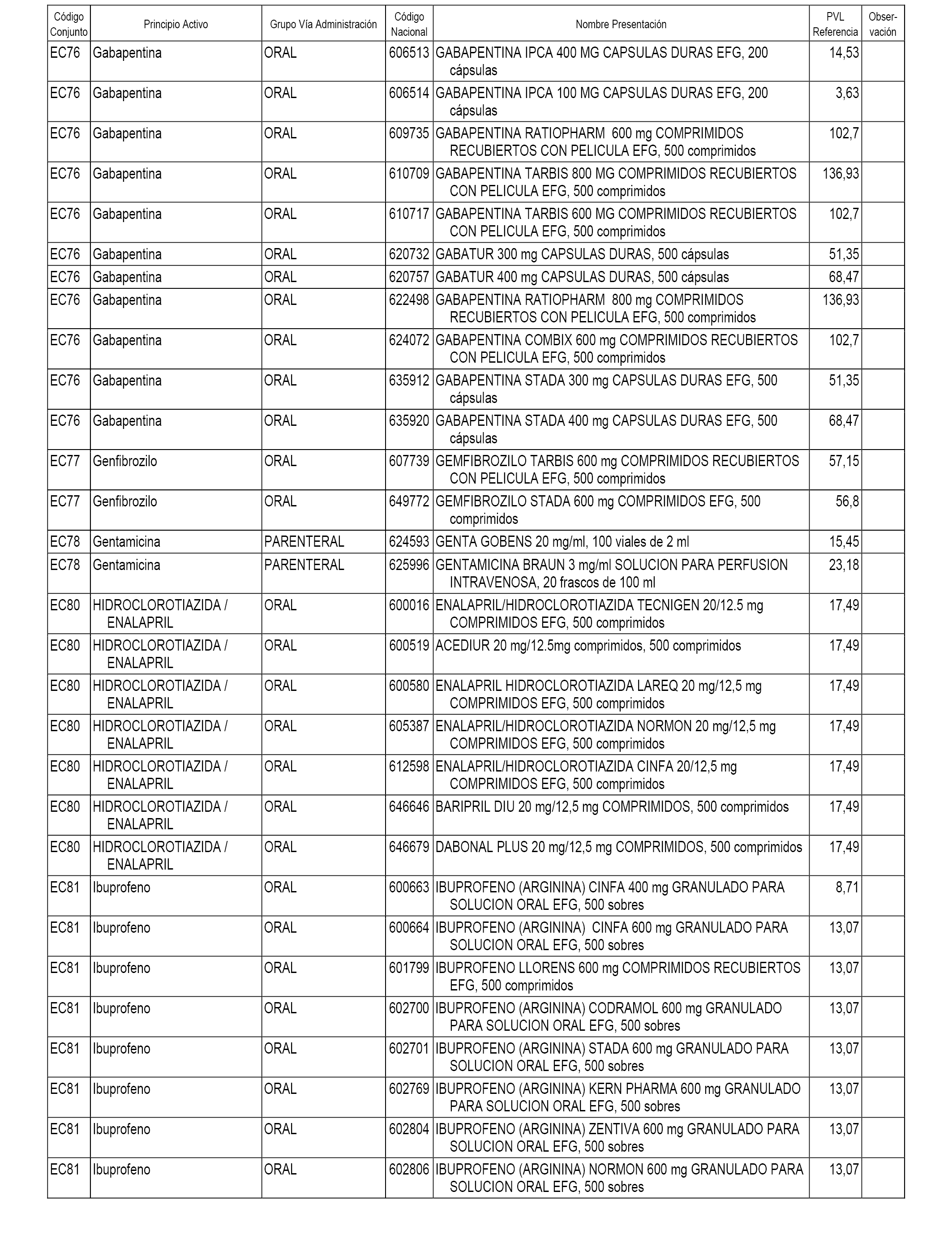
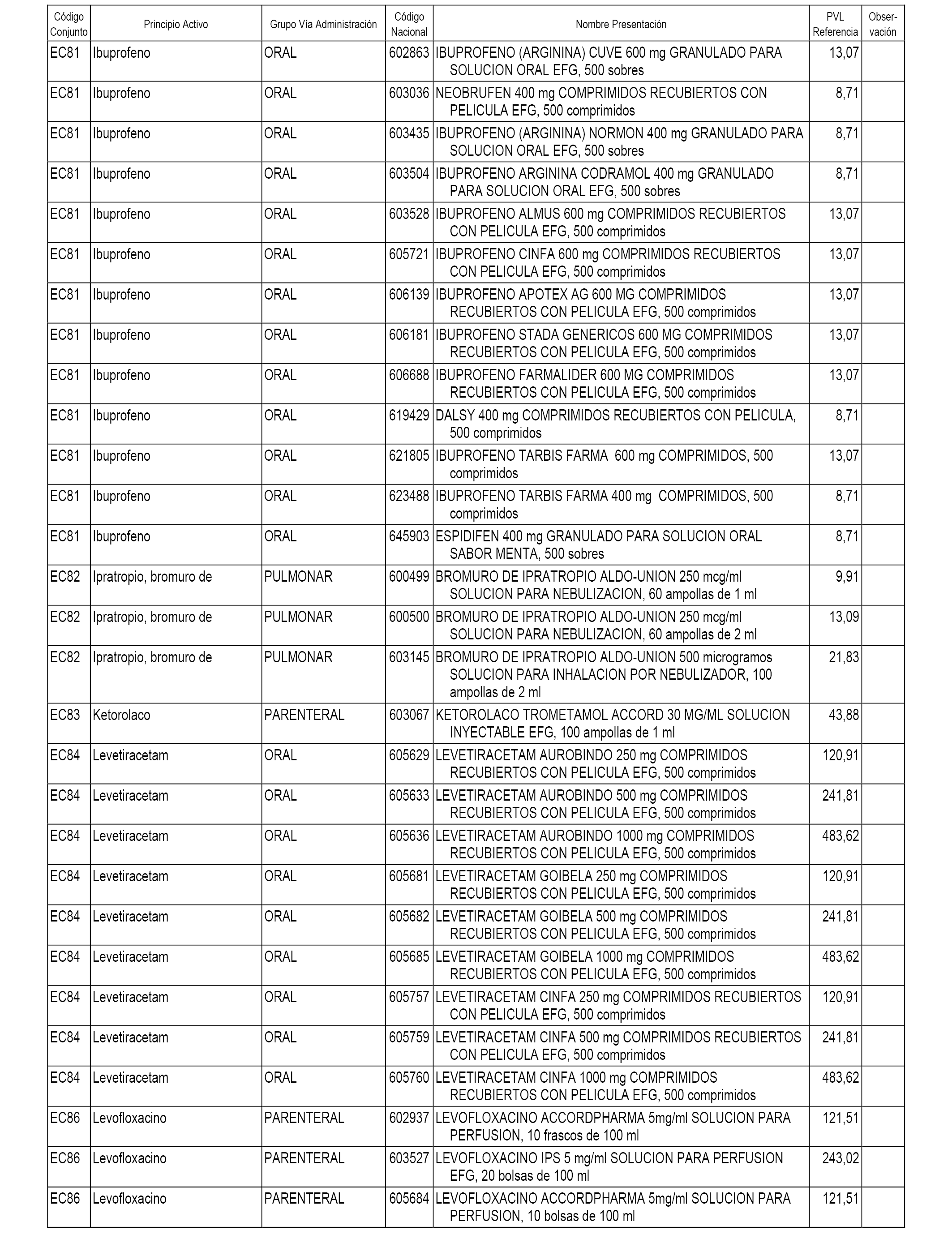
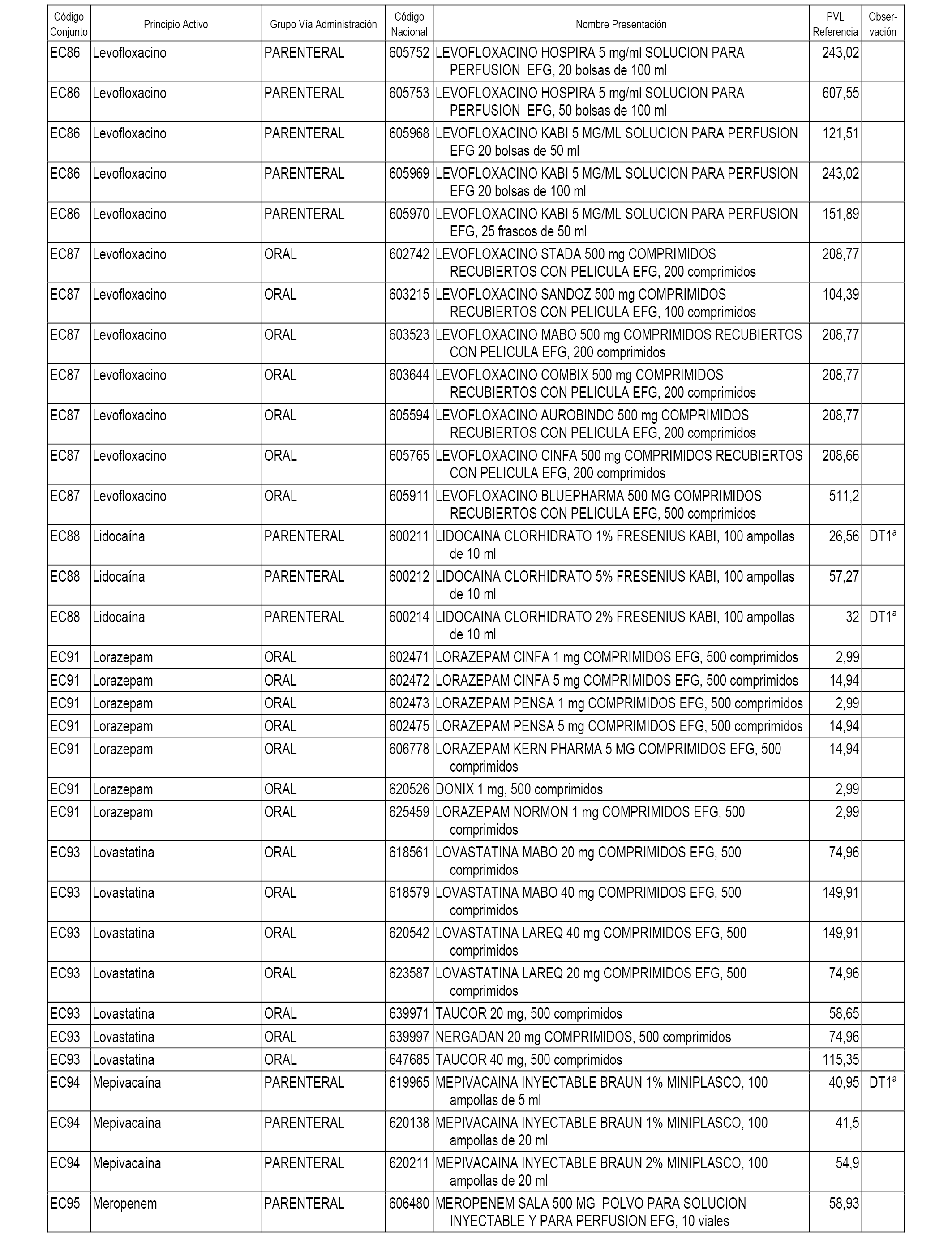
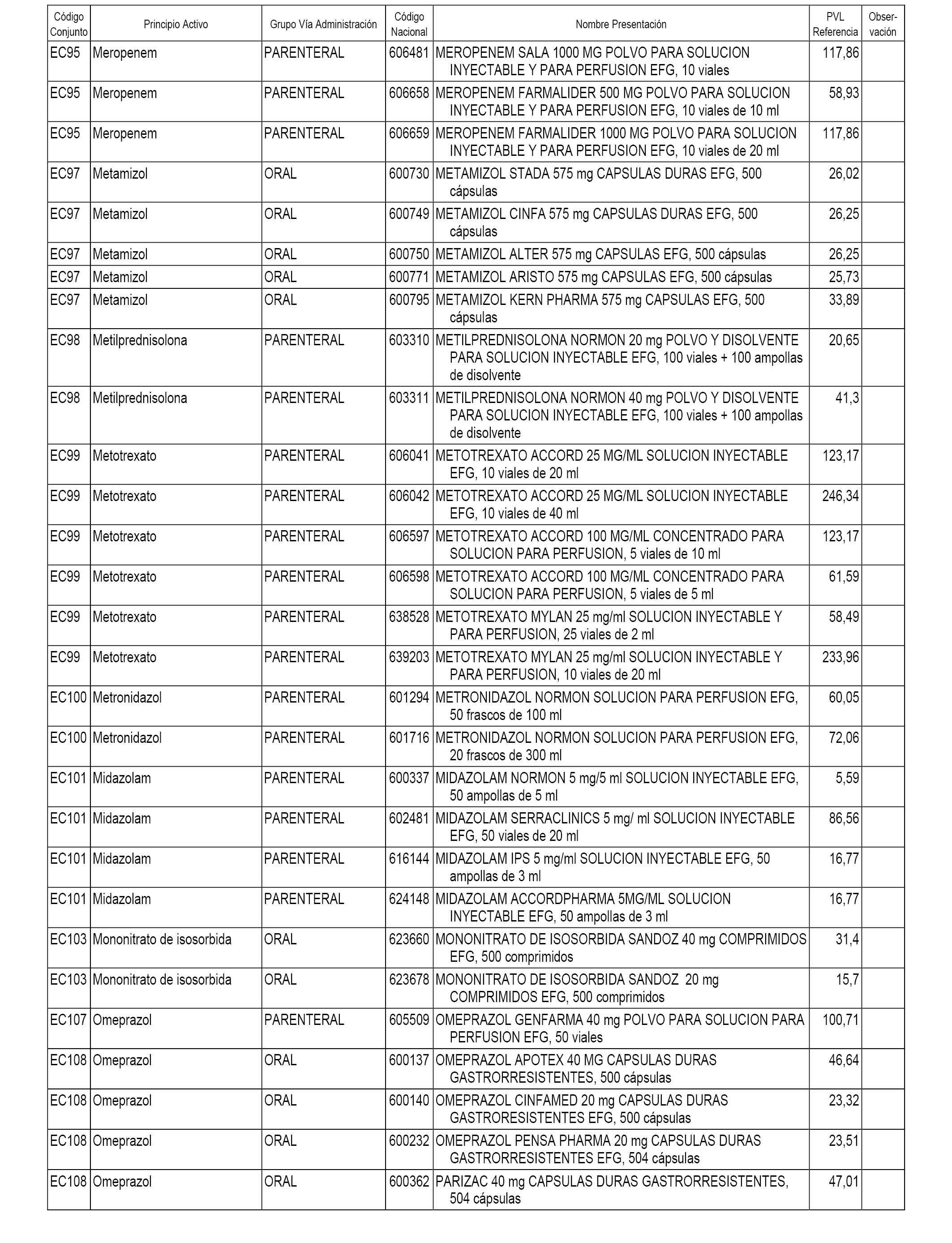
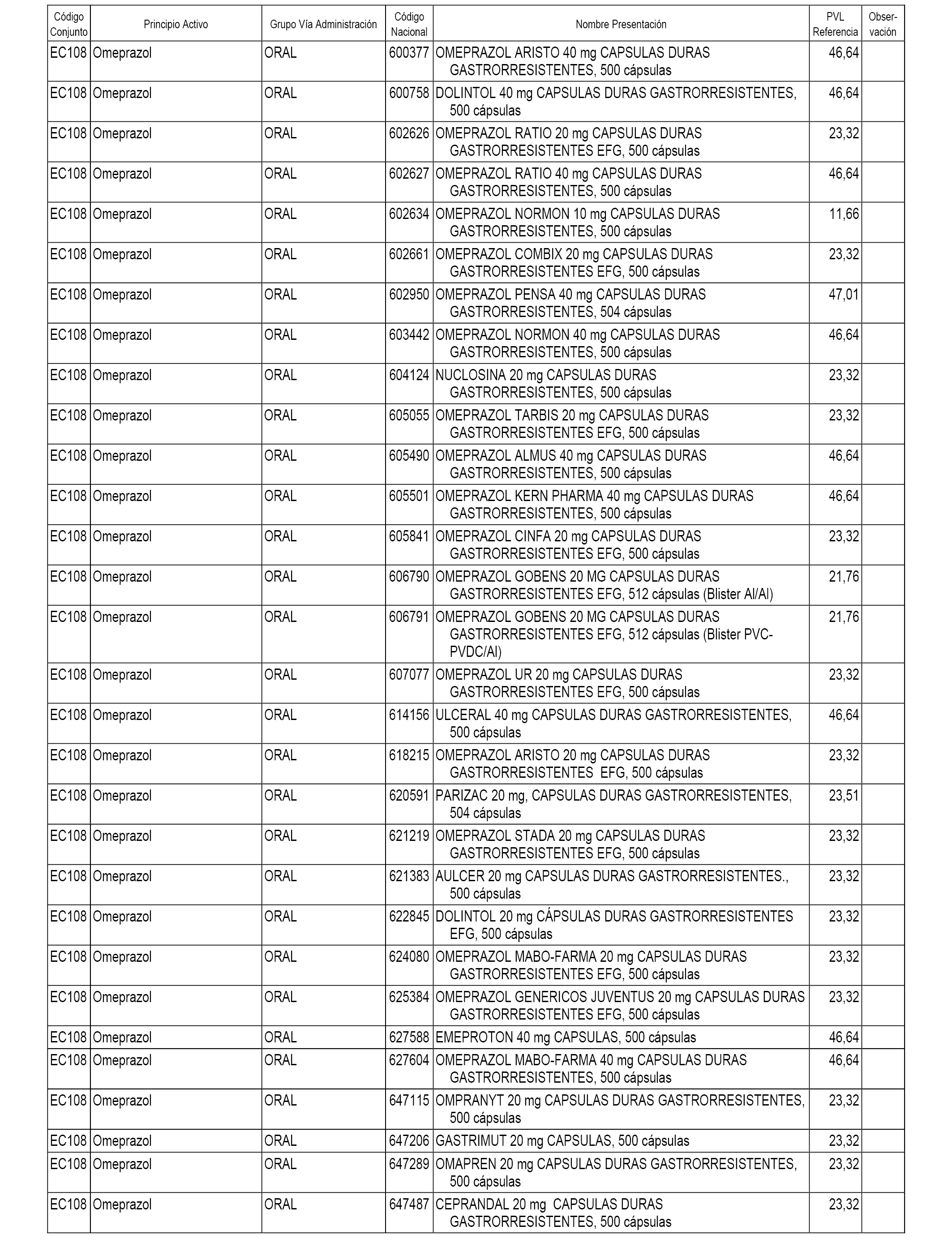
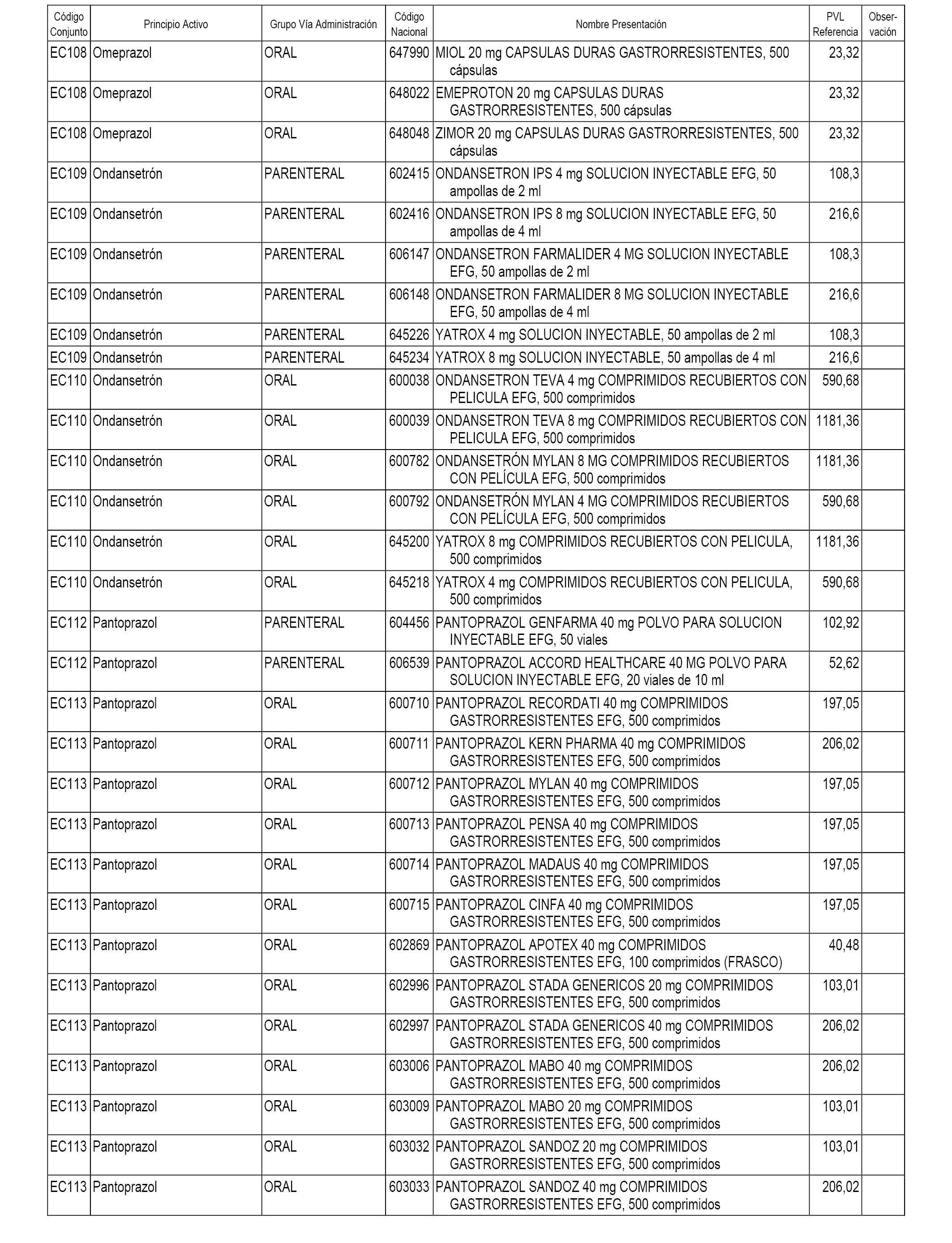
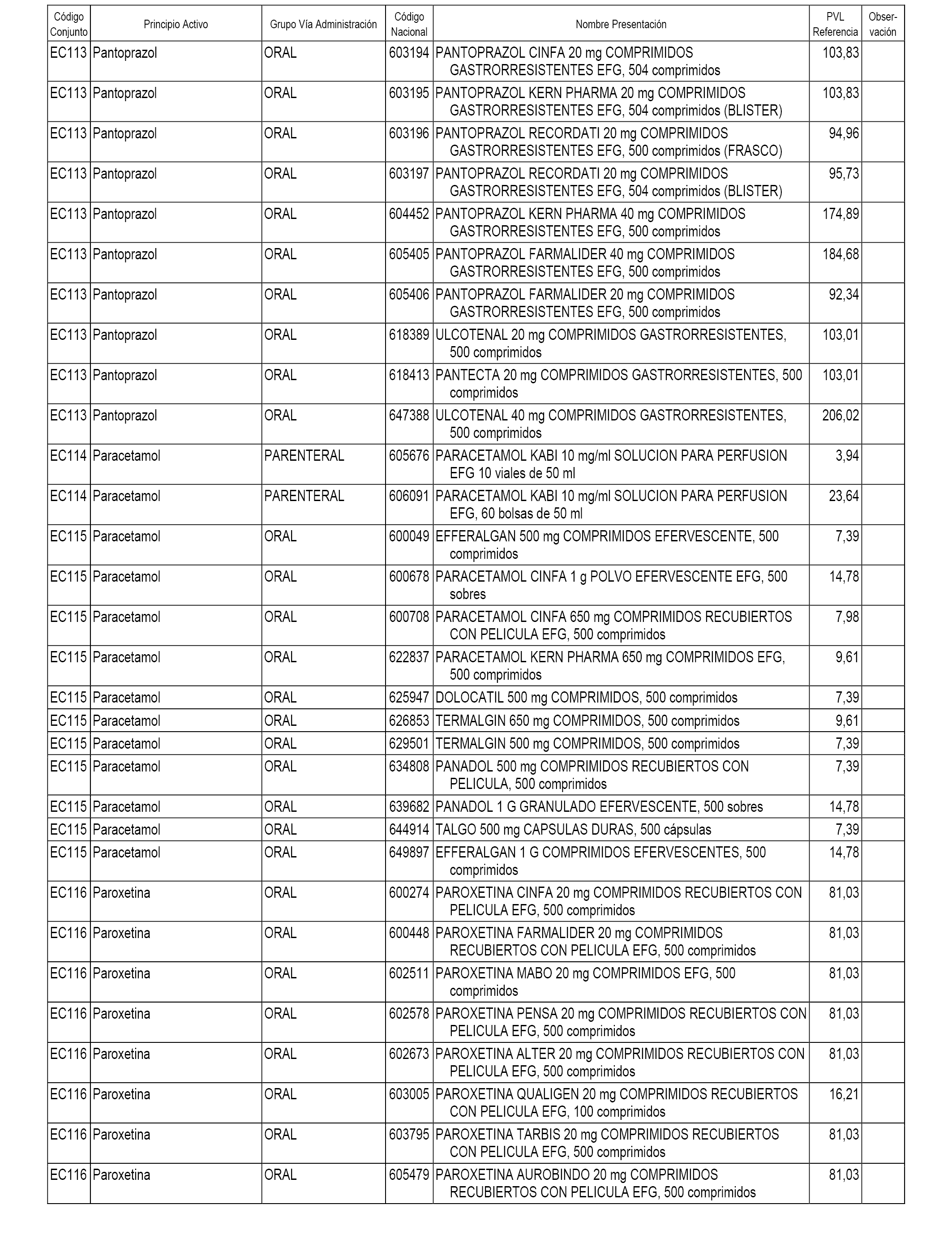
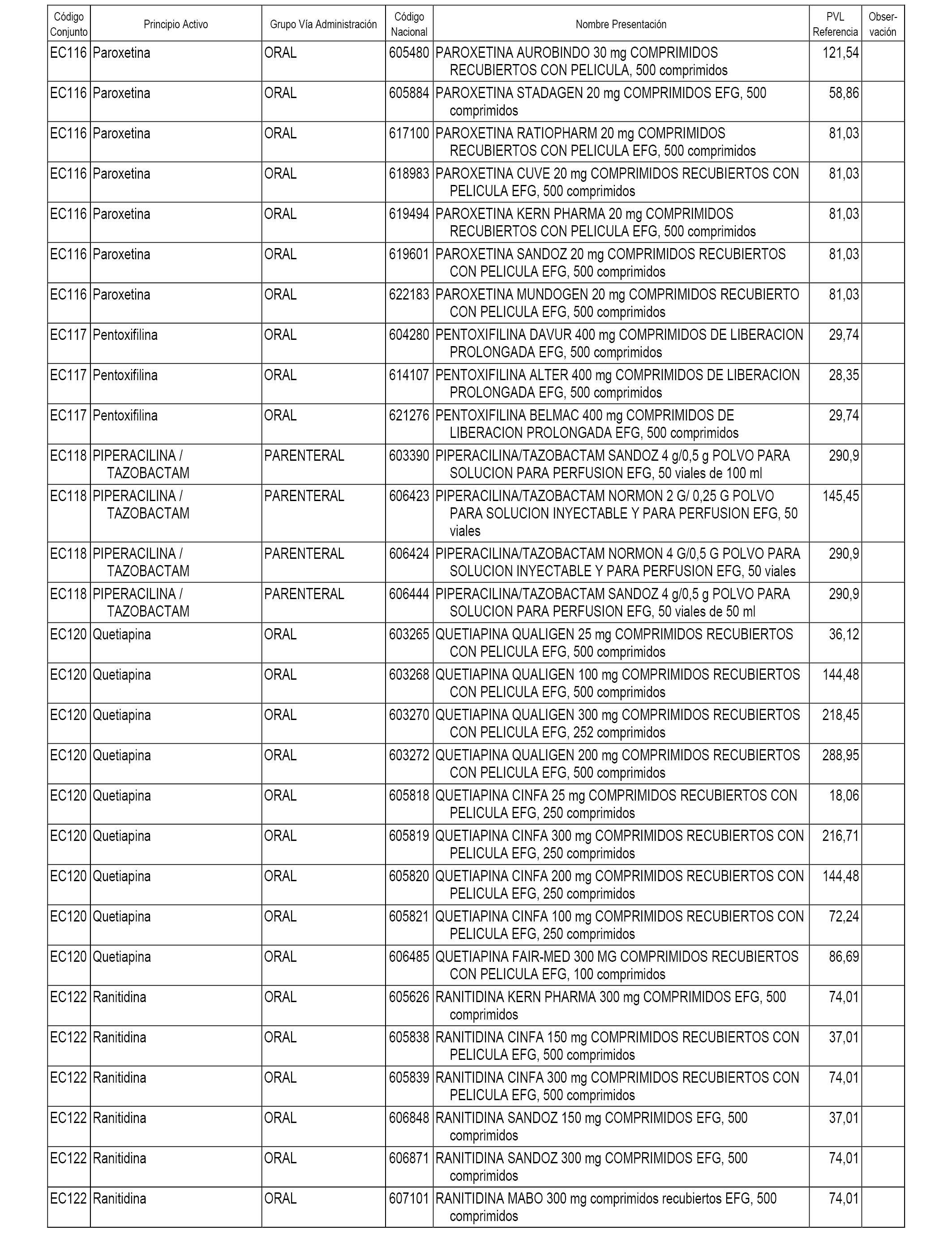
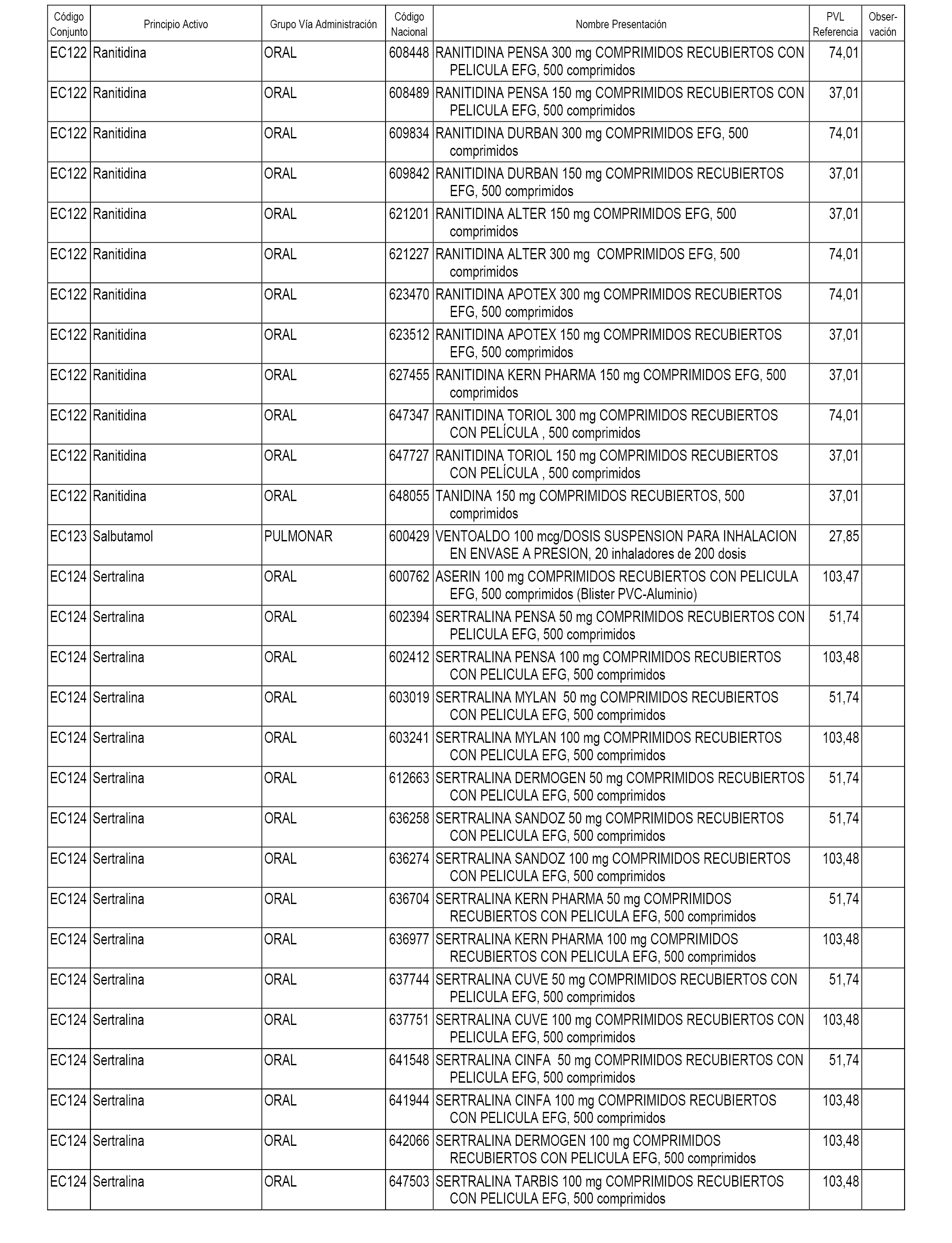
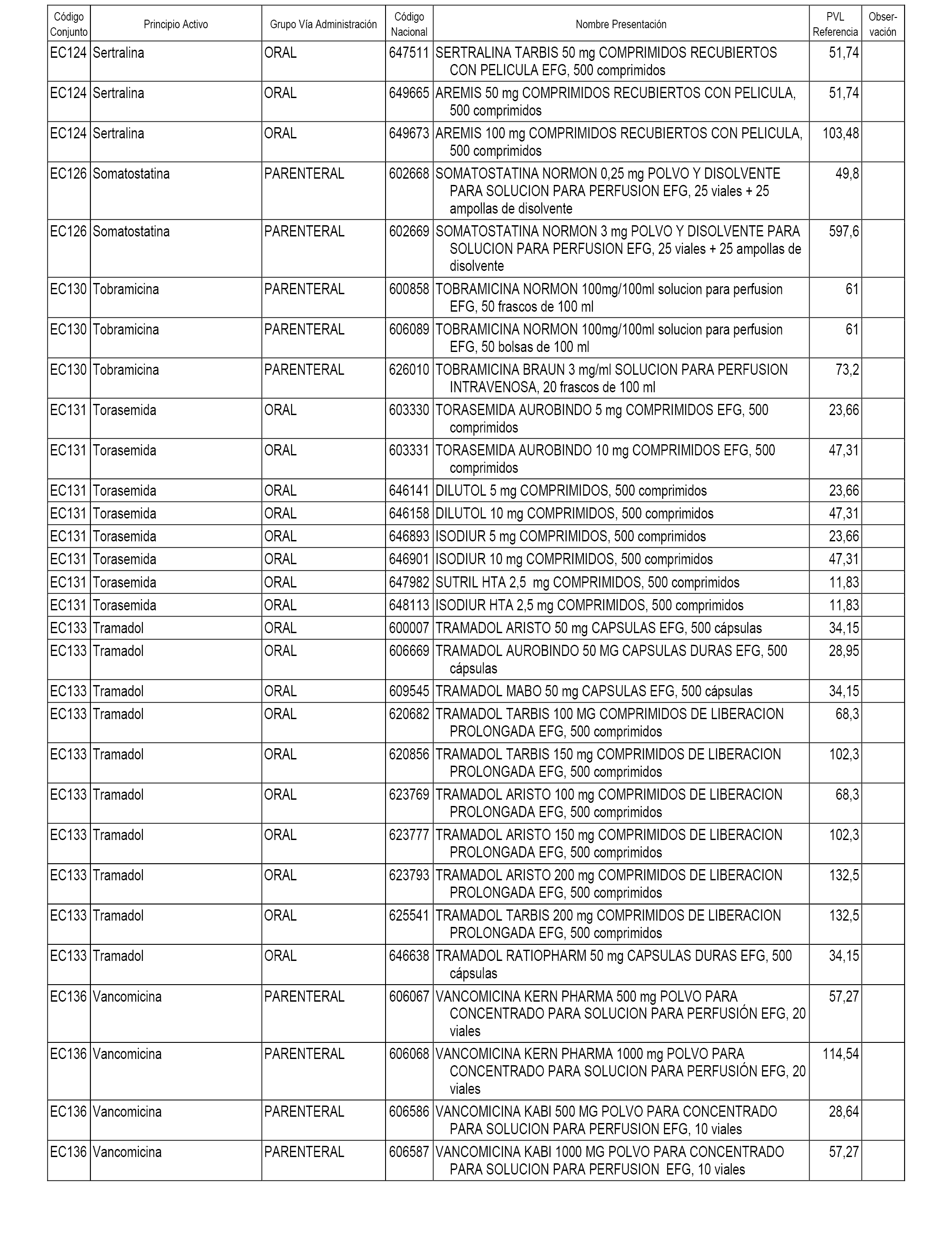
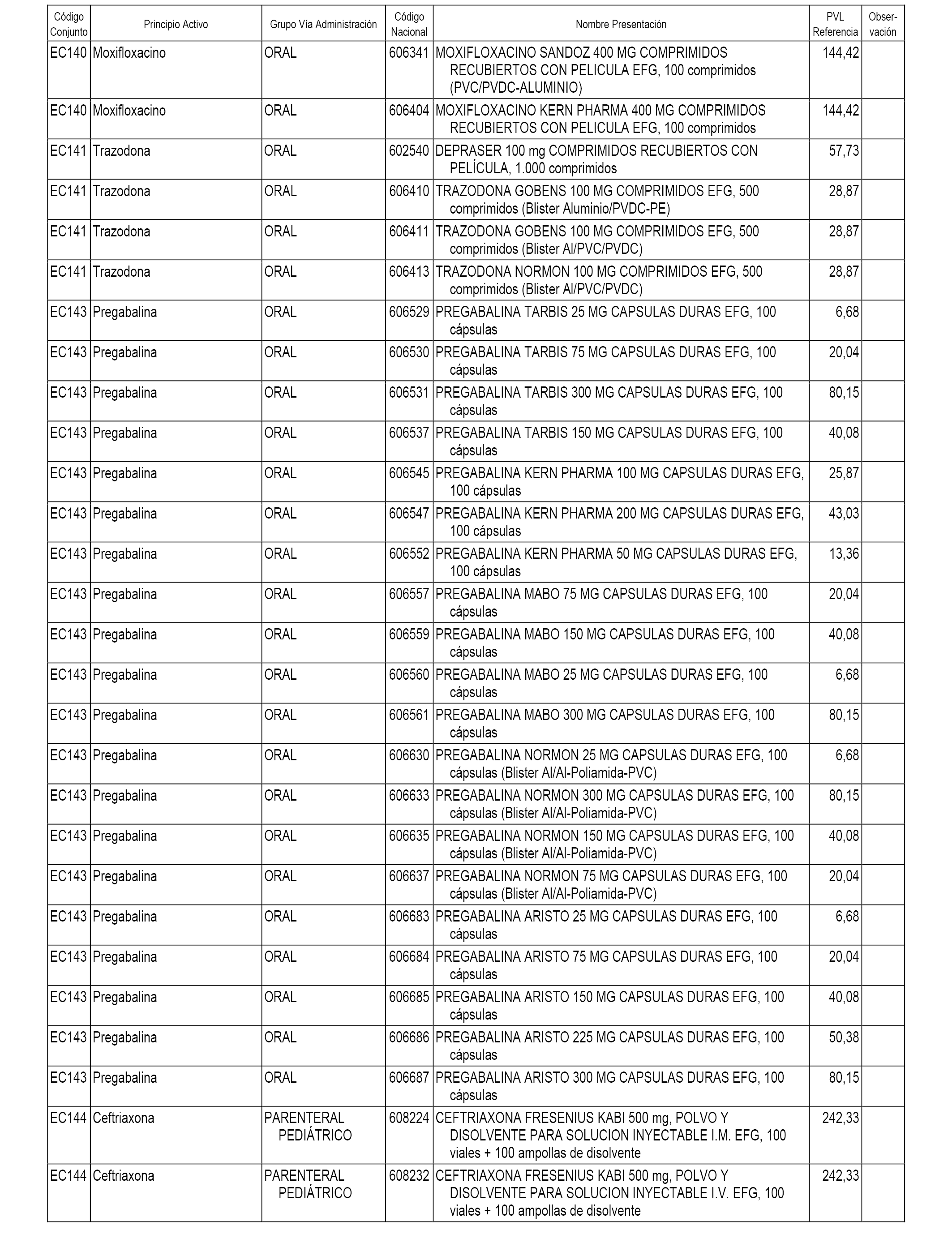
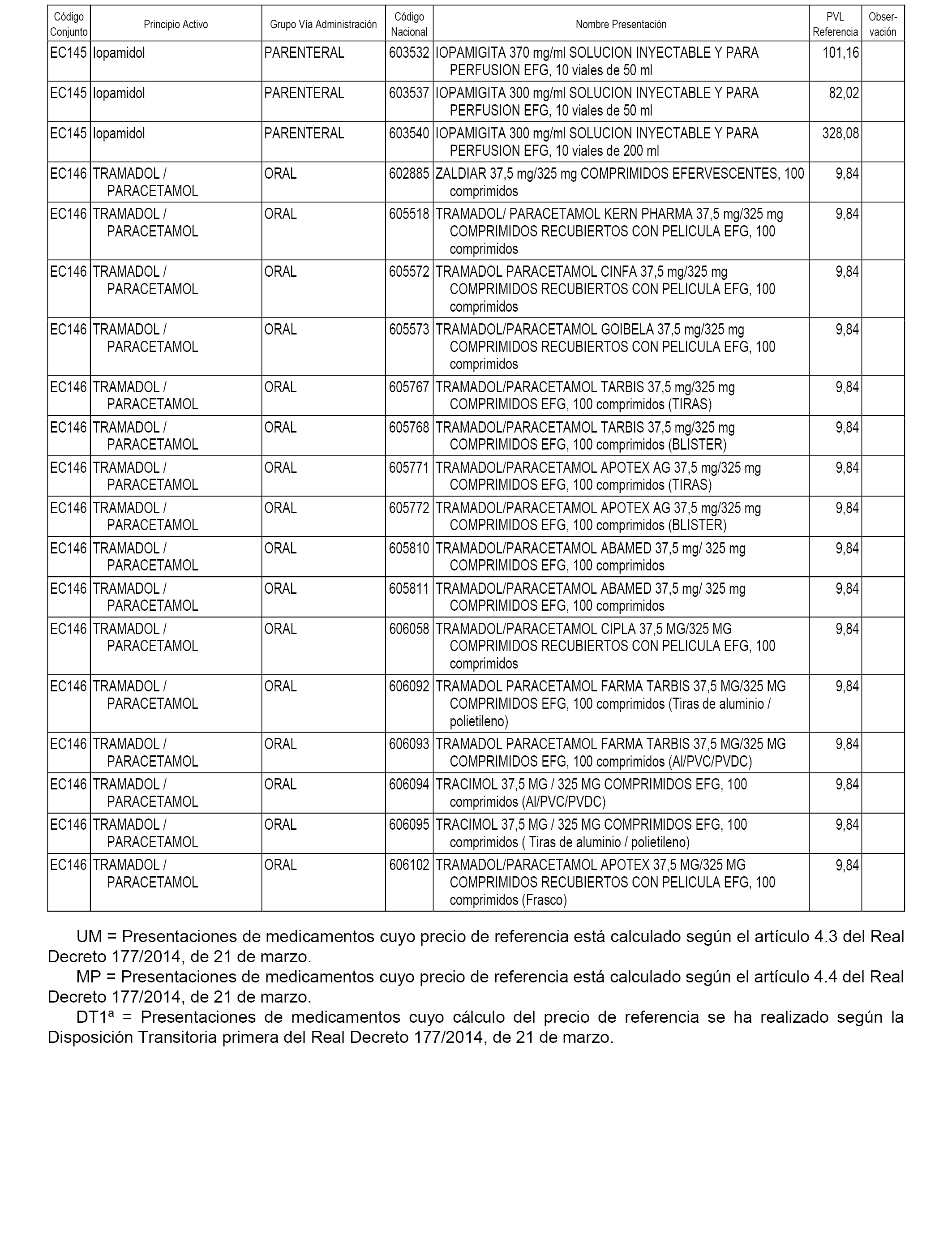
En el anexo 1 de esta orden se relacionan los conjuntos de referencia de presentaciones de medicamentos dispensables por oficinas de farmacia a través de receta médica oficial u orden de dispensación, con indicación del precio industrial de referencia y PVPIVA de referencia fijado para cada presentación.
Son de nueva creación los conjuntos enumerados del C-482 al C-505 del citado anexo.
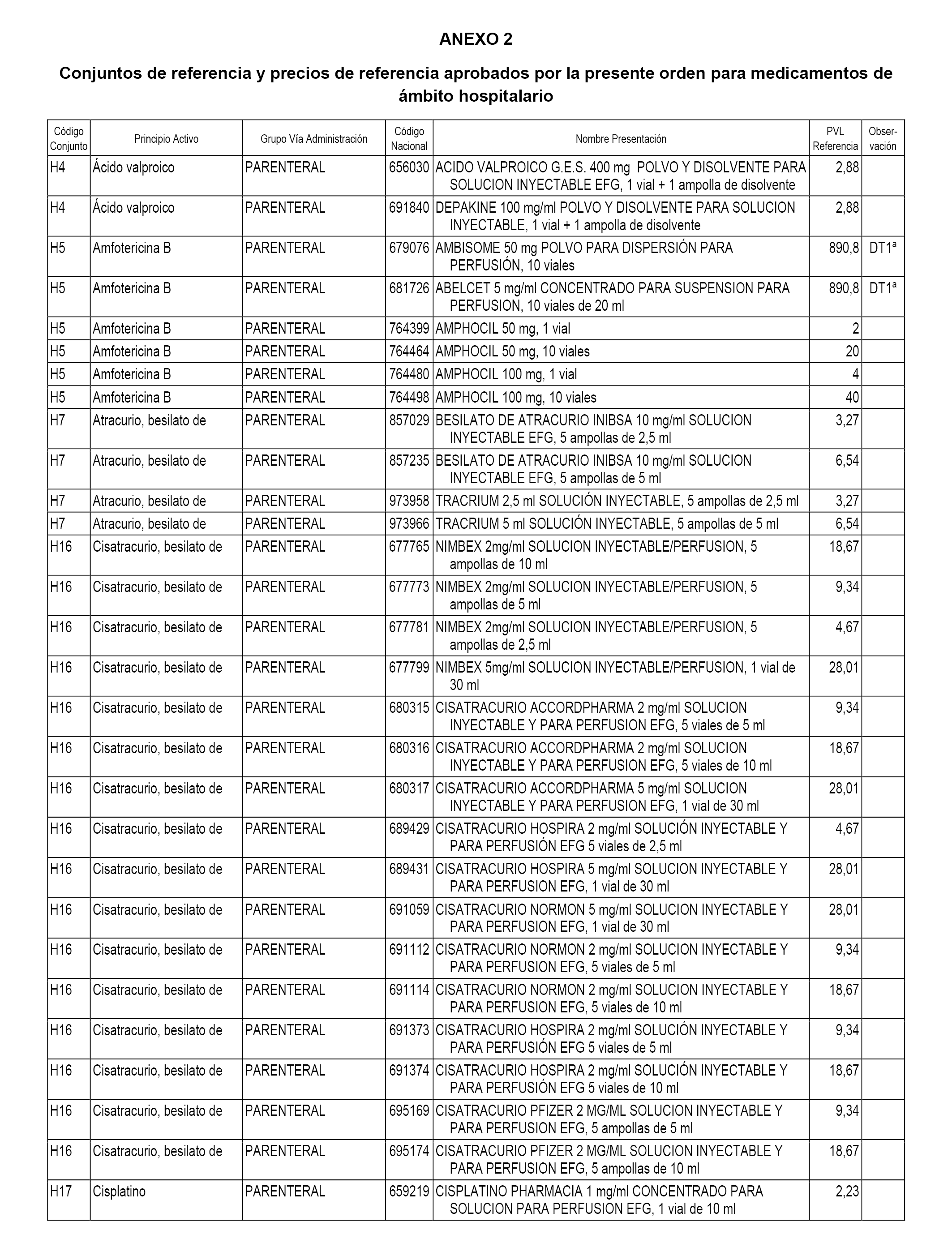
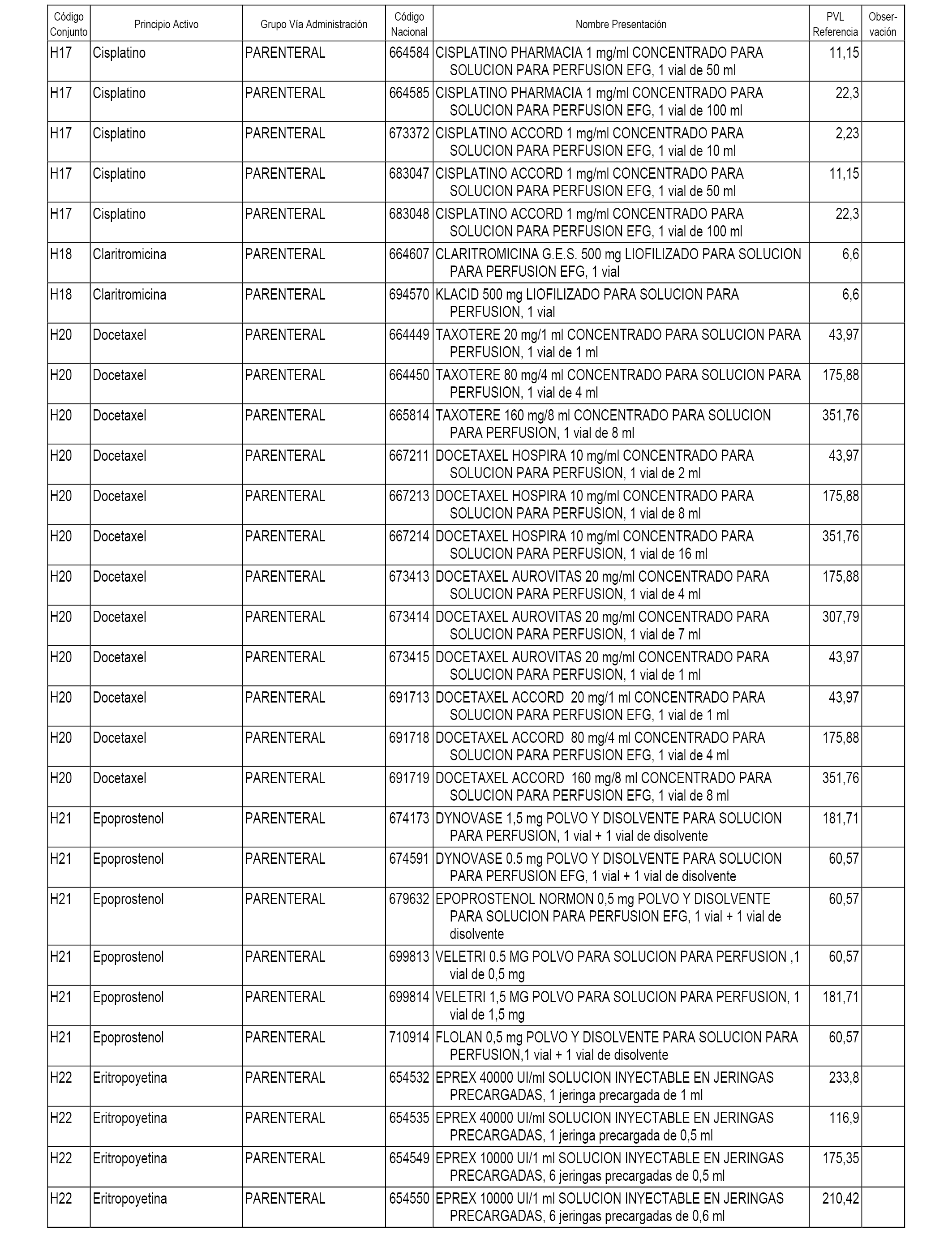
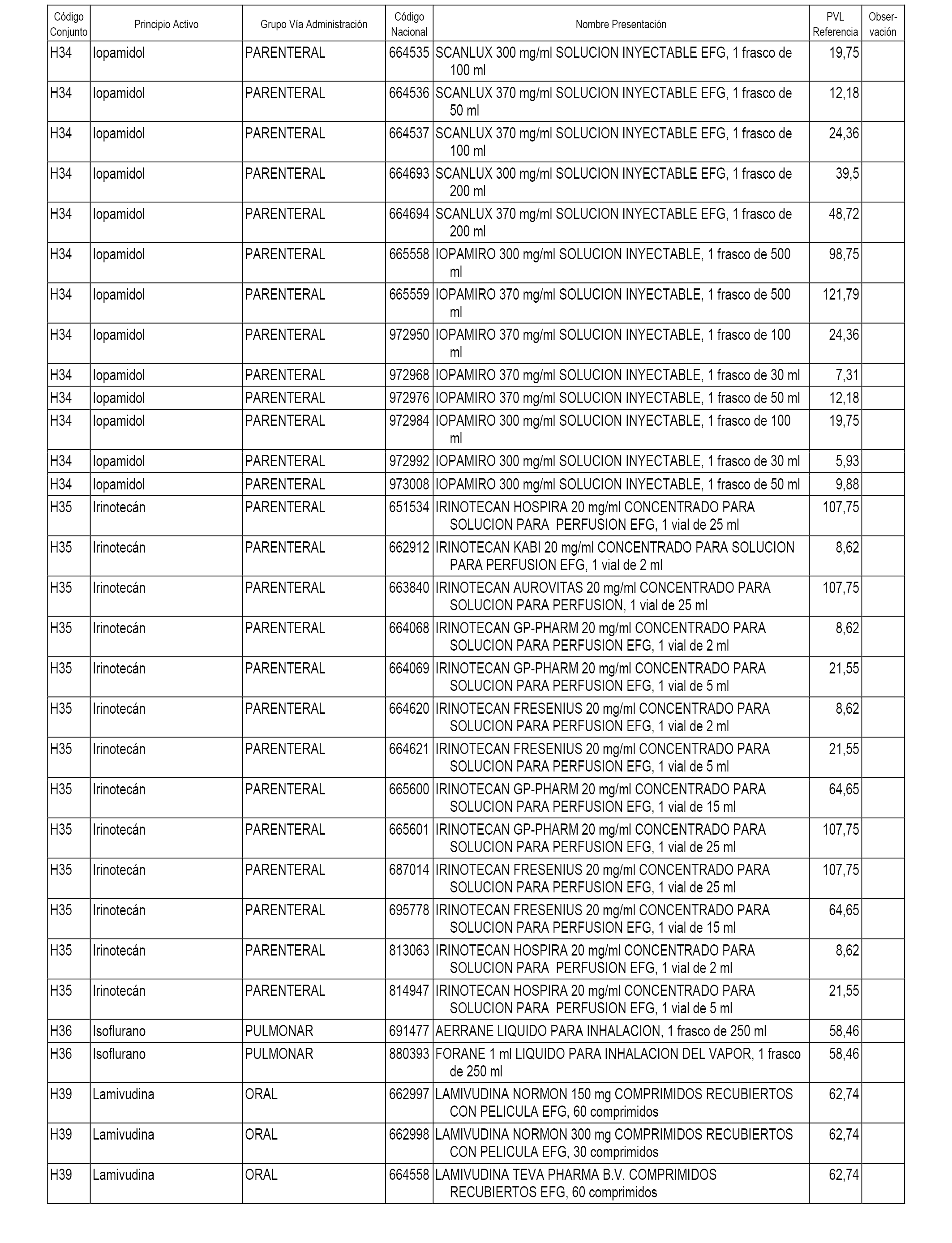
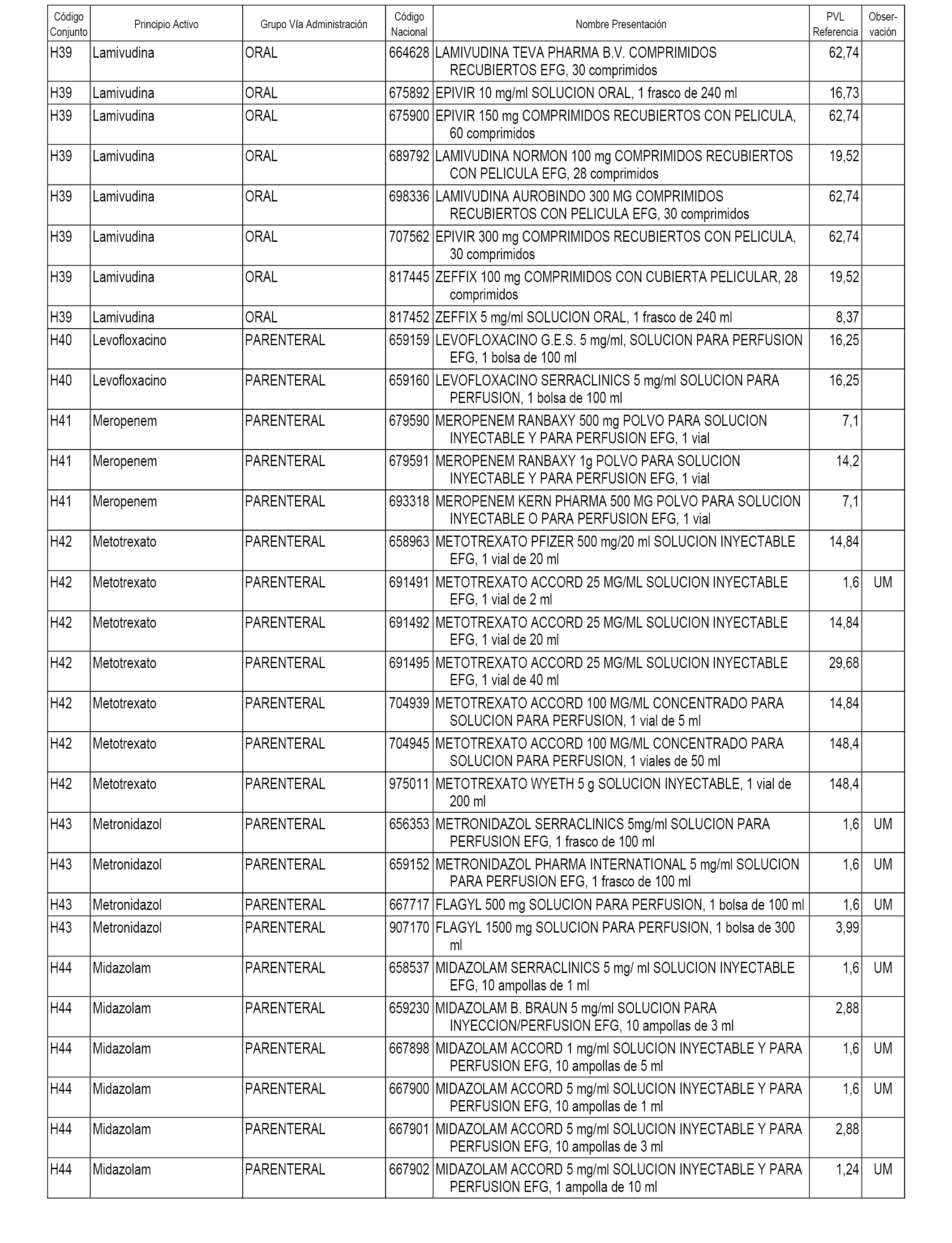
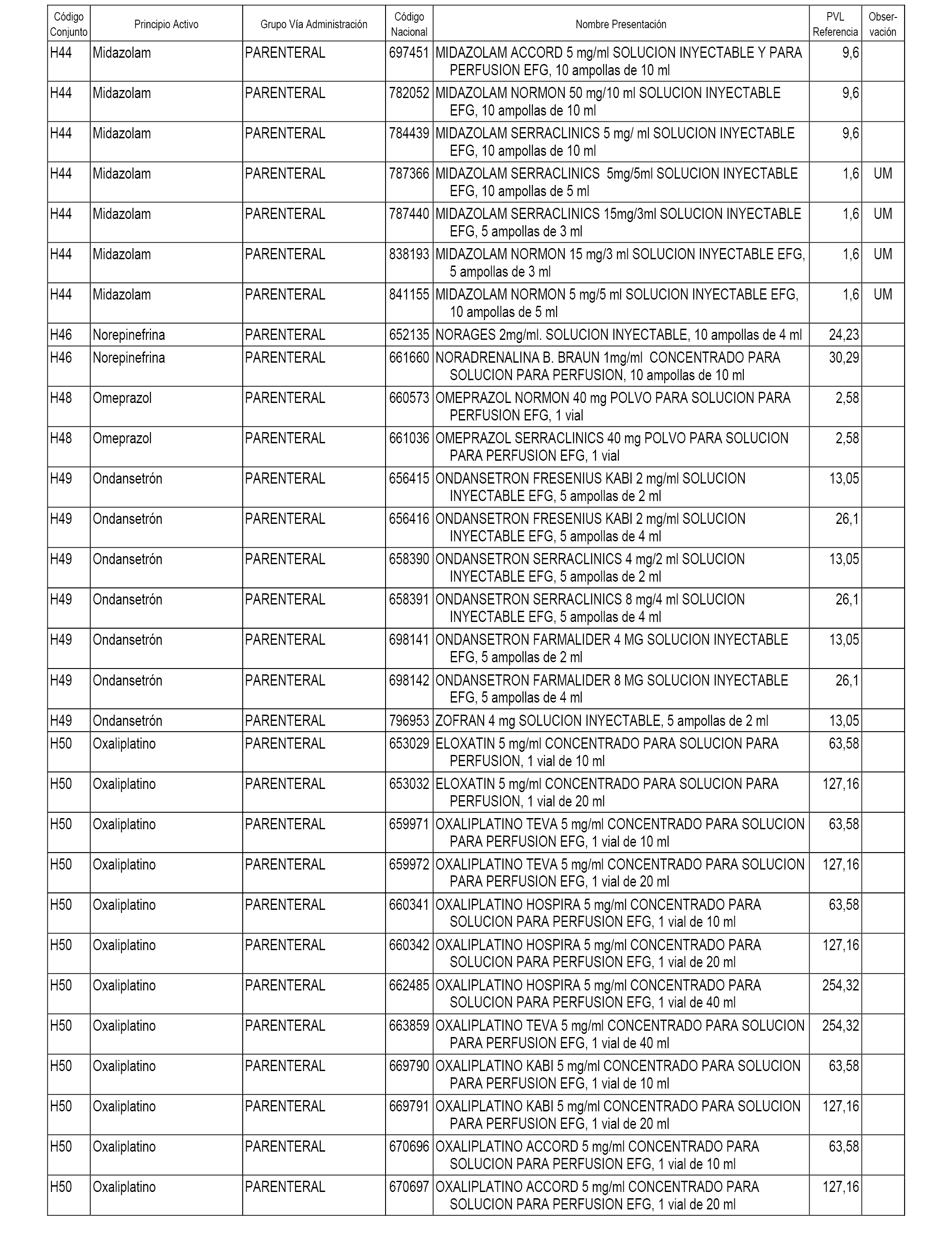
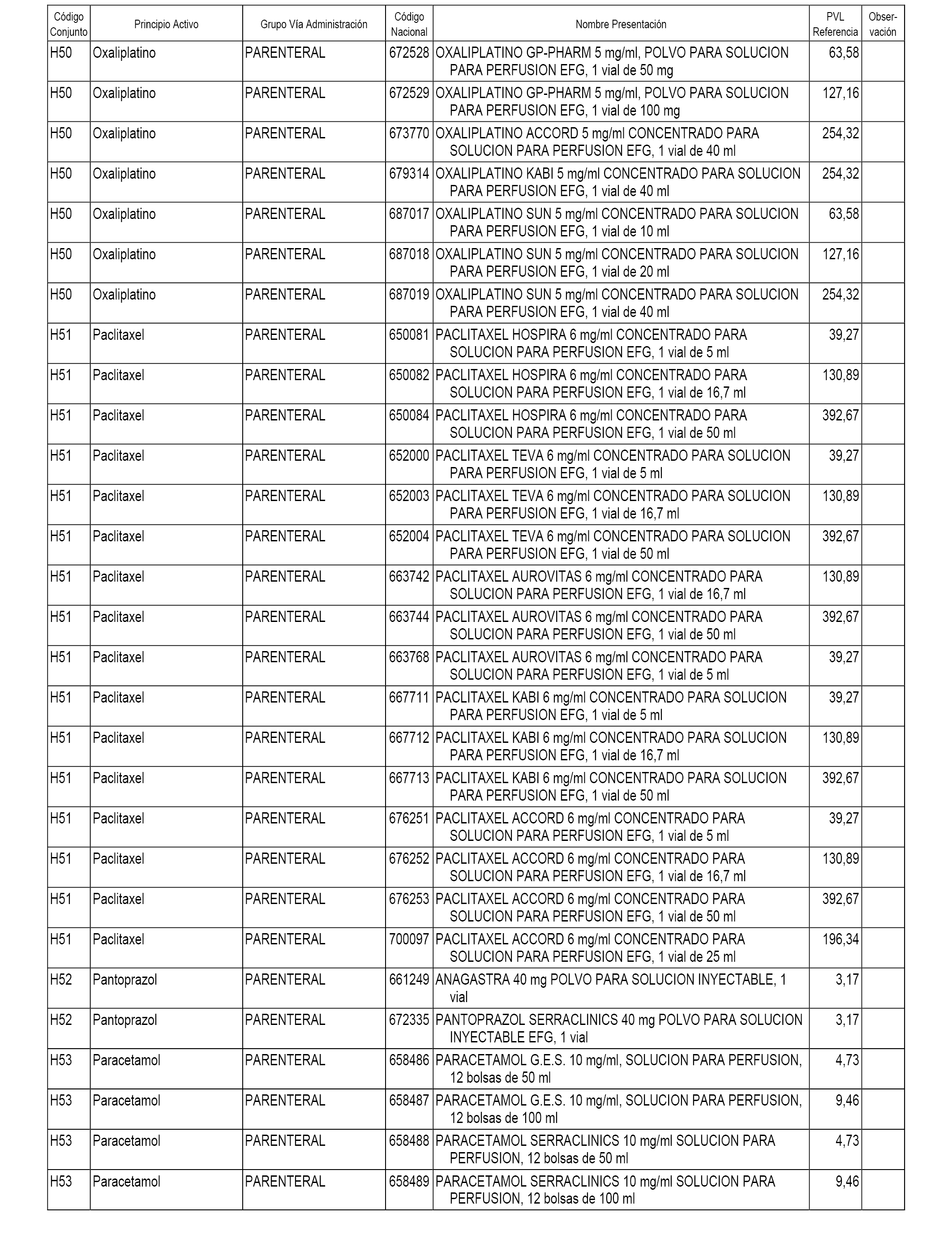
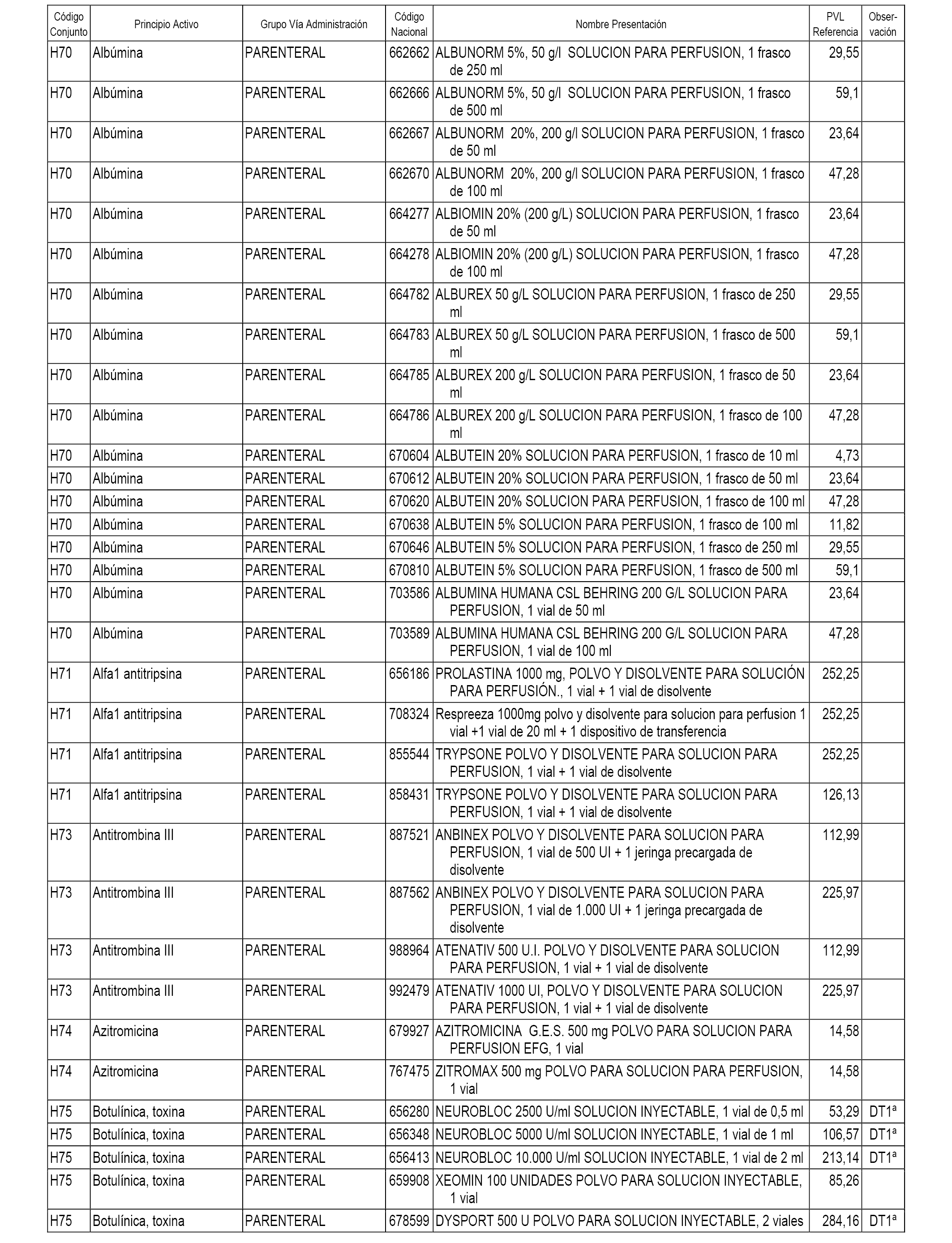
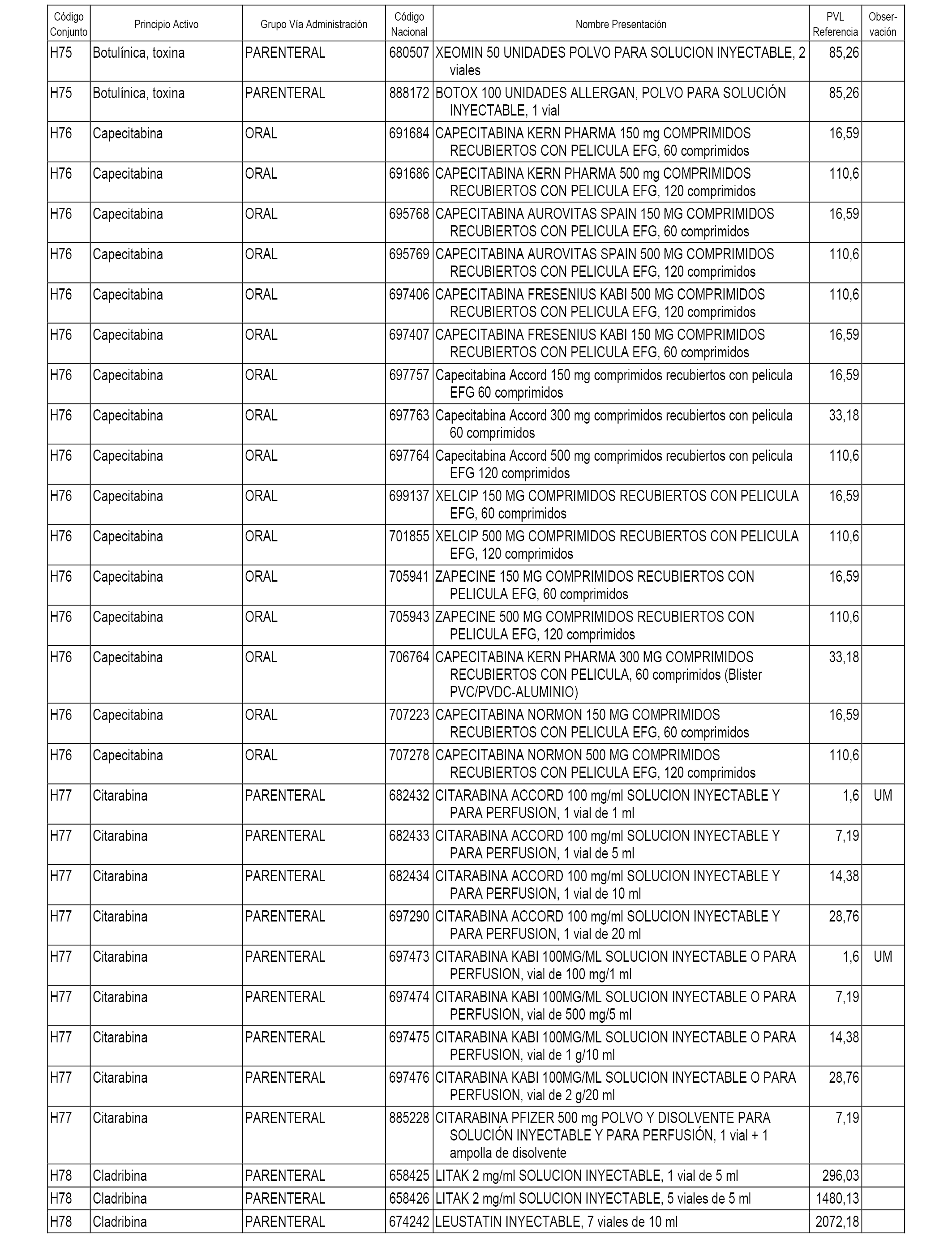
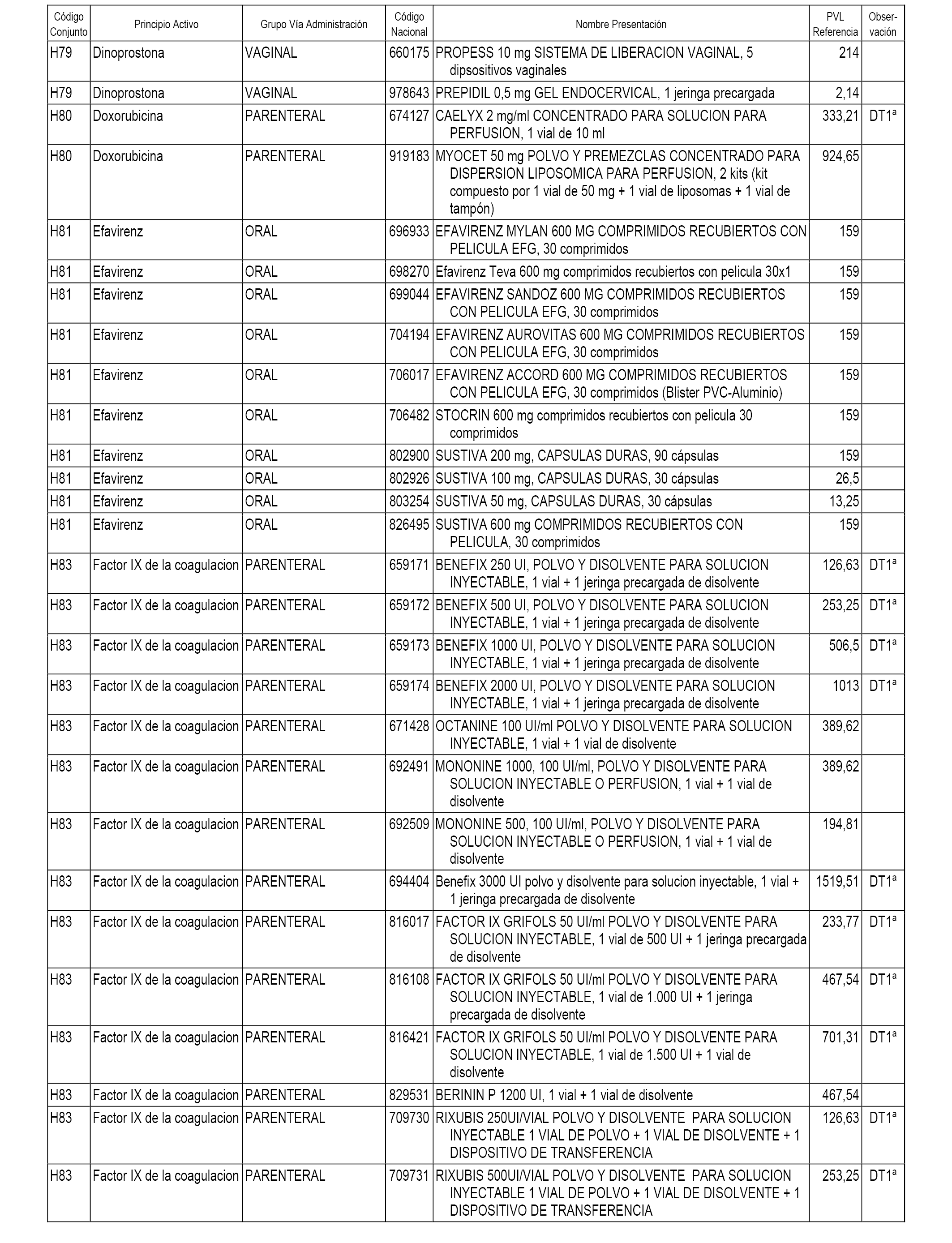
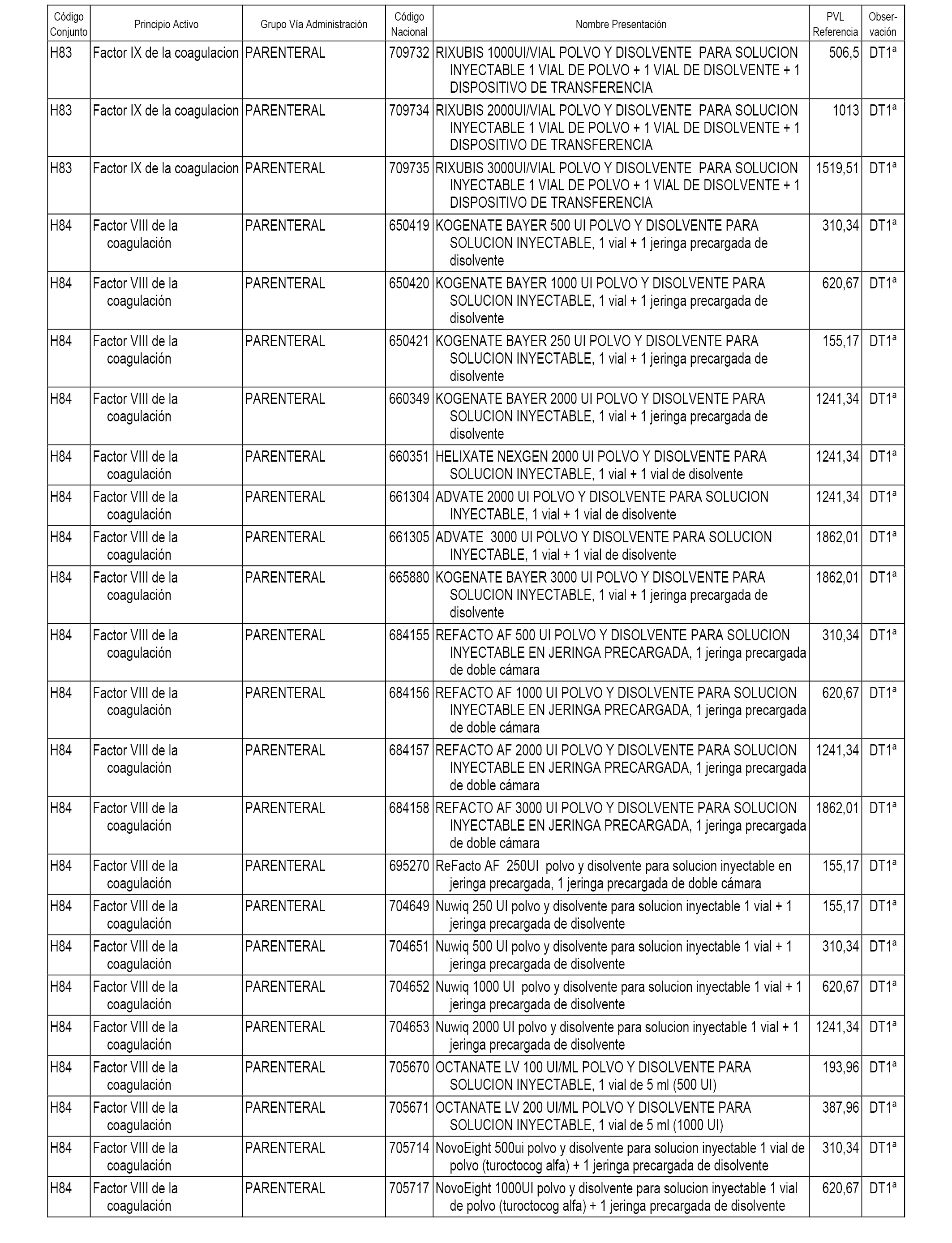
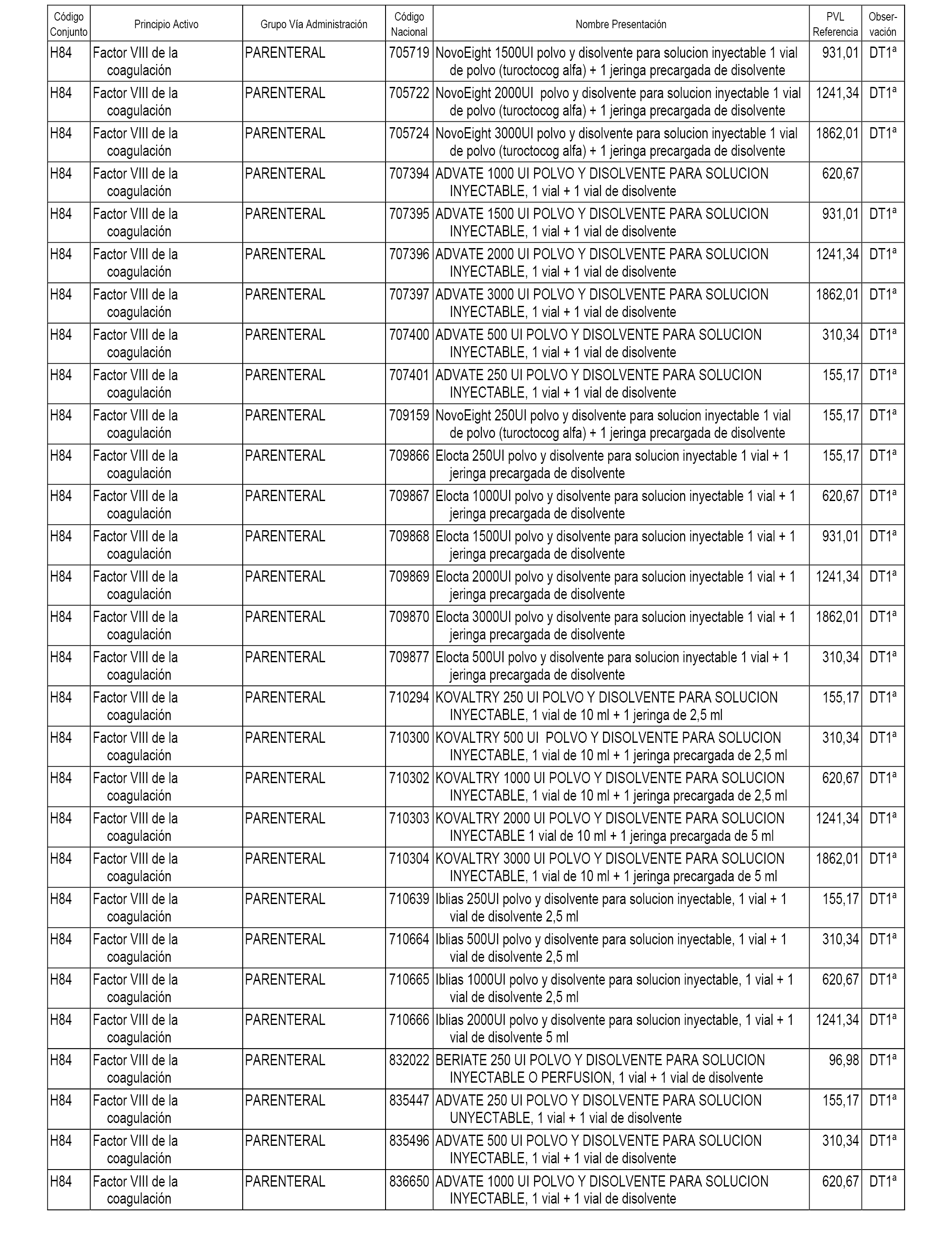
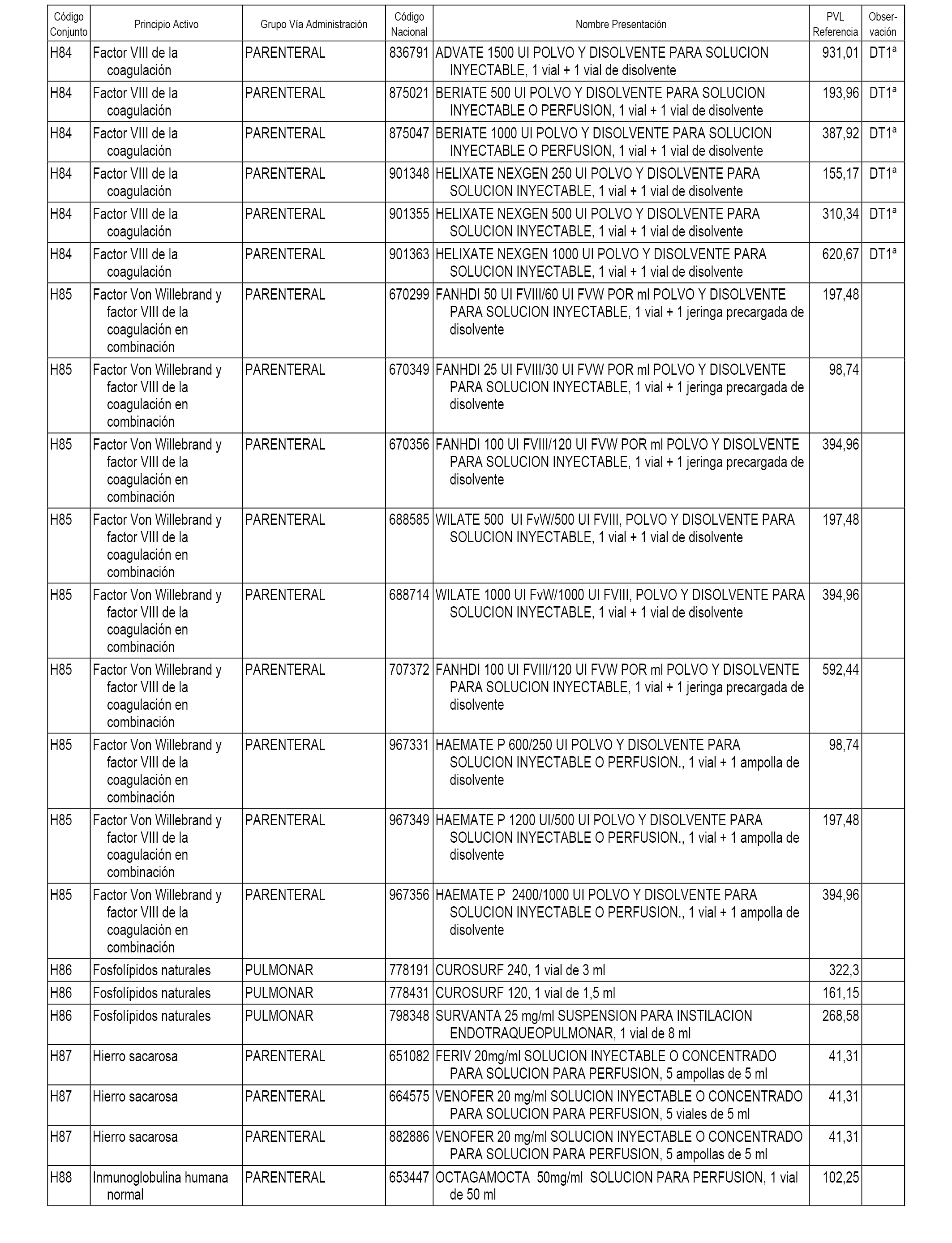
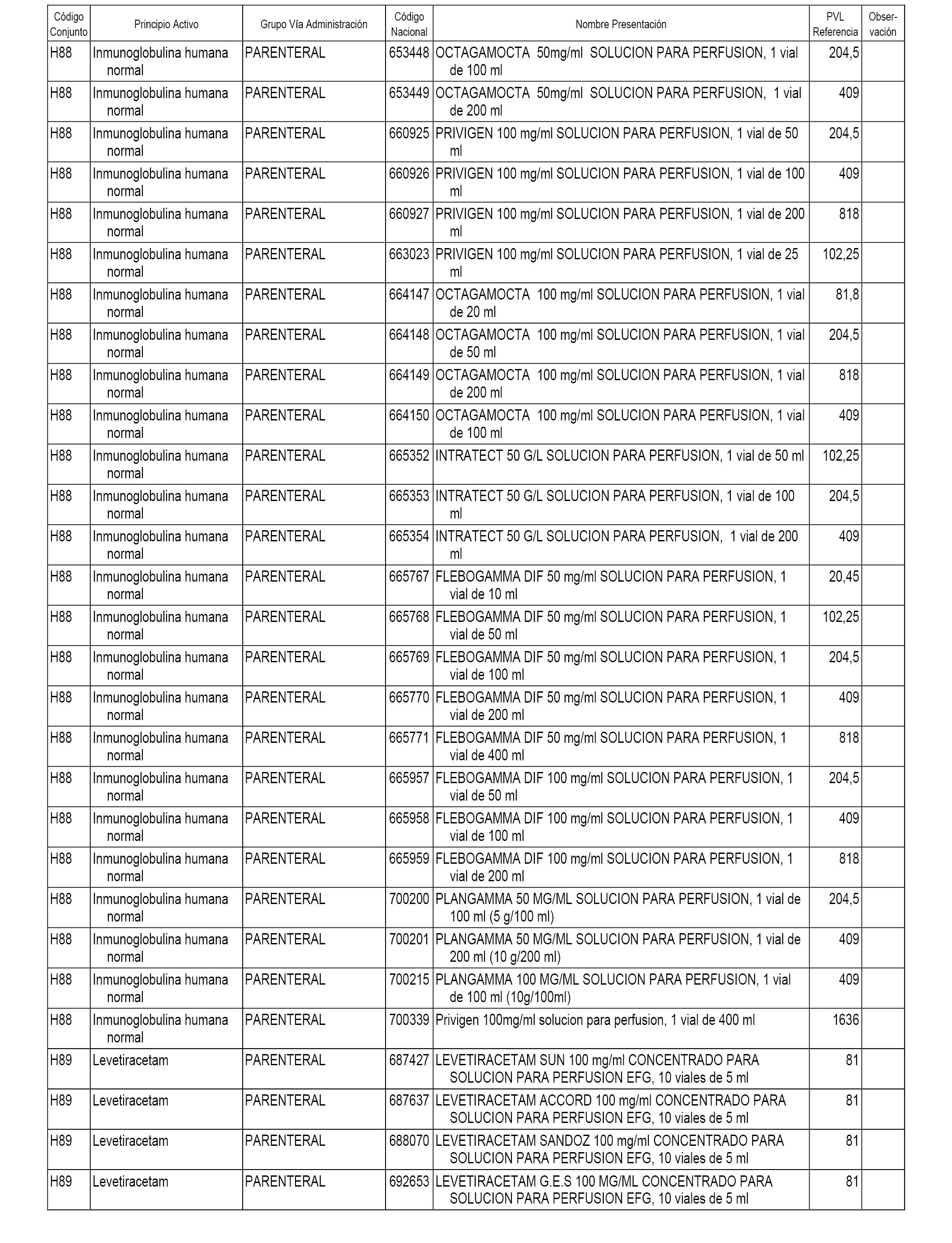
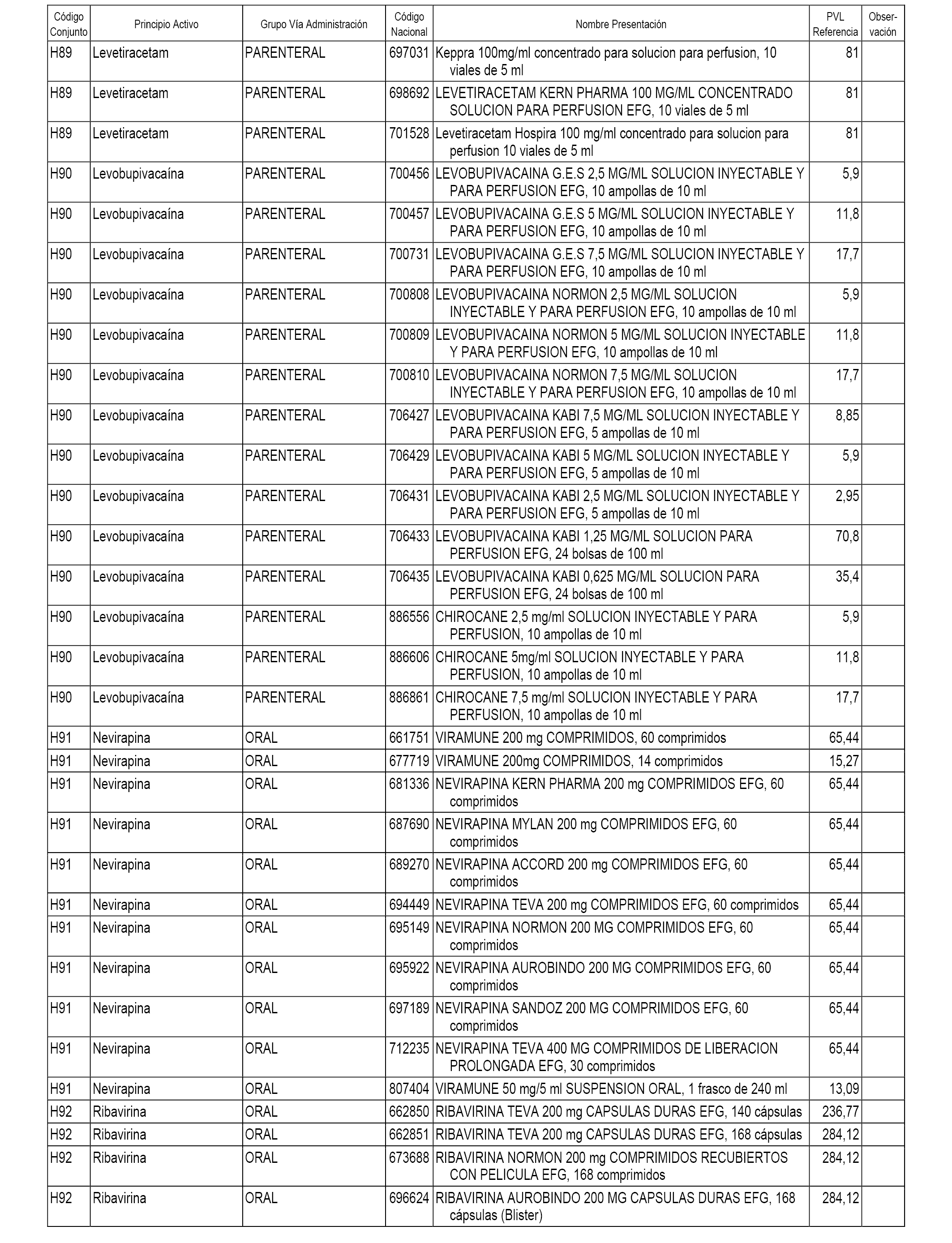
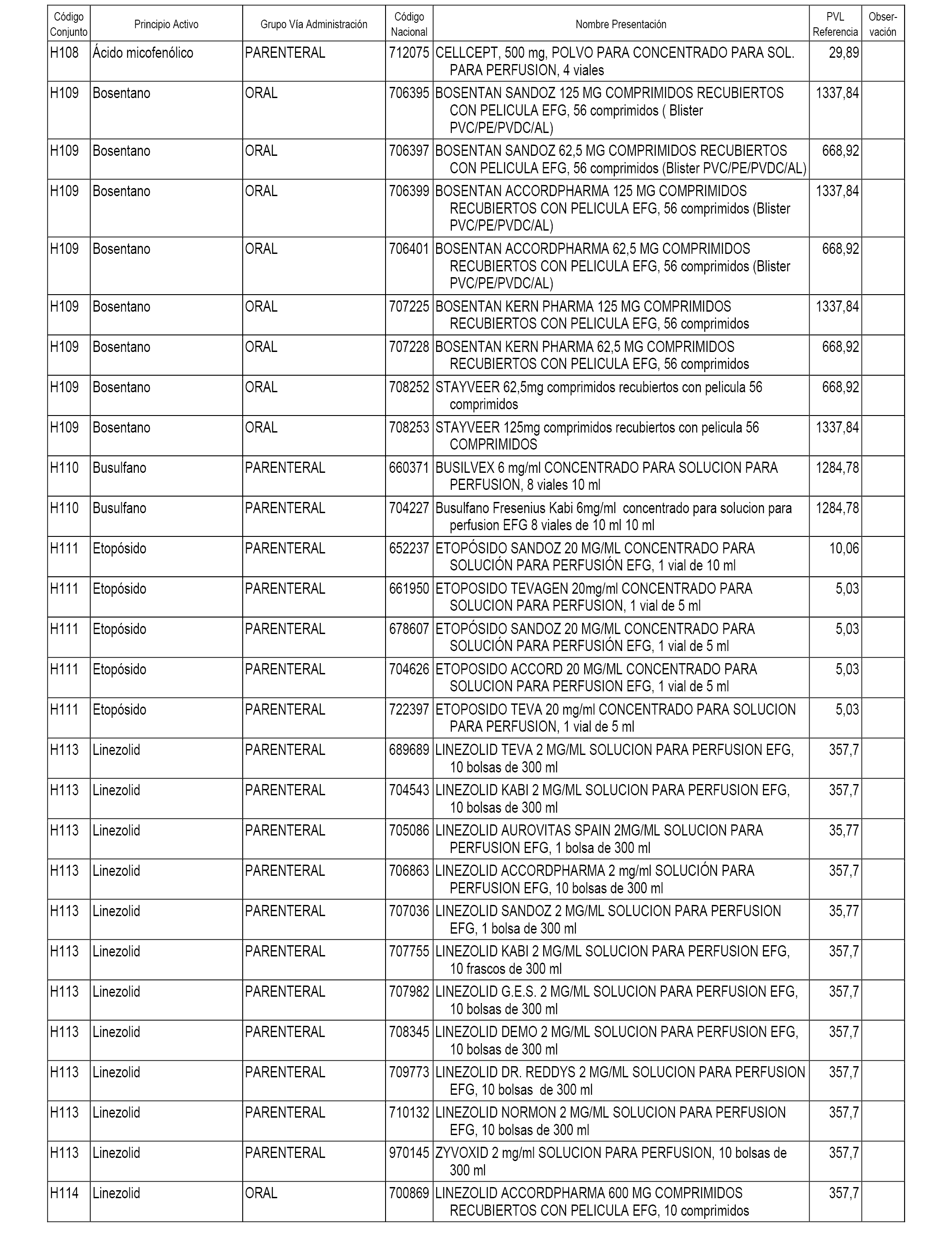
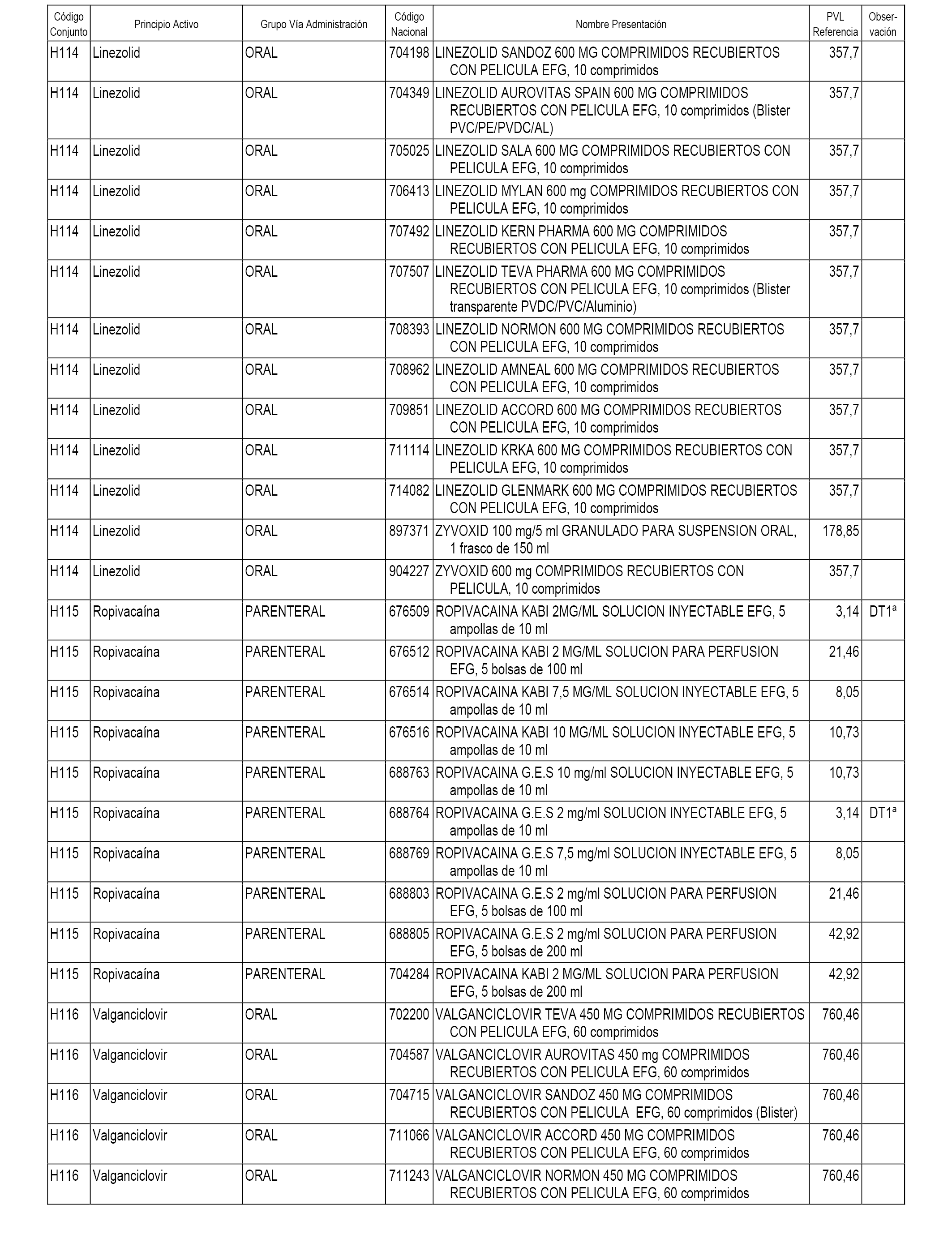
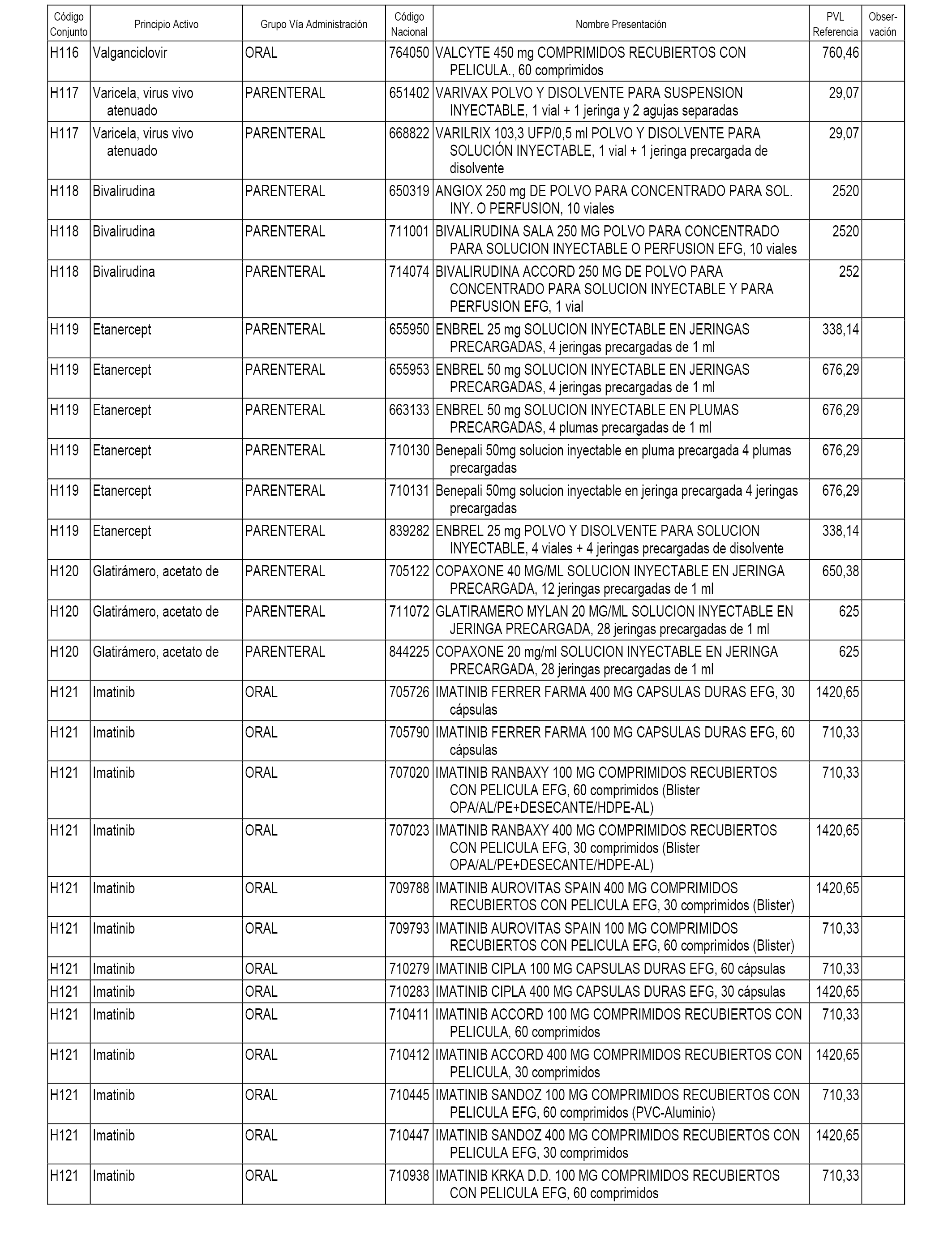
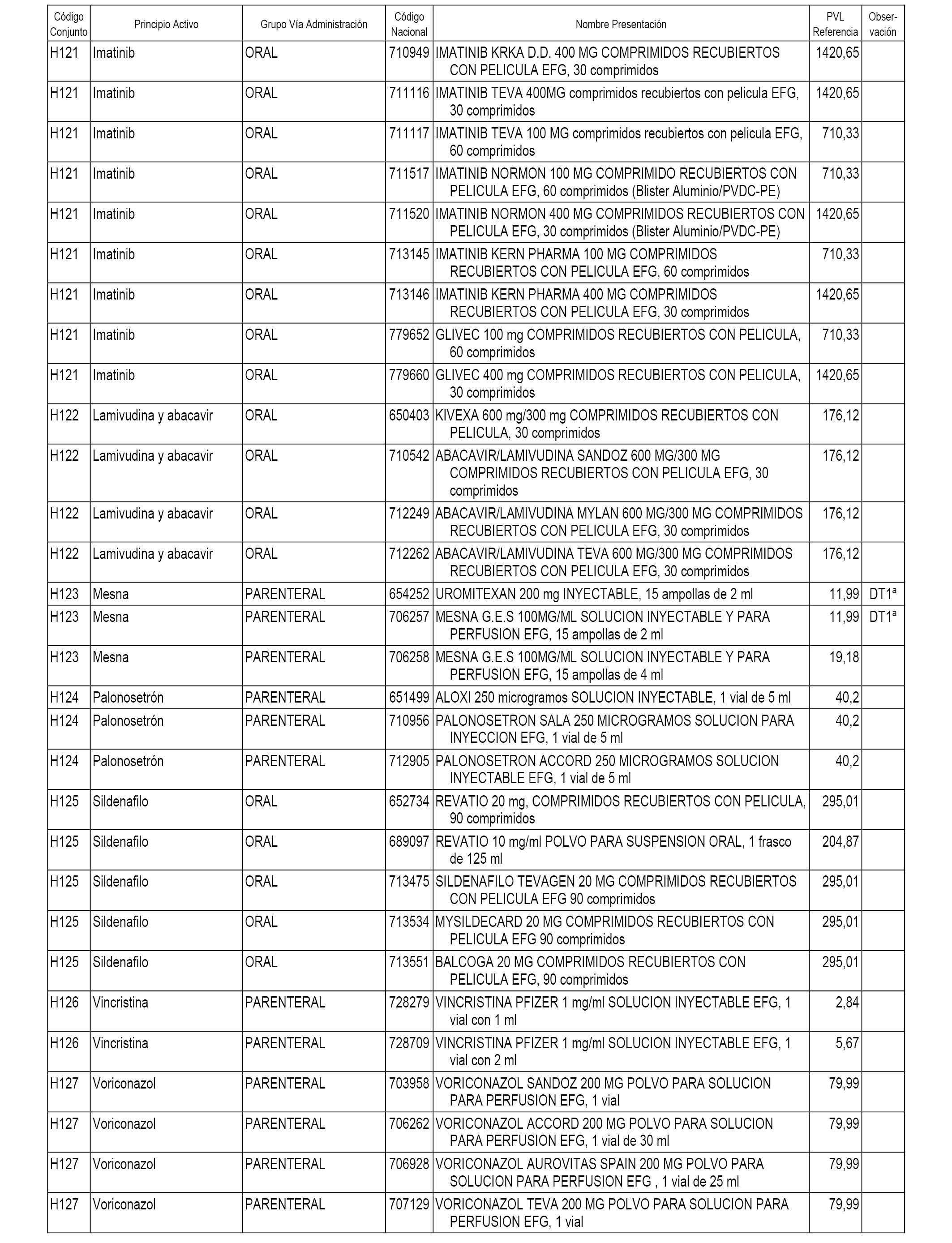
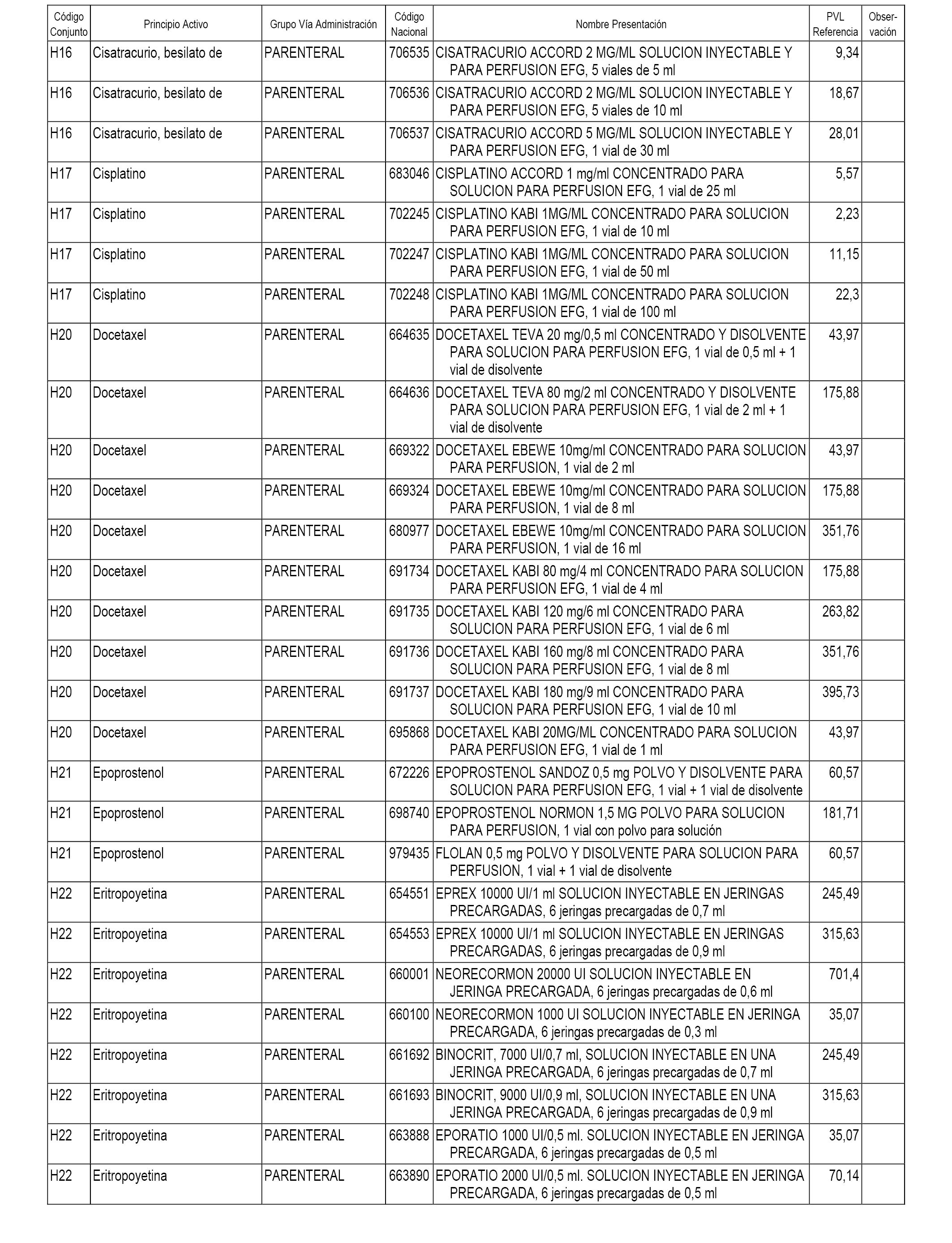
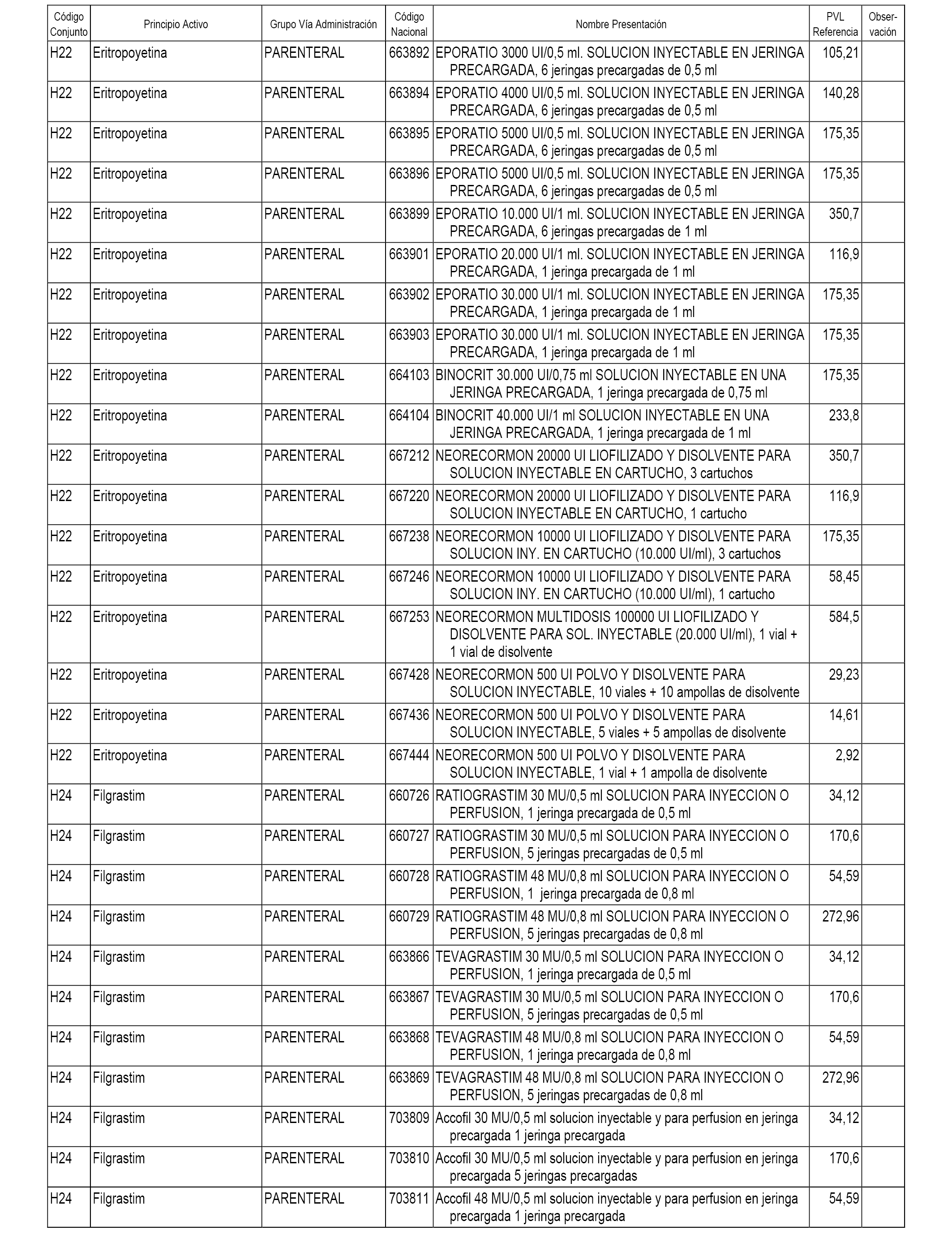
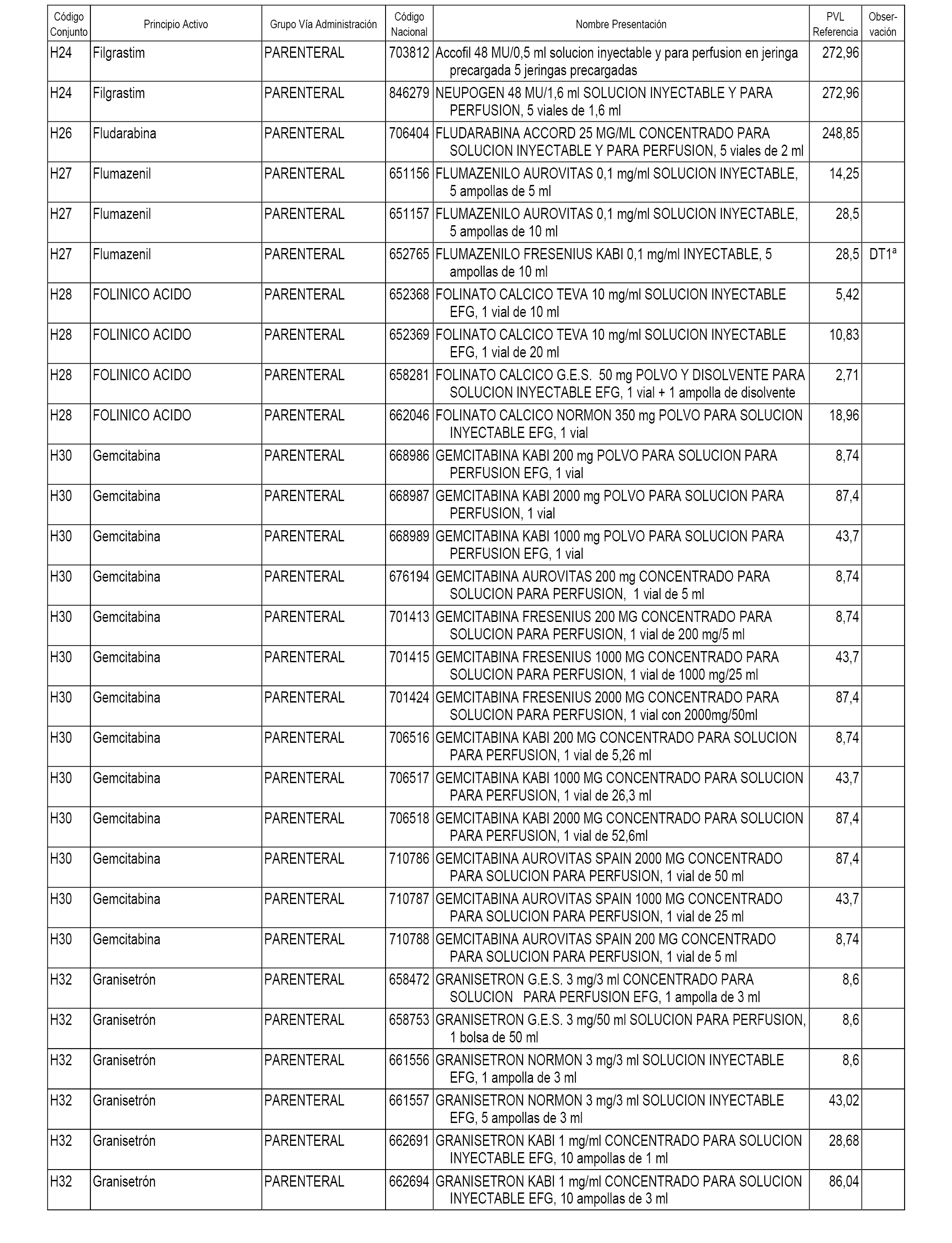
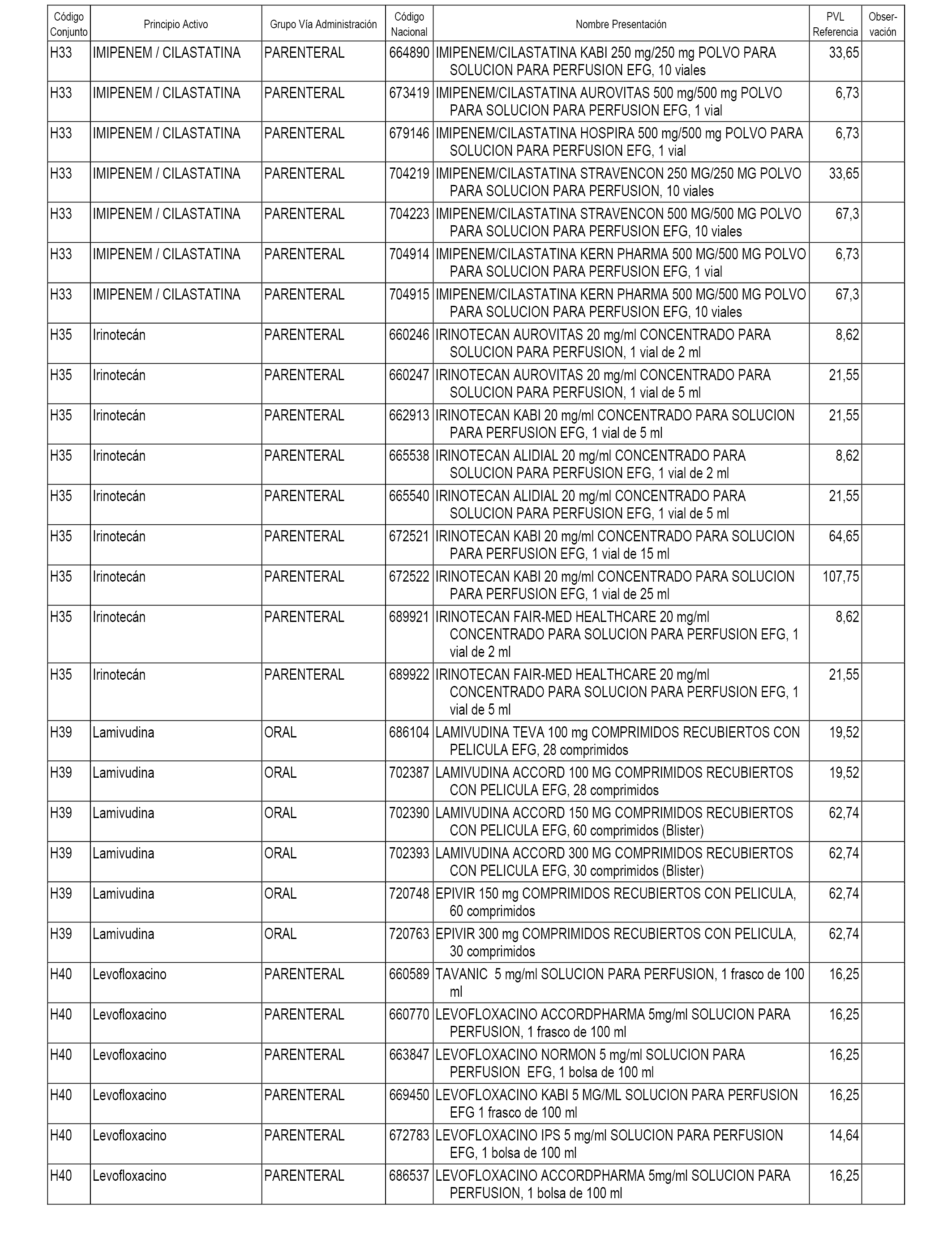
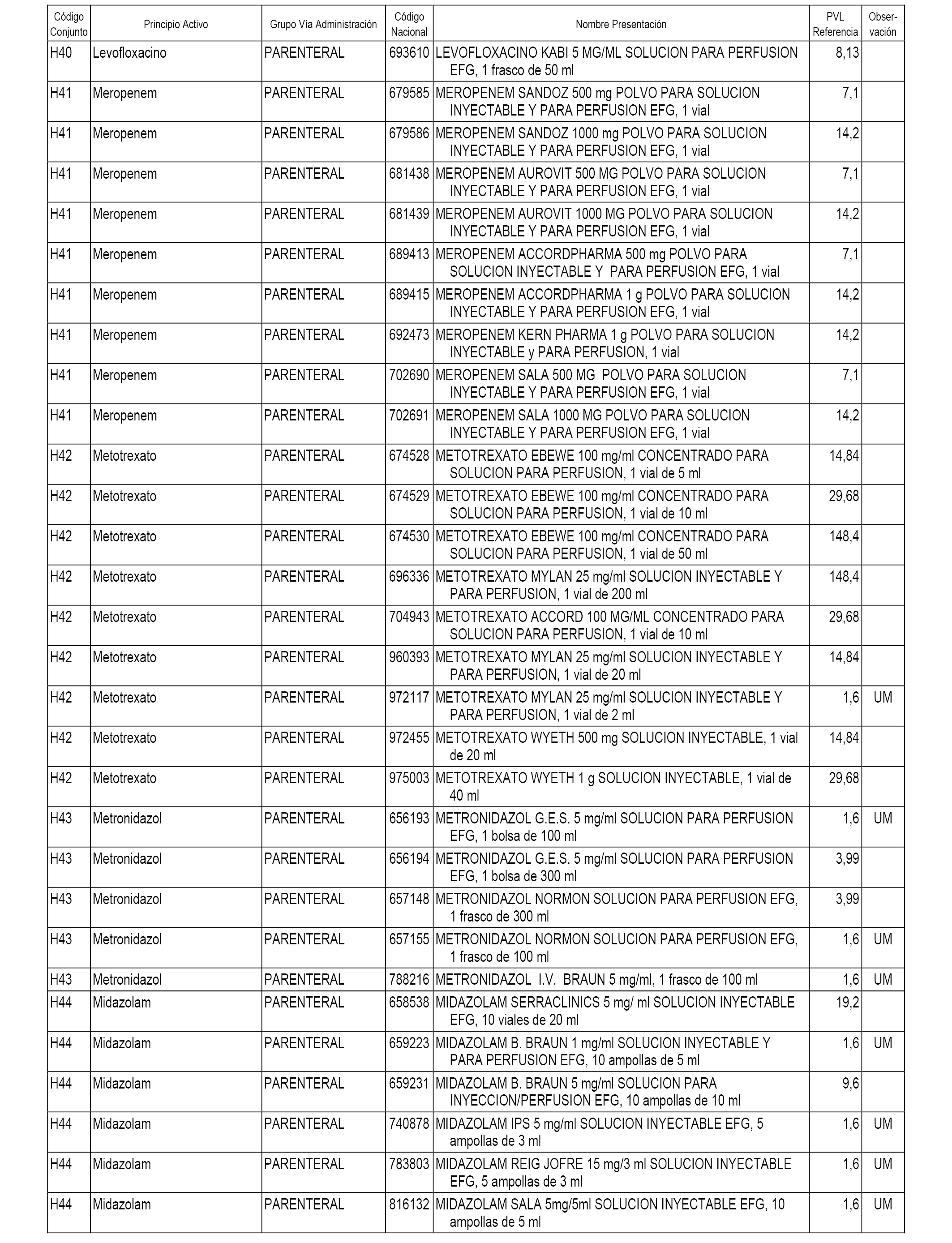
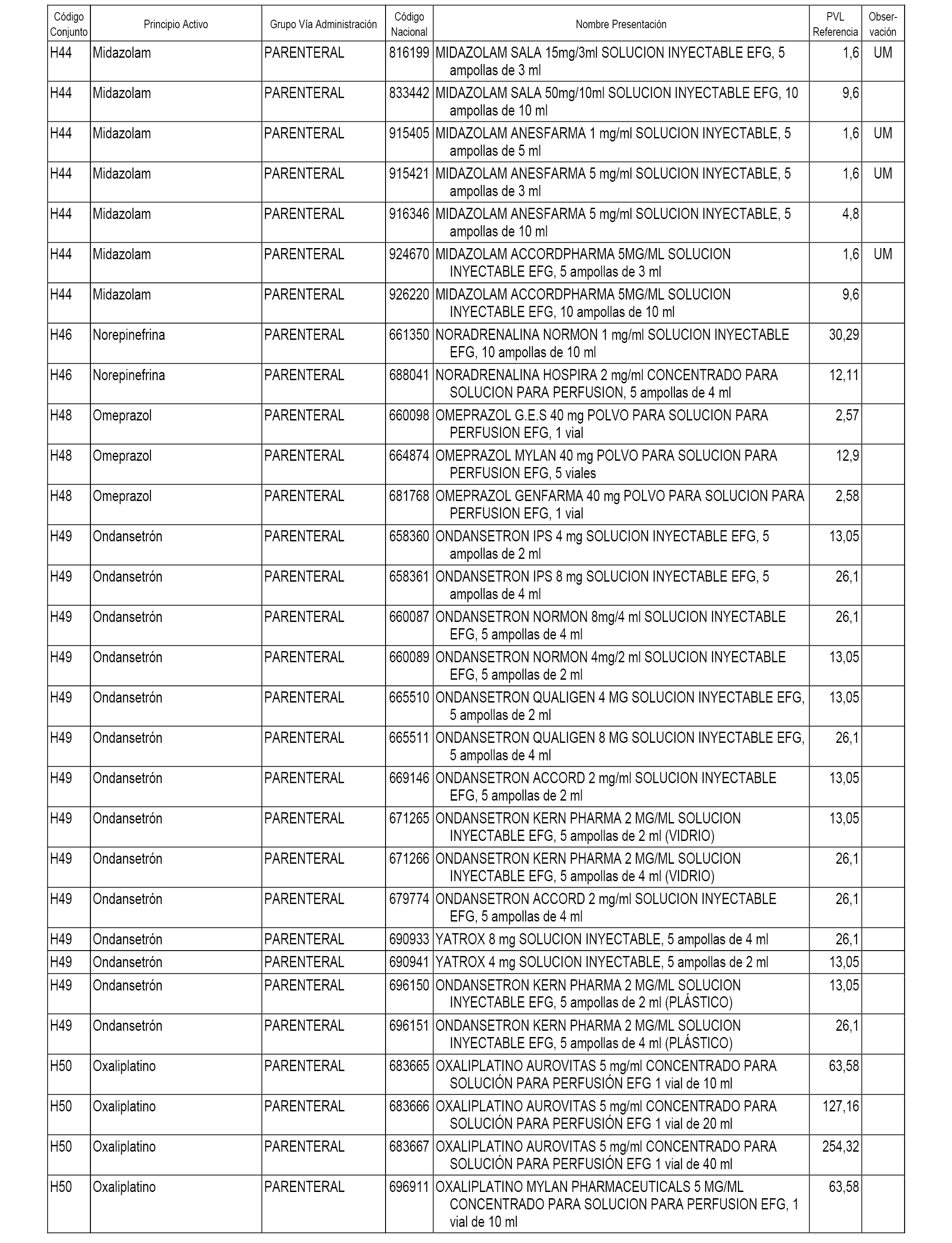
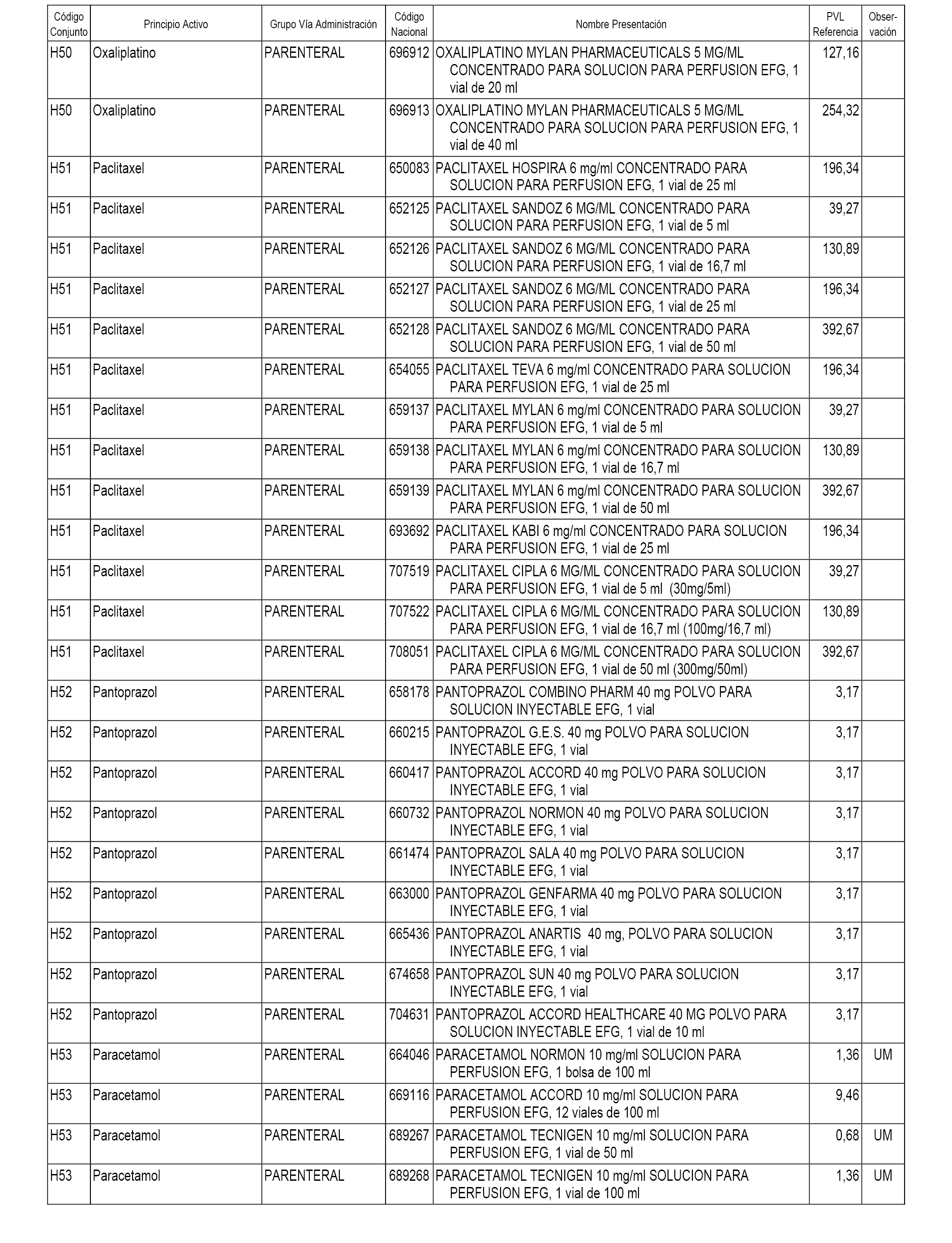
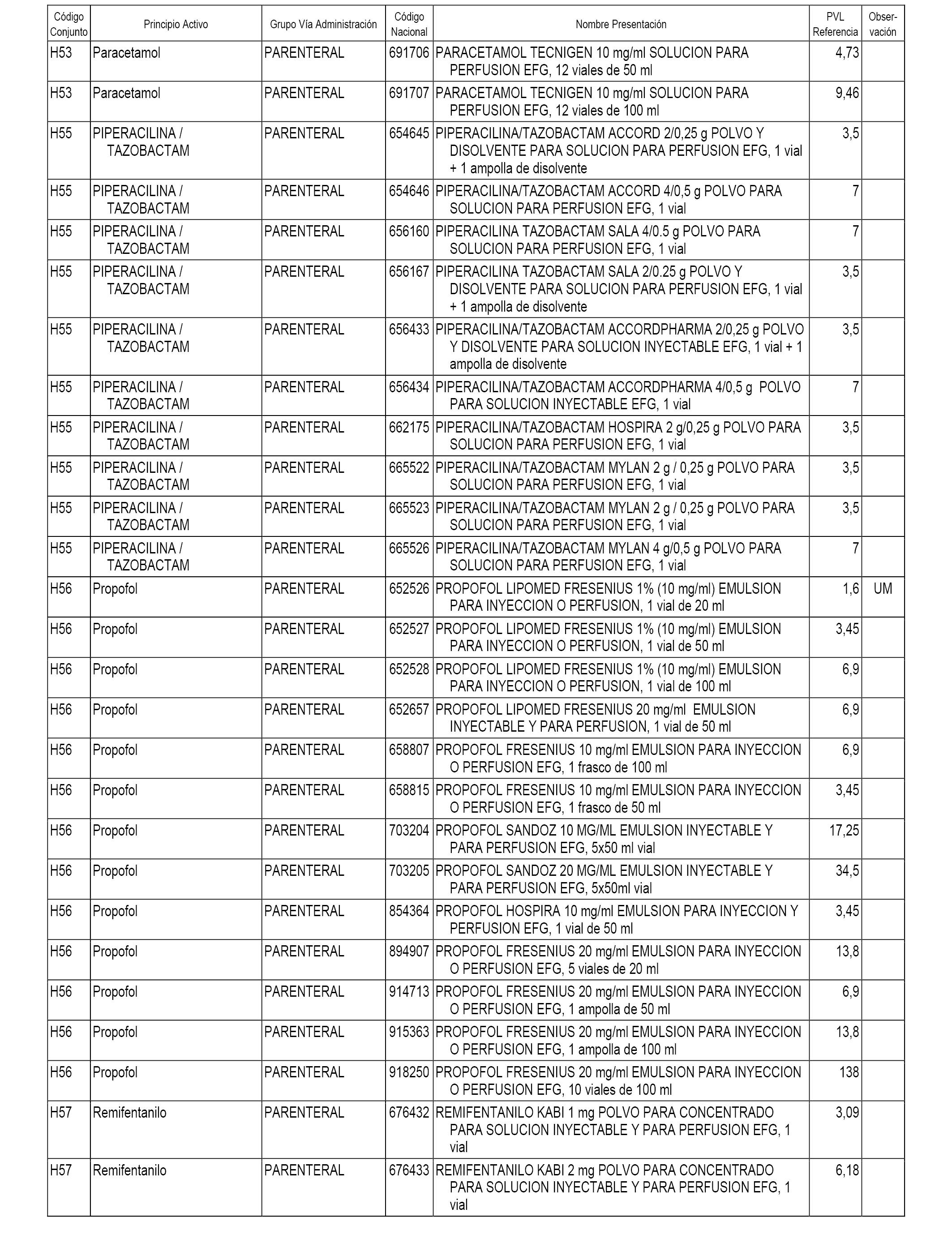
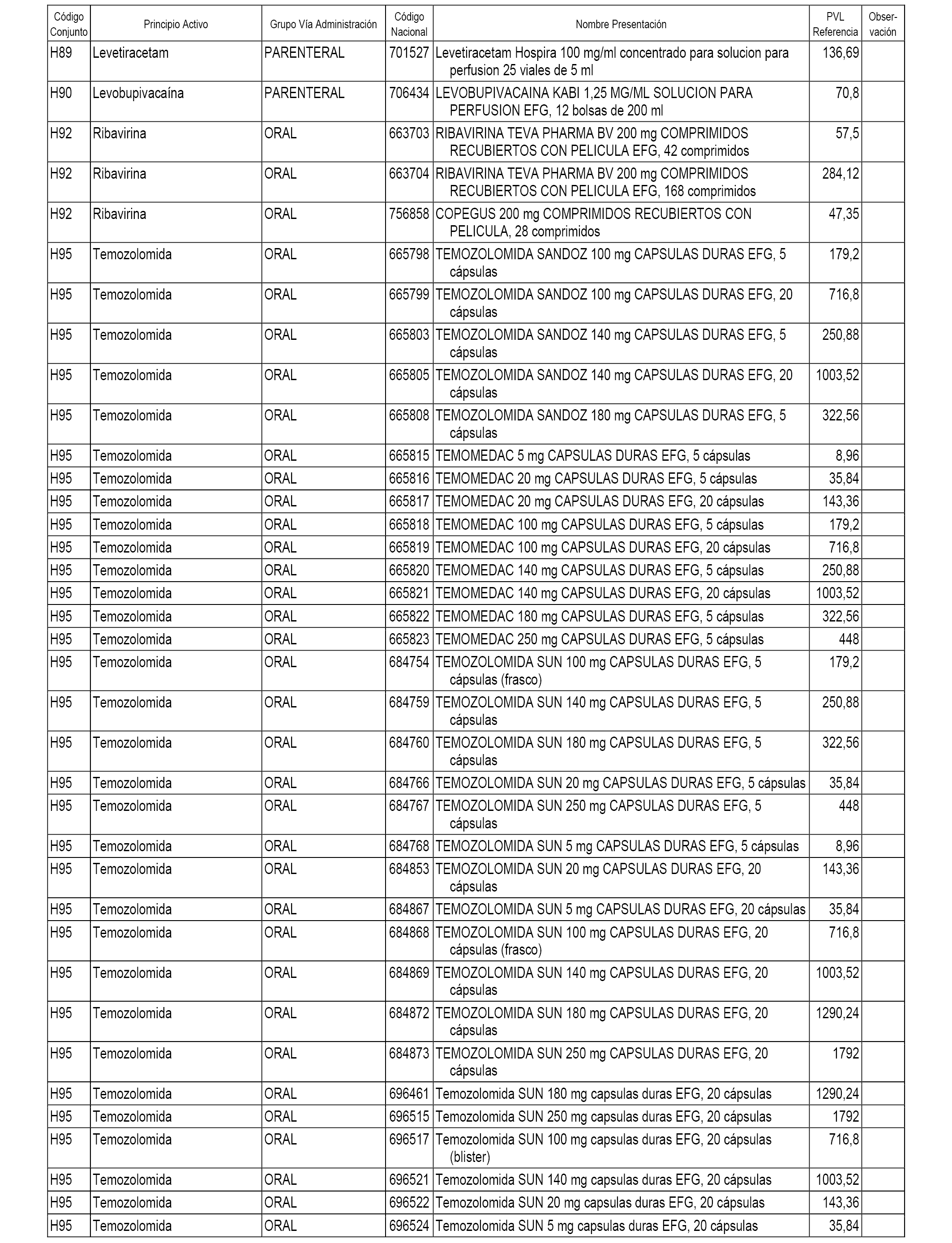
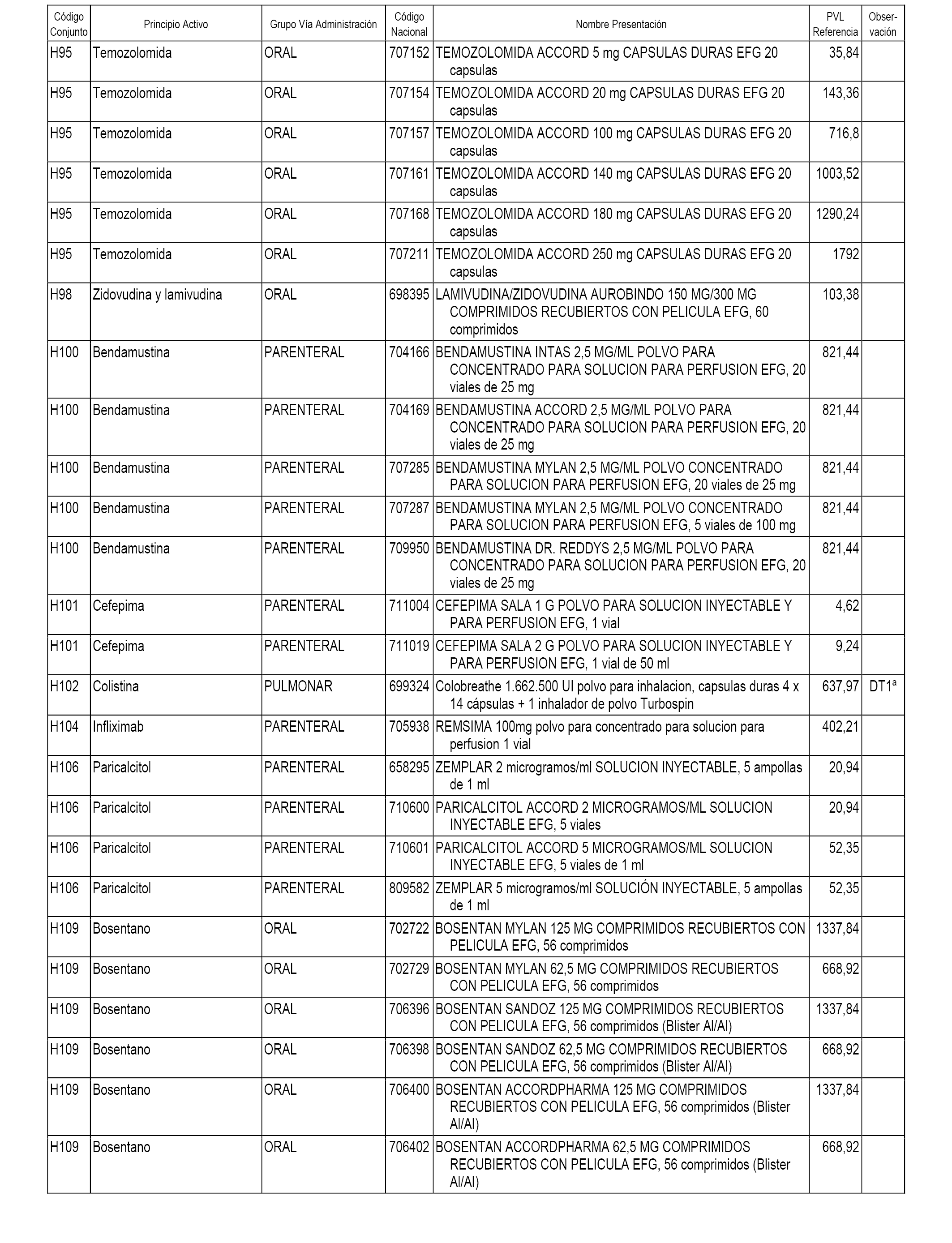
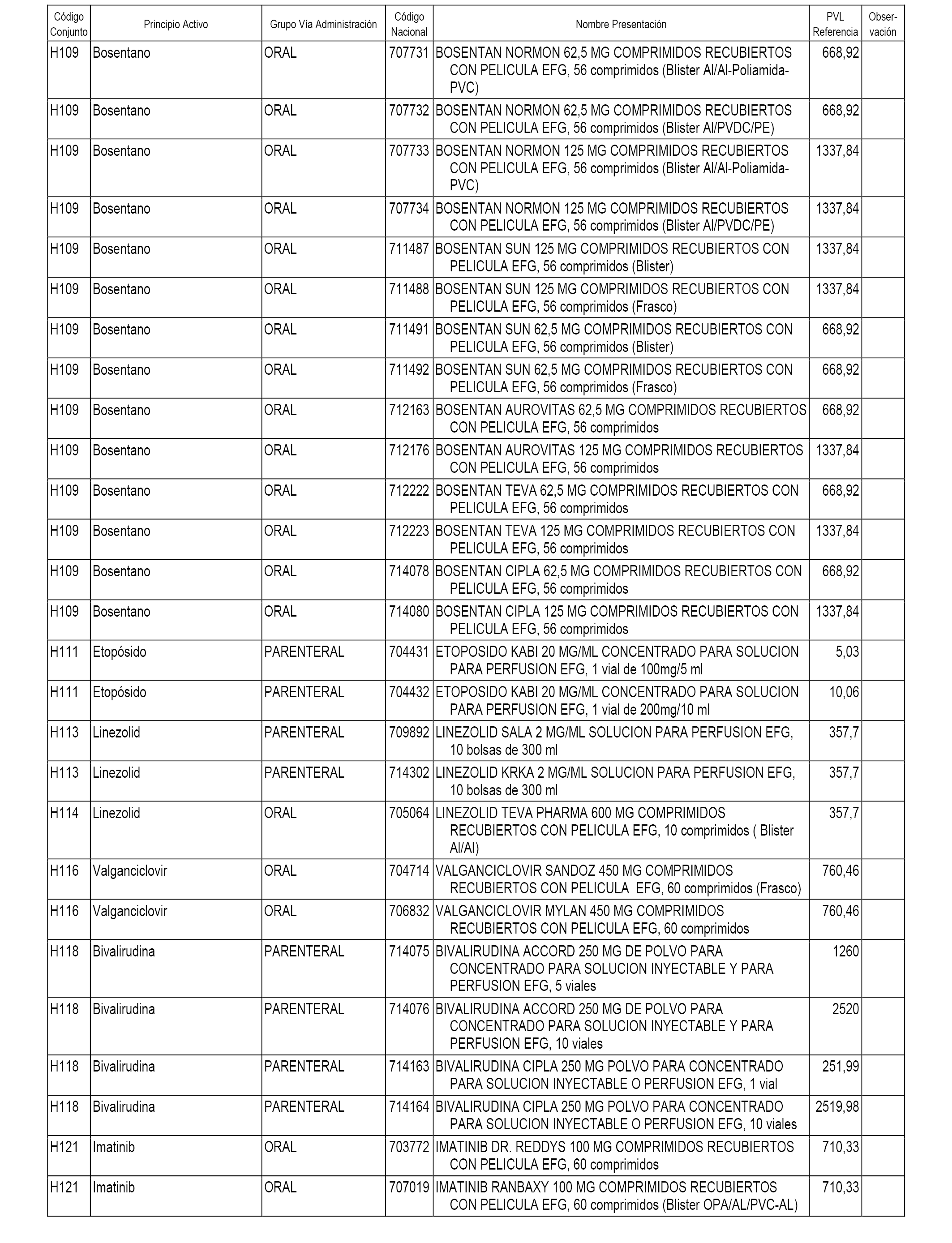
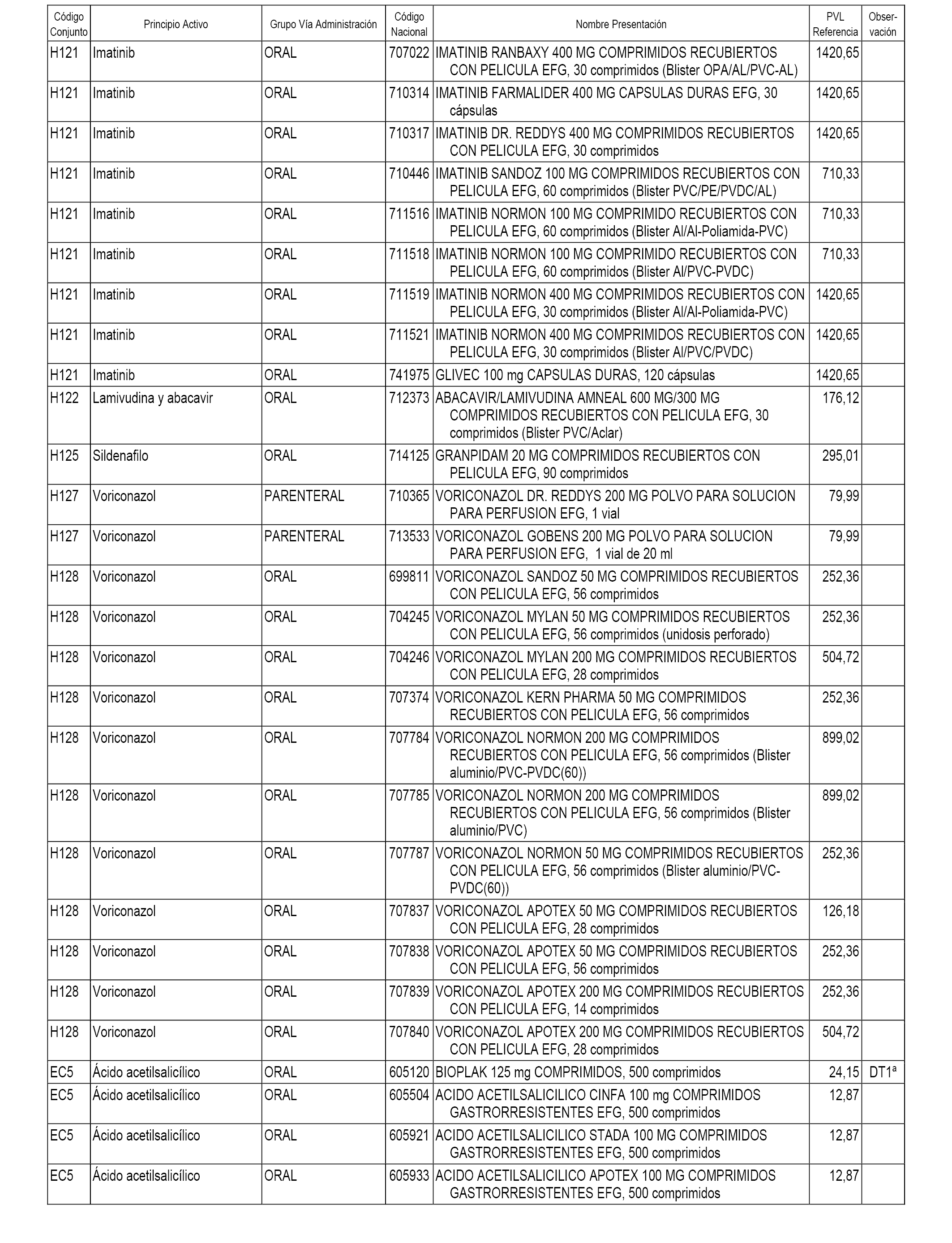
En el anexo 2 de esta orden se relacionan los conjuntos de referencia de presentaciones de medicamentos de ámbito hospitalario y presentaciones en envase clínico, con indicación del precio industrial de referencia fijado para cada presentación.
Son de nueva creación los conjuntos enumerados del H-118 al H-128 y del EC-144 al EC-146 del citado anexo.
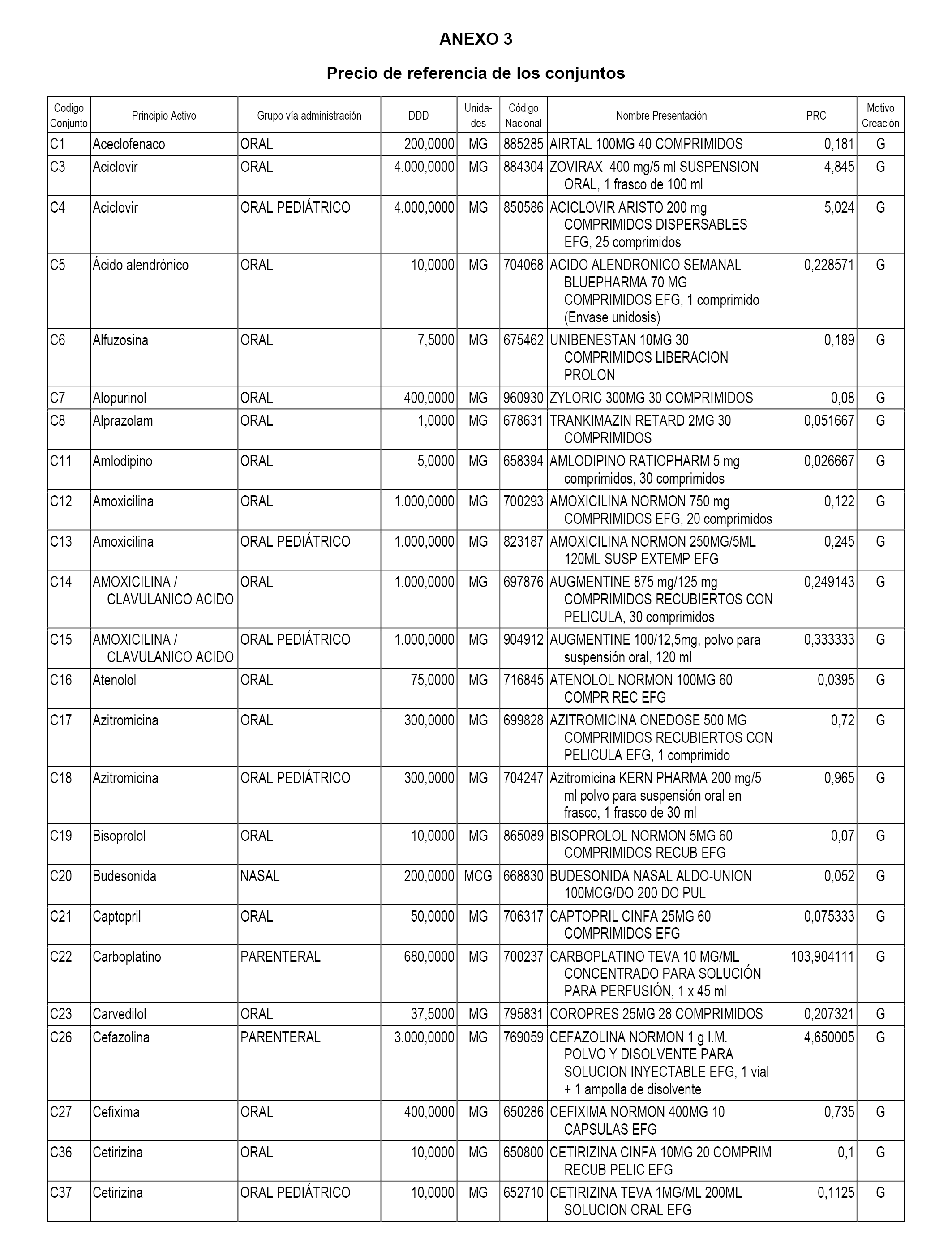
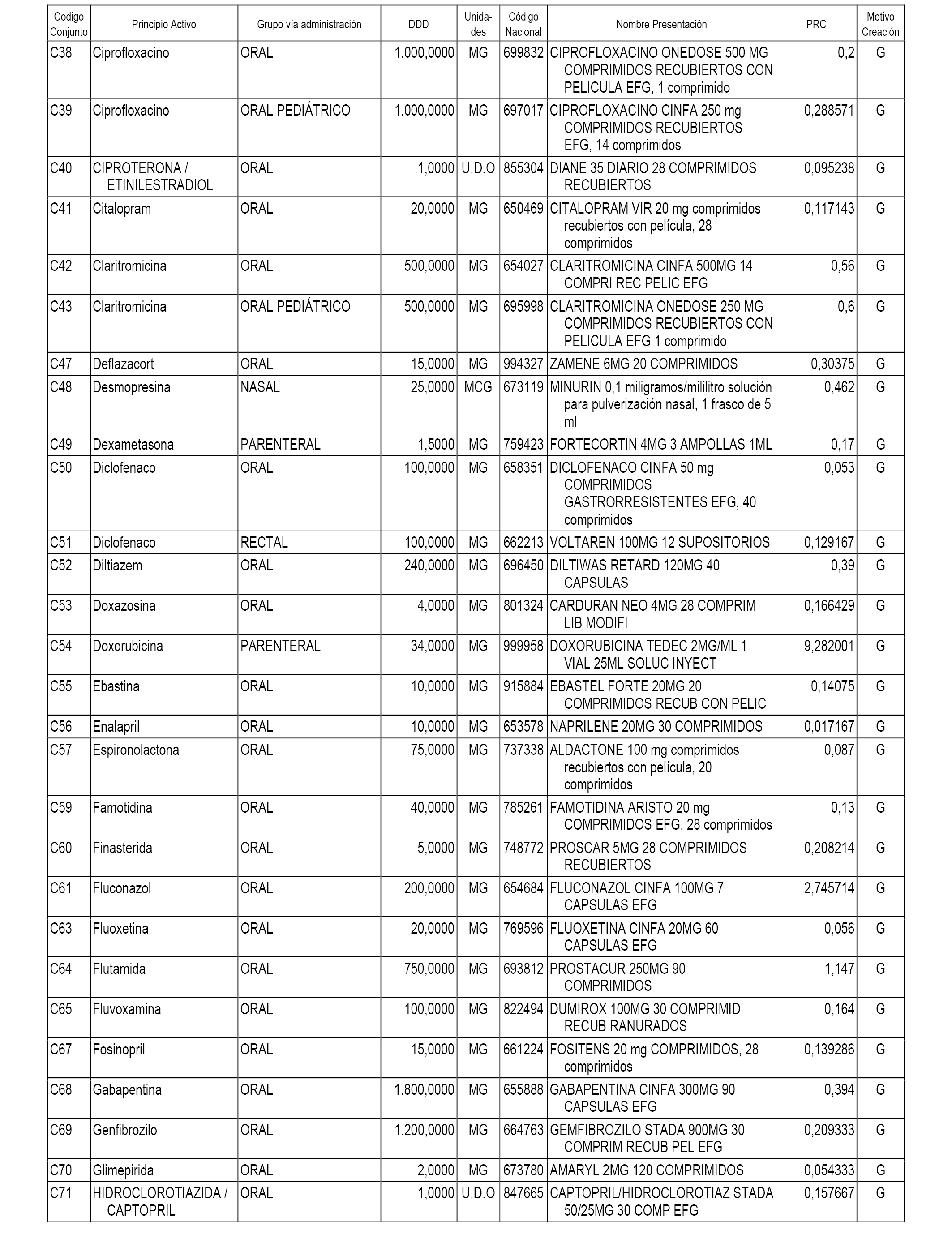
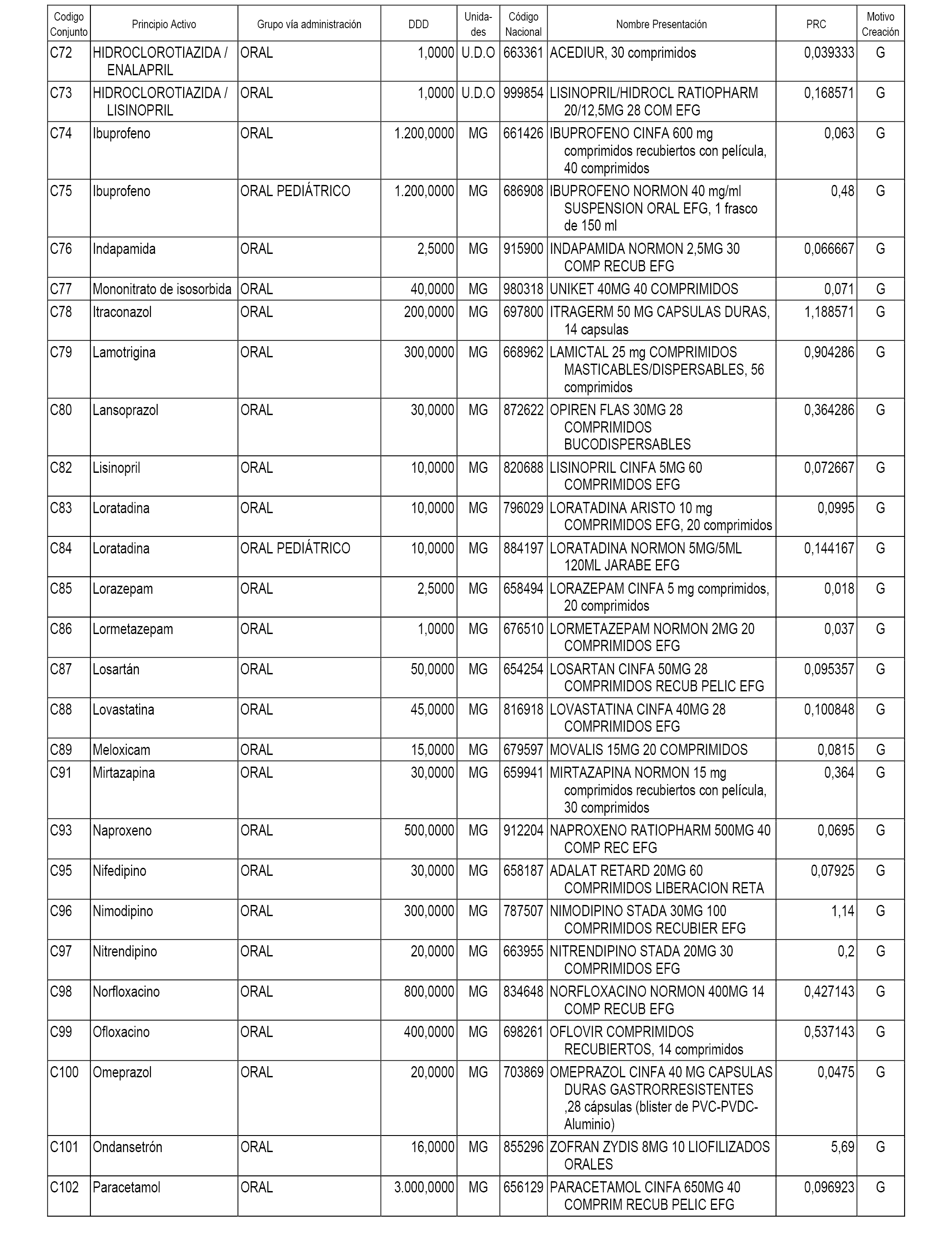
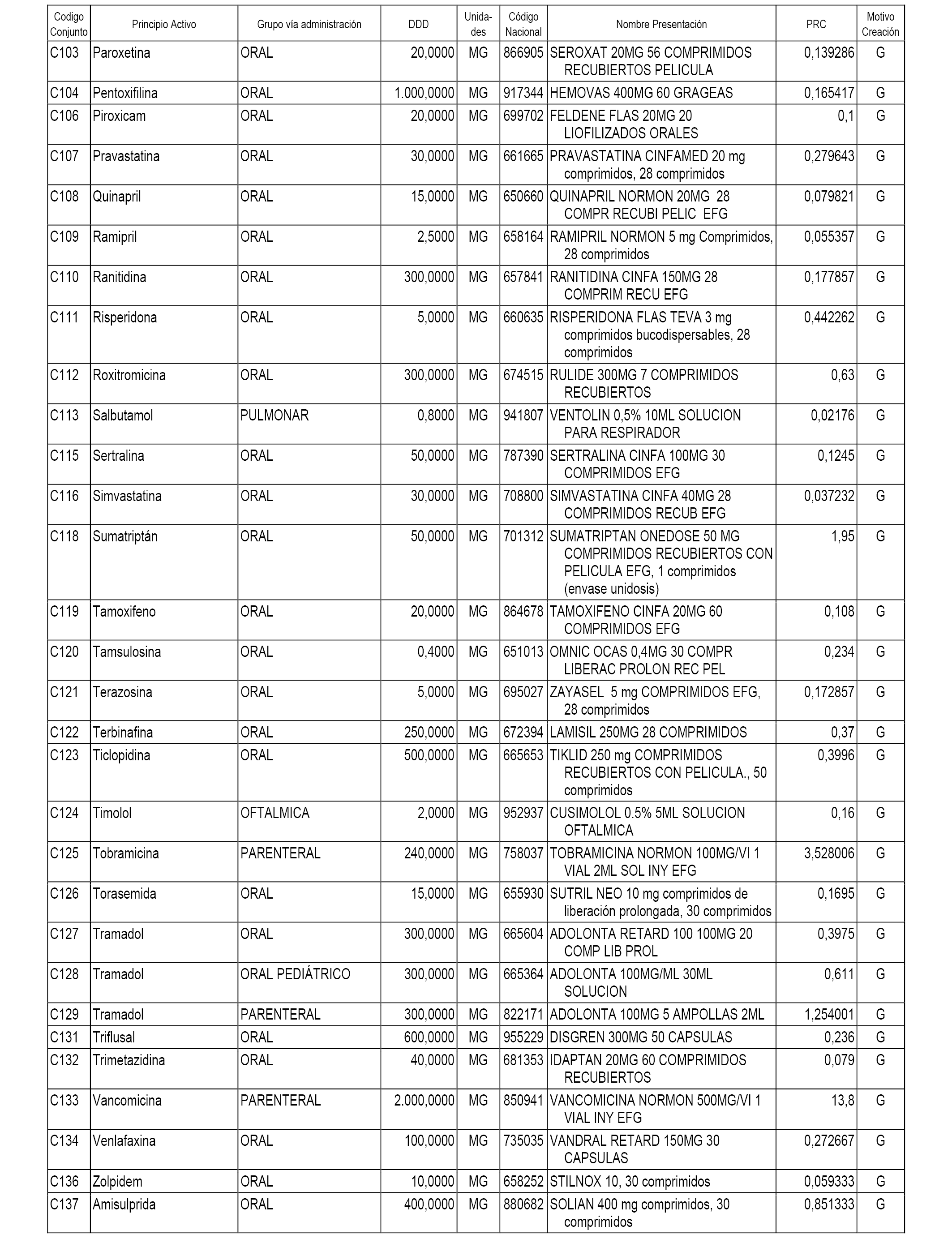
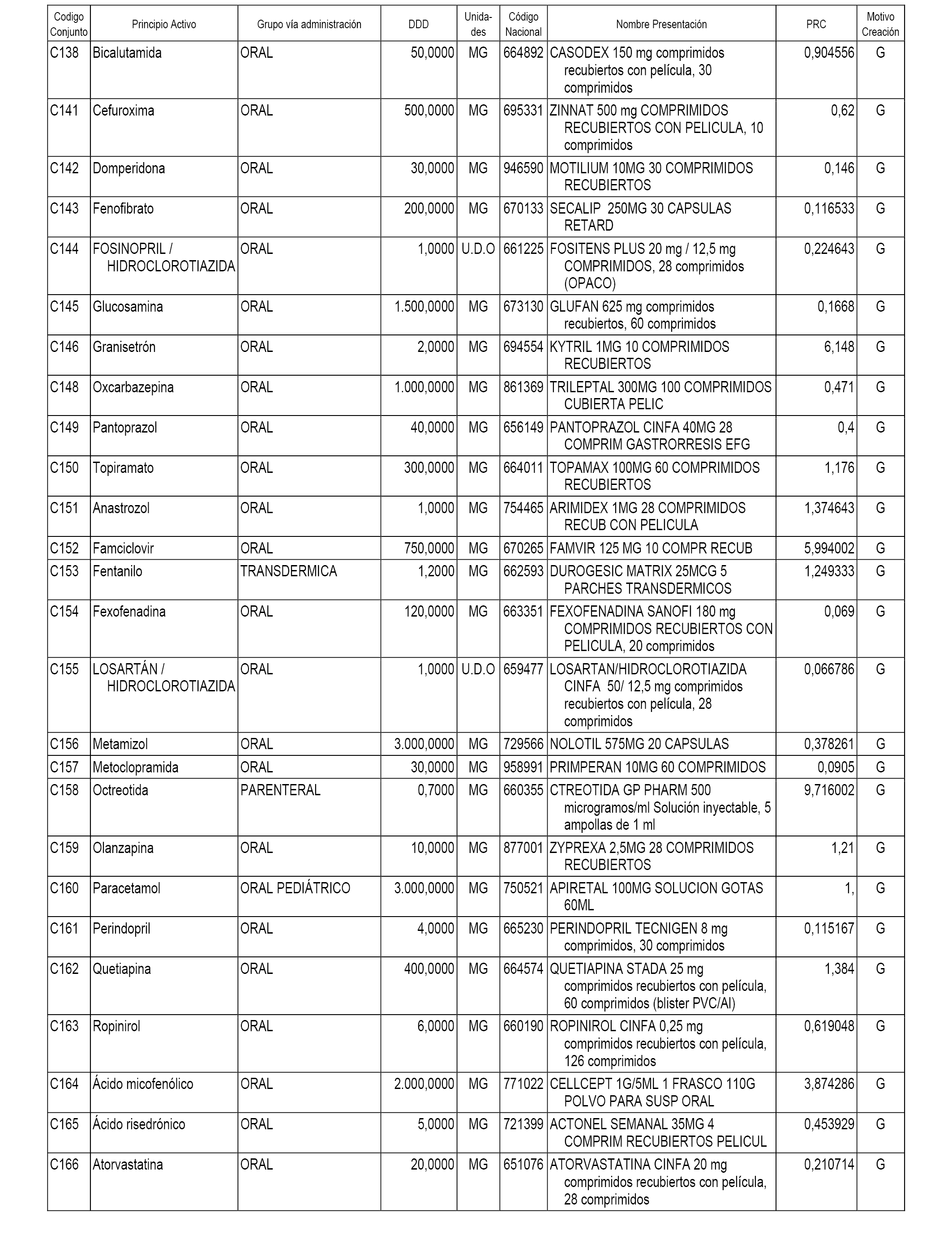
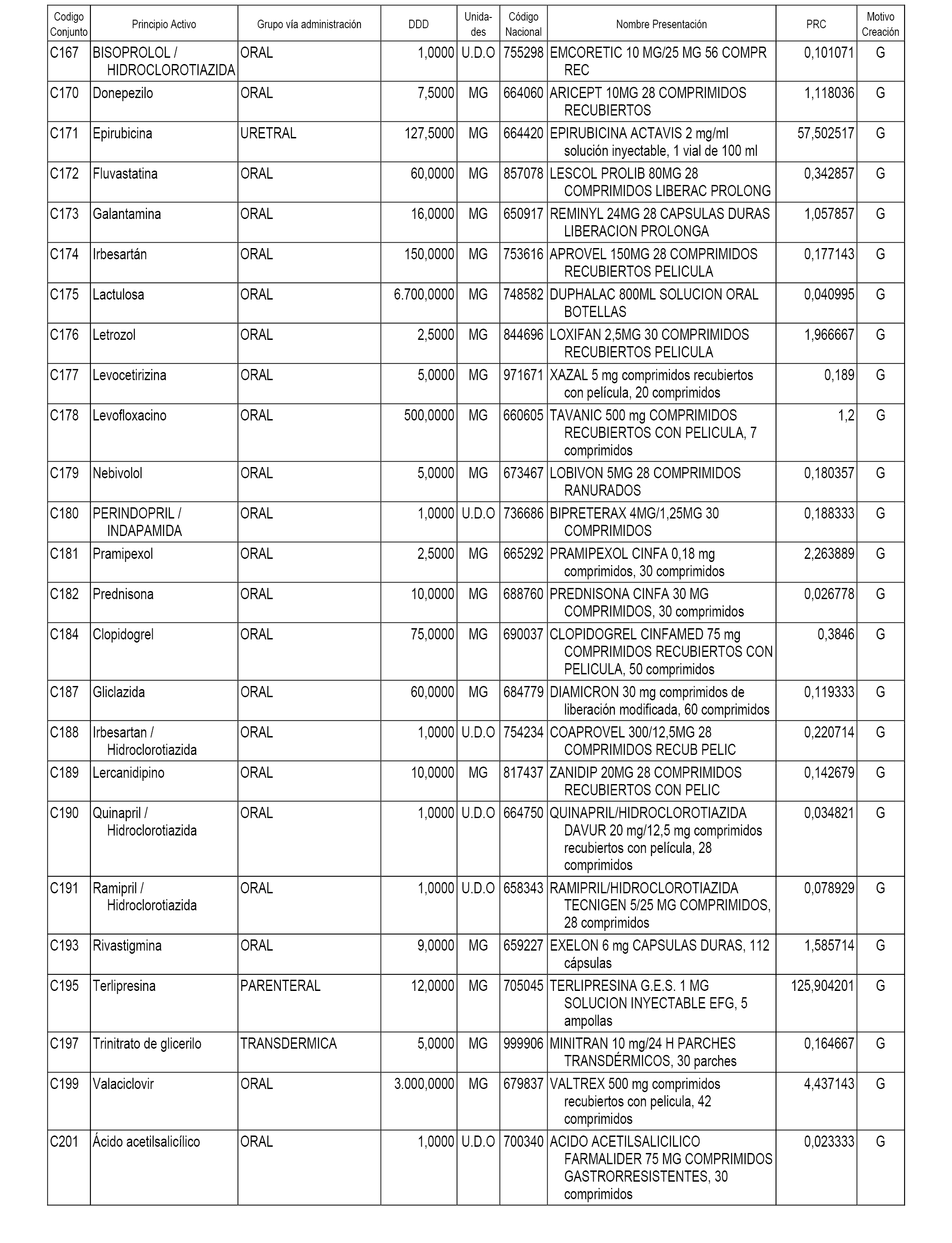
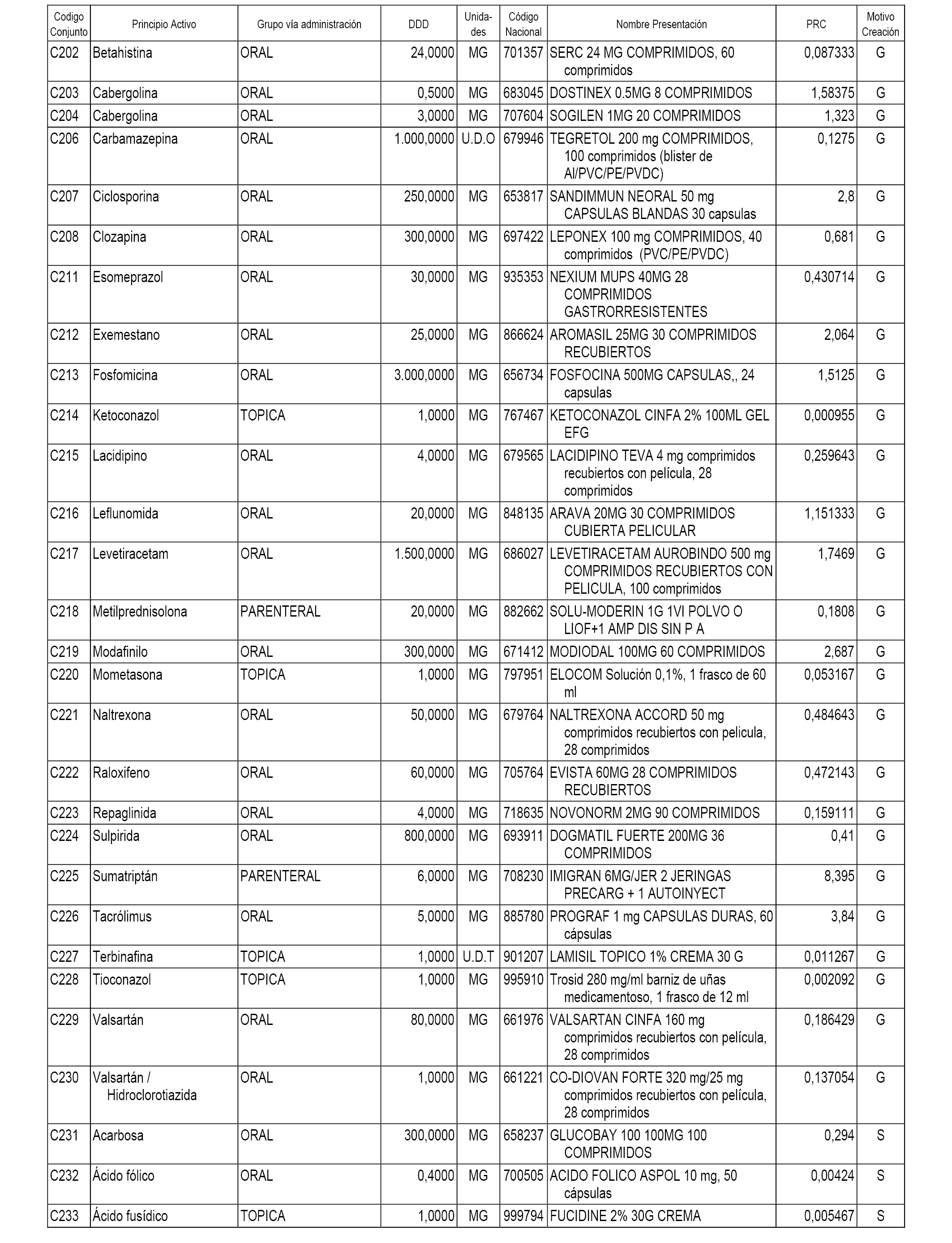
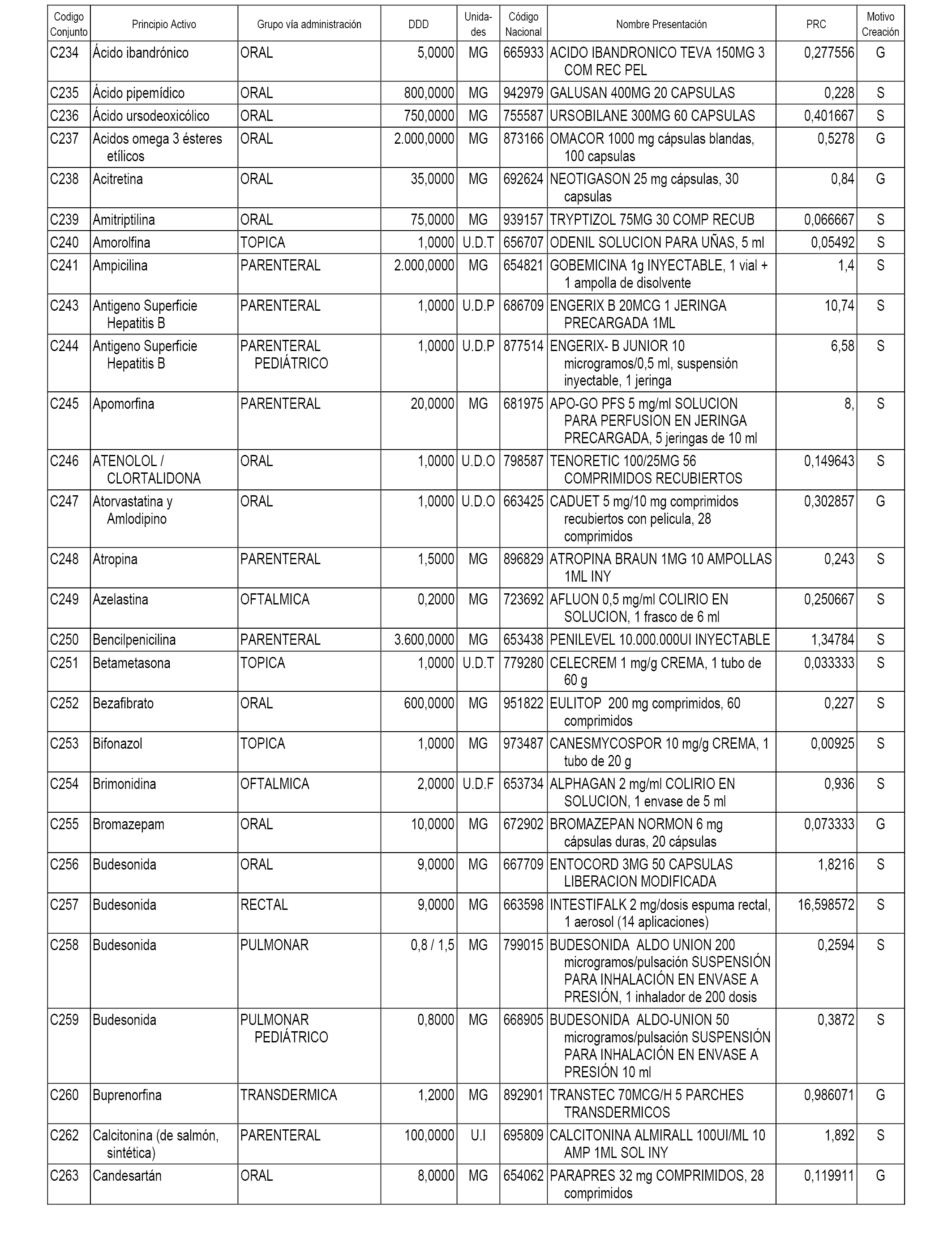
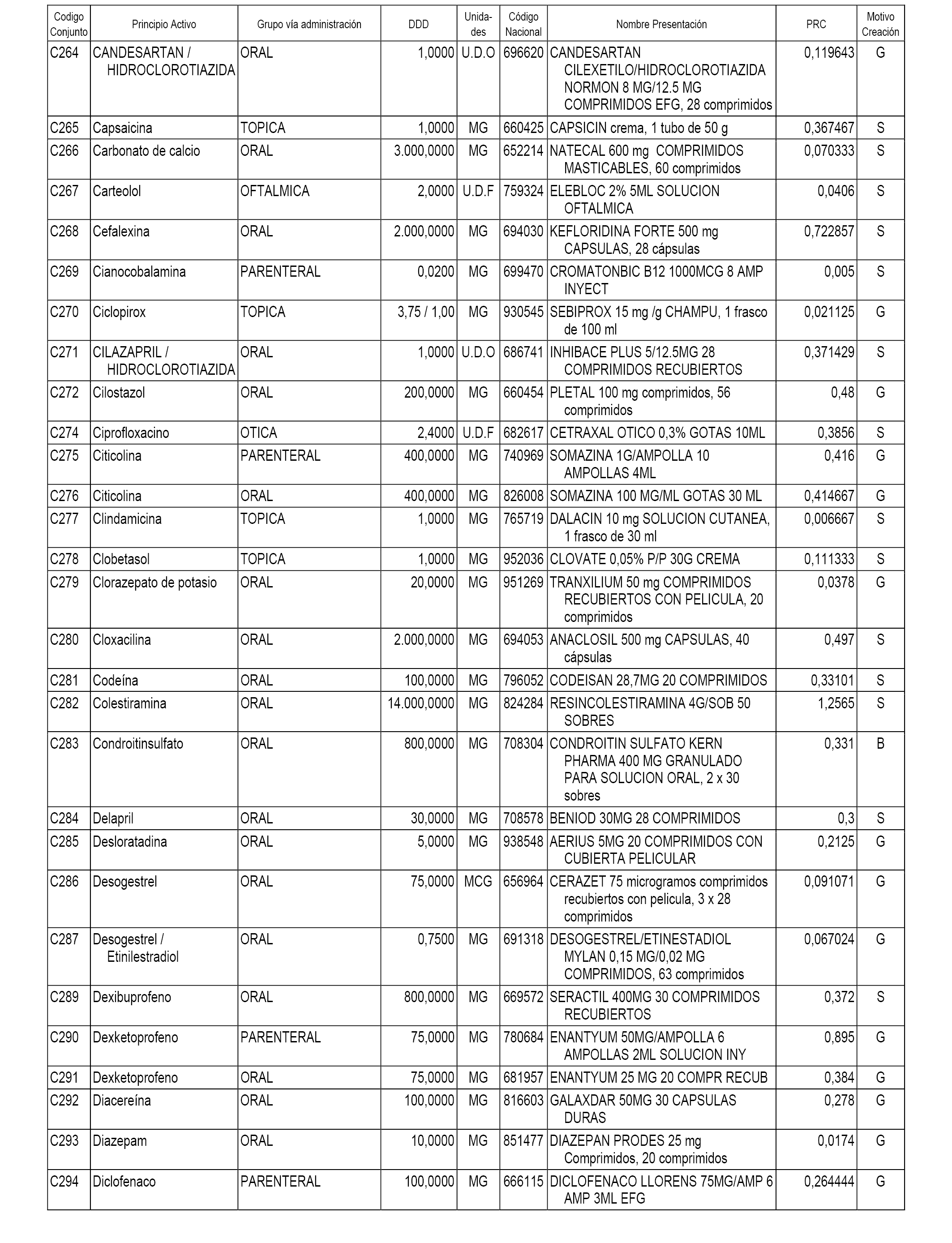
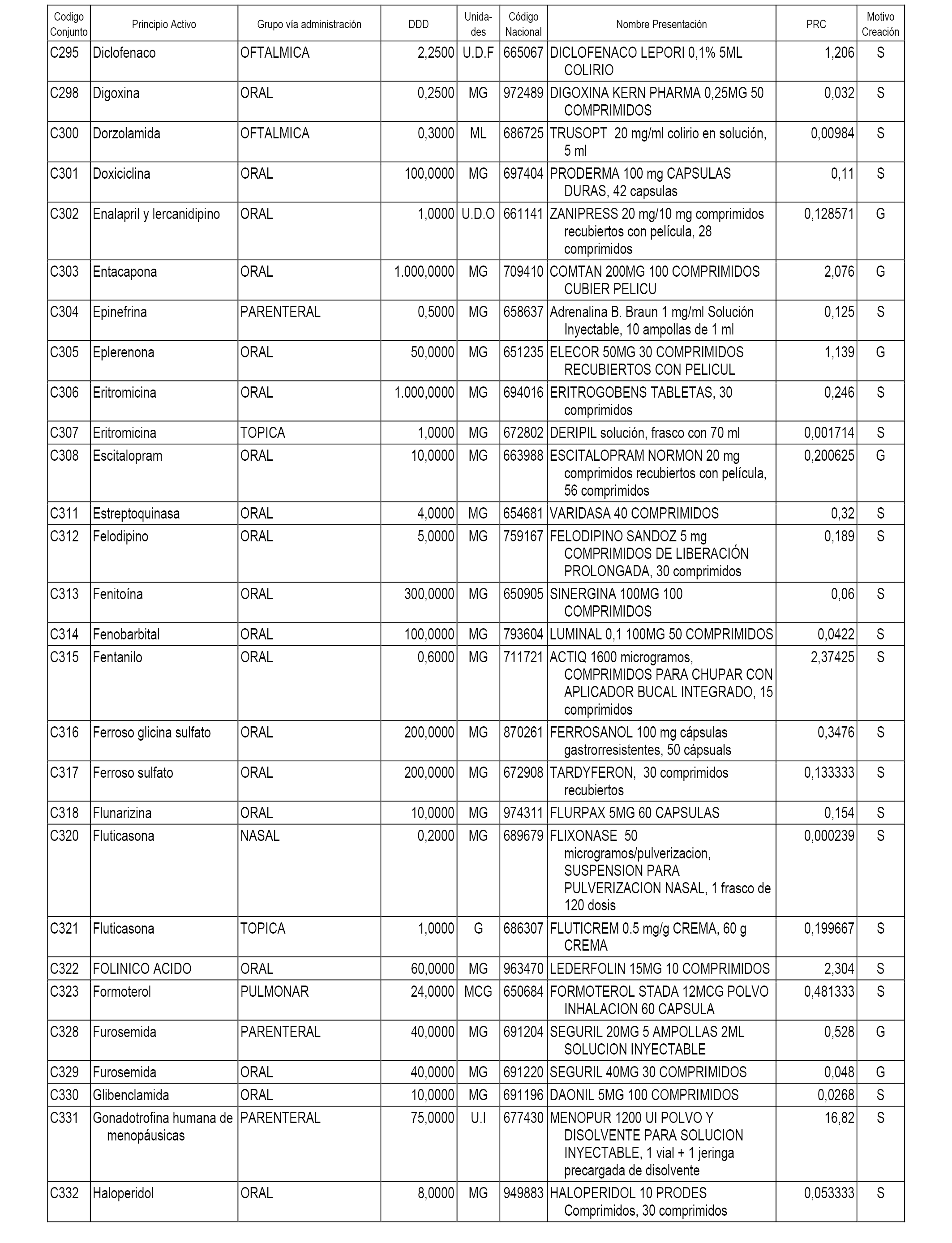
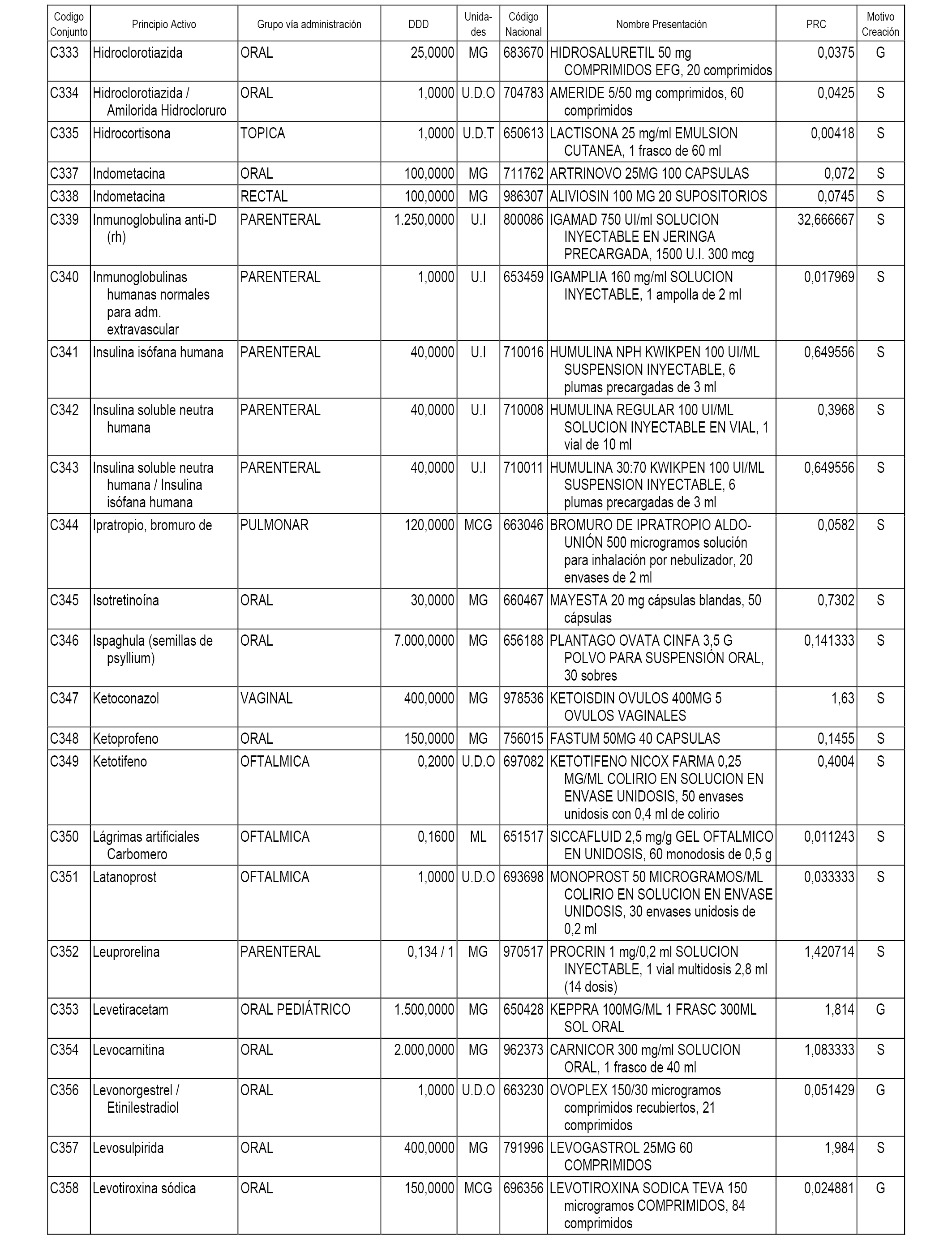
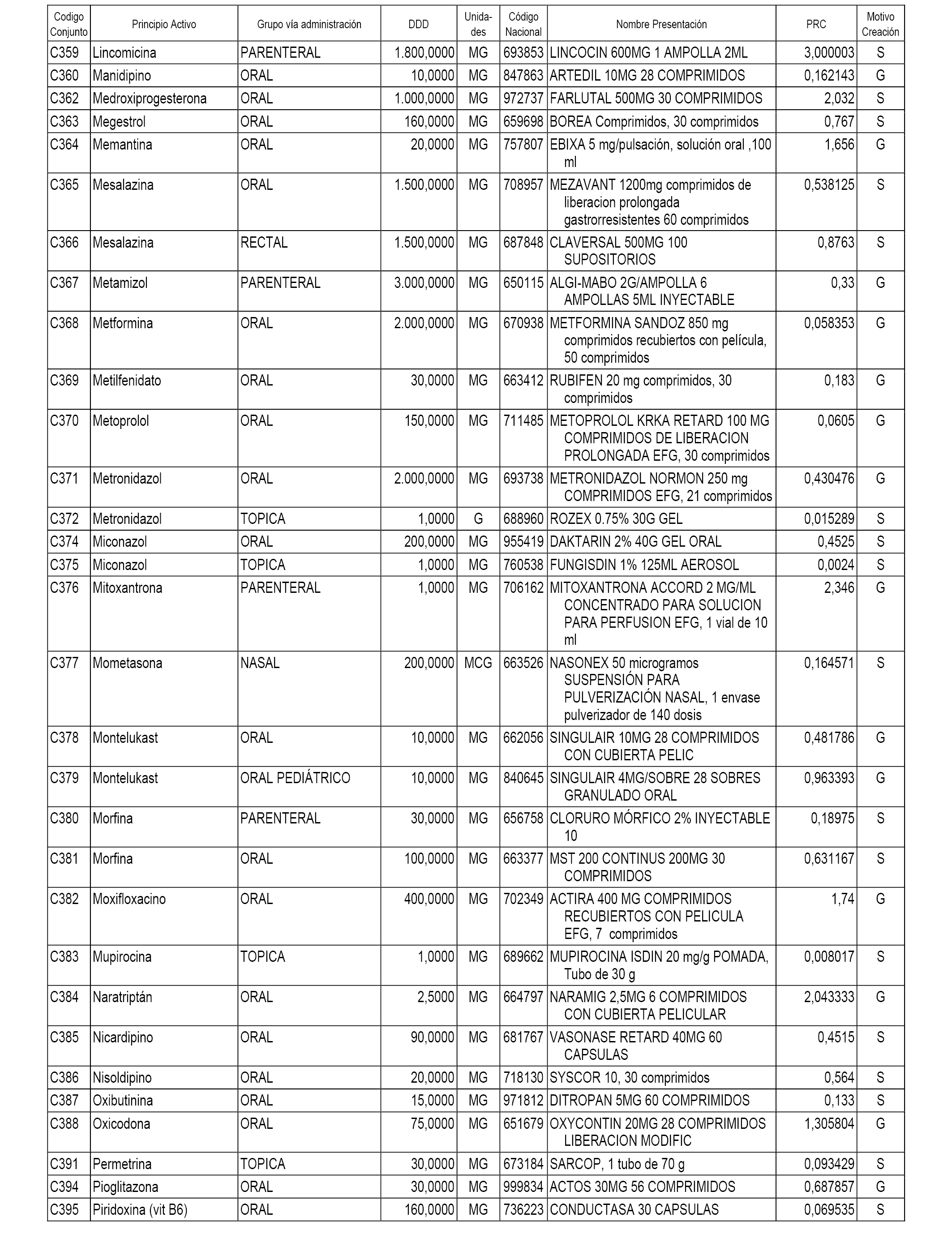
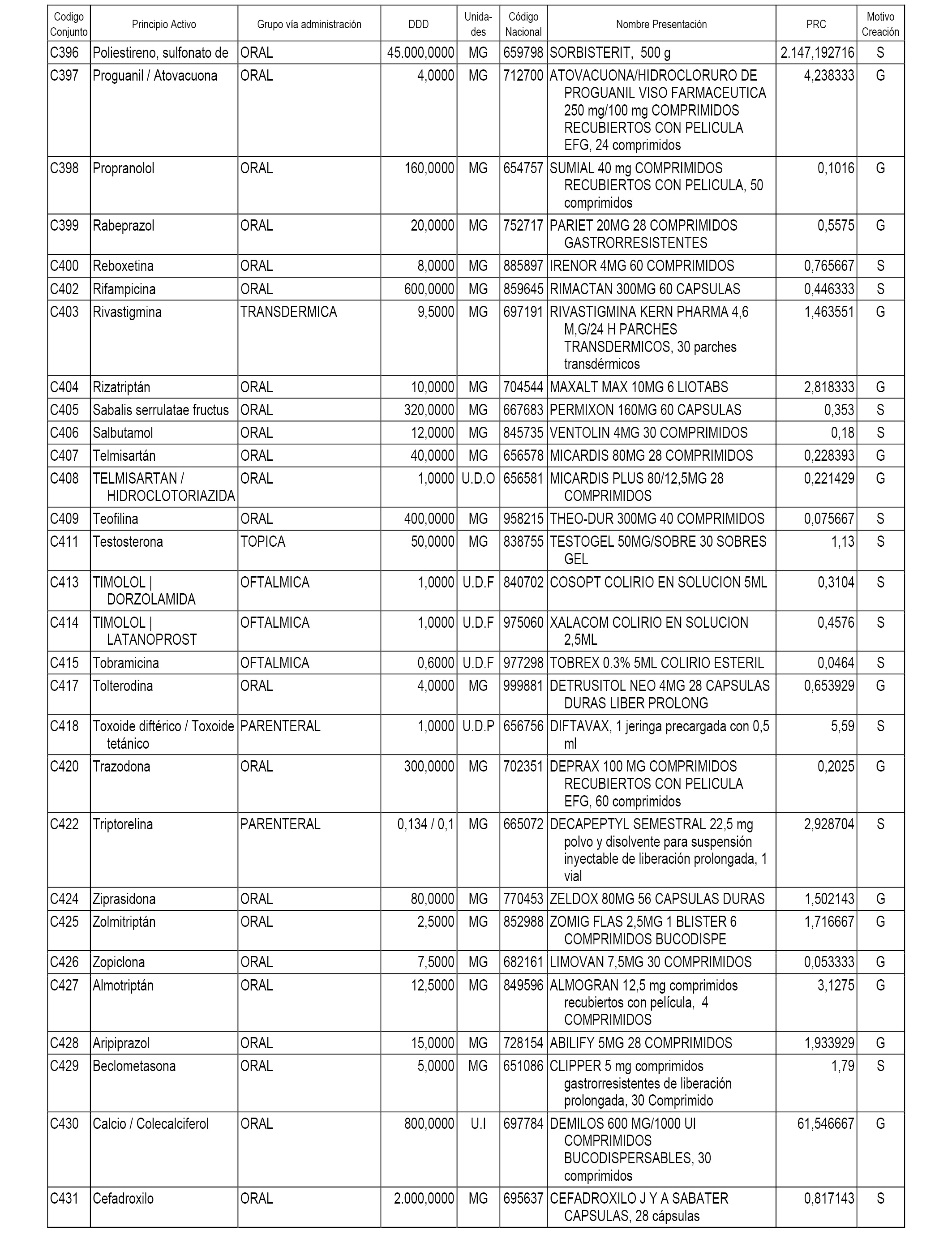
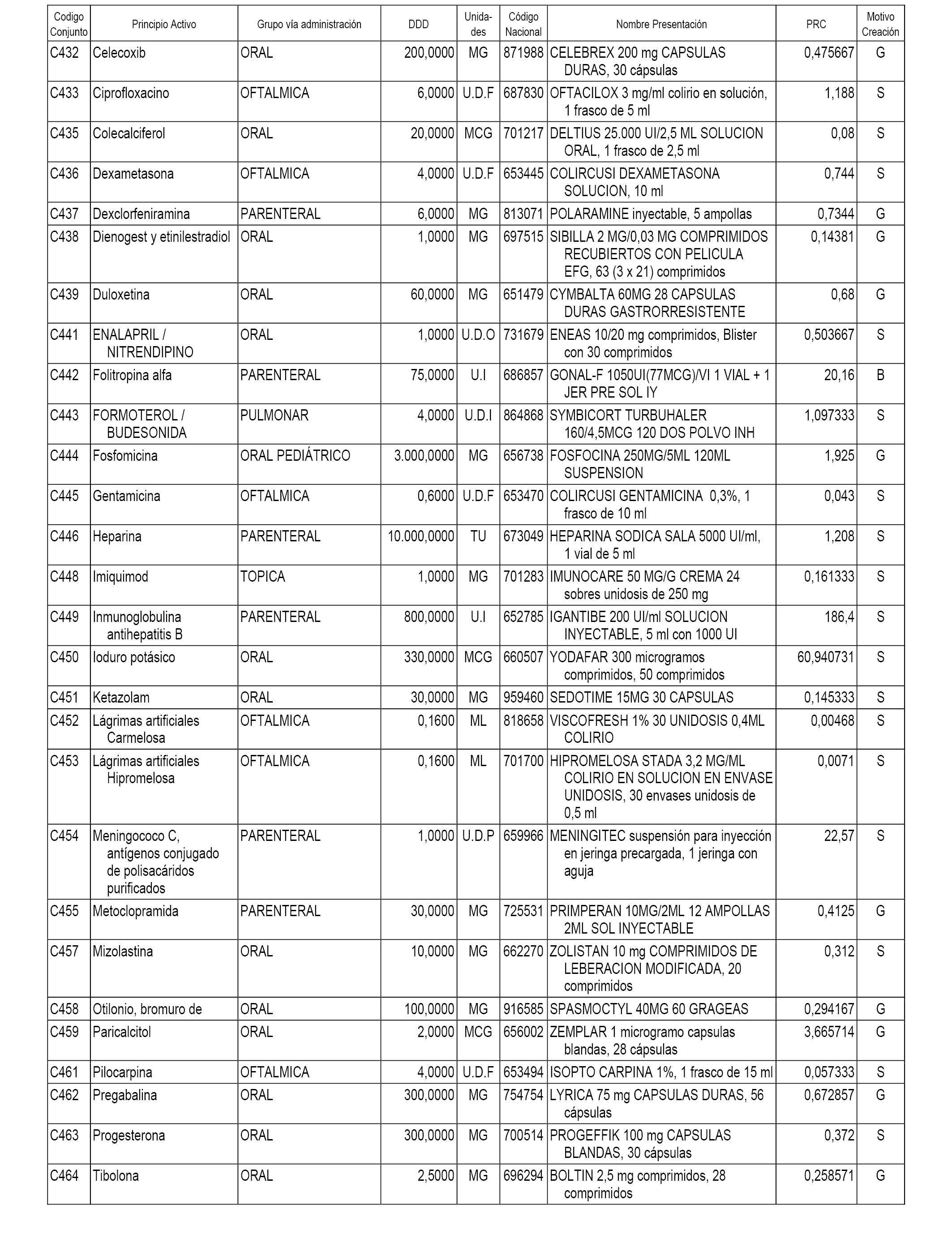
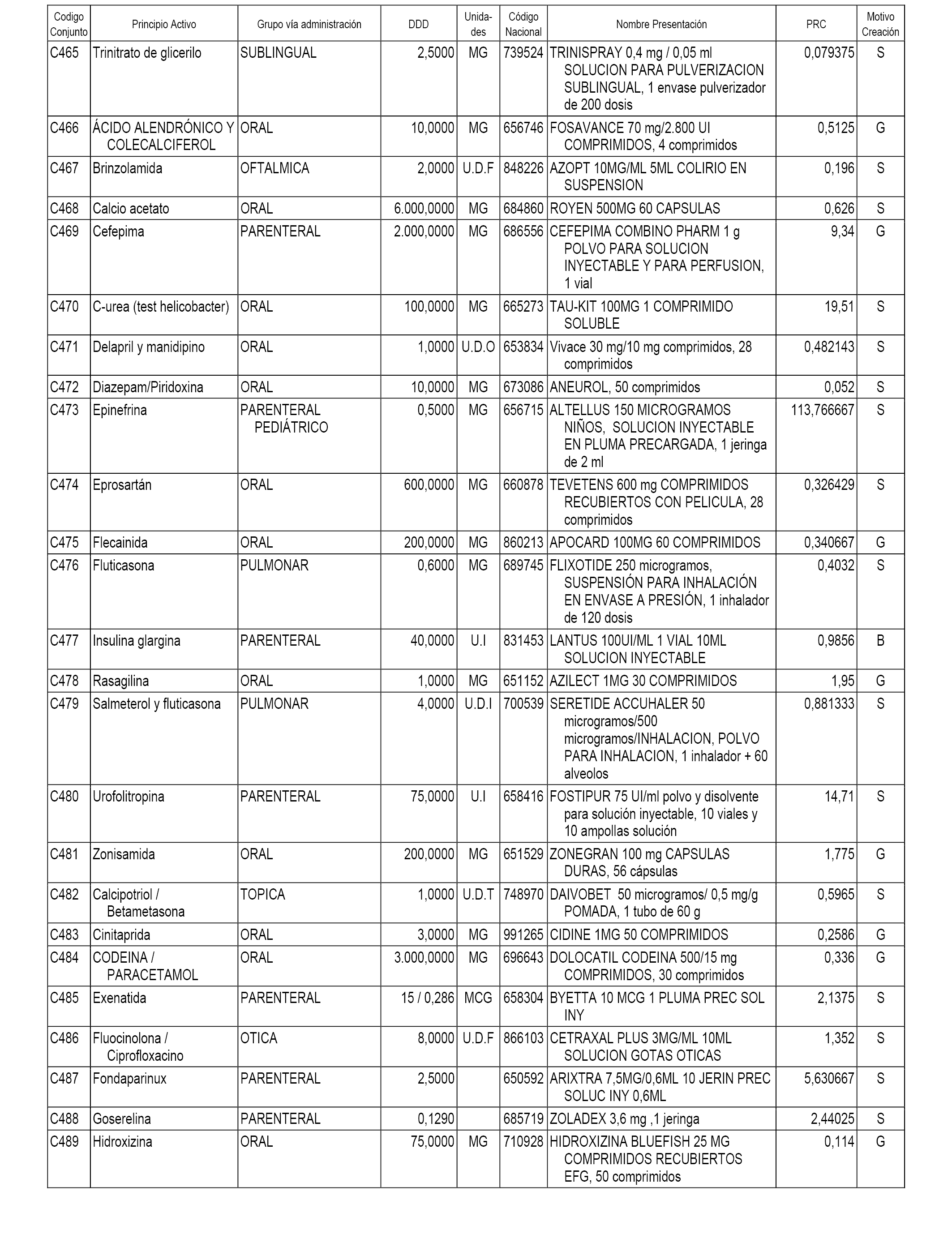
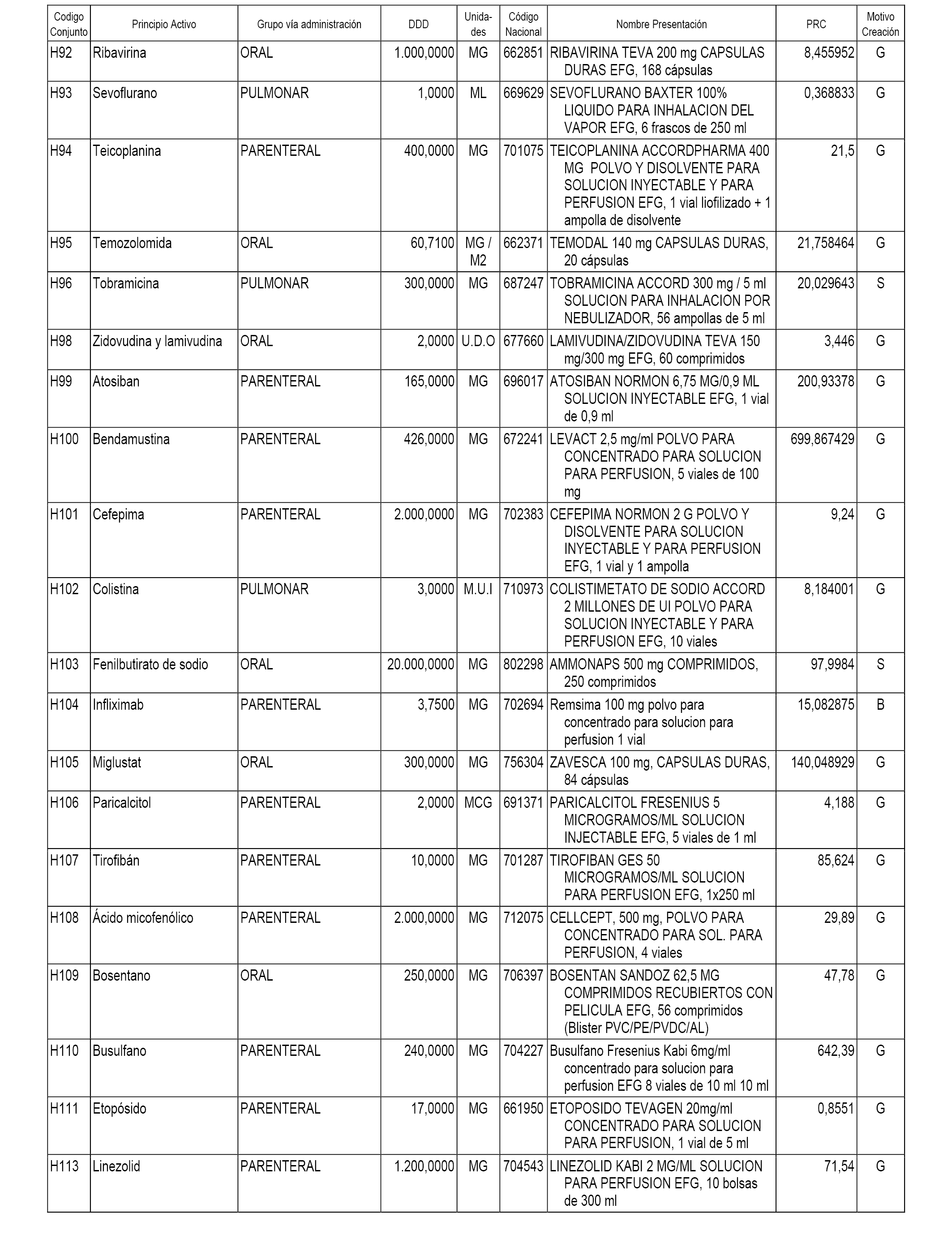
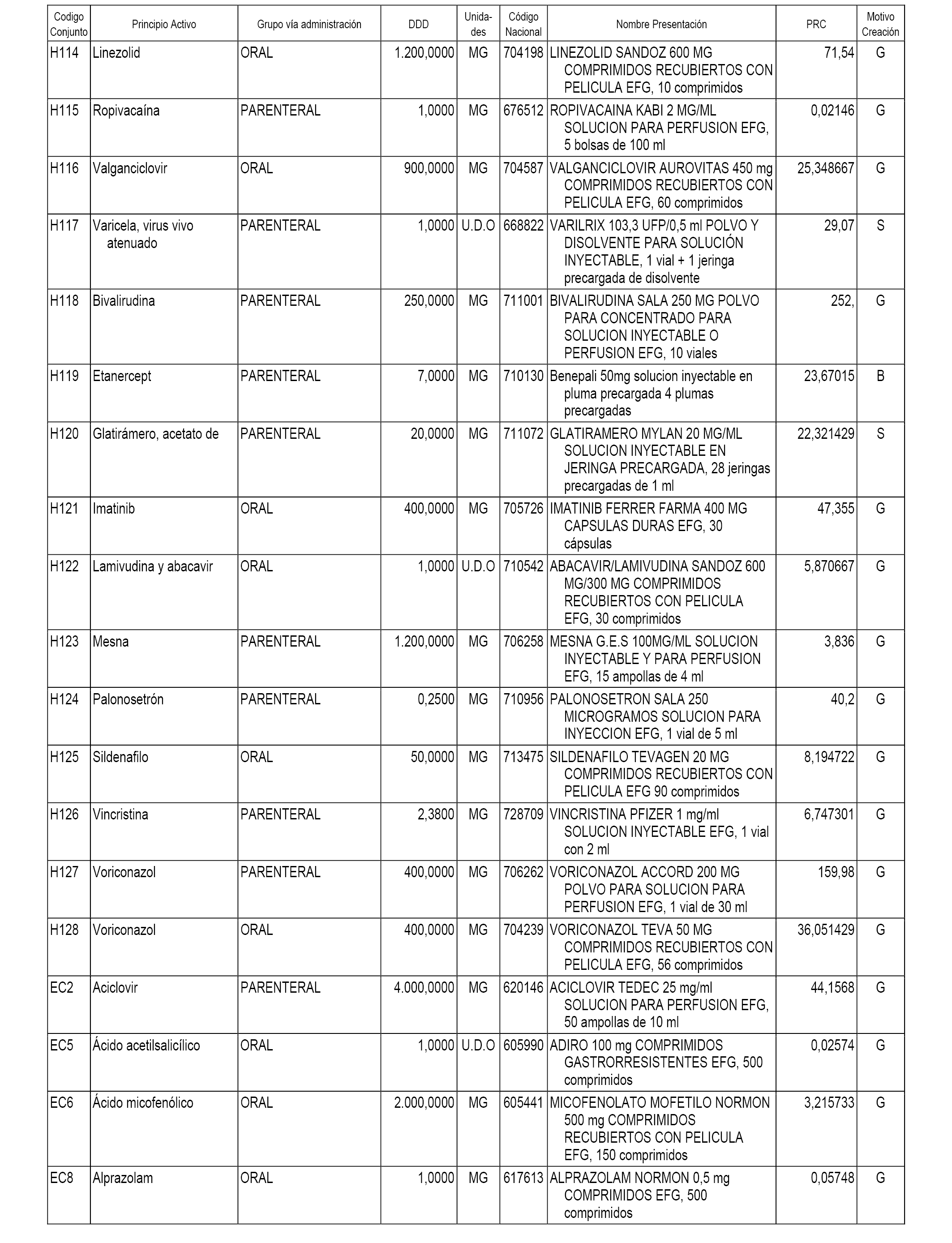
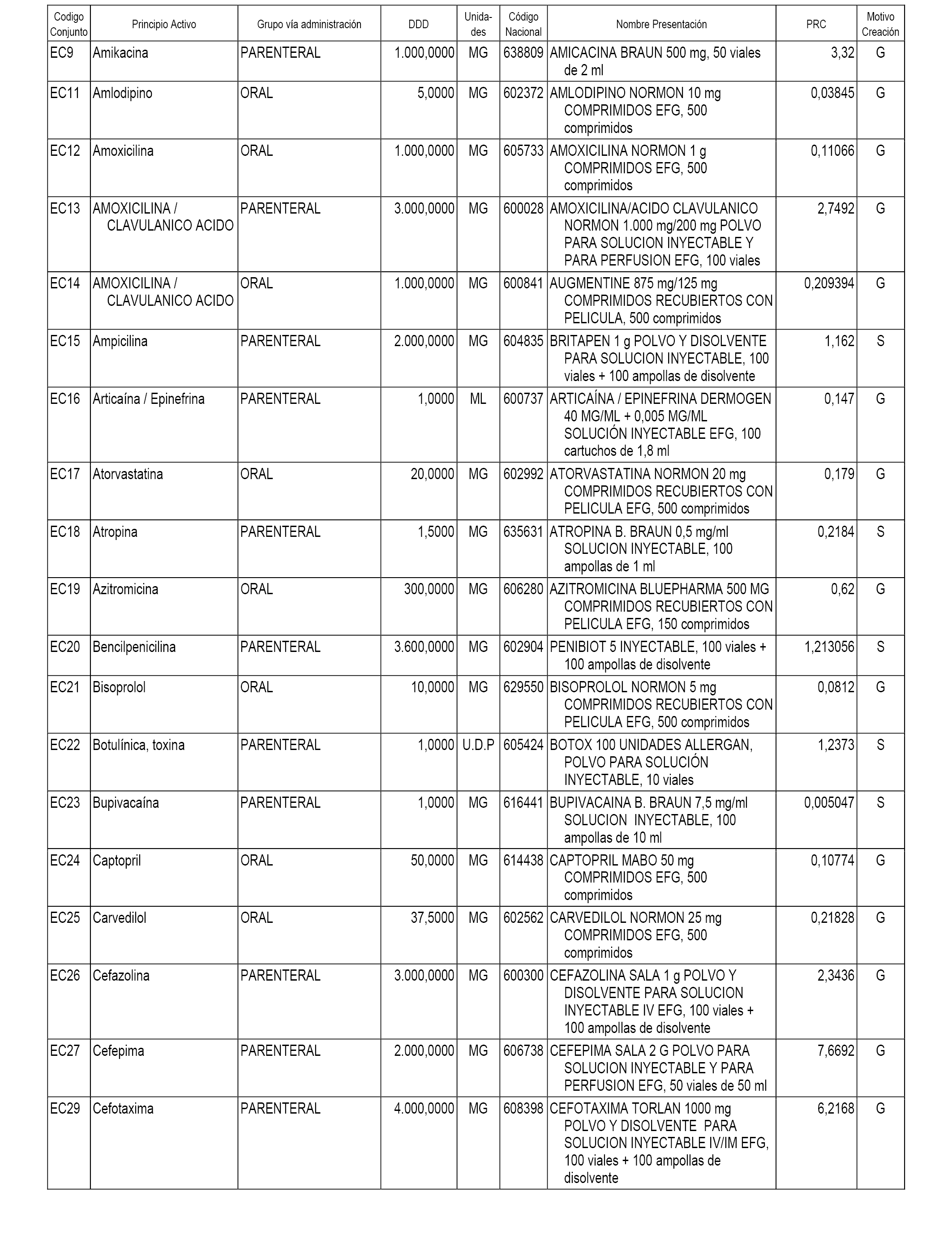
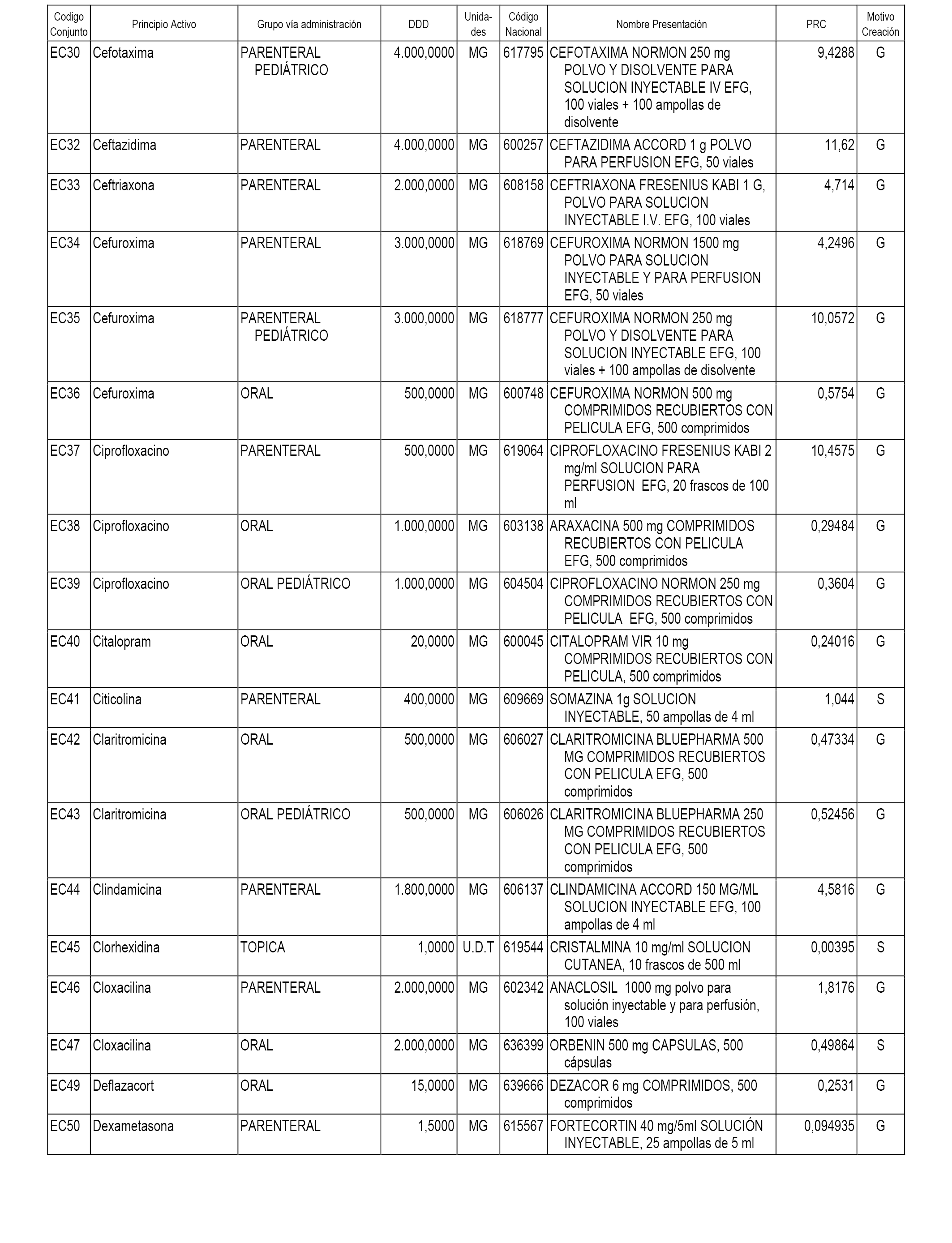
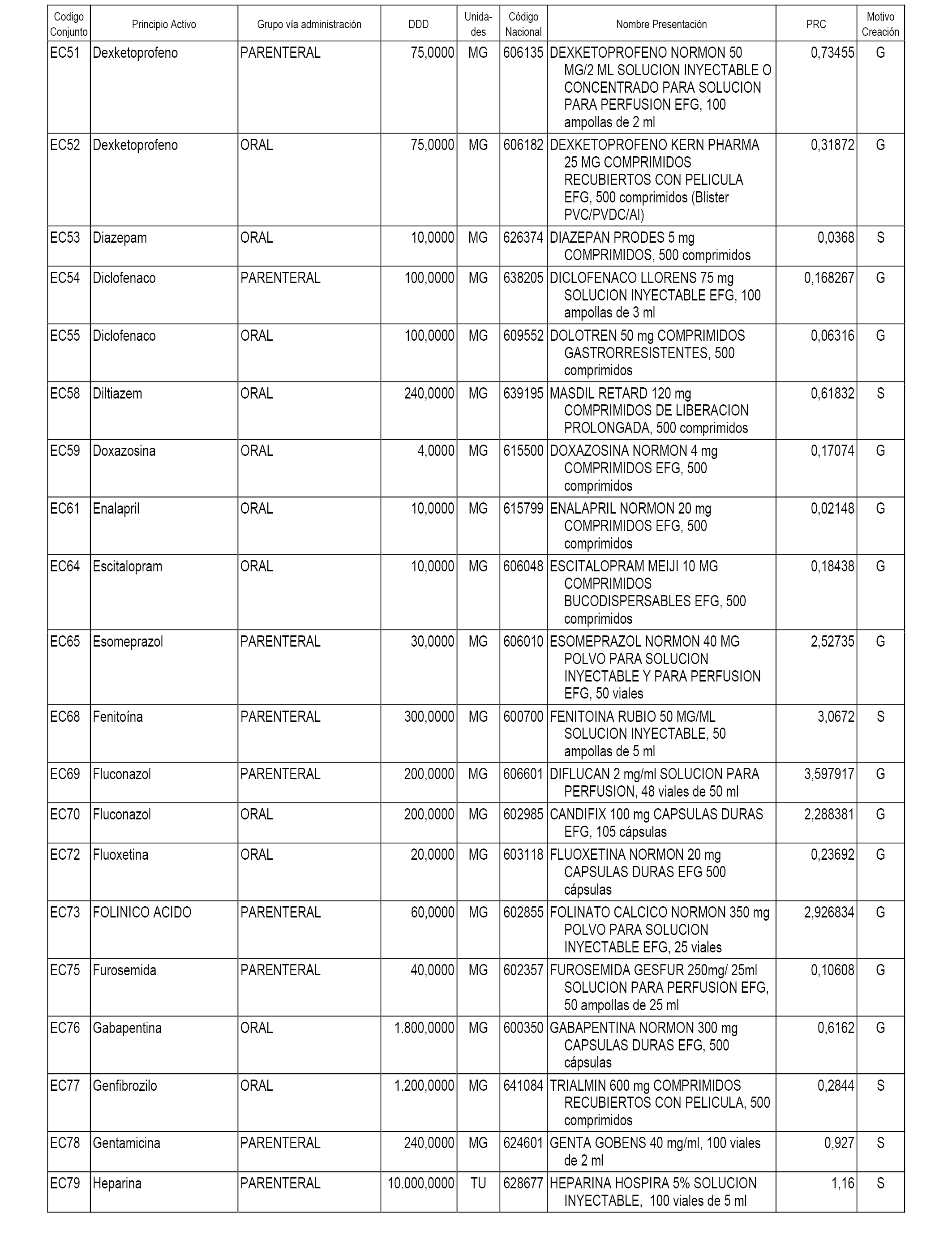
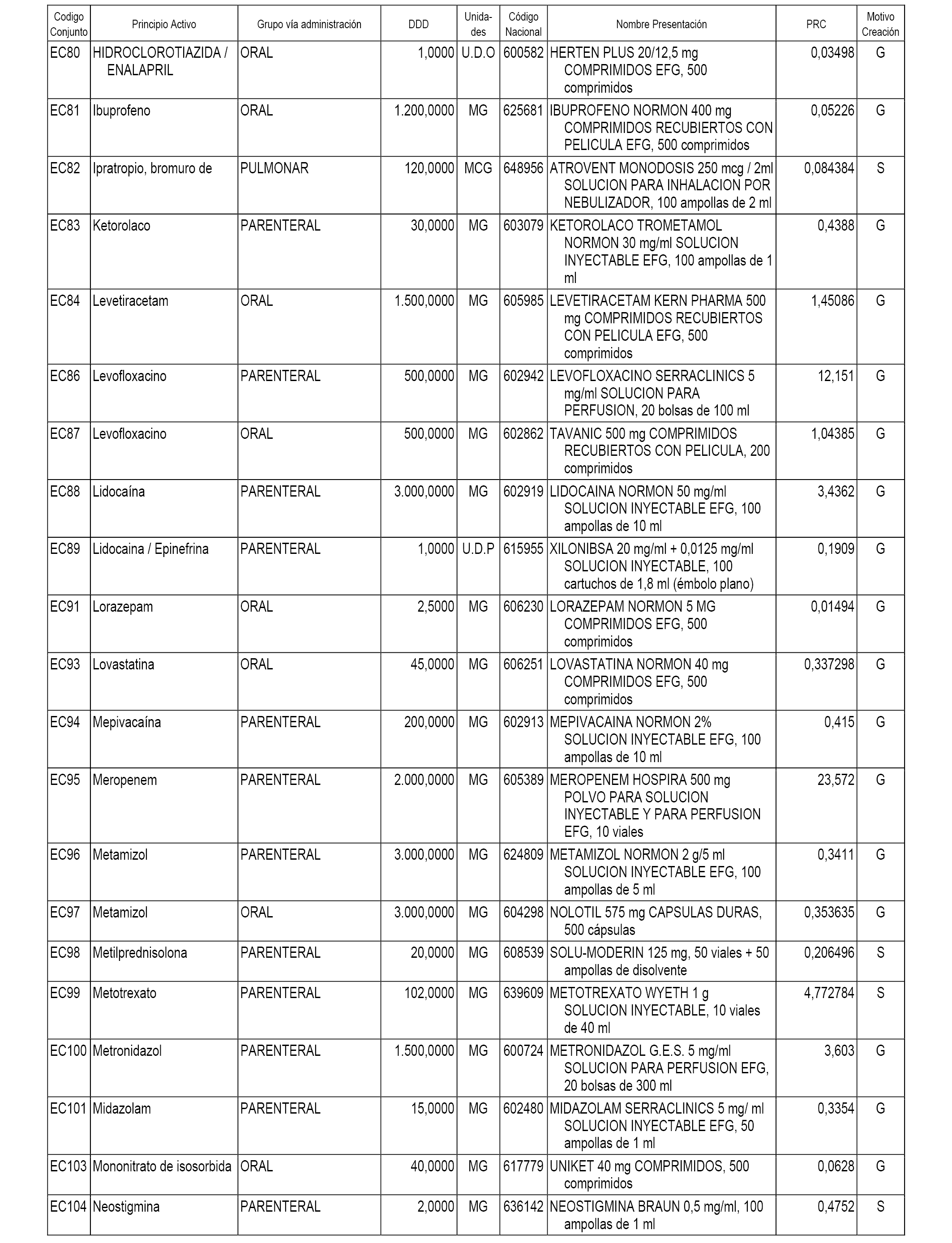
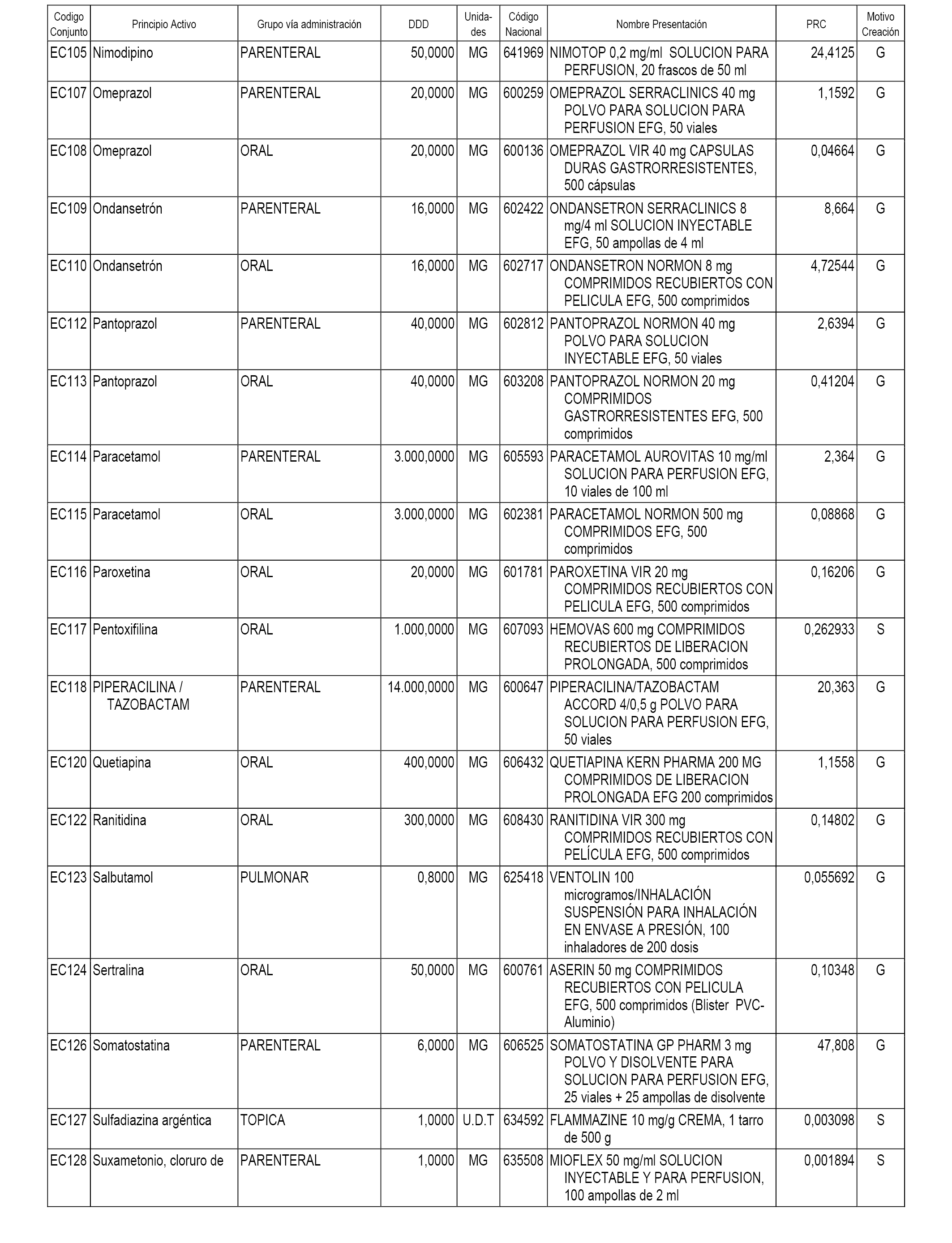
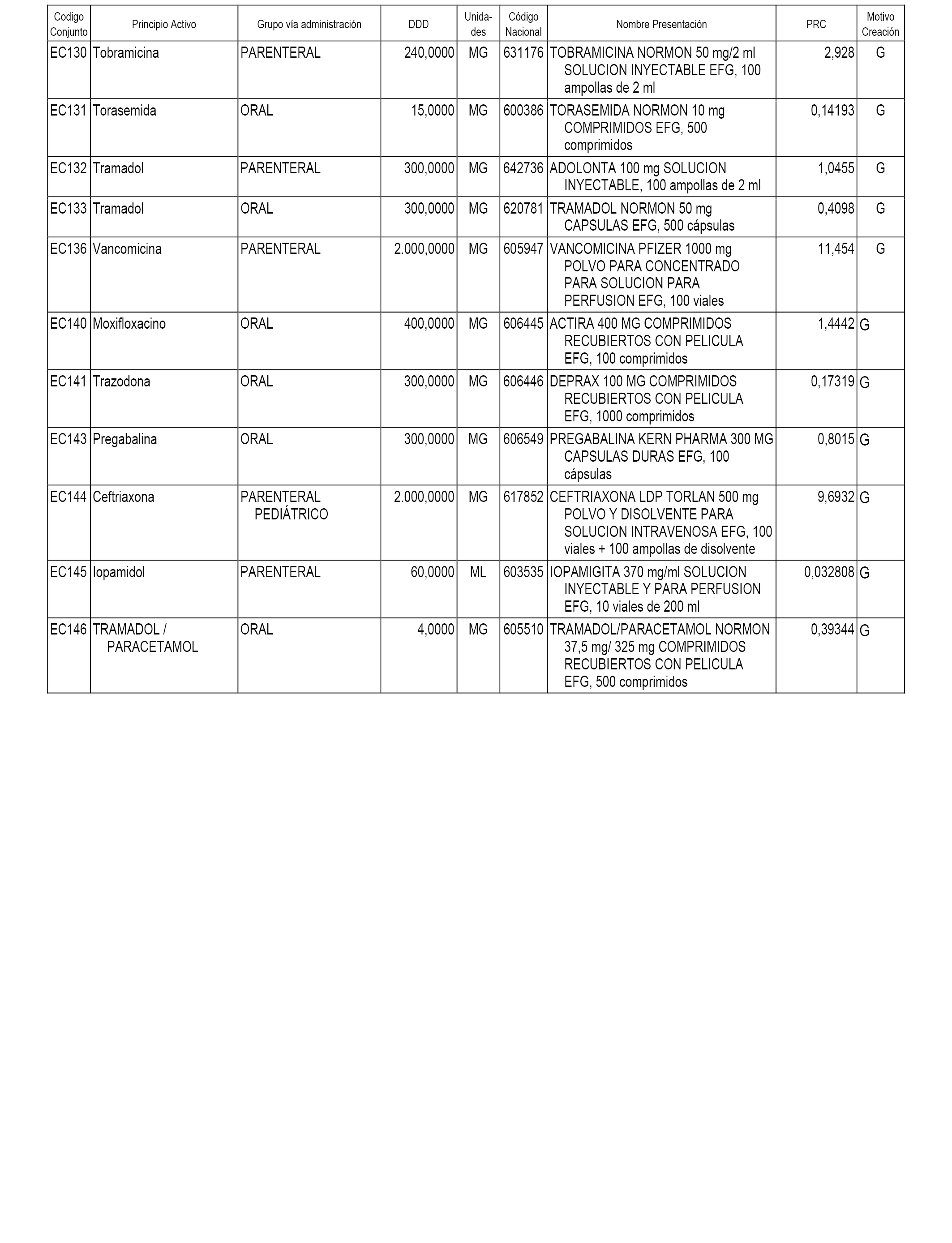
A efectos informativos, en el anexo 3 de esta orden se relacionan todos los conjuntos de referencia de medicamentos con indicación del precio de referencia de cada conjunto (PRC), identificando la presentación de medicamento cuyo coste/tratamiento/día (CTD) ha determinado el mismo.
También se incluye la información de las dosis diarias definidas (DDD) de cada conjunto de referencia de medicamentos utilizadas para el cálculo del coste/tratamiento/día (CTD) de las presentaciones de medicamentos integradas en el mismo conforme a lo establecido en el artículo 4 del Real Decreto 177/2014, de 21 de marzo.
Asimismo, se identifican los conjuntos de referencia de medicamentos formados por la existencia de un medicamento biosimilar y aquellos otros formados sin la existencia de un medicamento genérico o biosimilar conforme a lo establecido en el artículo 3 del Real Decreto 177/2014, de 21 de marzo.
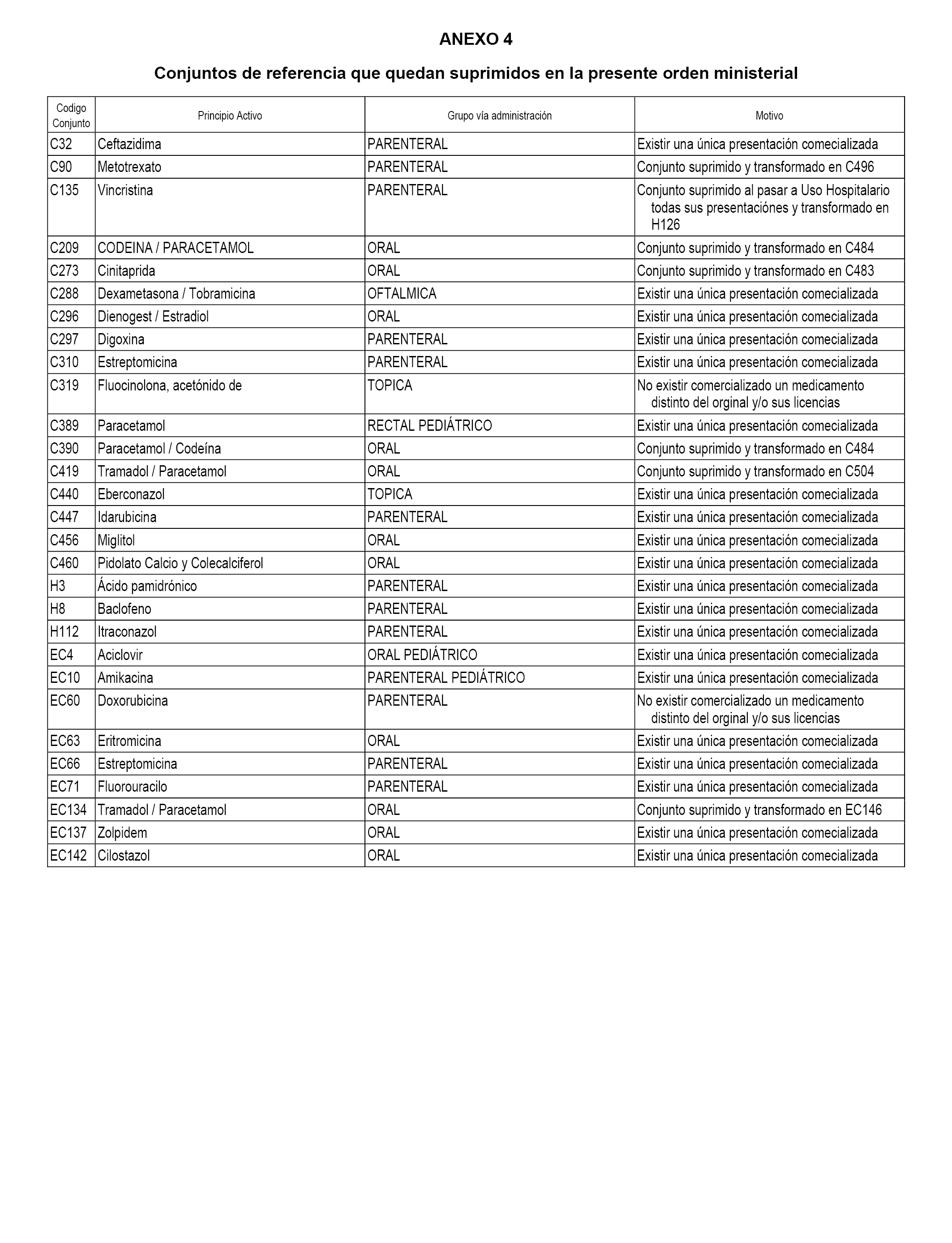
En aplicación de lo dispuesto en el artículo 5 del Real Decreto 177/2014, de 21 de marzo, se suprimen los conjuntos de referencia de medicamentos que han dejado de cumplir los requisitos exigidos para su establecimiento.
En el anexo 4 de esta orden se relacionan los conjuntos de referencia de medicamentos suprimidos, con indicación del motivo para su supresión.
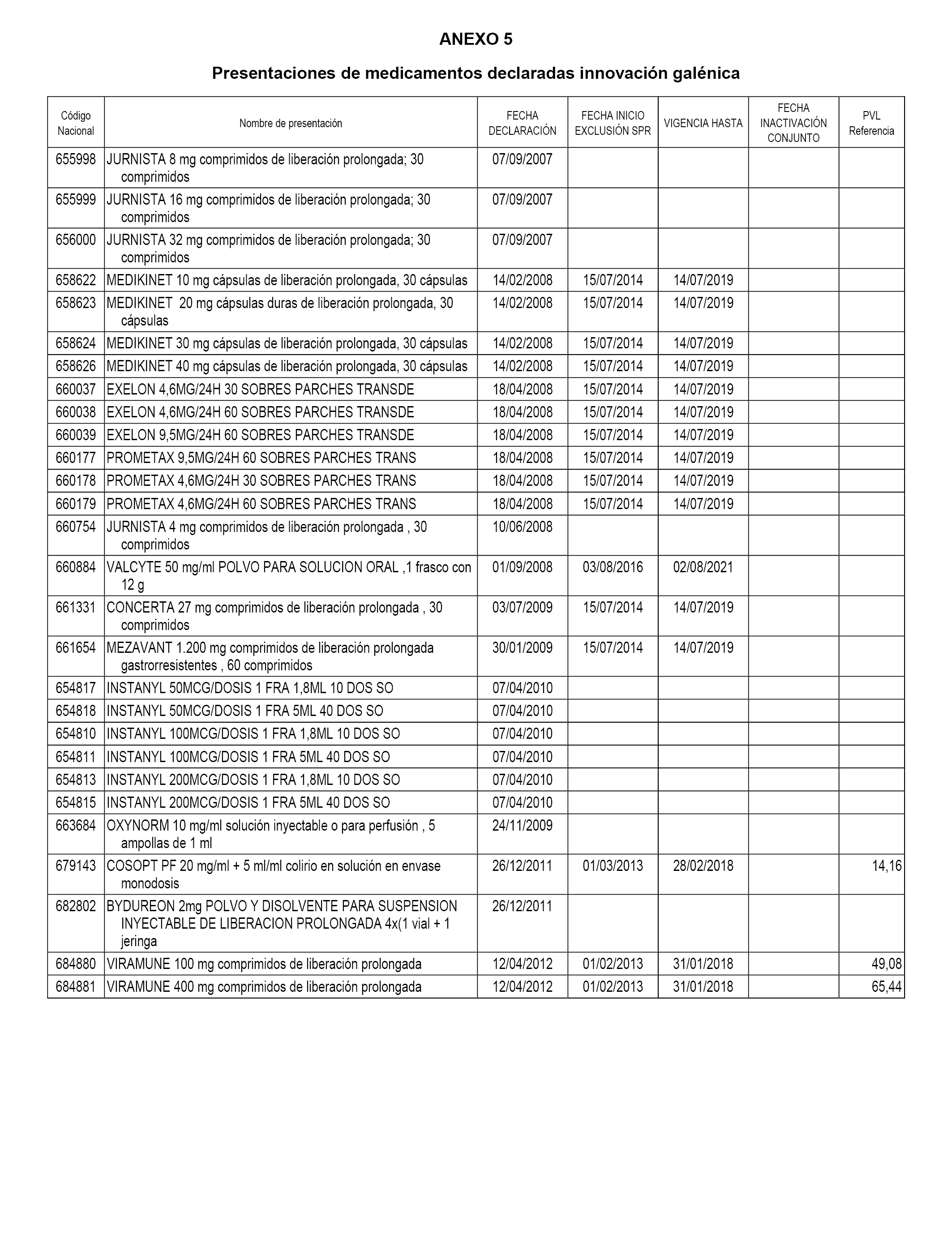
En el anexo 5 de esta orden se relacionan las presentaciones de medicamentos declaradas como innovaciones galénicas de interés terapéutico con anterioridad a la entrada en vigor del Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones, excluidas del sistema de precios de referencia, cuya declaración como innovación galénica expira con posterioridad a la fecha de efectos de esta orden.
En el citado anexo 5, conforme a lo establecido en el apartado 1 de la disposición adicional tercera del Real Decreto 177/2014, de 21 de marzo, se indica el plazo de exclusión del sistema de precios de referencia para cada una de las presentaciones de medicamentos, así como el precio industrial de referencia fijado para las presentaciones con el que se integrarán en el conjunto de referencia correspondiente durante el periodo de aplicación de la presente orden. Una vez transcurrido el plazo de exclusión, será de aplicación lo dispuesto en el apartado 2 de la citada disposición.
A efectos de lo dispuesto en la disposición adicional séptima del Real Decreto 177/2014, de 21 de marzo, en el anexo 6 de esta orden se relacionan las presentaciones de medicamentos y sus licencias para las que no se ha formado conjunto de referencia de conformidad con lo establecido en el artículo 3.2 del citado real decreto.
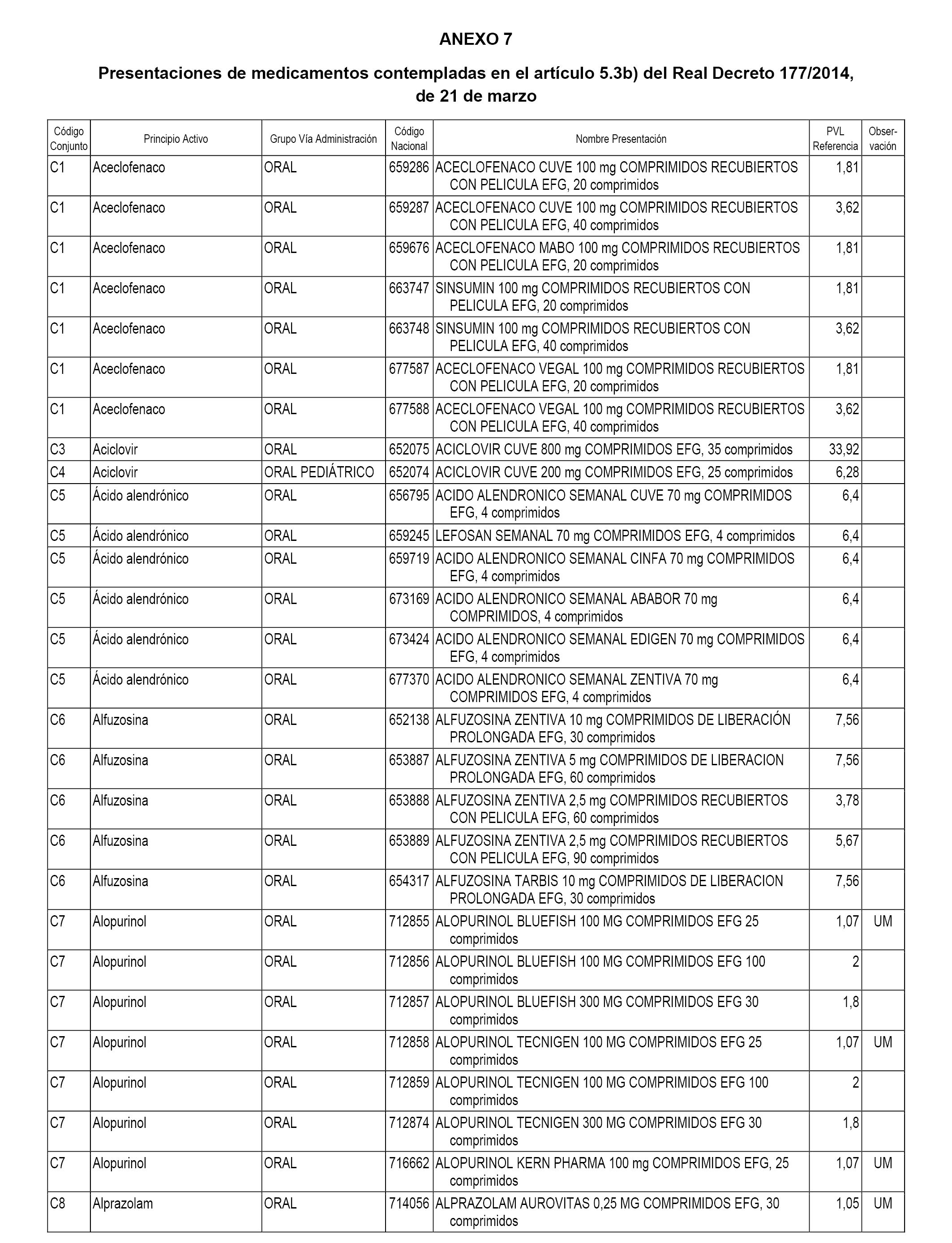
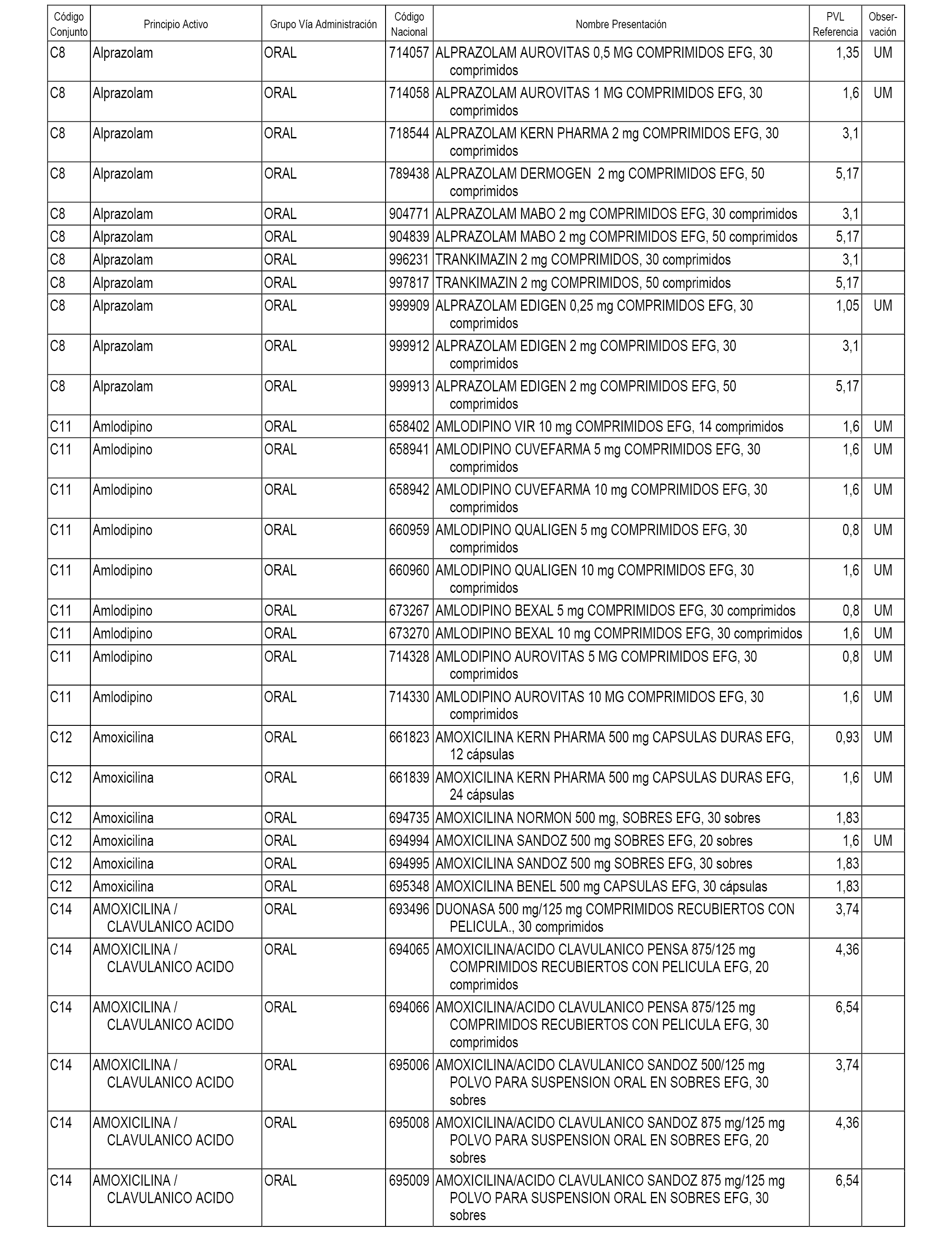
A efectos de aplicación de lo dispuesto en el artículo 5.3 del Real Decreto 177/2014, de 21 de marzo, se fija el precio de referencia a las presentaciones de medicamentos incluidas en la prestación farmacéutica del Sistema Nacional de Salud con anterioridad a la fecha de efectos de esta orden, pero cuya efectividad de inclusión en la prestación farmacéutica, conforme a lo dispuesto en la disposición adicional sexta del citado real decreto, no se había producido a fecha 6 de abril 2017, fecha de inicio del procedimiento de elaboración de esta orden.
En el anexo 7 de esta orden se relacionan las presentaciones de medicamentos con indicación del conjunto de referencia en el que se integrarán y el precio industrial de referencia para cada presentación.
Esta orden producirá efectos a partir del día siguiente al de su publicación en el «Boletín Oficial del Estado».
Contra la presente orden, que pone fin a la vía administrativa, se podrá interponer recurso contencioso-administrativo en el plazo de dos meses a partir del día siguiente al de su publicación ante la Sala de lo Contencioso-administrativo de la Audiencia Nacional, de conformidad con lo dispuesto en el artículo 11 de la Ley 29/1998, de 13 de julio, reguladora de la Jurisdicción Contencioso-Administrativa, o, potestativamente y con carácter previo, recurso administrativo de reposición en el plazo de un mes ante la Ministra de Sanidad, Servicios Sociales e Igualdad, de conformidad con lo establecido en los artículos 123 y 124 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
Madrid, 28 de noviembre de 2017.–La Ministra de Sanidad, Servicios Sociales e Igualdad, Dolors Montserrat Montserrat.























Axencia Estatal Boletín Oficial do Estado
Avda. de Manoteras, 54 - 28050 Madrid