El artículo 8 de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud, diferencia dentro de la cartera común de servicios del Sistema Nacional de Salud una cartera común suplementaria en la que se incluye la prestación ortoprotésica realizada mediante dispensación ambulatoria (ortoprótesis externas) y una cartera común básica de servicios asistenciales, de la que forman parte los implantes quirúrgicos.
El Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización, recoge en su anexo VI el contenido de la prestación ortoprotésica, tanto los implantes quirúrgicos como las ortoprótesis externas (prótesis externas, sillas de ruedas, ortesis y ortoprótesis especiales). Determina los grupos y subgrupos que la integran y en el caso de las ortoprótesis externas, también los códigos homologados que identifican las respectivas categorías de productos. Además especifica otros aspectos relativos al acceso a la prestación, al procedimiento de obtención y establece los requisitos generales aplicables a dicha prestación.
El artículo 8 ter.4 de la citada Ley 16/2003, de 28 de mayo, señala que para las prestaciones de la cartera común suplementaria (prestación ortoprotésica y prestación con productos dietéticos) se aprobará por orden ministerial, previo acuerdo del Consejo Interterritorial, a propuesta de la Comisión de prestaciones, aseguramiento y financiación, la actualización del catálogo de prestaciones, los importes máximos de financiación y los coeficientes de corrección a aplicar para determinar la facturación definitiva a los servicios autonómicos de salud por parte de los proveedores, que tendrá la consideración de precio final. La disposición adicional segunda del Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones, indicaba que en el plazo de 6 meses se aprobaría un real decreto para la regulación de la cartera suplementaria de prestación ortoprotésica del Sistema Nacional de Salud y para el establecimiento de sus importes máximos de financiación.
En consecuencia, el Real Decreto 1506/2012, de 2 de noviembre, por el que se regula la cartera común suplementaria de prestación ortoprotésica del Sistema Nacional de Salud y se fijan las bases para el establecimiento de los importes máximos de financiación en prestación ortoprotésica, supuso el primer paso para esta regulación, pero es necesario concretar y actualizar el catálogo común de prestación ortoprotésica, definiendo los tipos de productos que contiene y sus respectivos importes máximos de financiación.
Esta orden da una nueva redacción al anexo VI del Real Decreto 1030/2006, de 15 de septiembre, para actualizar en conjunto su contenido, incluyendo unas garantías de calidad, con el fin de facilitar una prestación más adecuada y ajustada a las necesidades de cada usuario.
En lo que se refiere al catálogo común de prestación ortoprotésica suplementaria, actualiza y concreta su contenido, determinando los tipos de productos de sillas de ruedas, ortesis y ortoprótesis especiales del anexo VI del Real Decreto 1030/2006, de 15 de septiembre, de modo que se desdoblan algunos de ellos, se incluyen algunos nuevos para cubrir necesidades sanitarias de los usuarios y se eliminan los obsoletos. Asimismo se actualiza la denominación y codificación de los grupos y subgrupos y con el fin de simplificar la codificación, los códigos homologados del citado anexo VI se han transformado en códigos alfanuméricos de 6 caracteres que identifican las categorías de productos.
En el catálogo común se recoge para cada tipo de producto su vida media, que es el tiempo medio de duración en condiciones normales de uso, con la finalidad de garantizar una calidad de los productos que se financien por el Sistema Nacional de Salud. No ha de confundirse con el periodo de renovación, que será establecido por los responsables de prestación ortoprotésica en cada ámbito para todos los productos, excepto para los que sean de uso temporal que no requieren renovación.
También figura en el catálogo común el importe máximo de financiación de cada tipo de producto. Para su cálculo se han tenido en cuenta, entre otros factores, las características de diseño de los productos, su funcionalidad y prestaciones, su consumo, los importes de los diferentes catálogos de las comunidades autónomas, Instituto Nacional de Gestión Sanitaria (INGESA) y mutualidades de funcionarios, así como la información disponible de otras fuentes. Estos importes máximos de financiación solo son de aplicación a los productos cuando son dispensados a usuarios del Sistema Nacional de Salud, por lo que los productos son de precio libre a los restantes efectos.
El catálogo común de implantes quirúrgicos ya se actualizó mediante la Orden SSI/1356/2015, de 2 de julio, por la que se modifican los anexos II, III y VI del Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización, y se regulan los estudios de monitorización de técnicas, tecnologías y procedimientos. Son productos cuyas características difieren sustancialmente de las ortoprótesis externas, lo que hace que la Oferta y la fijación de los importes máximos de financiación tengan unas peculiaridades que habrán de regularse específicamente en una norma posterior. Por otro lado, la mayor complejidad de la actualización del catálogo común de prótesis externas, en cuya elaboración se viene trabajando en los últimos años, ha dificultado tener finalizada esta parte del catálogo. Por todo ello, no se recogen en esta norma los apartados 6 y 7 del anexo VI del Real Decreto 1030/2006, de 15 de septiembre, correspondientes a los catálogos comunes de implantes quirúrgicos y prótesis externas, respectivamente.
Para adaptarse a los avances científicos, el catálogo común de prestación ortoprotésica se actualizará de acuerdo con lo previsto en la Orden SCO/3422/2007, de 21 de noviembre, por la que se desarrolla el procedimiento de actualización de la cartera de servicios comunes del Sistema Nacional de Salud, pudiendo formular propuestas de inclusión de nuevos tipos de productos en la cartera común de servicios del Sistema Nacional de Salud terceros interesados, como es el caso de las asociaciones de usuarios, de las sociedades científicas o de las empresas. En esta norma se modifica la citada Orden SCO/3422/2007, de 21 de noviembre, para que las mutualidades de funcionarios puedan realizar propuestas de actualización de la cartera común de servicios en las mismas condiciones que las administraciones sanitarias de las comunidades autónomas.
Por otra parte, también se establece en esta orden el procedimiento para la inclusión, alteración de las condiciones de uso y exclusión de los productos ortoprotésicos en la Oferta, en desarrollo de lo previsto en el artículo 4 del Real Decreto 1506/2012, de 2 de noviembre. Asimismo, con el fin de mantener permanentemente actualizada la información de los productos en la Oferta, se contempla la necesidad de su renovación.
Ante el elevado número de productos susceptibles de solicitar su inclusión en la Oferta, se ha considerado necesario hacer coexistir durante un periodo el procedimiento de inclusión en la Oferta establecido en la presente orden con la comunicación previa de información por parte de las empresas al sistema informatizado para la recepción de comunicaciones de productos ortoprotésicos al Sistema Nacional de Salud (SIRPO), regulado mediante la Orden SSI/566/2014, de 8 de abril, por la que se crea el sistema informatizado para la recepción de comunicaciones de productos ortoprotésicos al Sistema Nacional de Salud. De este modo se facilitará al Ministerio de Sanidad, Consumo y Bienestar Social el análisis de la información de cada producto necesaria para la resolución de las solicitudes de Oferta.
En esta norma se determinan los coeficientes de corrección que permiten calcular los precios de Oferta a partir de los precios de empresa. El precio de Oferta propuesto por la empresa, una vez aceptado por el Ministerio de Sanidad, Consumo y Bienestar Social, no podrá ser modificado por esta sin previamente presentar una alteración de la Oferta. El precio de Oferta de un producto no superará el importe máximo de financiación fijado para el tipo de producto en el que se encuadre. No obstante, se contempla la posibilidad de que las empresas puedan comunicar a la Oferta aquellos productos que lo superen, de modo que los usuarios podrán adquirirlos con cargo al Sistema Nacional de Salud, abonando la diferencia con dicho importe máximo de financiación, si así lo prevé la correspondiente normativa de la comunidad autónoma, INGESA, Instituto Social de la Marina o mutualidad de funcionarios.
Hay que tener en cuenta que tanto la fijación de los importes máximos de financiación como de los coeficientes de corrección no son un obstáculo que impida a las empresas y establecimientos dispensadores la posibilidad de ofrecer descuentos u otras estrategias competitivas que repercutan positivamente en la eficiencia del gasto público. Tampoco impedirá a los responsables de prestación ortoprotésica adquirir un tipo de producto por concurso u otro procedimiento similar de selección transparente y objetivo, al que podrán concurrir tanto los productos incluidos en la Oferta como los que no lo estén siempre que ofrezcan las adecuadas garantías de calidad y abastecimiento.
Además, con el fin de dar cabida a la participación del sector de la discapacidad en el Comité asesor para la prestación ortoprotésica, se modifica la Orden SPI/1117/2011, de 26 de abril, por la que se regula el Comité asesor para la prestación ortoprotésica, incluyendo un experto adicional nombrado por la persona titular del Ministerio de Sanidad, Consumo y Bienestar Social, a propuesta del Consejo Nacional de la Discapacidad. Asimismo se incluye un representante del Ministerio de Hacienda y otro del Ministerio de Economía y Empresa, dado que la actualización de los importes máximos de financiación es una nueva función a desarrollar por el Comité.
Esta orden se dicta en uso de las atribuciones conferidas por la disposición final segunda del Real Decreto-ley 16/2012, de 20 de abril, y por la disposición final segunda del Real Decreto 1030/2006, de 15 de septiembre, y en desarrollo del Real Decreto 1506/2012, de 2 de noviembre.
Por último, cabe señalar que esta orden se ajusta a los principios de buena regulación contenidos en el artículo 129 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas, principios de necesidad, eficacia, proporcionalidad, seguridad jurídica, transparencia y eficiencia, en tanto que la misma persigue un interés general al pretender facilitar a los pacientes el acceso a los tratamientos que les son necesarios, no existe ninguna alternativa regulatoria menos restrictiva de derechos, resulta coherente con el ordenamiento jurídico tanto nacional como europeo. Del mismo modo, durante el procedimiento de elaboración de la norma, ha sido informada por el Consejo Interterritorial del Sistema Nacional de Salud, se ha consultado a las comunidades autónomas, INGESA, las Ciudades de Ceuta y Melilla y las mutualidades de funcionarios y sectores afectados y quedan justificados en el preámbulo los objetivos que persigue esta orden.
En su virtud, con la aprobación previa de la Ministra de Política Territorial y Función Pública, de acuerdo con el Consejo de Estado, dispongo:
1. El objeto de esta norma es regular el contenido, los conceptos, el acceso, el procedimiento de obtención y los requisitos generales de la prestación ortoprotésica recogida en el anexo VI del Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización.
2. En concreto, en lo referente a la prestación ortoprotésica suplementaria:
a) Se actualiza el catálogo común de sillas de ruedas, ortesis y ortoprótesis especiales.
b) Se fijan los importes máximos de financiación de cada tipo de producto cuando se dispensan a usuarios del Sistema Nacional de Salud.
c) Se establecen los coeficientes de corrección que permiten calcular los precios de Oferta para determinar el precio final de facturación definitiva de los productos ortoprotésicos a los responsables de prestación ortoprotésica, tanto cuando se abonan directamente a los establecimientos dispensadores, como cuando se reintegra el correspondiente gasto a los usuarios.
d) Se regula el procedimiento de inclusión, alteración de las condiciones de uso y exclusión de la Oferta de productos ortoprotésicos del Sistema Nacional de Salud para las ortoprótesis externas.
Los dos párrafos introductorios y los apartados 1, 2, 3, 4, 5, 8, 9 y 10 del anexo VI del Real Decreto 1030/2006, de 15 de septiembre, se sustituyen por el contenido del anexo I de esta orden.
1. El importe máximo de financiación (en adelante, IMF), que es la cuantía máxima fijada para cada tipo de producto de ortoprótesis externas a efectos de su financiación por el Sistema Nacional de Salud, de acuerdo con lo previsto en el Real Decreto 1506/2012, de 2 de noviembre, por el que se regula la cartera común suplementaria de prestación ortoprotésica del Sistema Nacional de Salud y se fijan las bases para el establecimiento de los importes máximos de financiación en prestación ortoprotésica, se refleja en el catálogo común.
2. Cuando en la descripción de un tipo de producto en el catálogo común figura que se han de prescribir además determinados componentes adicionales, el prescriptor elegirá los más adecuados para cada usuario. El IMF de la parte principal del producto engloba la elaboración y los costes de adaptación del conjunto de la ortoprótesis externa, incluida la incorporación de los diferentes componentes adicionales que figuran en la correspondiente descripción. El IMF del producto final completo se calculará sumando al IMF del tipo de la parte principal del producto el de los componentes adicionales prescritos.
3. La actualización de los IMF se regirá por lo previsto en el artículo 6 del Real Decreto 1506/2012, de 2 de noviembre. Las empresas que consideren que existen motivos justificados para modificar el IMF de un tipo de producto podrán solicitarlo de forma argumentada a la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, quien dará traslado al Comité asesor para la prestación ortoprotésica para su valoración.
1. La Oferta de productos ortoprotésicos del Sistema Nacional de Salud (en adelante Oferta), en el ámbito de las ortoprótesis externas, recogerá los productos ortoprotésicos no elaborados a medida que se clasifiquen en los tipos de productos del catálogo común.
2. Sólo serán financiables por el Sistema Nacional de Salud los productos ortoprotésicos incluidos en la Oferta, sin perjuicio de lo previsto en el artículo 5.5 del Real Decreto 1506/2012, de 2 de noviembre. Además, en el caso de productos elaborados a medida, se financiarán todos aquellos productos que se clasifiquen en uno de los tipos de productos del catálogo común y no superen el respectivo IMF.
3. La información de los productos incluidos en la Oferta se recogerá en el nomenclátor de prestación ortoprotésica. La Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia lo pondrá a disposición de los responsables de prestación ortoprotésica y de aquellos otros agentes directamente implicados en la gestión de la prestación ortoprotésica, con el contenido y la periodicidad que determine el Comité asesor para la prestación ortoprotésica.
4. La Oferta tendrá carácter permanente, por lo que las empresas podrán solicitar en cualquier momento la inclusión en la Oferta, tanto de productos pertenecientes a los tipos de productos del catálogo común que ya tengan comercializados, como de los nuevos que vayan poniendo en el mercado.
5. Todas las notificaciones relativas a la Oferta que la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia deba efectuar a las empresas, así como las actuaciones concernientes al procedimiento de inclusión, alteración y exclusión de la Oferta, se realizarán a través de la aplicación de Oferta de productos ortoprotésicos del Sistema Nacional de Salud (OFEPO), conforme a lo previsto en los artículos 14.2 y 16.4 de la Ley 39/2015, de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas.
6. La solicitud de inclusión de un producto en la Oferta supone que la empresa acepta todas las condiciones establecidas en esta orden y se compromete a mantener actualizada la información del producto en OFEPO.
1. Las empresas que vayan a solicitar la inclusión de sus productos de ortoprótesis externas en la Oferta deberán declarar a través de OFEPO que cumplen los siguientes requisitos:
a) Disponer de la estructura y medios adecuados para garantizar la calidad de los productos, según las actividades y productos de que se trate, así como de un responsable técnico, con la titulación adecuada en función de los productos que tenga a su cargo, quien ejercerá la supervisión directa de tales actividades.
b) Contar con una estructura organizativa capaz de garantizar un adecuado servicio técnico de sus productos (reparaciones y repuestos) durante la vida media útil del producto.
c) Disponer de un procedimiento de notificación en relación al sistema de vigilancia y alertas sanitarias.
d) Cumplir con las prescripciones establecidas en el Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios, incluyendo en los casos en que les sea de aplicación:
1.º Disponer de las licencias de funcionamiento otorgadas por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) o de las autorizaciones de actividad de las comunidades autónomas o las Ciudades de Ceuta y Melilla, según corresponda en función de la actividad que desempeñen.
2.º Haber efectuado las comunicaciones al Registro de responsables de la AEMPS o a los registros de empresas distribuidoras de las comunidades autónomas o las Ciudades de Ceuta y Melilla según corresponda.
2. Los productos que las empresas oferten deberán:
a) Reunir todos los requisitos establecidos en el artículo 7 del Real Decreto 1506/2012, de 2 de noviembre, especialmente lo referente al marcado CE y demás prescripciones establecidas en el Real Decreto 1591/2009, de 16 octubre.
b) Tener una calidad que garantice su duración a los usuarios en condiciones normales de uso durante la vida media establecida en el catálogo común para el tipo de producto en el que se encuadren.
1. La empresa que desee que uno de sus productos de ortoprótesis externas sea financiado por el Sistema Nacional de Salud previamente deberá darse de alta en la aplicación OFEPO. Para ello cumplimentará los datos relativos a la empresa recogidos en el anexo II.
2. Una vez de alta, solicitará la inclusión del producto en la Oferta a través de la citada aplicación, cumplimentando la información del producto que figura en el anexo II y adjuntado la documentación que se especifica en el citado anexo. La empresa deberá proponer para cada producto el tipo de producto del catálogo común en el que se encuadraría, así como su precio de Oferta, para lo cual incluirá en la aplicación OFEPO el precio de venta ofertado por la empresa sin impuestos (en adelante, precio de empresa), a partir del cual se calculará automáticamente el precio de Oferta de acuerdo con lo establecido en el artículo 12.
3. Cuando el precio de Oferta de un producto supere el IMF del tipo de producto en el que se encuadre, OFEPO le indicará a la empresa que dispone de un plazo de 15 días para adaptar dicho precio al IMF o bien optar por comunicar el producto a la Oferta con el fin de que los responsables de prestación ortoprotésica dispongan de información que les permita hacer efectivo lo previsto en el artículo 5.5 del Real Decreto 1506/2012, de 2 de noviembre. En caso de que la empresa no adapte el precio de Oferta del producto ni opte por ser comunicado en dicho plazo, se entenderá que renuncia a su solicitud.
4. La Subdirección General de Cartera de Servicios del Sistema Nacional de Salud y Fondos de Compensación revisará la documentación recibida y teniendo en cuenta las características del producto, valorará si es susceptible o no de financiación, aplicando los criterios de inclusión recogidos en el artículo 7 del Real Decreto 1506/2012, de 2 de noviembre. Cuando detecte deficiencias o discrepancias en la documentación facilitada por la empresa solicitante, lo notificará a la misma, que deberá subsanarlas en un máximo de tres meses, de conformidad con el artículo 22.1.a) de la Ley 39/2015, de 1 de octubre. Este periodo no será computable a efectos del plazo de resolución que se establece en el apartado siguiente.
5. En el plazo máximo de seis meses desde la presentación de la solicitud, el titular de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia notificará al interesado la resolución motivada que corresponda, con expresión de los recursos que procedan. Esta resolución no pondrá fin a la vía administrativa, siendo recurrible en alzada, en el plazo de un mes, conforme a lo previsto en los artículos 121 y 122 de la Ley 39/2015, de 1 de octubre.
6. Cuando se determine la inclusión del producto en la Oferta, en dicha resolución se le notificará al solicitante el tipo de producto asignado, el precio de empresa y el correspondiente precio de Oferta aceptado, así como el código identificativo cuyas características se indican en el artículo 11.
7. Si trascurrido el plazo señalado en el apartado 5 no hubiera recaído resolución expresa, se podrá entender estimada la solicitud, en los términos previstos en el artículo 24 de la Ley 39/2015, de 1 de octubre, notificándose a través de OFEPO a la empresa el código identificativo asignado al producto.
8. La información de cada producto que se incluya en la Oferta se incorporará al nomenclátor en la fecha de inicio de comercialización en España comunicada por la empresa. Si el producto ya estuviera comercializado cuando se le notifique a la empresa la correspondiente resolución, la información se incorporará en el nomenclátor en la fecha de dicha notificación. En caso de que existan causas que le impidan a la empresa poner en el mercado el producto en la fecha prevista, comunicará a través de OFEPO la nueva fecha de inicio de comercialización y se hará efectiva su inclusión en el nomenclátor en esa fecha.
1. Las empresas deberán mantener actualizada en la Oferta toda la información tanto de la propia empresa como la de sus productos. Para ello, los cambios en las condiciones de uso de un producto serán objeto de solicitud de la correspondiente alteración de la Oferta antes de llevar a cabo estos cambios. A estos efectos se consideran cambios en las condiciones de uso la modificación de cualquiera de los datos de un producto incluido en la Oferta recogidos en el anexo II, excepto la descripción del producto, las observaciones, el fabricante, el país en el que está establecido el fabricante, la fecha de comercialización y los documentos en formato electrónico adjuntos, que únicamente deberán ser objeto de una comunicación a la Oferta a través de OFEPO.
2. La empresa responsable de la comercialización del producto deberá presentar la solicitud de la alteración de su Oferta al Ministerio de Sanidad, Consumo y Bienestar Social, a través de la aplicación OFEPO, cumplimentando la información que se establece en el anexo III.
3. La Subdirección General de Cartera de Servicios del Sistema Nacional de Salud y Fondos de Compensación, a la vista de la documentación recibida, comprobará si las nuevas características del producto continúan ateniéndose a la normativa vigente reguladora de la prestación ortoprotésica y el precio de Oferta se adecúa al IMF del tipo del producto en el que se clasifica, siguiendo los mismos trámites previstos en el artículo 6.
4. Cuando la alteración de la Oferta esté motivada por una modificación sustancial de las características del producto que implique un cambio de tipo, OFEPO asignará un nuevo código identificativo al producto afectado. El precio de Oferta del producto con el nuevo código se valorará en función del IMF del nuevo tipo que le corresponda, de acuerdo con lo indicado en el artículo 6.3. En la resolución de aceptación de la alteración se notificará al solicitante el nuevo código identificativo, el tipo de producto asignado, el precio de empresa y el correspondiente precio de Oferta aceptado. Este precio de Oferta se aplicará desde el momento en que se produzca la comercialización del producto con el nuevo código, y simultáneamente se producirá la baja en la Oferta del código original, de forma que a partir de esa fecha la empresa no podrá comercializar el producto antiguo con precinto.
5. Si la alteración se refiere únicamente a un cambio en el precio de Oferta sin implicar otras modificaciones en el producto, el nuevo precio de Oferta, que deberá ser siempre igual o inferior al IMF, entrará en vigor a los dos meses de la notificación a la empresa de la aceptación de dicha alteración. Una vez aceptado el nuevo precio de Oferta, la empresa no podrá solicitar otra modificación del precio hasta que haya transcurrido, al menos, un plazo de seis meses desde la fecha de la notificación antes citada, salvo en el caso de las revisiones que determine el Ministerio de Sanidad, Consumo y Bienestar Social en base a lo establecido en el artículo 6 del Real Decreto 1506/2012, de 2 de noviembre, o porque el producto sufra un cambio de tipo.
6. Si se revisa a la baja el IMF de un tipo, OFEPO comunicará a las empresas que tengan productos incluidos en la Oferta clasificados en dicho tipo con precio de Oferta superior al nuevo IMF, que deberán proceder a adaptar su precio al nuevo IMF para continuar incluidos en la Oferta, u optar a ser comunicados, según lo previsto en el artículo 6.3.
7. Cuando un producto incluido en la Oferta pase a ser comercializado por otra empresa que desea mantener el producto en la Oferta, la nueva empresa hará la correspondiente solicitud por cambio de titular a través de la aplicación OFEPO. La Subdirección General de Cartera de Servicios del Sistema Nacional de Salud y Fondos de Compensación lo notificará a la empresa que anteriormente comercializaba el producto para que en el plazo de 15 días comunique si tiene alguna objeción objetiva que justifique que no procede el cambio. En caso de no recibir ninguna objeción en dicho plazo, se aceptará el cambio de titular. Si además la nueva empresa tiene que comunicar otros cambios en las condiciones de uso del producto deberá presentar la oportuna alteración de la Oferta, de acuerdo con lo contemplado en este artículo.
8. Todos los cambios que se produzcan en la información de los productos incluidos en la Oferta realizados de acuerdo con lo establecido en este artículo, se reflejarán en el nomenclátor en la fecha prevista de efecto de la alteración comunicada por la empresa según se recoge en el anexo III.
1. Serán excluidos de la Oferta, mediante la oportuna resolución motivada de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, los productos en los que concurran alguna de las siguientes circunstancias:
a) Cuando por aplicación de la Orden SCO/3422/2007, de 21 de noviembre, por la que se desarrolla el procedimiento de actualización de la cartera de servicios comunes del Sistema Nacional de Salud, se excluya del catálogo común el tipo de producto en el que se clasifican.
b) Cuando se revise a la baja el valor del IMF de un tipo, según lo previsto en el artículo 7.6, y la empresa no adapte el precio de Oferta del producto al nuevo IMF ni opte por ser comunicado.
c) Si la Subdirección General de Cartera de Servicios del Sistema Nacional de Salud y Fondos de Compensación detecta que alguno de los productos incluidos en la Oferta deja de reunir las condiciones para ser clasificado en alguno de los tipos del catálogo común o los requisitos establecidos en la legislación vigente.
2. A partir de la fecha de efecto de la exclusión de la Oferta notificada a la empresa, no podrá seguir comercializando el producto con el correspondiente precinto identificativo y no será financiado por los responsables de prestación ortoprotésica.
1. Con el fin de garantizar que la información del nomenclátor está actualizada, las empresas renovarán la Oferta de sus productos cada tres años, confirmando la información a través de OFEPO. Si fuera necesario modificar algún dato, la empresa deberá realizar la consiguiente solicitud de alteración de la Oferta, de acuerdo con lo previsto en el artículo 7.
2. Para facilitar la renovación, el primer día del trimestre natural en el que se cumplan los tres años de la inclusión inicial del producto en la Oferta, o de la última renovación, la aplicación OFEPO lo comunicará automáticamente a la respectiva empresa, dándole un plazo de dos meses para que proceda a confirmar la información del producto o a realizar la oportuna alteración de la Oferta.
3. En caso de no llevar a cabo la renovación en el plazo mencionado en el apartado anterior, se procederá a notificar a la empresa que a partir de esa fecha se da de baja el producto en la Oferta.
1. Las empresas habrán de tener comercializados los productos de alta en la Oferta, para que se pueda facilitar adecuadamente la prestación ortoprotésica a los usuarios del Sistema Nacional de Salud. Si en la solicitud de inclusión en la Oferta han indicado que solo los van a comercializar en un determinado ámbito, esta obligación de comercialización se circunscribe al correspondiente ámbito.
2. Si fuera a producirse un cese definitivo en la comercialización de un producto o la empresa responsable no desea que continúe en la Oferta por cualquier motivo, deberá comunicar la baja a OFEPO, con una antelación mínima de un mes, facilitando la información que se recoge en el anexo IV.
3. Si una empresa va a cesar su actividad o no desea que ninguno de sus productos siga siendo financiado, se dará de baja en OFEPO, y automáticamente todos sus productos también se darán de baja.
4. Cuando se produzca la baja de un producto en la Oferta, la empresa no podrá comercializarlo con precinto a partir de la fecha de efecto de la baja, aunque los establecimientos dispensadores podrán continuar proporcionando el producto a los usuarios del Sistema Nacional de Salud durante un máximo de doce meses desde el efecto de la baja.
5. En caso de que una empresa no pudiera tener disponible en el mercado de forma transitoria un producto ofertado, comunicará a la Oferta la suspensión temporal de comercialización. Para ello, la empresa facilitará la información que se recoge en el anexo IV a través de OFEPO, un mes antes de que ocurra este supuesto. Si se trata de una circunstancia no previsible, lo comunicará a la mayor brevedad. Cuando finalice el periodo previsto de duración de la suspensión temporal, el producto pasará nuevamente a figurar de alta en la Oferta. Si se hubieran producido modificaciones en los datos del producto, la empresa procederá a realizar la correspondiente alteración de la Oferta. Si el producto fuera a ser comercializado por otra empresa, se actuará de acuerdo con lo previsto en el artículo 7.7.
6. Si antes de la fecha prevista de finalización de la suspensión temporal comunicada, la empresa estuviera en condiciones de comercializar de nuevo el producto, modificará esa fecha en OFEPO para que a partir de ese momento el producto vuelva a ser dado de alta. Por el contrario, si precisa prorrogar dicha situación, indicará la nueva fecha de duración de la suspensión temporal prevista. Si la empresa considera que ya no va a volver a comercializar el producto, procederá a darlo de baja, según lo contemplado en el apartado 2.
1. Cada uno de los productos ortoprotésicos incluidos en la Oferta se identificará de forma inequívoca con un código que a tal efecto le será asignado por la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia en la resolución mediante la que se acepte su inclusión en la Oferta.
2. El código será alfanumérico y estará compuesto por ocho caracteres tal y como se especifica a continuación:
a) Una letra que indica el apartado de la prestación al que pertenece el producto:
S = Sillas de ruedas; P = Prótesis externas; O = Ortesis; E = Ortoprótesis especiales.
b) Seis números correlativos dentro de cada uno de los apartados.
c) Un dígito de control.
3. Los productos incluidos en la Oferta irán dotados de un precinto identificativo, con los datos y características establecidas en el apartado 1 del anexo V. El uso de dicho precinto está reservado a los indicados productos, por lo que queda prohibida su utilización en cualquier producto al que no se le haya notificado su inclusión en la Oferta. En ningún caso las empresas ofertantes de los productos podrán poner en circulación en el mercado precintos identificativos no adheridos a los correspondientes envases.
4. Las empresas disponen de un plazo máximo de dos meses desde que reciban la notificación de aceptación de inclusión de un producto en la Oferta, para comercializarlo dotado del correspondiente precinto identificativo.
5. A efectos de la gestión y el control de la prestación, así como de la facturación de los productos financiables por el Sistema Nacional de Salud, el establecimiento que dispense un producto ortoprotésico incluido en la Oferta adherirá el precinto en la factura o en el documento que a tal efecto establezca la normativa del correspondiente responsable de prestación ortoprotésica, como justificante de la dispensación, y consignará el número de serie o de lote del producto. Si se trata de productos a medida, la persona responsable de la dispensación del producto indicará su nombre y firmará el citado documento.
6. En todo caso, los productos incluidos en la Oferta o comunicados a la misma deberán cumplir todos los requisitos de etiquetado que les resulten de aplicación por la normativa de productos sanitarios.
1. De acuerdo con lo indicado en el artículo 2.8 del Real Decreto 1506/2012, de 2 de noviembre, para determinar los precios de Oferta de las ortoprótesis externas se han de considerar los costes de adaptación o elaboración individualizada de los productos, por lo que exclusivamente a estos efectos:
a) La adaptación de un producto puede tener diferente grado de complejidad:
1.º Ajuste básico: Actuación no compleja que realiza el establecimiento sanitario dispensador sobre un producto ortoprotésico elaborado según métodos de fabricación continua o en serie para proporcionarlo al usuario.
2.º Adaptación individualizada: Actuación que realiza el establecimiento sanitario dispensador y adaptador que implica llevar a cabo modificaciones de diferente grado de complejidad en un producto ortoprotésico para adecuarlo a indicaciones concretas del prescriptor o a las características específicas del usuario al que va destinado. En función del tiempo y de las actuaciones que requiere la adaptación individualizada del producto a los usuarios, se subdivide en complejidad baja, complejidad media y complejidad alta. Cuando se trata de componentes, accesorios y recambios, que son elementos constituyentes de una ortoprótesis externa o que han de ser incorporados a la misma para adecuarla a las necesidades de un determinado usuario, la adaptación de los mismos a la ortoprótesis tiene un grado variable de complejidad, por lo que se diferencian en complejidad baja, complejidad media y complejidad alta.
b) Elaboración individualizada: Actuación para fabricar un producto ortoprotésico a medida específicamente según la prescripción escrita de un facultativo especialista, en la que este haga constar bajo su responsabilidad las características específicas de diseño, y que se destine únicamente a un paciente determinado.
2. Dado que los productos a medida no serán ofertados por el elaborador, se considerará que su precio de Oferta es el que refleje el establecimiento dispensador en la factura, que incluirá los correspondientes márgenes, los costes de su elaboración individualizada y los impuestos, y no podrá superar el IMF del tipo de producto en el que se encuadre.
3. Para los productos no elaborados a medida el precio de Oferta se calculará aplicando al precio de empresa el correspondiente coeficiente de corrección que se hace efectivo mediante la siguiente fórmula que considera el precio de empresa y la complejidad de la adaptación del producto y se añadirán los impuestos:
Precio de Oferta = [(Precio de empresa x F) + A] + impuestos.
Siendo F un factor que engloba los márgenes de la distribución y de los establecimientos, con los siguientes valores dependiendo del precio de empresa del producto:
|
Precio de empresa |
Valor del factor F |
|---|---|
|
Para los 1.000 primeros euros |
F = 1,30 |
|
Para el resto del precio de empresa (a partir de los 1.000 €) |
F = 1,20 |
y A un factor asociado al grado de complejidad de la adaptación de cada tipo de producto recogida en el anexo I:
|
Grado de complejidad |
Valor del factor A |
|---|---|
|
BAS |
A=10 |
|
ADAP1 |
A=20 |
|
ADAP2 |
A=50 |
|
ADAP3 |
A=120 |
|
COMP0 |
A=10 |
|
COMP1 |
A=20 |
|
COMP2 |
A=40 |
|
COMP3 |
A=60 |
4. Cuando una empresa solicite la inclusión de un producto en la Oferta, OFEPO calculará automáticamente el precio de Oferta aplicando al precio de empresa el coeficiente de corrección y un 10 % de impuestos. Una vez resuelta la solicitud, de acuerdo con lo previsto en el artículo 6, el precio de Oferta figurará en el nomenclátor. Dado que los impuestos que corresponden a un producto son variables en función del ámbito geográfico donde se dispense el producto y del grado de discapacidad del usuario, el nomenclátor recogerá también el precio de Oferta sin impuestos.
5. El importe de facturación definitiva es el precio final que abonará el respectivo responsable de prestación ortoprotésica por un producto, salvo cuando lo adquiera por concurso o mediante otro procedimiento de selección transparente y objetivo. Es el resultante de aplicar los impuestos que correspondan al precio de Oferta sin impuestos, y descontar, en su caso, la aportación del usuario vigente.
6. No obstante, los responsables de prestación ortoprotésica podrán establecer en los casos que así lo consideren oportuno, cantidades adicionales a abonar a los establecimientos para algunos tipos de productos cuando se requieran actuaciones especiales específicas por su parte, como puede ser el desplazamiento reiterado al domicilio del usuario o al hospital en el que se encuentre este ingresado en el momento de la indicación del producto.
1. De acuerdo con lo previsto en el artículo 6.3, las empresas pueden optar por comunicar a la Oferta aquellos productos pertenecientes a los tipos de productos recogidos en el catálogo común que cumplan los requisitos exigidos para solicitar su inclusión en la Oferta, pero superen el IMF. Estos productos no tendrán precio de Oferta, pero sí un precio comunicado a OFEPO (en adelante, precio de venta). Para calcular el precio de venta de cada uno de los productos comunicados a la Oferta, se aplicará al correspondiente precio de empresa el coeficiente de corrección que se recoge en el artículo 12.
2. Los productos comunicados a la Oferta podrán ser dispensados al usuario con cargo al Sistema Nacional de Salud cuando la normativa del correspondiente responsable de prestación ortoprotésica así lo establezca expresamente en su ámbito de gestión respectivo. Los responsables de prestación ortoprotésica abonarán por estos productos el IMF correspondiente al tipo de producto en el que se clasifican, aplicando los impuestos correspondientes en función del ámbito geográfico donde se dispense el producto y del grado de discapacidad del usuario, y descontando en su caso la aportación, abonando el usuario la diferencia con el precio de venta, de acuerdo a lo establecido en artículo 5.5 del Real Decreto 1506/2012, de 2 de noviembre.
3. El procedimiento para la comunicación de un producto a la Oferta se hará conforme a lo previsto en el artículo 6. Cuando la documentación facilitada por la empresa esté completa y correcta, en la resolución de aceptación de la comunicación se le notificará a la empresa el correspondiente código identificativo que tendrá las características recogidas en el artículo 11.2. La información relativa a dichos productos se recogerá en el nomenclátor de prestación ortoprotésica, diferenciándolos de los incluidos en la Oferta.
4. Los productos comunicados a la Oferta llevarán una etiqueta autoadhesiva con las características que se señalan en el apartado 2 del anexo V. El establecimiento dispensador deberá utilizarla como justificante de la dispensación al igual que se prevé para el precinto identificativo en el artículo 11.5. Las empresas disponen de un plazo máximo de dos meses contados a partir del momento en que reciban la notificación de aceptación de la comunicación del producto, para comercializarlo dotado de la correspondiente etiqueta autoadhesiva.
5. Las empresas que comercialicen productos comunicados a la Oferta deberán seguir el procedimiento establecido en el artículo 7 cuando se produzcan cambios en sus condiciones de uso, pero no les será de aplicación el plazo de seis meses previsto en el artículo 7.5 para solicitar modificaciones del precio.
6. La comunicación a la Oferta deberá ser renovada por las empresas cada tres años mediante el mismo procedimiento que se establece en el artículo 9 para los productos incluidos en la Oferta. En caso de no realizar la renovación de un producto, se anulará la información del mismo en la Oferta, lo que se notificará a la empresa y desde ese momento no podrá comercializarlo con la etiqueta autoadhesiva.
7. La comercialización de los productos comunicados a la Oferta estará sujeta a lo previsto en el artículo 10, siendo de aplicación a la etiqueta autoadhesiva lo establecido para el precinto identificativo en dicho artículo.
1. La empresa que cumpliendo los requisitos establecidos en el artículo 5.1 desee ofertar al Sistema Nacional de Salud uno de sus productos comercializados que reúna las condiciones señaladas en el artículo 5.2, deberá comunicar en el plazo de seis meses desde la entrada en vigor de esta orden, al Sistema informatizado para la recepción de comunicaciones de productos ortoprotésicos al Sistema Nacional de Salud (SIRPO), la información sobre el producto a la que se refiere la Orden SSI/566/2014, de 8 de abril, por la que se crea el sistema informatizado para la recepción de comunicaciones de productos ortoprotésicos al Sistema Nacional de Salud.
2. Finalizado este plazo de seis meses y en tanto se inicie la Oferta, las empresas facilitarán al SIRPO la información de los productos de nueva comercialización, así como la de los que no hubieran podido comunicar durante dicho plazo por motivos debidamente justificados por la empresa.
3. Cuando esté operativa la aplicación OFEPO, por resolución de la persona titular de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia se establecerá la fecha de inicio de la Oferta. A partir de ese momento, las empresas que deseen realizar una solicitud de inclusión en la Oferta del Sistema Nacional de Salud de acuerdo con el procedimiento previsto en el artículo 6, deberán completar, y en su caso modificar, a través de la correspondiente aplicación OFEPO la información previamente comunicada al SIRPO, de modo que no tendrán que comunicar nuevamente la información del anexo II ya disponible.
4. Transcurridos diez meses desde el inicio de la Oferta, los responsables de prestación ortoprotésica sólo financiarán los productos incluidos en la Oferta del Sistema Nacional de Salud, además de los productos a medida que no superen el IMF correspondiente y de los que puedan financiar en su ámbito como prestación complementaria o en aplicación de lo dispuesto en el artículo 5.5 del Real Decreto 1506/2012, de 2 de noviembre.
5. Los productos que se incluyan en la Oferta durante el periodo de diez meses señalado en el apartado anterior podrán ser dispensados sin precinto identificativo hasta dos meses después de finalizar dicho periodo. Este mismo plazo les será de aplicación a los productos a los que se refiere el artículo 13 respecto al uso de las etiquetas autoadhesivas.
Los responsables de prestación ortoprotésica adaptarán los tipos de productos de sus respectivos catálogos a lo dispuesto en el catálogo común establecido en esta orden en el plazo máximo de seis meses desde su entrada en vigor.
Las medidas incluidas en esta orden no podrán suponer incremento de dotaciones ni de retribuciones ni de otros gastos de personal al servicio del sector público.
Se mantendrá operativo el SIRPO hasta diez meses después del inicio de la Oferta. Durante ese tiempo, antes de solicitar la inclusión de un producto en la Oferta, la empresa comunicará a SIRPO la información del producto, conforme a lo dispuesto en la disposición adicional primera. Finalizado este plazo, para solicitar la inclusión de un producto en la Oferta la empresa deberá cumplimentar directamente en OFEPO toda la información recogida en el anexo II. Esto se aplicará también a los productos cuya información hubiera sido comunicada por la empresa previamente a SIRPO dentro de ese plazo, pero esta no hubiera realizado la correspondiente solicitud de inclusión en la Oferta.
1. En tanto se establezcan los límites de la aportación de la prestación ortoprotésica suplementaria, previstos en el artículo 9.3 del Real Decreto 1506/2012, de 2 de noviembre, se continuará aplicando la aportación recogida en el anexo VI del Real Decreto 1030/2006, de 15 de septiembre. No obstante, serán de aplicación las exenciones de aportación previstas en el artículo 9.4 del mencionado Real Decreto 1506/2012, de 2 de noviembre.
2. Se actualiza la denominación y codificación de los subgrupos de ortesis y ortoprótesis especiales a los que se aplica dicha aportación, para adaptarlos a los equivalentes del catálogo común que figuran en el anexo I de esta orden:
9. Ortesis
06 03 06 Ortesis lumbo-sacras (Aportación del usuario: 30 euros).
06 03 09 Ortesis toraco-lumbo-sacras (dorso-lumbares) (Aportación del usuario: 30 euros).
06 03 12 Ortesis cervicales (Aportación del usuario: 30 euros).
06 03 15 Ortesis cérvico-torácicas (Aportación del usuario: 30 euros).
06 03 18 Ortesis cérvico-toraco-lumbo-sacras (Aportación del usuario: 30 euros).
06 06 03 Ortesis de dedos (Aportación del usuario: 12 euros).
06 06 06 Ortesis de mano (Aportación del usuario: 12 euros).
06 06 12 Ortesis de muñeca y mano (Aportación del usuario: 30 euros).
06 06 13 Ortesis de muñeca, mano y dedos (Aportación del usuario: 30 euros).
06 06 15 Ortesis de codo (Aportación del usuario: 30 euros).
06 06 20 Ortesis de antebrazo (Aportación del usuario: 30 euros).
06 06 24 Ortesis de hombro y codo (Aportación del usuario: 30 euros).
06 06 27 Ortesis de hombro, codo y muñeca (Aportación del usuario: 30 euros).
06 06 36 Articulaciones de codo (Aportación del usuario: 0 euros).
06 12 06 Ortesis de tobillo y pie (tibiales) (Aportación del usuario: 30 euros).
06 12 09 Ortesis de rodilla (Aportación del usuario: 30 euros).
06 12 12 Ortesis de rodilla, tobillo y pie (femorales) (Aportación del usuario: 30 euros).
06 12 15 Ortesis de cadera, incluyendo ortesis de abducción (Aportación del usuario: 30 euros).
06 12 18 Ortesis de cadera, rodilla, tobillo y pie (Aportación del usuario: 30 euros).
06 12 21 Articulaciones de tobillo (Aportación del usuario: 0 euros).
06 12 24 Articulaciones de rodilla (Aportación del usuario: 0 euros).
06 12 27 Articulaciones de cadera (Aportación del usuario: 0 euros).
06 33 90 Calzados ortopédicos para grandes deformidades (Aportación del usuario: 36 euros).
10. Ortoprótesis especiales
12 03 09 Muletas de codo con soporte en antebrazo (Aportación del usuario: 12 euros).
12 03 16 Muletas con tres o más patas (Aportación del usuario: 12 euros).
12 06 00 Andadores (Aportación del usuario: 30 euros).
04 06 06 Prendas de compresión para brazos, piernas y otras partes del cuerpo para linfedemas de miembros superiores, linfedemas graves de miembros inferiores y linfedemas de tronco (Aportación del usuario: 30 euros).
04 07 00 Prendas de compresión para brazos, piernas y otras partes del cuerpo para quemados y grandes queloides (Aportación del usuario: 30 euros).
04 33 00 Cojines para prevenir las úlceras por presión (Aportación del usuario: 30 euros).
04 48 06 Aparatos de bipedestación (Aportación del usuario: 30 euros).
04 48 21 Planos inclinables (Aportación del usuario: 30 euros).
En tanto se determinan los tipos de productos del apartado 7 de prótesis externas del anexo VI del Real Decreto 1030/2006, de 15 de septiembre, no serán de aplicación a los productos correspondientes a ese apartado ni los IMF ni el procedimiento de inclusión, alteración y exclusión de la Oferta previsto en esta norma.
Queda derogada la Orden SSI/566/2014, de 8 de abril, por la que se crea el sistema informatizado para la recepción de comunicaciones de productos ortoprotésicos al Sistema Nacional de Salud (SIRPO), así como cuantas disposiciones de igual o inferior rango se opongan a lo dispuesto en esta orden.
La presente orden se dicta al amparo de lo previsto en el artículo 149.1.16ª de la Constitución Española, que atribuye al Estado la competencia exclusiva en materia de bases y coordinación general de la sanidad.
El párrafo b) del apartado 2 del artículo único de la Orden SPI/1117/2011, de 26 de abril, por la que se regula el Comité asesor para la prestación ortoprotésica, queda modificado como sigue:
«b) Vocales, que serán designados por la respectiva institución a la que representan entre las personas que desempeñan funciones relativas a la prestación ortoprotésica:
1.º Un representante de la Subdirección General de Cartera de Servicios del Sistema Nacional de Salud y Fondos de Compensación.
2.º Un representante del Departamento de Productos Sanitarios de la Agencia Española de Medicamentos y Productos Sanitarios.
3.º Un representante de la Secretaría de Estado de Servicios Sociales.
4.º Un representante de la Red Española de Agencias de Evaluación de Tecnologías Sanitarias y Prestaciones del Sistema Nacional de Salud, designado por la Secretaría Técnica de la Red.
5.º Un representante de cada una de las comunidades autónomas.
6.º Un representante del Instituto Nacional de Gestión Sanitaria (INGESA).
7.º Un representante de cada una de las mutualidades de funcionarios: Mutualidad General de Funcionarios Civiles del Estado (MUFACE), Mutualidad General Judicial (MUGEJU) e Instituto Social de las Fuerzas Armadas (ISFAS).
8.º Un representante del Ministerio de Hacienda.
9.º Un representante del Ministerio de Economía y Empresa.
Además se integrarán como vocales tres expertos, de los cuales dos serán facultativos especialistas del Sistema Nacional de Salud, previo informe a las sociedades científicas relacionadas con la especialidad de dichos facultativos, y el tercero a propuesta del Consejo Nacional de la Discapacidad. Todos ellos designados por la persona titular del Ministerio de Sanidad, Consumo y Bienestar Social, previo informe al Consejo Interterritorial del Sistema Nacional de Salud.
Para cada uno de los vocales se designará un titular y un suplente.»
El apartado 1 del artículo 6 de la Orden SCO/3422/2007, de 21 de noviembre, por la que se desarrolla el procedimiento de actualización de la cartera de servicios comunes del Sistema Nacional de Salud, queda modificado como sigue:
«1. Las propuestas de actualización de la cartera de servicios comunes del Sistema Nacional de Salud serán formuladas por el Ministerio de Sanidad, Consumo y Bienestar Social, por las administraciones sanitarias de las comunidades autónomas o por las mutualidades de funcionarios, a propia iniciativa o a petición razonada de terceros interesados».
La presente orden entrará en vigor el día 1 de julio de 2019.
Madrid, 22 de enero de 2019.–La Ministra de Sanidad, Consumo y Bienestar Social, María Luisa Carcedo Roces.
«La prestación ortoprotésica consiste en la utilización de productos sanitarios, implantables o no, cuya finalidad es sustituir total o parcialmente una estructura corporal, o bien modificar, corregir o facilitar su función, comprendiendo los elementos precisos para mejorar la calidad de vida y la autonomía del usuario.
Esta prestación se facilitará por los servicios de salud o dará lugar a ayudas económicas, en los casos y de acuerdo con las normas que reglamentariamente se establezcan por parte de las administraciones sanitarias competentes.
1. Contenido
1.1 La cartera común de servicios de prestación ortoprotésica comprende:
a) Los implantes quirúrgicos, que forman parte de la cartera común básica de servicios asistenciales, en la que también se incluyen las ortoprótesis externas de uso en pacientes ingresados.
b) Las ortoprótesis externas de dispensación ambulatoria, que son integrantes de la cartera común suplementaria. Están constituidas por las prótesis externas, las sillas de ruedas, las ortesis y las ortoprótesis especiales.
1.2 No constituyen parte de esta prestación los artículos ortoprotésicos destinados a uso deportivo, ni los utilizados con finalidad estética que no guarden relación con accidente, enfermedad o malformación congénita, ni aquellos de los que se realice publicidad dirigida al público en general.
1.3 La cartera común de servicios de prestación ortoprotésica se hace efectiva mediante los correspondientes catálogos comunes de implantes quirúrgicos y de ortoprótesis externas que figuran en los apartados 6, 7, 8, 9 y 10, en los que se incluyen, en su caso, sus condiciones de uso o el tipo de discapacidad o indicación clínica que justifica su prescripción:
a) En el apartado 6 se establece el catálogo común de implantes quirúrgicos, en el que se recogen las correspondientes divisiones codificadas con dos caracteres y los grupos codificados con cuatro caracteres, así como los respectivos desgloses, alcanzando diferentes niveles de desagregación que permiten agrupar productos con características similares.
b) En los apartados 7, 8, 9 y 10 figura el catálogo común de ortoprótesis externas en el que se recogen los respectivos grupos (codificados con cuatro caracteres) y subgrupos (seis caracteres). Estos se desglosan en categorías, identificadas con códigos homologados de seis caracteres, que, a su vez, se dividen en tipos de productos (codificados con siete caracteres).
1.4 En el caso de las ortoprótesis externas:
a) El catálogo común además recoge la siguiente información para cada tipo de producto:
1.º Si es de elaboración individualizada o requiere adaptación con su respectivo grado de complejidad.
2.º La vida media expresada en meses que es el tiempo medio de duración de un producto en condiciones normales de uso.
3.º El importe máximo de financiación (IMF) con un impuesto sobre el valor añadido (IVA) del 10 %, así como el correspondiente IMF sin impuestos.
b) Los productos financiables correspondientes a los tipos de productos incluidos en el catálogo común no elaborados a medida se recogerán en la Oferta de productos ortoprotésicos del Sistema Nacional de Salud, de acuerdo con lo contemplado en el artículo 4 del Real Decreto 1506/2012, de 2 de noviembre.
2. Conceptos
2.1 Implante quirúrgico: Producto sanitario diseñado para ser implantado total o parcialmente en el cuerpo humano mediante intervención quirúrgica y destinado a permanecer allí después de dicha intervención. Tiene finalidad terapéutica cuando sustituye total o parcialmente una estructura corporal o una función fisiológica que presenta algún defecto o anomalía, o bien tiene finalidad diagnóstica. Los productos destinados a permanecer en el cuerpo humano menos de 30 días no se consideran incluidos en el apartado de implantes quirúrgicos, si bien los centros sanitarios facilitarán a los usuarios aquellos que, siendo seguros y eficaces, precisen para su adecuada atención, utilizando para ello la vía que consideren más adecuada para garantizar la máxima eficiencia.
2.2 Ortoprótesis externa: Producto sanitario no implantable que requiere una elaboración o adaptación individualizada al usuario o un ajuste básico y que comprende los siguientes apartados:
a) Prótesis externa: Ortoprótesis externa dirigida a sustituir total o parcialmente un órgano o una estructura corporal o su función.
b) Silla de ruedas: Ortoprótesis externa con la consideración de vehículo individual que permite el traslado de una persona que haya perdido de forma permanente la capacidad de marcha funcional, adecuado a su grado de discapacidad.
c) Ortesis: Ortoprótesis externa que va destinada a modificar las condiciones estructurales o funcionales del sistema neuromuscular o del esqueleto.
d) Ortoprótesis especial: Ortoprótesis externa que modifica o sustituye una función corporal o facilita la deambulación de personas con movilidad reducida de forma permanente, que no pueda considerarse incluida en los apartados anteriores.
3. Acceso a la prestación ortoprotésica
3.1 Todos los usuarios del Sistema Nacional de Salud tendrán acceso al catálogo común siempre que exista una indicación clínica y sanitaria para ello, con independencia del ámbito geográfico en el que se encuentren.
3.2 Los responsables de prestación ortoprotésica establecerán sus respectivos catálogos que contendrán, al menos, los tipos de productos del catálogo común al que se refieren los apartados 6, 7, 8, 9 y 10.
3.3 El acceso a la prestación ortoprotésica se hará, garantizando las necesidades sanitarias de los usuarios, en la forma que establezca al efecto el correspondiente responsable de prestación ortoprotésica.
4. Procedimiento de obtención
4.1 En el caso de los implantes quirúrgicos las administraciones sanitarias responsables de la gestión establecerán el procedimiento de adquisición de los mismos por la vía que consideren más adecuada para lograr la máxima eficiencia y su adecuado suministro.
4.2 En el caso de ortoprótesis externas:
a) Cada responsable de prestación ortoprotésica determinará el procedimiento de obtención de dicha prestación en su ámbito, así como las condiciones de acceso, de indicación y prescripción, de gestión, de elaboración y de aplicación de su catálogo y, si procede, de préstamo, alquiler, recuperación y reparación de los artículos. Este procedimiento contemplará la posibilidad de que el usuario no tenga que adelantar el importe de los productos cuando se trate de personas con escasos recursos económicos o de productos de elevado importe.
b) La prestación ortoprotésica correrá a cargo del responsable de prestación ortoprotésica del ámbito en el que se atienda al paciente, si bien se llevará a cabo la compensación que proceda en función de lo establecido en el artículo 3 del Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones.
c) La indicación de un tipo de producto deberá ser realizada por un médico especialista en la materia correspondiente a la clínica que justifique la prescripción. Para la indicación se atenderá a criterios de individualización en relación con la persona usuaria y sus condiciones de salud y de calidad de vida, tales como edad, evolución previsible de la patología o discapacidad, situación laboral y social, grado de autonomía personal y acceso a servicios de la comunidad, y otros de análoga significación.
d) Los responsables de prestación ortoprotésica podrán establecer en sus respectivos catálogos, además de los casos de especial prescripción señalados en el catálogo común, los tipos de productos que solo podrán ser indicados en su ámbito por determinados especialistas o por las unidades clínicas que designen al efecto.
e) Los responsables de prestación ortoprotésica establecerán el periodo de renovación de los productos susceptibles de la misma. Ese periodo podrá reducirse en casos justificados por el prescriptor por tratarse de niños en los que se requiere una adecuación a la etapa de crecimiento o de usuarios en los que la evolución de su patología o cambios antropométricos así lo exijan o bien cuando concurran circunstancias objetivas que influyan en un especial desgaste de los productos. El mero hecho del transcurso del plazo de renovación del producto no genera automáticamente la necesidad de renovación, sino que deberá ser valorada específicamente en cada caso por el prescriptor. La renovación solo podrá concederse cuando no sea debida al mal trato o uso inadecuado del producto por parte del usuario, en las condiciones que determine el correspondiente responsable de prestación ortoprotésica.
f) Los establecimientos sanitarios dispensadores y adaptadores de productos ortoprotésicos (en adelante establecimientos) que opten por dispensar productos a cargo del Sistema Nacional de Salud asumirán todas las condiciones establecidas en este anexo y no podrán cobrar al usuario cantidades adicionales a la aportación que en su caso le pudiera corresponder en función del tipo de producto, salvo cuando así lo autorice el correspondiente responsable de prestación ortoprotésica de acuerdo con lo previsto en el artículo 5.5 del Real Decreto 1506/2012, de 2 de noviembre.
4.3 Los responsables de prestación ortoprotésica reclamarán a los terceros obligados al pago el importe de la prestación ortoprotésica en los supuestos establecidos en el anexo IX.
5. Requisitos generales de la prestación ortoprotésica
5.1 Con el fin de garantizar la calidad de la prestación ortoprotésica, los productos deben cumplir los requisitos contemplados en la legislación vigente de productos sanitarios que les resulte de aplicación.
5.2 En el caso de ortoprótesis externas, además, se establecen los siguientes requisitos:
a) En la prescripción de los productos ortoprotésicos deberán constar, como mínimo, los siguientes datos:
1.º Responsable de la prescripción: Datos de identificación del facultativo (Nombre, número de colegiado o código de identificación, centro sanitario y servicio).
2.º Usuario: Datos de identificación; Colectivo al que pertenece (TSI 001: Exentos de aportación, TSI 002: Pensionistas y beneficiarios de renta < 100.000 €, TSI 003: Activos y beneficiarios de renta < 18.000 €, TSI 004: Activos y beneficiarios de renta =18.000-100.000 €, TSI 005: Usuarios y beneficiarios de renta > 100.000 €, TSI 006: Usuarios y beneficiarios de mutualidades de funcionarios, ATEP: Accidente de trabajo y enfermedad profesional y DAST: Usuarios en el marco de aplicación de la Directiva 2011/24/UE, del Parlamento Europeo y del Consejo, de 9 de marzo de 2011, relativa a la aplicación de los derechos de los pacientes en la asistencia sanitaria transfronteriza); fecha de nacimiento; peso y talla, si procede.
3.º Motivo de la prescripción: Accidente de trabajo, accidente de tráfico, accidente deportivo, otro tipo de accidente (especificar), malformación congénita, enfermedad u otro origen (especificar).
4.º Diagnóstico: Discapacidad o patología que justifica la prescripción; patologías concomitantes que influyan en la prescripción; otra información clínica de interés.
5.º Valoración social (cuando proceda): Actividades que realiza: laborales, ocio, etc., medio en el que vive u otras circunstancias que puedan influir en la prescripción o renovación de los productos.
6.º Prescripción: Fecha; tipo de producto o nombre del producto; clase de prescripción (primera prescripción, renovación con la justificación del motivo, reparación o recambio); recomendaciones de uso. Cuando para componer un producto final completo sea necesario indicar a un usuario productos de varios tipos diferentes, todos ellos se indicarán conjuntamente constituyendo a todos los efectos una única prescripción.
7.º Firma del responsable de la prescripción.
8.º Revisiones que hayan de realizarse, en su caso.
b) El responsable de la prescripción dará el visto bueno de forma expresa al producto entregado al usuario que requiera una adaptación individualizada o sea elaborado a medida, tras comprobar que se ajusta a sus indicaciones, a las necesidades del mismo y que está adecuadamente adaptado o elaborado o indicará las modificaciones que hayan de introducirse en el producto, en los casos y mediante el procedimiento que regulen los responsables de prestación ortoprotésica en sus respectivos ámbitos.
c) La adaptación y dispensación de los productos ortoprotésicos se realizará en los establecimientos autorizados para dicho fin por la correspondiente administración competente. De acuerdo con lo que se indica en el artículo 3.4 del Real Decreto 1506/2012, de 2 de noviembre, estos establecimientos deberán reunir los requisitos que establezca la comunidad autónoma o ciudad autónoma en la que estén ubicados. Podrán determinar requisitos específicos teniendo en cuenta la forma de elaboración o el grado de complejidad de la adaptación de los tipos de productos que puede proporcionar cada uno de ellos a los usuarios del Sistema Nacional de Salud, a fin de que se salvaguarde una correcta elaboración y adaptación de la prestación prescrita al usuario y se garantice el acceso de los usuarios en condiciones de igualdad efectiva. En todo caso, se tratará de establecimientos sanitarios que cuenten con la correspondiente autorización sanitaria, de acuerdo con lo dispuesto en el Real Decreto 1277/2003, de 10 de octubre, por el que se establecen las bases generales sobre autorización de centros, servicios y establecimientos sanitarios.
d) Las autoridades sanitarias competentes pondrán a disposición de los usuarios la relación de los establecimientos de su ámbito de gestión que cumpliendo los requisitos mencionados en el apartado anterior, puedan dispensar los diferentes tipos de productos a los usuarios del Sistema Nacional de Salud.
e) Los establecimientos solo podrán dispensar productos pertenecientes al tipo de producto previamente indicado por el facultativo en el documento de prescripción. En caso de que en la prescripción figurara el nombre de un producto concreto, podrán dispensar otro producto del mismo tipo incluido en la Oferta siempre que lo permita la normativa de la correspondiente comunidad autónoma y que el facultativo prescriptor no hubiera indicado nada en contra de la sustitución.
f) Siempre que se trate de productos elaborados a medida o que requieren una adaptación individualizada al usuario:
1.º Correrán a cargo del establecimiento cuantas rectificaciones imputables a la elaboración y adaptación sean precisas.
2.º En la elaboración de los productos, el establecimiento se ajustará a las indicaciones consignadas por el especialista prescriptor.
g) La entrega del producto al usuario habrá de ir acompañada de la información establecida en la normativa de productos sanitarios, del certificado de garantía y de una hoja informativa, en lenguaje comprensible y accesible para personas con discapacidad, con las recomendaciones precisas para la mejor conservación del mismo en condiciones de utilización normal y las advertencias para evitar su mal uso, de acuerdo con lo que establezca el responsable de prestación ortoprotésica. Todo ello, sin perjuicio de lo dispuesto en el Real Decreto Legislativo 1/2007, de 16 de noviembre, por el que se aprueba el texto refundido de la Ley General para la Defensa de los Consumidores y Usuarios y otras leyes complementarias.
5.3 En el caso de los implantes quirúrgicos, además de la información establecida en la normativa de productos sanitarios, se ha de facilitar a los pacientes una hoja informativa con las instrucciones, así como las recomendaciones, contraindicaciones y precauciones que deben tomarse en su caso.
8. Sillas de ruedas
Grupo: 12 22 Sillas de ruedas de propulsión manual (No se consideran incluidas las sillas de ruedas manuales con ruedas grandes delanteras maniobradas por los dos brazos, las sillas de ruedas propulsadas con el pie, ni las sillas de ruedas con motor, salvo las incluidas en el grupo 12 23)
Subgrupo: 12 22 00 Sillas de ruedas manuales para personas con patologías o discapacidades que les impidan la marcha funcional de forma permanente.
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
SRM 000 Silla de ruedas manual no autopropulsable no plegable (rígida). |
SRM 000A Silla de ruedas manual no autopropulsable no plegable (rígida), con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables. |
BAS |
48 |
258,15 |
234,68 |
|
SRM 000B Silla de ruedas manual no autopropulsable no plegable (rígida), con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, para usuarios de más de 130 kg. |
BAS |
48 |
549,87 |
499,88 |
|
|
SRM 010 Silla de ruedas manual no autopropulsable plegable. |
SRM 010A Silla de ruedas manual no autopropulsable plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables. |
BAS |
36 |
258,15 |
234,68 |
|
SRM 010B Silla de ruedas manual no autopropulsable plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, con respaldo reclinable. |
BAS |
36 |
358,15 |
325,59 |
|
|
SRM 010C Silla de ruedas manual no autopropulsable plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, para usuarios de más de 130 kg. |
BAS |
36 |
549,87 |
499,88 |
|
|
SRM 020 Silla de ruedas manual no autopropulsable plegable o rígida, infantil. |
SRM 020A Silla de ruedas manual no autopropulsable plegable, infantil, para alteraciones funcionales, tipo paraguas. |
BAS |
24 |
515,17 |
468,34 |
|
SRM 020B Silla de ruedas manual no autopropulsable, desmontable, de plegado en libro, basculante, infantil ajustable al crecimiento del niño. |
ADAP2 |
24 |
1.618,94 |
1.471,76 |
|
|
SRM 020C Silla de ruedas manual no autopropulsable, plegable o rígida, basculante, infantil, para alteraciones neurológicas graves. |
ADAP2 |
24 |
2.146,79 |
1.951,63 |
|
|
SRM 030 Silla de ruedas manual autopropulsable no plegable (rígida). |
SRM 030A Silla de ruedas manual autopropulsable no plegable (rígida), con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables. |
BAS |
36 |
258,15 |
234,68 |
|
SRM 030B Silla de ruedas manual autopropulsable no plegable (rígida), con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, para usuarios de más de 130 kg. |
BAS |
36 |
549,87 |
499,88 |
|
|
SRM 030C Silla de ruedas manual autopropulsable no plegable (rígida), de verticalización, con sistema de sujeción en rodilla, para usuarios activos con lesión medular congénita o adquirida y antecedentes de úlcera por decúbito recidivante a pesar de tratamiento quirúrgico (especial prescripción). |
ADAP1 |
36 |
3.157,55 |
2.870,50 |
|
|
SRM 040 Silla de ruedas manual autopropulsable plegable. |
SRM 040A Silla de ruedas manual autopropulsable y plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables. |
BAS |
36 |
258,15 |
234,68 |
|
SRM 040B Silla de ruedas manual autopropulsable y plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, con respaldo reclinable. |
BAS |
36 |
478,85 |
435,32 |
|
|
SRM 040C Silla de ruedas manual autopropulsable y plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, para usuarios de más de 130 kg. |
BAS |
24 |
549,87 |
499,88 |
|
|
SRM 040D Silla de ruedas manual autopropulsable y plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, con ruedas de desmontaje rápido, de material ligero. |
ADAP1 |
36 |
413,23 |
375,66 |
|
|
SRM 040E Silla de ruedas manual autopropulsable y plegable, con reposabrazos desmontables y/o abatibles y reposapiés abatibles y regulables, con ruedas de desmontaje rápido, de material ligero, infantil. |
ADAP1 |
36 |
900,00 |
818,18 |
|
|
SRM 040F Silla de ruedas manual autopropulsable y plegable, con reposabrazos desmontables y/o abatibles, reposapiés abatibles y regulables, con ruedas de desmontaje rápido, de material ligero para usuarios activos, con patología medular de cualquier etiología o enfermedades neuromusculares (especial prescripción). |
ADAP1 |
36 |
2.000,85 |
1.818,95 |
|
|
SRM 050 Chasis y silla basculante para alteraciones neurológicas graves. |
SRM 050A Chasis posicionador basculante, incluyendo ruedas y frenos, susceptible de adaptaciones especiales, para alteraciones neurológicas graves (especial prescripción). |
ADAP3 |
36 |
1.604,08 |
1.458,25 |
|
SRM 050B Chasis posicionador basculante, de material ligero, incluyendo ruedas y frenos, susceptible de adaptaciones especiales, para alteraciones neurológicas graves (especial prescripción). |
ADAP3 |
36 |
1.936,00 |
1.760,00 |
|
|
SRM 050C Silla basculante, con asiento y respaldo reclinable, reposacabezas, reposabrazos extraíbles, reposapiés elevables, y control postural de tronco, para alteraciones neurológicas graves (especial prescripción). |
ADAP2 |
36 |
2.574,79 |
2.340,72 |
A aquellas personas que por su elevada obesidad no puedan utilizar sillas de los tipos SRM 000B, SRM 010C, SRM 030B y SRM 040C, se les podrá prescribir una silla de ruedas a medida, con importe según presupuesto.
Grupo: 12 23 Sillas de ruedas motorizadas
Subgrupo: 12 23 06 Sillas de ruedas de propulsión eléctrica y dirección eléctrica para personas con limitaciones funcionales graves del aparato locomotor por enfermedad, malformación o accidente que cumplan todos y cada uno de los requisitos siguientes:
a) Incapacidad permanente para la marcha independiente.
b) Incapacidad funcional permanente para la propulsión de sillas de ruedas manuales con las extremidades superiores.
c) Suficiente capacidad visual, mental y de control que les permita el manejo de sillas de ruedas eléctricas y ello no suponga un riesgo añadido para su integridad y la de otras personas.
Para la prescripción de las sillas de propulsión eléctrica se han de tener en cuenta los criterios que se recogen en los protocolos que se establezcan al efecto por el responsable de prestación ortoprotésica.
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
SRE 000 Silla de ruedas eléctrica. |
SRE 000A Silla de ruedas eléctrica estándar. |
ADAP2 |
48 |
3.520,00 |
3.200,00 |
|
SRE 000B Silla de ruedas eléctrica, infantil. |
ADAP2 |
48 |
4.015,00 |
3.650,00 |
|
|
SRE 000C Silla de ruedas eléctrica, para usuarios de más de 130 kg. |
ADAP2 |
60 |
4.725,72 |
4.296,11 |
|
|
SRE 000D Silla de ruedas eléctrica, con basculación manual. |
ADAP2 |
60 |
4.125,00 |
3.750,00 |
|
|
SRE 000E Silla de ruedas eléctrica, con basculación manual, infantil. |
ADAP2 |
60 |
4.620,00 |
4.200,00 |
|
|
SRE 000F Silla de ruedas eléctrica, con basculación electrónica. |
ADAP2 |
60 |
4.455,00 |
4.050,00 |
|
|
SRE 000G Silla de ruedas eléctrica, con basculación electrónica, infantil. |
ADAP2 |
60 |
4.950,00 |
4.500,00 |
A aquellas personas que por su elevada obesidad no puedan utilizar sillas del Tipo SRE 000C, se les podrá prescribir una silla de ruedas a medida, con importe según presupuesto.
Grupo: 12 24 Accesorios para sillas de ruedas para personas con patologías o discapacidades que les impidan la marcha funcional de forma permanente
Subgrupo: 12 24 15 Mesas o bandejas portátiles.
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
SAB 000 Bandeja desmontable especial. |
SAB 000A Bandeja desmontable especial. |
COMP1 |
36 |
117,29 |
106,63 |
Subgrupo: 12 24 24. Baterías.
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
SAT 000 Batería para silla de ruedas eléctrica. |
SAT 000A Batería para silla de ruedas eléctrica (par) de menos de 50A. |
COMP0 |
12 |
416,05 |
378,23 |
|
SAT 000B Batería para silla de ruedas eléctrica (par) de 50 A. |
COMP0 |
12 |
460,05 |
418,23 |
|
|
SAT 000C Batería para silla de ruedas eléctrica (par) de 60 A. |
COMP0 |
12 |
566,37 |
514,89 |
|
|
SAT 000D Batería para silla de ruedas eléctrica (par) de 70 A |
COMP0 |
12 |
668,23 |
607,49 |
Subgrupo: 12 24 89. Otros accesorios para sillas de ruedas.
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
SRA 000 Apoyo postural para silla de ruedas, incluidos tacos y correas. |
SRA 000A Apoyos laterales para la cabeza (par). |
COMP2 |
24 |
156,06 |
141,87 |
|
SRA 000B Apoyos laterales para el tronco fijos (par). |
COMP1 |
24 |
127,05 |
115,50 |
|
|
SRA 000C Apoyos laterales para el tronco abatibles (par). |
COMP2 |
24 |
166,00 |
150,91 |
|
|
SRA 000D Cuña niveladora de pelvis (unidad). |
COMP1 |
24 |
59,33 |
53,94 |
|
|
SRA 000E Taco abductor (unidad). |
COMP1 |
24 |
70,93 |
64,48 |
|
|
SRA 000F Cincha para la cabeza. |
COMP1 |
24 |
63,87 |
58,06 |
|
|
SRA 000G Chaleco de fijación. |
COMP2 |
24 |
101,92 |
92,65 |
|
|
SRA 000H Arnés de hombros. |
COMP1 |
24 |
90,00 |
81,82 |
|
|
SRA 000I Cinturón de 4 puntos. |
COMP1 |
24 |
88,07 |
80,06 |
|
|
SRA 000J Cinturón o arnés pélvico. |
COMP1 |
24 |
125,09 |
113,72 |
|
|
SRA 000K Cinchas para pies (par). |
COMP1 |
24 |
53,76 |
48,87 |
|
|
SRA 000L Soporte de fluido (unidad). |
COMP1 |
24 |
62,00 |
56,36 |
|
|
SRA 010 Reposacabezas. |
SRA 010A Reposacabezas fijo. |
COMP1 |
24 |
85,01 |
77,28 |
|
SRA 010B Reposacabezas con apoyo occipital o total, fijo u orientable. |
COMP1 |
24 |
187,14 |
170,13 |
|
|
SRA 010C Reposacabezas con apoyo occipital o total, orientable con brazo de una articulación ajustable en altura y profundidad. |
COMP3 |
24 |
495,00 |
450,00 |
|
|
SRA 010D Reposacabezas con apoyo occipital o total, orientable con brazo acodado de dos articulaciones, ajustable en altura y profundidad. |
COMP3 |
24 |
610,67 |
555,15 |
|
|
SRA 020 Sistema para autopropulsión con un solo brazo. |
SRA 020A Sistema de doble aro para autopropulsión con un solo brazo. |
COMP0 |
36 |
383,70 |
348,82 |
|
SRA 020B Palanca. |
COMP0 |
36 |
431,26 |
392,05 |
|
|
SRA 030 Otros accesorios. |
SRA 030A Mando especial de mentón para silla de ruedas eléctrica. |
COMP3 |
48 |
1.552,57 |
1.411,43 |
|
SRA 030B Otro mando especial para silla de ruedas eléctrica, de acuerdo con los protocolos de los responsables de prestación ortoprotésica (especial prescripción). |
COMP3 |
48 |
SP |
SP |
|
|
SRA 030C Sistema doble amputado. |
COMP0 |
36 |
65,85 |
59,86 |
|
|
SRA 030D Dispositivo especial para respirador. |
COMP0 |
36 |
162,00 |
147,27 |
|
|
SRA 030E Dispositivo para bombona de oxígeno. |
COMP0 |
36 |
83,78 |
76,16 |
|
|
SRA 030F Subebordillos para silla de ruedas eléctrica. |
COMP1 |
48 |
216,84 |
197,13 |
|
|
SRA 030G Rueda antivuelco para silla de ruedas manual. |
COMP1 |
36 |
49,62 |
45,11 |
|
|
SRA 030H Alargador de freno. |
COMP0 |
36 |
20,00 |
18,18 |
|
|
SRA 030I Base rígida para silla de ruedas. |
COMP0 |
36 |
51,49 |
46,81 |
Subgrupo: 12 24 90 Recambios y componentes para sillas de ruedas.
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
SRC 000 Reposabrazos especial. |
SRC 000A Reposabrazos de cazoleta. |
COMP1 |
36 |
108,63 |
98,75 |
|
SRC 000B Reposabrazos envolvente con soporte palmar. |
COMP1 |
36 |
151,75 |
137,95 |
|
|
SRC 000C Reposabrazos regulable en altura. |
COMP0 |
36 |
129,38 |
117,62 |
|
|
SRC 010 Reposapiés especial. |
SRC 010A Reposapiés único. |
COMP1 |
36 |
103,00 |
93,64 |
|
SRC 010B Reposapiés con cazoleta (par). |
COMP2 |
36 |
193,00 |
175,45 |
|
|
SRC 010C Reposapiés con elevación manual para silla de ruedas manual o eléctrica (par). |
COMP1 |
36 |
313,92 |
285,38 |
|
|
SRC 010D Reposapiés con elevación eléctrica para silla de ruedas eléctricas (par). |
COMP1 |
36 |
843,76 |
767,05 |
|
|
SRC 020 Asiento-respaldo postural con carcasa, a medida. |
SRC 020A Asiento-respaldo postural con carcasa, a medida previo molde. |
MED |
24 |
2.500,00 |
2.272,73 |
|
SRC 020B Asiento postural con carcasa, a medida previo molde. |
MED |
24 |
1.291,64 |
1.174,22 |
|
|
SRC 020C Respaldo postural con carcasa, a medida previo molde. |
MED |
24 |
1.320,00 |
1.200,00 |
|
|
SRC 030 Asiento-respaldo postural modular. |
SRC 030A Plataforma rígida ajustable para asiento postural modular. |
COMP1 |
36 |
238,50 |
216,82 |
|
SRC 030B Asiento postural modular. |
COMP3 |
24 |
754,00 |
685,45 |
|
|
SRC 030C Respaldo postural modular. |
COMP3 |
24 |
847,00 |
770,00 |
9. Ortesis
Grupo: 06 03 Ortesis de columna vertebral (No se consideran incluidas las fajas preventivas)
Subgrupo: 06 03 06 Ortesis lumbo-sacras (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OTL 000 Ortesis lumbo-sacra semirrígida. |
OTL 000A Ortesis lumbo-sacra semirrígida elástica con flejes posteriores. |
BAS |
24 |
68,28 |
62,07 |
|
OTL 000B Ortesis lumbo-sacra semirrígida en tejido no elástico. |
BAS |
24 |
88,20 |
80,18 |
|
|
OTL 000C Ortesis lumbo-sacra semirrígida en tejido elástico o no elástico para abdomen péndulo. |
ADAP1 |
24 |
99,00 |
90,00 |
|
|
OTL 000D Ortesis lumbo-sacra semirrígida para eventración y/u ostomía. |
ADAP1 |
24 |
99,00 |
90,00 |
|
|
OTL 000E Ortesis lumbo-sacra semirrígida, a medida, para usuarios con características especiales que no permiten adaptar las prefabricadas. |
MED |
24 |
290,95 |
264,50 |
|
|
OTL 010 Ortesis lumbo-sacra rígida. |
OTL 010A Ortesis lumbo-sacra rígida, prefabricada. |
ADAP2 |
24 |
277,31 |
252,10 |
|
OTL 010B Ortesis lumbo-sacra rígida en termoplástico, a medida. |
MED |
24 |
538,49 |
489,54 |
|
|
OTL 010C Ortesis lumbo-sacra Knight. |
ADAP1 |
24 |
186,30 |
169,36 |
|
|
OTL 010D Ortesis lumbo-sacra con armazón rígido posterior y tejido elástico. |
ADAP1 |
24 |
218,10 |
198,27 |
Subgrupo: 06 03 09. Ortesis toraco-lumbo-sacras (dorso-lumbares) (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OTD 000 Ortesis toraco-lumbar semirrígida. |
OTD 000A Ortesis toraco-lumbar semirrígida. |
ADAP1 |
24 |
104,50 |
95,00 |
|
OTD 000B Ortesis toraco-lumbar semirrígida para abdomen péndulo. |
ADAP1 |
24 |
104,50 |
95,00 |
|
|
OTD 000C Ortesis toraco-lumbar semirrígida, a medida, para usuarios con características especiales que no permiten adaptar las prefabricadas. |
MED |
24 |
242,18 |
220,16 |
|
|
OTD 010 Ortesis para pectus carinatum (tórax en quilla) o excavatum. |
OTD 010A Corsé para pectus carinatum (tórax en quilla) o pectus excavatum, a medida. |
MED |
12 |
647,65 |
588,77 |
|
OTD 010B Ortesis para pectus carinatum (tórax en quilla), prefabricada. |
ADAP2 |
12 |
495,00 |
450,00 |
|
|
OTD 020 Ortesis toraco-lumbar rígida. |
OTD 020A Ortesis toraco-lumbar rígida monovalva para inmovilización en termoplástico, prefabricada. |
ADAP2 |
24 |
275,00 |
250,00 |
|
OTD 020B Ortesis toraco-lumbar rígida bivalva con apoyo esternal para inmovilización en termoplástico, prefabricada. |
ADAP2 |
24 |
448,13 |
407,39 |
|
|
OTD 020C Ortesis toraco-lumbar rígida para inmovilización en termoplástico, a medida. |
MED |
24 |
688,57 |
625,97 |
|
|
OTD 020D Ortesis toraco-lumbar Taylor, prefabricada. |
ADAP1 |
24 |
214,19 |
194,72 |
|
|
OTD 020E Ortesis toraco-lumbar con armazón rígido posterior y tejido elástico. |
ADAP1 |
24 |
341,00 |
310,00 |
|
|
OTD 030 Corsé rígido para cifolordosis. |
OTD 030A Corsé rígido de corrección progresiva para cifolordosis, a medida. |
MED |
12 |
988,80 |
898,91 |
|
OTD 030B Corsé rígido de corrección progresiva para cifolordosis articulado, a medida. |
MED |
12 |
988,80 |
898,91 |
|
|
OTD 040 Corsé para escoliosis, a medida. |
OTD 040A Corsé de Stagnara o Lyones, a medida. |
MED |
12 |
977,66 |
888,78 |
|
OTD 040B Corsé de Cheneau, con almohadillas de presión, a medida. |
MED |
12 |
1.048,49 |
953,17 |
|
|
OTD 040C Corsé de Michel, a medida. |
MED |
12 |
910,80 |
828,00 |
|
|
OTD 050 Corsé tipo Boston. |
OTD 050A Corsé tipo Boston, en termoplástico con aperturas de expansión y almohadillas de presión, con módulo prefabricado. |
ADAP3 |
12 |
880,00 |
800,00 |
|
OTD 050B Corsé tipo Boston, en termoplástico con aperturas de expansión y almohadillas de presión, talla especial. |
ADAP3 |
12 |
894,83 |
813,48 |
|
|
OTD 050C Corsé tipo Boston blando. |
ADAP2 |
12 |
816,42 |
742,20 |
|
|
OTD 050D Corsé tipo Boston, en termoplástico con aperturas de expansión y almohadillas de presión, a medida. |
MED |
12 |
909,65 |
826,95 |
|
|
OTD 060 Ortesis de uso nocturno. |
OTD 060A Ortesis de inclinación lateral de uso nocturno, a medida. |
MED |
12 |
1.024,89 |
931,72 |
|
OTD 060B Corsé de termoplástico con sistema de presión en 3 puntos y zonas de expansión de uso nocturno (tipo Providence o similar), a medida. |
MED |
12 |
1.049,07 |
953,70 |
|
|
OTD 070 Ortesis de Kallabis. |
OTD 070A Ortesis de Kallabis de tres puntos. |
ADAP2 |
12 |
188,99 |
171,81 |
|
OTD 080 Ortesis de hiperextensión. |
OTD 080A Ortesis de hiperextensión de Jewett. |
ADAP2 |
24 |
216,37 |
196,70 |
|
OTD 080B Ortesis de hiperextensión cruciforme. |
ADAP2 |
12 |
225,37 |
204,88 |
|
|
OTD 080C Ortesis de hiperextensión basculante. |
ADAP2 |
12 |
234,37 |
213,06 |
|
|
OTD 090 Lecho postural. |
OTD 090A Lecho postural Denis Browne para escoliosis del lactante. |
ADAP1 |
12 |
442,63 |
402,39 |
|
OTD 090B Lecho postural en termoplástico, a medida previo molde. |
MED |
12 |
600,46 |
545,87 |
Subgrupo: 06 03 12 Ortesis cervicales (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OTC 000 Ortesis cervical semirrígida. |
OTC 000A Soporte cervical semirrígido en termoplástico blando con refuerzo, bivalvo, con apoyo mentoniano. |
ADAP1 |
24 |
43,20 |
39,27 |
|
OTC 010 Ortesis cervical rígida. |
OTC 010A Ortesis cervical rígida en termoplástico, con apoyo occipital y mentoniano regulable o no. |
ADAP1 |
24 |
179,28 |
162,98 |
Subgrupo: 06 03 15 Ortesis cérvico-torácicas (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OTT 000 Ortesis cervical tipo Somi. |
OTT 000A Soporte cervical tipo Somi. |
ADAP2 |
24 |
289,10 |
262,82 |
|
OTT 010 Minerva larga. |
OTT 010A Minerva larga, a medida previo molde. |
MED |
24 |
592,63 |
538,75 |
|
OTT 010B Minerva larga, prefabricada. |
ADAP2 |
24 |
410,56 |
373,24 |
|
|
OTT 020 Chaleco para halo. |
OTT 020A Chaleco para halo. |
ADAP3 |
24 |
273,85 |
248,95 |
Subgrupo: 06 03 18 Ortesis cérvico-toraco-lumbo-sacras (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OTS 000 Corsé de Milwaukee. |
OTS 000A Corsé de Milwaukee con cesta pélvica en cuero y placas correctoras, a medida. |
MED |
12 |
1.190,97 |
1.082,70 |
|
OTS 000B Corsé de Milwaukee con cesta pélvica en termoplástico y placas correctoras, a medida. |
MED |
12 |
822,82 |
748,02 |
|
|
OTS 900 Supraestructura. |
OTS 900A Supraestructura de corsé de Milwaukee adaptada a otro tipo de corsé. |
ADAP3 |
12 |
340,02 |
309,11 |
|
OTS 910 Cambio de cesta pélvica. |
OTS 910A Cesta pélvica en cuero para corsé de Milwaukee, a medida. |
MED |
12 |
850,95 |
773,59 |
|
OTS 910B Cesta pélvica en termoplástico para corsé de Milwaukee, a medida. |
MED |
12 |
482,80 |
438,91 |
Grupo: 06 06 Ortesis de miembro superior
Subgrupo: 06 06 03 Ortesis de dedos (Aportación del usuario: 12 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSD 000 Ortesis pasiva para dedo pulgar. |
OSD 000A Ortesis pasiva rígida para mantener el pulgar en oposición o abducción, prefabricada. |
ADAP1 |
24 |
68,50 |
62,27 |
|
OSD 000B Ortesis pasiva en termoplástico para mantener el pulgar en oposición o abducción, a medida. |
MED |
24 |
87,60 |
79,64 |
|
|
OSD 010 Ortesis pasiva para dedo. |
OSD 010A Ortesis pasiva rígida para inmovilización de dedo, prefabricada. |
BAS |
24 |
25,29 |
22,99 |
|
OSD 010B Ortesis pasiva en termoplástico para inmovilización de dedo, a medida. |
MED |
24 |
44,29 |
40,26 |
|
|
OSD 020 Ortesis activa para dedo pulgar. |
OSD 020A Ortesis activa para dedo pulgar, prefabricada. |
ADAP1 |
12 |
73,16 |
66,51 |
|
OSD 030 Ortesis activa flexora/extensora para dedo. |
OSD 030A Ortesis activa extensora para dedo. |
ADAP1 |
12 |
42,64 |
38,76 |
|
OSD 030B Ortesis activa flexora para dedo. |
ADAP1 |
12 |
42,64 |
38,76 |
Subgrupo: 06 06 06 Ortesis de mano (Aportación del usuario: 12 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSM 000 Ortesis pasiva para mantener las articulaciones metacarpofalángicas en una posición determinada. |
OSM 000A Ortesis pasiva para mantener las articulaciones metacarpofalángicas en una posición determinada, prefabricada. |
ADAP1 |
24 |
107,80 |
98,00 |
|
OSM 000B Ortesis pasiva para mantener las articulaciones metacarpofalángicas en una posición determinada, a medida. |
MED |
24 |
116,13 |
105,57 |
|
|
OSM 000C Ortesis pasiva progresiva para llevar las articulaciones metacarpofalángicas a una posición determinada. |
ADAP1 |
24 |
121,97 |
110,88 |
|
|
OSM 010 Ortesis activa flexora o extensora de articulaciones metacarpofalángicas. |
OSM 010A Ortesis activa extensora de articulaciones metacarpofalángicas. |
ADAP1 |
24 |
122,55 |
111,41 |
|
OSM 010B Ortesis activa flexora de articulaciones metacarpofalángicas. |
ADAP1 |
24 |
122,55 |
111,41 |
|
|
OSM 010C Ortesis activa flexora de articulaciones metacarpofalángicas y aditamento extensor de dedo/s. |
ADAP1 |
24 |
146,56 |
133,24 |
|
|
OSM 010D Ortesis activa extensora de articulaciones metacarpofalángicas y aditamento extensor/abductor del pulgar. |
ADAP1 |
24 |
148,90 |
135,36 |
|
|
OSM 010E Ortesis activa flexora de articulaciones metacarpofalángicas y aditamento extensor/abductor del pulgar. |
ADAP1 |
24 |
148,90 |
135,36 |
Subgrupo: 06 06 12 Ortesis de muñeca y mano (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSN 000 Ortesis pasiva de muñeca. |
OSN 000A Ortesis pasiva de muñeca. |
ADAP1 |
24 |
61,60 |
56,00 |
|
OSN 010 Ortesis activa de muñeca. |
OSN 010A Ortesis activa de muñeca. |
ADAP1 |
18 |
140,31 |
127,55 |
|
OSN 020 Ortesis activa flexora o extensora de las articulaciones metacarpofalángicas con estabilización de la articulación de la muñeca. |
OSN 020A Ortesis activa flexora de las articulaciones metacarpofalángicas con estabilización de la articulación de la muñeca. |
ADAP1 |
18 |
199,00 |
180,91 |
|
OSN 020B Ortesis activa extensora de las articulaciones metacarpofalángicas con estabilización de la articulación de la muñeca. |
ADAP1 |
18 |
199,00 |
180,91 |
Subgrupo: 06 06 13 Ortesis de muñeca, mano y dedos (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSU 000 Ortesis pasiva de muñeca, mano y dedo/s. |
OSU 000A Ortesis pasiva de muñeca, mano y dedo/s, prefabricada. |
ADAP2 |
24 |
125,92 |
114,47 |
|
OSU 000B Ortesis pasiva de muñeca, mano y dedo/s, a medida. |
MED |
24 |
168,98 |
153,62 |
|
|
OSU 010 Ortesis activa de muñeca, mano y dedo/s. |
OSU 010A Ortesis activa para flexión dorsal de muñeca, extensión o flexión de articulaciones metacarpofalángicas e interfalángicas, con o sin dispositivo abductor del pulgar, prefabricada. |
ADAP1 |
12 |
247,12 |
224,65 |
|
OSU 010B Ortesis activa para flexión dorsal de muñeca, extensión o flexión de articulaciones metacarpofalángicas e interfalángicas, con o sin dispositivo abductor del pulgar, a medida. |
MED |
12 |
370,80 |
337,09 |
Subgrupo: 06 06 15 Ortesis de codo (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSC 000 Ortesis pasiva de codo. |
OSC 000A Ortesis pasiva de codo sin articulación, prefabricada. |
ADAP1 |
24 |
165,57 |
150,52 |
|
OSC 000B Ortesis pasiva de codo sin articulación, a medida. |
MED |
24 |
205,78 |
187,07 |
|
|
OSC 010 Ortesis activa de codo. |
OSC 010A Ortesis activa de codo para flexión y/o extensión con articulación regulable incluida, prefabricada. |
ADAP1 |
18 |
331,89 |
301,72 |
|
OSC 010B Ortesis activa de codo para flexión y/o extensión, a medida (Prescribir además una articulación regulable a elección). |
MED |
18 |
368,39 |
334,90 |
Subgrupo: 06 06 20 Ortesis de antebrazo (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSA 000 Ortesis pasiva de antebrazo. |
OSA 000A Ortesis pasiva de antebrazo, prefabricada. |
ADAP1 |
24 |
111,24 |
101,13 |
|
OSA 000B Ortesis pasiva de antebrazo, a medida. |
MED |
24 |
169,28 |
153,89 |
Subgrupo: 06 06 24 Ortesis de hombro y codo (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSB 000 Ortesis pasiva de brazo. |
OSB 000A Ortesis pasiva para inmovilización ósea de brazo en termoplástico, prefabricada. |
ADAP1 |
24 |
151,80 |
138,00 |
|
OSB 000B Ortesis pasiva para inmovilización ósea de brazo en termoplástico, a medida. |
MED |
24 |
239,91 |
218,10 |
Subgrupo: 06 06 27 Ortesis de hombro, codo y muñeca (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSH 000 Ortesis pasiva de hombro, codo y muñeca, sin articulación. |
OSH 000A Ortesis pasiva para mantener hombro, codo y muñeca en una posición determinada. |
ADAP1 |
24 |
270,60 |
246,00 |
|
OSH 000B Ortesis pasiva para subluxación de hombro. |
ADAP1 |
24 |
132,48 |
120,44 |
|
|
OSH 010 Ortesis de hombro, codo y muñeca, con articulaciones. |
OSH 010A Ortesis pasiva de hombro, codo y muñeca con articulación de codo. |
ADAP1 |
24 |
322,73 |
293,39 |
|
OSH 010B Ortesis multiarticulada pasiva para control de articulaciones de hombro, codo y muñeca. |
ADAP1 |
24 |
496,56 |
451,42 |
|
|
OSH 010C Ortesis multiarticulada activa para control de articulaciones de hombro, codo y muñeca. |
ADAP2 |
24 |
737,00 |
670,00 |
|
|
OSH 020 Ortesis pasiva para parálisis del plexo braquial, obstétrica o infantil. |
OSH 020A Ortesis pasiva para parálisis del plexo braquial, obstétrica o infantil, prefabricada. |
ADAP2 |
12 |
231,50 |
210,45 |
|
OSH 020B Ortesis pasiva para parálisis del plexo braquial, obstétrica o infantil, a medida. |
MED |
12 |
376,17 |
341,97 |
Subgrupo: 06 06 36 Articulaciones de codo (Aportación del usuario: 0 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OSO 000 Articulación de codo |
OSO 000A Articulación de codo mecánica monocéntrica. |
COMP0 |
24 |
72,73 |
66,12 |
|
OSO 000B Articulación de codo mecánica policéntrica. |
COMP0 |
24 |
128,32 |
116,65 |
|
|
OSO 000C Articulación de codo tipo tornillo sin fin. |
COMP2 |
24 |
87,45 |
79,50 |
|
|
OSO 000D Articulación de codo tipo cremallera o rueda dentada. |
COMP0 |
24 |
195,84 |
178,04 |
|
|
OSO 000E Articulación de codo dinámica y activa. |
COMP0 |
24 |
364,73 |
331,57 |
Grupo: 06 12 Ortesis de miembro inferior (No se consideran incluidas las ortesis de pie ni las rodilleras en tejido elástico sin flejes)
Subgrupo: 06 12 06 Ortesis de tobillo y pie (tibiales) (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIT 000 Ortesis posterior pasiva tibial. |
OIT 000A Ortesis posterior pasiva tibial. |
ADAP2 |
24 |
136,06 |
123,69 |
|
OIT 010 Ortesis de Denis Browne. |
OIT 010A Ortesis Denis Browne, para menores de 3 años (Prescribir además un botín o bota). |
ADAP1 |
24 |
57,90 |
52,64 |
|
OIT 010B Ortesis Denis Browne articulada, para menores de 3 años (Prescribir además un botín o bota). |
ADAP1 |
24 |
96,54 |
87,76 |
|
|
OIT 020 Botín multiarticulado. |
OIT 020A Botín multiarticulado (unidad). |
ADAP1 |
12 |
111,14 |
101,04 |
|
OIT 030 Ortesis para inmovilización de la articulación tibio-tarsiana. |
OIT 030A Ortesis no articulada para inmovilización medio-lateral y de la flexo-extensión de la articulación tibio-tarsiana. |
ADAP1 |
24 |
110,00 |
100,00 |
|
OIT 040 Ortesis tibial de marcha en descarga. |
OIT 040A Ortesis tibial de marcha en descarga. |
ADAP1 |
24 |
259,26 |
235,69 |
|
OIT 050 Ortesis de control medio-lateral de la articulación tibio-tarsiana. |
OIT 050A Ortesis de control medio-lateral de la articulación tibio-tarsiana con dos hemivalvas y cámara de aire o gel. |
BAS |
24 |
99,72 |
90,65 |
|
OIT 050B Ortesis de control medio-lateral de la articulación tibio-tarsiana con sistema de contención. |
BAS |
24 |
53,90 |
49,00 |
|
|
OIT 050C Ortesis dinámica para ligamentos laterales del tobillo. |
BAS |
24 |
89,73 |
81,57 |
|
|
OIT 060 Ortesis dinámica antiequino. |
OIT 060A Ortesis posterior antiequino, «Rancho Los Amigos», prefabricada. |
ADAP1 |
24 |
127,26 |
115,69 |
|
OIT 060B Ortesis posterior antiequino, «Rancho Los Amigos», a medida. |
MED |
24 |
246,85 |
224,41 |
|
|
OIT 060C Ortesis antiequino, dinámica, en alambre de acero anclada a zapato. |
ADAP2 |
24 |
168,30 |
153,00 |
|
|
OIT 060D Ortesis antiequino, dinámica con tensor elástico anterior. |
BAS |
24 |
124,98 |
113,62 |
|
|
OIT 060E Bitutor de Klenzack, a medida (unidad). |
MED |
24 |
433,58 |
394,16 |
|
|
OIT 060F Ortesis tibial antiequino termoconformada, a medida. |
MED |
24 |
233,48 |
212,25 |
|
|
OIT 060G Ortesis tibial antiequino termoconformada con valva anterior, a medida. |
MED |
24 |
285,03 |
259,12 |
|
|
OIT 060H Ortesis posterior dinámica antiequino, con fleje lateral y plantilla termoplástica para interior de zapato. |
ADAP1 |
24 |
234,66 |
213,33 |
|
|
OIT 070 Ortesis dinámica antiequino tipo DAFO. |
OIT 070A Ortesis supramaleolar tipo DAFO envolvente para control de prono-supinación, con o sin dorsiflexión, para paciente neurológico infantil, a medida. |
MED |
12 |
407,61 |
370,55 |
|
OIT 070B Ortesis supramaleolar tipo DAFO envolvente en medio-pie flexible para bloqueo de flexión plantar, para paciente neurológico infantil, a medida. |
MED |
12 |
407,61 |
370,55 |
|
|
OIT 070C Ortesis supramaleolar tipo DAFO envolvente en medio-pie flexible con botín interior para bloqueo de flexión plantar, para paciente neurológico infantil, a medida. |
MED |
12 |
493,72 |
448,84 |
|
|
OIT 070D Ortesis supramaleolar tipo DAFO envolvente en medio-pie flexible con botín interior para bloqueo de flexión plantar y apoyo prepatelar, para paciente neurológico infantil, a medida. |
MED |
12 |
640,93 |
582,66 |
|
|
OIT 070E Ortesis supramaleolar tipo DAFO envolvente en medio-pie, flexible con botín interior, para bloqueo de flexión plantar, articulada, para paciente neurológico infantil, a medida. |
MED |
12 |
503,54 |
457,76 |
|
|
OIT 070F Ortesis supramaleolar tipo DAFO envolvente en medio-pie, flexible con botín interior, para bloqueo de flexión plantar, articulada, para paciente neurológico infantil con hiperextensión de rodilla, a medida. |
MED |
12 |
572,04 |
520,04 |
|
|
OIT 070G Ortesis supramaleolar tipo DAFO envolvente para control de prono-supinación, con o sin dorsiflexión, para paciente neurológico infantil, prefabricada. |
ADAP1 |
12 |
154,35 |
140,32 |
|
|
OIT 070H Ortesis supramaleolar tipo DAFO envolvente para control de prono-supinación, con bloqueo de la flexión plantar y articulación Tamarack, que asiste a la dorsiflexión, para paciente neurológico infantil, a medida. |
MED |
12 |
677,40 |
615,82 |
|
|
OIT 080 Bitutor corto. |
OIT 080A Bitutor corto, a medida (unidad) (Prescribir además, si lo precisa, una articulación de tobillo a elección). |
MED |
24 |
325,20 |
295,64 |
|
OIT 090 Polaina desde el tobillo hasta debajo de la rodilla. |
OIT 090A Polaina desde el tobillo hasta debajo de la rodilla, a medida. |
MED |
24 |
212,56 |
193,24 |
|
OIT 100 Ortesis funcional tipo PTB (Patellar Tendon Bearing). |
OIT 100A Ortesis funcional tipo PTB (Patellar TendonBearing), prefabricada. |
ADAP2 |
24 |
207,28 |
188,44 |
|
OIT 100B Ortesis funcional tipo PTB (Patellar TendonBearing), a medida. |
MED |
24 |
422,72 |
384,29 |
|
|
OIT 110 Ortesis para la descarga del pie, con apoyo de tendón rotuliano. |
OIT 110A Ortesis para la descarga del pie, con apoyo en tendón rotuliano y estribo deslizante, con alza contralateral, a medida. |
MED |
24 |
469,69 |
426,99 |
|
OIT 900 Botín. |
OIT 900A Botín de cuero moldeado para adaptar a ortesis, a medida. |
MED |
24 |
270,96 |
246,33 |
|
OIT 900B Botín para Denis Browne para menores de 3 años. |
COMP1 |
6 |
78,11 |
71,01 |
|
|
OIT 910 Bota tipo boxer para adaptar a ortesis de marcha (par). |
OIT 910A Bota tipo boxer para adaptar a ortesis de marcha. Hasta el número 23 (par). |
COMP1 |
12 |
132,00 |
120,00 |
|
OIT 910B Bota tipo boxer para adaptar a ortesis de marcha. Números 24 al 29 (par). |
COMP1 |
12 |
137,50 |
125,00 |
|
|
OIT 910C Bota tipo boxer para adaptar a ortesis de marcha. Números 30 al 33 (par). |
COMP1 |
12 |
145,20 |
132,00 |
|
|
OIT 910D Bota tipo boxer para adaptar a ortesis de marcha. Números 34 al 37 (par). |
COMP1 |
12 |
152,90 |
139,00 |
|
|
OIT 910E Bota tipo boxer para adaptar a ortesis de marcha. Números 38 y superiores (par). |
COMP1 |
12 |
159,50 |
145,00 |
|
|
OIT 920 Correa en «T» para antivalgo o antivaro. |
OIT 920A Correa en «T» para antivalgo o antivaro. |
COMP0 |
24 |
50,29 |
45,72 |
Subgrupo: 06 12 09 Ortesis de rodilla (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIR 000 Ortesis pasiva para la inmovilización de la rodilla. |
OIR 000A Ortesis pasiva para la inmovilización de rodilla sin articulación. |
BAS |
24 |
98,45 |
89,50 |
|
OIR 000B Ortesis pasiva para la inmovilización de rodilla con articulación. |
ADAP1 |
24 |
137,39 |
124,90 |
|
|
OIR 010 Ortesis para la articulación de la rodilla, con sistema de estabilización (varillas, flejes, etc.). |
OIR 010A Ortesis para la articulación de rodilla, con sistema de estabilización. |
BAS |
24 |
75,90 |
69,00 |
|
OIR 010B Ortesis para la articulación de rodilla, con sistema de estabilización y rodete rotuliano de compresión intermitente. |
BAS |
24 |
87,59 |
79,63 |
|
|
OIR 020 Ortesis de rodilla estabilizadora con articulación graduable de flexo-extensión. |
OIR 020A Ortesis de rodilla estabilizadora con articulación monocéntrica graduable de flexo-extensión. |
ADAP1 |
24 |
210,10 |
191,00 |
|
OIR 020B Ortesis de rodilla estabilizadora con articulación policéntrica graduable de flexo-extensión. |
ADAP1 |
24 |
272,59 |
247,81 |
|
|
OIR 030 Ortesis para el control mediolateral y de flexo-extensión de la rodilla. |
OIR 030A Ortesis de rodilla para control de genu recurvatum. |
ADAP1 |
24 |
377,30 |
343,00 |
|
OIR 030B Ortesis de rodilla para el control de inestabilidad mediolateral (varo-valgo). |
ADAP1 |
24 |
390,17 |
354,70 |
|
|
OIR 030C Ortesis para el control mediolateral y de flexo-extensión de la rodilla (ligamento cruzado anterior (LCA) y/o posterior (LCP)). |
ADAP1 |
24 |
417,52 |
379,56 |
|
|
OIR 030D Ortesis para el control mediolateral y/o de flexo-extensión de la rodilla, a medida, bajo protocolo. |
MED |
24 |
575,04 |
522,76 |
Subgrupo: 06 12 12 Ortesis de rodilla, tobillo y pie (femorales) (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIF 000 Ortesis de valva posterior de muslo y pierna rígida. |
OIF 000A Ortesis para extensión de rodilla mediante valva posterior de muslo, pierna y pie, con galápago de tracción sobre rodilla, en termoplástico, a medida. |
MED |
24 |
350,09 |
318,26 |
|
OIF 000B Ortesis para extensión de rodilla mediante valva posterior de muslo, pierna y pie, con dispositivo de tracción dinámica sobre rodilla, en termoplástico, a medida. |
MED |
24 |
436,67 |
396,97 |
|
|
OIF 010 Ortesis de abducción. |
OIF 010A Ortesis de abducción de tobillo a muslo con pletina graduable, a medida. |
MED |
24 |
419,79 |
381,63 |
|
OIF 020 Muslera conformada en termoplástico. |
OIF 020A Muslera conformada en termoplástico, a medida. |
MED |
24 |
215,19 |
195,63 |
|
OIF 030 Ortesis estabilizadora de rodilla. |
OIF 030A Ortesis de rodilla a pie con apoyo anterior en tendón rotuliano y supracondilar, a medida. |
MED |
24 |
381,49 |
346,81 |
|
OIF 040 Ortesis correctora dinámica genu-valgo o varo. |
OIF 040A Ortesis genu-valgo o varo, con barra externa o interna unida a bota, aro de muslo y galápago elástico para corrección dinámica (unidad), a medida. |
MED |
24 |
356,94 |
324,49 |
|
OIF 050 Ortesis de Grenier. |
OIF 050A Ortesis de Grenier con dos valvas mediales de muslo, a medida. |
MED |
24 |
326,67 |
296,97 |
|
OIF 060 Ortesis femoral QTB (Quadrilateral Thigh Bearing). |
OIF 060A Ortesis funcional QTB (Quadrilateral Thigh Bearing) en termoplástico, a medida (Prescribir además una articulación de rodilla y una articulación de tobillo a elección). |
MED |
24 |
551,86 |
501,69 |
Subgrupo: 06 12 15 Ortesis de cadera, incluyendo ortesis de abducción (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIC 000 Ortesis de inmovilización de cadera sin articulación. |
OIC 000A Ortesis de inmovilización de cadera sin articulación, a medida. |
MED |
24 |
513,12 |
466,47 |
|
OIC 000B Ortesis de inmovilización de cadera sin articulación, prefabricada. |
ADAP1 |
24 |
353,41 |
321,28 |
|
|
OIC 010 Ortesis para la displasia congénita de cadera. |
OIC 010A Ortesis para mantener caderas en abducción (tipo Frejka o similar). |
ADAP1 |
24 |
96,06 |
87,33 |
|
OIC 010B Ortesis para mantener caderas en abducción y rotación externa mediante arnés con tirantes (Arnés de Pavlik). |
ADAP1 |
12 |
132,63 |
120,57 |
|
|
OIC 010C Ortesis multiarticulada para mantener caderas en abducción y rotación externa de forma independiente. |
ADAP2 |
24 |
733,07 |
666,43 |
|
|
OIC 020 Ortesis modular desrotadora de cadera. |
OIC 020A Ortesis modular desrotadora de cadera, a medida. |
MED |
24 |
331,46 |
301,33 |
|
OIC 030 Ortesis de Atlanta (o del Hospital Scottish Rite en Atlanta). |
OIC 030A Ortesis de Atlanta (o del Hospital Scottish Rite en Atlanta), a medida. |
MED |
24 |
660,00 |
600,00 |
|
OIC 040 Ortesis modular de abducción de cadera. |
OIC 040A Ortesis modular de abducción de cadera regulable con control de la flexo-extensión. |
ADAP2 |
24 |
579,87 |
527,15 |
Subgrupo: 06 12 18 Ortesis de cadera, rodilla, tobillo y pie (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIE 000 Bitutor femoral metálico. |
OIE 000A Bitutor femoral metálico con aros, a medida (unidad) (Prescribir además articulación de rodilla y articulación de tobillo a elección y, si lo precisa, un botín). |
MED |
24 |
891,12 |
810,11 |
|
OIE 000B Bitutor femoral metálico con muslera de apoyo isquiático, a medida (unidad) (Prescribir además articulación de rodilla y articulación de tobillo a elección y, si lo precisa, un botín). |
MED |
24 |
991,99 |
901,81 |
|
|
OIE 000C Bitutor femoral metálico, con encaje cuadrangular, a medida (unidad) (Prescribir además articulación de rodilla y articulación de tobillo a elección y, si lo precisa, un botín). |
MED |
24 |
1.107,88 |
1.007,16 |
|
|
OIE 000D Bitutor femoral metálico con cinturón pélvico, a medida (unidad) (Prescribir además articulación de cadera, articulación rodilla y articulación de tobillo a elección y, si lo precisa, un botín). |
MED |
24 |
1.009,04 |
917,31 |
|
|
OIE 000E Bitutor femoral metálico con muslera de apoyo isquiático y cinturón pélvico, a medida (unidad) (Prescribir además articulación de cadera, articulación de rodilla y articulación de tobillo a elección y, si lo precisa, un botín). |
MED |
24 |
1.109,91 |
1.009,01 |
|
|
OIE 000F Bitutor femoral metálico con encaje cuadrangular y cinturón pélvico, a medida (unidad) (Prescribir además articulación de cadera, articulación rodilla y articulación de tobillo a elección y, si lo precisa, un botín). |
MED |
24 |
1.225,80 |
1.114,36 |
|
|
OIE 010 Monotutor femoral. |
OIE 010A Monotutor femoral laminado en resina con articulación de rodilla y articulación de tobillo, a medida. |
MED |
24 |
3.410,00 |
3.100,00 |
|
OIE 020 Ortesis femoral. |
OIE 020A Ortesis termoconformada al vacío desde pie a tercio proximal de muslo, a medida (TPV) (Prescribir además una articulación de rodilla y una articulación de tobillo a elección). |
MED |
24 |
790,96 |
719,05 |
|
OIE 030 Ortesis tipo Swash. |
OIE 030A Ortesis de abducción variable desrotadora femoral (tipo Swash), infantil. |
ADAP3 |
24 |
956,97 |
869,97 |
|
OIE 040 Ortesis femoral de abducción en acero de Tachdjian. |
OIE 040A Ortesis femoral de abducción de Tachdjian (unilateral) en acero, a medida, con encaje trilateral, articulación en rodilla, control de rotación, estribo de marcha, mecanismo distractor del pie y alza contralateral. |
MED |
24 |
1.200,03 |
1.090,94 |
|
OIE 050 Ortesis desrotadora femoral. |
OIE 050A Ortesis desrotadora femoral (tipo twister) (unidad). |
ADAP2 |
18 |
252,67 |
229,70 |
|
OIE 050B Ortesis desrotadora femoral en tejido elástico (unidad). |
ADAP1 |
18 |
40,70 |
37,00 |
|
|
OIE 900 Dispositivo estabilizador y reciprocador para adaptar a ortesis de marcha bilateral. |
OIE 900A Dispositivo estabilizador y reciprocador para adaptar a ortesis de marcha bilateral (Prescribir además una ortesis de marcha bilateral a elección). |
ADAP3 |
36 |
2.750,00 |
2.500,00 |
Subgrupo: 06 12 21 Articulaciones de tobillo (Aportación del usuario: 0 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIO 000 Articulación de tobillo. |
OIO 000A Articulación rígida de tobillo libre. |
COMP1 |
24 |
125,40 |
114,00 |
|
OIO 000B Articulación rígida de tobillo, con control del movimiento dorsal y plantar. |
COMP1 |
24 |
140,80 |
128,00 |
|
|
OIO 000C Articulación flexible de tobillo con asistencia del movimiento de flexión dorsal y/o plantar. |
COMP1 |
24 |
129,80 |
118,00 |
|
|
OIO 000D Articulación rígida de tobillo con asistencia dinámica del movimiento de flexión dorsal y/o plantar tipo Klenzack. |
COMP1 |
24 |
129,01 |
117,28 |
|
|
OIO 000E Articulación flexible de tobillo con asistencia del movimiento de flexión dorsal y/o plantar variable. |
COMP1 |
24 |
264,00 |
240,00 |
|
|
OIO 000F Articulación flexible de tobillo con asistencia del movimiento de flexión dorsal y/o plantar con tope posterior. |
COMP1 |
24 |
135,30 |
123,00 |
Subgrupo: 06 12 24 Articulaciones de rodilla (Aportación del usuario: 0 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIA 000 Articulación de rodilla libre. |
OIA 000A Articulación de rodilla libre. |
COMP1 |
24 |
163,19 |
148,35 |
|
OIA 000B Articulación de rodilla libre con eje desplazado. |
COMP1 |
24 |
278,40 |
253,09 |
|
|
OIA 000C Articulación de rodilla libre con asistencia a la extensión. |
COMP1 |
24 |
554,65 |
504,23 |
|
|
OIA 010 Articulación de rodilla con cierre de anillas. |
OIA 010A Articulación de rodilla con cierre de anillas. |
COMP1 |
24 |
301,80 |
274,36 |
|
OIA 020 Articulación de rodilla con cierre suizo. |
OIA 020A Articulación de rodilla con cierre suizo con o sin sistema de amortiguación. |
COMP2 |
24 |
435,11 |
395,55 |
|
OIA 030 Articulación de rodilla policéntrica. |
OIA 030A Articulación de rodilla policéntrica. |
COMP1 |
24 |
484,37 |
440,34 |
|
OIA 040 Articulación de rodilla progresiva. |
OIA 040A Articulación de rodilla progresiva dentada con bloqueo en la flexión. |
COMP1 |
24 |
580,80 |
528,00 |
Subgrupo: 06 12 27 Articulaciones de cadera (Aportación del usuario: 0 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OID 000 Articulación de cadera libre. |
OID 000A Articulación de cadera libre, en acero. |
COMP1 |
24 |
264,29 |
240,26 |
|
OID 000B Articulación de cadera libre, en acero, con movimiento de abducción. |
COMP1 |
24 |
324,86 |
295,33 |
|
|
OID 010 Articulación de cadera con cierre de anillas. |
OID 010A Articulación de cadera con cierre de anillas. |
COMP1 |
24 |
254,43 |
231,30 |
|
OID 010B Articulación de cadera con cierre de anillas y movimiento de abducción. |
COMP1 |
24 |
324,86 |
295,33 |
Subgrupo 06 12 90: Recambios y componentes para ortesis de miembro inferior (Aportación del usuario: 0 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OIS 900 Recambios y componentes para ortesis de miembro inferior. |
OIS 900A Cinturón pélvico para ortesis de miembro inferior. |
COMP0 |
24 |
117,92 |
107,20 |
|
OIS 900B Cinturón pélvico con soporte glúteo. |
COMP0 |
24 |
160,36 |
145,78 |
|
|
OIS 900C Barra para ortesis de miembro inferior. |
COMP0 |
24 |
23,61 |
21,46 |
|
|
OIS 900D Estribo para ortesis de miembro inferior. |
COMP0 |
24 |
63,27 |
57,52 |
|
|
OIS 900E Galápago, prefabricado. |
COMP0 |
18 |
17,07 |
15,52 |
|
|
OIS 900F Galápago, a medida. |
MED |
24 |
110,00 |
100,00 |
Grupo: 06 33 Calzados ortopédicos
Subgrupo: 06 33 90 Calzados ortopédicos para grandes deformidades (Aportación del usuario: 36 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
OCO 000 Calzado de plastazote, licra, fibra elástica o similar (par). |
OCO 000A Calzado ortopédico en plastazote, licra, fibra elástica o similar para deformidades en pies diabéticos, artríticos y neuropáticos (par). |
BAS |
12 |
97,93 |
89,03 |
|
OCO 010 Calzado a medida. |
OCO 010A Calzado ortopédico, a medida, previo molde, para grandes deformidades (par). |
MED |
12 |
728,56 |
662,33 |
10. Ortoprótesis especiales
Grupo: 12 03 Productos de apoyo para caminar manejados por un brazo
Subgrupo: 12 03 09 Muletas de codo con soporte en antebrazo (Aportación del usuario: 12 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EMS 000 Muleta con soporte en antebrazo y empuñadura anatómica. |
EMS 000A Muleta con soporte en antebrazo y empuñadura anatómica con o sin abrazadera (unidad). |
BAS |
36 |
23,82 |
21,65 |
Subgrupo: 12 03 16 Muletas con tres o más patas (Aportación del usuario: 12 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EMT 000 Muleta con tres o más patas. |
EMT 000A Muleta con tres o más patas. |
BAS |
36 |
44,97 |
40,88 |
Grupo: 12 06 Productos de apoyo para caminar manejados por los dos brazos
Subgrupo: 12 06 00 Andadores (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EAN 000 Andador sin ruedas. |
EAN 000A Andador fijo regulable en altura. |
BAS |
36 |
75,53 |
68,66 |
|
EAN 000B Andador plegable de altura regulable. |
BAS |
36 |
82,40 |
74,91 |
|
|
EAN 000C Andador deambulador plegable de altura regulable. |
BAS |
36 |
104,46 |
94,96 |
|
|
EAN 010 Andador con ruedas. |
EAN 010A Andador de ruedas delanteras y tacos traseros, para niños y adultos. |
BAS |
36 |
93,91 |
85,37 |
|
EAN 010B Andador de ruedas delanteras y tacos traseros con asiento, para niños y adultos. |
BAS |
36 |
101,48 |
92,25 |
|
|
EAN 010C Andador con ruedas delanteras giratorias y traseras con freno, con o sin asiento (rollator), para niños y adultos. |
BAS |
36 |
130,52 |
118,65 |
|
|
EAN 020 Andador con control postural de tronco y pelvis. |
EAN 020A Andador con control postural de tronco y pelvis, graduable en altura y con freno, para niños y adultos. |
ADAP2 |
36 |
1.414,01 |
1.285,46 |
|
EAN 030 Andador anteroposterior. |
EAN 030A Andador anteroposterior graduable en altura, con asiento abatible y freno, para niños y adultos. |
ADAP2 |
36 |
837,36 |
761,24 |
Grupo: 04 06 Productos para la terapia del linfedema
Subgrupo: 04 06 06 Prendas de compresión para brazos, piernas y otras partes del cuerpo para linfedemas de miembros superiores, linfedemas graves de miembros inferiores y linfedemas de tronco (se podrán indicar dos unidades de cada producto en cada prescripción) (Aportación del usuario: 30 euros)
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EPL 000 Soporte de cuello para linfedema. |
EPL 000A Soporte de cuello para linfedema, a medida. |
MED |
6 |
132,41 |
120,37 |
|
EPL 010 Máscara para linfedema. |
EPL 010A Máscara abierta para linfedema, a medida. |
MED |
6 |
313,98 |
285,44 |
|
EPL 010B Máscara abierta con banda labial para linfedema, a medida. |
MED |
6 |
334,36 |
303,96 |
|
|
EPL 010C Máscara con apertura para ojos, nariz y boca para linfedema, a medida. |
MED |
6 |
421,27 |
382,97 |
|
|
EPL 020 Camiseta para linfedema. |
EPL 020A Camiseta sin mangas para linfedema de tronco, a medida. |
MED |
6 |
278,93 |
253,57 |
|
EPL 020B Camiseta con mangas largas para linfedema de tronco, a medida. |
MED |
6 |
469,49 |
426,81 |
|
|
EPL 030 Soporte de mama para afectación linfática. |
EPL 030A Soporte de mama para afectación linfática, prefabricado. |
ADAP1 |
6 |
140,00 |
127,27 |
|
EPL 040 Guantelete y guante para linfedema. |
EPL 040A Guantelete para linfedema, a medida. |
MED |
6 |
52,53 |
47,75 |
|
EPL 040B Guantelete para linfedema, prefabricado. |
COMP0 |
6 |
31,74 |
28,85 |
|
|
EPL 040C Guante sin protección distal para linfedema, a medida. |
MED |
6 |
150,07 |
136,43 |
|
|
EPL 040D Guante sin protección distal para linfedema, prefabricado. |
ADAP1 |
6 |
125,85 |
114,41 |
|
|
EPL 040E Guante con protección distal para linfedema, a medida. |
MED |
6 |
157,61 |
143,28 |
|
|
EPL 040F Guante hasta el codo sin protección distal para linfedema, a medida. |
MED |
6 |
175,25 |
159,32 |
|
|
EPL 040G Guante hasta el codo con protección distal para linfedema, a medida. |
MED |
6 |
181,21 |
164,74 |
|
|
EPL 050 Manga para linfedema. |
EPL 050A Manga para linfedema, a medida. |
MED |
6 |
108,70 |
98,82 |
|
EPL 050B Manga para linfedema, prefabricada. |
COMP0 |
6 |
105,60 |
96,00 |
|
|
EPL 050C Manga con guantelete para linfedema, a medida. |
MED |
6 |
147,94 |
134,49 |
|
|
EPL 050D Manga con guantelete para linfedema, prefabricada. |
ADAP1 |
6 |
109,69 |
99,72 |
|
|
EPL 050E Manga con guante para linfedema, a medida. |
MED |
6 |
232,57 |
211,43 |
|
|
EPL 050F Manga abarcando el hombro para linfedema, a medida. |
MED |
6 |
154,47 |
140,43 |
|
|
EPL 050G Manga abarcando el hombro para linfedema, prefabricada. |
ADAP1 |
6 |
121,79 |
110,72 |
|
|
EPL 050H Manga abarcando el hombro con guantelete para linfedema, a medida. |
MED |
6 |
213,66 |
194,24 |
|
|
EPL 050I Manga abarcando el hombro con guantelete para linfedema, prefabricada. |
ADAP1 |
6 |
174,96 |
159,05 |
|
|
EPL 050J Manga abarcando el hombro con guante para linfedema, a medida. |
MED |
6 |
298,73 |
271,57 |
|
|
EPL 060 Guante con dedos para pie para linfedema. |
EPL 060A Guante sin protección distal para pie para linfedema, a medida. |
MED |
6 |
149,67 |
136,06 |
|
EPL 060B Guante con protección distal para pie para linfedema, a medida. |
MED |
6 |
152,14 |
138,31 |
|
|
EPL 070 Media para linfedema. |
EPL 070A Media hasta la rodilla para linfedema, a medida. |
MED |
6 |
106,82 |
97,11 |
|
EPL 070B Media hasta la rodilla para linfedema, prefabricada. |
ADAP1 |
6 |
84,44 |
76,76 |
|
|
EPL 070C Media entera para linfedema, a medida. |
MED |
6 |
165,44 |
150,40 |
|
|
EPL 070D Media entera para linfedema, prefabricada. |
ADAP1 |
6 |
109,14 |
99,22 |
|
|
EPL 070E Media entera con sujeción a la cintura para linfedema, a medida. |
MED |
6 |
173,03 |
157,30 |
|
|
EPL 080 Panty para linfedema. |
EPL 080A Panty de una extremidad para linfedema, a medida. |
MED |
6 |
282,15 |
256,50 |
|
EPL 080B Panty de una extremidad para linfedema, prefabricado. |
ADAP1 |
6 |
246,63 |
224,21 |
|
|
EPL 080C Panty (de dos piernas) para linfedema, a medida. |
MED |
6 |
353,67 |
321,52 |
|
|
EPL 080D Panty (de dos piernas) para linfedema, prefabricado. |
ADAP1 |
6 |
319,06 |
290,05 |
|
|
EPL 090 Pantalón para linfedema. |
EPL 090A Pantalón de pernera corta para linfedema, a medida. |
MED |
6 |
251,82 |
228,93 |
|
EPL 090B Pantalón para linfedema, a medida. |
MED |
6 |
309,79 |
281,63 |
El IMF de los tipos de productos a medida del subgrupo 04 06 06 hace referencia a la fabricación de dichos productos en tejido circular. En caso de que se prescriba tejido plano, el correspondiente IMF se incrementará en un 15 %.
Grupo: 04 07 Productos para la prevención y tratamiento de cicatrices patológicas
Subgrupo: 04 07 00 Prendas de compresión para brazos, piernas y otras partes del cuerpo para quemados y grandes queloides (se podrán indicar dos unidades de cada producto en cada prescripción) (Aportación del usuario: 30 euros)
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EPQ 000 Soporte de cuello y/o mentón para quemados y grandes queloides |
EPQ 000A Soporte de cuello para quemados y grandes queloides, a medida |
MED |
6 |
132,41 |
120,37 |
|
EPQ 000B Soporte de mentón para quemados y grandes queloides, a medida |
MED |
6 |
174,10 |
158,27 |
|
|
EPQ 000C Soporte de cuello y mentón para quemados y grandes queloides, a medida |
MED |
6 |
245,50 |
223,18 |
|
|
EPQ 010 Máscara para quemados y grandes queloides |
EPQ 010A Máscara abierta para quemados y grandes queloides, a medida |
MED |
6 |
313,98 |
285,44 |
|
EPQ 010B Máscara abierta con banda labial para quemados y grandes queloides, a medida |
MED |
6 |
334,36 |
303,96 |
|
|
EPQ 010C Máscara con apertura para ojos, nariz y boca para quemados y grandes queloides, a medida |
MED |
6 |
421,27 |
382,97 |
|
|
EPQ 010D Máscara de termoplástico con silicona para quemados y grandes queloides, a medida |
MED |
6 |
1.277,46 |
1.161,33 |
|
|
EPQ 020 Camiseta para quemados y grandes queloides |
EPQ 020A Camiseta sin mangas para quemados y grandes queloides, a medida |
MED |
6 |
278,93 |
253,57 |
|
EPQ 020B Camiseta con mangas cortas para quemados y grandes queloides, a medida |
MED |
6 |
419,54 |
381,40 |
|
|
EPQ 020C Camiseta con mangas largas para quemados y grandes queloides, a medida |
MED |
6 |
469,49 |
426,81 |
|
|
EPQ 030 Tronco para quemados y grandes queloides |
EPQ 030A Tronco sin mangas para quemados y grandes queloides, a medida |
MED |
6 |
472,20 |
429,27 |
|
EPQ 030B Tronco con mangas cortas para quemados y grandes queloides, a medida |
MED |
6 |
567,47 |
515,88 |
|
|
EPQ 030C Tronco con mangas largas para quemados y grandes queloides, a medida |
MED |
6 |
580,35 |
527,59 |
|
|
EPQ 040 Guantelete y guante para quemados y grandes queloides |
EPQ 040A Guantelete para quemados y grandes queloides, a medida |
MED |
6 |
52,53 |
47,75 |
|
EPQ 040B Guante sin protección distal para quemados y grandes queloides, a medida |
MED |
6 |
150,07 |
136,43 |
|
|
EPQ 040C Guante con protección distal para quemados y grandes queloides, a medida |
MED |
6 |
157,61 |
143,28 |
|
|
EPQ 040D Guante hasta el codo sin protección distal para quemados y grandes queloides, a medida |
MED |
6 |
175,25 |
159,32 |
|
|
EPQ 040E Guante hasta el codo con protección distal para quemados y grandes queloides, a medida |
MED |
6 |
181,21 |
164,74 |
|
|
EPQ 050 Manga para quemados y grandes queloides |
EPQ 050A Manga para quemados y grandes queloides, a medida |
MED |
6 |
108,70 |
98,82 |
|
EPQ 050B Manga con guantelete para quemados y grandes queloides, a medida |
MED |
6 |
147,94 |
134,49 |
|
|
EPQ 050C Manga con guante para quemados y grandes queloides, a medida |
MED |
6 |
232,57 |
211,43 |
|
|
EPQ 050D Manga abarcando el hombro para quemados y grandes queloides, a medida |
MED |
6 |
154,47 |
140,43 |
|
|
EPQ 050E Manga abarcando el hombro con guantelete para quemados y grandes queloides, a medida |
MED |
6 |
213,66 |
194,24 |
|
|
EPQ 050F Manga abarcando el hombro con guante para quemados y grandes queloides, a medida |
MED |
6 |
298,73 |
271,57 |
|
|
EPQ 060 Guante con dedos para pie para quemados y grandes queloides |
EPQ 060A Guante con dedos sin protección distal para pie para quemados y grandes queloides, a medida |
MED |
6 |
149,67 |
136,06 |
|
EPQ 060B Guante con dedos con protección distal para pie para quemados y grandes queloides, a medida |
MED |
6 |
152,14 |
138,31 |
|
|
EPQ 070 Media para quemados y grandes queloides |
EPQ 070A Media hasta la rodilla para quemados y grandes queloides, a medida |
MED |
6 |
106,82 |
97,11 |
|
EPQ 070B Media entera para quemados y grandes queloides, a medida |
MED |
6 |
165,44 |
150,40 |
|
|
EPQ 070C Media entera con sujeción a la cintura para quemados y grandes queloides, a medida |
MED |
6 |
173,03 |
157,30 |
|
|
EPQ 080 Panty para quemados y grandes queloides |
EPQ 080A Panty de una extremidad para quemados y grandes queloides, a medida |
MED |
6 |
282,15 |
256,50 |
|
EPQ 080B Panty (de dos piernas) para quemados y grandes queloides, a medida |
MED |
6 |
353,67 |
321,52 |
|
|
EPQ 090 Pantalón para quemados y grandes queloides |
EPQ 090A Pantalón de pernera corta para quemados y grandes queloides, a medida |
MED |
6 |
251,82 |
228,93 |
|
EPQ 090B Pantalón para quemados y grandes queloides, a medida |
MED |
6 |
309,79 |
281,63 |
|
|
EPQ 100 Tobillera para quemados y grandes queloides |
EPQ 100A Tobillera para quemados y grandes queloides, a medida |
MED |
6 |
82,96 |
75,42 |
El IMF de los tipos de productos del subgrupo 04 07 00, excepto en el caso de la máscara de termoplástico, hace referencia a la fabricación de dicho producto en tejido circular. En caso de que se prescriba tejido plano, el correspondiente IMF se incrementará en un 15 %.
Grupo: 04 90 Complementos para las prendas de compresión
Subgrupo: 04 90 00 Complementos para las prendas de compresión (para linfedema, quemados y grandes queloides) (Aportación del usuario: 0 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EPC 000 Cierre para prendas de compresión. |
EPC 000A Cierre de cremallera, a medida. |
MED |
6 |
30,42 |
27,65 |
|
EPC 000B Cierre de corchetes, a medida. |
MED |
6 |
18,46 |
16,78 |
|
|
EPC 000C Cierre de velcro, a medida. |
MED |
6 |
17,99 |
16,35 |
|
|
EPC 010 Adaptaciones para prendas de compresión. |
EPC 010A Apertura de mamas, a medida. |
MED |
6 |
18,46 |
16,78 |
|
EPC 010B Confección de copas, a medida. |
MED |
6 |
14,47 |
13,15 |
|
|
EPC 010C Confección de bolsa escrotal, a medida. |
MED |
6 |
55,00 |
50,00 |
|
|
EPC 010D Adaptación anatómica articular, a medida. |
MED |
6 |
23,67 |
21,52 |
|
|
EPC 010E Adaptación textil, a medida. |
MED |
6 |
34,13 |
31,03 |
|
|
EPC 010F Inserción de bolsillo, a medida. |
MED |
6 |
35,00 |
31,82 |
|
|
EPC 010G Almohadillas linfáticas, a medida. |
MED |
6 |
33,69 |
30,63 |
|
|
EPC 020 Otros complementos para prendas de compresión. |
EPC 020A Banda proximal de sujeción para prendas de compresión para linfedema, a medida. |
MED |
6 |
36,52 |
33,20 |
|
EPC 020B Soporte de silicona para quemados y grandes queloides, a medida. |
MED |
6 |
16,96 |
15,42 |
Grupo: 04 33 Productos de apoyo para la prevención de las úlceras por presión (Productos antidecúbitos)
Subgrupo: 04 33 00 Cojines para prevenir las úlceras por presión (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
ECJ 000 Cojín para prevenir las úlceras por presión, de una sola pieza de silicona, gel u otros materiales. |
ECJ 000A Cojín para prevenir las úlceras por presión, de una sola pieza de silicona, gel u otros materiales, para usuarios de sillas de ruedas con alto riesgo de úlcera por presión. |
BAS |
36 |
115,97 |
105,43 |
|
ECJ 010 Cojín para prevenir las úlceras por presión, modular, de diferentes materiales con base firme. |
ECJ 010A Cojín para prevenir las úlceras por presión, modular, de diferentes materiales con base firme, para usuarios de sillas de ruedas con patología medular de cualquier etiología o daño cerebral adquirido. |
ADAP1 |
36 |
355,47 |
323,15 |
|
ECJ 020 Cojín para prevenir las úlceras por presión, con múltiples celdas de aire, u otros materiales, independientes unidas por una base. |
ECJ 020A Cojín para prevenir las úlceras por presión, con múltiples celdas de aire u otros materiales, independientes unidas por una base, para usuarios de sillas de ruedas con patología medular de cualquier etiología o daño cerebral adquirido. |
ADAP1 |
36 |
677,77 |
616,15 |
Grupo: 04 48 Equipo para el entrenamiento del movimiento, la fuerza y el equilibrio para pacientes lesionados medulares, parálisis cerebral, traumatismos craneoencefálicos, mielomeningocele, distrofias musculares progresivas y enfermedades neurodegenerativas.
Subgrupo: 04 48 06 Aparatos de bipedestación (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EBI 000 Aparato de bipedestación. |
EBI 000A Bipedestador de niño. |
ADAP1 |
24 |
1.705,80 |
1.550,73 |
|
EBI 000B Bipedestador de adulto. |
ADAP1 |
36 |
2.282,91 |
2.075,37 |
Subgrupo: 04 48 21 Planos inclinables (Aportación del usuario: 30 euros).
|
Categorías (Código homologado y descripción) |
Tipos de productos (Código y descripción) |
Elaboración |
Vida media – Meses |
IMF |
IMF si |
|---|---|---|---|---|---|
|
EPI 000 Plano inclinado. |
EPI 000A Plano inclinado prono/supino para niños. |
ADAP1 |
36 |
1.769,27 |
1.608,43 |
ADAP = Adaptación individualizada al usuario (ADAP1: de complejidad baja, ADAP2: de complejidad media, ADAP3: de complejidad alta).
BAS = Ajuste básico al usuario.
COMP = Componentes, accesorios o recambios (COMP0: componente constituyente de una ortoprótesis externa, accesorio o recambio de complejidad básica; COMP1: de complejidad baja; COMP2: de complejidad media; COMP3: de complejidad alta).
IMF si = Importe máximo de financiación sin impuestos.
MED = Elaboración individualizada (producto a medida). No se ofertarán los productos correspondientes a estos tipos por estar elaborados a medida.
SP = Tipo de producto sin IMF. Los productos de este tipo se financiarán al precio de Oferta, que en el caso de los productos a medida es el que refleje el establecimiento dispensador en la factura.»



1. Cada producto ortoprotésico incluido en la Oferta se identificará de forma inequívoca mediante un precinto que deberá reunir las siguientes características:
a) El precinto irá en la parte exterior, será autoadhesivo y extraíble, de modo que pueda ser utilizado como comprobante de la dispensación.
b) Las características del precinto serán tales que al separarlo no se produzca deterioro del producto y en el espacio en el que estaba ubicado quede la siguiente frase con caracteres bien legibles: «DISPENSADO AL SNS». Tipo de letras: Arial 13 negrita de color rojo, pantone número 032, y con inclinación de texto 30º.
c) Se procurará que la ubicación del precinto sea en una zona lo más visible posible del producto y que esté dispuesto de forma que no se impida o dificulte la lectura, es decir, evitar que esté situado en una arista para que no se doble o en una zona de fácil roce para que no se deteriore, etc.
d) Tendrá dos partes diferenciadas (zonas A y B) entre las que no existirá línea divisoria alguna ni señal impresa.
e) La zona A (parte superior) contendrá la siguiente información en letra negra:
i. Primera línea: Leyenda que indique: «SNS» (ajustado a la izquierda) y el código del tipo de producto notificado en la resolución mediante la que se acepte su inclusión en la Oferta (ajustado a la derecha).
ii. Segunda línea: Nombre de la empresa (ajustado a la izquierda).
iii. Tercera línea: Nombre del producto (ajustado a la izquierda) con el que figura en la Oferta, que en caso necesario, podrá abreviarse.
iv. Cuarta línea: Código identificativo del producto asignado por la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia en la resolución mediante la que se acepte su inclusión en la Oferta, precedido de las siglas C.I. (centrado).
f) La zona B (parte inferior) quedará libre, en previsión de que en un futuro pueda incorporarse por resolución de la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, un código de lectura lineal o bidimensional, u otro con las debidas garantías de estandarización.
g) Todo el precinto llevará un fondo de seguridad con mensaje encriptado con el texto «SNS», que se leerá con una lente decodificadora. El fondo será contiguo de diseño de línea fina, en pantone 333 sobre soporte blanco.
h) Además, la zona A estará dotada de las siguientes medidas de seguridad:
i. Leyenda visible únicamente a la luz ultravioleta, de forma cruzada al texto, en la que figure repetidas veces «SNS» con fuente Time Bold de 12 puntos y 45º de inclinación.
ii. Texto en microimpresión situado junto al borde lateral derecho de la zona A en el que figure la leyenda «SNS» repetida con un cuerpo de 240 micras.
i) Las dimensiones del precinto autoadhesivo serán de 34 mm de ancho por 25 mm de alto:
Zona A: Ancho 34 mm, alto 13 mm.
Zona B: Ancho 34 mm, alto 12 mm.
Ejemplo de precinto identificativo autoadhesivo para los productos incluidos en la Oferta
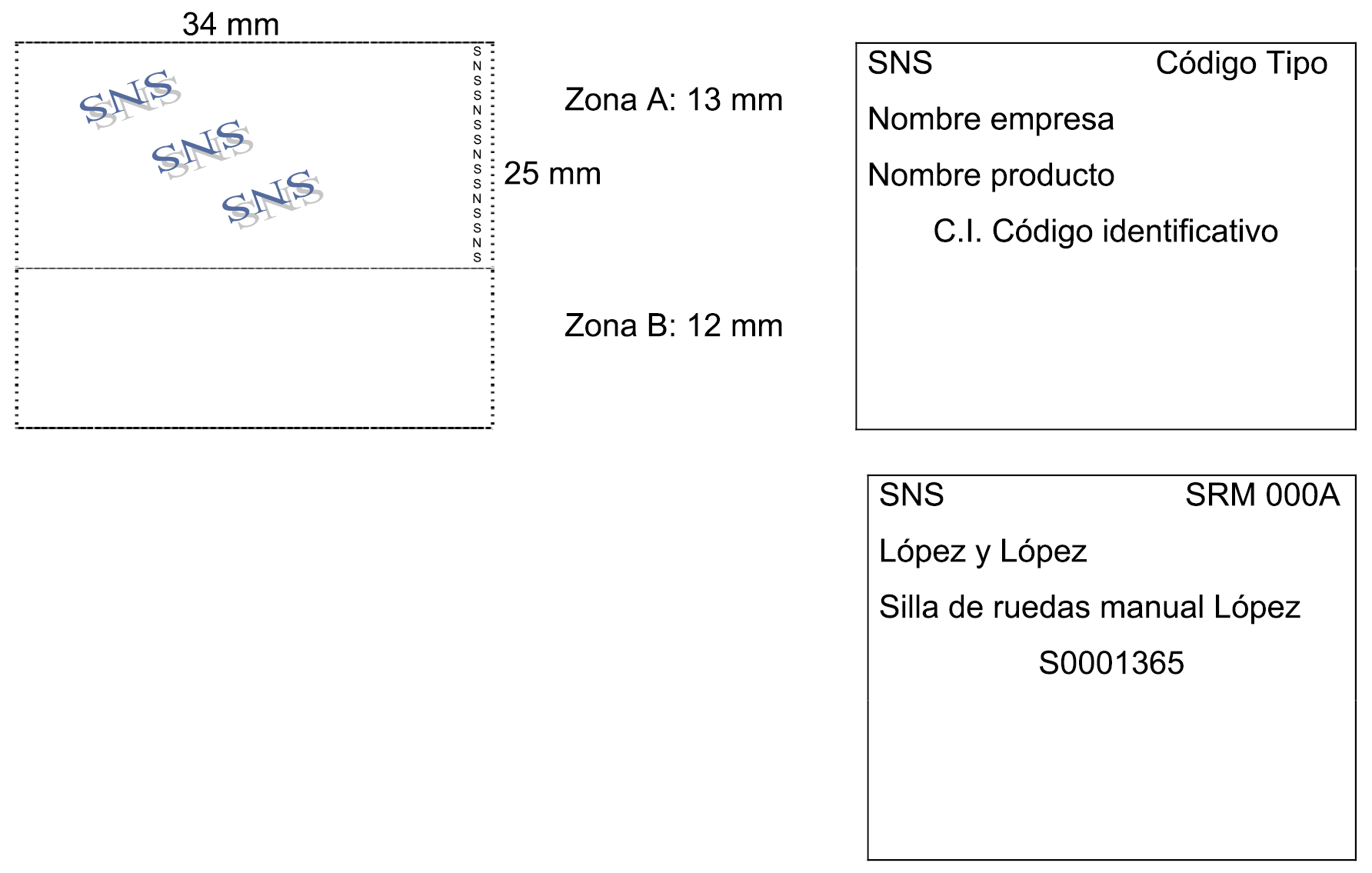
2. Los productos comunicados a la Oferta no llevarán precinto identificativo ni ningún dato que haga alusión a la financiación por el Sistema Nacional de Salud, pero utilizarán una etiqueta autoadhesiva en la que constará el código que les sea asignado por la Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, precedido de las siglas C.I. (centrado) y debajo, alineado a la izquierda, el nombre de la empresa, el nombre del producto y el código del tipo de producto notificado en la resolución de aceptación de la comunicación. Esta etiqueta tendrá unas dimensiones de 34 mm de ancho por 25 mm de alto, con fondo blanco y texto en negro.
Ejemplo de etiqueta autoadhesiva
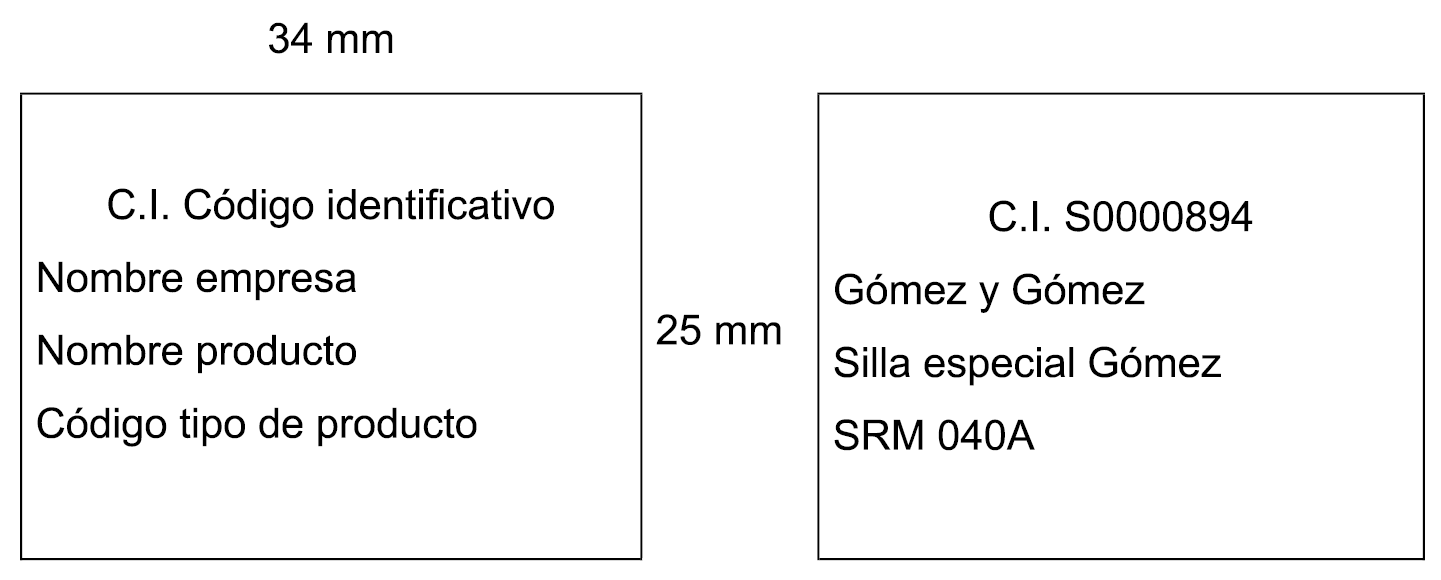
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid