Contingut no disponible en valencià
LA COMISIÓN EUROPEA,
Visto el Tratado de Funcionamiento de la Unión Europea,
Visto el Reglamento (UE) 2017/625 del Parlamento Europeo y del Consejo, de 15 de marzo de 2017, relativo a los controles y otras actividades oficiales realizados para garantizar la aplicación de la legislación sobre alimentos y piensos, y de las normas sobre salud y bienestar de los animales, sanidad vegetal y productos fitosanitarios, y por el que se modifican los Reglamentos (CE) n.o 999/2001, (CE) n.o 396/2005, (CE) n.o 1069/2009, (CE) n.o 1107/2009, (UE) n.o 1151/2012, (UE) n.o 652/2014, (UE) 2016/429 y (UE) 2016/2031 del Parlamento Europeo y del Consejo, los Reglamentos (CE) n.o 1/2005 y (CE) n.o 1099/2009 del Consejo, y las Directivas 98/58/CE, 1999/74/CE, 2007/43/CE, 2008/119/CE y 2008/120/CE del Consejo, y por el que se derogan los Reglamentos (CE) n.o 854/2004 y (CE) n.o 882/2004 del Parlamento Europeo y del Consejo, las Directivas 89/608/CEE, 89/662/CEE, 90/425/CEE, 91/496/CEE, 96/23/CE, 96/93/CE y 97/78/CE del Consejo y la Decisión 92/438/CEE del Consejo (Reglamento sobre controles oficiales) (1), y en particular su artículo 34, apartado 6, párrafo primero, letra a),
Considerando lo siguiente:
|
(1) |
El Reglamento (CE) n.o 152/2009 de la Comisión (2) establece los métodos de análisis utilizados en apoyo de los controles oficiales para hacer cumplir la prohibición del uso de proteína animal elaborada en piensos para animales destinados a la producción de alimentos. Entre ellos se incluyen los métodos de los análisis para la determinación de componentes de origen animal con fines de control oficial de los piensos, que se describen en el anexo VI de dicho Reglamento y que se realizan por microscopía óptica o por reacción en cadena de la polimerasa (RCP). |
|
(2) |
El uso de proteína animal transformada derivada de insectos de granja ha sido autorizado en los piensos para animales de acuicultura por el Reglamento (UE) 2017/893 de la Comisión (3) y en los piensos para porcinos y aves de corral por el Reglamento (UE) 2021/1372 de la Comisión (4), pero sigue estando prohibido en virtud del Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo (5) en determinados piensos, en particular en los piensos para rumiantes. |
|
(3) |
El laboratorio de referencia de la Unión Europea para las proteínas animales en los piensos ha desarrollado y validado un protocolo especial, que incluye una fase de sedimentación doble, que garantiza la detección de partículas de invertebrados terrestres, incluidos los insectos, si están presentes en los materiales para piensos, los piensos compuestos y las premezclas sometidos a ensayo en laboratorio. Con esta fase adicional, dicho protocolo debe utilizarse en el marco de los controles oficiales para verificar el correcto cumplimento de la prohibición del uso de proteína animal transformada de insectos en determinados piensos para animales destinados a la producción de alimentos. |
|
(4) |
Por consiguiente, la descripción del método de microscopía óptica que figura en el anexo VI del Reglamento (CE) n.o 152/2009 debe ajustarse para incluir una fase de sedimentación doble en el protocolo de preparación de las muestras que deben someterse a ensayo para detectar componentes procedentes de invertebrados terrestres. |
|
(5)
(6) |
Procede, por tanto, modificar el anexo VI del Reglamento (CE) n.o 152/2009 en consecuencia.
Las medidas previstas en el presente Reglamento se ajustan al dictamen del Comité Permanente de Vegetales, Animales, Alimentos y Piensos. |
HA ADOPTADO EL PRESENTE REGLAMENTO:
El anexo VI del Reglamento (CE) n.o 152/2009 se modifica de conformidad con el anexo del presente Reglamento.
El presente Reglamento entrará en vigor a los veinte días de su publicación en el Diario Oficial de la Unión Europea.
El presente Reglamento será obligatorio en todos sus elementos y directamente aplicable en cada Estado miembro.
Hecho en Bruselas, el 7 de junio de 2022.
Por la Comisión
La Presidenta
Ursula VON DER LEYEN
(1) DO L 95 de 7.4.2017, p. 1.
(2) Reglamento (CE) n.o 152/2009 de la Comisión, de 27 de enero de 2009, por el que se establecen los métodos de muestreo y análisis para el control oficial de los piensos (DO L 54 de 26.2.2009, p. 1).
(3) Reglamento (UE) 2017/893 de la Comisión, de 24 de mayo de 2017, que modifica los anexos I y IV del Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo y los anexos X, XIV y XV del Reglamento (UE) n.o 142/2011 de la Comisión por lo que se refiere a las disposiciones sobre proteína animal transformada (DO L 138 de 25.5.2017, p. 92).
(4) Reglamento (UE) 2021/1372 de la Comisión, de 17 de agosto de 2021, por el que se modifica el anexo IV del Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo en lo que respecta a la prohibición de alimentar a animales de granja no rumiantes, distintos de los animales de peletería, con proteínas derivadas de animales (DO L 295 de 18.8.2021, p. 1).
(5) Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo, de 22 de mayo de 2001, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (DO L 147 de 31.5.2001, p. 1).
El anexo VI del Reglamento (CE) n.o 152/2009 se modifica como sigue:
1) El punto 1 se sustituye por el texto siguiente:
|
|
«1. Objeto y ámbito de aplicación Los componentes de origen animal presentes en los piensos se determinarán por microscopía óptica o por reacción en cadena de la polimerasa (RCP) de conformidad con las disposiciones establecidas en el presente anexo. Estos dos métodos permiten detectar la presencia de componentes de origen animal en las premezclas, los materiales para piensos y los piensos compuestos. Sin embargo, no permiten calcular la cantidad de dichos componentes en los materiales para las premezclas, los piensos y los piensos compuestos. Ambos métodos presentan un límite de detección inferior al 0,1 % (p/p). El método RCP permite identificar los grupos taxonómicos de los componentes de origen animal presentes en las premezclas, los materiales para piensos y los piensos compuestos. Estos métodos se aplicarán al control de la aplicación de las prohibiciones establecidas en el artículo 7, apartado 1, del Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo (*) y en el anexo IV de dicho Reglamento, así como en el artículo 11, apartado 1, del Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo (**). Dependiendo del tipo de piensos que se esté analizando, podrán utilizarse estos métodos, dentro de un único protocolo de actuación, ya sea solos o combinados de conformidad con los procedimientos normalizados de trabajo (PNT) establecidos por el laboratorio de referencia de la UE para las proteínas animales en los piensos (EURL-AP) y publicados en su sitio web (***). (*) Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo, de 22 de mayo de 2001, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (DO L 147 de 31.5.2001, p. 1)." (**) Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo, de 21 de octubre de 2009, por el que se establecen las normas sanitarias aplicables a los subproductos animales y los productos derivados no destinados al consumo humano y por el que se deroga el Reglamento (CE) n.o 1774/2002 (Reglamento sobre subproductos animales) (DO L 300 de 14.11.2009, p. 1)." (***) https://www.eurl.craw.eu/legal-sources-and-sops/method-of-reference-and-sops/.»." |
2) El punto 2.1 se sustituye por el texto siguiente:
|
|
«2.1. Microscopía óptica 2.1.1. Principio Los componentes de origen animal que pudieran estar presentes en las premezclas, los materiales para piensos y los piensos compuestos enviados para su análisis se identifican sobre la base de unas características típicas microscópicamente identificables, como fibras musculares y otras partículas de carne, cartílago, huesos, cuerno, pelo, cerdas, fragmentos cuticulares de invertebrados, estructuras traqueales de insectos, sustancias sanguíneas, glóbulos lácteos, cristales de lactosa, plumas, cáscaras de huevo, espinas y escamas de pescado. Los exámenes microscópicos se realizarán tras la preparación de las muestras por sedimentación. Las muestras se someterán a una fase de sedimentación como sigue: a) para la detección de componentes de origen animal distintos de los procedentes de invertebrados terrestres, una fase de sedimentación única en tetracloroetileno (TCE), tal como se detalla en el punto 2.1.3.4.3; b) para la detección de componentes procedentes de invertebrados terrestres, una fase de doble sedimentación de éter de petróleo/tetracloroetileno (PE/TCE), tal como se detalla en el punto 2.1.3.4.4. 2.1.2. Reactivos y equipo 2.1.2.1. Reactivos 2.1.2.1.1. Agente de concentración
2.1.2.1.2. Reactivo de tinción
2.1.2.1.3. Medios de montaje
2.1.2.1.4. Medios de montaje con propiedades de tinción
2.1.2.1.5. Agentes de lavado
2.1.2.1.6. Reactivo decolorante
2.1.2.2. Equipo
2.1.3. Muestreo y preparación de las muestras 2.1.3.1. Muestreo Se utilizará una muestra representativa tomada de conformidad con el anexo I. 2.1.3.1.1. Secado de la muestra Las muestras con un contenido de humedad > 14 % se secarán antes de manipularlas de conformidad con el anexo III. 2.1.3.1.2. Tamizado previo de la muestra Con el fin de reunir información sobre la posible contaminación ambiental de los piensos, se recomienda tamizar previamente a 1 mm los piensos granulados y los granos y, seguidamente, preparar y analizar las dos fracciones resultantes, que deben considerarse como muestras distintas, e informar sobre ellas por separado. 2.1.3.2. Precauciones que deben tomarse Con el fin de evitar la contaminación cruzada en el laboratorio, todos los equipos reutilizables deberán limpiarse cuidadosamente antes de su utilización. Las piezas del embudo de decantación se desmontarán antes de la limpieza. Las piezas del embudo de decantación y el material de vidrio deberán someterse a un lavado manual previo y, seguidamente, lavarse en una máquina lavadora. Los tamices deberán limpiarse con un cepillo de cerdas sintéticas rígidas. Después de tamizar materiales grasos, como la harina de pescado, se recomienda efectuar una limpieza final de los tamices con acetona y aire comprimido. 2.1.3.3. Preparación de muestras consistentes en grasa o aceite En el análisis de muestras consistentes en grasas podrá utilizarse el siguiente protocolo:
Se aplicará el mismo protocolo, con excepción de los guiones primero y cuarto, para la preparación de muestras consistentes en aceite. 2.1.3.4. Preparación de muestras distintas de grasa o aceite
2.1.4. Examen al microscopio 2.1.4.1. Preparación de los portaobjetos Los portaobjetos de microscopía deberán prepararse a partir del sedimento y, en función de la elección del analista, bien a partir del sobrenadante o de la materia prima. Cuando proceda, para detectar solamente los componentes procedentes de invertebrados terrestres, también se prepararán portaobjetos a partir del sobrenadante final obtenido como se describe en el punto 2.1.3.4.4. Se prepararán las dos fracciones resultantes (la fina y la gruesa). Las porciones de las fracciones destinadas al análisis esparcidas en los portaobjetos deberán ser representativas de la totalidad de la fracción. Se preparará un número suficiente de portaobjetos con el fin de garantizar que se lleva a cabo un protocolo completo de examen como el establecido en el punto 2.1.4.2. Los portaobjetos de microscopía se montarán con el medio de montaje adecuado, de conformidad con los PNT establecidos por el EURL-AP y publicados en su sitio web. Los portaobjetos se cubrirán con cubreobjetos. 2.1.4.2. Diagrama de flujo de observación para la detección de partículas de origen animal en piensos compuestos, material para piensos y premezclas. Los portaobjetos para microscopía preparados se observarán de conformidad con los diagramas de flujo de observación establecidos en los diagramas 1 y 2. Para las observaciones microscópicas, se observarán con un microscopio compuesto el sedimento y, en función de la elección del analista, bien el sobrenadante o la materia prima. Además, para detectar los componentes procedentes de invertebrados terrestres, también se realizarán observaciones a partir del sobrenadante final obtenido como se describe en el punto 2.1.3.4.4 de conformidad con el diagrama 3. En el caso de las fracciones gruesas podrá utilizarse el estereomicroscopio además del microscopio compuesto. Cada portaobjetos se observará en su totalidad a diversos aumentos. Un PNT establecido por el EURL-AP y publicado en su sitio web precisará en detalle cómo utilizar los diagramas de flujo. Se respetará estrictamente el número mínimo de portaobjetos que se observarán en cada fase de los diagramas de flujo de observación, salvo en caso de que la totalidad del material de la fracción no permita alcanzar el número de portaobjetos establecido, por ejemplo cuando no se obtenga sedimento. Por cada determinación no se utilizarán más de 6 portaobjetos para registrar el número de partículas. Cuando se preparen portaobjetos adicionales en el sobrenadante o en la materia prima utilizando un medio de montaje con propiedades de tinción más específico, tal como se describe en el punto 2.1.2.1.4, para caracterizar en mayor medida las estructuras (por ejemplo, plumas, pelos, músculos o partículas sanguíneas) que se hayan detectado en portaobjetos preparados con otros medios de montaje, tal como se describe en el punto 2.1.2.1.3, el número de partículas se calculará sobre la base de un número de portaobjetos por determinación no superior a 6, incluidos los portaobjetos adicionales con un medio de montaje más específico. Los portaobjetos adicionales preparados a partir del sobrenadante final obtenido, tal como se describe en el punto 2.1.3.4.4, para la detección de componentes procedentes de invertebrados terrestres no se tendrán en cuenta para la identificación de otros tipos (vertebrados terrestres y pescado). Con el fin de facilitar la identificación del tipo y el origen de las partículas, el analista podrá utilizar herramientas de apoyo, como los sistemas de apoyo a la toma de decisiones, los bancos de imágenes y las muestras de referencia. Diagrama 1 Diagrama de flujo de observación tras la sedimentación única de TCE para la detección de partículas animales distintas de las procedentes de invertebrados terrestres en piensos compuestos, materiales para piensos y premezclas para la primera determinación

Diagrama 2 Diagrama de flujo de observación tras la sedimentación única de TCE para la detección de partículas animales distintas de las procedentes de invertebrados terrestres en piensos compuestos, materiales para piensos y premezclas para la segunda determinación
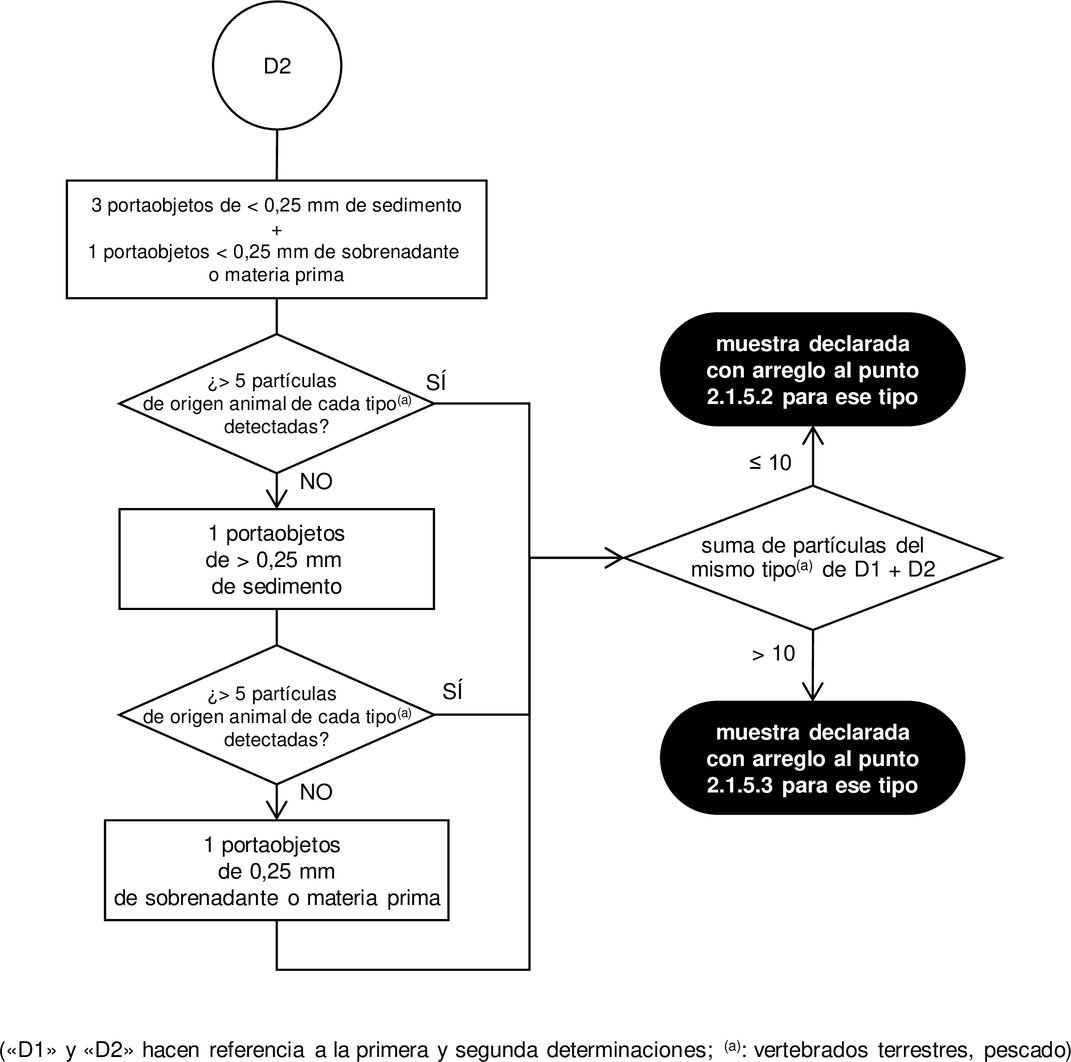
Diagrama 3 Diagrama de flujo de observación tras la sedimentación doble de PE/TCE para la detección de componentes procedentes de invertebrados terrestres en piensos compuestos, materiales para piensos y premezclas
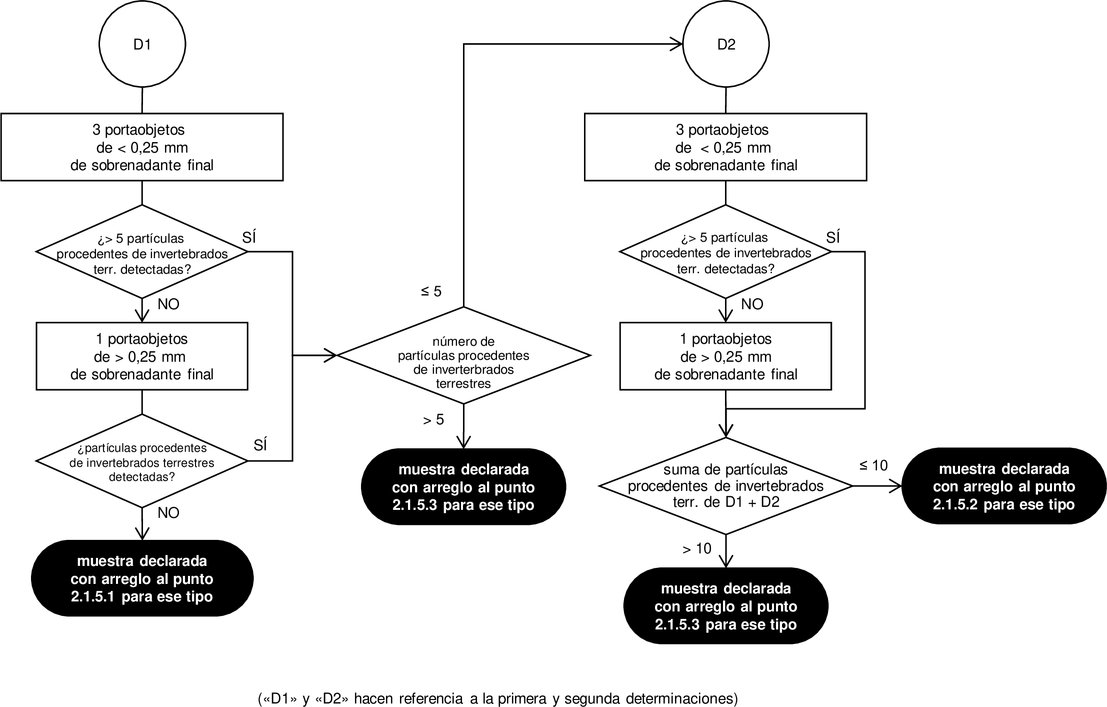
2.1.4.3. Número de determinaciones Las determinaciones se llevarán a cabo en diferentes submuestras de 50 g cada una. Si tras la primera determinación llevada a cabo de conformidad con el diagrama de flujo de observación establecido en el diagrama 1, o, cuando proceda, el diagrama 3, no se detecta ninguna partícula de origen animal, no será necesaria ninguna determinación complementaria y se notificará el resultado del análisis utilizando la formulación establecida en el punto 2.1.5.1. Si tras la primera determinación llevada a cabo de conformidad con el diagrama de flujo de observación establecido en el diagrama 1 se detectan una o más partículas animales de un tipo determinado (es decir, de vertebrados terrestres o de pescado) y el tipo de las partículas halladas confirma el contenido declarado de la muestra, no será necesaria una segunda determinación. Si el número de partículas de origen animal de un tipo determinado detectadas fuera superior a 5, se notificará el resultado del análisis por cada tipo de animal utilizando la formulación establecida en el punto 2.1.5.3. En cualquier otro caso, se notificará el resultado del análisis por cada tipo de animal utilizando la formulación establecida en el punto 2.1.5.2. Si tras la primera determinación llevada a cabo de conformidad con el diagrama de flujo de observación establecido en el diagrama 3 se detectan más de 5 partículas de invertebrados terrestres, no será necesaria ninguna segunda determinación y se notificará el resultado del análisis utilizando la formulación establecida en el punto 2.1.5.3 para este tipo. En todos los demás casos, incluso cuando no se haya facilitado al laboratorio ninguna declaración de contenido, se efectuará una segunda determinación a partir de una nueva submuestra. Si tras la segunda determinación llevada a cabo de conformidad con el diagrama de flujo de observación establecido en el diagrama 2, o, cuando proceda, del diagrama 3, la suma de las partículas de origen animal de un tipo determinado detectadas en las dos determinaciones fuera superior a 10, se notificará el resultado del análisis por cada tipo de animal utilizando la formulación establecida en el punto 2.1.5.3. En cualquier otro caso, se notificará el resultado del análisis por cada tipo de animal utilizando la formulación establecida en el punto 2.1.5.2. 2.1.5. Expresión de los resultados Al comunicar los resultados, el laboratorio indicará en qué tipo de material se ha realizado el análisis (sedimento, sobrenadante, sobrenadante final o materia prima). El informe del laboratorio indicará claramente cuántas determinaciones se han llevado a cabo y si no se ha efectuado el tamizado de las fracciones antes de la preparación de los portaobjetos, de conformidad con el punto 2.1.3.4.3, primer guion, párrafo tercero, o el punto 2.1.3.4.4, tercer guion. Dicho informe contendrá, como mínimo, información sobre la presencia de componentes derivados de vertebrados terrestres y de pescado. Las diversas situaciones se comunicarán de la forma que se expone a continuación.
|
(*) Reglamento (CE) n.o 999/2001 del Parlamento Europeo y del Consejo, de 22 de mayo de 2001, por el que se establecen disposiciones para la prevención, el control y la erradicación de determinadas encefalopatías espongiformes transmisibles (DO L 147 de 31.5.2001, p. 1).
(**) Reglamento (CE) n.o 1069/2009 del Parlamento Europeo y del Consejo, de 21 de octubre de 2009, por el que se establecen las normas sanitarias aplicables a los subproductos animales y los productos derivados no destinados al consumo humano y por el que se deroga el Reglamento (CE) n.o 1774/2002 (Reglamento sobre subproductos animales) (DO L 300 de 14.11.2009, p. 1).
(***) https://www.eurl.craw.eu/legal-sources-and-sops/method-of-reference-and-sops/.».»
Agència Estatal Butlletí Oficial de l'Estat
Avda. de Manoteras, 54 - 28050 Madrid