La Constitución Española, en sus artículos 43 y 51, asegura la protección de la salud pública y la defensa y seguridad de los consumidores y usuarios.
En este sentido, la Ley 14/1986, de 25 de abril, General de Sanidad, en su título preliminar, artículo 1.º.1, declara como objetivo «la regulación de todas las acciones que permitan hacer efectivo el derecho a la protección de la salud». En su artículo 40. 2, 5 y 6, al tratar las competencias del Estado señala corno tales la determinación de los requisitos sanitarios de las Reglamentaciones Técnico-Sanitarias de los alimentos, servicios o productos directa o indirectamente relacionados con el uso y consumo humano; la reglamentación, autorización, registro u homologación, según proceda, de los medicamentos de uso humano y veterinario y de los demás productos y artículos sanitarios y de aquellos que, al afectar al ser humano, pueden suponer un riesgo para la salud de las personas, así como la reglamentación y autorización de las actividades de las personas físicas o jurídicas dedicados a la preparación, elaboración y fabricación de los productos mencionados.
Del mismo modo, la Ley 26/1984, de 19 de julio, General para la Defensa de los Consumidores y Usuarios, en su artículo 2.º.1.a señala como derecho básico de los consumidores «la protección contra los riesgos que puedan afectar su salud o seguridad». En concreto, los artículos 3.º y 13 aseguran la protección de los consumidores contra los riegos previsibles, determinando la obligación de una correcta información sobre los productos de consumo. Los artículo 4.º y 28, 1 y 2, precisan el contenido de los reglamentos reguladores, garantías de pureza, eficacia o seguridad y responsabilidad por los daños originados en el uso o consumo de productos, que son de aplicación a los cosméticos.
La Ley de Bases de Sanidad de 1944, en su base XVI, menciona los productos cosméticos. El Código Alimentario Español de 1967 fijó algunas de las características que deben poseer los cosméticos en su apartado 5.38.02.
La normativa vigente hasta hoy, Decreto 3339/1968, de 26 de diciembre, por el que se regulan los cosméticos, ha quedado totalmente superada por los grandes avances realizados en el conocimiento científico y técnico de los productos cosméticos; por ello, en una línea de superación en la política de protección de la salud de los consumidores, se hace necesaria la actualización de la legislación sobre productos cosméticos.
Por otra parte, la adhesión de España a la Comunidad Económica Europea obliga a la armonización de la legislación española de cosméticos con la Directiva Marco del Consejo 76/768, y sus posteriores modificaciones (Directivas del Consejo 79/661, 82/368, 83/574), que se refieren a la aproximación de las disposiciones legislativas, reglamentarias y administrativas relativas a la competición, etiquetado y envasado de los productos cosméticos, así como las adaptaciones de sus anexos al progreso técnico (Directivas de la Comisión 82/147, 83/191, 83/341, 83/496, 84/415, 85/391, 86/179 y 86/199), Legislación comunitaria que queda recogida en el presente Real Decreto, incorporándola de esta forma al Ordenamiento Jurídico de nuestro país.
En su virtud, a propuesta del Ministro de Sanidad y Consumo, oídos los sectores afectados y la Comisión Interministerial para la Ordenación Alimentaria, de acuerdo con el Consejo de Estado y previa deliberación del Consejo de Ministros, en su reunión del día 15 de abril de 1988,
D I S P O N G O :
Se aprueba la adjunta Reglamentación Técnico-Sanitaria de productos cosméticos.
Mediante Orden del Ministro de Sanidad y Consumo se constituirá un Comité Asesor de Cosmetología integrado por representantes de la Administración, de los sectores afectados y de profesionales de reconocido prestigio, con funciones consultivas y asesoramiento técnico.
Lo dispuesto en el presente Real Decreto será de aplicación a los productos cosméticos que a la entrada en vigor del mismo se hallen en trámite de autorización en base al Decreto 3339/1968.
Las Empresas fabricantes y los responsables de la puesta en el mercado comunicarán a la Dirección General de Farmacia y Productos Sanitarios, a través de las Administraciones Sanitarias competentes, en el plazo de doce meses, mediante certificación global, que los productos cosméticos que estén comercializando en la fecha de entrada en vigor de esta disposición se atienen a las especificaciones contenidas en los anexos de este Real Decreto.
1. Los productos cosméticos autorizados en base al Decreto 3339/1968 deberán adecuarse a las prescripciones del presente Real Decreto, de acuerdo con un calendario que la Dirección General de Farmacia y Productos Sanitarios establecerá mediante Resolución.
2. La adecuación anterior se aplicará también a los dentífricos autorizados que, de acuerdo con los anexos de este Real Decreto, queden clasificados como productos cosméticos.
Los productos no incluidos en el ámbito de aplicación de este Real Decreto y que sin embargo, por sus propiedades, composición o forma de aplicación, eran considerados cosméticos en base al Decreto 3339/1968, quedarán sometidos a la Declaración Especial prevista en el artículo 7.º de la adjunta Reglamentación, hasta tanto no exista una normativa específica que los regule.
La Dirección General de Farmacia y Productos Sanitarios resolverá las dudas que puedan surgir en la aplicación de esta disposición transitoria.
A partir de la entrada en vigor del presente Real Decreto quedan derogados los preceptos y disposiciones que se citan:
Los apartados 5.38.02 a 5.38.14 del Decreto 2484/1967, de 21 de septiembre.
El Decreto 3339/1968, de 26 de diciembre, en lo que se oponga al presente Real Decreto.
La Resolución de 1 de febrero de 1972 (DGS).
La Resolución de 18 de octubre de 1983 (DGFM).
Asimismo, se derogan cuantas disposiciones de igual o inferior rango se opongan a lo establecido en el presente Real Decreto.
El Ministerio de Sanidad y Consumo dictará un Protocolo Básico sobre normas de correcta fabricación de los productos cosméticos, así como cuantas disposiciones resulten necesarias para la ejecución y desarrollo del presente Real Decreto y para la actualización de sus anexos, cuando lo establezca la normativa de la Comunidad Económica Europea.
El presente Real Decreto entrará en vigor a los tres meses de su publicación en el «Boletín Oficial del Estado», sin perjuicio de lo establecido en la disposición final primera.
Dado en Madrid a 15 de abril de 1988.
JUAN CARLOS R.
El Ministro de Sanidad y Consumo,
JULIÁN GARCÍA VARGAS
La presente Reglamentación tiene por objeto definir a efectos legales los productos cosméticos, así como determinar las condiciones técnico-sanitarias que deban reunir, su control sanitario, los requisitos que han de cumplir las instalaciones donde se elaboren y almacenen, la inspección, las infracciones y, en general, la ordenación jurídica de los citados productos.
A efectos de la presente Reglamentación, se entiende por.
1. Producto cosmético: Toda sustancia o preparado destinado a ser puesto en contacto con las diversas partes superficiales del cuerpo humano (epidermis, sistema capilar y piloso, labios, uñas, órganos genitales externos, o con los dientes y mucosas de la cavidad bucal), con el fin exclusivo o propósito principal de limpiarlas, perfumarlas o protegerlas, para mantenerlas en buen estado, modificar su aspecto y corregir los olores corporales.
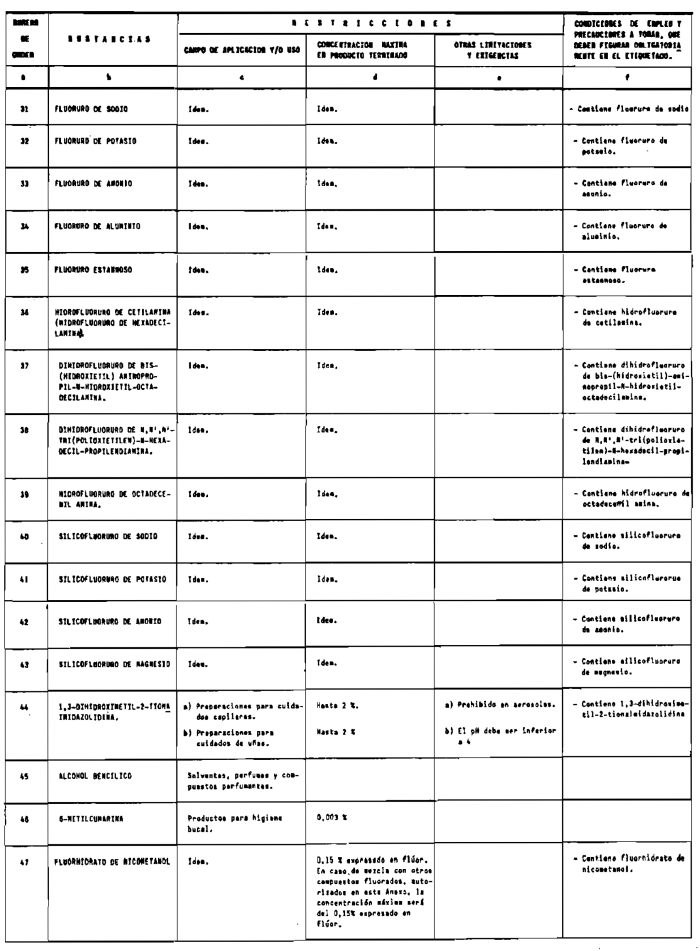
Se consideran productos cosméticos los preparados que figuran en el anexo I de esta Reglamentación.
Son productos cosméticos decorativos los que, en virtud de poseer sustancias coloreadas y por su poder cubriente, se aplican sobre diferentes zonas del cuerpo, con el fin de acentuar temporalmente su belleza o enmascarar o disimular diversos inesteticismos cutáneos.
2. Comunicación: Acción por la que se pone en conocimiento de la Dirección General de Farmacia y Productos Sanitarios, en adelante DGFPS, en los términos previstos en este Real Decreto, la información requerida en la presente Reglamentación.
3. Puesta en el mercado: El acto de suministrar o tener a disposición de terceros un producto cosmético, sea o no para transacciones comerciales.
4. Responsable de la puesta en el mercado: Persona física o Entidad jurdicía que, ostentando la condición de fabricante, importador o propietario de un productos cosmético, presenta, en nombre propio o mediante representación legal de tercero, la comunicación administrativa o la declaración especial, en su caso, a efectos de su puesta en el mercado.
5. Etiquetas, envases y prospectos: A los efectos de la presente Reglamentación, se considera:
a) Etiqueta: Texto impreso, adherido al envase o cartonaje o bien colgante de ellos, conteniendo información y datos preceptivos del producto.
b) Envase: Todo elemento o recipiente que contiene al producto cosmético y está en contacto directo con él.
c) Cartonaje o envase exterior. Caja, estuche o cualquier otro sistema que contiene al envase y lo protege.
d) Prospecto: Texto impreso, incluido opcionalmente dentro del envase exterior, conteniendo información complementaria e instrucciones de uso del producto cosmético.
Quedan excluidos de la presente Reglamentación aquellos preparados destinados a la prevención, diagnóstico y curación de enfermedades, así como los destinados a ser ingeridos, inhalados, inyectados o implantados en el cuerpo humano.
1. Los productos cosméticos puestos en el mercado a disposición de los consumidores no implicarán riesgo para la salud o seguridad cuando sean utilizados en las condiciones previstas para su empleo.
2. Los riesgos que previsiblemente pudieran derivarse de la normal utilización de los productos cosméticos, habida cuenta de su naturaleza y de las personas a que van destinados, deberán ser puestos en conocimiento previo de los consumidores por medio de instrucciones e indicaciones para su uso correcto y de advertencias apropiadas.
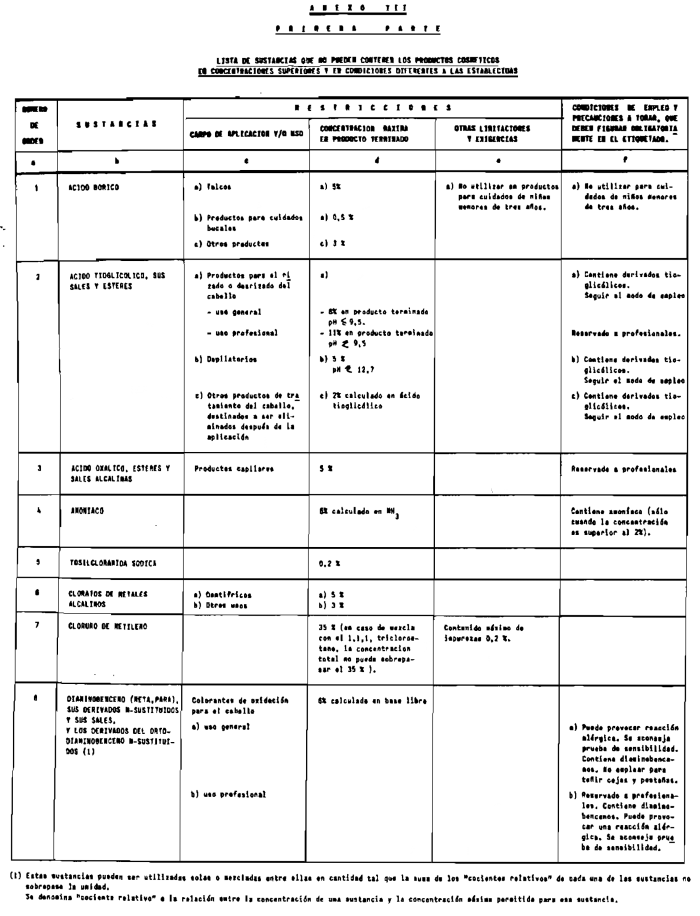
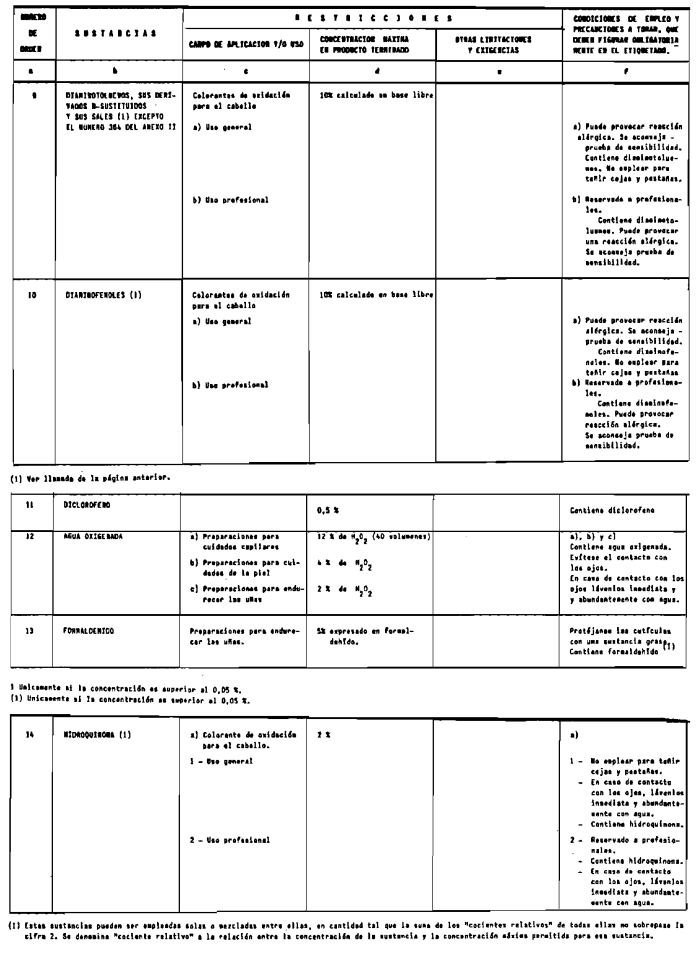
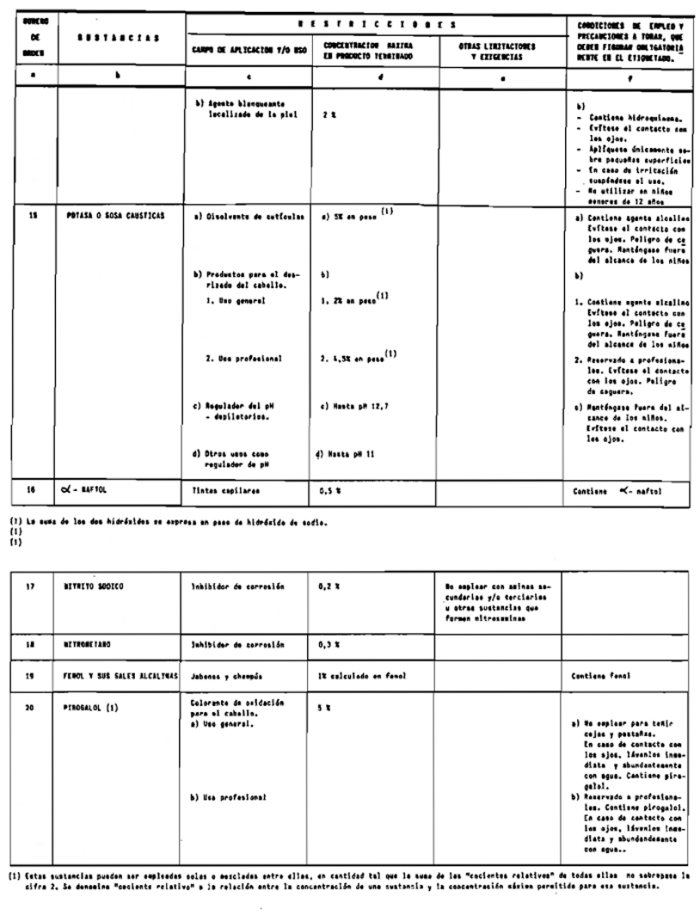
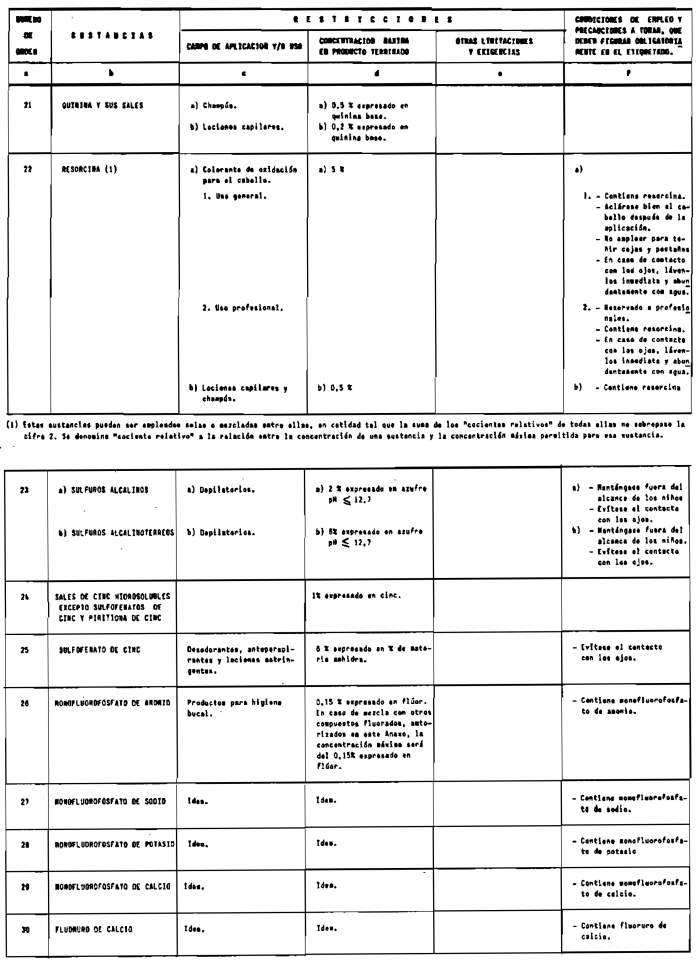
Sin perjuicio de lo establecido en el artículo 4.º, queda prohibida la puesta en el mercado de los productos cosméticos que contengan:
1. Las sustancias comprendidas en el anexo II de esta Reglamentación Técnico-Sanitaria.
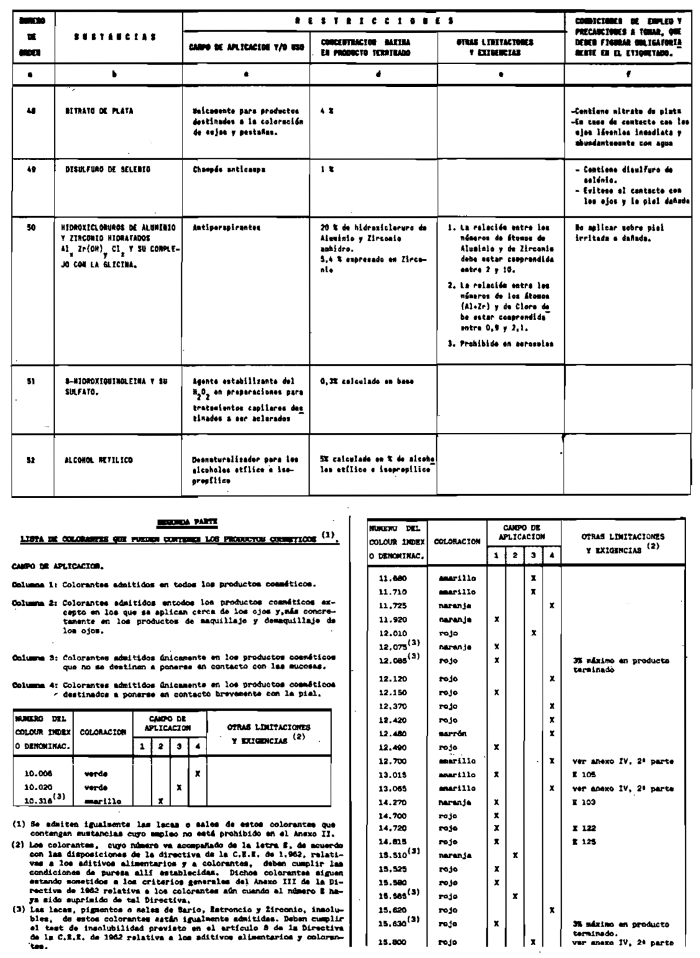
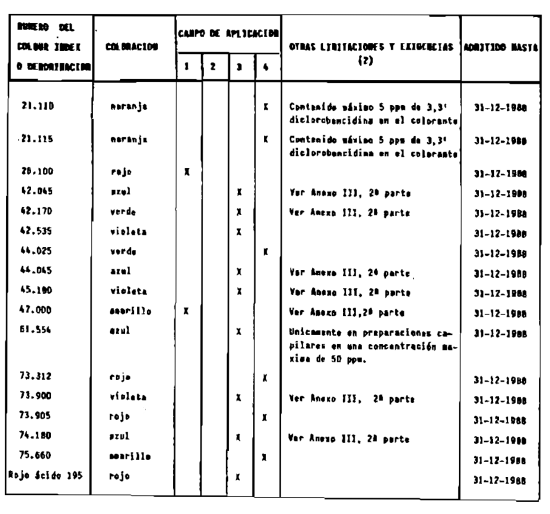
2. Las sustancias comprendidas en el anexo III (primera parte) y anexo IV (primera parte), en concentraciones superiores y en condiciones diferentes de las establecidas en dichos anexos.
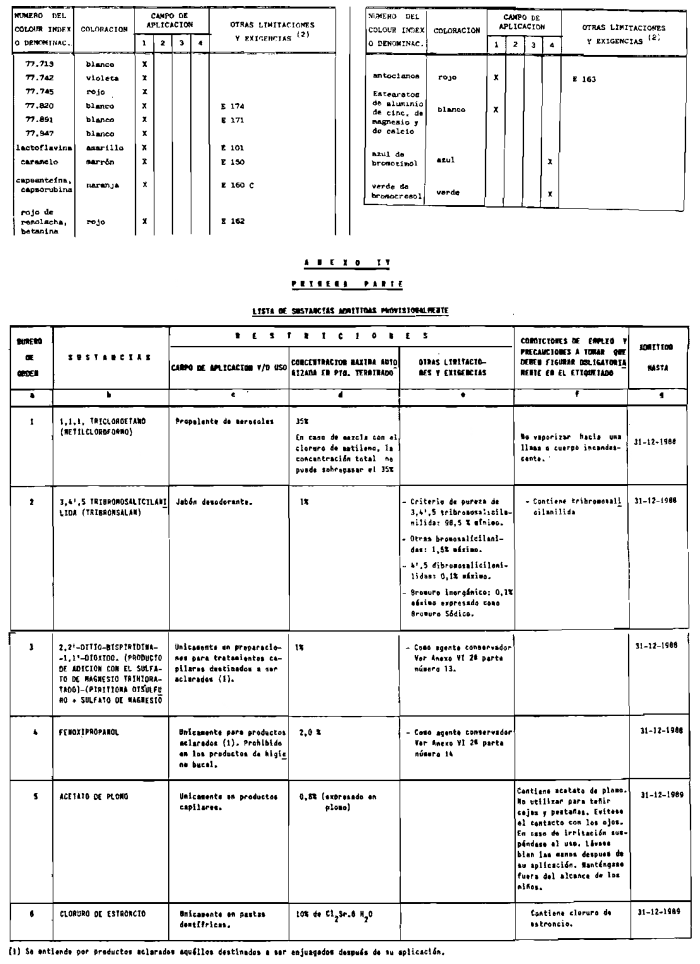
3. Colorantes no incluidos en los anexos IIl y IV.
4. Colorantes de los comprendidos en los anexos III y IV en concentraciones superiores y en condiciones diferentes a las estipuladas en ellos.
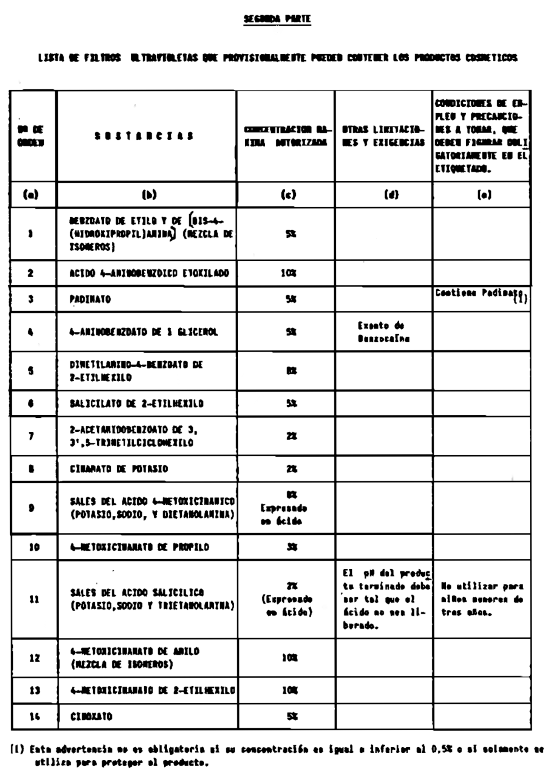
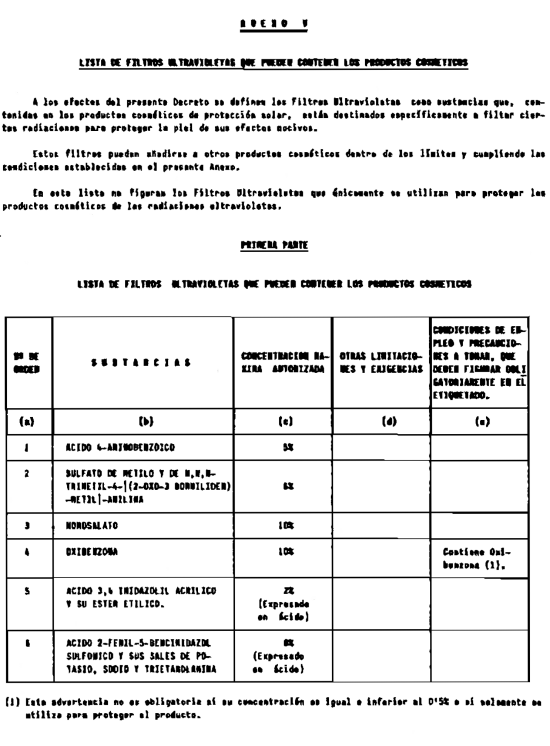
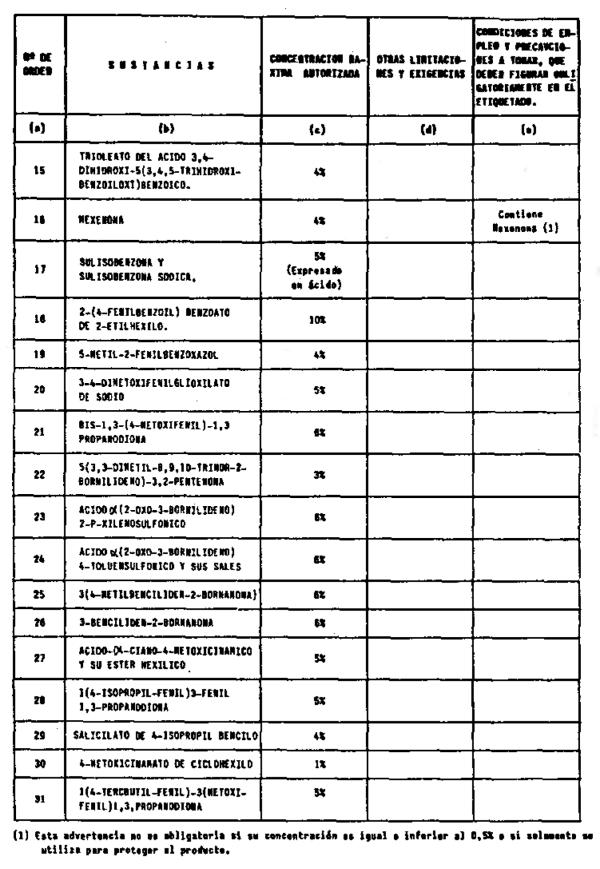
5. Filtros ultravioleta no incluidos en el anexo V.
6. Filtros ultravioleta en concentraciones superiores y en condiciones diferentes de las establecidas en el anexo V.
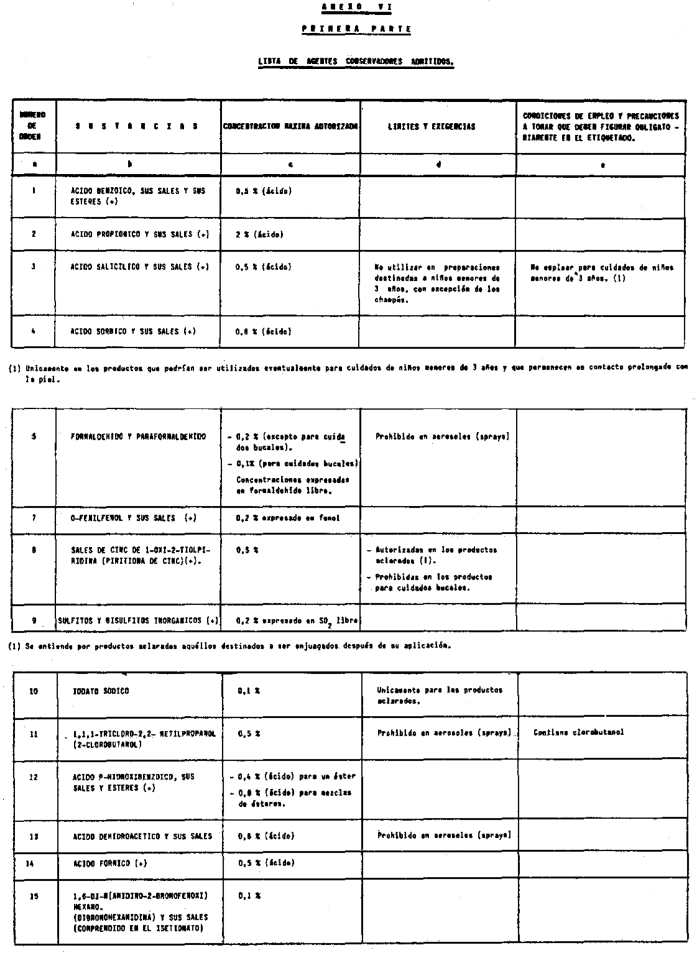
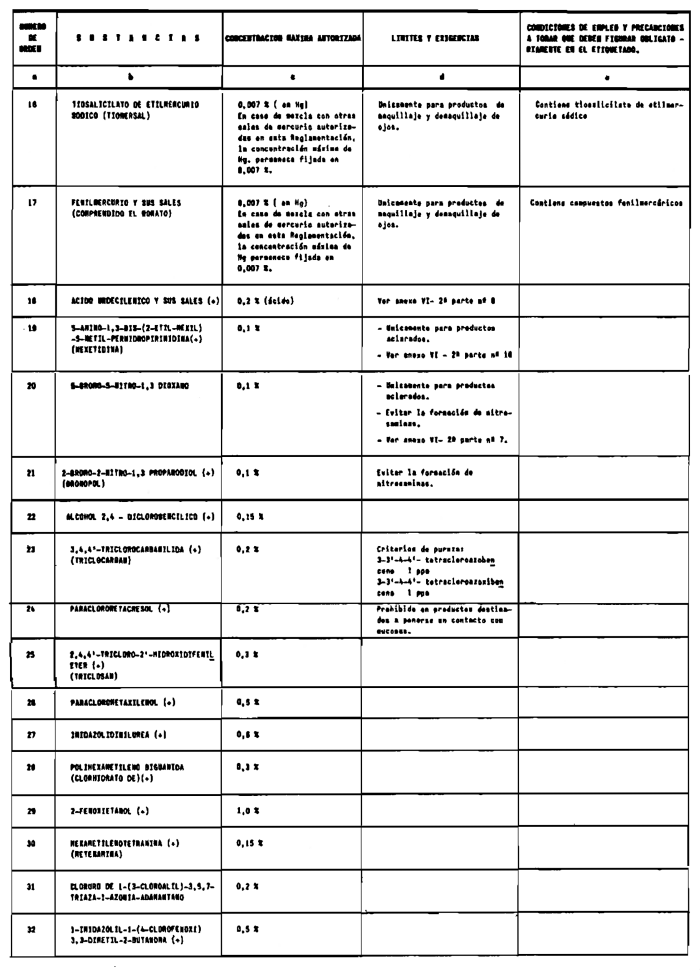
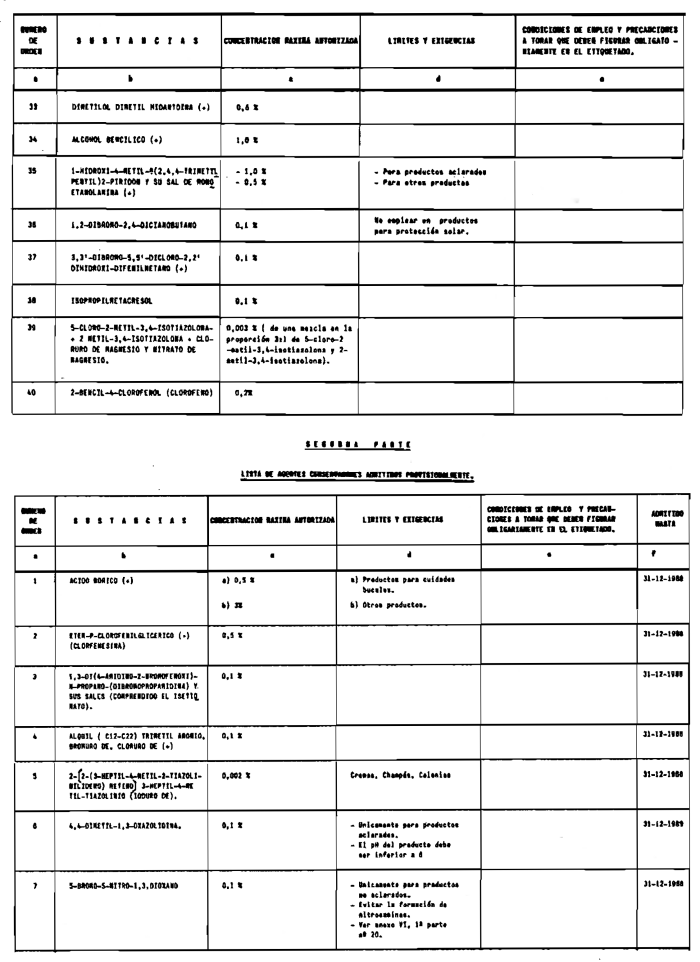
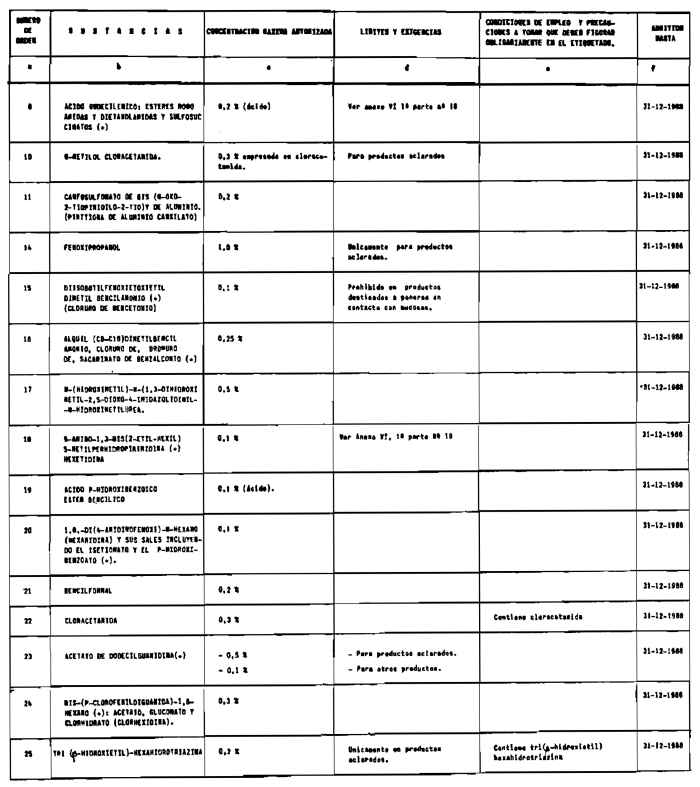
7. Agentes conservadores no incluidos en el anexo VI.
8. Agentes conservadores en concentraciones superiores y en condiciones diferentes de las establecidas en el anexo VI.
9. Cualquier otra sustancia o preparado expresamente prohibido por el Ministerio de Sanidad y Consumo, con objeto de asegurar la protección de la salud o la seguridad de las personas.
1. La puesta en el mercado de un producto cosmético deberá comunicarse no más tarde del día en que se haga efectiva. Para ello, el responsable de la puesta en el mercado deberá presentar los impresos que se establezcan, debidamente cumplimentados en la lengua española oficial del Estado. En ellos habrán de figurar, al menos, los datos siguientes:
a) El nombre o la razón social y la dirección o sede social del fabricante y del responsable de la puesta en el mercado del producto cosmético.
b) Identificación completa y titulación del técnico responsable a que se refiere el artículo 16.
c) Número de licencia de funcionamiento de la instalación del responsable de la puesta en el mercado.
d) Denominación del producto cosmético y la categoría a la que pertenece, de acuerdo con las contempladas en el anexo I o con la clasificación que en su caso se establezca.
e) Composición cualitativa de sus componentes activo, en orden decreciente de sus concentraciones, expresados con la Denominación Común Internacional (DCI), cuando exista, o, en su defecto, de acuerdo con las reglas de nomenclatura internacionales que permitan su identificación.
En el caso de los jabones sólidos, perfumes, aguas de colonia y de tocador, la fórmula cualitativa se referirá solamente al vehículo, agentes conservadores y colorantes empleados.
f) Composición cuantitativa de los componentes a que se refiere el apartado anterior que se presentará en un único sobre lacrado para asegurar su confidencialidad.
g) Etiquetas, envases y prospectos o, en su defecto, un boceto de los mismos en el que se incluirán los textos que figuran en el producto puesto en el mercado.
h) Contenido neto en el momento del envasado, de acuerdo con los contenidos máximos y los volúmenes señalados, en su caso, por la legislación vigente.
i) Certificado de haber realizado las pruebas necesarias para comprobar la inocuidad del producto cosmético.
j) Certificado de haber realizado los controles necesarios para comprobar la calidad del producto cosmético,
k) Cuando se trate de productos cosméticos no comercializados en la Comunidad Económica Europea se incluirá, además, la autorización de comercialización o el certificado de libre venta expedido por la autoridad competente del país de origen, pudiéndose recabar cualquier otra información adicional de dicha autoridad.
2. La documentación a que se refiere el número anterior se presentará ante la Administración Sanitaria competente en duplicado ejemplar, salvo lo previsto en el apartado 1, f). Esta Administración remitirá inmediatamente uno de dichos ejemplares junto con el aludido sobre lacrado a la DGFPS.
3. La documentación técnica en base a la cual se presenta el certificado de inocuidad podrá ser experimental o bibliográfica.
La documentación anterior junto con los métodos analíticos y las pruebas realizadas a que hace mención el apartado j) del presente artículo, se conservarán en el domicilio social de la Empresa fabricante o responsable de la puesta en el mercado para su comprobación por la Administración.
4. La comunicación relativa a los productos cosméticos importados desde terceros países y la de los productos cosméticos puestos en el mercado desde otro país miembro de la Comunidad Económica Europea, con las excepciones que se prevén en esta Reglamentación, se efectuará mediante la presentación de la documentación correspondiente directamente en la DGFPS.
1. La DGFPS podrá autorizar con carácter excepcional el empleo en productos cosméticos de colorantes, agentes conservadores o filtros ultravioleta que no estén incluidos en los anexos de esta Reglamentación.
En estos supuestos deberá presentarse una declaración especial que cumpla los términos que indica el artículo excepto sus apartados i) y j), cuyos requisitos serán sustituidos por los siguientes:
1.º Justificación de su inocuidad con las pruebas necesarias toxicológicas, científico-técnicas y analíticas de acuerdo con la naturaleza y el uso previsto para ese producto, mediante presentación de una memoria.
2.º Cumplimiento de un programa de seguimiento que acredite la inocuidad en su uso por la Entidd que los declare, de acuerdo con los requisitos que establezca la DGFPS.
3.º Tener una indicación concreta que se detallará en la declaración especial y se identificará según fije la DGFPS para diferenciarlos del resto de los productos.
2. En el plazo de sesenta días la DGFPS deberá pronunciarse sobre la declaración especial presentada. Si ésta no permitiese una evaluación sanitaria adecuada del producto, se requerirán al declarante los datos o ensayos necesarios; en este supuesto se empezará a contar un nuevo plazo de sesenta días a partir de la recepción de los datos o ensayos requeridos.
3. La declaración especial surtirá efecto durante un período máximo de tres años, a partir de la fecha del pronunciamiento favorable.
4. Siempre que la DGFPS lo considere necesario para la protección de la salud y seguridad de las personas, podrá aplicarse el sistema de declaración especial a cualquier producto cosmético que contenga otras sustancias distintas de las señaladas en el apartado 1.
5. Cualquier declaración especial sobre la que recaiga pronunciamiento favorable se comunicará a la Comisión de la CEE en un plazo de sesenta días.
La DGFPS asegurará la confidencialidad de los datos que tengan tal carácter mediante las disposiciones e instrucciones necesarias. La DGFPS por sí misma o a instancia de la Administración Sanitaria correspondiente podrá proceder a la apertura del sobre a que se refiere el apartado f) del artículo 6.º por razones de riesgo para la salud o la seguridad de las personas, adoptándose las medidas que en su caso procedan.
Los criterios de calidad química y microbiológica de los productos cosméticos, así como sus métodos analíticos, se establecerán por Orden del Ministro de Sanidad y Consumo, teniendo en cuenta la legislación comunitaria y oído el parece del Comité Asesor de Cosmetología.
En su defecto, se utilizarán preferentemente los métodos analíticos usados o recomendados por el Instituto de Salud «Carlos III» y demás Centros e Institutos especializados, nacionales o internacionales, de reconocida solvencia.
1. En caso de cese de la fabricación o comercialización de un producto cosmético, la Entidad responsable deberá comunicarlo a la DGFPS mediante el procedimiento previsto en los artículos 6.2 ó 6.4, según corresponda, conservando toda la documentación técnica relativa al producto durante un período de cinco años.
2. Lo dispuesto en el número anterior se efectuará directamente en la DGFPS para los productos del capítulo II.
Sin perjuicio de las actuaciones que correspondan a otras Administraciones Sanitarias; la DGFPS fundándose en razones justificadas podrá prohibir la puesta en el mercado, ordenar la retirada o someter a condiciones especiales de control a cualquier productos cosmético que, aun cumpliendo los requisitos establecidos en esta Reglamentación, presente un riesgo para la salud y la seguridad de las personas en las condiciones normales o previsibles de utilización.
Cualquiera de estas medidas tendrá carácter provisional y de las mismas se informará inmediatamente a la Comisión de la CEE y a las autoridades competentes de los Estados miembros. En cualquier caso, si de la decisión que se adopte se deriva la anulación de un producto cosmético, ésta se realizará mediante la instrucción del correspondiente expediente administrativo con audiencia del interesado.
1. Cualquier modificación de los datos incluidos en la comunicación o declaración habrá de comunicarse a la mayor brevedad posible.
2. Cada cinco años contados a partir de la fecha en que hubiere sido comunicada la puesta en el mercado de un producto cosmético, su responsable deberá manifestar su intención de mantenerlo en el mismo.
La DGFPS mantendrá actualizado un libro-registro en el que figurarán anotadas todas las comunicaciones y declaraciones especiales de productos cosméticos.
1. En el etiquetado del envase y del cartonaje de todo producto cosmético puesto en el mercado deberán figurar, al menos, en la lengua española oficial del Estado, con caracteres indelebles, visibles y fácilmente legibles, los datos siguientes:
a) Denominación del producto. Podrán figurar nomenclaturas internacionalmente aceptadas o de uso común.
b) Origen o procedencia, cuando se trate de productos cosméticos importados de países no comunitarios,
c) Contenido nominal neto en el momento del envasado, expresado en unidades S.I., cuando se trate de productos con un peso o volumen igual o superior a 5 g o 5 ml y el número de ejemplares que contiene, en caso de envase múltiple.
d) La fecha de duración mínima que, a los efectos de esta Reglamentación, es la fecha hasta la cual dicho producto, conservado en condiciones apropiadas, continúa cumpliendo su función inicial y en especial lo establecido en el artículo 4.º
La fecha de duración mínima se indicará con la mención «utilizar preferentemente antes de finales de...» seguida, bien sea de la fecha o de una indicación del lugar del etiquetado en que figura dicha fecha.
La fecha se compondrá de la indicación del mes y del año, en forma clara y en este orden.
Estas menciones se completarán en caso necesario con la indicación de las condiciones que habrán de cumplirse para garantizar la duración indicada.
La indicación de la fecha de duración no será obligatoria para los productos cosméticos cuya duración mínima exceda treinta meses.
e) Condiciones particulares de empleo si el producto lo requiere y en especial las que se especifican en los anexos de esta Reglamentación como «condiciones de empleo y precauciones a tomar que deben figurar obligatoriamente en el etiquetado», las cuales no deberán aparecer en etiquetas colgantes.
Si por razones justificadas de espacio, derivadas de la reducida dimensión del producto, esto no fuera posible, las condiciones particulares de empleo deberán incluirse en el envase exterior o en el prospecto, figurando entonces sobre el envase definido en el artículo 2.º5, b, una mención que indique que las referidas condiciones de empleo se detallan en el envase exterior o, en su caso, en el prospecto.
2. Además, deberán figurar las menciones siguientes que podrán expresarse en sus lenguas oficiales de origen cuando el producto proceda de países comunitarios:
a) Nombre o razón social y dirección o sede social del fabricante o responsable de la puesta en el mercado, establecido dentro de la Comunidad Económica Europea. Los responsables de la puesta en el mercado de productos procedentes de terceros países, deberán indicar además del nombre o razón social, su domicilio o sede social en el territorio español.
Estas menciones podrán abreviarse siempre y cuando su abreviatura permita, en términos generales, identificar a la Empresa.
b) Número de lote de fabricación o referencia que permita su identificación.
Cuando el tamaño reducido de algún producto cosmético no permita su inclusión en el etiquetado del envase, este dato deberá figurar obligatoriamente en el envase exterior.
3. Las etiquetas de los envases múltiples y las presentaciones que contengan distintos productos cosméticos de la misma Empresa, deberán cumplir los mismos requisitos que las de los envases individuales.
1. Sin perjuicio de lo establecido en las normas reguladoras de la publicidad, el texto, denominaciones, marcas, imágenes y otros signos, gráficos o no, que figuren en las etiquetas, envases y prospectos y en la publicidad de los productos cosméticos, no atribuirán a los mismos características o propiedades que no posean.
2. Las denominaciones de los productos cosméticos no podrán dar lugar a confusión con medicamentos, especialidades farmacéuticas o productos alimenticios.
3. Los envases y presentaciones de estos productos serán tales que no puedan prestarse a confusión con otros productos de consumo, con el fin de evitar riesgos de tipo sanitario.
4. Ei producto cosmético indicará la fórmula cualitativa y cuantitativa de las sustancias cuya presencia se anuncie en la denominación del producto o en su publicidad.
1. La fabricación, control, almacenamiento, así como la importación desde países no comunitarios de los productos cosméticos, se realizará bajo la supervisión y responsabilidad de un Técnico titulado en profesión relacionada con la actividad precisa para dichos procesos, a los efectos de garantizar las características y la composición del producto, así como su inocuidad.
2. La Empresa comunicará a la DGFPS, mediante el procedimiento previsto en el artículo 6.º, 2, el nombramiento del Técnico responsable. En caso de que cesara éste, la Empresa deberá comunicar el nombramiento de un sustituto en el plazo de un mes.
1. Las Empresas fabricantes y los responsables de la puesta en el mercado de productos cosméticos deberán contar en España con unas instalaciones autorizadas por la correspondiente licencia de funcionamiento. Este requisito no será exigible respecto de los productos cosméticos puestos en el mercdo desde otro país miembro de la Comunidad Económica Europea.
2. Dichas instalaciones habrán de cumplir los siguientes requisitos:
a) Tener un Técnico responsable de acuerdo con lo establecido en el artículo 16.
b) Contar con áreas diferenciadas, en su caso, de:
Fabricación. Con las instalaciones y medios necesarios para la elaboración y envasado de los productos cosméticos en condiciones higiénico-sanitarias adecuadas.
Control. Con los medios, aparatos, útiles de laboratorio, reactivos y patrones necesarios para garantizar la calidad de las materias primas, productos intermedios y productos terminados, así como la del material de envasado y etiquetado.
Almacenamiento. Para materias primas, productos intermedios y productos terminados, así como para el material de envasado y etiquetado.
c) La realización de análisis y pruebas de control de calidad de los productos cosméticos se podrá concertar con Centros o laboratorios de control previamente homologados por a DGFPS.
1. La licencia de funcionamiento se podrá conceder previa presentación de la siguiente documentación:
1.º Solicitud debidamente cumplimentada y firmada por el fabricante o el responsable de la puesta en el mercado y por el Técnico a que se refiere el artículo 16.
2.º Memoria descriptiva de la instalación y plano de la misma en el que se especificarán claramente las áreas destinadas a fabricación, control y almacenamiento.
3.º Clases de productos cosméticos que se pretendan elaborar de acuerdo con las categorías indicadas en el anexo I o en la clasificación que, en su caso, se establezca.
4.º Nombramiento del Técnico responsable junto con una copia de su título académico debidamente autenticada por el Centro universitario, Notario o Colegio oficial correspondiente,
5.º Las Entidades importadoras acompañarán la documentación que acredite que el propietario o Empresa fabricante está legalmente establecido en el país de origen.
6.º Las Entidades que tengan concertada la realización de análisis y pruebas de control de calidad con Centros o laboratorios a los que se refiere el artículo 17.2, c), presentarán, además copia del correspondiente contrato.
2. A la vista de la documentación presentada, previa la correspondiente visita de inspección a la instalación, se otorgará, si la licencia de funcionamiento y se asignará el correspondiente código de identificación.
En el supuesto de que el responsable de la puesta en el mercado concierte la elaboración de productos cosméticos con otra u otras Entidades, las instalaciones de éstas habrán de contar también con licencia de funcionamiento.
1. El traslado, ampliación o modificación sustancial de las instalaciones a que se refiere el artículo 17 se considerará como nueva instalación.
2. Cuando una Entidad titular de una instalación autorizada cambie su personalidad jurídica, el nombre, o su razón social lo comunicará adjuntando la documentación acreditativa. Asimismo será comunicado el cese de las actividades, adjuntando una relación de los productos cosméticos que tenga comunicados o declarados en ese momento.
Las Administraciones Públicas competentes efectuarán inspecciones periódicas para verificar el cumplimiento de lo dispuesto en esta Reglamentación.
1. Son infracciones leves:
1.º La simple irregularidad en la observancia de la normativa técnico-sanitaria, así como las infracciones cometidas por la simple negligencia siempre que la alteración o riesgo sanitario producido fuera de escasa entidad y sin trascendencia directa para la salud pública.
2.º Las que, en razón de los criterios contemplados en este artículo, merezcan la calificación de leves, o no proceda su calificación como faltas graves o muy graves.
2. Son infracciones graves:
1.º La falta de controles y precauciones exigibles en la actividad de las instalaciones de los productos cosméticos.
2.º El incumplimiento de los requerimientos específicos que formule en su caso la DGFPS, siempre que se produzcan por primera vez.
3.º La resistencia a suministrar datos, facilitar información o prestar colaboración a las Autoridades Sanitarias o a sus Agentes.
4.º Elaborar los productos cosméticos en condiciones técnico-sanitarias deficientes que afecten a su seguridad, inocuidad y calidad.
5.º Trasladar, ampliar o modificar sustancialmente las instalaciones donde se fabriquen, envasen o almacenen los productos cosméticos sin contar con la preceptiva licencia de funcionamiento.
6.º Fabricar, envasar, almacenar o importar productos cosméticos sin el concurso del Técnico responsable a que se refiere el artículo 16.
7.º Realizar ofertas, promociones o publicidad de los productos cosméticos que no se ajusten a las normas generales que regulan estos aspectos y en especial cuando en ellas se haga mención de propiedades curativas, afirmaciones falsas o que induzcan a error.
8.º Las que sean concurrentes con otras infracciones leves, o hayan servido para facilitar o encubrir su comisión.
9.º Las que en razón de los elementos contemplados en este artículo merezcan la calificación de graves o no proceda su calificación como faltas leves o muy graves.
10. La reincidencia en la comisión de infracciones leves en los últimos tres meses.
3. Son infracciones muy graves:
1.º Las que se realicen de forma consciente y deliberada siempre que produzcan un daño grave.
2.º El incumplimiento reiterado de Ios requerimientos específicos que formulen las Autoridades Sanitarias.
3.º La negativa absoluta a facilitar información o prestar colaboración a los servicios de inspección sanitaria, así coma la resistencia, coacción, amenazas, represalia, desacato o cualquier otra forma de presión ejercida sobre las Autoridades Sanitarias o sus Agentes.
4.º La negativa a suministrar cuando se requiera la documentación técnica a que se refiere el artículo 10.
5.º Vender o mantener en el mercado productos cosméticos que hayan sido objeto de orden de retirada cautelar o definitiva.
6.º La puesta en el mercado de productos cosméticos que contravengan lo dispuesto en el artículo 5.º
7.º La puesta en el mercado de productos cosméticos sin haber efectuado las comunicaciones u obtenido la autorización a que se refieren los artículos 6.º, 7.º y 12.
8.º El falseamiento de los datos comunicados o declarados así como la falta de cualquier documento, en base a los que se han expedido las certificaciones de los apartados i) y j) del artículo 6.º
9.º Fabricar o almacenar productos cosméticos en instalaciones que no cuenten con la preceptiva licencia de funcionamiento.
10. Modificar la composición del producto cosmético o cualquiera de los datos que el artículo 14 exige sobre el etiquetado sin la previa comunicación.
11. Las infracciones que sean concurrentes con otras infracciones sanitarias graves o hayan servido para facilitar o encubrir su comisión.
12. Las que, en razón de los elementos contemplados en este artículo y de su grado de concurrencia, merezcan la calificación de muy graves o no proceda su calificación como faltas leves o graves.
13. La reincidencia en la comisión de faltas graves en los últimos cinco años.
Las infracciones a lo dispuesto en el presente Real Decreto serán objeto de las sanciones administrativas que correspondan, previa instrucción del oportuno expediente, sin perjuicio de las responsabilidades civiles, penales o de otro orden que pudieran concurrir.
Si en la producción de los daños concurren varias personas, responderán solidariamente ante los perjudicados.
1. Las infracciones tipificadas en el artículo 22 de este Reglamento serán sancionadas con multa de acuerdo con la siguiente graduación:
a) Infracciones leves, hasta 500.000 pesetas.
b) Infracciones graves, desde 500.001 a 2.500.000 pesetas, pudiendo rebasar dicha cantidad hasta alcanzar el quíntuplo del valor de los productos objeto de infracción.
c) Infracciones muy graves, desde 2.500.001 a 100.000.000 de pesetas, pudiendo rebasar dicha cantidad hasta alcanzar el quíntuplo del valor de los productos objeto de la infracción.
2. Dentro de los límites establecidos en el número anterior el órgano administrativo sancionador graduará las multas atendiendo a los criterios de riesgo para la salud, cuantía del beneficio obtenido, grado de intencionalidad y gravedad de la alteración social o sanitaria producida.
3. El procedimiento sancionador se ajustará a lo establecido en los artículos 133 a 137, ambos inclusive, de la Ley de Procedimiento Administrativo. La Administración competente es la que resulta de lo establecido en las Leyes 14/1986, de 25 de abril, y 26/1984, de 19 de julio, y, en su caso, en el Real Decreto 1945/1983, de 22 de junio.
En todo caso, cuando sean detectadas infracciones de índole sanitaria, el órgano instructor dará cuenta inmediata de las mismas a las Autoridades Sanitarias competentes, sin perjuicio de la adopción de las medidas precautorias procedentes.
1. En los supuestos de infracciones muy graves, podrá acordarse, por el Consejo de Ministros o por el órgano correspondiente de las Comunidades Autónomas que tuvieren competencia para ello, el cierre temporal del establecimiento o instalación por un plazo máximo de cinco años. En tal caso, será de aplicación lo previsto en el artículo 57.4 de la Ley 8/1980, de 10 de marzo, por la que se aprueba eI Estatuto de los trabajadores.
2. La autoridad a que corresponda resolver el expediente podrá acordar, como sanción accesoria el decomiso del producto.
3. En el caso de que exista o se sospeche razonablemente la existencia de un riesgo inminente y extraordinario par la salud, la Autoridad Sanitaria podrá adoptar las medidas preventivas a que se refiere el artículo 26 de la Ley 14/1986, de 25 de abril, con el alcance previsto en dicho artículo.
Cremas, emulsiones, lociones, geles y aceites para la piel.
Máscaras de belleza (con exclusión de los productos de abrasión superficial de la piel por vía química).
Maquillaje (líquidos, pastas, polvos).
Polvos de maquillaje, polvos para utilizar después del baño y para la higiene corporal.
Jabón de tocador, jabón desodorante.
Perfumes, aguas de tocador, aguas de colonia...
Productos para baño y ducha (sales, espumas, aceites, geles).
Depilatorios.
Desodorantes antitranspirantes.
Productos capilares.
Tintes y decolorantes.
Productos para moldear, para desrizar y fijar.
Productos que ayudan a mantener el peinado.
Productos de limpieza (lociones, polvos, champús).
Productos acondicionadores (lociones, lacas, brillantinas).
Otros productos para el peinado.
Productos para el afeitado (jabones, espumas, lociones).
Productos para el maquillaje y desmaquillaje de la cara y los ojos.
Productos para los labios.
Productos para cuidado bucal y dental.
Productos para cuidado y maquillaje de uñas.
Productos para cuidado íntimo externo.
Productos solares.
Productos para bronceado sin sol.
Productos blanqueadores de la piel.
Productos antiarrugas.
1. 2-acetilamino-5-clorobenzoxazol.
2. Acetilcolina y sus sales.
3. Aceglumato de deanol (a).
4. Espironolactona (a).
5. Acido [4-(4-hidroxi-3-yodofenoxi)-3,5-diyodefenil] acético, [(ácido 3,3’,5-triyodotiroacético) y sus sales].
6. Metotrexato (a).
7. Acido aminocaproico (a) y sus sales.
8. Cincofeno (a), sus sales, derivados y las sales de sus derivados.
9. Ácido tiroprópico (a) y sus sales.
10. Acido tricloroacético.
11. «Aconitum napellus L» (hojas, raíces y preparaciones).
12. Aconitina (principal alcaloide de «Aconitum napellus L») y sus sales.
13. «Adonis versalis L.» y sus preparaciones.
14. Epinefrina (a).
15. Alcaloides de «Rauwolfia serpentina» y sus sales.
16. Alcoholes acetilénicos, sus esteres, oxi-éteres y sus sales.
17. Isoprenalina (a).
18. lsotiocianato de alilo.
19. Aloclamida (a) y sus sales.
20. Nalorfina (a), sus sales y oxi-éteres.
21. Aminas simpaticomiméticas que actúen sobre el sistema nervioso central: Cualquier sustancia que figure en la primera lista de medicamentos cuya venta esté sujeta a la prescripción médica recogida en la Resolución A. P. (69) 2 del Consejo de Europa.
22. Aminobenceno (anilina), sus sales y derivados halogenados y sulfonados.
23. Betoxicaína (a) y sus sales.
24. Zoxazolamina (a).
25. Procainamida (a), sus sales y derivados.
26. Diaminobifenilo (bencidina).
27. Tuaminoheptano (a) (amínoheptano), sus isómeros y sus sales.
28. Octodrina (a) y sus sales.
29. 2-amino-1,2-bis (4-metoxifenil) etanol y sus sales.
30. 2-amino-4-metilhexano y sus sales.
31. Acido 4-aminosalicílico y sus sales.
32. Aminotolueno, sus isómeros, sales, derivados halogenados y sulfonados.
33. Aminoxilenos, sus isómeros, sales, derivados halogenados y sulfonados.
34. 9-(3-metil-2 buteniloxi)-7-H-furo[3,2-g][1]-benzopirano-7-ona (amidina).
35. «Ammi majus L» y sus preparaciones.
36. 2,3-dicloro-2-metilbutano (amileno clonado).
37. Andrógenos y sustancias de acción androgénica.
38. Aceite de antraceno.
39. Antibióticos, con excepción de los recogidos en el anexo IV.
40. Antimonio y sus compuestos.
41. «Apocynum cannabinum «L» y sus preparaciones.
42. 5,6,6a,7-tetrahidro-6-metil-4h-dibenzo [de,g]-10,11-diolquinolina (apomorfina) y sus sales.
43. Arsénico y sus compuestos.
44. «Atropa Belladonna L.» y sus preparaciones.
45. Atropina, sus sales y derivados.
46. Sales de bario con excepción de:
Sulfato y sulfuro en las condiciones previstas en el anexo III (primera parte).
Lacas, pigmentos o sales preparadas a partir de colorantes que figuran con la referencia (3) en la lista del anexo III (segunda parte) y con la referencia (1) en el anexo IV (segunda parte).
47. Benceno.
48. Bencimidazolona.
49. Benzoacepina benzodiacepina, sus sales y derivados.
50. Benzoato de (2-metil-2 butanol) dimetilamina y sus sales (aminolocaína).
51. Trimetilbenzoiloxipiperidina (benzamina) y sus sales.
52. Isocarboxazida (a).
53. Bendroflumetiazida (a) y derivados.
54. Berilio y sus compuestos (glucinium).
55. Bromo.
56. Tosilato de bretilio (a).
57. Carbromal (a).
58. Bromisoval (a).
59. Bromfeniramina (a) y su sales.
60. Bromuro de benzilonio (a).
61. Bromuro de tetrilamonio (a).
62. Brucina.
63. Tetracaína (a) y sus sales.
64. Mofebutazona (a).
65. Tolbutamida (a).
66. Carbutamida (a).
67. Fenilbutazona (a).
68. Cadmio y sus compuestos.
69. «Cantharis vesicatoria».
70. Cantaridina.
71. Fenprobamato (a).
72. Derivados nitrados del carbazol.
73. Disulfuro de carbono.
74. Catalasa.
75. Cefelina y sus sales.
76. Esencia de «Chenopodium ambrosioides L».
77. Cloral hidratado.
78. Cloro elemental.
79. Clorpropamida (a).
80. Difenoxilato (a).
81. Clorhidrato y/o citrato de 2,4-diaminoazobenceno (crisoidina, clorhidrato y/o citrato).
82. Clorzoxazona (a).
83. 2-cloro-4-dimetilamino-6-metilpidimidina (crimidina).
84. Clorprotixeno (a) y sus sales.
85. Clofenamida (a).
86. N-óxido de bis-(2-cloroetil) metilamina y sus sales (óxido de n-mustina).
87. Clormetina (a) y sus sales.
88. Ciclofosfamida (a) y sus sales.
89. Manomustina (a) y sus sales.
90. Butanilicaína (a) y sus sales.
91. Clormezanona (a).
92. Triparanol (a).
93. 2-(2-p-clorofenil-2-fenilacetil) indano-1,3-diona (clorofacinona).
94. Clorfenoxamina (a).
95. Fenaglicodol (a).
96. Clroetano.
97. Sales de cromo, ácido crómico sus sales.
98. «Claviceps purpurea tul», sus alcaloides y preparaciones.
99. «Conium maculatum L» (fruto, polvo y preparaciones).
100. Gliciclamida (a).
101. Bencenosulfonato de cobalto.
102. Colchicina, sus sales y derivados.
103. Colchicosido y sus derivados,
104. Colchicum Autumnale L y sus preparaciones.
105. Convalatoxina.
106. Anamirta Cocculus L (frutos).
107. Croton Tiglium L (aceite).
108. N-(Crotonilamino-4-Bencenosulfonil)-N’-Butilurea
109. Curare y curaminas.
110. Curarizantes de síntesis.
111. Acido cianhídrico y sus sales.
112. 1-Ciclohexil-3-dietilamino-1 (2-dietil-amino metil) fenilpropano y sus sales.
113. Ciclomenol (a) y sus sales.
114. Hexaciclonato de sodio (a).
115. Hexapropimato (a).
116. Dextropropoxifeno (a).
117. 0,0’-Diacetil-N-alil-desmetilmorfina.
118. Pipazetato (a) y sus sales.
119. (a, β dibromo-5,5 feniletil)-5-metil hidantoina.
120. Sales de 1,5-bis-(trimetilamonio) pentano (entre éstas el bromuro de pentametonio (a).
121. Bromuro de azametonio (a).
122. Ciclarbamato (a).
123. Clofenotano.
124. Sales de 1,6-bis (trimetilamonio) hexano (entre éstas el bromuro de haxametonio).
125. 1,2-dicloroetano (cloruro de etileno).
126. 1,1-dicloroetileno (cloruro de acetileno).
127. Lisérgido (a) y sus sales.
128. Benzoato de -3-hidroxi-4-fenil dietilaminoetilo y sus sales.
129. Cincocaino (a) y sus sales.
130. Cinamato de 3-dietilamino propilo.
131. Tiofosfato de 0,0-dietilo y 0-(4-nitrofenilo) (paration).
132. Sales de N,N’-bis-(2 dietilaminoetil) oxamida bis-2-clorobencilo (entre éstas el cloruro de ambenonio) (a).
133. Metipirilona (a) y sus sales.
134. Digitalina y todos los heteróxidos de la digital.
135. 7-(2,6-dihidroxi-4-metil-4-aza-hexil) teofilina (xantinol).
136. Dioxetedrina (a) y sus sales.
137. Piprocurano (a).
138. Propifenazona (a).
139. Tetrabenacina (a) y sus sales.
140. Captodiano (a).
141. Mefeclorazina (a) y sus sales.
142. Dimetilamina.
143. Benzoato de 1-dimetilamino-2-dimetilaminometil butilo y sus sales.
144. Metapirileno y sus sales.
143. Metamfepramona (a) y sus sales.
146. Amitriptilina (a) y sus sales.
147. Metformina (a) y sus sales.
148. Dinitrato de isosorbida (a).
149. Malonato de dinitrilo.
150. Succinato de dinitrilo.
151. Isómeros dinitrofenólicos.
152. Improcuona (a).
153. Dimevamida (a) y sus sales.
154. Difenilpiralina (a) y sus sales.
155. Sulfinpirazona (a).
156. Sales de N-(4-amino-4-oxo-3,3-difenilbutilo)-N,N-diisopropil-N-metilamonio (entre éstas el yoduro de isopropamida) (a).
157. Benacticina (a).
158. Benzatropina (a) y sus sales.
159. Ciclizina (a) y sus sales.
160. 5,5-difenil-4-tetrahidroglioxalinona.
161. Probenecida (a).
162. Disulfuro de bis (N,N-dietiltiocarbamilo) (disulfiramo) (a).
163. Emetina, sus sales y derivados.
164. Efedrina y sus sales.
165. Oxanamida (a) y derivados.
166. Eserina o fisostigmina y sus sales.
167. Esteres del ácido P-aminobenzoico (con el grupo amino libre). Exceptuados los que aparecen recogidos en el anexo V (2.ª parte).
168. Esteres de la colina y de la metilcolina y sus sales.
169. Caramifenio (a).
170. Ester dietilfosfórico del P-nitrofenol.
171. Metetoheptazina (a) y sus sales.
172. Oxofeneridina (a) y sus sales.
173. Etoheptazina (a) y sus sales.
174. Metoheptazina (a) y sus sales.
175. Metilfenidato (a) y sus sales.
176. Doxilminio (a) y sus sales.
177. Tolboxano.
178. 4-Benziloxifenol. 4-Metoxifenol. 4-Etoxifenol.
179. Paretoxicaina (a) y sus sales.
180. Fenozolona (a).
181. Glutetimida (a) y sus sales.
182. Oxido de etileno (epoxietano).
183. Bemegrida (a) y sus sales.
184. Valnoctamida (a).
185. Haloperidol (a).
186. Parametasona (a).
187. Fluanisona (a).
188. Trifluperidol (a).
189. Fluoresona (a).
190. Fluorouracilo (a).
191. Acido fluorhídrico, sus sales, complejos e hidroxifluoruros salvo excepciones recogidas en el anexo III (1.ª parte).
192. Sales de furfuriltrimetilamonio (entre éstas el yoduro de furtretonio (a).
193. Galantamina (a).
194. Gestágenos (sustancias de acción progestacional).
195. 1,2,3,4,5,6 hexaclorociclohexano (HCH).
196. 1,2,3,4,10,10 hexacloro-6,7-epoxi-1,4,4a,5,6,7,8,8a octahidro-1,4,5,8-endo-endodimetilennaftaleno (endrina).
197. Hexacloroetano.
198. 1,2,3,4,10,10 hexacloro-1,4,4a,5,8,8a hexahidro-I,4,5,8 endo-endodimetilennaftaleno (isodrina).
199. Hidrastina, hidrastinina y sus sales.
200. Hidracinas y sus sales.
201. Hidracina, sus sales y derivados.
202. Octamoxina (a) y sus sales.
203. Warfarina (a) y sus sales.
204. Bis (4-hidroxi-2-cumarinil) acetato de etilo y sales del ácido.
205. Metocarbamol (a).
206. Propatilnitrato (a).
207. 1,1-bis-[(4-hidroxi-2-oxo-2H-lbenzopirano) 3-IL] 3-metiltiopropano.
208. Fenadiazol (a).
209. Nitroxolina (a) y sus sales.
210. Hiosciamina, sus sales y derivados.
211. «Hyosciamus Níger L-» (hojas, semillas, polvo y preparaciones).
212. Pemolina (a) y sus sales.
213. Yodo.
214. Sales de 1,10-bis (trimetilamonio) decano (entre éstas el brumuro de decametonio).
215. «Ipeca Uragoga Ipecacuaha Baill» y especies parecidas (raíces y preparaciones).
216. N-(2-isopropil-4-pentenoil) urea (apronalida).
217. Santonina.
218. «Lobelia Inflata L» y preparaciones.
219. Lobelina (a) y sus sales.
220. Acido barbitúrico, sus sales y derivados.
221. Mercurio y sus compuestos a excepción de los recogidos en el anexo VI (1.ª parte).
222. Mescalina y sus sales.
223. Poliacetaldehído (metaldehído).
224. N,N-2,2 (metoxi-4-alilfenoxi) dietil acetamida y sus sales.
225. Cumetarol (a).
226. Dextrometorfano (a) y sus sales.
227. 2-metilamineheptano y sus sales.
228. Isometepteno y sus sales (a).
229. Mecamilamina (a).
230. Guaifenesina (a).
231. Dicumarol (a).
232. Fenmetrazina (a), sus sales y derivados.
233. Tiamazol (a).
234. (2-metil-2-metoxi-4-fenil)-3-4-dihidropirano cumarina (ciclo-cumarol).
235. Carisoprodol (a).
236. Meprobamato (a).
237. Tefazolina (a) y sus sales.
238. Arecolina.
239. Metilsulfato de poidina (a).
240. Hidroxicina (a).
241. β–naftol.
242. α y β naftilaminas y sus sales.
243. α, 3 naftil-4-hidroxicumarina.
244. Nafazolina (a) y sus sales.
245. Neostigmina y sus sales [entre éstas el bromuro de neostigmina (a)].
246. Nicotina y sus sales.
247. Nitritos de amilo.
248. Nitritos metálicos a excepción del nitrito de sodio.
249. Nitrobenzeno.
250. Nitrocresol y sus sales alcalinas.
251. Nitrofurantoina (a).
252. Furanzolidona (a).
253. Nitrocliclerina.
254. Acenocoumarol (a).
255. Nitroferricianuros alcalinos (nitroprusiatos).
256. Nitrostilbenos, sus homólogos y derivados.
257. Noradrenalina y sus sales.
258. Noscapina (a) y sus sales.
259. Guanetidina (a) y sus sales.
260. Estrógenos (sustancias de acción estrogénica).
261. Oleandrina.
262. Clortalidona (a).
263. Peletierina y sus sales.
264. Pentacloroetano.
265. Tetranitrato de pentaeritritilo (a).
266. Petricloral (a).
267. Octamilamina (a) y sus sales.
268. Acido pícrico.
269. Fenacemida (a).
270. Difencloxazina (a).
271. 2-fenil-1,3-indanodiona (fenindiona).
272. Etilfenacemida (a).
273. Femprocoumona (a).
274. Feniramidol.
275. Triamterena (a) y sus sales.
276. Pirofosfato de tetraetilo.
277. Fosfato de tricresilo.
278. Psilocibina (a).
279. Fósforo y fosfuros metálicos,
280. Talidomida (a) y sus sales.
281. «Physostigma venenosum balf».
282. Picrotoxina.
283. Pilocarpina y sus sales.
284. 2-bencilacetatato de α, piperidilo-L, (levofacetoperano) y sus sales.
285. Pipradol (a) y sus sales.
286. Azaciclonol (a) y sus sales.
287. Bietamiverina (a).
288. Butopiprina (a) y sus sales.
289. Plomo y sus compuestos a excepción del acetato en las condiciones previstas en el anexo IV (primera parte).
290. Coniina.
291. «Prunus lauro-cerasus L» (agua destilada de laurel cerezo).
292. Metirapona (a).
293. Sustancias radiactivas (l).
294. «Juniperus sabina L» (hojas, aceite esencial y preparaciones).
295. Escopolamina, sus sales y derivados.
296. Sales de oro.
297. Selenio y sus compuestos a excepción del disulfuro de selenio, en las condiciones previstas en el anexo III (primera parte, número 49).
298. «Solarium nigrum L» y sus preparaciones.
299. Esparteína y sus sales.
300. Glucocorticoides.
301. «Datura stramonium L» y sus preparaciones.
302. Estrofantinas, estrofantidinas y derivados.
303. «Strophanthus» (especies) y sus preparaciones.
304. Estricnina y sus sales.
305. «Strychnos» (especies) y preparaciones.
306. Estupefacientes: Aquellas sustancias recogidas en las tablas I y II de la Convención sobre Estupefacientes celebrada el 30 de marzo de 1961, en Nueva York.
307. Sulfonamidas (paraaminobencenosulfonamida y sus derivados obtenidos por sustitución de uno o varios átomos de hidrógeno ligados al átomo de nitrógeno) y sus sales.
308. Sultiamo.
309. Neodimio y sus sales.
310. Tiotepa (a).
311. «Pilocarpus jaburandi holmes» y sus preparaciones.
312. Teluro y sus compuestos.
313. Xilometazolina (a) y sus sales.
314. Tetracloroetileno.
315. Tetracloruro de carbono.
316. Tetrafosfato de hexaetilo.
317. Talio y sus compuestos.
318. Glucósidos de «thevitia nerifolia juss».
319. Etionamida (a).
320. Fenotiazina (a) y sus compuestos.
321. Tiourea y derivados, a excepción de los que aparecen en el anexo III (primera parte).
322. Mefenesina (a) y sus ésteres.
323. Vacunas, toxinas o sueros relacionados en anexo de la segunda directiva del Consejo de 20 de mayo de 1975 y que se refiere a la aproximación de disposiciones legislativas, reglamentarias y administrativas relativas a las especialidades farmacéuticas. («Diario Oficial de las Comunidades Europeas» número L 147 de 9 de junio de 1975, página 13).
324. Tranilcipromina (a) y sus sales.
325. Tricloronitrometano.
326. Tribromoetanol (avertina).
327. Triclormetina (a) y sus sales.
328. Tetramina (a).
329. Trietioduro de galamina (a).
330. «Urginea scillia stern» y sus preparaciones.
331. Veratrina y sus sales.
332. «Schoenocaulon officinale lind». (Semillas y preparaciones).
333. «Veratrum spp» y sus preparaciones.
334. Cloruro de vinilo (monómero).
335. Ergocalciferol (a) y colecalciferol (vitaminas D2 y D3).
336. Xantatos alcalinos y alkilxantatos.
337. Yohimbina y sus sales.
338. Dimetilsulfóxido (a).
339. Difenhidramina y sus sales.
340. P-butil terc-fenol.
341. P-butil terc-pirocatequina.
342. Dihidrotaquisterol (a).
343. Dioxano (dióxido de 1,4 dietileno).
344. Morfolina y sus sales.
345. «Pyrethrum album L» y sus preparaciones.
346. Maleato de pirianisamina.
347. Tripelenamina (a).
348. Tetraclorosalicilanilidas.
349. Diclorosalicilanilidas.
350. Tetrabromosalicilanilidas salvo impurezas de la tribromosalicilanilida según los criterios fijados en el anexo IV (primera parte).
351. Dibromosalicitanilidas salvo impurezas de la tribromosalicilanilida según los criterios fijados en el anexo IV (primera parte).
352. Bitionol (a).
353. Monosulfuros tiourámicos.
354. Disulfuros tiourámicos.
355. Dimetilformamida.
356. Bencilidenacetona.
357. Benzoatos de coniferilo salvo cantidades normales contenidas en esencias naturales utilizadas.
358. Furocumarinas entre estas: Trioxisalen (a) y 8-metoxipsoraleno salvo cantidades normales contenidas en esencias naturales utilizadas.
359. Aceite de semillas de «Laura nobilis L».
360. Safrol salvo cantidades normales contenidas en aceites naturales utilizados y a condición de que la concentración no sobrepase:
100 PPM en el producto determinado.
50 PPM en productos para cuidados dentarios y bucales, a condición de que el safrol no aparezca en dentífricos destinados especialmente a los niños.
361. Yodotimol.
362. 3’-etil-5’,6,7’,8’-tetrahidro-5’,6’,8’,8’-tetrametil-2’-acetonaftona(1,1,4,4-tetrametil-6-etil-7-acetil-1,2,3,4-tetrahidronaftaleno) (Acetiloetiltetramietiltetralina) (AETT).
363. 1,2-diaminobenceno y sus sales.
364. 2,4-diaminotolueno y sus sales.
365. Acido aristolóquico y sus sales.
366. Cloroformo.
367. 2, 3,7,8-tetracolorodibenzo-P-dioxifla.
368. 6-acetoxi-2,4-dimetil-1,3-dioxano (dimetoxano).
369. 2-N-óxido-tiopiridino, sal de sodio. (Piritiona sódica).
370. N-triclorometitio-4-ciclobexano-1,2-dicarboximida. (Captan),
371. 2,2’-dihidroxi-3,3’,5,5’,6,6’-hexaclorodifenilmetano (bexaclorofeno).
372. 6-(1-piperidinil)-2,4-pirimidinodiamina-3-óxido (minoxidil) y sus sales y derivados.
373. Estroncio y sus compuestos con excepción de:
Sulfuro en las condiciones previstas en el anexo III (primera parte).
Cloruro en las condiciones previstas en el anexo IV (primera parte).
Lacas, pigmentos o sales preparadas a partir de colorantes que figuran con la referencias (3) en la lista del anexo III (segunda parte) y con la referencia (1) en el anexo IV (segunda parte).
374. Zirconio y sus compuestos [con excepción de los complejos relacionados en el número 50 del anexo III (primera parte), y las lacas, pigmentos o sales de zirconio de los colorantes que figuran con la referencia (3) del anexo III (segunda parte) y con la referencia (1) en el anexo IV (segunda parte)].
375. Lidocaína.
376. Tirotricina.
Se tolerará la presencia de trazas de las sustancias comprendidas en este anexo, cuando éstas sean técnicamente inevitables como consecuencias de la aplicación de las buenas prácticas de laboratorio y siempre que se cumpla el artículo 4.º de esta Reglamentación.
(a) El nombre de sus sustancias es el recomendado como «Denominación Común Internacional» para las sustancias farmacéuticas publicadas por la Organización Mundial de la Salud. Ginebra, 1982.
(1) Se admite la presencia de sustancias radiactivas naturales procedentes de contaminaciones artificiales ambientales, a condición de que dichas sustancias radiactivas no sean enriquecidas antes de utilizarlo en la fabricación de productos cosméticos, y siempre que su concentración no supere los límites establecidos en las directivas que fijan las normas básicas relativas a la protección sanitaria de la población y de los trabajadores, frente a los peligros resultantes de las radiaciones ionizantes. («Diario Oficial de las Comunidades Europeas número 11, de 20 de febrero de 1959, páginas 221/59).



Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid