El Presidente del Consejo de Seguridad Nuclear y el Vicerrector de Investigación y de Transferencia de la Universitat Autònoma de Barcelona han suscrito, con fecha 22 de junio de 2020, un Convenio sobre la «Susceptibilidad individual de riesgo asociado con la edad ante exposición a dosis bajas y moderadas de radiación».
Para general conocimiento, y en cumplimiento de lo establecido en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, dispongo la publicación en el «Boletín Oficial del Estado» del referido Convenio, como anejo a la presente Resolución.
Madrid, 24 de junio de 2020.–El Presidente del Consejo de Seguridad Nuclear, Josep Maria Serena i Sender.
REUNIDOS
De una parte: don Josep Maria Serena i Sender, Presidente del Consejo de Seguridad Nuclear (en adelante, CSN), cargo para el que fue nombrado por el Real Decreto 227/2019, de 29 de marzo (BOE número 77, del 30), en nombre y representación de este Organismo, con domicilio en la calle Pedro Justo Dorado Dellmans n.º 11 de Madrid, y número de identificación fiscal Q2801036-A.
De otra parte: don Armand Sánchez Bonastre, Vicerrector de Investigación y de Transferencia de la Universitat Autònoma de Barcelona (en adelante, UAB), según nombramiento de la Rectora de 6 de junio de 2016, y en uso de las atribuciones que le confieren la Resolución de la Rectora de 15 de junio de 2016, que le otorga atribuciones para suscribir convenios y contratos de investigación; y con sede social en el Campus Universitari de la UAB, 08193 Bellaterra, con NIF: Q-0818002-H.
Ambos intervienen para la realización de este acto por sus respetivos cargos y en el ejercicio de las facultades que, para convenir en nombre de las Entidades a que representan, tienen conferidas y, a tal efecto,
EXPONEN
Que el CSN, como único organismo competente en materia de seguridad nuclear y protección radiológica, tiene legalmente asignada la función de establecer y evaluar el impacto radiológico de las instalaciones nucleares y radiactivas y de las actividades que impliquen el uso de radiaciones ionizantes.
Que el CSN suscribe el presente Convenio en ejercicio de la función que le atribuye su Ley de Creación (Ley 15/1980, de 22 de abril) en su artículo 2, letra p), que es la de establecer y efectuar el seguimiento de planes de investigación en materia de seguridad nuclear y protección radiológica.
Que el Plan de Investigación y Desarrollo del CSN 2016-2020, aprobado por el Pleno del CSN en junio de 2016, establece como línea de investigación la Radiobiología, siendo uno de los campos de interés para el desarrollo de las tareas reguladoras del CSN la búsqueda de nuevas evidencias sobre mecanismos de producción de daño y de respuesta biológica a las radiaciones ionizantes.
Que la UAB es un organismo público de carácter multisectorial y pluridisciplinario, que lleva a cabo actividades de docencia, investigación y desarrollo científico y tecnológico, y está interesada en colaborar con los sectores científicos y socioeconómicos de nuestro país.
Que el CSN y la UAB han colaborado en el pasado para el desarrollo de diversos proyectos de investigación, dedicados a la dosimetría biológica y a los efectos de las radiaciones ionizantes médicas sobre las personas. Todos estos proyectos se han desarrollado de forma satisfactoria para ambas Partes.
Que, a la vista de los excelentes resultados obtenidos hasta ahora, el CSN y la UAB consideran conveniente continuar realizando actividades conjuntas de investigación, encaminadas a realizar el estudio sobre «Susceptibilidad individual de riesgo asociado con la edad ante exposición a dosis bajas y moderadas de radiación».
Que el Convenio supone una cooperación entre el CSN y la UAB, en adelante las Partes, con la finalidad de garantizar que los servicios públicos que les incumben se prestan de modo que se logren los objetivos que tienen en común; y que el desarrollo de dicha cooperación se guía únicamente por consideraciones relacionadas con el interés público.
Que las Partes consideran que la colaboración entre ellas en este campo contribuirá al mejor cumplimiento de los objetivos propios de cada una de ellas, y aumentará el conocimiento científico y técnico en este ámbito en beneficio de ambas Partes.
Por todo ello, las Partes convienen en formalizar el presente Convenio con sujeción a las siguientes
CLÁUSULAS
El objetivo general de este Convenio es la realización del Proyecto titulado «Susceptibilidad individual de riesgo asociado con la edad ante exposición a dosis bajas y moderadas de radiación».
El alcance de las actividades que se considera necesario realizar para alcanzar este objetivo se detalla en la Memoria Técnica que se adjunta a este Convenio como Anexo 1.
Son obligaciones de la UAB dentro de este Convenio:
Realizar las actividades que se describen en la Memoria Técnica (Anexo 1) que se adjunta, relacionadas con los objetivos descritos en la cláusula primera.
Poner a disposición del Convenio el personal necesario para garantizar la máxima calidad de los trabajos en él incluidos.
Contribuir a la financiación de los costes del Convenio en la forma que se describe en la cláusula cuarta.
Poner a disposición del CSN los resultados, métodos, códigos, metodologías, y, en general, toda la información que se genere durante la realización de las actividades objeto de este Convenio.
Documentar los trabajos realizados dentro del Convenio, en la forma que se describe en la Memoria Técnica (Anexo 1 a este Convenio).
Son obligaciones del CSN dentro de este Convenio:
Contribuir a la financiación de los gastos del Convenio en la forma que se describe en la cláusula cuarta.
Poner a disposición de la UAB los datos e información de que disponga y que pudieran ser necesarios para la realización de los trabajos.
Aportar horas de dedicación del personal técnico que pondrá su conocimiento a disposición de los equipos de expertos, dirigiendo y supervisando las tareas y trasladando la visión reguladora durante todo el desarrollo del proyecto.
De acuerdo con el artículo 49. E), de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, las consecuencias aplicables en caso de incumplimiento de las obligaciones y compromisos asumidos por cada una de las Partes en el presente Convenio y, en su caso, los criterios para determinar la posible indemnización por el incumplimiento, se determinarán teniendo en cuenta las circunstancias concurrentes.
El coste total del Convenio comprenderá las partidas correspondientes a: recursos humanos; amortización del material inventariable durante la ejecución del proyecto; material fungible y servicios (incluida la publicación de los resultados del proyecto), y realización de viajes y dietas. Las cantidades correspondientes a cada uno de estos conceptos se detallan en la Memoria Económica que se incluye como Anexo 2 de este Convenio.
Sobre la base de estas cantidades, se obtienen unos costes totales para este proyecto de I+D plasmado en este Convenio de cuatrocientos cincuenta y un mil ochocientos cuarenta y seis euros (451.846,00 €). El CSN aportará la cantidad de doscientos diecinueve mil seiscientos cuarenta y siete euros con un céntimo (219.647,01 €), lo que corresponde a un 48,61 % del total citado. La UAB aportará doscientos treinta y dos mil ciento noventa y ocho euros con noventa y nueve céntimos (232.198,99 €), que supone un 51,39 % del coste total.
La distribución de la contribución del CSN se establece en aportaciones anuales, correspondiendo a la aplicación presupuestaria con código 23.302.424M.640, abonándose cada uno de los pagos tras la correspondiente emisión por parte de la entidad firmante de la nota de cargo, en la forma y plazos que se detallan en la Memoria Económica.
Los pagos que efectúe el CSN se realizarán siempre tras la entrega de los informes técnicos correspondientes.
Las citadas cantidades serán satisfechas por el CSN previa entrega y aceptación de la documentación que se define en la Memoria Técnica y en la Memoria Económica, y se abonarán condicionadas a la previa existencia de crédito específico y suficiente en cada ejercicio, con cumplimiento de los límites establecidos en el artículo 47 de la Ley General Presupuestaria.
Estas condiciones económicas podrán ser revisadas en caso de producirse alguna modificación de las bases del Convenio y de sus contenidos técnicos y presupuestarios.
Tanto el CSN como la UAB realizan en el mercado abierto menos del 20 % de las actividades objeto de la cooperación.
El CSN y la UAB designan respectivamente como Coordinadores Técnicos del Convenio:
Por el CSN: Asunción Díez Sacristán (Subdirección Radiológica Operacional).
Por la UAB: Anna Genescà Garrigosa (Departament de Biologia Cel·lular, Fisiologia i Immunologia).
Los Coordinadores Técnicos serán responsables de controlar el desarrollo del Convenio y de adoptar, por mutuo Convenio, las decisiones necesarias para la buena marcha de las actividades contempladas en el mismo. Para ello, podrán asesorarse de los expertos que consideren oportuno.
Los términos del Convenio se podrán revisar o modificar en cualquier momento a petición de cualquiera de las Partes, de manera que puedan introducirse, de mutuo acuerdo, tales modificaciones o revisiones.
Este Convenio queda sometido al régimen jurídico de los convenios, previsto en el Capítulo VI del Título Preliminar de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, teniendo naturaleza administrativa.
La interpretación del Convenio se realizará bajo el principio de buena fe y confianza legítima entre las Partes, que convienen en solventar de mutuo acuerdo las diferencias que pudieran presentarse en su aplicación. Para ello, surgida la controversia, cada parte designará un representante si bien, en el caso de no lograrse común Convenio, éstas someterán la cuestión a los tribunales competentes de la jurisdicción contencioso-administrativa.
Las Partes conceden, con carácter general, la calificación de información reservada a la generada en aplicación de este Convenio, por lo que asumen de buena fe el tratamiento de restricción en su utilización por sus respectivas organizaciones a salvo de su uso para el destino o finalidad pactados o de su divulgación, que habrá de ser autorizada previamente caso por caso por cada una de las Partes.
Asimismo cada una de las Partes se compromete a mantener de forma confidencial la información y/o documentación que le haya sido facilitada por las otras Partes y que, por su naturaleza, o por haberse hecho constar expresamente, tenga carácter confidencial.
Esta obligación de confidencialidad se mantendrá en vigor una vez finalizado el presente convenio.
La aplicación en otros proyectos de los conocimientos adquiridos por las Partes como consecuencia de su participación en este proyecto no estará restringida por ninguna condición adicional.
Los derechos de propiedad industrial e intelectual que recaigan sobre los trabajos o resultados de las actividades que se realicen dentro del alcance de este Convenio pertenecerán exclusivamente a las Partes, como únicos titulares de los mismos, por lo que ninguna entidad podrá divulgar dichos trabajos o resultados ni realizar explotación alguna de los derechos reconocidos sobre los mismos, incluyendo su cesión a terceros, sin contar con la previa aprobación escrita de la otra Parte.
En caso de que se obtuvieran ingresos económicos derivados de los resultados de estas investigaciones, tendrán derecho al mismo ambas Partes en la misma proporción, siendo no obstante necesario, antes de proceder al correspondiente reparto, detraer de los citados ingresos el importe de los costes y gastos que cada una de las Partes haya aportado al proyecto de conformidad con lo establecido en el presente convenio.
La difusión de los resultados del proyecto, ya sea a través de publicaciones o de presentaciones en talleres, conferencias, o mediante cualquier otro medio, hará referencia a la financiación del proyecto por parte del CSN. El contenido de este párrafo permanecerá en vigor de forma indefinida una vez finalizado el presente convenio.
La finalidad del tratamiento de los datos personales tendrá por objeto lo estipulado en la cláusula primera de este Convenio y la gestión administrativa del mismo. En desarrollo de tales finalidades, y en cumplimiento de lo previsto en el Reglamento General de Protección de Datos UE 2016/679 y la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de datos personales y garantía de los derechos digitales, cada una las Partes poseerá la condición de responsable del tratamiento.
La base legal para el tratamiento de los datos personales es la ejecución de este Convenio, así como su autorización para ejecutar el mismo y las finalidades que en éste se describen.
Los interesados podrán ejercer los derechos de acceso, rectificación, supresión, portabilidad, limitación u oposición al tratamiento aportando copia de un documento oficial que les identifique (NIF-NIE, Pasaporte), y si fuera necesaria, documentación acreditativa de su solicitud ante:
Consejo de Seguridad Nuclear.
Delegado de Protección de Datos del CSN.
Secretaría General.
C/ Pedro Justo Dorado Dellmans, 11.
28040 Madrid.
Universidad Autónoma de Barcelona.
Delegado de Protección de Datos de la UAB.
Edificio Rectorado.
Campus Universitari de la UAB.
08193 Bellaterra.
En caso de reclamación, la autoridad competente es la Agencia Española de Protección de Datos.
El plazo de conservación de los datos será el de la vigencia del presente Convenio, sin perjuicio de lo dispuesto en la normativa aplicable.
El presente Convenio se perfeccionará por la prestación del consentimiento de las Partes mediante su firma. Tendrá una vigencia de cuatro años contados a partir de su publicación en el «Boletín Oficial del Estado» previa inscripción en el Registro Electrónico estatal de Órganos e Instrumentos de Cooperación del sector público estatal.
El CSN será responsable de los trámites para la publicación en el BOE de este Convenio.
Si fuera necesario variar su plazo de ejecución, el Convenio podrá ser objeto de prórroga (máximo hasta cuatro años adicionales) por mutuo acuerdo de las Partes, siempre que se respete lo establecido en el artículo 49, letra h, de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público y la prórroga sea compatible con las obligaciones presupuestarias legalmente establecidas. En este caso, se formalizará la oportuna cláusula adicional incluyendo las condiciones de la prórroga con anterioridad a la fecha del vencimiento del Convenio.
El presente Convenio se extinguirá por el cumplimiento de las actuaciones que constituyen su objeto o por incurrir en alguna de las causas de resolución previstas en el artículo 51.2 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público. Asimismo las Partes, por motivos razonables, podrán rescindir o suspender temporalmente este Convenio, preavisando con al menos tres meses de antelación a la fecha en que la resolución deba ser efectiva.
En tal caso, el CSN y la UAB se comprometen a abonar el importe de los trabajos y/o gastos incurridos comprometidos que según el convenio corresponda abonar a cada una de estas entidades a los que ineludiblemente haya que hacer frente pese a la resolución del Convenio.
La UAB entregará al CSN un informe de los resultados obtenidos hasta el momento de la interrupción, pudiendo utilizar libremente dichos resultados, siempre que se salvaguarden las condiciones estipuladas en las cláusulas Octava y Novena.
Las Partes manifiestan su plena conformidad con el presente Convenio, en Madrid, 22 de junio de 2020.–Por el Consejo de Seguridad Nuclear, el Presidente, Josep Maria Serena i Sender.–Por la Universitat Autònoma de Barcelona, el Vicerrector de Investigación y de Transferencia, Armand Sánchez Bonastre.
Convenio entre el Consejo de Seguridad Nuclear y la Universidad Autónoma de Barcelona, para la ejecución de proyecto de I+D sobre «Susceptibilidad individual de riesgo asociado con la edad ante exposición a dosis bajas y moderadas de radiación»
Índice
Resumen.
Áreas de interés según el Plan I+D del CSN 2016-2020.
Memoria científico-técnica.
1. Antecedentes.
1.1 La exposición a dosis bajas y moderadas de radiación.
1.2 La transformación maligna de las células.
1.3 La radiosensibilidad y el envejecimiento.
1.4 Referencias.
2. Objetivos, alcance, adecuación y retornos esperados.
2.1 Hipótesis de partida.
2.2 Objetivos específicos.
2.3 Alcance.
2.4 Adecuación del proyecto al Plan Estratégico del CSN.
2.5 Retornos esperados y mejoras en protección radiológica.
3. Actividades propuestas.
3.1 Obtención de las células.
3.2 Transformación experimental premaligna de las células.
3.3 Ensayos para valorar la transformación celular maligna radioinducida.
3.4 Cambios en la expresión génica a nivel de RNA: PAM 50.
3.5 Propagación de células epiteliales mamarias de donantes sanas de dos grupos distintos de edad.
3.6 Detección de diferencias en la susceptibilidad individual a los riesgos carcinogénicos de la radiación estimados mediante la monitorización de daño en el DNA.
3.7 Referencias.
4. Plan de trabajo, cronograma y productos entregables.
4.1 Plan de trabajo detallado por tareas.
4.2 Cronograma detallado de las tareas.
4.3 Productos resultantes de las actividades (deliverables).
5. Plan de Difusión.
5.1 Niveles de difusión.
5.2 Publicaciones, congresos científicos y tesis doctorales.
5.3 Informes científico-técnicos.
5.4 Difusión on line.
6. El proyecto de investigación en el contexto nacional e internacional.
6.1 Alineación del proyecto con las directrices nacionales e internacionales de investigación.
6.2 Manifestación de interés de otros organismos públicos.
7. Resursos materiales e infraestructuras disponibles en la entidad investigadora para realizar las actividades propuestas .
8. Recursos humanos previstos para la consecución de actividades propuestas.
8.1 Experiencia del equipo sobre el tema.
8.2 Curriculum vitae.
8.3 Otros grupos de investigación en Protección Radiológica en la UAB.
8.4 Aportación del CSN.
RESUMEN
De acuerdo con el Plan de I+D del CSN (2016-2020), la investigación en radiobiología es prioritaria para mejorar el conocimiento de las bases genético-moleculares de la respuesta a las exposiciones con dosis bajas y moderadas de radiación ionizante. Los estudios en el área de interés de la radiobiología contribuyen a determinar los efectos carcinogénicos de estas dosis de radiación e identificar posibles diferencias en la susceptibilidad individual de los riesgos de la radiación. Es muy probable que las dosis de radiación a las que la población general y los trabajadores se hallan más frecuentemente expuestos sean demasiado bajas para inducir la transformación completa de las células normales en tumorales. Sin embargo, es posible que puedan inducir mutaciones promotoras capaces de completar la transformación de células premalignas. Para investigar el potencial carcinogénico de las dosis bajas y moderadas de radiación proponemos la utilización de células epiteliales, ya que de ellas derivan la mayor parte de las neoplasias en la población adulta. Entre los distintos tipos de células epiteliales se han escogido las mamarias ya que podemos disponer de células normales con facilidad a partir de reducciones mamarias estéticas. Estas células pueden transformarse experimentalmente mediante la introducción de genes seleccionados y posteriormente irradiarse con dosis bajas y moderadas de rayos X para determinar el efecto carcinogénico de las mismas y distinguir poblaciones con distinta susceptibilidad. Con el objetivo final de proporcionar datos que permitan optimizar la regulación de la exposición a radiación de la población general y de los trabajadores expuestos, proponemos un trabajo a dos niveles. En primer lugar, para determinar su potencial de transformación evaluaremos el potencial tumorigénico de las células irradiadas utilizando tres herramientas distintas: ensayo de crecimiento independiente de sustrato (en agar blando), ensayo de formación de estructuras acinares polarizadas (esferoides) en cultivos tridimensionales y análisis de expresión génica. En segundo lugar se determinará si, con la edad, existen diferencias en la susceptibilidad individual de riesgos por exposición a radiación. Para investigar esta cuestión, dispondremos de células epiteliales normales derivadas de tejido mamario sano de mujeres adultas de dos grupos de edad: mujeres menores de 27 años y mayores de 60 años. Las células serán irradiadas y se analizará la frecuencia de roturas de doble cadena de DNA en ambos grupos, así como la cinética de reparación de las lesiones. En resumen, el conjunto de experimentos propuestos permitirá conocer si las dosis bajas y moderadas de radiación son capaces de inducir la transición de las células epiteliales mamarias hacia un fenotipo maligno y si la edad es un factor de riesgo que contribuye a incrementar los efectos de la exposición a dichas dosis de radiación. La mejora de nuestro conocimiento básico de los efectos de las bajas dosis de radiación es esencial para la utilización segura de la radiación ionizante. Esta mejora en el conocimiento debe conducir a la propuesta de las reglamentaciones e instrucciones más adecuadas en materia de protección radiológica a fin de mejorar las medidas de protección radiológica y promover la confianza del público y de los trabajadores profesionalmente expuestos.
ÁREAS DE INTERÉS SEGÚN EL PLAN I+D DEL CSN 2016-2020
Línea estratégica en Protección Radiológica:
2.4.5 Radiobiología.
Trabajos de I+D recogidos en la línea estratégica 2.4.5:
Efectos de las dosis y tasas de dosis de radiación en la carcinogénesis y otros efectos como cataratas y enfermedades cardiovasculares.
Entender el impacto potencial de la susceptibilidad individual de riesgo de la radiación.
Tipo de I+D+i:
Investigación básica.
MEMORIA CIENTÍFICO-TÉCNICA
La protección radiológica es una actividad científico-técnica multidisciplinar que tiene como finalidad la protección de las personas y del medio ambiente contra los efectos nocivos que pueden resultar de la exposición a radiación ionizante. Las organizaciones internacionales y las autoridades nacionales definen las normativas aplicables para la protección radiológica en base a las evidencias científicas resultantes de proyectos de I+D. En un proyecto de investigación previo iniciamos estudios sobre los efectos biológicos de las bajas dosis de radiación con el objetivo de mejorar el conocimiento básico para la protección radiológica de las personas. En ese proyecto anterior, que fue financiado por el CSN mediante subvención en convocatoria pública competitiva, se optimizó el uso de indicadores de exposición a bajas dosis de rayos X de baja energía en células epiteliales mamarias humanas y se investigaron las consecuencias del envejecimiento in vitro de las células en la sensibilidad ante las bajas dosis de radiación. El estudio nos permitió concluir que la exposición de células epiteliales mamarias a dosis de rayos X equivalentes a las que recibe la glándula mamaria tras una sola exploración mamográfica produce un incremento estadísticamente significativo de roturas de doble cadena de DNA. Uno de los hallazgos más importantes de nuestro estudio fue observar que en las células envejecidas in vitro las lesiones radio-inducidas permanecen sin reparar durante más tiempo, convirtiéndose en sustratos propensos a reparar ilegítimamente y causando mayor daño en el genoma de las células expluestas. Los objetivos que nos marcamos en la presente propuesta de investigación han sido diseñados para resolver dos nuevas incógnitas: ¿Induce la exposición a dosis bajas y moderadas de radiación cambios capaces de conducir a la transformación maligna de las células epiteliales? ¿Aumenta con la edad la sensibilidad de las células a estas dosis de radiación?
1. Antecedentes
1.1 La exposición a dosis bajas y moderadas de radiación.
El 85 % de la radiación recibida por la población tiene un origen natural, siendo el radón la principal fuente natural. El 15% restante de radiación recibida procede de fuentes artificiales, como las radiografías de diagnóstico médico, las pruebas de medicina nuclear o la exposición ocupacional. Estos sencillos datos avalan la importancia de estudiar los efectos de las bajas dosis de radiación a fin de evaluar los riesgos en la población general y los trabajadores. Se calcula que cada persona recibe una media de 2,4 mSv/año. La ICRP (Internacional Comisión on Radiological Protection), en su publicación 99 redactada el año 2005, establece que 0,2 Gy es el límite por debajo del cual una dosis ha de ser considerada baja. Desde entonces este valor ha sido revisado y los distintos comités que velan por la radioprotección lo han situado en 0,1 Gy (ICRP Publicación 103 de 2007, BEIR VII Phase 2 de 2006 y UNSCEAR de 2012).
A nivel epidemiológico se ha establecido claramente una relación entre exposición a dosis altas de radiación e incrementos en los riesgos derivados de la exposición a las mismas. Por ejemplo, se ha concluido que la exposición a 1 Sv provoca la aparición de 5 casos de cáncer por cada 100 personas expuestas (es decir, si la incidencia basal de un tipo concreto de cáncer fuera de un 25%, esta dosis la incrementaría a un 30%). Los estudios epidemiológicos en población expuesta a dosis más bajas, si bien son más escasos, también muestran efectos significativos. Por ejemplo, se detectó un incremento en el riesgo de desarrollar cáncer de mama en mujeres que habían sido repetidamente examinadas mediante fluoroscopia torácica (0,01 Gy/exposición) por tuberculosis (Boice et al, 1991; Ronckers et al, 2010). El número de casos de cáncer por encima de lo esperado fue de 10 por cada 10000 personas por año y por Gy a la edad de 50 años. En cuanto a la exposición ocupacional, en 2007 Cardis y colaboradores realizaron un estudio de exposición a radiación en 600.000 trabajadores de 15 países diferentes que habían estado expuestos a bajas dosis de radiación a causa de su profesión. En este estudio, los autores concluyen que existe una relación dosis-efecto lineal (Cardis et al, 2007). En los estudios epidemiológicos, los efectos carcinogénicos que puedan tener las dosis situadas por debajo de 0,1 Gy son menos evidentes debido a las dificultades para discernir entre neoplasias radioinducidas y las debidas a otros factores (Brenner et al, 2003) y se requieren grupos de estudio muy grandes para encontrar diferencias estadísticamente significativas.
Dada la limitada sensibilidad de los estudios epidemiológicos para detectar cáncer radioinducido, los comités que dictan los estándares de radioprotección asumen un modelo lineal sin umbral, más conocido como Lineal No-Threshold (LNT). De acuerdo con este modelo, se asume que no existe umbral de dosis a partir del cual empiecen a producirse los efectos y que por tanto cualquier dosis de radiación, por pequeña que sea, supone un riesgo para la salud humana. El modelo LNT también asume que este riesgo sigue una relación lineal con la dosis y que se puede extrapolar a partir del riesgo de poblaciones expuestas a dosis más elevadas (Figura 1). Sin embargo, la cuantificación de riesgos tras exposición a dosis bajas de radiación sigue siendo problemática y sujeta a incertidumbre (Mullenders et al, 2009).

El modelo LNT ha sido tildado por algunos de sobreprotector al considerar que la exposición a bajas dosis de radiación puede ser beneficiosa para la salud (Tubiana et al, 2000; Feinendegen, 2005). Por el contrario, algunos de los efectos de la radiación más recientemente establecidos, tales como la persistencia y transmisibilidad de la inestabilidad genómica inducida por exposición a radiación y los efectos bystander podrían incrementar el riesgo de cáncer radioinducido por encima de la extrapolación lineal basada en el modelo LNT. De hecho, hay evidencias experimentales que indican que existen diferencias en las respuestas biológicas a radiación que dependen de la dosis y que pueden incrementar los riesgos de las bajas dosis de radiación. Concretamente, se observó que los fibroblastos expuestos a dosis de radiación por debajo de los 20 mGy (dosis a la que solo una de cada 20 células presenta roturas de doble cadena de DNA) fallan en la reparación de este importante tipo de lesiones (Rothkamm y Lobrich, 2003). El significado de estos hallazgos no está enteramente establecido, pero se trata de resultados importantes dado que estudios posteriores indican cierta negligencia por parte del punto de control del ciclo celular en G2/M que tendría un impacto en la inestabilidad genómica y la inducción de cáncer. Estos estudios indican que, si bien en general la duración de la parada en el punto de control G2/M correlaciona con el número de roturas de DNA no reparadas, existe un umbral por debajo del cual el punto de control no es eficaz. Concretamente, cuando en las células se inducen menos de 20 roturas de doble cadena de DNA (<0,2 Gy) falla la iniciación del punto de control de G2/M (Deckbar et al, 2007). Si el punto de control en G2/M no funciona, las células pueden entrar en división aunque presenten roturas en su DNA. En otras palabras, la insensibilidad del punto de control en G2/M tras la exposición a bajas dosis de radiación podría tener importantes consecuencias en la carcinogénesis radioinducida al permanecen sin reparar roturas en el DNA capaces de generar inestabilidad genómica.
En resumen, los datos epidemiológicos mencionados informan de los riesgos relacionados con la radiación tanto a dosis altas (> 1 Gy) como moderadas (1-0,1 Gy), pero son limitados los datos epidemiológicos referentes a los efectos de la exposición a dosis bajas (≤0,1 Gy). El modelo LNT ha sido desarrollado con el objetivo de permitir la estimación de los efectos de la exposición a dosis bajas de radiación. Sin embargo, algunos resultados de estudios recientes indican que este modelo no estaría perfectamente ajustado. La limitada sensibilidad de los estudios epidemiológicos hace que los estudios experimentales para monitorizar los efectos de las bajas dosis de radiación adquieran máxima relevancia.
1.2 La transformación maligna de las células.
El cáncer tiene su origen en el crecimiento de células que han adquirido cambios en genes que controlan la proliferación y la supervivencia celular. Durante el proceso de transformación, las células adquieren mutaciones genéticas y cambios epigenéticos que anulan los mecanismos normales de control de la proliferación celular. Con el fin de identificar el conjunto mínimo de cambios necesarios para la transformación de células normales, el laboratorio Weinberg desarrolló un sistema in vitro para introducir cambios genéticos definidos (Elenbaas et al, 2001). En este estudio seminal se estableció que los cambios mínimos necesarios para conducir a la transformación completa de las células epiteliales consistían en la inactivación de las vías de p53 y de pRb (lograda mediante la introducción del antígeno T-large de SV40), el mantenimiento de la longitud telomérica conferido por expresión del gen hTERT exógeno y la adquisición de una señal mitogénica proporcionada por H-Ras. La introducción de estos tres elementos génicos en células normales de tipo epitelial y fibroblastoide dio lugar a su transformación, siendo entonces capaces de formar tumores en ratones inmunodeprimidos (Elenbaas et al, 2001; Ince et al, 2007).
De los estudios de Elenbaas et al (2001) citados en el párrafo anterior se deduce que el proceso de inmortalización por expresión de telomerasa exógena es, por sí solo, insuficiente para crear una célula transformada con capacidad tumorigénica. Sin embargo, la acción combinada de agentes mutagénicos químicos y físicos en células epiteliales mamarias humanas (HMECs) previamente inmortalizadas sí es capaz de inducir la transformación maligna de las mismas. Por ejemplo, la exposición conjunta a dosis moderadas de radiación (100 mGy) y a condensado de humo de cigarrillo generó un fenotipo neoplásico en líneas celulares inmortalizadas HMECs (Botlagunta et al, 2010). El fenotipo de estas HMECs tratadas con agentes físicos y químicos se caracterizaba por mostrar el ciclo celular alterado, disminución en p53 y p21 y aumento de la movilidad y de la capacidad invasiva de las células. De manera similar, las HMECs immortalizadas e irradiadas originaban colonias celulares incapaces de establecer una polaridad y una comunicación adecuadas (Park et al, 2003), características típicas de células en progresión neoplásica (Andarawewa et al, 2007). Si bien estos estudios muestran el potencial mutagénico de las dosis altas y moderadas de radiación, los estudios experimentales llevados a cabo para valorar los efectos de las bajas dosis de radiación se han realizado únicamente en linfocitos y fibroblastos. Es importante tener en cuenta que estos dos tipos celulares son poco relevantes en neoplasias humanas dado que la mayoría de tumores malignos en adultos derivan de células epiteliales. Dadas las importantes diferencias entre tipos celulares, los estudios experimentales encaminados a investigar la transformación celular maligna inducida por exposición a radiación deben llevarse a cabo en modelos celulares adecuados, tales como los desarrollados en células de linaje epitelial.
Teniendo en cuenta los antecedentes presentados, en el presente proyecto examinaremos en primer lugar la capacidad de las dosis bajas y moderadas de radiación para inducir la transformación oncogénica de las células epiteliales mamarias premalignas derivadas de tejido normal sano. La transformación de células epiteliales mamarias requiere la introducción consecutiva de hTERT, SV40-LargeT y H-ras. Investigaremos el potencial tumorigénico de las dosis bajas y moderadas en células premalignas a las que se habrán introducido dos de los tres elementos genéticos necesarios para su transformación. De esta manera podremos determinar si estas dosis de rayos X producen mutaciones promotoras capaces de completar la transformación de las células premalignas que puedan hallarse en los tejidos de las personas adultas.
1.3 La radiosensibilidad y el envejecimiento.
En los estudios realizados en las cohortes de Hiroshima y Nagasaki se examinó el riesgo relativo de padecer cáncer radioinducido en función de la edad en el momento de la exposición (Shuryak et al, 2010). Tal y como se esperaba, el riesgo de cáncer radioinducido es superior en exposiciones recibidas durante la infancia y desciende progresivamente hasta los 30-40 años. Sorprendentemente, el riesgo de desarrollar tumores radioinducidos incrementa de nuevo cuando la exposición se produce a partir de los 40 años (Shuryak et al, 2010). Se han obtenido evidencias epidemiológicas similares que relacionan radiosensibilidad y edad en estudios realizados en adultos expuestos a dosis bajas de radiación por razones ocupacionales. Por ejemplo, en personas expuestas ocupacionalmente a radiación se demuestra una asociación positiva entre la edad de exposición y el riesgo de cáncer radioinducido, ya que se ha observado una relación dosis-efecto más pronunciada cuando se consideran las exposiciones recibidas a partir de los 45 años (Wing y Richardson, 2005). Se ha sugerido que esta distribución bimodal observada en ambos estudios refleja que los riesgos de la exposición a radiación en niños están relacionados con procesos de iniciación tumorigénica (la inducción de células premalignas irreversiblemente alteradas), mientras que en las personas de mayor edad la tumorigénesis radioinducida se debe mayormente a procesos de promoción (inducción de nuevas mutaciones en células premalignizadas) (Shuryak et al, 2010). Es importante señalar que los riesgos de cáncer radioinducido en personas mayores pueden llegar a ser el doble de lo estimado previamente, cuando sólo se consideraban los procesos de iniciación.
Dadas las evidencias epidemiológicas presentadas, se plantea la cuestión de si las dosis bajas y moderadas de radiación pueden inducir más daño en el DNA de las células de las personas de mayor edad que en las células de adultos jóvenes. La identificación de posibles variaciones en la susceptibilidad a lo largo de la vida es esencial para la optimización de protocolos de protección radiológica. En un estudio básico realizado en nuestro laboratorio concluimos que la presencia de telómeros disfuncionales en células envejecidas podría contribuir a aumentar los riesgos de la radiación en las personas de edad (Genescà y col, 2006; Soler et al, 2009). Además, parece existir un deterioro con la edad en la eficiencia de reparación de roturas de doble cadena de DNA, tanto en las vías de reunión no homóloga de extremos (Seluanov et al, 2004; Sedelnikova et al, 2008) como en las de recombinación homóloga (Mao et al, 2012). Por último, en un proyecto de investigación llevado a cabo en nuestro laboratorio gracias a una subvención del CSN demostramos una disminución en la capacidad de las células epiteliales humanas envejecidas in vitro para hacer frente al daño del DNA (Hernández et al, 2013). Nuestros resultados indican que, en células epiteliales envejecidas in vitro, las roturas de doble cadena persisten abiertas durante más tiempo y no quedan completamente reparadas (Figura 2). Ello podría explicar el mayor riesgo de cáncer radioinducido en personas de mayor edad observado en los estudios epidemiológicos de Wing y Richardson (2005) y de Shuriak et al (2010). Así pués, es importante determinar si se produce un aumento de sensibilidad en las células epiteliales de personas de mayor edad cuando se exponen a dosis bajas y moderadas de radiación.
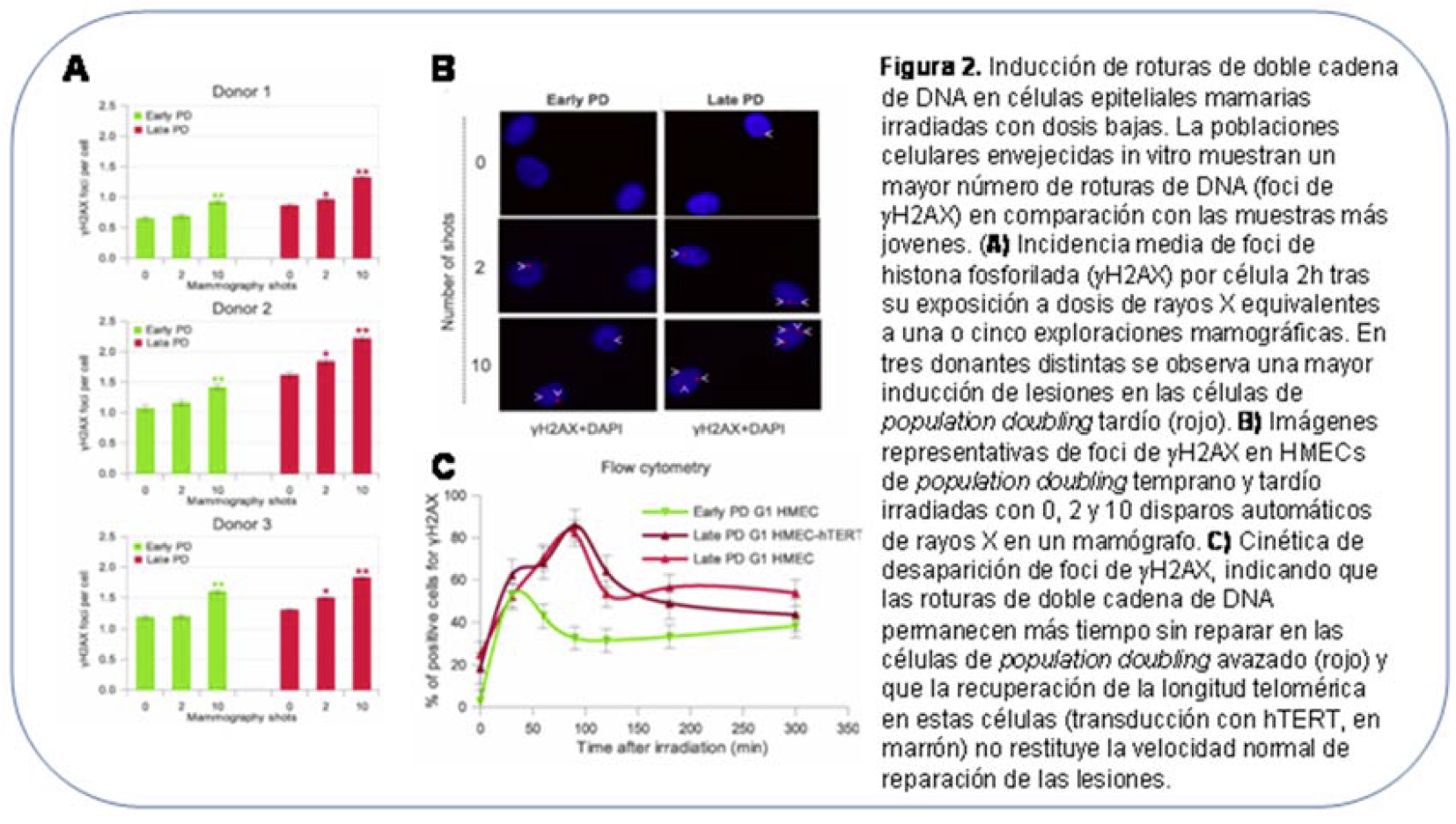
Teniendo en cuenta los resultados de los estudios epidemiológicos que muestran que en la población adulta la radiación tiene mayor efecto carcinogénico cuando la exposición se produce en personas de más edad, la segunda parte del estudio la dedicaremos a determinar si existen diferencias asociadas con la edad en los efectos de la radiación sobre las células y en los mecanismos celulares de respuesta a las lesiones radioinducidas. La respuesta individual de las células de donantes de dos grupos de edad (<27 y >60) se investigarán mediante la valoración de roturas de doble cadena de DNA y su reparación.
1.4 Referencias.
– Aisenberg AC, Finkelstein DM, Doppke KP, Koerner FC, Boivin JF, Willett CG. High risk of breast carcinoma after irradiation of young women with Hodgkin’s disease. Cancer. 1997, 79(6):1203-10.
– Andarawewa KL, Erickson AC, Chou WS, Costes SV, Gascard P, Mott JD, Bissell MJ, and Barcellos-Hoff MH. Ionizing radiation predisposes nonmalignant human mammary epithelial cells to undergo transforming growth factor β -induced epithelial to mesenchymal transition. 2007 Cancer Res 2007, 67(18):8662-8670
– Autier P, Boniol M, Middleton R, Doré JF, Héry C, Zheng T, Gavin A. Advanced breast cancer incidence following population-based mammographic screening. Ann Oncol. 2011, 22(8):1726-35.
– Botlagunta M, Winnard PT, Raman V. Neoplastic transformation of breast epithelial cells by genotoxic stress. BMC Cancer. 2010; 10: 343.
– Brenner DJ, Doll R, Goodhead DT, Hall EJ, et al. Cancer risks attributable to low doses of ionizing radiation: assessing what we really know. Proc Natl Acad Sci U S A. 2003, 100(24):13761-6.
– Cardis, E. et al. The 15-country collaborative study of cancer risk among radiation workers in the nuclear industry: estimates of radiation-related cancer risks. Radiat. Res. 167, 396–416 (2007).
– Deckbar D, Birraux J, Krempler A, Tchouandong L, Beucher A, Walker S, Stiff T, Jeggo P, Löbrich M. Chromosome breakage after G2 checkpoint release. J Cell Biol. 2007 Mar 12; 176(6):749-55.
– Elenbaas B, Spirio L, Koerner F, Fleming MD, Zimonjic DB, Donaher JL, Popescu NC, Hahn WC, Weinberg RA. Human breast cancer cells generated by oncogenic transformation of primary mammary epithelial cells. Genes Dev. 2001, 15(1): 50 -65.
– Esserman L, Shieh Y, Thompson I. Rethinking screening for breast cancer and prostate cancer. JAMA. 2009, 302(15):1685-92.
– Feinendegen, L. Evidence for beneficial low level radiation effects and radiation hormesis. Br. J. Radiol. 78, 3–7 (2005).
– Genescà A, Martin M, Latre L, Soler D, Pampalona J, Tusell L. Telomere dysfunction: a new player in radiation sensitivity. Bioessays. 2006, 28(12):1172-80.
– Hernández L, Terradas M, Martín, Feijoo P, Soler D, Tusell L, Genescà A. Increased mammogram-induced DNA damage in mammary epithelial cells aged in vitro. PLos One. 2013, 8(5):e63052
– Howe GR, McLaughlin J. Breast cancer mortality between 1950 and 1987 after exposure to fractionated moderate-dose-rate ionizing radiation in the Canadian fluoroscopy cohort study and a comparison with breast cancer mortality in the atomic bomb survivors study. Radiat Res. 1996, 145(6):694-707.
– Ince TA, Richardson AL, Bell GW, Saitoh M, Godar S, Karnoub AE, Iglehart JD, Weinberg RA. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 2007, 12(2):160-70.
– Ma H, Hill CK, Bernstein L, Ursin G. Low-dose medical radiation exposure and breast cancer risk in women under age 50 years overall and by estrogen and progesterone receptor status: results from a case-control and a case-case comparison. Breast Cancer Res Treat. 2008, 109(1):77-90.
– Mao Z, Tian X, Van Meter M, Ke Z, Gorbunova V, Seluanov A. Sirtuin 6 (SIRT6) rescues the decline of homologous recombination repair during replicative senescence. Proc Natl Acad Sci U S A. 2012, 109(29):11800-5
– Mullenders L1, Atkinson M, Paretzke H, Sabatier L, Bouffler S. Assessing cancer risks of low-dose radiation. Nat Rev Cancer. 2009 Aug; 9(8):596-604.
– Pampalona J, Frías C, Genescà A, Tusell L. Progressive telomere dysfunction causes cytokinesis failure and leads to the accumulation of polyploid cells. PLoS Genet. 2012; 8(4):e1002679.
– Park CC, Henshall-Powell RL, Erickson AC, Talhouk R, Bissell MJ, Barcellos-Hoff MH. Ionizing radiation induces heritable disruption of epithelial cell interactions. Proc Natl Acad Sci USA 2003, 100(19):10728-10733
– Romanov SR, Kozakiewicz BK, Holst CR, Stampfer MR, Haupt LM, Tlsty TD. Normal human mammary epithelial cells spontaneously escape senescence and acquire genomic changes. Nature 2001, 409(6820):633-7.
– Ronckers CM, Land CE, Miller JS, Stovall M, Lonstein JE, Doody MM. Cancer mortality among women frequently exposed to radiographic examinations for spinal disorders. Radiat Res. 2010, 174(1):83-90.
– Rothkamm, K. & Löbrich, M. Evidence for a lack of DNA double-strand break repair in human cells exposed to very low x-ray doses. Proc. Natl Acad. Sci. USA 100, 5057–5062 (2003).
– Sedelnikova OA, Horikawa I, Redon C, Nakamura A, Zimonjic DB, Popescu NC, Bonner WM. Delayed kinetics of DNA double-strand break processing in normal and pathological aging. Aging Cell. 2008, 7(1):89-100.
– Seluanov A, Mittelman D, Pereira-Smith OM, Wilson JH, Gorbunova V. DNA end joining becomes less efficient and more error-prone during cellular senescence. Proc Natl Acad Sci U S A. 2004, 101(20):7624-9
– Shuryak I, Sachs RK, Brenner DJ. Cancer risks after radiation exposure in middle age. J Natl Cancer Inst. 2010 Nov 3; 102(21):1628-36.
– Soler D, Pampalona J Tusell, Genescà A. Radiation sensitivity increases with proliferation associated telomere dysfunction in nontransformed human epithelial cells. Aging Cell. 2009, 8(4):414-25.
– Tubiana, M., Aurengo, A., Averbeck, D. & Masse, R. Recent reports on the effect of low doses of ionising radiation and its dose-effect relationship. Radiat. Environ. Biophys. 44, 245–251 (2000).
– Wing S, Richardson DB. Age at exposure to ionising radiation and cancer mortality among Hanford workers: follow up through 1994. Occup Environ Med. 2005 Jul; 62(7):465-72
2. Objetivos, alcance, adecuación y retornos esperados
2.1 Hipótesis de partida.
Las hipótesis principales del presente proyecto son: 1) Las dosis bajas y moderadas de radiación no son capaces de inducir la transformación completa de las células epiteliales mamarias normales, pero pueden completar la transformación oncogénica de las células epiteliales mamarias premalignas y 2) En la población adulta existen diferencias individuales asociadas con la edad en la respuesta a radiación que determinan diferencias en la sensibilidad individual.
2.2 Objetivos específicos.
El presente proyecto pretende avanzar en la estimación de los riesgos asociados a las dosis bajas y moderadas de radiación. Para ello hemos establecido dos objetivos básicos:
I) Determinar si la exposición a dosis bajas y moderadas de radiación puede inducir la transformación oncogénica de células premalignas.
Brevemente, dado que el proceso de transformación oncogénica es gradual, el análisis de la transformación celular radioinducida por dosis bajas y moderadas de radiación se realizará mediante diversos ensayos que proporcionen una idea ajustada de las diferentes fases de progresión tumorigénica de las células epiteliales. Por esta razón los estudios para evaluar el potencial oncogénico de la exposición a radiación incluirán diversos ensayos: crecimiento independiente de anclaje, pérdida de polaridad de las células en cultivos tridimensionales y cambios en la expresión de los genes.
II) Determinar si existen diferencias asociadas con la edad en la respuesta a radiación que puedan afectar la susceptibilidad individual de riesgo por radiación.
Mediante la aplicación de técnicas de microscopia automatizadas se investigará si existen diferencias en la cantidad de daño inducido en las células mamarias de mujeres de dos grupos de edad (<27 y >60 años). Para determinar las causas de las posibles diferencias en la radiosensibilidad asociadas con la edad se analizará la cinética de reparación de DSBs radioinducidos en células epiteliales de donantes de los dos grupos de edad.
2.3 Alcance.
Los objetivos planteados permitirán profundizar en los conocimientos básicos relativos a la transformación oncogénica inducida por exposición a dosis bajas y moderadas de radiación ionizante y establecer si existen diferencias en la sensibilidad individual asociadas con la edad. El cumplimiento de estos objetivos permitirá comprender mejor los efectos de las distintas dosis de radiación en la carcinogénesis y determinar de forma más concreta el impacto que tiene la susceptibilidad individual en el riesgo de cáncer radioinducido. Es determinante conocer cómo se desencadenan los mecanismos celulares y fisiológicos básicos que contribuyen a los efectos biológicos negativos de la radiación ionizante para así poder detectarlos y evitarlos, contribuyendo a la protección radiológica de la población.
2.4 Adecuación del proyecto al plan estratégico de I+D del CSN.
El presente proyecto se ajusta perfectamente a las actividades de promoción de la investigación del CSN en el campo la protección radiológica. El plan de I+D del CSN 2016-2020 identifica la Radiobiología (2.4.5) como una de las líneas estratégicas dentro del ámbito de la protección radiológica. En dicha línea prioritaria, el plan estratégico recoge la previsión de desarrollar los siguientes trabajos de I+D:
Efectos de las dosis y tasas de dosis de radiación en la carcinogénesis y otros efectos como cataratas y enfermedades cardiovasculares.
Entender el impacto potencial de la susceptibilidad individual de riesgo de la radiación.
Este estudio representa una contribución completa en el área de la Radiobiología ya que abarca ambas líneas estratégicas citadas en el Plan de I+D del CSN. El primer objetivo de este trabajo enfoca la investigación de los efectos de las dosis de radiación en la carcinogénesis y el segundo pretende contribuir a comprender el impacto potencial de la edad en la susceptibilidad individual de riesgo de la exposición a radiación. Por lo tanto, representa una contribución importante a las líneas prioritarias establecidas por el CSN en su actual plan estratégico de investigación y desarrollo.
El carácter básico de este estudio no se halla en contradicción con los objetivos de la I+D promovida por el CSN. El actual Plan de I+D del CSN reconoce que «La forma en que se producen los efectos biológicos de las radiaciones ionizantes y cómo evitarlos, sigue estando en la base de los conocimientos para llevar a cabo la protección radiológica». Por tanto, este estudio busca contribuir a mejorar la protección radiológica de los trabajadores y del público, ya que contribuirá a la comprensión de la respuesta biológica a radiación y a la determinación de las bases de la sensibilidad individual.
2.5 Retornos esperados y mejoras en protección radiológica.
Nuestro estudio se centra en la respuesta a dosis bajas y moderadas de radiación recogiendo uno de los elementos primordiales de investigación en protección radiológica. De hecho, en el Plan de I+D del CSN 2016-2020 se manifiesta la relevancia de las investigaciones en dichas dosis de radiación: «…sigue siendo uno de los grandes retos en radiobiología mejorar el conocimientos de las bases genético-moleculares de la respuesta celular a las exposiciones con bajas dosis de radiación ionizante, a fin de establecer de forma algo más precisa el riesgo real asociado, así como tratar de identificar las posibles diferencias en la respuesta a las radiaciones en función de las características individuales (sensibilidad individual a las radiaciones)». El conocimiento preciso de la respuesta celular y fisiológica a estas dosis de radiación y de las bases de la susceptibilidad individual es esencial para la protección radiológica de la población.
El retorno fundamental que puede obtener el CSN con el desarrollo de este proyecto es la obtención de nuevos conocimientos sobre los efectos de las exposiciones a dosis bajas y moderadas de radiación, así como información de primera mano sobre diferencias en la susceptibilidad individual relacionadas con la edad. La comprensión de los cambios relacionados con la edad que puedan comprometer la seguridad radiológica de la población de más edad se convierte en un asunto cada vez más relevante dada la evolución de la esperanza de vida en los países desarrollados.
Por otro lado, la Universidad Autónoma de Barcelona participa de manera activa en las iniciativas promovidas por la Comisión Europea en el marco del programa EURATOM a través de proyectos de investigación competitivos. Este sería otro retorno importante para el CSN, ya que se promoverían a nivel nacional programas de investigación complementarios a los de la Comisión Europea. La idea de una cofinanciación de programas europeos en el campo de las bajas dosis de radiación es uno de los pilares en los se apoya el programa Horizonte 2020 en el campo de la protección radiológica. Dicho programa establece la necesidad de promover y mantener programas de investigación en radioprotección. Por lo tanto, la sinergia establecida entre el equipo investigador de la UAB para este proyecto y el CSN, daría cumplimiento a dicha necesidad.
3. Actividades propuestas
A continuación se describen detalladamente las actividades propuestas y la metodología de Investigación que se pretende utilizar para alcanzar cada uno de los objetivos.
Objetivo 1: Investigar si la exposición a dosis bajas y moderadas de radiación puede completar la transformación de las células epiteliales mamarias humanas premalignas.
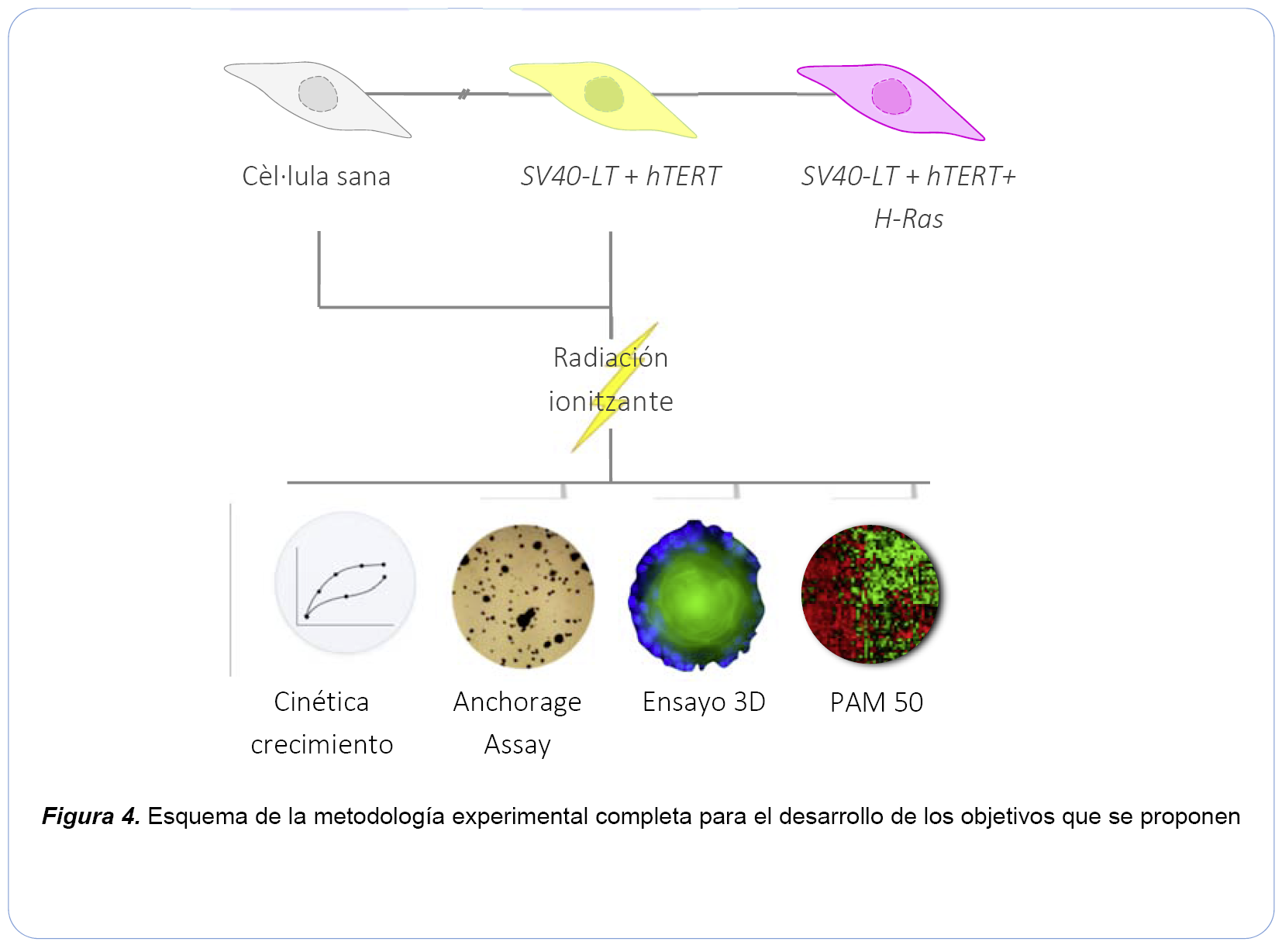
Se ha demostrado que la introducción de tres elementos genéticos SV40-LT/st, hTERT y H-Ras en células sanas comporta su transformación completa, adquiriendo la capacidad de formar tumores cuando se inoculan en ratones inmunodeprimidos (Figura 3) (Elenbaas et al, 2001; Ince et al, 2007). Para evaluar los efectos de dichas dosis de radiación dispondremos de células premalignas obtenidas mediante la introducción de cambios en dos de los tres elementos genéticos. A fin de facilitar la selección de las células que hayan adquirido los elementos genéticos se fusionará cada uno de ellos al gen de una proteína fluorescente, de manera que las células que hayan sido infectadas podrán seleccionarse gracias a la fluorescencia emitida.

En la Figura 4 se resume el diseño experimental del primer objetivo, que incluye la obtención de las células objeto de estudio (BPECs, breast primary epithelial cells) a partir de tejido mamario sano, el diseño y producción de los vectores lentivirales necesarios para la posterior modificación de las células, la infección de los cultivos celulares con los vectores lentivirales generados y su posterior selección mediante citometría gracias a la expresión de proteínas fluorescentes asociadas al gen de interés, el cultivo de las células premalignas y su irradiación con dosis bajas y moderadas de rayos X. El grado de transformación adquirido por las células tras la irradiación se valorará mediante distintos ensayos de la cinética de crecimiento de las células irradiadas, de su capacidad de proliferación independiente de sustrato, de la pérdida de polaridad de las estructuras acinares en cultivos tridimensionales y de la adquisición de cambios en el transcriptoma de las células irradiadas característicos de células transformadas.
3.1 Obtención de las células.
En nuestro laboratorio hemos obtenido células epiteliales mamarias (BPECs) a partir de tejido de mamario normal de diversas donantes (mamoplastias estéticas) utilizando las metodologías descritas por Ince et al (2007). Este modelo experimental es relevante ya que las BPECs transformadas completamente con los tres elementos genéticos descritos en apartados anteriores (hTERT, SV40-LT/st y H-Ras) son capaces de generar tumores de tipo adenocarcinoma en ratones inmunodeprimidos.
3.2 Transformación experimental premaligna de las células.
La transformación de células epiteliales derivadas de glándula mamaria normal requiere la introducción de los tres elementos genéticos: hTERT, SV40-LT/st y H-Ras. Con el fin de investigar el potencial carcinogénico de las células expuestas a dosis bajas y moderadas de radiación, obtendremos células premalignas mediante la transducción de BPECs normales con una combinación incompleta de los tres elementos genéticos (solo hTERT + SV40-LT/st) (Tarea 1). El análisis de las células pre-transformadas permitirá evaluar la susceptibilidad a la transformación como consecuencia de la exposición a radiación. Las transducciones se realizarán de forma secuencial con vectores virales de tipo lentiviral que contengan cada uno de los genes de interés (hTERT, SV40-LT/st) asociado al gen de una proteína fluorescente (CherryFP, GreenFP). La proteína fluorescente va a permitir seleccionar las poblaciones celulares que hayan incorporado el transgen. De hecho, gracias a una colaboración con el equipo de investigación del Servicio de Vectores del Centro de Investigaciones Cardiológicas de Madrid, se han clonado ya las tres construcciones genéticas (h-TERT-ChFP, SV40-LT/st-GFP y H-Ras-CFP) para la construcción de los vectores lentivirales. La eficiencia de los procedimientos de transducción se controlará valorando en las células infectadas la expresión de hTERT, p53, pRb y H-Ras tanto a nivel de mRNA (con qRT-PCR) como a nivel de proteína (Western blot) (Tarea 2). La irradiación de las células premalignas (h-TERT-ChFP–SV40-LT/st-GFP) se realizará con dosis entre 0,1-0,2 Gy y 2 Gy. En todos los experimentos se utilizaran las células completamente transformadas (h-TERT-ChFP–SV40-LT/st-GFP–H-Ras-CFP) como control positivo.
3.3 Ensayos para valorar la transformación celular maligna radioinducida.
Para analizar el efecto carcinogénico de la exposición a dosis bajas y moderadas de radiación en células premalignas se realizarán en primer lugar ensayos de proliferación independiente de anclaje (Tarea 3). Los resultados de este ensayo son valiosos dado que sólo las células capaces de proliferar en estas condiciones son capaces de generar tumores en ratones inmunodeprimidos. Brevemente, el ensayo consiste en cultivar un número limitado de células en agar blando (medio de cultivo al 0,3% de agar). Esta baja concentración de agar evita el anclaje de las células al substrato y las mantiene individualizadas. Pasados 21 días se analiza mediante la tinción con MTT la presencia de colonias de células vivas que hayan sido capaces de proliferar. Teniendo en cuenta el número de células sembradas y el número de colonias vivas, se calcula la eficiencia de la proliferación celular independiente de anclaje, que constituye una medida del grado de transformación radioinducida que han sufrido las células.
El segundo ensayo para valorar la transformación celular inducida por radiación se realizará mediante el cultivo de las células irradiadas en una matriz rica en laminina y colágeno (Matrigel). En estas condiciones las células epiteliales derivadas de la glándula mamaria normal se dividen un número limitado de veces y sufren procesos de apoptosis selectivos que dan lugar a estructuras esféricas, huecas y polarizadas parecidas a los acinos de la glándula mamaria. A diferencia de las células epiteliales mamarias normales, las células epiteliales transformadas proliferan de manera ilimitada cuando se cultivan en Matrigel y forman estructuras desorganizadas similares a los tumores de mama, que se caracterizan por la pérdida de la polaridad apicobasal y por la repoblación celular del lumen central (Weigelt y Bissel, 2008). El cultivo de las células premalignas irradiadas en Matrigel nos permitirá detectar cambios indicativos de transformación maligna, tales como los que afectan la morfología de las estructuras acinares, su polaridad o la proliferación celular (Tarea 4). La pérdida de polarización de las estructuras acinares se analizará mediante la detección de laminina V, claudina 4 y citoqueratina K14. Los cambios en la proliferación celular serán analizados con Ki67. Por último, la presencia de células apoptóticas se detectará con anticuerpos anti-caspasa.
3.4 Cambios en la expresión génica a nivel de RNA: PAM 50.
Analizaremos si la irradiación de las BPECs premalignas influye en la expresión de genes relacionados con la proliferación y la regulación de checkpoints relevantes en cáncer (Tarea 5). Los conocimientos básicos sobre el perfil de expresión génica global de los distintos tipos de tumores han permitido desarrollar plataformas para clasificar los tumores según su agresividad, riesgo de recurrencia y capacidad de metástasis a partir del análisis de RNA. Concretamente, la plataforma NanoString, que obtuvo los permisos CE Mark en 2012 y el US Food and Drug Administration en 2013, utiliza pares de sondas fluorescentes específicas para un número de genes que oscila entre 50 y 1000. Este ensayo del transcriptoma se denomina PAM 50. Gracias a una colaboración con el Dr. Aleix Prat (VHIO y Hospital Clínic de Barcelona) utilizaremos la plataforma NanoString desarrollada en su laboratorio para analizar la expresión génica de los clones derivados de células epiteliales irradiadas. Los resultados de este análisis nos permitirán establecer de qué manera la exposición a dosis bajas y moderadas de radiación condiciona la expresión de genes relevantes en cáncer.
Objetivo 2. Determinar si existen diferencias asociadas con la edad en la respuesta a radiación capaces de afectar la susceptibilidad individual de riesgo ante exposición a radiación.
Estudios recientes realizados en nuestro laboratorio indican que las células epiteliales mamarias envejecidas in vitro desencadenan respuestas ineficientes ante lesiones inducidas en su DNA con dosis bajas de radiación (Hernández et al, 2013a). Para determinar si esta respuesta ineficaz de las células se produce también con la edad, se propone la utilización de metodologías automatizadas desarrolladas en nuestro laboratorio (Hernández et al, 2013b). Estas metodologías nos permitirán cuantificar diferentes marcadores de daño y respuesta al mismo en un gran número de células epiteliales mamarias de donantes de dos grupos de edad distintos (<27 y >60 años).
3.5 Propagación de células epiteliales mamarias de donantes sanas de dos grupos distintos de edad.
Las muestras biológicas para llevar a cabo el objetivo 2 proceden de reducciones mamarias estéticas. Se analizarán muestras de células epiteliales mamarias de 12 donantes de dos grupos de edad distintos (<27 y >60 años). El cultivo in vitro de las células de donantes de los dos grupos de edad se realizará en el medio M87A, que permite el crecimiento celular sin apenas generar estrés. Con el fin de prevenir el envejecimiento in vitro de las células, sólo se utilizarán células de pase 6-8. Las células se irradiarán con dosis bajas y moderadas de rayos X. La propagación de las células de las donantes de los dos grupos de edad y su posterior irradiación constituyen la Tarea 6.
3.6 Detección de diferencias en la susceptibilidad individual a los riesgos carcinogénicos de la radiación estimados mediante la monitorización de daño en el DNA.
Para realizar este análisis se propone el uso de metodologías automatizadas que permiten cuantificar diferentes marcadores de daño y de respuesta al mismo en un gran número de células por muestra y, además, suponen un análisis objetivo. Concretamente, se investigará si existen diferencias entre muestras de donantes de distinta edad en la inducción de roturas de doble cadena de DNA y en su cinética de reparación. Esta parte del estudio se realizará mediante el análisis de la formación de foci de histona H2AX fosforilada (γH2AX) y su desaparición a lo largo del tiempo (Tarea 7). Todos los recuentos se harán con un microscopio automatizado capaz de rastrear y localizar automáticamente las células en el portaobjetos y permitir un ensayo a ciegas. Estos estudios permitirán determinar si existen diferencias interindividuales en el daño inducido por dosis moderadas de radiación como consecuencia de la edad, indicadores relacionados con la probabilidad de desarrollar cáncer.
3.7 Referencias.
– Elenbaas B, Spirio L, Koerner F, Fleming MD, Zimonjic DB, Donaher JL, Popescu NC, Hahn WC, Weinberg RA Human breast cancer cells generated by oncogenic transformation of primary mammary epithelial cells Genes Dev. 2001 January 1; 15(1): 50 -65.
– Ince TA, Richardson AL, Bell GW, Saitoh M, Godar S, Karnoub AE, Iglehart JD, Weinberg RA. Transformation of different human breast epithelial cell types leads to distinct tumor phenotypes. Cancer Cell. 2007 Aug; 12(2):160-70.
– Hammond SL, Ham RG, Stampfer MR. Serum-free growth of human mammary epithelial cells: rapid clonal growth in defined medium and extended serial passage with pituitary extract. Proc Natl Acad Sci U S A. 1984 Sep; 81(17):5435-9.
– Hernández L, Terradas M, Martín M, Feijoo P, Soler D, Tusell L, Genescà A. Increased mammogram-induced DNA damage in mammary epithelial cells aged in vitro. Plos One 2013a 8:e63052
– Hernández L, Terradas M, Martín M, Tusell L, Genescà A. Highly sensitive automated method for DNA damage assessment: gamma-H2AX foci counting and cell cycle sorting. Int J Mol Sci. 2013b Jul 30; 14(8):15810-26
– Howe GR, McLaughlin J. Breast cancer mortality between 1950 and 1987 after exposure to fractionated moderate-dose-rate ionizing radiation in the Canadian fluoroscopy cohort study and a comparison with breast cancer mortality in the atomic bomb survivors study. Radiat Res. 1996, 145(6):694-707.
– Ma H, Hill CK, Bernstein L, Ursin G. Low-dose medical radiation exposure and breast cancer risk in women under age 50 years overall and by estrogen and progesterone receptor status: results from a case-control and a case-case comparison. Breast Cancer Res Treat. 2008, 109(1):77-90.
– Ronckers CM, Land CE, Miller JS, Stovall M, Lonstein JE, Doody MM. Cancer mortality among women frequently exposed to radiographic examinations for spinal disorders. Radiat Res. 2010, 174(1):83-90.
– Weigelt B, Bissell MJ. Unraveling the microenvironmental influences on the normal mammary gland and breast cancer. Semin Cancer
4. Plan de trabajo, cronograma y productos entregables
4.1 Plan de trabajo desglosado por tareas.
A continuación se expone un listado de las tareas a realizar para cada objetivo con detalle de los miembros del equipo que participaran en cada una de ellas y periodo de ejecución.
Objetivo 1: Investigar si la exposición a dosis bajas y moderadas de radiación puede completar la transformación maligna de las células epiteliales mamarias humanas.
Tarea 1. Transducción de BPECs con hTERT + SV40-LT/st con el fin de obtener las células pre-malignas e irradiación de las muestras con dosis entre 0,01 y 1 Gy. Participantes: Anna Genescà, Teresa Anglada y David Soler.
Tarea 2. Comprobación de la eficiencia de los procedimientos de transducción de BPECs por qPCR y por Western blot de la subunidad catalítica hTERT de la telomerasa, p53, pRb y H-Ras en extractos proteicos de las células transducidas y no transducidas. Participantes: Anna Genescà, Teresa Anglada y David Soler.
Tarea 3. Ensayos de proliferación independiente de anclaje de BPECs irradiadas. Participantes: Anna Genescà, Teresa Anglada y David Soler.
Tarea 4. Detección de cambios morfogenéticos indicativos de la transformación maligna de BPECs irradiadas en mamoesferas. Participantes: Anna Genescà, Teresa Anglada y David Soler. Meses: 13-24.
Tarea 5. Análisis de la influencia de la irradiación en la expresión de genes relacionados con la proliferación celular y la regulación de checkpoints. Participantes: Anna Genescà, Teresa Anglada y David Soler.
Objetivo 2. Determinar si existen diferencias asociadas con la edad en la respuesta a radiación capaces de afectar la susceptibilidad individual de riesgo ante exposición a radiación.
Tarea 6. Propagación in vitro e irradiación de células epiteliales de doce donantes sanas de los dos grupos de edad. Participantes: Anna Genescà, Marta Martín, Teresa Anglada y Marina Rodríguez.
Tarea 7. Aplicación de metodologías automatizadas para la cuantificación objetiva de marcadores de DSBs (γH2AX) y valoración de la cinética de reparación de las lesiones en muestras de donantes de los dos grupos de edad. Participantes: Anna Genescà, Marta Martín, Teresa Anglada y Marina Rodríguez.
4.2 Cronograma detallado de las tareas.
|
Actividad |
Primer año |
Segundo año |
Tercer año |
Cuarto año |
|---|---|---|---|---|
|
T1. Transducción de BPECs con hTERT + SV40-Lt/st e irradiación de las muestras. |
X |
|||
|
T2. Control de la eficacia de transducción mediante qPCR y WB. |
X |
|||
|
T3. Ensayos de proliferación independiente de anclaje de BPECs irradiadas. |
X |
X |
||
|
T4. Detección de cambios morfogenéticos en esferoides de BPECs irradiadas. |
X |
X |
||
|
T5. Análisis de expresión de genes relacionados con la proliferación celular y la regulación de checkpoints. |
X |
X |
||
|
T6. Propagación e irradiación de células epiteliales de donantes sanas de dos grupos de edad. |
X |
X |
||
|
T7. Valoración de la inducción de DSBs y cinética de reparación de las lesiones en donantes de distinta edad. |
X |
X |
X |
4.3 Productos resultantes de las actividades.
A continuación se indican las fechas concretas de entrega de los resultados parciales y finales del proyecto, así como la naturaleza del producto (deliverable) resultante.
|
Producto Delivery |
Relación con tarea |
Descripción del producto |
Naturaleza |
|---|---|---|---|
|
D1 |
T1 |
Construcción de los vectores lentivirales h-TERT-ChFP, SV40-LT/st-GFP y H-ras-CFP. |
Experimental. |
|
D2 |
T1 |
Obtención de los modelos celulares de experimentación. |
Experimental. |
|
D3 |
T1 |
Irradiación de las muestras. |
Experimental. |
|
D4 |
T2 |
Obtención de extractos proteicos y de RNA de las células transducidas. |
Experimental. |
|
D5 |
T2 |
Determinación de los niveles de RNA y proteína de hTERT, LT/st y H-ras. |
Experimental. |
|
D6 |
T3 |
Establecimiento del ensayo de proliferación celular en agar blando. |
Experimental. |
|
D7 |
T3 |
Valoración semiautomática de la capacidad de proliferación independiente de sustrato. |
Experimental. |
|
D8 |
T4 |
Establecimiento del cultivo tridimensional de células epiteliales. |
Experimental. |
|
D9 |
T4 |
Valoración de la polarización e integridad de las estructuras tridimensionales irradiadas. |
Experimental. |
|
D10 |
T5 |
Obtención de extractos proteicos y de RNA de las células irradiadas. |
Experimental. |
|
D11 |
T5 |
Valoración de expresión de genes de proliferación y control de ciclo. |
Experimental. |
|
D12 |
T6 |
Cultivo de células epiteliales de 12 donantes de dos grupos de edad. |
Experimental. |
|
D13 |
T6 |
Irradiación de muestras de las donantes de dos grupos de edad. |
Experimental. |
|
D14 |
T7 |
Preparación de muestras para el análisis de lesiones radioinducidas. |
Experimental. |
|
D15 |
T7 |
Valoración automática de inducción y reparación de roturas de DNA. |
Experimental. |
|
D16 |
T7 |
Elaboración de modelo matemático de relación entre edad e inducción/reparación lesiones. |
Experimental. |
|
D17 |
T1 y T7 |
Informe científico-técnico de los resultados del primer año. |
Informativa. |
|
D18 |
T2, T3, T4, T6 y T7 |
Informe científico-técnico de los resultados del segundo año. |
Informativa. |
|
D19 |
T3, T4, T5 y T7 |
Informe científico-técnico de los resultados del tercer año. |
Informativa. |
|
D20 |
Todas. |
Informe científico-técnico final. |
Informativa. |
5. Plan de difusión
A continuación se detalla la forma de difusión de los resultados y conclusiones del proyecto, de manera que redunde en un beneficio para la comunidad científica y para la seguridad nuclear y la protección radiológica.
5.1 Niveles de difusión.
Identificamos dos niveles distintos de difusión de los resultados del proyecto de investigación. La primera diana de información la constituye la comunidad científica. La segunda son los organismos encargados de los programas de protección radiológica. Hemos desarrollado una estrategia de diseminación de información específica para cada uno de estos dos niveles.
5.2 Publicaciones, congresos científicos y tesis doctorales.
Los instrumentos que se utilizarán para la difusión de los resultados del proyecto de investigación a la comunidad científica van a ser las publicaciones revisadas por pares y los congresos científicos especializados. El número y nivel de las publicaciones internacionales sería el mejor aval de la calidad del trabajo que se realice. Se espera obtener como mínimo 3 publicaciones derivadas de este proyecto en revistas de elevado impacto a nivel internacional, preferentemente aquellas pertenecientes al área de Radiobiología. Se priorizarán las revistas situadas en primer decil y primer cuartil de estas categorías. Asimismo, se comunicarán los resultados obtenidos en un mínimo de dos congresos nacionales e internacionales. Por último, el trabajo desarrollado en este proyecto será de utilidad inmediata para dos de las tesis en curso en nuestro grupo de investigación.
5.3 Informes científico-técnicos.
A fin de mantener informado al CSN, se ralizarán informes periódicos de carácter científico-técnico en los que se dará información detallada de los resultados obtenidos. Se elaborará un informe preliminar al mes de la firma del convenio y otro al fin del primer año que dará cuenta de los resultados obtenidos del trabajo de preparación de los modelos experimentales y de los trabajos de propagación e irradiación de células epiteliales de donantes sanas de dos grupos de edad. Al final del segundo año se informará de los resultados obtenidos para comprobar si la introducción de los elementos genéticos ha sido exitosa, así como del resto del trabajo realizado durante la segunda anualidad. Al final del tercer año se preparará y entregará al CSN un nuevo informe que dará cuenta de los resultdos obtenido a partir de los distintos ensayos para valorar la transformación radioinducida de las células y la cinética de reparación de lesiones de DNA inducidas por radiación en células de donantes jóvenes y mayores. Por último, el informe final que se preparará al final de la cuarta anualidad contendrá los resultados obtenidos del trabajo realizado a lo largo de los cuatro años.
5.4 Difusión on line.
Dada la sensibilización de la sociedad general ante este tipo de cuestiones, descartamos la diseminación no filtrada de los resultados a la población general vía página web o similar.
Se creará un espacio del proyecto en internet con áreas privadas vinculadas al sitio web de la plataforma MELODI para la difusión de resultados a la comunidad científica especialista en temas de protección radiológica. Esta página será una herramienta útil tanto para la gestión del proyecto como para estimular la difusión y utilización de los conocimientos obtenidos.
6. El proyecto de investigación en el contexto nacional e internacional
6.1 Alineación del proyecto con las directrices nacionales e internacionales de investigación.
Las medidas actuales de protección radiológica para las personas expuestas a radiación como consecuencia de procedimientos médico-diagnósticos no tienen en consideración posibles diferencias en la susceptibilidad individual relacionadas con la edad. Sin embargo, la evolución demográfica de la población occidental recomienda prestar atención a este tema. El incremento en la esperanza de vida de la población de los países occidentales en las últimas décadas (World Health Organization & Who WHO 2012) puede conllevar un mayor riesgo de tumores radioinducidos dado que éstos tienen más tiempo para desarrollarse y progresar. Por tanto, la comprensión de los cambios relacionados con la edad que puedan comprometer a la población después de la exposición a radiación se convierte en un asunto cada vez más relevante. A este respecto, la plataforma europea responsable de la identificación de las actividades de investigación fundamentales en protección radiológica en la Unión Europea (MELODI, The Multidisciplinary European Low-Dose Initiative), y los organismos consultivos internacionales en temas de protección radiológica ICRP (Internacional Comisión on Radiation Protection), BEIR (Biological Effects of Ionizing Radiation) y UNSCEAR (United Nations Scientific Comité on the Effects of Atomic Radiation) señalan la urgente necesidad de investigar el área, hasta ahora descuidada, que concierne al potencial tumorigénico de las dosis bajas y moderadas de radiación y de las diferencias en la sensibilidad individual relacionadas con la edad ante exposición a dichas dosis.
6.2 Manifestación de interés de otros organismos públicos.
Dado que el interés del presente proyecto son los efectos de dosis bajas y moderadas de radiación, no se limita al ámbito laboral de los trabajadores expuestos sino que también puede tener importantes repercusiones en la población general expuesta a radiación por razones médico-diagnósticas, la Dirección General de Salud Pública del Ministerio de Sanidad, Servicios Sociales e Igualdad ha evaluado este proyecto de investigación y ha emitido una carta de apoyo al mismo. En ella se declara el interés de este organismo público en los objetivos y resultados que se puedan obtener en el proyecto de investigación que se presenta.
7. Recursos materiales e infraestructuras disponibles en la entidad investigadora para realizar las actividades propuestas
En las instalaciones de la UAB se dispone del equipamiento necesario para el desarrollo del proyecto de investigación. Disponemos de campanas de flujo vertical para la manipulación de muestras y células humanas, incubadores de CO2, un microscopio invertido para el control del crecimiento de las células en cultivo, un termociclador de gradiente, cubetas de electroforesis, fuentes de alimentación para electroforesis, baños termostáticos, centrífugas refrigeradas y varios microscopios de epifluorescencia equipados con cámaras y sistemas para la captura de imágenes. Además el equipo de investigación va a tener acceso a los servicios core de la Universidad como el Servicio de Citometría y el de Microscopía así como la Unidad Técnica de Protección Radiológica de la Universidad.
La experiencia del equipo de investigación abarca técnicas de cultivo celular, citogenética clásica y molecular, inmunofluorescencia para la detección in situ de proteínas, infección de células con vectores lentivirales para la activación o silenciamiento permanente de genes en las células, transfección con genes de proteínas fluorescentes para estudios de microscopía a tiempo real y técnicas de biología celular y molecular en general. Por lo que se refiere a los ensayos de tumorigenicidad, se posee experiencia en los ensayos in vitro de crecimiento independiente de sustrato, cultivo tridimensional y ensayo de invasividad.
8. Recursos humanos previstos para la consecución de las actividades propuestas
8.1 Experiencia del equipo sobre el tema.
La Dra. Anna Genescà dirige el grupo de investigación en Integridad Genómica de la UAB. Ha publicado en revistas científicas de 1er decil i 1er cuartil en las áreas de Genética y Herencia, Toxicología, Oncología y Gerontología y Geriatría. Los resultados de este equipo han contribuido a la comprensión de los mecanismos de inestabilidad genómica dependiente de disfunción telomérica, que se reconoce como un importante factor promotor de la tumorigénesis en humanos. Las células tumorales se caracterizan por su incapacidad de mantener su genoma estable y presentar una amplia variedad de aberraciones cromosómicas (Genescà et al, Adv Cancer Res. 2011; Factor de Impacto IF 6,080). Los estudios llevados a cabo por nuestro grupo de investigación demuestran que la presencia de telómeros excesivamente cortos en las células causa una mayor radiosensibilidad que puede contribuir al aumento de la sensibilidad que se observa con la edad (Genescà et al, Bioessays. 2006; IF 4,479), (Soler et al, Aging Cell. 2009; IF 7,148). Hemos demostrado que las dosis recibidas por la mama tras una sola exploración mamográfica inducen un aumento significativo en la frecuencia de roturas de doble cadena de DNA en las células epiteliales mamarias envejecidas in vitro (Hernández et al, Plos One, 2013, IF 4.092). Ello se debe a que estas células poseen vías de respuesta al daño en el DNA menos eficaces que las jóvenes (Hernández et al, Int J Mol Sci, 2013; IF 2,464). Para restaurar la integridad del genoma, la célula debe detectar y señalizar rápidamente las lesiones presentes en su genoma a fin de iniciar rápidamente el proceso de reparación y evitar la acumulación de extremos dañados que promoverían la reparación ilegítima de los mismos (Martín et al, Cell Cycle 2014; IF 5,006). Tanto las anomalías en la cinética de respuesta al daño en el DNA (Martín et al, Cancer Res. 2005; IF 9,284) como la detección incompleta de las lesiones (Martín et al, Genes Chrom & Cancer. 2009; IF 3,990) se traduce en una elevada radiosensibilidad e inestabilidad del genoma de las células (Martín et al. Mutat Res. 2012; IF 8,741). Además, sólo las lesiones del material genético contenido en el núcleo de la célula son capaces de generar una respuesta correcta (Terradas et al. Mutat Res. 2010; IF 8,741), mientras que aquellas que han quedado secuestradas en los micronúcleos son incapaces de reclutar de manera eficiente las proteínas necesarias para su reparación (Terradas et al. DNA Repair. 2009; IF 4,293. Terradas et al. Mutat Res 2012; IF 3,204). Los micronúcleos, que se habían considerado hasta hace poco indicadores de inestabilidad genómica, emergen ahora como una fuente de inestabilidad al mismo tiempo que indicadores de daño (Terradas et al. Int J Mol Sci. 2012; 13(9):11569-83; IF 2,464).
Los resultados descritos se han obtenido mediante financiación de organismos públicos nacionales e internacionales. Referente a la financiación pública internacional, la coordinadora técnica ha participado como coordinadora, work package leader o investigadora principal en un total de 6 proyectos europeos en el 3º, 4º, 5º, 6º y 7º Programa Marco. En cuanto a la financiación nacional, se ha obtenido del Consejo de Seguridad Nuclear y del Ministerio de Educación y Ciencia en convocatorias públicas competitivas.
Por lo que se refiere al conocimiento de las técnicas necesarias para el desarrollo del proyecto, los investigadores del equipo conocen y utilizan, entre otras, las técnicas de derivación de células epiteliales mamarias a partir de reducciones mamarias estéticas, las técnicas de cultivo in vitro de BPECs, los métodos de control del crecimiento celular mediante recuento de population doublings, técnicas de citometría de flujo, extracción de DNA celular para PCR, técnicas de metil-PCR para analizar el estado de metilación de promotores génicos, extracción de RNA, transcripción inversa del RNA a DNA complementario para la PCR cuantitativa en tiempo real, obtención de extractos proteicos de las células humanas, detección y cuantificación de las proteínas celulares mediante Western blot, inmunodetección fluorescente de proteínas para el análisis de microscopía de fluorescencia, obtención de células binucleadas a través de tratamiento citocalasina para el análisis de morfologías nucleares anómalas y el análisis citogenético de las células. El grupo de investigación también tiene una amplia experiencia en la transducción de genes en cultivos primarios de células epiteliales mamarias humanas utilizando vectores lentivirales, así como en técnicas de transfección de plásmidos en células inmortalizadas y en cultivos primarios de células.
8.2 Curriculum vitae.
Se incluye un breve resumen de los currículos de la investigadora principal Dra. Anna Genescà y de la Dra. Marta Martín Flix, así como una relación de las diez aportaciones científicas más relevantes del grupo de investigación, en los últimos diez años, relacionadas con la radiobiología. En la relación de aportaciones se indican los parámetros de calidad de cada una de ellas y el autor principal (*) de cada una de ellas.
Anna Genescà Garrigosa:
La investigadora principal dirige el grupo de investigación en Integridad Genómica en la Universidad Autónoma de Barcelona. El equipo ha trabajado en el mantenimiento de la integridad genómica tras exposición a radiación y ha demostrado que las dosis de rayos X correspondientes a una sola exploración mamográfica inducen un aumento de roturas del DNA en las células mamarias envejecidas, pero no en las jóvenes. Ello se debe a que las células envejecidas poseen vías de respuesta al daño en el DNA menos eficientes que las jóvenes. Los trabajos del grupo que la Dra. Genescà lidera demuestran la importancia de que la detección de las lesiones en el DNA sea rápida y completa para garantizar la reparación eficaz de las lesiones radioinducidas. Los estudios llevados a cabo por su equipo demuestran además que el comportamiento mitótico de los puentes de cromatina originados por exposición a radiación ionizante o por cualquier otra causa determina los distintos tipos de anomalías generadas en células premalignas. Los puentes que resisten sin romperse la tensión ejercida por el huso mitótico generan células tetraploides y aneuploidías. En cambio, la rotura de los puentes origina translocaciones y amplificación génica. Así pues, los cromosomas dicéntricos originados por exposición a radiación constituyen no solo un marcador de exposición sinó también una fuente de inestabilidad genómica Lo más importante es que su resolución contribuye a explicar la enorme diversidad de cambios genómicos en los tumores humanos. Las contribuciones científicas de la investigadora principal en los últimos 10 años ascienden a 28 artículos en revistas indexadas en el JCR, la mayor parte de ellos en revistas del primer cuartil y en los que figura como autora de correspondencia. Los resultados descritos se han obtenido mediante financiación de organismos públicos nacionales e internacionales. Ha participado en seis proyectos europeos (3º, 4º, 5º, 6º y 7º programas marco) y varios proyectos nacionales (convocatorias competitivas del Consejo de Seguridad Nuclear y del programa de Acciones Especiales del Ministerio de Educación y Ciencia). Uno de los objetivos principales de la investigadora ha sido crear un grupo sólido y con continuidad en la Universidad Autónoma de Barcelona.
Selección de las diez principales aportaciones científicas publicadas por los investigadores del grupo en los últimos diez años:
1. Anglada T, Repullés J, Espinal A, LaBarge MA, Stampfer MR, Genescà A*, Martín M*. Delayed γH2AX foci disappearance in mammary epithelial cells from aged women reveals an age-associated DNA repair defect. Aging. 2019 11(5):1510-1523; IF 5,179 Primer cuartil.
2. Feijoo P, Terradas M, Soler D, Domínguez D, Tusell L, Genescà A*. Breast primary epithelial cells that escape p16-dependent stasis enter a telomere-driven crisis state. Breast Cancer Res. 2016 Jan 13;18(1):7; IF 5,490 Primer cuartil.
3. Hernández L, Terradas M, Camps J, Martín M, Tusell L, Genescà A*. Aging and radiation: bad companions. Aging Cell. 2015 Apr;14(2):153-61; IF 6,340 Primer cuartil.
4. Martín M, Terradas M, Hernández L, Genescà A*. γH2AX foci on apparently intact mitotic chromosomes: not signatures of misrejoining events but signals of unresolved DNA damage. Cell Cycle.2014 13(19):3026-36; IF 4,565 Primer cuartil.
5. Pampalona J, Frías C, Genescà A, Tusell L. Progressive telomere dysfunction causes cytokinesis failure and leads to the accumulation of polyploid cells. Plos Genet. 2012 8(4):e1002679; IF 8,517 Primer decil 1.
6. Martín M, Terradas M, Tusell L, Genescà A*. ATM and DNA-PKcs make a complementary couple in DNA double strand break repair. Mutat Res. 2012; 751:29-35; IF 6,426 Primer decil.
7. Genescà A, Pampalona J, Frías C, Domínguez D, Tusell L. Role of telomere dysfunction in genetic intratumor diversity. Adv Cancer Res. 2011; 112:11-41. IF 6,733 Primer decil (R).
8. Terradas M, Martín M, Tusell L, Genescà A*. Genetic activities in micronuclei: is the DNA entrapped in micronuclei lost for the cell? Mutat Res. 2010; 705(1):60-7. IF 8,741; Primer decil.
9. Terradas M, Martín M, Tusell L, Genescà A*. DNA lesions sequestered in micronuclei induce a local defective-damage response. DNA Repair. 2009;8(10):1225-34. IF 4,199 Primer decil.
10. Soler D, Pampalona J, Tusell L, Genescà A*. Radiation sensitivity increases with proliferation-associated telomere dysfunction in nontransformed human epithelial cells. Aging Cell. 2009 Aug;8(4):414-25. IF 7,554 Primer decil.
Marta Martín Flix:
Posee 23 artículos indexados en el JCR, 17 de ellos en el primer cuartil. 11 de estas publicaciones corresponden a su etapa posdoctoral. 7 artículos tienen índices superiores a 6, siendo dos de ellos superiores a 9. En Diciembre de 2008 presentó su tesis doctoral centrada en el estudio de la radiosensibilidad de las células deficientes en ATM y en DNA-PKcs. Ambas proteínas cinasas son claves en la respuesta a las roturas de doble cadena del DNA. Como resultado de esta investigación se publicaron 5 artículos en revistas indexadas, todos ellos en primer tercil y entre ellos EMBO Reports y Cancer Research (Espejel et al, 2004; Martín et al 2005). En estos trabajos se describen los factores que contribuyen a la radiosensibilidad en estas células (Martín et al, 2012). La persistencia de los DSBs en células deficientes en ATM puede atribuirse a un déficit en la detección del daño (Martín et al, 2003 y Martín et al, 2009), mientras que en las células deficientes en DNA-PKcs se debe a una cinética más lenta en la reparación de las roturas de DNA, que favorece la reparación ilegítima y contribuye a la aparición de procesos tumorales (Espejel et al, 2004; Martín et al 2005). El denominador común de todos los proyectos que se desarrollan en el grupo es la determinación de los mecanismos que contribuyen al desarrollo de la inestabilidad cromosómica y genómica. Uno de ellos es el acortamiento telomérico y la consiguiente fusión de los extremos erosionados (Latre et al, 2003; Latre et al, 2004; Genescà et al, 2006); otro es el ambiente celular: las lesiones secuestradas en micronúcleos son incapaces de reclutar eficientemente las proteínas necesarias para su reparación (Terradas et al, 2009; Terradas et al, 2010; Terradas et al (2012). Su experiencia como investigadora y las 3 estancias en otros centros (2 predoctorales y 1 postdoctoral) le han permitido especializarse en diversas técnicas de análisis del daño en el DNA, transfección celular, microscopía de fluorescencia convencional, confocal y time-lapse. En la actualidad su línea de investigación se centra en la contribución de las vías de reparación –HR y NHEJ– a la resolución de DSBs residuales (Martín et al, 2014; Anglada et al, 2016), que son especialmente frecuentes en ambientes celulares envejecidos (Hernández et al, 2013a y b; Hernández et al; 2015). Concretamente queremos discernir la eficiencia en el reclutamiento de proteínas de reparación al DNA en células de donantes jóvenes y de más edad y determinar si ésta podría estar modulada por cambios cromatínicos (hiperacetilación de H4K16) y de la estructura nuclear (degradación de la lámina nuclear) asociados al envejecimiento.
8.3 Otros grupos de investigación en Protección Radiológica en la UAB.
Existen cuatro grupos en la Universidad Autónoma de Barcelona dedicados a la investigación básica en el área de la Protección Radiológica. Se trata de los grupos de Integridad Genómica, liderado por la Dra. Anna Genescà, el grupo de Efectos de las radiaciones ionizantes y cáncer liderado por el Dr. Joan Francesc Barquinero, el Grupo de Investigación en Radiaciones Ionizantes coordinado por el Dr. Carles Domingo y el grupo de industrias NORM, dentro del Laboratorio de Radiactividad Ambiental, liderado por el Dr. Jordi García. Estos dos últimos grupos se integran dentro de la Unidad de Física de las Radiaciones, cuyo coordinador es el Dr. Lluís Font. La actividad de los grupos de Integridad Genómica y Efectos de las radiaciones ionizantes y cáncer en PR se centra en estudios de investigación en bajas dosis de radiación, estudios de respuesta al daño en el DNA inducido por radiación, estudios de dosimetría biológica y de variabilidad interindividual. Los temas de investigación del Grupo de Investigación en Radiaciones Ionizantes incluyen la metrología, dosimetría y espectrometría de neutrones; la protección radiológica de los pacientes sometidos a radioterapia y el impacto radiológico del gas radón. Además, la UAB dispone de la Unidad Técnica de Protección Radiológica cuyas funciones principales son la de asesorar, controlar, medir y certificar que una instalación radiactiva o de radiodiagnóstico cumple con la legislación vigente en materia de protección radiológica. Esta Unidad además organiza numerosas actividades de formación en protección radiológica.
Los proyectos de investigación desarrollados por los equipos de la UAB en temas de protección radiológica han sido financiados por organismos nacionales e internacionales. Segun el informe de la Plataforma Nacional I+D en Protección Radiológica PEPRI, los organismos financiadores nacionales de los proyectos desarrollados por los cuatro grupos de investigación de la UAB durante el periodo 2009-2014 han sido principalmente el Consejo de Seguridad Nuclear, el Instituto de Salud Carlos III y los Ministerios MICINN y MINECO por un importe de 1.698.288 euros. Las herramientas para la financiación de los proyectos de investigación en Protección Radiológica de estos grupos de la UAB han sido subvenciones en convocatoria pública competitiva y convenios. En este mismo periodo de cinco años los cuatro grupos de investigación mencionados también han recibido financiación internacional en diversos programas de la Unión Europea por un importe total de 1.180.380 euros.
De acuerdo también al informe de PEPRI sobre las actividades de I+D+i en Protección Radiológica en España (2009-2014), los cuatro grupos de investigación de la UAB han publicado un total de 96 artículos en revistas científicas de alcance internacional. El índice de impacto de las revistas en las que se han publicado los artículos se encuentra entre 0,600 y 9,543. Las revistas se hallan principalmente al primer y segundo cuartil de sus áreas de conocimiento cuando se clasifican por índice de impacto. Las publicaciones se clasifican dentro de la Protección Radiológica dentro de las siguientes áreas concretas: Radiobiología y epidemiología; Detección y medida de las radiaciones; Situaciones de exposición en emergencias; Protección radiológica del público y del medio ambiente; Protección radiológica en medicina; Protección radiológica planificada y Situaciones de exposición existente. Por último, se han organizado e impartido un total de 41 cursos de formación que incluyen básicamente cursos para operadores y supervisores de instalaciones radioactivas y otros relacionados con la protección radiológica.
8.4 Aportación del CSN.
Para las tareas de supervisión y coordinación de este proyecto de I+D el Consejo de Seguridad Nuclear designa a una técnica de la Subdirección de Protección Radiológica Operacional (Asunción Díez sacristán), como experta conocedora de las aplicaciones de esta I+D a la función reguladora.
Los recursos para esta coordinación se han estimado en 30 horas/año de dedicación, horas que se estiman de producción científica, por lo que se cuantifican en la Memoria Económica del Convenio como aportación no dineraria del CSN en concepto de personal.
Convenio entre el Consejo de Seguridad Nuclear y la Universidad Autónoma de Barcelona, para la ejecución de proyecto de I+D sobre «Susceptibilidad individual de riesgo asociado con la edad ante exposición a dosis bajas y moderadas de radiación»
1. Coste total del proyecto y distribución anual
A continuación se desglosan los costes del proyecto, atendiendo a las distintas partidas (personal, material inventariable, material fungible, difusión, viajes y dietas, y otros gastos contemplados). Dada la naturaleza de este proyecto de I+D, este Convenio está exento de IVA.
1.1 Costes de personal.
|
Personal que participa en el proyecto |
Coste anual (Salario + seg social + indemniz) (euros) |
Coste mensual bruto (euros) |
Núm. de horas (*) |
Coste del Proyecto (euros) |
Contrib. de la UAB (%) |
Contrib. de la UAB (euros) |
Contrib. del CSN (%) |
Contrib. del CSN (euros) |
|---|---|---|---|---|---|---|---|---|
|
1. Investigadora Principal (AGG). |
83.475,89 |
6.956,32 |
1.640 |
83.475,89 |
100 |
83.475,89 |
0 |
0 |
|
2. Investigadora senior (MMF). |
77.389,92 |
6.449,16 |
410 |
19.347,48 |
100 |
19.347,48 |
0 |
0 |
|
3. Técnico de soporte (DSM). |
47.608,11 |
3.967,34 |
2.460 |
71.412,17 |
70 |
49.988,52 |
30 |
21.423,65 |
|
4. Investigadora postdoctoral con contrato técnico (TAP). |
40.968,72 |
3.414,06 |
2.050 |
51.210,90 |
0 |
0,00 |
100 |
51.210,90 |
|
5. Investigadora predoctoral (MRM). |
23.072,08 |
1.922,67 |
1.640 |
23.072,08 |
100 |
23.072,08 |
0 |
0,00 |
|
6. Experta del CSN (ADS). |
4.923,60 |
0 |
100 |
4.923,60 |
||||
|
Total. |
253.442,12 |
175.883,97 |
77.558,15 |
(*) Se indican las horas destinadas al proyecto de I+D, considerando que el total de horas de dedicación laboral es de 1.640 horas/año.
Anna Genescà Garrigosa (AGG, Profesora Catedrática).
Marta Martín Flix (MMF, Profesora Titular interina).
David Soler Moreno (DSM, Técnico).
Teresa Anglada Pons (TAP, Investigadora Posdoctoral).
Marina Rodríguez Muñoz (MRM, Investigadora Predoctoral).
A los costes de personal investigador, se añade la contribución del CSN en horas de una experta, Asunción Díez Sacristán (ADS, Técnica Superior del CSN), que se corresponden con un total de 120 horas para los 4 años de duración del proyecto. Atendiendo a un coste/hora de 41,03 euros/hora, esta aportación no dineraria del CSN asciende a un total de 4.923,60 euros.
1.2 Amortización de material inventariable.
|
Descripción |
Importe (euros) |
Amortización mensual (euros) |
Núm. de meses amortizables |
Dedicación al proyecto |
Contrib. del CSN |
Contrib. UAB (importe en euros) |
|---|---|---|---|---|---|---|
|
Cámara IMX249 para microscopio. |
1.000,00 |
12,50 |
42 |
100% |
0 |
525,00 |
|
Pipeteadores automáticos. |
560,00 |
7,00 |
42 |
100% |
0 |
294,00 |
|
Balanza de precisión. |
151,20 |
1,89 |
42 |
50% |
0 |
79,38 |
|
Pipeteadores automáticos Pipet Aid XP. |
551,20 |
6,89 |
42 |
100% |
0 |
289,38 |
|
Agitador magnético. |
280,00 |
3,50 |
42 |
50% |
0 |
147,00 |
|
Cubo de filtros para microscopía. |
1.000,00 |
12,50 |
42 |
100% |
0 |
525,00 |
|
Congelador -80ºC. |
10.851,00 |
135,64 |
42 |
70% |
0 |
5.696,87 |
|
Ordenadores. |
2.000,00 |
41,67 |
48 |
100% |
2.000,00 |
0 |
|
Total. |
2.000,00 |
7.556,53 |
* Amortización calculada a 80 meses de vida de los equipos, salvo en el caso de los ordenadores, que se han considerado 48 meses.
1.3 Costes de material fungible y servicios.
|
Concepto |
Importe imputable al proyecto (euros) |
Importe de la contribución del CSN (euros) |
|---|---|---|
|
Producción de modelos experimentales genéticamente modificados. |
6.000,00 |
6.000,00 |
|
Cultivos celulares de donantes de distinta edad. |
8.000,00 |
8.000,00 |
|
Reactivos para inmunoflourescencia, hibridación in situ de DNA, PCR y western blot. |
8.000,00 |
8.000,00 |
|
Filtros y bombillas para microscopio de fluorescencia. |
4.000,00 |
4.000,00 |
|
Cultivo de células (medios de cultivo y material de plástico). |
8.000,00 |
8.000,00 |
|
Servicios internos UAB (Servicio de Análisis, Servicio de Protección Radiológica, Servicio de Citometría, Servicio de Microscopía). |
12.000,00 |
12.000,00 |
|
Servicios Externos para irradiación dosis bajas, producción de vectores virales y microscopia. |
8.000,00 |
8.000,00 |
|
Publicación de resultados en revistas científicas de acceso abierto. |
14.000,00 |
14.000,00 |
|
Ensayos de expresión genética. |
4.000,00 |
4.000,00 |
|
Total. |
72.000,00 |
72.000,00 |
1.4 Viajes y dietas.
|
Concepto |
Importe imputable al proyecto (euros) |
Importe de la contribución del CSN (euros) |
|---|---|---|
|
Inscripción a congresos científicos. |
5.000 |
5.000 |
|
Viajes y dietas para atender a congresos científicos. |
6.000 |
6.000 |
|
Viaje a USA para estancia en laboratorio externo. |
2.000 |
2.000 |
|
Complemento para dietas y alojamiento durante estancia en laboratorio externo (6 meses). |
10.000 |
10.000 |
|
Total. |
23.000,00 |
23.000,00 |
1.5 Resumen del presupuesto.
|
Concepto |
Coste del Proyecto (euros) |
Contrib. UAB (euros) |
Contrib. UAB (%) |
Contrib. CSN (euros) |
Contrib. CSN (%) |
|---|---|---|---|---|---|
|
Gastos de ejecución: |
|||||
|
Personal. |
253.442,12 |
175.883,97 |
69,40 |
77.558,15 |
30,60 |
|
Inventariable. |
9.556,53 |
7.556,53 |
79,07 |
2.000,00 |
20,93 |
|
Material y servicios. |
72.000,00 |
0 |
0,00 |
72.000,00 |
100,00 |
|
Viajes y dietas. |
23.000,00 |
0 |
0,00 |
23.000,00 |
100,00 |
|
Costes directos. |
357.998,65 |
183.440,50 |
51,80 |
174.558,15 |
48,20 |
|
Aportación dineraria del CSN (excluyendo canon). |
169.634,55 |
||||
|
Canon universidad*. |
93.847,35 |
48.758,49 |
45.088,86 |
||
|
Total (Canon incluido). |
451.846,00 |
232.198,99 |
219.647,01 (**) |
* Cálculo del canon = 21% de la aportación dineraria del CSN; esta cantidad es el 26,58 % de la contribución del CSN en los costes directos.
** De este coste total aportado por el CSN una parte es contribución dineraria (214.723,41 €) y otra parte corresponde a las horas de la experta que coordina el proyecto (4.923,60 €).
Sobre la base de las cantidades que se han pormenorizado en los apartados anteriores, se obtienen unos gastos totales para este convenio de cuatrocientos cincuenta y un mil ochocientos cuarenta y seis euros (451.846,00 €). El CSN aportará la cantidad de doscientos diecinueve mil seiscientos cuarenta y siete euros con un céntimo (219.647,01 €), que corresponde a un 48,61% del total del coste. El monto restante de doscientos treinta y dos mil ciento noventa y ocho euros con noventa y nueve céntimos (232.198,99), que corresponde a un 51,39% del total del coste, serán por cuenta de la UAB.
2. Distribución anual prevista
La aportación dineraria del CSN se realizará mediante el pago correspondiente en cada ejercicio anual. Cada uno de los pagos se realizará previa entrega por parte de la UAB de la documentación (informes de progreso, informes específicos, artículos, comunicaciones,…) que refleje los trabajos realizados en el periodo a que corresponde el pago, y que se han descrito con más detalle en la memoria técnica. En lo que se refiere al último pago, se deberá presentar con un mes de antelación a la fecha prevista de pago un informe que resuma las conclusiones de la totalidad de los trabajos realizados dentro del este Convenio, haciendo referencia a toda la documentación generada a lo largo del mismo.
La distribución de los pagos se hará conforme se indica en las siguientes tablas:
|
Concepto |
1 mes después de la firma del Convenio (tras informe preliminar) |
1 año después de la firma del convenio (tras informe anual de resultados) |
2 años después de la firma del Convenio (tras informe anual de resultados) |
3 años después de la firma del Convenio (tras informe anual de resultados) |
Tras aprobación del informe final de resultados |
|---|---|---|---|---|---|
|
Gastos de ejecución. |
33.926,91 |
33.926,91 |
67.853,82 |
16.963,46 |
16.963,46 |
|
Canon universidad. |
9.017,77 |
9.017,77 |
18.035,55 |
4.508,89 |
4.508,89 |
|
Total |
42.944,68 |
42.944,68 |
85.889,37 |
21.472,34 |
21.472,34 |
Los costes se distribuirán a lo largo de cinco ejercicios presupuestarios, en la forma que se indica a continuación:
|
Año |
Importe (euros) |
|---|---|
|
2020 |
42.944,68 |
|
2021 |
42.944,68 |
|
2022 |
85.889,37 |
|
2023 |
21.472,34 |
|
2024 |
21.472,34 |
|
Total |
214.723,41 |
El CSN abonará su participación en el Proyecto con cargo a sus presupuestos anuales de gastos, previo cumplimiento de los hitos que se definen en la Memoria Técnica y en la Memoria Económica.
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid