La Directora del Instituto Nacional de Gestión Sanitaria, el Director General de la Tesorería General de la Seguridad Social y el Presidente del Consejo General de Colegios Oficiales de Farmacéuticos han suscrito un Convenio para el concierto por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia de Ceuta y Melilla.
Para general conocimiento, y en cumplimiento de lo establecido en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, dispongo la publicación en el «Boletín Oficial del Estado» del referido Convenio como anejo a la presente Resolución.
Madrid, 28 de mayo de 2021.–El Subsecretario de la Presidencia, Relaciones con las Cortes y Memoria Democrática, Antonio J. Hidalgo López.
19 de mayo de 2021.
De una parte, doña María Belén Hernando Galán, Directora del Instituto Nacional de Gestión Sanitaria (INGESA), entidad gestora de la Seguridad Social adscrita al Ministerio de Sanidad, nombrada mediante Acuerdo del Subsecretario del Departamento de fecha 24 de febrero de 2021 en virtud de las atribuciones conferidas por el artículo 15 del Real Decreto 1087/2003, de 29 de agosto (BOE de 30 de agosto), por el que se establece la estructura orgánica básica del Ministerio de Sanidad y Consumo, actual Ministerio de Sanidad, cuya estructura se encuentra actualmente recogida en el Real Decreto 735/2020, de 4 de agosto, por el que se desarrolla la estructura orgánica básica del Ministerio de Sanidad, y se modifica el Real Decreto 139/2020, de 28 de enero, por el que se establece la estructura orgánica básica de los departamentos ministeriales, y
De otra, don Andrés Harto Martínez, en calidad de Director General de la Tesorería General de la Seguridad Social (en lo sucesivo TGSS), nombrado mediante Real Decreto 132/2020, del 21 de marzo, representante legal de la misma, como servicio común de la Seguridad Social al que le compete la gestión de los recursos económicos y la administración financiera del sistema, de conformidad con el Real Decreto 1314/1984, de 20 de junio, por el que se regula la estructura y competencias de la Tesorería General de la Seguridad Social.
Y de otra, don Jesús Aguilar Santamaría, en calidad de Presidente del Consejo General de Colegios Oficiales de Farmacéuticos (en lo sucesivo CGCOF) quien interviene en nombre y representación del Colegio Oficial de Farmacéuticos de Ceuta y del Colegio Oficial de Farmacéuticos de Melilla, como Presidente del CGCOF, tras las Elecciones convocadas por el Pleno del Consejo General en su reunión de 20 de marzo de 2018 y el Acto de Toma de Posesión celebrada el 12 de junio de 2018, reconociéndose la capacidad jurídica necesaria para representar a los Farmacéuticos Titulares de las Oficinas de Farmacia de las Ciudades Autónomas de Ceuta y Melilla, de acuerdo con lo establecido en los artículos 1.3, 5 y 9 de la Ley 2/1974, de Colegios Profesionales, y Reglamento del Consejo General de Colegios Oficiales de Farmacéuticos de España, aprobado por Orden del Ministerio de la Gobernación de 16 de mayo de 1957 y sus modificaciones aprobadas por los Reales Decretos del Ministerio de Sanidad y Consumo 1774/1979, de 22 de junio; 616/1982, de 17 de marzo, y 249/1985, de 23 de enero.
Las partes, en uso de las facultades que les están conferidas,
MANIFIESTAN
Que, en virtud del artículo 15 del Real Decreto 1087/2003, de 29 de agosto, le corresponde a la Dirección del INGESA la gestión de las prestaciones sanitarias en el ámbito de las Ciudades Autónomas de Ceuta y Melilla, así como realizar cuantas funciones sean necesarias para el normal funcionamiento de sus servicios, en el marco de lo dispuesto por la disposición transitoria tercera de la Ley 14/1986, de 25 de abril, General de Sanidad.
Que, en los términos establecidos por el artículo 107.4 del Texto refundido de la Ley General de la Seguridad Social, aprobado por Decreto 2065/1974, de 30 de mayo, de los artículos 16 y 33.2 de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud y del artículo 105 del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por Real Decreto Legislativo 1/2015, de 24 de julio, la prestación farmacéutica a los usuarios del Sistema Nacional de Salud (en lo sucesivo SNS), en el ámbito territorial de las Ciudades Autónomas de Ceuta y Melilla, se realiza a través de las Oficinas de Farmacia autorizadas en las indicadas ciudades autónomas, como colaboradoras del INGESA en la realización de la prestación farmacéutica y que la concertación de las oficinas de farmacia, se realiza a través de la representación del CGCOF, tal y como establece el artículo 107.4 del Texto refundido de la Ley General de la Seguridad Social, aprobado por Decreto 2065/1974, de 30 de mayo.
Que el Concierto, por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia, suscrito el 17 de noviembre de 1998 por el INSALUD y la TGSS, con las Oficinas de Farmacia cuyos titulares estuvieron representados por el Presidente del CGCOF, ha estado vigente en el INGESA a tenor de lo dispuesto en el artículo 15.1 del Real Decreto 840/2002 por el que se modifica y desarrolla la estructura orgánica básica del Ministerio de Sanidad y Consumo, y del artículo 15 del Real Decreto 1087/2003, de 29 de agosto, incorporándose al mismo diversas adendas, para su adaptación a los nuevos requisitos legislativos de la prestación farmacéutica del sistema sanitario público.
Dicho Concierto, en aplicación de lo dispuesto en la disposición adicional 8.ª, apartado 1 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, debe entenderse que ha expirado su vigencia a partir del periodo establecido en la citada Disposición Adicional 8.ª
Por ello las partes, en uso de las facultades que les están conferidas, acuerdan suscribir el presente Convenio, manteniendo para el mismo la denominación de Concierto, atendiendo al artículo 33 de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud, que prevé la vía del concierto como mecanismo para el desarrollo de la colaboración de las oficinas de farmacia con el SNS, en el desempeño de la prestación farmacéutica a fin de garantizar el uso racional del medicamento.
En el mismo se regularán las condiciones en que debe efectuarse la prestación farmacéutica con cargo a fondos públicos del INGESA, a través de todas las Oficinas de Farmacia legalmente autorizadas en las Ciudades Autónomas de Ceuta y Melilla (en adelante Oficinas de Farmacia), con arreglo a las siguientes
CLÁUSULAS
1. Régimen Jurídico
El presente Convenio, de naturaleza jurídico administrativa, tiene por objeto establecer el Concierto por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia de Ceuta y Melilla. Se regulará, además de por sus condiciones particulares establecidas en las Clausulas y anexos de este Convenio, por la normativa sanitaria que regula la prestación farmacéutica del SNS y, en particular, por lo dispuesto en la Ley 16/2003, de 28 de mayo; en el Real Decreto 1030/2006, de 15 de septiembre, por el que se establece la cartera de servicios comunes del Sistema Nacional de Salud y el procedimiento para su actualización; y en el Real Decreto Legislativo 1/2015, de 24 de julio, que aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, quedando sometido al régimen jurídico de convenios, previsto en el Capítulo VI, Título Preliminar de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
Así mismo es de aplicación directa la normativa que regula los productos dietéticos financiables del SNS que se dispensen en Oficinas de Farmacia según lo previsto en el Real Decreto 1205/2010, de 24 de septiembre, por el que se fijan las bases para la inclusión de los alimentos dietéticos para usos médicos especiales en la prestación con productos dietéticos del Sistema Nacional de Salud y para el establecimiento de sus importes máximos de financiación; la Orden SPI/2958/2010, de 16 de noviembre, por el que se establece el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la oferta de productos dietéticos del Sistema Nacional de Salud y para la aplicación de los importes máximos de financiación, y la Orden SSI/2366/2012, de 30 de octubre, por la que se establece el factor común de facturación de la prestación con productos dietéticos.
También es de aplicación, la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, así como la normativa nacional y de la Unión Europea en materia de protección de datos aplicable, en concreto el Reglamento (UE) 2016/679, del Parlamento Europeo y del Consejo, de 27 de abril de 2016, relativo a la protección de las personas física en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la Directiva 95/467CE (Reglamento general de protección de datos); la Ley 41/2002, de 14 de noviembre, Básica Reguladora de la Autonomía del Paciente y de Derechos y Obligaciones en materia de información y documentación clínica; la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, y la Ley 39/2015 de 1 de octubre, del Procedimiento Administrativo Común de las Administraciones Públicas y demás disposiciones aplicables.
2. Objeto del Convenio
El presente Convenio tiene por objeto:
2.1 Establecer el régimen de colaboración entre las Oficinas de Farmacia legalmente establecidas en las Ciudades Autónomas de Ceuta y Melilla, como establecimientos sanitarios privados de interés público, y el INGESA, organismo encargado de la gestión de la asistencia sanitaria en las Ciudades Autónomas de Ceuta y Melilla, y concretar las condiciones económicas de los servicios profesionales relacionados con la prestación farmacéutica.
2.2 En particular, se regula lo referente a la dispensación de los productos que se relacionan a continuación, que vayan prescritos en recetas oficiales del SNS:
A) Medicamentos de uso humano fabricados industrialmente, que estén incluidos en la prestación farmacéutica del SNS, para su dispensación por las oficinas de farmacia.
B) Fórmulas magistrales y preparados oficinales comprendidos en la prestación farmacéutica del SNS, elaborados por las oficinas de farmacia de acuerdo con las normas de correcta elaboración y control de calidad y con los principios y directrices del Formulario Nacional, y que cumplan las normas de la Real Farmacopea Española, en las condiciones establecidas en este Concierto y en el artículo 43.1 del Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
C) Preparados individualizados antialérgicos, así como las vacunas individualizadas bacterianas autorizadas, preparadas a concentración y dilución específica en base a la correspondiente prescripción facultativa para un paciente determinado, de acuerdo con la normativa vigente y las condiciones establecidas en este Concierto
D) Productos sanitarios incluidos en la prestación farmacéutica del SNS (efectos y accesorios), que se dispensen por las Oficinas de Farmacia y productos sanitarios sin cupón precinto sometidos a visado y prescritos en receta oficial.
E) Productos dietéticos incluidos en la prestación con productos dietéticos financiables del SNS, que se dispensen en oficinas de farmacia.
2.3 Asimismo, se contemplan las condiciones de facturación y pago de las recetas dispensadas incluyendo la grabación de datos de las recetas oficiales en papel y de los documentos de facturación mensual en receta electrónica (en adelante DF) como elementos indispensables para el proceso de su facturación.
2.4 Además de lo anterior, promover y regular los mecanismos de colaboración de las Oficinas de Farmacia en el sistema sanitario orientados al desarrollo, la implantación de programas y la coordinación de actividades de uso racional del medicamento, atención farmacéutica, prevención de la enfermedad y mejora de la salud de la población.
3. Características de la dispensación
La dispensación de los productos reflejados en la Cláusula segunda, prescritos en formato papel o a través del Sistema de Receta Electrónica (en lo sucesivo SRE) del INGESA, en recetas oficiales y cuando sea posible, en órdenes oficiales de dispensación del SNS, se efectuarán en todas y cada una de las Oficinas de Farmacia legalmente establecidas, y siempre que sobre las mismas no se haya decretado la clausura, el cierre del establecimiento, la suspensión de su funcionamiento ni haya recaído sanción firme o se hayan adoptado medidas cautelares que les impida la dispensación o el desarrollo de cualquier otra actuación en el desempeño de la prestación farmacéutica y, en todo caso, bajo la dirección y responsabilidad de los farmacéuticos titulares de las mismas.
Los usuarios del SNS, gozarán de libertad de elección de oficina de farmacia.
Las características generales de dispensación y las condiciones de validez de las recetas oficiales son las recogidas en el anexo A y se harán extensivas a las órdenes oficiales de dispensación, cuando ello sea posible.
3.1 El SRE del INGESA, posibilita que mediante la visualización por el farmacéutico directamente en su oficina de farmacia de las prescripciones realizadas a los usuarios del SNS de Ceuta y Melilla y, previa la identificación de los mismos, pueda el farmacéutico realizar una correcta dispensación de los medicamentos con plena garantía de calidad y seguridad.
La dispensación mediante receta electrónica será realizada por todas las oficinas de farmacia, que estarán conectadas al Sistema, a través de los Colegios Oficiales de Farmacéuticos de Ceuta y Melilla (en lo sucesivo CCOOFF), según el procedimiento normalizado establecido por INGESA e informado por los citados Colegios.
3.2 La dispensación en las oficinas de farmacia de Ceuta y Melilla de las recetas electrónicas, prescritas en otra Comunidad Autónoma a los usuarios del SNS, se realizará a través del Sistema de Interoperabilidad de la Receta Electrónica del SNS, según lo contemplado en el anexo A.
El INGESA y los CCOOFF realizarán, en la medida de sus respectivas obligaciones fijadas por el Convenio las adaptaciones necesarias, para mantener la adecuación del modelo de receta electrónica del INGESA a los requisitos técnicos y funcionales descritos por el Ministerio de Sanidad, para permitir la compatibilidad e interoperabilidad con otros sistemas de receta electrónica existentes en el SNS.
3.3 Será responsabilidad del INGESA, desarrollar y mantener la aplicación de prescripción electrónica para que recoja todos los requisitos contemplados en el SRE, así como definir la arquitectura y seguridad de la red de comunicaciones que conecta el nodo Colegial Ceuta-Melilla de los CCOOFF con el INGESA y autorizar la conexión de las oficinas de farmacia al Sistema, a través de los CCOOFF, previo establecimiento del procedimiento de acreditación y gestión de la misma.
Asimismo, será responsabilidad del INGESA el mantenimiento de los sistemas que le correspondan para garantizar que el SRE esté operativo las 24 horas del día, los 365 días del año, con excepción de las imprescindibles operaciones de mantenimiento de su infraestructura que requieran un corte de servicio.
Las partes se comprometen a trabajar en la definición de los posibles escenarios de emergencias a ser soportadas por el sistema y el funcionamiento del sistema en el modo alternativo.
Será responsabilidad del INGESA proveer a todos los ciudadanos con derecho a prestación farmacéutica de su ámbito de responsabilidad de la correspondiente tarjeta sanitaria individual o documento sustitutorio de derecho a la asistencia, actualizado y legible digitalmente que permita el acceso informático a las Oficinas de Farmacia al SRE.
Será responsabilidad de los CCOOFF, el desarrollo y mantenimiento del nodo operativo las 24 horas del día, los 365 días del año, con excepción de las imprescindibles operaciones de mantenimiento de su infraestructura que requieran un corte de servicio, que permita la conexión de las Oficinas de Farmacia con el nodo de Receta Electrónica del INGESA, asegurando la autenticidad e identidad de los accesos y su confidencialidad y garantizando que sólo se conectarán desde las Oficinas de Farmacia autorizadas los profesionales farmacéuticos autorizados. Para ello, éstos deberán aportar a su respectivo Colegio Oficial de Farmacéuticos su certificado digital emitido por la Fábrica Nacional de Moneda y Timbre u otro sistema de firma válido que pueda ser acordado por la Comisión Central, número de la Oficina de Farmacia y Documento Nacional de Identidad del farmacéutico.
3.4 Las aplicaciones instaladas en las Oficinas de Farmacia, a los efectos de la dispensación electrónica y facturación reguladas en el presente Convenio, solamente transmitirán la información a través de los CCOOFF. Los citados Colegios dispondrán de los módulos de facturación y dispensación que permitan la integración y verificación de las recetas electrónicas y en papel, en la forma y procedimiento necesarios para el proceso de facturación contemplado en el anexo C y almacenarán exclusivamente los datos necesarios para la facturación de la receta electrónica, en los términos contenidos en el Real Decreto 1718/2010, de 17 de diciembre, sobre receta médica y órdenes de dispensación, siendo de aplicación la normativa nacional y de la Unión Europea en materia de protección de datos.
4. Obligaciones y compromisos económicos
El INGESA se compromete a abonar a las Oficinas de Farmacia, a través de los CCOOFF las recetas correctamente dispensadas y facturadas en las condiciones económicas siguientes:
4.1 Los medicamentos de uso humano fabricados industrialmente y los productos sanitarios, incluidos en la prestación farmacéutica así como los productos dietéticos financiables, se valorarán de acuerdo con los precios legalmente autorizados, recogidos en el Nomenclátor Oficial de la prestación farmacéutica del SNS correspondiente al mes de facturación, debidamente actualizado, y aplicando el régimen impositivo específico de las Ciudades Autónomas de Ceuta y Melilla, sin perjuicio de lo establecido en la legislación sobre aplicación de precios de referencia, precios menores y precios más bajos.
4.2 Las fórmulas magistrales y preparados oficinales incluidos como prestación farmacéutica se dispensarán y valorarán de conformidad con el procedimiento establecido en el anexo B. Así mismo los preparados individualizados antialérgicos y las vacunas individualizadas bacterianas, se regirán por lo establecido en el citado anexo, aplicando para todos estos productos el régimen impositivo específico de las Ciudades Autónomas de Ceuta y Melilla.
4.3 EL INGESA se compromete al abono de las facturas presentadas por los CCOOFF, de acuerdo con lo contemplado en el presente Convenio y anexo C del mismo, para ello se incluirá en cada ejercicio presupuestario las partidas correspondientes, con cargo a la aplicación presupuestaria del Instituto Nacional de Gestión Sanitaria, Programa 2121, Capitulo 4, Articulo 48, Concepto 489, Subconcepto 4890, Partida 48908.
4.4 Los CCOOFF, realizarán la facturación, grabación y digitalización, de acuerdo con lo dispuesto en el anexo C. Por otra parte, los CCOOFF asumirán los costes del mantenimiento del nodo que permite la conexión de las Oficinas de Farmacia con el nodo de receta electrónica del INGESA y de las adaptaciones necesarias para posibilitar la dispensación de la receta electrónica y su interoperabilidad con el SNS.
4.5 Los aspectos recogidos en el punto 2.4 de la cláusula segunda, descritos en la cláusula novena de este documento, relativos a la colaboración de los farmacéuticos de las Oficinas de Farmacia de las Ciudades Autónomas de Ceuta y Melilla, en el uso racional del medicamento y demás actuaciones relacionadas con la promoción de la salud y prevención de las enfermedades, no están sujetos a ninguna obligación ni compromiso económico por parte de INGESA.
5. Procedimiento de facturación
La facturación de recetas se realizará por los Colegios Oficiales de Farmacéuticos por meses naturales, según el procedimiento indicado en el anexo C, y se efectuará a través del procesamiento informático de las recetas en formato papel y de los identificadores de la dispensación en el caso de recetas electrónicas. Este procesamiento garantizará el conocimiento por el INGESA de los datos que se consideran necesarios para la facturación, y el correcto control de la prestación farmacéutica conforme al citado anexo C.
La facturación contendrá las recetas dispensadas en el mes que se factura. Los CCOOFF presentarán, en el tiempo y forma establecidos, la factura correspondiente a las recetas oficiales dispensadas, con el importe líquido a abonar por el INGESA según el modelo incluido en el anexo C. La factura no incorporará datos de contingentes no facturables al INGESA y especificará las deducciones que correspondan según la normativa vigente y el presente Convenio.
Asimismo, entregarán al INGESA los documentos y ficheros informáticos requeridos conforme a los plazos establecidos en el citado anexo.
6. Procedimiento de pago
6.1 Los CCOOFF, asumirán el compromiso de la deducción de la factura valorada a precio de venta al público (en adelante PVP), incluido el impuesto vigente en cada una de las Ciudades Autónomas de Ceuta y Melilla, las cantidades correspondientes a la aportación del usuario abonado por este en la Oficina de Farmacia en el momento de la dispensación y al importe resultante de la aplicación de la normativa vigente en materia de márgenes y deducciones, como son las contempladas en el Real Decreto Ley 8/2010, de 20 de mayo, por el que se adoptan medidas extraordinarias para la reducción del déficit público y Real Decreto 1193/2011, de 19 de agosto, por el que se establece el procedimiento de aplicación de la escala conjunta de deducciones a la facturación mensual de cada oficina de farmacia.
Se aplicarán además los incrementos o deducciones derivadas de los procesos de devolución que se detallan en este Convenio.
6.2 El pago de la factura será realizado en concepto de liquidación provisional, estando por tanto a resultas de los importes que se obtengan del tratamiento y comprobación de la información en la forma y condiciones dispuestas en este Convenio. Las diferencias resultantes se cargarán o abonarán en las liquidaciones de los meses posteriores.
Con carácter previo al abono de la factura, el INGESA se compromete a proceder a la comprobación de la información recibida por parte de los CCOOFF.
6.3 La forma y plazo de pago será la establecida en el anexo D de este Convenio.
De esta forma, la TGSS se compromete a hacer el pago de la factura de acuerdo con lo dispuesto en la legislación presupuestaria y dicho anexo D, cursando las órdenes de transferencia correspondientes, hasta el día 20 inclusive, del mes siguiente al que corresponda la facturación, para el abono efectivo a cada Colegio Oficial de Farmacéuticos de su correspondiente factura. Si el día 20 fuera inhábil se cursará orden de pago el primer día hábil siguiente al día 20.
En el caso de que los soportes informáticos sean devueltos por resultar con defectos técnicos o no validados entre sí, deberán ser reenviados en los plazos establecidos en el anexo C. En este sentido, el abono de la factura se pospondrá tantos días como retraso se haya producido. En caso contrario, la fecha de pago del mes siguiente se pospondrá un mes y siempre que para dicha fecha se encuentren debidamente corregidos y validados.
7. Consecuencias aplicables en caso de incumplimiento de las obligaciones de cada una de las partes en materia de deficiencias técnicas de los ficheros de facturación o incidencias de facturación
La entrega por parte de los anexo de ficheros de facturación, afectados por deficiencias técnicas que impidan su tratamiento informático, conllevara la devolución de los ficheros según lo contemplado en el anexo C del Convenio.
Adicionalmente a la comprobación de la información enviada por los CCOOFF previo al abono de la factura, el INGESA procederá a la posterior comprobación de las recetas facturadas según lo contemplado en el punto 4 del anexo C del Convenio y teniendo en cuenta las causas de nulidad de las recetas facturadas y de las devoluciones contempladas en los puntos 2 y 3 del anexo A de este Convenio. Las incidencias detectadas se comunicarán al respectivo Colegio Oficial de Farmacéuticos aplicándose los plazos e incrementos o deducciones derivadas de los procesos de devolución detallados en los mencionados anexos.
Por otra parte, los Colegios Oficiales de Farmacéuticos podrán objetar las diferencias detectadas por el INGESA, de acuerdo con lo contemplado en el punto 4.3 del anexo C de este Convenio. En caso de litigio, se aplicará el procedimiento contemplado en el referido punto 4.3 del anexo C.
8. Mecanismos de seguimiento, vigilancia y control de la ejecución del cumplimiento y aplicación del Convenio
Para garantizar e interpretar el cumplimiento y aplicación del presente Convenio se crea la Comisión Central de seguimiento, vigilancia y control de la ejecución y las Comisiones Territoriales de seguimiento, vigilancia y control de la ejecución, con las siguientes funciones y composición:
8.1 Comisiones Territoriales de seguimiento vigilancia y control de la ejecución.
En cada Ciudad Autónoma se creará una Comisión Territorial de seguimiento, y vigilancia y control de la ejecución, con actuación delegada de la Comisión Central. El funcionamiento de las Comisiones se ajustará a lo dispuesto para los órganos colegiados en la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
8.1.1 Composición:
a) Cuatro vocales, designados por la Dirección Territorial del INGESA en Ceuta o Melilla.
b) Cuatro vocales designados por el Colegio Oficial de Farmacéuticos de la ciudad autónoma correspondiente.
Corresponderá la presidencia de esta Comisión, al Director/a Territorial del INGESA en Ceuta o Melilla, o persona en quien delegue.
El secretario de la Comisión Territorial será designado por el presidente, y asistirá a las reuniones con voz, pero sin voto.
8.1.2 Funciones:
– Controlar la ejecución de los compromisos adquiridos por los firmantes, y resolver las incidencias que se produzcan en el ámbito de su demarcación, con motivo de la facturación y devolución de recetas.
– Resolver los problemas de interpretación y cumplimiento que puedan plantearse en el ámbito de su demarcación.
Las Comisiones Territoriales remitirán a la Comisión Central las correspondientes actas de sus reuniones, comunicando las incidencias surgidas en lo relativo a la facturación y devolución de recetas, informando del correcto cumplimiento del Convenio para el Concierto por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia, así como de las medidas que estimen oportuno que deban adoptarse para perfeccionar la aplicación del mismo.
8.1.3 Régimen de las Comisiones Territoriales.
Las Comisiones se reunirán, con carácter mensual y, además, cuando así lo solicite una de las partes por causa justificada.
Para la válida constitución de la comisión, a efectos de la celebración de sesiones, deliberaciones y toma de acuerdos, se requerirá la presencia, del Presidente y Secretario o en su caso, de quienes les suplan, y la de la mitad, al menos, de sus miembros.
Los acuerdos se adoptarán por mayoría y, en caso de que no se llegue a acuerdo en las causas de devolución de recetas, se remitirán a la Comisión Central, justificando adecuadamente la causa de la no resolución de la incidencia, que decidirá lo que proceda.
De cada sesión que se celebre se levantará un acta por el Secretario del cual deberá entregar un borrador a cada una de las partes en un plazo no superior a 15 días desde que se celebró la sesión.
8.2 Comisión Central de seguimiento, vigilancia y control de la ejecución.
Existirá una Comisión Central encargada de velar por el cumplimiento y aplicación del Convenio sin perjuicio de las facultades inspectoras de la Administración. La Comisión tendrá la siguiente composición y funciones:
8.2.1 Composición:
a) Seis vocales, representantes de la Administración, entre los que figurará un representante de la TGSS, designados por la Dirección de la TGSS y del INGESA.
b) Seis vocales, representantes de la organización farmacéutica colegial, designados por el CGCOF, entre los que necesariamente se encontrarán los presidentes de los CCOOFF de las Ciudades Autónomas de Ceuta y Melilla, o personas en quien éstos deleguen.
Corresponderá la presidencia de esta Comisión, al Director/a del INGESA o persona en quien delegue.
El secretario de la Comisión Central será designado por el Presidente, y asistirá a las reuniones con voz, pero sin voto.
8.2.2 Funciones:
– Controlar la ejecución de los compromisos adquiridos por los firmantes, y resolver las incidencias que se produzcan, con motivo de la facturación y devolución de recetas.
– Resolver los problemas de interpretación y cumplimiento que puedan plantearse en su ejecución.
– Analizar y resolver las adaptaciones y ajustes necesarios para el cumplimiento de los objetivos del Convenio, así como para salvar las dificultades técnicas que pudieran surgir en su aplicación.
– Proponer las medidas que procedan ante los actos de incumplimiento para su inmediata cesación y corrección.
– Proponer la creación de cuantos grupos de trabajo y comisiones técnicas se precisen para el desarrollo de los aspectos recogidos en el Convenio.
– La revisión y actualización del listado de principios activos financiables en relación con la formulación magistral, así como de las condiciones económicas para su facturación.
– Proponer a los representantes legales de cada una de las partes firmantes del presente Convenio, la aprobación o modificación de anexos o Adendas de modificación y/o desarrollo del mismo.
– Acordar la adición de nuevos acuerdos o anexos de conformidad con lo dispuesto en las cláusulas novena y undécima (11.3) del Convenio y siempre que, además de estar dentro del ámbito fijado en sus objetivos, no conlleven obligaciones económicas adicionales a las previstas en el mismo. Estos acuerdos deberán formalizarse mediante adenda, conforme a los requisitos legalmente establecidos y previa autorización prevista en el artículo 50 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
8.2.3 Régimen de la Comisión Central:
La Comisión Central se reunirá, al menos, una vez al semestre y, además, cuando así lo solicite una de las partes por causas justificadas.
Para la válida constitución de la comisión, a efectos de la celebración de sesiones, deliberaciones y toma de acuerdos, se requerirá la asistencia, presencial o a distancia, del Presidente, y Secretario o en su caso, de quienes les suplan, y la de la mitad, al menos, de sus miembros.
Los acuerdos se adoptarán por mayoría de los vocales presentes, en caso de empate, decidirá el voto de calidad del Presidente de la Comisión Central, que deberá ser aceptado por las partes, salvo los acuerdos que supongan una modificación de las condiciones económicas establecidas en este Convenio que requerirán los votos favorables de 2/3 partes. De cada sesión que se celebre se levantará un acta por el Secretario del cual deberá entregar un borrador a cada una de las partes en un plazo no superior a 15 días desde que se celebró la sesión.
9. Uso racional del medicamento y actuaciones relacionadas con la promoción de la salud y prevención de enfermedades, en las oficinas de farmacia de las ciudades autónomas de Ceuta y Melilla
Los farmacéuticos, como responsables de la asistencia farmacéutica a través de la dispensación de las recetas oficiales a los pacientes ambulatorios, colaborarán con el INGESA para garantizar el uso racional de los medicamentos en su ámbito territorial, así como la mejora de la referida asistencia mediante la implantación y desarrollo de los procedimientos y servicios de atención farmacéutica. El farmacéutico de Oficina de Farmacia, por su capacitación, accesibilidad y cercanía al usuario es un agente esencial en la asistencia sanitaria al paciente.
El INGESA promoverá, en los términos previstos en el artículo 86 del texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, aprobado por Real Decreto Legislativo 1/2015, de 24 de julio, la participación de los farmacéuticos en el seguimiento del tratamiento cooperando con el facultativo responsable del tratamiento a través de los procedimientos de atención farmacéutica, contribuyendo a mejorar el uso de los medicamentos y participando en la realización del conjunto de actividades destinadas a la utilización racional de los medicamentos, en orden a mejorar el cumplimiento terapéutico, en los tratamientos. Para ello se fomentará el desarrollo de los protocolos y herramientas necesarias para permitir el registro adecuado de las mismas y la comunicación entre el facultativo prescriptor-farmacéutico, de forma que se pueda llevar a cabo su seguimiento y evaluación. Estos protocolos y herramientas se podrán adoptar en el marco de los criterios generales y comunes que fije el Ministerio de Sanidad previo acuerdo del Consejo Interterritorial del SNS conforme a lo dispuesto en el artículo 33.2 de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud, en relación con su artículo 71.1.g).
El INGESA y los CCOOFF velarán por el desarrollo y la promoción de las medidas necesarias para la actualización y desarrollo de los sistemas de información propios y de las Oficinas de Farmacia que posibiliten una implantación efectiva e integrada en los sistemas de información sanitarios, para una adecuada atención farmacéutica en las Ciudades Autónomas de Ceuta y Melilla.
Por otro lado, se establecerá el marco de actuación para el desarrollo y puesta en marcha de las actividades que le corresponden realizar a las Oficinas de Farmacia de acuerdo a lo dispuesto en la legislación vigente y dentro de las competencias del INGESA y, en particular, en la Ley 16/1997, de 25 de abril, de regulación de servicios de las oficinas de farmacia; art. 16, 33 y 71.1. g) de la Ley 16/2003, de 28 de mayo, de cohesión y calidad del Sistema Nacional de Salud; art. 24 de la Ley 33/2011, de 4 de octubre, General de Salud Pública y art. 6.3 del Real Decreto-ley 16/2012, de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud, o normativa que le sustituya, como programas de atención farmacéutica, uso racional de los medicamentos, adherencia y seguimiento de los tratamientos, actuaciones de farmacovigilancia, prevención y promoción de la salud y de educación sanitaria que se consideren de interés, particularmente los orientados a enfermos crónicos y polimedicados, en coordinación con los equipos de atención primaria y especializada y las Administraciones Públicas.
Los acuerdos que se adopten en este ámbito se incorporarán como anexos al presente Convenio.
10. Protección de datos
El INGESA y los CCOOFF velarán, respectivamente, por el estricto cumplimiento de la normativa de protección de los datos de carácter personal y especialmente la referida al acceso, cesión, tratamiento, almacenamiento y custodia de datos de salud en aras a proteger la intimidad de los pacientes, según lo contemplado en el anexo E.
En cualquier caso, el tratamiento de los datos personales deberá tener en cuenta que el acceso por parte del farmacéutico en la Oficina de Farmacia, a los datos de prescripción de medicamentos a los pacientes del SNS y la gestión de la información necesaria para la realización de prestación farmacéutica mediante la receta electrónica, tiene únicamente como finalidad efectuar, en los términos establecidos por el apartado 8° del artículo 79 del Real Decreto Legislativo 1/2015, que aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, la asistencia farmacéutica al paciente por medios electrónicos, en las Ciudades Autónomas de Ceuta y Melilla, siendo de aplicación la normativa nacional y de la Unión Europea en materia de protección de datos.
Los CCOOFF, de acuerdo con lo contemplado en el anexo E solamente podrán disponer y utilizar la información procedente de la mecanización y digitalización de las recetas oficiales del SNS dispensadas en Ceuta y Melilla para dar cumplimiento a las condiciones de facturación establecidas en el presente Convenio. Las normas para la utilización por parte de los CCOOFF de los datos procedentes de la facturación que sean de carácter personal, se establecen en el anexo E. Cualquier otro uso deberá ser autorizado por el INGESA.
Al objeto de garantizar la confidencialidad de los datos de carácter personal, se cumplirá estrictamente lo dispuesto en el Reglamento (UE) 2016/679, del parlamento Europeo y del Consejo, de 27 de abril de 2016, relativo a la protección de las personas física en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la Directiva 95/467CE (Reglamento general de protección de datos); la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales, y la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
11. Vigencia, efectos, extinción y régimen de modificación del Convenio
11.1 Plazo de vigencia y efectividad.
De acuerdo con lo establecido en el artículo 48.8 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, este Convenio se perfeccionará con el consentimiento de las partes y resultará eficaz una vez inscrito en el Registro Electrónico Estatal de Órganos e Instrumentos de Cooperación del sector público estatal, al que se refiere la disposición adicional séptima de la citada Ley 40/2015.
Asimismo, deberá ser publicado en el plazo de 10 días hábiles desde su formalización en el «Boletín Oficial del Estado» sin perjuicio de su publicación facultativa en los boletines oficiales de las dos ciudades autónomas.
Tendrá una duración de 4 años a partir de la fecha de su eficacia. Asimismo, en cualquier momento antes de la finalización del plazo previsto en el párrafo anterior, los firmantes del mismo podrán acordar unánimemente su prórroga por un periodo de hasta 4 años adicionales o su extinción, y de acuerdo con el artículo 49 de la Ley 40/2015, la citada prórroga deberá ser comunicada al Registro Electrónico Estatal de Órganos e Instrumentos de Cooperación del sector público estatal.
11.2 Extinción del Convenio.
El presente Convenio se extinguirá por el cumplimiento de las actuaciones que constituye su objeto.
Asimismo, se producirá la extinción del Convenio por la expiración del plazo de vigencia previsto en el punto 11.1 de la presente cláusula y la imposibilidad sobrevenida de cumplir el fin propuesto, este Convenio quedará extinguido por el cumplimiento de las actuaciones que constituyen su objeto, contemplado en el artículo 51.1 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público, así como la concurrencia de las causas de resolución, contempladas en el artículo o 51.2 de dicha Ley 40/2015.
No obstante, de acuerdo con el artículo 52.3 de dicha Ley, si cuando concurra cualquiera de las causas de resolución del Convenio existen actuaciones en curso de ejecución, las partes, a propuesta de la comisión de seguimiento, vigilancia y control del Convenio, podrán acordar la continuación y finalización de las actuaciones en curso que consideren oportunas, estableciendo un plazo improrrogable para su finalización, transcurrido el cual deberá realizarse la liquidación de las mismas en los términos establecidos en el apartado anterior.
11.3 Modificación de las condiciones del Convenio.
Las partes podrán modificar el contenido de las cláusulas, o modificar el contenido de los anexos existentes cuando las circunstancias así lo aconsejen y mediante el acuerdo unánime de las partes firmantes.
Por acuerdo de la Comisión Central, según lo establecido en la cláusula octava, (8.2.2) se podrán incorporar nuevos anexos de conformidad con lo dispuesto en su cláusula novena y siempre que, además de estar dentro del ámbito fijado en los objetivos convenidos, no conlleven contraprestaciones económicas adicionales a las previstas en el Convenio. Estos acuerdos deberán formalizarse mediante adenda, conforme a los requisitos legalmente establecidos y previa autorización prevista en el artículo 50 de la Ley 40/2015, de 1 de octubre, de Régimen Jurídico del Sector Público.
Así mismo la modificación de la regulación legal o reglamentaria que afecte a las condiciones económicas actualmente vigentes en la prestación farmacéutica a través de las oficinas de farmacia, incluida la modificación de los márgenes profesionales, o la del procedimiento de facturación y pago pactado, podrá determinar su revisión a petición de cualquiera de las partes. Transcurridos treinta días naturales desde la fecha de petición de la revisión, durante los cuales no se podrá ejercer la facultad de denuncia, si no se alcanzase acuerdo, podrá formularse la denuncia del Convenio con el efecto correspondiente de rescisión a los seis meses. A fin de evitar la interrupción de la prestación farmacéutica del SNS, una vez haya sido denunciado, seguirá siendo de aplicación a las partes durante un plazo máximo de seis meses, salvo que en dicho plazo se hubiere aprobado un nuevo Convenio sobre la misma materia.
12. Consecuencias aplicables en caso de incumplimiento de las obligaciones asumidas por las partes
12.1 En caso de incumplimiento total o parcial, cualquiera de las partes podrá notificar a la parte incumplidora un requerimiento por escrito para que cumpla en el plazo de un mes a partir del incumplimiento, con las obligaciones o compromisos que se consideran incumplidos.
12.2 Cualquier incumplimiento o desacuerdo se tratará en primera instancia en las Comisiones Territoriales correspondientes y en segunda instancia, en Comisión Central de seguimiento, vigilancia y control de la ejecución, conforme establece la cláusula 8.ª del Concierto.
12.3 El incumplimiento de la obligación de abono de la factura por parte del INGESA en los plazos y términos establecidos en el presente Convenio facultará a los CCOOFF para reclamar, además de las cantidades adeudadas, los intereses que legalmente correspondan.
12.4 El pago de la factura por parte del INGESA queda condicionado a la entrega a este Instituto por parte de los CCOOFF de las recetas y de los ficheros informáticos de facturación que constituyen los justificantes de pago, tal y como se establece en el correspondiente anexo D del presente Convenio.
Dada la necesidad de garantizar la adecuada adaptación de los procesos y los ajustes necesarios para las partes en el desarrollo y correcto funcionamiento de los nuevos requerimientos convenidos, durante un periodo máximo de seis meses, a partir del primer día del mes siguiente al de la fecha de eficacia de este Convenio, se podrán adoptar soluciones específicas y puntuales, de común acuerdo por las partes y en el seno de los órganos de seguimiento y control del mismo. Estos acuerdos tenderán a evitar que, por incidencias propias del proceso transitorio de adaptación, se produzcan devoluciones de receta.
En prueba de conformidad firman el presente Convenio, para el Concierto por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia de Ceuta y Melilla y sus anexos, por triplicado ejemplar y a un solo efecto.–La Directora del Instituto Nacional de Gestión Sanitaria, María Belén Hernando Galán.–El Director General de la Tesorería General de la Seguridad Social, Andrés Harto Martínez.–El Presidente del Consejo General de Colegios Oficiales de Farmacéuticos, Jesús María Aguilar Santamaría.
Los siguientes anexos se consideran incorporados al Convenio para el Concierto por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia de Ceuta y Melilla, y forman parte integrante del mismo:
– Anexo A: Dispensación en las Oficinas de Farmacia.
– Anexo B: Dispensación de fórmulas magistrales, preparados oficinales, preparados individualizados antialérgicos, vacunas individualizadas bacterianas autorizadas y productos dietéticos financiables.
– Anexo C: Procedimiento de facturación (Incluye 13 modelos de documentos relacionados con el proceso de facturación).
– Anexo D: Procedimiento de pago.
– Anexo E: Protección y confidencialidad de datos de carácter personal.
1. Características generales
1.1 Dispensación por el farmacéutico.
La dispensación es el acto profesional por el cual el farmacéutico o el personal bajo su directa supervisión, pone un medicamento o producto sanitario a disposición del paciente, según la prescripción o indicación recogida en una receta oficial u orden de dispensación oficial cumpliendo los requisitos legalmente establecidos, informando, aconsejando e instruyendo sobre su correcta utilización.
Con carácter general serán de aplicación a las órdenes de dispensación oficial, todas las disposiciones contenidas en el Real Decreto 1718/2010, de 17 de diciembre, sobre receta médica y ordenes de dispensación, con las particularidades que le sean propias.
En adelante, se hará extensivo a las órdenes de dispensación oficial, todos los requisitos y condiciones establecidas en este Convenio para las recetas oficiales, con las particularidades que, en su caso, sean de aplicación.
Sólo serán dispensables con cargo al INGESA las prescripciones de aquellos medicamentos, efectos y accesorios, fórmulas magistrales y preparados oficinales, preparados individualizados antialérgicos y vacunas individualizadas bacterianas autorizadas que forman parte de la prestación farmacéutica, así como los productos dietoterápicos complejos y de nutrición enteral domiciliaria que forman parte de la prestación con productos dietéticos del SNS, que se efectúen en las correspondientes recetas oficiales, que pueden emitirse en soporte papel, para cumplimentación manual o informatizada, o/y en soporte electrónico y serán prescritas por los profesionales sanitarios autorizados, en el ejercicio de sus funciones, en el ámbito del Sistema Nacional de Salud, debiendo ajustarse a lo dispuesto en el Real Decreto 1718/2010, de 17 de diciembre, y a los requisitos que el INGESA introduzca en el marco de sus competencias, así como a los específicamente establecidos en este Convenio.
Los farmacéuticos están obligados en las condiciones legal y reglamentariamente establecidas, dentro del horario de atención establecido, así como en los supuestos de urgencia, a efectuar la dispensación, siempre que el beneficiario presente una receta oficial, que reúna los requisitos de validez que se señalan en este anexo, y abone la correspondiente aportación.
Cuando el paciente, o en su caso la persona en quien delegue, haya salido de la Oficina de Farmacia con el medicamento, se considerará a todos los efectos que el acto de dispensación ha finalizado.
1.2 Sustitución por el farmacéutico en la dispensación.
1.2.1 El farmacéutico dispensará el medicamento prescrito en la receta oficial.
1.2.2 Con carácter excepcional, cuando por causa de un problema de suministro no se disponga en la Oficina de Farmacia del medicamento prescrito o concurran razones de urgente necesidad en su dispensación para el paciente, el farmacéutico podrá sustituirlo por el de precio más bajo de su agrupación homogénea. En todo caso, deberá tener igual composición, forma farmacéutica, vía de administración y dosificación. El farmacéutico informará en todo caso al paciente sobre la sustitución, y se asegurará de que conozca el tratamiento prescrito por el médico. La firma de la receta por el farmacéutico en el momento de su dispensación constatará que el farmacéutico ha informado adecuadamente al paciente de dicha actuación. El farmacéutico responsable de la dispensación consignará la causa de la sustitución en el lugar destinado a ello en la receta en formato papel o bien en el SRE.
1.2.3 Se considerará que un medicamento se encuentra en situación de problema de suministro, cuando así lo determine la Agencia Española de Medicamentos y Productos Sanitarios o bien cuando haya problemas de suministro con el mismo y así conste en el listado que dicha Agencia publica en su página web o cuando se encuentre en falta en los almacenes de distribución autorizados en la Ciudad Autónoma correspondiente, justificada mediante certificación emitida y suficientemente justificada, por los directores técnicos de los referidos almacenes de distribución.
1.2.4 Cuando la prescripción se realice por denominación comercial, si el medicamento prescrito tiene un precio superior al precio menor de su agrupación homogénea, el farmacéutico, sustituirá el medicamento prescrito por el de precio más bajo de su agrupación homogénea.
Cuando la prescripción se realice por principio activo, se dispensará el medicamento de precio más bajo de su agrupación homogénea. En el caso de que no esté disponible por problemas de suministro el medicamento correspondiente de precio más bajo, se deberá dispensar la presentación disponible con el siguiente precio más bajo y, en su defecto, el de precio menor de la agrupación homogénea.
A los efectos de facturación, en las recetas de medicamentos intercambiables incluidos en agrupaciones homogéneas, bien estén prescritas por principio activo o por denominación comercial, se tendrán en cuenta las siguientes circunstancias:
– Si el precio del medicamento dispensado no supera el precio menor de la agrupación, se aplicarán las condiciones generales de facturación y se abonara el precio (PVP más IPSI) del medicamento dispensado, previa deducción de la aportación correspondiente a satisfacer por el usuario.
– Si el precio del medicamento dispensado supera el precio menor de la agrupación, se abonará el PVP más IPSI del medicamento de precio menor, previa deducción de la aportación correspondiente a satisfacer por el usuario.
– Si el precio del medicamento dispensado supera el precio menor de la agrupación y existe situación de problema de suministro o urgente necesidad, se abonará el precio del medicamento dispensado (PVP más IPSI) previa deducción de la aportación correspondiente a satisfacer por el usuario.
– Como precios menores y precios más bajos, a efectos de dispensación por el farmacéutico, se tomarán los publicados mensualmente en el Nomenclátor Oficial de la Prestación Farmacéutica del Sistema Nacional de Salud de aplicación al mes en que se produzca la facturación.
Cuando las presentaciones que den lugar al precio más bajo o menor no están disponibles en las Oficinas de Farmacia porque no se haya producido su comercialización efectiva que hubiere sido notificada por el CGCOF a INGESA, incluida en la información derivada del Centro de Información de Suministro de Medicamentos (CISMED) de dicho GCCOF, se tomarán como precio menor o más bajo los de las siguientes presentaciones disponibles por orden de precio más bajo según el Nomenclátor Oficial de la Prestación Farmacéutica del SNS de aplicación al mes en que se produzca la facturación, dispensándose por el farmacéutico la presentación que cumpla con las condiciones de prescripción y cuyo precio más se aproxime al precio más bajo o menor.
1.2.5 No podrán sustituirse en el acto de dispensación los siguientes medicamentos:
a) Los medicamentos biológicos (insulinas, hemoderivados, vacunas, medicamentos biotecnológicos);
b) Los medicamentos que contengan alguno de los principios activos considerados de estrecho margen terapéutico incluidos en el anexo I de la Orden SC0/2874/2007, de 28 de septiembre, y posteriores actualizaciones, excepto cuando se administren por vía intravenosa;
c) Los medicamentos que contengan principios activos que requieran medidas específicas de seguimiento por motivos de seguridad y que se relacionan en el anexo II de la citada orden; y,
d) Los medicamentos para el aparato respiratorio administrados por vía inhalatoria.
1.3 Sustitución de productos sanitarios (efectos y accesorios).
La sustitución de efectos y accesorios se regirá por criterios que garanticen idéntico efecto, el mismo formato e igual o inferior precio al producto prescrito y se realizará de manera similar a lo establecido para la sustitución de medicamentos.
1.4 Sustitución de productos dietéticos financiables.
Los productos dietoterápicos complejos y de nutrición enteral domiciliaria no se podrán sustituir excepto por otros de diferente sabor, siempre y cuando el resto de su composición sea idéntica.
1.5 Identificación de los usuarios.
Para la dispensación de las recetas oficiales del Sistema Nacional de Salud, de acuerdo con el artículo 101 del Real Decreto Legislativo 1/2015, de 24 de julio, los usuarios estarán obligados a justificar su derecho a la prestación en la oficina de farmacia, mediante la presentación de la tarjeta sanitaria individual (en adelante TSI) del destinatario de las recetas, o impreso sustitutivo.
Las partes firmantes de este Convenio tomarán las medidas oportunas para mantener la integridad de la prestación farmacéutica, colaborando activamente con las autoridades competentes en la detección de posibles fraudes. El INGESA informará a los farmacéuticos, a través de su Colegio Oficial, de las medidas anti falsificación incorporadas en las recetas oficiales en formato papel, para que los farmacéuticos puedan realizar las comprobaciones oportunas de forma previa a la dispensación en caso de sospecha sobre su validez.
Los farmacéuticos no dispensarán ningún producto farmacéutico cuando surjan dudas razonables sobre la validez y autenticidad de la receta médica presentada, y extremarán la cautela en el caso de prescripciones de estupefacientes y psicótropos, respetando y garantizando, no obstante, en todo caso, el derecho a la intimidad personal y familiar de los ciudadanos, comprobando previamente a su dispensación, que la receta contenga los datos que permitan la identificación del prescriptor y paciente, según lo dispuesto en la normativa vigente.
Cuando se detecte cualquier tipo de utilización fraudulenta de recetas oficiales y en especial si se prescriben medicamentos susceptibles de desviación hacia una utilización fraudulenta, el INGESA, a través del Colegio Oficial de Farmacéuticos, lo pondrá en conocimiento de las oficinas de farmacia quienes colaborarán en el esclarecimiento de los hechos con las autoridades competentes.
El INGESA informará, además, con la mayor brevedad de los posibles robos de talonarios de recetas o de órdenes de dispensación, o sellos oficiales para la prescripción de recetas o de visado de inspección, de manera que el farmacéutico, en la medida de lo posible, ponga los medios necesarios para evitar la dispensación de recetas fraudulentas.
1.6 Datos comunes de las recetas médicas.
1.6.1 Todos los datos e instrucciones consignados en la receta médica deberán ser claramente legibles, sin perjuicio de su posible codificación adicional con caracteres ópticos. Las recetas médicas no presentarán enmiendas ni tachaduras en los datos de consignación obligatoria o en el TSI a no ser, en el caso exclusivo de las recetas manuales en formato papel, que éstas hayan sido salvadas por nueva firma del prescriptor.
El prescriptor deberá consignar en la receta los datos básicos obligatorios imprescindibles para la validez de la receta médica, previstos en el artículo 3 punto 2 del Real Decreto 1718/2010 de 17 de diciembre sobre receta médica y ordenes de dispensación.
Otros datos necesarios para la validez de las recetas a efectos de su facturación serán:
– El visado, conforme a lo contemplado en el presente anexo.
– La firma del farmacéutico y el sello de la Oficina de Farmacia.
– La fecha de la dispensación (día/mes/año).
En el caso de recetas en formato papel, ya sea de cumplimentación manual o informatizada, los datos imprescindibles del prescriptor serán: nombre o inicial y primer apellido o dos apellidos y el número de colegiado o CIAS o CPF. Del mismo modo, en las recetas cumplimentadas a mano se considerarán válidas cuando figure el nombre y primer apellido del paciente, así como el TSI y el CIP.
Los farmacéuticos no dispensarán ninguna receta en las que no figuren expresamente consignados por el prescriptor los códigos de identificación personal del paciente (CIP) y/o del código de clasificación de tarjeta sanitaria individual (TSI) del paciente. Excepcionalmente, la falta de consignación por el prescriptor de dichos códigos podrá ser corregida por el farmacéutico en el espacio de la receta reservada para dichas informaciones, la ausencia o error en los códigos (CIP) y/o (TSI) podrá ser subsanada por el farmacéutico. En ambos casos, la firma de la receta por el farmacéutico en el momento de la dispensación validará dicha ausencia o error. INGESA se compromete a adaptar sus sistemas de información y procesos para que la totalidad de las recetas en formato papel emitidas por los prescriptores, ya sean –informatizadas o manuscritas– incorporen los códigos de identificación del paciente y de la aportación del paciente. INGESA, procurará que el número de recetas que carezcan de uno o de ambos códigos, sea inferior al 2 % mensual.
En los datos de la prescripción, excepcionalmente tanto en el caso de medicamentos como de productos sanitarios o dietéticos podrán dispensarse aquellas recetas en formato papel, de cumplimentación manual o informatizada, que careciendo de alguno de los siguientes datos: forma farmacéutica, dosis por unidad, vía de administración, formato o presentación, esté garantizada su identificación de forma inequívoca, quedando avalada su dispensación por la firma de la receta por el farmacéutico.
En caso de ausencia de duración de tratamiento y posología, cuando estos no hayan podido ser cumplimentados, el farmacéutico podrá dispensar la receta constatando que el paciente ha sido informado y avalándolo con su firma. La ausencia de la firma del farmacéutico motivará la anulación del margen profesional de la receta.
1.6.2 La falta de concordancia entre los datos de identificación del médico prescriptor que figuren en el espacio reservado en la receta y los que consten en el código de barras bidimensional PDF 417, no será motivo de devolución. Sí esta circunstancia ocurre en la consignación de la fecha de prescripción, prevalecerá, a efectos del cómputo del plazo de validez de las recetas, la fecha manuscrita por el médico prescriptor.
1.7 Dispensación farmacéutica en la receta oficial en formato papel.
1.7.1 Envases dispensables.
En cada receta médica en soporte papel se podrá dispensar un solo producto de los contemplados en la Cláusula segunda del Convenio, y un único envase de los mismos. Con carácter general, el plazo máximo de duración del tratamiento que puede ser dispensado en una receta oficial es de tres meses.
No obstante, en las excepciones previstas a continuación, se podrán dispensar hasta cuatro envases por receta, siempre que el tratamiento dispensado no supere la duración señalada en el párrafo anterior:
a) Presentaciones en unidosis y por vía parenteral del grupo terapéutico «J01 Antibacterianos para uso sistémico», a excepción de los subgrupos J01E, J01M y J01R.
En el caso de presentaciones orales deberá tenerse en cuenta que se podrán dispensar hasta dos envases siempre que tengan la misma Denominación Común Internacional (DCI), dosis, forma farmacéutica y formato.
b) Viales multidosis (excepto cartuchos multidosis) del grupo terapéutico A10A «Insulinas y análogos».
c) Medicamentos que contengan sustancias estupefacientes incluidas en la lista I de la Convención Única de 1961 de estupefacientes, de acuerdo con la normativa específica de aplicación.
d) Medicamentos de diagnóstico hospitalario.
e) Vendas de gasa, no elásticas, ni adhesivas.
f) Productos dietéticos financiables, siempre que no supere un mes la duración del tratamiento.
Cuando se dispensen varios envases de un mismo medicamento por seguridad del paciente, se tendrá en cuenta que sean de la misma marca comercial.
Para las presentaciones de medicamentos autorizados en unidosis cuyo embalaje exterior coincida con su acondicionamiento primario, se podrá dispensar un solo medicamento y envase por receta, con las excepciones previstas para los medicamentos contemplados en el apartado anterior, y en la Resolución de Dirección General de Farmacia y Productos Sanitarios que, en su caso, esté en vigor y que pueda autorizar un número mayor de envases por receta para dichos medicamentos en desarrollo de lo establecido en el artículo 5 del Real Decreto 1718/2010, de 17 de diciembre, sobre receta médica y órdenes de dispensación.
En las recetas de estupefacientes y en las que se prescriban productos dietéticos financiables, se podrán dispensar varios envases según lo establecido para dichos productos en el presente Convenio
Las fórmulas magistrales y preparados oficinales no podrán dispensarse conjuntamente en una misma receta médica con otros medicamentos y en cada receta sólo se podrá prescribir una fórmula magistral o un preparado oficinal. Los productos dietoterápicos y los preparados individualizados antialérgicos, así como las vacunas individualizadas bacterianas autorizadas se dispensarán de acuerdo con lo previsto en el anexo B.
Una vez dispensado el medicamento el farmacéutico adherirá a la receta el/los cupones/es precinto de los envases dispensados, como comprobantes de la dispensación. En los productos que carecen del cupón precinto como fórmulas magistrales, preparados oficinales y los preparados individualizados antialérgicos, se adherirá la etiqueta correspondiente, conforme se establece en el anexo C.
1.7.2 Aplicación del límite máximo de aportación mensual en la prestación farmacéutica.
Para la aplicación en las recetas en formato papel, del límite o tope de aportación a los usuarios en el momento de la dispensación, ambas partes se comprometen a acordar el procedimiento necesario y realizar las adaptaciones en sus aplicaciones y sistemas que posibiliten la grabación de los datos de estas recetas en la oficina de farmacia, y su agregación a las recetas electrónicas dispensadas al mismo paciente en el mes en curso, permitiendo al farmacéutico conocer la cantidad que resta por abonar hasta el tope de aportación. Sólo será aplicable a usuarios del SNS cuya prestación farmacéutica está cubierta por el INGESA y cuyas recetas están prescritas en el ámbito de la asistencia sanitaria del INGESA.
1.8 Dispensación farmacéutica en la receta médica electrónica.
1.8.1 De igual manera que en el caso de recetas en formato papel, los tratamientos prescritos al paciente en receta médica electrónica podrán ser dispensados en cualquier oficina de farmacia del territorio nacional.
Las recetas electrónicas que reciban las farmacias a través del SRE se consideran recetas oficiales a efectos de lo establecido en el presente Convenio estando sometidas a las mismas condiciones que las recetas oficiales emitidas en papel, y con las particularidades que se establecen para las mismas.
Todas y cada una de las Oficinas de Farmacia legalmente establecidas en Ceuta y en Melilla, tienen el derecho y la obligación, de disponer de acceso al SRE, en la medida que técnicamente sea posible. Los CCOOFF serán, respectivamente, responsables de la seguridad del nodo del correspondiente Colegio, así como de la autentificación de los farmacéuticos de las Oficinas de Farmacia de su ámbito territorial, mediante certificación electrónica, garantizando que el proceso de dispensación electrónica cumple todos los requisitos legales.
1.8.2 La dispensación será realizada por las Oficinas de Farmacia conectadas al SRE, mediante el procedimiento normalizado establecido por el INGESA que se ajustará a las condiciones y requerimientos establecidos en la legislación y en el presente Convenio, siendo necesaria la previa identificación del farmacéutico responsable de la dispensación ante el repositorio de usuarios acreditados del correspondiente Colegio Oficial de Farmacéuticos. Los CCOOFF mantendrán informadas a las Direcciones territoriales del INGESA, del código REGCESS de la Oficina de Farmacia y del DNI de los farmacéuticos autorizados para la dispensación.
Para la dispensación será necesario el certificado electrónico del titular de la oficina de farmacia, o en su caso del farmacéutico regente, adjunto o sustituto, cada uno con su certificado electrónico, expedido por una entidad competente.
El acceso de los farmacéuticos al SRE se realizará exclusivamente desde los equipos instalados en la Oficina de Farmacia y mediante la TSI del paciente, debiendo ser siempre devuelta de forma inmediata a su titular y sin que pueda ser retenida en la Oficina de Farmacia. El farmacéutico dispensador tendrá acceso a las prescripciones del paciente cuya dispensación está autorizada por dicho sistema.
En los términos establecidos por el apartado 8° del artículo 79 del Real Decreto Legislativo 1/2015, así como en la normativa nacional y de la Unión Europea en materia de protección de datos aplicable, el farmacéutico solo podrá acceder a los datos necesarios para la correcta asistencia farmacéutica al paciente incluyendo, en todo caso, la dispensación informada y el seguimiento del tratamiento y dispensará exclusivamente, de entre las prescripciones pendientes de dispensar, las que el paciente solicite. El acceso del farmacéutico siempre quedará registrado en el SRE.
En la dispensación a los usuarios con tope de aportación (TSI 002, subindicador 01 o 02, o bien TSI 005, subindicador 03), el INGESA a través del SRE informará al farmacéutico de la cuantía que resta por abonar al paciente hasta alcanzar el límite máximo según su tipo de aportación. El farmacéutico comunicará la cuantía aportada por el paciente en la dispensación de la prescripción. El SRE incorporará los mecanismos necesarios para controlar que no se exceda el tope del paciente.
1.8.3 En el SRE los medicamentos y productos sanitarios y cualquier otro producto que pueda ser dispensable en los términos de este Convenio, serán prescritos según el plan terapéutico establecido, en base a intervalos de tratamiento definidos que no podrán ser superiores a un año, con las limitaciones establecidas reglamentariamente para la prescripción de medicamentos estupefacientes fiscalizados en España.
No obstante, cada dispensación no podrá superar un mes de duración máxima de tratamiento, salvo aquellos casos en los que la propia naturaleza del envase, lo exceda. En la dispensación de receta electrónica solo se podrá dispensar un envase al día, tanto de medicamentos, como de productos sanitarios, con las excepciones contempladas para las recetas en formato papel, teniendo en cuenta por seguridad del paciente, que cuando se dispensen varios envases de un mismo medicamento, sean de la misma marca comercial. El INGESA aplicará las excepciones que sean precisas para el funcionamiento adecuado del SRE.
En el momento de la dispensación, en las Oficinas de Farmacia, se comprobará si la receta electrónica presenta los requisitos necesarios para su correcta dispensación, previstos por la normativa vigente.
En la dispensación, se cumplimentarán e incorporarán al SRE a través del nodo colegial, todos los datos exigidos para la dispensación por el SRE, que incluyen:
a) Identificación de la Oficina de Farmacia que hace la dispensación.
b) Número de identificación de la dispensación.
c) Código Nacional del medicamento, efecto y accesorio o producto dietético financiable dispensado.
d) Número de envases dispensados.
e) Causa de sustitución, en su caso.
f) Cantidad abonada por el usuario en concepto de aportación.
g) Fecha de dispensación.
h) Firma electrónica del farmacéutico. En tanto no está habilitada esta funcionalidad, será suficiente la identificación del farmacéutico.
Serán válidas todas las dispensaciones electrónicas que hayan finalizado sin errores ni incidencias en el SRE imputables a la Oficina de Farmacia. Las recetas que, no coincidiendo el Código Nacional prescrito con el Código Nacional dispensado, serán aceptadas en virtud de una causa de sustitución de las permitidas.
1.8.4 Cuando el farmacéutico sustituya en la dispensación un medicamento prescrito de conformidad con los criterios legales vigentes, introducirá en el SRE la causa de dicha sustitución, quedando registrado el código del medicamento dispensado, para posibilitar su consulta por el prescriptor. De la misma forma se actuará en supuestos de sustitución de productos sanitarios y/o producto dietético financiable.
1.8.5 El SRE permitirá que el farmacéutico bloquee cautelarmente la dispensación de un medicamento, producto sanitario o producto dietético financiable prescrito, cuando se aprecie la existencia de error manifiesto en la prescripción, inadecuación de esta a la medicación concomitante, alerta de seguridad reciente, duplicidad en la prescripción, desajuste del producto prescrito con la evolución del paciente o cualquier otro motivo que pueda suponer un riesgo grave y evidente para la salud del mismo. Esta circunstancia se comunicará de forma telemática al prescriptor y el farmacéutico informará sobre dicho bloqueo al paciente. El prescriptor deberá revisar la prescripción bloqueada cautelarmente procediendo a su anulación o reactivación según considere.
1.8.6 En el caso de medicamentos y otros productos que requieran visado previo a la dispensación mediante receta electrónica, solo será posible la dispensación, si se encuentra autorizado y registrado en el SRE el visado electrónico, previamente al momento de la dispensación.
1.8.7 Una vez dispensado el medicamento el farmacéutico adherirá el/los cupones/es precinto o el sistema que la legislación pueda establecer como documento justificante de la dispensación de un producto financiado, al documento de facturación (en lo sucesivo DF). Los DF, son documentos de comprobación de la facturación al INGESA de las recetas electrónicas dispensadas por las Oficinas de Farmacia, equiparándose a estos efectos a las recetas en formato papel. Los DF son personales e intransferibles, de cada titular de la oficina de farmacia que efectúa la facturación. Existirá un DF específico para estupefacientes. Los modelos de DF se incluyen en el anexo C.
1.8.8 Los DF serán editados por los CCOOFF que los distribuirán a los titulares de las oficinas de farmacia, estarán identificados unívocamente por su numeración correlativa, conteniendo el espacio reservado para los cupones precinto que determine el INGESA. El Colegio comunicará o aportará mensualmente al INGESA la relación de los números de DF distribuidos a cada una de las farmacias de la ciudad. La utilización de los DF, así como su facturación y presentación se ajustará a lo previsto en el anexo C.
1.8.9 El SRE garantizará la seguridad en el acceso y transmisión de la información, así como la protección de la confidencialidad de los datos, de conformidad con lo dispuesto en la Ley Orgánica 3/2018, de 5 de diciembre, así como en la normativa nacional y de la Unión Europea en materia de protección de datos aplicable.
Para garantizar esos niveles de seguridad, esta información solo será accesible desde la Oficina de Farmacia a efectos de dispensación, y residirá de forma permanente en el SRE gestionado por INGESA y no podrá ser almacenada en los repositorios o servidores ajenos a este organismo establecidos para efectuar la facturación, una vez esta se haya producido. Los CCOOFF solo tendrán acceso a los datos necesarios para el ejercicio de las funciones que, en el ámbito de la facturación y como responsables de la misma tienen atribuidas.
A efectos de comprobaciones por incidencias que puedan surgir en el funcionamiento del SRE, ambas partes aceptan como justificantes validos los registros electrónicos que se mantienen de cada transacción electrónica entre el servidor del INGESA y el servidor de los CCOOFF, siempre que los mismos se hayan ajustado a las especificaciones técnicas acordadas por las partes para su desarrollo, homologación e implantación del SRE, conforme al protocolo establecido en el Acuerdo de colaboración para el desarrollo e implantación de la receta electrónica en las Ciudades Autónomas de Ceuta y Melilla el 26 de julio de 2012 o cualquier otro requisito que por las partes se pueda acordar al efecto.
Cada parte es responsable de la información que remite a la otra para la realización y registro de cada dispensación electrónica o para proceder a su facturación.
1.8.10 Los sistemas de dispensación de receta electrónica de las oficinas de farmacia de Ceuta y Melilla deberán estar adaptados a los criterios de interoperabilidad del SNS, que determine el Ministerio de Sanidad. El INGESA se compromete a mantener informadas a las Oficinas de Farmacia de Ceuta y Melilla, a través de los respectivos CCOOFF, de los requisitos necesarios para la adaptación a los criterios de interoperabilidad con tiempo suficiente para llevar a cabo las actuaciones que se correspondan.
Será responsabilidad de los CCOOFF comunicar al INGESA las variaciones de los códigos REGCESS de las Oficinas de Farmacia (Registro General de Centros, Servicios y Establecimientos Sanitarios, Orden SCO/3866/2007 de 18 de diciembre), ya que esta información es necesaria para el Sistema de Interoperabilidad de la Receta Electrónica, así como mantener actualizada la información de los farmacéuticos que realizan la dispensación en las Oficinas de Farmacia de Ceuta y Melilla, utilizando los medios técnicos acordados por las partes.
El único documento acreditativo para la dispensación de receta electrónica a los usuarios del SNS es la TSI emitida por cualquier comunidad autónoma (CA) interoperable. Las Oficinas de Farmacia de Ceuta y Melilla dispondrán de los sistemas que permitan la lectura de las TSI y del software capaz de extraer el código CIP de la banda, independientemente de cual sea la CA emisora de la TSI del paciente.
La interfaz debe permitir al farmacéutico seleccionar una determinada CA de entre todas las comunidades autónomas (en lo sucesivo CCAA) interoperables, seleccionando en primer lugar la CA emisora de la TSI del paciente, si el sistema no lo hace en el momento de leer la banda magnética. A continuación, se preguntará al paciente en qué CA se ha realizado la prescripción y se seleccionará dicha comunidad.
1.8.11 Las condiciones de dispensación de las recetas electrónicas prescritas en otras CCAA, serán las mismas que las establecidas para las recetas electrónicas prescritas en el ámbito del INGESA. Serán dispensados a través del Sistema de Interoperabilidad de la Receta Electrónica, los medicamentos, y los efectos y accesorios, incluidos en la prestación farmacéutica del SNS. También podrán ser dispensables a través de dicho sistema otros productos farmacéuticos financiados, así como los productos dietéticos incluidos en la prestación. En todo caso, el SRE informará al farmacéutico de la cantidad de aportación del usuario que deberá abonar para proceder a la correspondiente dispensación.
No obstante, las Oficinas de Farmacia podrán dispensar a través del mencionado sistema cualquier medicamento no financiado prescrito en otra CA, así como un medicamento prescrito para una indicación no financiada. El farmacéutico será informado por el sistema de estas situaciones para poder aplicarlo y en estos casos el paciente abonará el 100 % del precio del medicamento, no siendo facturable al INGESA la dispensación realizada.
Las Oficinas de Farmacia deberán entregar el recibo correspondiente al paciente pensionista, por la aportación económica de la dispensación realizada a través del Sistema de Interoperabilidad de la Receta Electrónica, para que solicite en la CA emisora de su TSI, el reembolso de la cantidad que le corresponde cuando supere su tope de aportación.
Las recetas electrónicas dispensadas a usuarios del SNS a través del Sistema de Interoperabilidad de la Receta Electrónica, serán facturadas por los Colegios Oficiales de Farmacéuticos de Ceuta y Melilla, de acuerdo con las condiciones establecidas para las recetas electrónicas prescritas en el ámbito del INGESA.
Para el correcto control de la facturación y con la finalidad de posibilitar la compensación al INGESA del gasto facturado por las recetas dispensadas a usuarios del SNS de otras CCAA, a través del Fondo de Garantía Asistencial (FOGA), gestionado por el Ministerio de Sanidad, los CCOOFF incorporarán al fichero de facturación, como registros adicionales de todas las dispensaciones electrónicas, la codificación de la CA emisora de la tarjeta del paciente, así como de la CA prescriptora. El INGESA comunicará las modificaciones, si las hubiera, sobre la codificación de las CCAA certificadas como interoperables.
1.9 Dispensación farmacéutica de estupefacientes.
1.9.1 El farmacéutico extremará la cautela en la dispensación de las recetas de estupefacientes, comprobando previamente que la receta esté correctamente prescrita. La receta oficial de estupefacientes del INGESA en formato papel, contiene la preceptiva identificación, según consta en el artículo 6 del Real Decreto 1675/2012, de 14 de diciembre, y está sometida a las condiciones generales de dispensación de las recetas oficiales emitidas por INGESA con las particularidades que se establecen en este anexo.
En una misma receta oficial de estupefacientes del INGESA en formato papel, podrá dispensarse de uno a cuatro envases del mismo medicamento, para un tratamiento de hasta tres meses de duración.
No obstante, en el caso de discrepancia entre el número de envases que conste en la receta y el que correspondiera según posología y duración del tratamiento cumplimentados por el médico, se dispensará el menor número de envases, siendo aplicable en caso de no hacerlo así la nulidad parcial de la receta, descontando el importe total del resto de envases dispensados.
Si en la receta no constase la duración del tratamiento o/y de la posología, se dispensará un envase independientemente del número de envases consignados en la receta, siendo aplicable en caso de no hacerlo así la nulidad parcial de la receta, descontando el importe total del resto de envases dispensados. Además, el farmacéutico constatará que el paciente ha sido informado y conoce la posología y duración del tratamiento avalándolo con su firma.
En el momento de la dispensación de las recetas oficiales de estupefacientes, en el caso de medicamentos fiscalizados como estupefacientes en España o sustancias psicotrópicas incluidas en las listas I, II, III y IV del anexo I del Real Decreto 2829/1977 de 6 de octubre, por el que se regulan las sustancias y preparados medicinales psicotrópicos, así como la fiscalización e inspección de su fabricación, distribución, prescripción y dispensación, en los términos establecidos en el artículo 15 del Real Decreto 1718/2010, de 17 de diciembre, el farmacéutico deberá comprobar la identidad de la persona que acude a retirar el medicamento, anotando en la receta el número del DNI o documento asimilado para extranjeros. De igual manera se actuará en las recetas oficiales que prescriban medicamentos que contengan sustancias psicotrópicas, según lo previsto en el referido Real Decreto.
1.9.2 De igual manera que en las recetas en formato papel, los tratamientos con medicamentos estupefacientes prescritos a los usuarios del SNS de Ceuta y Melilla mediante receta electrónica, podrán ser dispensados en cualquier farmacia del territorio nacional. A través del Sistema de Interoperabilidad de receta electrónica del SNS las Oficinas de Farmacia de Ceuta y de Melilla, podrán dispensar recetas electrónicas de estupefacientes prescritos en otra CA a usuarios del SNS.
En las recetas electrónicas, el DNI se anotará en el DF específico de estupefacientes, junto al cupón precinto correspondiente.
1.10 Emisión de ticket o recibo de la dispensación.
Sin perjuicio de la obligación de información establecida en el artículo 15.4 del Real Decreto Legislativo 1/2015 de 24 de julio,, las oficinas de farmacia cuando dispensen recetas del SNS con cargo al INGESA proporcionarán a los pacientes que así lo soliciten un ticket/recibo de los medicamentos y efectos y accesorios dispensados, con el fin de posibilitar que por parte de los pacientes e INGESA se puedan realizar las comprobaciones que fuesen necesarias y solicitar de INGESA la devolución de las cuantías de la aportación, que, en su caso, en los términos previstos en el artículo 102, apartado 7 del mencionado Real Decreto Legislativo. Asimismo, y si el paciente lo solicita, se consignará el sello de la Oficina de Farmacia en el documento de información al paciente emitido junto con la receta oficial.
El ticket/recibo deberá incluir, al menos, la siguiente información:
1. Dato del paciente: número del DNI o NIE o número de pasaporte del paciente.
2. Datos de la dispensación para cada uno de los medicamentos: nombre de los medicamentos y efectos y accesorios dispensados, número de envases dispensados, precio de venta al público, Aportación abonada por el paciente (con IPSI), fecha de la dispensación.
3. Datos de la Oficina de Farmacia: razón o denominación social completa de la misma (Nombre del farmacéutico titular, n° NIF, dirección postal).
1.11 Controles especiales. Visado de recetas.
El visado de inspección será un requisito necesario para la dispensación y facturación de los medicamentos y productos sanitarios, que en sus condiciones específicas de financiación requieran visado previo a su dispensación, así mismo la dispensación de productos dietéticos financiables exigirá el visado de inspección. Dicho visado constará del sello de la Inspección de Servicios Sanitarios, firma y fecha, en las recetas en formato papel y en el caso de receta electrónica la oportuna validación mediante visado electrónico.
La fecha del visado deberá ser igual o anterior a la de dispensación. Excepcionalmente, a efectos de dispensación, se considera que, en caso de no aparecer la fecha del visado en las recetas papel, éste se ha realizado en la misma fecha de la prescripción.
Además de lo anterior y cuando así sea decidido por la Comisión Permanente de Farmacia del Consejo Interterritorial del SNS, en base a lo previsto en el artículo 92.1 del Real Decreto Legislativo 1/2015, de 24 de julio, en el ámbito de INGESA se podrá establecer, con carácter especial, el visado de recetas u otro tipo de medidas de control de naturaleza similar, para la dispensación de los productos que se determinen.
El INGESA, notificará la medida a la Comisión Central de Seguimiento del Convenio y comunicará la decisión adoptada a la Organización Farmacéutica Colegial, con la antelación suficiente para su eficaz implantación.
En el caso de productos que careciendo de cupón precinto, el INGESA determine que sean dispensables en su ámbito de gestión, requerirán el visado de inspección previo para su dispensación. A efectos de facturación, estas recetas deberán llevar justificante de la dispensación (fragmento del cartonaje en que figure el nombre y precio del producto), salvo en los supuestos en que se compruebe existencia de imposibilidad material, y la correspondiente etiqueta adhesiva o sello, como indica el anexo C. Estas recetas se facturarán en el apartado de «recetas provistas de etiqueta autoadhesiva o sello», según lo previsto en el anexo C.
2. Recetas facturables
2.1 Serán facturables con cargo al INGESA, todas aquellas recetas de medicamentos, productos sanitarios, incluidos en la financiación del SNS y relacionados en el correspondiente Nomenclátor Oficial, prescritas en el modelo oficial de receta del Sistema Nacional de Salud que se ajusten a la normativa vigente y se encuentren provistos de cupón-precinto, y se ajusten en su dispensación a lo establecido en el punto 1, del presente anexo.
2.2 Serán facturables con cargo al INGESA las recetas de fórmulas magistrales y preparados oficinales, así como los preparados individualizados antialérgicos, las vacunas individualizadas bacterianas autorizadas, y los productos dietoterápicos que se ajusten a las características generales de dispensación establecidas en el punto 1, del presente anexo y las especificas recogidas en el anexo B.
2.3 De acuerdo con el artículo 92.2 del Real Decreto Legislativo 1/2015, de 24 de julio, así como con el artículo 2 punto 1 del Real Decreto 83/1993, de 22 de enero, por el que se regula la selección de los medicamentos a efectos de su financiación por el Sistema Nacional de Salud, se considerarán excluidos los productos de utilización cosmética, dietéticos, aguas minerales, elixires, dentífricos, especialidades farmacéuticas publicitarias, productos de régimen, vinos medicinales, artículos de confitería medicamentosa, jabones medicinales, productos de diagnóstico y otros similares.
Asimismo, no podrán facturarse con cargo al INGESA, los medicamentos y fórmulas magistrales excluidas de la prestación farmacéutica de la Seguridad Social, de acuerdo con lo dispuesto en la normativa de aplicación.
2.4 Para la dispensación de las recetas y su consiguiente facturación, se verificará que en la receta figuren los datos básicos de acuerdo con el Real Decreto 1718/2010, de 17 de diciembre, y lo contemplado en el presente anexo.
3. Validez de las recetas
Serán válidas a efectos de pago por el INGESA aquellas recetas oficiales dispensadas por las Oficinas de Farmacia que cumplan los requisitos establecidos reglamentariamente en este Convenio.
3.1 Plazos de validez de las recetas en soporte papel.
3.1.1 La receta médica oficial en soporte papel es válida para una dispensación por la Oficina de Farmacia con un plazo máximo de diez días naturales a partir de la fecha de prescripción o, cuando conste, de la fecha prevista por el prescriptor para su dispensación. Una vez transcurrido este plazo, no podrán solicitarse ni dispensarse medicamentos ni productos sanitarios con su presentación. No se considerarán válidas las recetas papel con deterioros que impidan comprobar alguno de los datos que de acuerdo con este Convenio resulten imprescindibles para la validez de la receta.
3.1.2 En el supuesto de medicamentos o productos sanitarios sujetos a visado el plazo de validez de la receta se contará a partir de la fecha de visado.
3.1.3 Por las especiales características de los preparados individualizados antialérgicos, así como de las vacunas individualizadas bacterianas autorizadas, el plazo de validez de estas recetas será de un máximo de noventa días naturales a partir de la fecha consignada. Asimismo, el plazo de validez de la receta médica oficial podrá ser inferior a los diez días establecidos, en el caso de medicamentos sometidos a disposiciones específicas por el Ministerio de Sanidad.
3.2 Plazos de validez de la receta electrónica.
3.2.1 En la receta electrónica, el plazo de validez durante el cual el paciente puede recoger el medicamento o producto sanitario en la farmacia, será de diez días naturales en el caso de una primera dispensación, contados a partir de la fecha de la prescripción o del visado en su caso.
3.2.2 Para las prescripciones de vacunas individualizadas antialérgicas y vacunas individualizadas bacterianas y de medicamentos sometidos a disposiciones específicas al respecto por el Ministerio de Sanidad, se aplicarán los plazos de validez previstos para la receta oficial en soporte papel.
3.2.3 El plazo de validez de la segunda o sucesivas dispensaciones, se inicia diez días naturales antes de la fecha de finalización de la medicación de la dispensación anterior y termina en la fecha de finalización del tratamiento instaurada por el prescriptor, sin perjuicio de que, por el INGESA, puedan ser establecidos otros plazos por necesidades de control o gestión que, en su caso, serán comunicados a los CCOOFF con suficiente antelación.
3.3 Causas de devolución de las recetas.
Las causas de devolución de recetas previstas en el vigente Convenio serán de aplicación a las recetas en formato papel, así como a las recetas electrónicas, con las particularidades que se especifican.
3.3.1 Anulación total.
El INGESA no se hará cargo y, por tanto, no abonará aquellas recetas, o el envase facturado en un DF, cuando se produzca alguna de las siguientes circunstancias:
A.1 Recetas o DF sin el correspondiente cupón-precinto, o sin justificantes de la dispensación en los productos que carezcan de cupón-precinto, salvo en los supuestos en que se compruebe existencia de imposibilidad material.
A.2 Recetas o DF facturadas con algún producto de los excluidos o no financiados en la prestación farmacéutica.
A.3 Recetas o DF con falta de coincidencia entre la prescripción y dispensación, salvo en supuestos de sustitución autorizados de conformidad con los puntos 1.2, 1.3 y 1.4 de este anexo, o en aquellos casos en que, habiéndose producido intercambio de los cupones-precinto de las recetas de una Oficina de Farmacia, se observe coincidencia entre prescripción y dispensación, la anulación afectará a los cupones precinto o comprobantes de la dispensación, no coincidentes.
A.4 Recetas o DF con falta de coincidencia entre el cupón adherido y el facturado, excepto cuando se trate de medicamentos que pertenezcan a la misma agrupación homogénea y se compruebe que no se ha producido un intercambio de los cupones-precinto. La anulación afectará a los cupones precinto o comprobantes de la dispensación, no coincidentes.
A.5 Recetas que, precisando el correspondiente visado de Inspección previo a la dispensación, no lo lleven en las condiciones establecidas en el presente anexo. El visado de Inspección compuesto por sello, firma y fecha, avala la ausencia de algún dato de consignación obligatoria del médico prescriptor, excepto los referidos al producto prescrito, falta de identificación del beneficiario no completada por el farmacéutico y falta de los datos de identificación y firma del médico prescriptor. Las enmiendas, añadidos o rectificaciones de la prescripción deben ser salvadas por el médico prescriptor, no obstante, si no lo estuvieran podrán ser subsanadas por la Inspección, a excepción de enmiendas del producto prescrito, con nueva firma y sello del Inspector.
A.6 Ausencia de los siguientes datos de consignación obligatoria por el médico prescriptor: nombre o su inicial, primer y segundo apellidos, número de identificación del colegiado o del código CIAS, firma y fecha de prescripción.
Excepcionalmente, en el caso de que estos datos fueran manuscritos, la ausencia del segundo apellido, si consta nombre o inicial, o la ausencia de nombres o inicial si constan los dos apellidos, no serán causa de devolución, siempre que figure el número de colegiado y el CIAS o CPF.
A.7 Los añadidos, enmiendas o tachaduras en el producto prescrito, numero de envases, fecha de prescripción y código de aportación del usuario (TSI), no salvados por la nueva firma del médico prescriptor, así como aquellos otros relacionados con la fecha del visado no salvados con nuevo sello y firma de la inspección.
No obstante, si las enmiendas en el producto prescrito o en la fecha de prescripción no afectan a la correcta identificación del producto o al plazo de validez de la receta, respectivamente, no será necesario que estén salvadas por el prescriptor.
A.8 Recetas en las que se acredite documentalmente su falsedad.
A.9 Recetas de estupefacientes que no hayan sido prescritas en el modelo oficial de estupefacientes o cupones de estupefacientes facturados en un DF que no corresponda a estupefacientes.
A.10 Recetas en las que se prescriban fórmulas magistrales que no se ajusten a lo establecido en el correspondiente anexo B.
A.11 Recetas de accidentes de trabajo o enfermedad profesional, siendo la Entidad Aseguradora distinta de la Seguridad Social (INSS), de acuerdo con lo indicado en el anexo C. En este caso se devolverán los originales de las recetas.
A.12 Presentación de DF de numeración duplicada, no imputable al INGESA.
A.13 Dispensaciones de recetas facturadas con anterioridad.
A.14 No realizar la suspensión cautelar de la dispensación, y llevar a cabo la misma en los supuestos de dispensaciones en receta electrónica donde concurra la existencia de error manifiesto en la prescripción, inadecuación de esta a la medicación concomitante, alerta de seguridad reciente o cualquier otro motivo que pueda suponer un riesgo grave y evidente para la salud del paciente, como en el caso de los medicamentos de precaución extrema de uso declarados así por la AEMPS.
3.3.2 Anulación del margen de beneficio profesional.
El INGESA no se hará cargo y, por tanto, no abonará el margen de beneficio profesional del farmacéutico, en aquellas recetas en las que se produzca alguna de las siguientes circunstancias:
M.1 Recetas dispensadas después del plazo de 10 días naturales, con las excepciones señaladas en el presente anexo y salvo que exista una causa justificada para superar los plazos señalados en el punto 3.1.3.
M.2 Recetas médicas facturadas después de los plazos fijados al respecto, salvo en los casos de subsanación expresamente contemplados en este anexo, para los cuales se establecerá un plazo adicional de sesenta días, contados desde el día siguiente al de la devolución por el INGESA, pasado el cual, no podrán ser presentadas de nuevo.
M.3 Recetas en las que se dispense un tratamiento, que, de acuerdo con la posología prescrita y el número de unidades o tamaño de la presentación del medicamento dispensado, incluidos los estupefacientes, permita una duración de tratamiento mayor de tres meses, salvo aquellos casos en que en los que la propia naturaleza del envase lo exceda, o la inspección autorice para un tiempo superior.
M.4 Ausencia de diligencia del farmacéutico en las recetas en las que esté explícitamente establecido en la normativa de aplicación (se exceptúa lo contemplado en el punto M.10).
M.5 Ausencia de alguno de los datos de consignación obligatoria relativos al paciente: nombre, dos apellidos, año de nacimiento y número de identificación.
Si la consignación viene realizada a mano, sólo serán necesarios para su validez y abono, los datos correspondientes al nombre y primer apellido, TSI y CIP. La ausencia de los datos correspondiente al nombre y apellido del usuario, año de nacimiento TSI y al CIP podrá ser completada por el farmacéutico, así como el año de nacimiento.
M.6 Ausencia de algún dato referente al DNI de la persona que acude a retirar el medicamento en las dispensaciones de estupefacientes y psicótropos dará lugar a nulidad de margen en las recetas manuales.
M.7 Dispensación de algún envase de diferente marca comercial, en los supuestos de dispensación de más de un envase, contemplados en el presente anexo, cuando no conste que el paciente ha sido informado.
M.8 No coincidencia del cupón precinto consignado en la receta o documento de facturación, con el facturado, cuando se trate de medicamentos intercambiables de idéntica composición y precio.
M.9 Cuando se presenten un número de DF incompletos superior al permitido según el número autorizado en cada oficina de farmacia, se procederá al descuento del margen, que afectará a aquellos DF incompletos facturados por encima del número permitido. Esta nulidad afectará a los DF con menor número de dispensaciones o cupones precintos.
M.10 Recetas papel que careciendo de alguno de los siguientes datos: forma farmacéutica, dosis por unidad, vía de administración, formato o presentación, esté garantizada su identificación de forma inequívoca y no estén avaladas por la firma del farmacéutico.
M.11 DF facturados con un medicamento calificado como estupefaciente carente de la correspondiente identificación de la persona que retira el medicamento.
M.12 Cupones precinto situados en el DF, en posiciones diferentes a las que consta en el fichero de facturación, siempre que sean un 25% o más, de los cupones incluidos en el DF.
M.13 La ausencia en el fichero de facturación, del CIP del paciente y/o de la CA emisora de la tarjeta sanitaria individual del paciente y/o de la CA prescriptora, en las recetas dispensadas a través del sistema de interoperabilidad, siempre que no sea subsanable en el proceso de facturación.
M.14 Las recetas oficiales de estupefacientes del INGESA, no separadas en su presentación, del resto de recetas de medicamentos y de otros grupos de facturación conforme a lo dispuesto en el anexo de facturación.
3.3.3 Anulación Parcial.
El INGESA considera como nulas parciales las recetas en las que se produzcan las siguientes incidencias:
P.1 Las recetas en las que el precio del medicamento dispensado supere el precio más bajo de la agrupación, se abonará el PVP más IPSI del medicamento de precio más bajo, previa deducción de la aportación correspondiente a satisfacer por el usuario. Esta causa de nulidad parcial no se aplicará cuando esté acreditado el desabastecimiento o urgencia, según figura en el presente ANEXO.
P.2 Aquellas recetas en que se haya dispensado el tamaño mayor de envase, tanto en el caso de medicamentos como en el de productos sanitarios, cuando en la prescripción figure uno menor o no figure, serán abonadas con el importe correspondiente al envase menor, a no ser que se compruebe, de forma fehaciente y documentada, su inexistencia o en los canales de distribución habituales por la Comisión Territorial. Esta causa de nulidad parcial no se aplicará cuando no figure el tamaño del envase, pero la posología y duración de tratamiento debidamente cuantificados por el médico justifiquen el tamaño del envase dispensado
P.3 En las recetas de fórmulas magistrales o preparados oficinales cuando la cantidad de los productos dispensada exceda de la máxima autorizada, sólo se abonará el importe de la cantidad máxima estipulada.
P.4 En los casos en que se dispense más de un envase de los permitidos, teniendo en cuenta lo establecido en este Convenio, sólo se abonará el importe correspondiente al máximo de envases permitidos.
P.5 Las dispensaciones de receta electrónica que supongan entregar un envase cuyo formato supere un mes de tratamiento, salvo en aquellos casos que la propia naturaleza del envase, lo exceda. Salvo que se justifique en la prescripción un tratamiento superior solo se abonaran las dispensaciones correspondientes a un mes de tratamiento.
P.6 Las recetas facturadas a precio diferente al establecido en este Convenio, serán abonadas al precio legalmente autorizado, que vendrá recogido en el correspondiente Nomenclátor Oficial.
P.7 Las recetas oficiales de estupefacientes del INGESA en las que se hubiera dispensado un tratamiento que supere los tres meses de duración, en cuyo caso solo se abonará el importe de los envases que se correspondan con dicha duración máxima. Si el número de envases dispensados supera el número de envases previstos según pauta posológica y duración del tratamiento se anularán los envases dispensados de más.
En el caso de discrepancia entre el número de envases que conste en la receta y el que correspondiera según posología y duración del tratamiento cumplimentados por el médico, se dispensara el menor número de envases, siendo aplicable en caso de no hacerlo así la nulidad parcial de la receta, descontando el importe total del resto de envases dispensados.
Así mismo, si en la receta no constase la duración del tratamiento o/y de la posología, se dispensará un envase independientemente del número de envases consignados en la receta, siendo aplicable en caso de no hacerlo así la nulidad parcial de la receta, descontando el importe total del resto de envases dispensados. Además, el farmacéutico constatara que el paciente ha sido informado y conoce la posología y duración del tratamiento avalándolo con su firma.
3.3.4 Recetas subsanables.
El INGESA considera como recetas incursas en causas de devolución subsanables, aquellas en las que se den las siguientes circunstancias:
S.1 La ausencia de la firma y/o los datos de identificación de la Oficina de Farmacia serán subsanables y, por tanto, se devolverán las recetas a la Oficina de Farmacia para su cumplimentación, siempre que no se trate en ningún caso de la mayoría de las recetas facturadas por esa farmacia. En caso contrario, se procederá a la anulación de las mismas.
S.2 Los añadidos, enmiendas o tachaduras en los datos de identificación de la Oficina de Farmacia y fecha de dispensación, no salvados por la diligencia del farmacéutico se remitirán a la Oficina de Farmacia para la cumplimentación y subsanación de las recetas, siempre que no se trate, en ningún caso, de la mayoría de las recetas facturadas por esa farmacia. En caso contrario, se procederá a la anulación de las mismas.
S.3 Ausencia de los datos de valoración en recetas de fórmulas magistrales, según lo recogido en el anexo B.
S.4 Recetas electrónicas que no fueron facturadas por alguna incidencia técnica, ya sea telefónica, informática, electrónica o eléctrica.
S.5 No deducida la aportación del usuario o deducida indebidamente.
S.6 Ausencia de la fecha de dispensación.
S.7 Otras causas, en cuyo caso será en la Comisión Central de Seguimiento donde se determine el efecto que deban producir.
Errores de facturación.
El INGESA considera como errores de facturación cuando, para una misma receta, se produzca falta de coincidencia en alguno de los datos en los diferentes documentos de facturación (facturas, soporte informático del fichero general, DVD de imágenes y recetas y DF originales) de acuerdo con lo indicado en el anexo C.
El presente anexo regula las condiciones económicas de la dispensación en lo concerniente a fórmulas magistrales, preparados oficinales, preparados individualizados antialérgicos, vacunas individualizadas bacterianas autorizadas y productos dietéticos financiables incluidos en la prestación del SNS.
Parte primera. Formulación magistral y preparados oficinales
Generalidades
El presente anexo regula la elaboración, dispensación y las condiciones económicas de facturación de las fórmulas magistrales y preparados oficinales en el ámbito de este Convenio. La elaboración y dispensación de las fórmulas magistrales se llevará a cabo conforme al marco legal vigente.
La Comisión Central del Convenio, al menos una vez al año evaluará el desarrollo del anexo o cuando así lo solicite alguna de las partes por causas suficientemente justificadas.
1. Fórmulas magistrales incluidas en la prestación farmacéutica objeto de este Convenio
Las fórmulas magistrales dispensables con cargo al INGESA serán las que se elaboren por las oficinas de farmacia con principios activos y excipientes incluidos en los correspondientes listados de este anexo (Tablas I y II), en la vía de administración que garantice la eficacia, seguridad y calidad de la fórmula y en las condiciones particulares que se especifican para cada sustancia, conforme a la normativa vigente y a lo establecido en este Convenio.
A fin de garantizar la interoperabilidad de la receta electrónica entre los diferentes servicios de salud del SNS, serán igualmente financiables aquellas fórmulas magistrales incluidas con su correspondiente código identificativo, en el Nomenclátor Oficial de Productos Farmacéuticos del SNS. Las modificaciones del Nomenclátor Oficial respecto a estas fórmulas magistrales serán comunicadas por el INGESA a los CCOOFF a través de la Comisión Central.
2. Fórmulas magistrales excluidas de la prestación farmacéutica objeto de este Convenio
2.1 Fórmulas magistrales elaboradas con productos químicos formulables como principios activos, que no se ajusten al listado o tabla I del presente anexo, o no se encuentren incluidas como fórmulas magistrales en el Nomenclátor oficial de productos farmacéuticos del SNS.
2.2 Fórmulas magistrales que no hayan sido elaboradas por el farmacéutico que las factura, o bajo su directa responsabilidad y dirección, de conformidad con la normativa aplicable. No se abonarán aquellas recetas de fórmulas magistrales que sean facturadas por oficinas de farmacias distintas a las que las dispensan.
2.3 Fórmulas magistrales en cuya prescripción no conste la composición cualitativa y cuantitativa o no hagan referencia al Formulario Nacional vigente en España.
2.4 Fórmulas magistrales en cuya elaboración haya sido utilizado un medicamento de fabricación industrial registrado y comercializado.
Fórmulas magistrales cuya composición, dosis y forma farmacéutica sea idéntica a la de un medicamento fabricado industrialmente registrado y comercializado. Excepcionalmente cuando se produzcan un problema de suministro continuado que tenga un impacto asistencial por tratarse de medicamentos de elevado interés terapéutico que carezcan de alternativa terapéutica comercializada y no se haya establecido su suministro como medicamento extranjero, el INGESA podrá autorizar a las Oficinas de Farmacia a preparar y facturar con dichos medicamentos como fórmula magistral. Su precio se fijará de forma excepcional a partir del precio de coste de las materias primas utilizándose los mismos criterios de los principios activos incluidos en la Tabla I.
2.5 Fórmulas magistrales que no cumplan las condiciones particulares que se especifican para cada sustancia expresada en la lista de principios activos.
2.6 Fórmulas magistrales que se correspondan con medicamentos no financiados por el SNS.
2.7 Fórmulas magistrales que se correspondan con medicamentos calificados de Uso hospitalario o sometido a reservas singulares consistentes en que su dispensación a pacientes externos está limitada a los servicios de farmacia hospitalarios del SNS.
2.8 Fórmulas magistrales que incluyan excipientes solos, o mezclas de excipientes, cuya finalidad sea únicamente servir de vehículo.
2.9 Fórmulas magistrales que incluyan principios activos no autorizados legalmente en España.
2.10 Fórmulas magistrales elaboradas con dos o más principios activos de la Tabla I, cuando alguno de los principios activos esté indicado como mono fármaco o cuya asociación no se corresponda con las autorizadas y financiadas.
2.11 Fórmulas magistrales en cuya facturación no se haya consignado, al dorso de la receta, el importe de facturación contemplado en el punto 4.6 del presente anexo. La ausencia de estos datos será subsanable y, por tanto, se devolverán las recetas a la Oficina de Farmacia para su cumplimentación y subsanación.
2.12 Fórmulas magistrales homeopáticas.
3. Elaboración y dispensación
3.1 El proceso de elaboración y dispensación de las fórmulas magistrales se realizará según las normas técnicas y científicas del arte farmacéutico y lo establecido en el Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios, el Real Decreto 175/2001, de 23 de febrero, relativo a normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales, así como el resto de la normativa vigente aplicable.
3.2 Las fórmulas magistrales y los preparados oficinales se dispensarán en los envases adecuados a su composición, debiendo estar correctamente etiquetados, expresados en caracteres fácilmente legibles, claramente comprensibles e indelebles y contendrán los siguientes datos en el acondicionamiento primario:
a) Denominación del preparado oficinal o, en su caso, de la fórmula magistral tipificada, que deberá coincidir con la establecida en el Formulario Nacional.
b) Composición cualitativa y cuantitativa completa, al menos, de los principios activos y de los excipientes de declaración obligatoria.
c) Forma farmacéutica, vía de administración y cantidad dispensada.
d) Número de registro en el Libro Recetario o soporte que lo sustituya, de acuerdo con la legislación vigente.
e) Número de lote, en el caso de preparados oficinales.
f) Fecha de elaboración y plazo de validez o fecha de caducidad.
g) Condiciones de conservación, si procede.
h) Nombre, apellidos y número de colegiado del prescriptor, para las preparaciones que precisen receta.
i) Nombre y apellidos del paciente en el caso de las fórmulas magistrales.
j) Oficina de farmacia dispensadora: nombre y apellidos del farmacéutico titular, dirección y número de teléfono.
k) Advertencia: manténgase fuera del alcance de los niños.
Cuando la dimensión del envase no permita la inclusión en su etiqueta de todos los datos anteriores, figurarán, como mínimo, los siguientes:
a) Denominación de la fórmula magistral tipificada, que deberá coincidir con la establecida en el Formulario Nacional.
b) Composición cualitativa y cuantitativa completa, al menos, de los principios activos y de los excipientes de declaración obligatoria.
c) Vía de administración, si puede existir confusión.
d) En el caso de fórmulas magistrales, número de registro del Libro Recetario o del soporte que lo sustituya de conformidad con la legislación vigente.
e) Número de lote, en caso de preparados oficinales.
f) Fecha de elaboración y plazo de validez o fecha de caducidad.
g) Identificación de la oficina de farmacia elaboradora y dispensadora.
El resto de los datos que no se hayan podido incluir en el etiquetado se entregarán junto con la información escrita o prospecto dirigido al paciente que deberá acompañar a la dispensación de la fórmula magistral, asimismo figurarán aquellos datos que el farmacéutico crea imprescindibles para el correcto uso del medicamento.
4. Valoración de las fórmulas magistrales
Para la valoración de las fórmulas magistrales se tendrán en cuenta los siguientes conceptos:
– El precio de los principios activos (Tabla l).
– El precio de los excipientes, según forma farmacéutica (Tabla ll).
– Los honorarios profesionales (Tabla III).
– El precio del material de acondicionamiento que corresponda (Tabla lV).
– El IPSI vigente para los medicamentos en cada ciudad autónoma.
4.1 Precio de principios activos.
Las fórmulas magistrales se elaborarán con los principios activos incluidos en la Tabla l, en la que figura el precio en euros por gramo de cada uno de ellos, en cada ciudad autónoma se añadirá el ipsi correspondiente. Dichos precios se actualizarán de acuerdo con lo previsto en el presente anexo. En el caso de principios activos no incluidos en la Tabla I pero que formen parte de las fórmulas magistrales incluidas en el Nomenclátor Oficial de Productos Farmacéuticos del SNS, la Comisión Central del Convenio establecerá el precio a pagar por el principio activo a partir de los comprobantes o certificados originales acreditativos de los precios de coste emitidos por los centros o proveedores.
Los principios activos no serán dispensables a granel.
4.2 Precio de los excipientes.
El precio de los excipientes viene determinado en euros por unidad, dependiendo de la forma farmacéutica de la fórmula magistral a elaborar (Tabla ll), en cada ciudad autónoma se añadirá el ipsi correspondiente. Dichos precios se actualizarán de acuerdo con lo previsto en el presente anexo.
4.3 Fijación de honorarios profesionales.
Los honorarios se fijarán de conformidad con los distintos apartados de la tabla y adjunta, en donde se agrupan por formas farmacéuticas que requieren tiempo y responsabilidades semejantes.
Como criterio para la valoración de cada grupo se establece un Factor P seguido de un coeficiente multiplicador diferente para cada uno de los grupos.
El valor de Factor P a la entrada en vigor del Convenio será de 2,88 euros.
La revisión de dicho Factor P será automática efectuándose de acuerdo con el incremento del conjunto de las retribuciones íntegras del personal en activo del Sector Público no sometido a la legislación laboral que establezca la Ley de Presupuestos Generales del Estado:
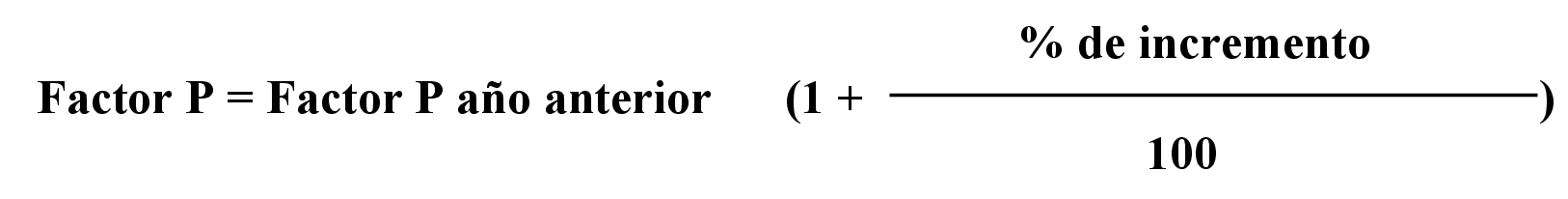
4.4 Precio de los envases.
El precio de los envases que se utilicen en la elaboración de las fórmulas magistrales dependerá de la forma farmacéutica y de la cantidad a elaborar, de acuerdo con los precios que vienen consignados en la Tabla lV. En cada ciudad autónoma se añadirá el ipsi correspondiente. Dichos precios se actualizarán de acuerdo con lo previsto en el presente anexo.
Los envases de plástico blanco se utilizarán para la dispensación de preparados oficinales.
Los envases de plástico topacio se utilizarán en las fórmulas magistrales fotosensibles en general (solo formas líquidas en las que intervengan productos señalados con x en la Tabla I).
Los envases de cristal topacio se utilizarán en las fórmulas magistrales fotosensibles de características especiales (formas liquidas en las que intervengan productos señalados con OX) y también para productos señalados con O.
4.5 Cálculo del importe de facturación.
El cálculo del importe de las fórmulas magistrales facturadas con cargo al INGESA se realizará de la forma siguiente:
– Primero se determina el precio (euros/gramo) de los principios activos que forman parte de la fórmula magistral, y que figuran en la tabla I.
– En segundo lugar, se suma el valor de los excipientes, en función de la forma farmacéutica, según los precios que figuran en la tabla II.
– Seguidamente se suma el valor calculado de los honorarios profesionales del farmacéutico, de conformidad con los distintos apartados que figuran en la tabla III.
– Finalmente se añade el precio del envase que corresponda, conforme a los precios que figuran en la tabla IV
– Al precio resultante, debe sumarse el IPSI vigente para los medicamentos, en las Ciudades Autónomas de Ceuta y Melilla.
En las recetas, el farmacéutico deberá consignar al dorso de la receta el precio de facturación desglosado de la siguiente forma:
Precio principios activos (incluido el ipsi).
Precio de excipientes (incluido el ipsi).
Honorarios profesionales Envase (incluido el ipsi).
Subtotal, .............. euros.
IPSI, .............. euros.
Total, .............. euros.
En cada fórmula magistral, el prescriptor indicara la cantidad a preparar. No obstante, según la tabla III, se fija una cantidad máxima a elaborar expresada en unidades, gramos o centímetros cúbicos. No se abonarán cantidades superiores a las fijadas.
En el caso de que no figure en la prescripción la cantidad a preparar, se elaborará y dispensará las cantidades siguientes:
– Papeles, sellos, grageas, píldoras, comprimidos, cápsulas y cápsulas gastrorresistentes: 30 unidades.
– Pastas, pomadas, geles, granulados, emulsiones, polvos compuestos, suspensiones, soluciones estériles, soluciones y enemas: 100 gramos o mililitros.
– Inyectables, óvulos y supositorios: 25 unidades.
4.6 Importe de facturación de las fórmulas magistrales incluidas en interoperabilidad de receta electrónica.
Las fórmulas magistrales incluidas con su correspondiente código identificativo, en el Nomenclátor Oficial de Productos Farmacéuticos del SNS, se valorarán de acuerdo con lo contemplado en este anexo, atendiendo a su composición, dosis, forma farmacéutica, contenido, material de acondicionamiento, honorarios profesionales, e impuesto correspondiente.
4.7 Determinación de los precios de nuevos principios activos, excipientes y envases, así como la actualización de los ya incluidos en los listados.
La Comisión Central del Convenio estudiará la inclusión y determinación del precio de nuevos principios activos, excipientes y envases, así como la revisión de los ya incluidos en el listado, a partir de los comprobantes o certificados originales acreditativos de los precios de coste emitidos por proveedores representativos, preferentemente en el ámbito territorial de las ciudades autónomas, acompañado de la documentación relativa a la eficacia, seguridad y calidad de producto.
La vigencia de los precios establecidos en el listado podrá prorrogarse anualmente, si hay acuerdo entre las partes
5. Facturación y aportación
Las fórmulas magistrales se facturarán de acuerdo con lo establecido en el anexo C de este Convenio.
En las fórmulas magistrales incluidas, en el Nomenclátor Oficial de Productos Farmacéuticos del SNS con su correspondiente código identificativo, éste se incorporará en el fichero de facturación en el campo 5 (código del producto dispensado) y en el campo 16 (código del producto prescrito) y en el DF correspondiente se adherirá la etiqueta de fórmulas magistrales 500017, anotando en la misma el importe de facturación.
La aportación de los beneficiarios con derecho a prestación farmacéutica en la dispensación de fórmulas magistrales, será en cada momento la que determine la normativa vigente para la prestación farmacéutica.
6. Preparados oficinales
Todo lo relativo a fórmulas magistrales contemplado en los puntos anteriores se hace extensivo a los preparados oficinales.
Tabla I. Listado y precio de los principios activos
| Principio activo | Comentario | Vía | ENV | Precio €/g (sin IVA) |
|---|---|---|---|---|
| 5-AMINOSALICILICO, ACIDO (Mesalazina). | Como monofármaco. | vs | 0,411469 | |
| ACETAZOLAMIDA. | Como monofármaco. | vs | 0,938678 | |
| ACETILSALICÍLICO, ÁCIDO. | 0,048833 | |||
| ACETOHIDROXAMICO, ÁCIDO. | Como monofármaco. | vo | 2,281825 | |
| ACICLOVIR. | Como monofármaco. Excluidas formas farmacéuticas tópicas. | 5,265313 | ||
| ALOPURINOL. | Como monofármaco. | vo | 11,016552 | |
| AMIODARONA, CLORHIDRATO. | Como monofármaco. | 4,165124 | ||
| AMITRIPTILINA. | Como monofármaco. | vo | 1,664588 | |
| AMOXICILINA, TRIHIDRATO. | Como monofármaco. | 0,194012 | ||
| AMPICILINA, TRIHIDRATO. | Como monofármaco. | 1,089045 | ||
| ASCÓRBICO, ACIDO= VITAMINA C. | Solamente por vía inyectable. | X | 0,047517 | |
| ATENOLOL. | 2,280000 | |||
| ATROPINA, SULFATO (dosificación en mcg). | Como monofármaco. | X | 8,444972 | |
| BACITRACINA. | Como monofármaco. | X | 0,836007 | |
| BECLOMETASONA, DIPROPIONATO. | vo | X | 33,960212 | |
| BETAMETASONA. | Como monofármaco o en asociación autorizada con antibióticos para administración oftálmica. | X | 32,999736 | |
| BETAMETASONA, DIPROPIONATO. | Como monofármaco. | vt | X | 15,498612 |
| BETAMETASONA, VALERATO. | Como monofármaco. | vt | X | 19,178750 |
| BIFONAZOL. | Como monofármaco. | vt | 8,875722 | |
| BIOTINA=VITAMINA H (dosificación en mcg). | Como monofármaco. | X | 9,047169 | |
| BISMUTO, SUBCITRATO. | vo | 1,775717 | ||
| BÓRICO ÁCIDO POLVO. | Formulario Nacional. | vt | X | 0,020793 |
| BREA HULLA= Alquitrán Hulla=Coaltar. | vt | 0,064681 | ||
| BROMOCRIPTINA, MESILATO. | Como monofármaco. | vo | 42,617222 | |
| BUDESONIDA. | 38,925600 | |||
| BUMETANIDA. | Como monofármaco. | vo | X | 29,679947 |
| BUTILESCOPOLAMINA, BROMURO. | Como monofármaco. | X | 64,142975 | |
| CALCIO, ACETATO. | Como monofármaco o asociado a otras sales de Ca o Vit D. | 0,076919 | ||
| CALCIO, CARBONATO PRECIPITADO. | vo | 0,029164 | ||
| CALCIO, FOSFATO DIBÁSICO. | Como monofármaco. | 0,021693 | ||
| CALCIO, FOSFATO MONOBÁSICO. | Como monofármaco o asociado a otras sales de Ca o Vit D. | 0,030321 | ||
| CALCIO, FOSFATO TRIBÁSICO. | Como monofármaco o asociado a otras sales de Ca o Vit D. | 0,090949 | ||
| CAPSICUM, OLEORRESINA. | vt | 0,799197 | ||
| CAPTOPRIL. | vo | 8,564079 | ||
| CARBAMAZEPINA. |
Como monofármaco. Estrecho margen terapéutico. |
vo | 0,996225 | |
| CIANOCOBALAMINA=VITAMINA B12(dosificación en mcg). | Como monofármaco. | X | 30,246281 | |
| CICLOPIROX ETANOLAMINA. | Como monofármaco. | vt | 5,679002 | |
| CICLOSPORINA. | vía oftálmica. | vof | X | 19,232463 |
| CIPROTERONA, ACETATO. | vo | 30,630607 | ||
| CLINDAMICINA, CLORHIDRATO. | Como monofármaco. | 2,616057 | ||
| CLIOQUINOL=CLORIODOQUINA=IODOCLORHIDROXIQUINOLEINA. | Solamente con otros principios activos en asociación autorizada. | vt | X | 0,138700 |
| CLOBETASOL, PROPIONATO. | Como monofármaco. | vt | X | 16,823193 |
| CLONIDINA, CLORHIDRATO (dosificación mcg). | Como monofármaco. | 51,794149 | ||
| CLORAL, HIDRATO. | Formulario Nacional. | X | 0,041357 | |
| CLORANFENICOL, PALMITATO. | Como monofármaco. | vt | X | 0,385203 |
| CLORANFENICOL, SUCCINATO. | Como monofármaco. | vt | X | 0,625660 |
| CLORAZEPATO DIPOTÁSICO. | Como monofármaco. | 1,870056 | ||
| CLORDIAZEPOXIDO. | como monofármaco. | X | 1,075306 | |
| CLOROTIAZIDA. | 1,362307 | |||
| CLORPROMAZINA, CLORHIDRATO. | Como monofármaco. | X | 16,629197 | |
| CLORTALIDONA. | vo | 1,802003 | ||
| CLOTRIMAZOL. | como monofármaco vía tópica o ginecológica. | 0,952344 | ||
| CLOXACILINA SÓDICA. | Como monofármaco. | 1,251570 | ||
| COBRE SULFATO PENTAHIDRATADO. | Formulario Nacional. | vt | 0,154942 | |
| CODEÍNA. | como monofármaco por vía sistémica con visado. | X | 1,026188 | |
| CODEÍNA FOSFATO. | como monofármaco por vía sistémica con visado. | X | 0,650817 | |
| COLECALCIFEROL. | Como monofármaco o asociado a sales de Ca. | X | 20,244152 | |
| CROMOGLICATO DISÓDICO. | Como monofármaco. | vof | 2,237183 | |
| DEXAMETASONA. | Como monofármaco o en asociaciones autorizadas con gentamicina, tobramicina y tetraciclina. | vof | X | 43,299114 |
| DEXAMETASONA, FOSFATO SÓDICO. | Como monofármaco o en asociaciones autorizadas con gentamicina y/o tobramicina. | vof | X | 8,912205 |
| DIAZEPAM. | Como monofármaco. | X | 1,639557 | |
| DIFLUCORTOLONA VALERATO. | como monofármaco. | 101,903894 | ||
| DILTIAZEM, CLORHIDRATO. | Como monofármaco. | vo | X | 7,227821 |
| DOXICICLINA. | Como monofármaco. | X | 0,474552 | |
| ENALAPRILO. | vo | 3,584298 | ||
| ERITROMICINA. | Como monofármaco. | X | 0,827603 | |
| ESCOPOLAMINA, BUTILBROMURO. | Como monofármaco. | X | 15,744754 | |
| ESPIRONOLACTONA. | vo | X | 3,278069 | |
| ESTRADIOL 17-ALFA. | vs | X | 30,039000 | |
| ESTRADIOL 17-BETA. | Como monofármaco. Se admite por vía transdérmica, en forma de gel, a concentraciones máximas de hasta un 0,06%. | vs | X | 19,524284 |
| ESTREPTOMICINA, SULFATO. | Como monofármaco. | 0,115296 | ||
| ETINILESTRADIOL (dosificación en mcg). | vs | X | 22,610000 | |
| FENITOINA=DIFENILHIDANTOINA. |
Como monofármaco. Estrecho margen terapéutico. |
1,293289 | ||
| FENOBARBITAL. | Como monofármaco. | 0,486446 | ||
| FITOMENADIONA=VIT.K1. | Como monofármaco. | X | 22,371821 | |
| FLUOCINOLONA, ACETONIDO. | X | 34,277382 | ||
| FLUOROURACILO. | X | 14,424350 | ||
| FÓLICO, ÁCIDO. | Como monofármaco o asociado con sales de hierro. | vo | X | 1,448694 |
| FOSFATO POTASIO. | vp | 0,067826 | ||
| FUROSEMIDA. | Como monofármaco. | X | 1,140496 | |
| GENTAMICINA, SULFATO. | Como monofármaco o asociado a corticoides para uso oftálmico. | 12,693012 | ||
| HIDRALAZINA, CLORHIDRATO. | Como monofármaco. | 4,103068 | ||
| HIDROCLOROTIAZIDA. | vo | 0,541719 | ||
| HIDROCORTISONA BASE. | Como monofármaco. Formulario nacional. | vt | X | 5,825018 |
| HIDROCORTISONA, ACETATO. | Como monofármaco. Formulario nacional. | vt | X | 5,284754 |
| HIDROXIZINA, CLORHIDRATO. | vo | 2,053620 | ||
| HIERRO, GLUCONATO. | Como monofármaco o asociado a ácido fólico. | vo | X | 0,094744 |
| HIERRO, OXALATO. | Como monofármaco o asociado a ácido fólico. | vo | X | 0,003079 |
| HIERRO, SULFATO CRISTAL (Ferroso). | Como monofármaco o asociado a ácido fólico. | vo | 0,043974 | |
| IMIPRAMINA CLORHIDRATO. | vo | X | 1,582195 | |
| INDOMETACINA. | Como monofármaco. | X | 0,755114 | |
| ISONIAZIDA. | X | 0,509322 | ||
| ISOTRETINOINA=13 Cis retinoico ácido=retinoico ácido 13-Cis. | vo | X | 24,357540 | |
| KETOCONAZOL. | Como monofármaco. | X | 3,783914 | |
| KETOPROFENO. | Como monofármaco. | 1,450671 | ||
| KETOTIFENO, FUMARATO. | Como monofármaco. | 39,491500 | ||
| LEVODOPA. | vo | X | 1,283802 | |
| LEVOTIROXINA (Dosificación en mcg). | vo | X | 25,052264 | |
| LIDOCAINA, CLORHIDRATO. | Vía mucosa, no formulable en antihemorroidales. | 0,289950 | ||
| MAGNESIO, SULFATO POLVO. | Como monofármaco en dosis > 15 g y solo sobres. | 0,006764 | ||
| MEBENDAZOL. | vo | 1,932007 | ||
| MEDROXIPROGESTERONA ACETATO. | como monofármaco para administración oral o parenteral. | 17,437501 | ||
| METADONA, CLORHIDRATO. | X | 1,027332 | ||
| METFORMINA. | Como monofármaco. | vo | 0,234395 | |
| METILPREDNISOLONA 6-ALFA. | Como monofármaco. | X | 19,428754 | |
| METILSALICILATO = salicilato de metilo. | vt | X | 0,059947 | |
| METOCLOPRAMIDA, CLORHIDRATO. | X | 1,235002 | ||
| METOXALENO = metoxipsoraleno 8. | vo | X | 12,254962 | |
| METRONIDAZOL. | X | 0,646122 | ||
| MICONAZOL, NITRATO. | Como monofármaco. | 1,685448 | ||
| MORFINA, CLORHIDRATO. | X | 0,918118 | ||
| NAFAZOLINA, CLORHIDRATO. | Solamente en asociaciones de uso oftálmico. | vof | X | 1,026863 |
| NAPROXENO. | Como monofármaco. | vo | 0,698301 | |
| NEOMICINA, SULFATO. | Como monofármaco. | X | 0,504588 | |
| NEOMICINA, UNDECILENATO. | Como monofármaco. | 0,409450 | ||
| NICARDIPINO, CLORHIDRATO. | 2,389644 | |||
| NIFEDIPINO. | vo | 2,287246 | ||
| NISTATINA. | Como monofármaco. | X | 1,234883 | |
| NORETISTERONA, ACETATO. | vs | X | 23,370000 | |
| NORTRIPTILINA. | vo | X | 3,287000 | |
| OMEPRAZOL. | Uso pediátrico o administración sonda. | X | 6,160853 | |
| OXITETRACICLINA, CLORHIDRATO. | Como monofármaco o asociado a corticoides para uso oftálmico. | X | 0,297666 | |
| PARACETAMOL. | X | 0,088496 | ||
| PERMANGANATO POTÁSICO. | Formulario Nacional. | 0,054545 | ||
| PILOCARPINA, CLORHIDRATO. | vof | X | 13,942307 | |
| PIRAZINAMIDA. | vo | X | 0,524410 | |
| PIRIDOXINA, CLORHIDRATO = vitamina B6. | Como monofármaco o asociado a Isoniazida. | X | 0,417712 | |
| PIROXICAM. |
Visado de inspección. Excluido vía tópica. |
4,933276 | ||
| POTASIO, BICARBONATO. | vo | 0,060370 | ||
| POTASIO, CITRATO. | vo | 0,054645 | ||
| POTASIO, CLORURO. | 0,042638 | |||
| POTASIO, IODURO. | vs | X | 0,180489 | |
| PREDNISOLONA. | Como monofármaco o asociación autorizada para administración oftálmica. | X | 3,562010 | |
| PREDNISONA. | Como monofármaco o asociación autorizada para administración oftálmica. | X | 4,328350 | |
| PROGESTERONA. | Se admite por vía transdérmica. | vs | X | 2,143312 |
| PROPAFENONA. | 2,028377 | |||
| PROPANOLOL. | vo | X | 0,300377 | |
| RANITIDINA. | 0,376721 | |||
| RETINOICO ACIDO (13 CIS)=ISOTRETINOINA=VIT.A ACIDA (13 CIS). | Vía oral. | vo | X | 24,357540 |
| RETINOL = vitamina A. | Como monofármaco vía sistémica. | vs | X | 0,374843 |
| RETINOL, ACETATO = acetato de vitamina A. | Como monofármaco vía sistémica. | vs | X | 0,352760 |
| RETINOL, PALMITATO. | Como monofármaco vía sistémica. | vs | X | 0,832298 |
| RIBOFLAVINA=VITAMINA B2. | Como monofármaco. | X | 0,482896 | |
| RIFAMPICINA. | Como monofármaco. | X | 0,771174 | |
| SALBUTAMOL, SULFATO. | Como monofármaco. | X | 68,825937 | |
| SALICÍLICO, ACIDO. | Como monofármaco o asociado con un antipsoriásico y en concentraciones hasta el 10%. | vt | 0,023927 | |
| SODIO, BICARBONATO. | 0,009858 | |||
| SODIO, CITRATO CRISTAL. | 0,030354 | |||
| SODIO, TIOSULFATO. | 0,059855 | |||
| SULFADIAZINA. | Como monofármaco. | X | 0,193421 | |
| SULFAMETOXAZOL. | Como monofármaco o asociado a trimetoprim. | X | 0,111107 | |
| SULPIRIDE. | 1,363167 | |||
| TEOFILINA ANHIDRA. | Como monofármaco. | vo | 0,180225 | |
| TERBUTALINA. | Como monofármaco. | X | 7,505000 | |
| TESTOSTERONA, PROPIONATO. | X | 9,545098 | ||
| TETRACICLINA, CLORHIDRATO. | Vía mucosa, no formulable en antihemorroidales. | X | 1,176218 | |
| TIAMINA, CLORHIDRATO = vitamina B1 clorhidrato. | Como monofármaco. | X | 0,707306 | |
| TIAMINA, MONONITRATO = vitamina B1 mononitrato. | Como monofármaco. | X | 0,205139 | |
| TRIAMCINOLONA, ACETONIDO. | Como monofármaco o asociado a queratolíticos en tratamiento de psoriasis en concentración hasta el 0,5%. | 10,012562 | ||
| TRIAMTERENO. | vo | X | 3,161884 | |
| TRIMETROPIM. | Como monofármaco o asociado a sulfametoxazol. | 0,326559 | ||
| VALPROATO SÓDICO. | 0,426172 | |||
| VERAPAMILO. | 3,453831 | |||
| VINCAMINA. | vo | 14,970003 | ||
| VITAMINA A, ACETATO. | Como monofármaco. | vs | X | 0,352760 |
| VITAMINA A, PALMITATO. | Como monofármaco. | vs | X | 0,215840 |
| VITAMINA E, ACETATO=TOCOFEROL, ACETATO. | Como monofármaco. | vo | 0,253547 | |
| XILOCAÍNA BASE = Lidocaína base. | No formulable en antihemorroidales. | 0,231841 | ||
| ZINC, ACETATO. | 0,014230 | |||
| ZINC, SULFATO CRISTAL. | Como monofármaco. Formulario Nacional. | vs | 0,012012 | |
| ZINC, SULFATO DIFFUCAPS. | Como monofármaco. | vs | 0,620152 | |
| ZINC, SULFATO POLVO. | Como monofármaco. | vs | 0,224198 |
Tabla II. Precio de los excipientes
| Excipiente | Unidad | Precio € (sin IVA) |
|---|---|---|
| SOLUCIONES Y SUSPENSIONES ESTÉRILES. | 10 ml. | 0,355 |
| SOLUCIONES Y SUSPENSIONES ACUOSAS. | 100 ml o fracción. | 0,587 |
| SOLUCIONES Y SUSPENSIONES HIDROALCÓHOLICAS. | 100 ml o fracción. | 1,785 |
| JARABES. | 100 ml o fracción. | 1,587 |
| PASTAS Y POMADAS. | 100 ml o fracción. | 1,149 |
| EMULSIONES Y GELES. | 100 ml o fracción. | 1,603 |
| CAPSULAS. | 1 unidad. | 0,025 |
| SUPOSITORIOS, ÓVULOS. | 1 unidad. | 0,017 |
| POLVOS COMPUESTOS. | 100 g o fracción. | 0,587 |
| CÁPSULAS ENTÉRICAS. | 1 unidad. | 0,033 |
Tabla III. Honorarios profesionales
| Forma farmacéutica | Máximo | Unidades |
|---|---|---|
| Inyectables (soluciones, suspensiones). | 25 | Px8( 1 a 10) +( n-10).0,3P* |
| Óvulos y supositorios. | 25 | Px4 (1 a10)+(n-10).0,1P* |
| Colirios y pomadas oftálmicas. | 1 | Px7 |
| Papeles, sellos. | 50 | Px4 (de 1 a 10)+( n-10).0,1P* |
| Grajeas-píldoras. | 100 | Px7 (de 1 a 10)+(n-10).0,1P*** |
| Cápsulas. | 100 | Px7 (de 1 a 10)+(n-10).0,1P*** |
| Cápsulas entéricas. | 100 | Px8 (de 1 a 10)+(n-10).0,1P*** |
| Comprimidos. | 100 | Px6 (de 1 a 10)+(n-10).0,1P)*** |
| Pastas y pomadas anhidras. | 250 grs. | Px5 (de 1 a 100 grs.)+(g-100).0,010P* |
| Granulados, emulsiones y geles. | 250 grs. | Px5 (de 1 a 100 g)+(g-100).0,013P* |
| Polvos compuestos. | 250grs | Px5 (de 1 a 100g)+(g-100).0,003P* |
| Suspensiones y soluciones orales. | 250grs o ml | Px4 (de 1 a 100g)+(g-100).0,007P* |
| Formas Farmacéuticas estériles. | Soluciones estériles 1000 | Px5( de 1 a 1000) +(g-100).0,005P ** |
| Enemas. | Soluciones enemas 1000 | Px 5(de 1 a 1000)+( g-100).0,005P** |
Tabla IV. Precio del envase
| ENVASE | PRECIO € (sin IVA) |
|---|---|
|
FORMAS SEMISÓLIDAS |
|
| Envase 30 cc. | 0,6612 |
| Envase 50 cc. | 0,6612 |
| Envase 100 cc. | 0,8678 |
| Envase 200 cc. | 0,9256 |
| Envase 300 cc. | 1,2562 |
|
FORMAS LÍQUIDAS |
|
| Botella plástico blanco opaco. Tapón precinto. 30 cc. | 0,4959 |
| Botella plástico blanco opaco. Tapón precinto. 60 cc. | 0,5124 |
| Botella plástico blanco opaco. Tapón precinto. 125 cc. | 0,6033 |
| Botella plástico blanco opaco. Tapón precinto. 250 cc. | 0,7025 |
| Botella plástico blanco opaco. Tapón precinto. 500 cc. | 0,7851 |
| Botella plástico blanco opaco. Tapón precinto. 1000 cc. | 1,1736 |
| Frasco cristal topacio 30 cc. | 0,5537 |
| Frasco cristal topacio 60 cc. | 0,7438 |
| Frasco cristal topacio 125 cc. | 0,8926 |
| Frasco cristal topacio 250 cc. | 1,1157 |
| Frasco cristal topacio 500 cc. | 1,8595 |
| Frasco cristal topacio 1000 cc. | 2,9752 |
| Frasco cristal topacio cuentagotas 30 cc. | 0,8512 |
| Frasco cristal topacio cuentagotas 60 cc. | 1,0661 |
| Frasco cristal topacio cuentagotas 125 cc. | 1,2397 |
| Frasco cristal topacio cuentagotas 250 cc. | 1,4876 |
|
CÁPSULAS, PAPELES, Y OTRAS FORMAS FARMACÉUTICAS SÓLIDAS |
|
| Envase hasta 50 unidades. | 0,5455 |
| Envase hasta 100 unidades. | 0,7603 |
| SUPOSITORIOS. | |
| Envase/molde de 6 supositorios. | 2,5620 |
| ÓVULOS. | |
| Envase/molde de 6 óvulos. | 2,8595 |
| INYECTABLES. | |
| Ampolla 5 ml. | 0,5702 |
| Vial de 5 ml o 10 ml. | 0,5702 |
| Vial de 50 ml. | 1,0000 |
| COLIRIOS. | |
| Frasco estéril. | 0,7438 |
Parte segunda. Preparados individualizados antialérgicos y vacunas individualizadas bacterianas autorizadas
1. Preparados individualizados antialérgicos y vacunas individualizadas bacterianas autorizadas incluidas en la prestación farmacéutica objeto de este Convenio
Según el Real Decreto 1345/2007, de 11 de octubre, por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente, se consideran como vacunas individualizadas las preparadas con agentes inmunizantes, a concentración y dilución especifica en base a la correspondiente prescripción facultativa para un paciente determinado.
2. Elaboración y dispensación
Para que las recetas oficiales en las que se prescriban preparados individualizados antialérgicos o vacunas individualizadas bacterianas autorizadas, sean dispensables con cargo al INGESA, en la prescripción se especificará cada uno de los antígenos con su composición cualitativa y cuantitativa, debiendo ser elaboradas por laboratorios farmacéuticos registrados y autorizados para la preparación de medicamentos de uso humano por la Agencia Española de Medicamentos y Productos Sanitarios.
Los preparados individualizados antialérgicos o vacunas individualizadas bacterianas que estén autorizadas para su dispensación con cargo al INGESA, llevarán una etiqueta cuya finalidad será unirse a la receta oficial en el momento de la dispensación. Durante la vigencia del presente Convenio, para la dispensación de todos los preparados individualizados antialérgicos o vacunas individualizadas bacterianas autorizadas, será preciso el previo visado de Inspección de Servicios Sanitarios. Cualquier modificación sobre este requisito será comunicada por el INGESA, con suficiente antelación, a los CCOOFF. El plazo de validez para su dispensación será de 90 días desde la fecha que figure en el visado de las recetas.
3. Facturación y aportación
El farmacéutico adherirá a las correspondientes recetas, en el momento de la facturación, copia o fotocopia del documento de solicitud con la identificación del laboratorio preparador y PVP-ii.
Se aceptarán en la facturación con cargo al INGESA aquellos preparados individualizados antialérgicas que, habiendo sido preparados por un laboratorio farmacéutico autorizado, tengan en su composición los alérgenos que a continuación se citan: ácaros, polvo, pólenes, hongos, epitelios y mezclas de antígenos compatibles (hongos-polvo y ácaros-polvo).
Asimismo, se aceptarán en la facturación con cargo al INGESA aquellos preparados individualizados antialérgicos que en su composición entren alérgenos distintos a los anteriormente citados, siempre y cuando cumplan los requisitos establecidos con carácter general y se autoricen por el INGESA.
A efectos de aportación los preparados individualizados antialérgicos o vacunas individualizadas bacterianas autorizadas, se le aplicará la normativa vigente referente a la prestación farmacéutica y para su facturación se tendrá en cuenta lo previsto en el punto 1.3 del anexo C.
Parte tercera. Productos dietéticos financiables
1. Generalidades
El Real Decreto-Ley 16/2012 de 20 de abril, de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones, modifica el artículo 8 de la Ley 16/2003, de 28 de mayo de Cohesión y Calidad del Sistema Nacional de Salud - estableciendo que la prestación con productos dietéticos forma parte de la cartera común suplementaria del SNS que incluye todas aquellas prestaciones cuya provisión se realiza mediante dispensación ambulatoria.
2. Productos dietéticos financiables con cargo al INGESA
El presente anexo establece las condiciones que regirán la dispensación de productos dietéticos financiables a través de las Oficinas de Farmacia de Ceuta y Melilla con cargo al INGESA, cuando se utilice para ello la prescripción en receta oficial del SNS, así como las condiciones económicas y de facturación aplicables.
Comprende la dispensación de los tratamientos dietéticos a las personas que padezcan determinados trastornos metabólicos congénitos y la nutrición enteral domiciliaria para pacientes a los que no es posible cubrir sus necesidades nutricionales, a causa de su situación clínica, con alimentos de consumo ordinario.
A tal efecto se considerarán productos dietéticos financiables para trastornos metabólicos congénitos y para nutrición enteral domiciliaria, aquellos productos inscritos en el Registro General Sanitario de Alimentos como alimentos dietéticos destinados a usos médicos especiales e incluidos en la oferta del SNS, Nomenclátor Oficial de productos dietéticos y provistos de precinto identificativo acorde con las características establecidas en la Orden SPI/2958/2010, de 16 de noviembre, por la que se establece el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la oferta de productos dietéticos del Sistema Nacional de Salud y para la aplicación de los importes máximos de financiación.
3. Características generales de la dispensación
3.1 Las Oficinas de Farmacia de Ceuta y Melilla sólo podrán dispensar con cargo al INGESA los productos dietéticos financiables para trastornos metabólicos congénitos y para nutrición enteral domiciliaria que, formando parte de las prestaciones del SNS conforme al apartado 2, estén provistos de código nacional y precinto identificativo según la normativa actual, sean prescritos en documento oficial (receta médica u orden de dispensación) y lleven el correspondiente visado de inspección.
3.2 Solo se podrá prescribir un producto dietético financiable por receta y un máximo de cuatro envases, siempre que no superen un mes de tratamiento.
El visado de Inspección compuesto por sello, firma y fecha, avala la ausencia de algún dato de consignación obligatoria del médico prescriptor, excepto los referidos al producto prescrito, falta de identificación del beneficiario no completada por el farmacéutico y falta de los datos de identificación y firma del médico prescriptor. Las enmiendas, añadidos o rectificaciones de la prescripción deben ser salvadas por el médico prescriptor, no obstante, si no lo estuvieran podrán ser subsanadas por la Inspección, a excepción de enmiendas del producto prescrito, con nueva firma y sello del Inspector.
En el caso de discrepancia entre el número de envases que conste en la receta y el que correspondiera según posología y duración del tratamiento cumplimentados por el médico, o si en la receta no constase la duración del tratamiento o/y de la posología, el farmacéutico diligenciara la receta constatando que el paciente ha sido informado y conoce la posología y duración del tratamiento, avalándolo con su firma.
En cada receta solo se podrá dispensar un único sabor de un producto dietético. En la dispensación, el farmacéutico podrá sustituir estos productos por otros de diferente sabor, siempre y cuando su contenido sea idéntico en todo lo demás, incluido su precio, al producto prescrito.
3.3 La dispensación de estos productos en las Oficinas de Farmacia se realizará de acuerdo con las normas generales de dispensación en receta médica y orden de dispensación (tanto en formato papel como electrónico) según lo previsto en el anexo A de este Convenio. En caso de receta médica y orden de dispensación en formato papel se adjuntará el o los precintos identificativos con el código del producto dispensado.
4. Condiciones económicas
4.1 En relación con la financiación de los productos dietéticos, la Orden SSI/2366/2012, de 30 de octubre, establece el factor común de facturación de la prestación con productos dietéticos. Dicho factor comprende los márgenes de distribución, incluido el margen profesional de las oficinas de farmacia, y los impuestos correspondientes.
El importe de facturación de los productos dietéticos es el resultante de multiplicar, el precio de oferta de cada producto incluido en la oferta de productos dietéticos financiables del SNS, por el factor común de facturación establecido en dicha orden.
Los importes de facturación de los productos incluidos en la oferta se reflejan en el Nomenclátor de productos dietéticos financiables por el SNS, que elabora el Ministerio de Sanidad para el conjunto del SNS, teniendo en cuenta en las Ciudades Autónomas de Ceuta y Melilla, los importes de facturación aplicables en cada una de ellas, como consecuencia del valor del IPSI de cada ciudad.
Mensualmente se remitirá a los CCOOFF, el Nomenclátor de productos dietéticos, aplicable en cada ciudad autónoma, siendo únicamente facturables los productos que consten en el mismo en situación de alta en el Nomenclátor correspondiente al mes de su dispensación. El INGESA abonará los productos dietéticos incluidos en la oferta, cuando son facturados por las oficinas de farmacia al importe de facturación que corresponda.
5. Facturación y aportación
5.1 La facturación de estos productos se realizará tal como se señala en el anexo C del Convenio. Las recetas médicas oficiales de productos dietéticos financiables se presentarán separadas del resto de las recetas y de otros grupos de facturación.
5.2 La mecanización de las correspondientes recetas, se hará mediante la lectura de la información contenida en el código identificativo establecido en la Orden SPI 2958/2010, de 16 de noviembre por la que se establece el procedimiento para la inclusión de los alimentos dietéticos para usos médicos especiales en la oferta de productos dietéticos del Sistema Nacional de Salud y para la aplicación de los importes máximos de financiación.
5.3 Los productos dietéticos financiables están sujetos a aportación del usuario según lo dispuesto en el Real Decreto-ley 16/2012 de medidas urgentes para garantizar la sostenibilidad del Sistema Nacional de Salud y mejorar la calidad y seguridad de sus prestaciones en su modificación de la Ley 16/2003, de 28 de mayo, de Cohesión y Calidad del Sistema Nacional de Salud. En tanto no se haya desarrollado dicha normativa en esta materia y hasta su entrada en vigor, se mantendrá la situación de ausencia de aportación.
La facturación de recetas con cargo al INGESA, se realizará según el procedimiento indicado en este anexo y se efectuará a través de la mecanización informática de las mismas.
El coste de la facturación de recetas, tal como queda contemplado a la entrada en vigor de este Convenio será asumido íntegramente por los CCOOFF.
Con relación al coste de digitalización de las imágenes de los Documentos de facturación (DF) grabación y localización de los cupones precinto, el INGESA abonará un coste de 0,316€ más IPSI por DF, incluyendo en este coste la generación e impresión de los DF.
En relación con el valor monetario del coste previsto en el párrafo anterior, por causa justificada y a solicitud de cualquiera de las Partes, podrá ser revisado por la Comisión Central de Seguimiento y Vigilancia, que se llevará a cabo observando lo establecido en el artículo 5 de la Ley 2/2015, de 30 de marzo, de desindexación de la economía española y su reglamento de desarrollo o, en su caso, por la normativa que la sustituya.
Las Direcciones Territoriales de INGESA facilitarán a los respectivos Colegios Oficiales de Farmacéuticos la información necesaria para la generación de los DF y su distribución a las farmacias por parte de los Colegios.
1. Normas previas a la facturación
Las Oficinas de Farmacia en el acto de la dispensación, procederán de la siguiente forma en las recetas en formato papel:
1.1 Se comprobará si la receta presenta todos los requisitos necesarios para su correcta dispensación, tanto previstos por la normativa vigente sobre receta oficial como los que se establezcan al amparo del presente Convenio. En el caso de recetas de accidentes de trabajo no prescritas en modelo oficial, se comprobará que éstas estén correctamente prescritas, según lo dispuesto en el Real Decreto 1718/2010, de 17 de diciembre sobre receta médica y ordenes de dispensación y que en la misma consta la empresa donde presta sus servicios el asegurado, domicilio de ésta y mención expresa de que la protección del riesgo de accidente de trabajo corresponde al Instituto Nacional de la Seguridad Social. Si la protección de este riesgo corresponde a una Entidad Aseguradora distinta, el INGESA no se hará cargo de su abono, debiendo devolver dichas recetas a los CCOOFF.
1.2 Consignarán en la receta el nombre y número de la farmacia, la fecha de dispensación y firma del farmacéutico.
1.3 Colocarán en el lugar reservado al efecto el cupón o cupones-precinto cuando se trate de medicamentos o productos sanitarios provistos del mismo.
En el caso de productos sin cupón-precinto, se adjuntará como comprobante de la dispensación un fragmento del envase, o etiqueta, que permita la identificación inequívoca del producto e incluya su código de barras industrial, salvo que exista imposibilidad material. Junto a este comprobante se estampillará el sello o etiqueta autoadhesiva con la información que permita distinguir los grupos de dispensación e incluya de forma legible el precio de venta al público del producto dispensado.
Las etiquetas o sellos (modelo I) tendrán unas medidas de 34x25 mm y un espacio destinado al precio, que cumplimentará el farmacéutico a mano en tanto no se desarrollen otros procedimientos, e incorporarán un código de barras conforme a los siguientes grupos:
CÓDIGO.
500017 Fórmulas magistrales y preparados oficinales.
500009 Preparados individualizados antialérgicos y vacunas individualizadas bacterianas autorizadas.
500033 Visado sin cupón-precinto y sin aportación.
500041 Visado sin cupón-precinto, con aportación.
Tanto el cupón-precinto como la etiqueta autoadhesiva o el sello, se colocarán de forma que se procure su legibilidad y su no desprendimiento en la manipulación normal y para la lectura automatizada de cada uno de ellos.
1.4 Las etiquetas autoadhesivas o sellos sólo se utilizarán en los casos en que el producto a dispensar no lleve cupón-precinto. En las recetas de productos que necesiten llevar etiqueta autoadhesiva o sello, por tratarse de fórmulas y preparados individualizados antialérgicos y vacunas individualizadas bacterianas que además llevasen visado, sólo se adherirá la etiqueta o se estampillará el sello correspondiente al producto. En el caso de recetas de preparados individualizados antialérgicos y vacunas individualizadas bacterianas autorizadas, se actuará de acuerdo con lo previsto en el anexo B.
1.5 En el caso de la receta electrónica, al no estar soportada físicamente por papel, la documentación de la dispensación es el conjunto de datos registrados dentro del sistema electrónico, además de los cupones precinto adheridos en el Documento de Facturación (DF) cuyo modelo se incluye en este anexo (modelo 10).
INGESA facilitará a los CCOOF de Ceuta y Melilla el fichero con la información contenida en los DF, que posibilite su generación. Los DF estarán identificados unívocamente por su numeración correlativa, conteniendo el espacio reservado para los cupones precinto que determine el INGESA. Los CCOOF distribuirán los DF a los titulares de las oficinas de farmacia. El Colegio comunicará o aportará mensualmente al INGESA la relación de los números de DF distribuidos a cada una de las farmacias de la Ciudad Autónoma correspondiente.
El farmacéutico en el acto de la dispensación, procederá de la siguiente forma en las recetas electrónicas:
Al realizar la dispensación, y antes de validarla se debe verificar que los datos de los medicamentos dispensados coincidan con los datos de los envases entregados a los pacientes y, por tanto, con los cupones-precinto que se van a incluir en los DF.
Se colocará en cada lugar reservado al efecto en el DF los cupones precinto justificantes de la dispensación, o etiquetas autoadhesivas o sellos, cuando proceda. Se colocarán tantos cupones precinto como lugares reservados al efecto tenga el DF. Cuando se dispense más de un envase del mismo medicamento, los cupones precintos ocuparan posiciones correlativas.
Solo serán facturables los DF completos salvo las excepciones acordadas por las partes. En concreto, se podrán admitir mensualmente hasta 5 DF incompletos por farmacia. Una vez facturadas las dispensaciones de un DF, este quedará inhabilitado para nuevas dispensaciones, por lo que en ningún caso será posible volverlo a facturar. En tanto se mantengan los cupones precintos como comprobantes de la dispensación, éstos se recogerán en los DF que se remitirán mensualmente por los CCOOFF a las respectivas Direcciones Territoriales de Ceuta y Melilla, y ordenados correlativamente.
La toma de datos para la facturación mensual de las dispensaciones electrónicas, se incorporará al proceso de facturación y a los soportes informáticos establecidos en el anexo C directamente de los registros informáticos existentes en los programas de gestión de las farmacias, y del SRE.
La grabación de datos correspondiente a las prescripciones y dispensaciones electrónicas realizadas a través del sistema SRE se realizará en el mismo soporte informático que el utilizado para los datos de las recetas en soporte papel.
Se registrará para cada dispensación, el número del DF, donde se recoge el/os cupón/es precinto, y la posición dentro del DF de cada cupón y el paquete donde se facture el DF correspondiente. A efectos de lo establecido en el presente anexo, los DF se presentarán de forma conjunta con las recetas formato papel.
En la dispensación de los medicamentos estupefacientes, los cupones precinto se incorporarán al DF específico cuyo modelo se recoge en este anexo (modelo 11) diferenciado con la leyenda ESTUPEFACIENTES, que se presentara en cajas apartes e identificadas como DF de ESTUPEFACIENTES. No obstante, lo señalado anteriormente, los DF de medicamentos estupefacientes dispensados a través del Sistema de Interoperabilidad de la Receta Electrónica, podrán ser presentados incompletos, hasta que se implante en el INGESA, la receta electrónica de estupefacientes.
El DNI de la persona que acude a retirar el medicamento estupefaciente, se anotará, en el DF correspondiente, en la parte superior del casillero donde conste el cupón precinto de este tipo de medicamentos. En cualquier caso, esta anotación dejará de hacerse en el momento en el que el SRE de INGESA emita este tipo de recetas, Para los medicamentos psicotrópicos se utilizará el DF común al resto de medicamentos.
2. Proceso de facturación
El proceso de facturación, será único y uniforme y se realizará por la Organización Farmacéutica a través de los Colegios Oficiales de Farmacéuticos de Ceuta y de Melilla, bien por medios propios o concertados y tendrá en cuenta las peculiaridades impositivas de cada ciudad autónoma y que se contemplan en el punto 2.5.1 del presente anexo.
La repercusión en las Oficinas de Farmacia del ámbito del INGESA del coste derivado de la toma de datos de las recetas para la confección del fichero de facturación, se efectuará entre las Oficinas de Farmacia de cada provincia en las condiciones que se establezcan por cada Colegio Oficial de Farmacéuticos.
La facturación de todas las recetas papel y electrónicas, comprenderá periodos mensuales y se incluirán las recetas dispensadas en el mes que se factura. No obstante, se admitirá para las recetas en papel, la facturación de las dispensadas en el mes anterior al que se factura, y en las dispensaciones electrónicas la facturación de hasta un máximo de 5 DF por farmacia, sin incluir entre ellos los DF de estupefacientes, correspondientes a recetas dispensadas en el mes anterior al que se factura. El Colegio Oficial de Farmacéuticos velará para que los plazos de la facturación se ajusten al último día del mes, garantizando el cierre conjunto de todas las modalidades de dispensación.
2.1 Toma de datos.
Los datos a grabar a partir de las recetas y que son considerados necesarios para el proceso de facturación y un correcto control de la prestación farmacéutica son los siguientes:
1. Provincia (2 dígitos).
2. Mes (2 dígitos) y año (4 dígitos).
3. Número de farmacia (4 dígitos) y paquete donde va la receta o el DF (4 dígitos).
4. Régimen de receta (1 dígito).
5. Código Nacional del producto dispensado y facturado, o código de la etiqueta autoadhesiva o del sello en su caso (6 dígitos).
6. Precio de venta al público PVP-IVA (9 dígitos).
7. Número de envases (2 dígitos).
8. Grupo de facturación (1 dígito)*.
9. Tipo de moneda (E: euros) (1 dígito).
10. Número de colegiado médico (12 dígitos).
11. Clave de Identificación de Asistencia Sanitaria CÍAS (11 dígitos)
12. Número de la receta (12 dígitos para receta papel), en blanco en receta electrónica.
13. Código de Identificación del Paciente (16 dígitos).
14. Localizador de la receta en papel PDF-417 (10 dígitos) en blanco en receta electrónica.
15. Fecha de prescripción, formato AAMMDD (8 dígitos).
16. Código Nacional del producto prescrito (6 dígitos).
17. N° de orden (11 dígitos en receta papel), en blanco para receta electrónica.
18. Código de aportación del usuario (5 dígitos)*.
* El campo 18, identifica el Código de aportación del usuario (5 dígitos). Será obligatoria la toma de este dato manualmente en los casos en los que no sea posible su lectura informática. Los siguientes dígitos identificaran cada una de las situaciones establecidas en el artículo 102 del RDL 1/2015:
– 00001 para usuarios exentos de aportación (incluye al síndrome toxico y resto de exentos).
– 00002 para usuarios con aportación de un 10 %.
– 00003 para usuarios con aportación del 40 %.
– 00004 para usuarios con aportación del 50 %.
– 00005 para usuarios con aportación del 60 %.
– 0ATEP para recetas de accidentes de trabajo o enfermedad profesional, exentas de aportación.
– F 003, situaciones especiales con el 40 %.
– F 004, situaciones especiales con el 50 %.
19. Código Identificador de la dispensación (9 dígitos) en receta electrónica.
20. Código identificador de la prescripción (8 dígitos) en receta electrónica.
21. Cantidad abonada en concepto de aportación del total de envases dispensados del medicamento (5 dígitos).
22. Número del DF (12 dígitos) en receta electrónica.
23. Posición del cupón precinto en el DF (2 dígitos) en receta electrónica.
24. Numeración del DF final (12 dígitos) en receta electrónica.
25. Posición final del cupón precinto dentro del DF (2 dígitos) en receta electrónica.
26. Fecha dispensación (8 dígitos).
27. Tipo de aportación en receta electrónica. (1 digito, valor: A /E/P/C)**.
** El campo 27 que indica del tipo de aportación, posibilita información del tope de la aportación y se cumplimentará en todos los registros de los ficheros de facturación con las siguientes opciones:
A (con aportación): la aportación registrada en el dato anterior es la que corresponde a la dispensación por su TSI / Su código - Tipo de aportación del CNPF.
E (en límite): El paciente ya ha llegado al límite y no le corresponde aportar en esa dispensación y por lo tanto la aportación registrada en el dato anterior es 0.
P (parcial): en esa dispensación el paciente llega al límite y la aportación registrada en el dato anterior es la cantidad que le queda para llegar al límite.
C (contingencia): son recetas de síndrome, accidente de trabajo, enfermedad profesional.
En las recetas de activos (recetas sin tope de aportación), constará en este campo siempre el valor «A».
28. Código OID de la comunidad autónoma que ha emitido la tarjeta del paciente, al que se le ha dispensado la receta. Completando con 0 a la izquierda en el caso de ser necesario.
En el caso de que la receta no sea electrónica y no se puede recuperar el OID, se cumplimentará con 0000000000000. (13 dígitos, valor: OID).
29. Código OID de la comunidad autónoma prescriptora de la receta. Completando con 0 a la izquierda en el caso de ser necesario. En el caso de que la receta no sea electrónica y no se puede recuperar el OID, se cumplimentará con 0000000000000. (13 dígitos, valor: OID).
30. Código identificador de la prescripción de la receta electrónica (Ingesa e interoperabilidad). Completando con 0 a la izquierda en el caso de ser necesario. En el caso de que la receta no sea electrónica y no se puede recuperar el identificador, se cumplimentará con 0000000000000000000000000. (25 dígitos, valor: alfanumérico). Este campo sustituye al campo 20 del actual fichero, que se mantiene, pero con valores cero.
La omisión de los datos correspondientes a los códigos de identificación del paciente y de su aportación, en el fichero de facturación superior al 1,00 % de las recetas, será causa de devolución del mismo con el fin de proceder a grabarlos de nuevo, siempre y cuando no sea atribuible una mala calidad de impresión de las recetas informatizadas por parte del prescriptor.
En los casos de las recetas que no lleven impreso el código de barras bidimensional PDF-417, por parte de los CCOOFF se procederá a grabar todos los datos indicados anteriormente, excepto el localizador de la receta (punto 14) y la fecha de prescripción (punto 15). Los datos relativos a la clave CÍAS, así como al número de colegiado médico, se grabarán manualmente.
En aquellas recetas en las que no venga el número de receta en código de barras, o bien éste no se pueda leer informáticamente, este dato también se grabará manualmente.
2.2 Confección del soporte informático de facturación.
La grabación de los datos de facturación se realizará en un fichero único para toda la facturación.
Este fichero debe de tener la siguiente estructura:
Debe de ser un fichero secuencial en formato ASCII.
El fichero tendrá tres tipos de registro:
Registro de cabecera: único y situado al principio del fichero, con la siguiente estructura:
– Código de la ciudad autónoma, 2 dígitos.
– Año de los datos, 4 dígitos.
– Mes de facturación, 2 dígitos.
– Fecha de generación del fichero (dd/mm/aaaa), 10 dígitos.
Registros de datos de las recetas: contiene la información de cada una de las recetas papel y electrónicas.
Registro final: único y situado al final del fichero, con la siguiente estructura:
– Código de la Ciudad Autónoma, 2 dígitos.
– Año de los datos, 4 dígitos.
– Mes de los datos, 2 dígitos.
– Fecha de generación del fichero (dd/mm/aaaa), 10 dígitos.
– Número de recetas registradas en el fichero, 9 dígitos.
– Importe total de las recetas registradas (PVP), 14 dígitos.
No se utilizarán delimitadores, estando ubicados cada uno de los datos que componen el registro en una dirección determinada y fija. El fichero se identificará con el mes y la Ciudad Autónoma a la que corresponda la facturación, así como el número de registros que contiene.
En el caso de «recetas subsanables», a las que se hace referencia en el punto 4.2.4 del presente anexo, devueltas a las Oficinas de Farmacia para su verificación y cumplimentación, una vez resueltas las deficiencias que fueron objeto de su devolución, no se volverán a grabar en los ficheros de facturación.
A efectos de facturación, los distintos regímenes se codificarán de la siguiente forma:
1. Recetas con aportación.
2. Recetas sin aportación, Accidentes de trabajo y Enfermedad Profesional.
3. Campañas sanitarias.
4. Síndrome tóxico.
Asimismo, los diferentes grupos de facturación se codificarán, coincidiendo con la forma de presentación de la receta, de la siguiente forma:
1. Medicamentos.
2. Productos sanitarios.
3. Fórmulas magistrales, productos dietéticos financiables, medicamentos con visado.
4. Recetas sin cupón precinto y con visado.
En la facturación de los productos con cupón precinto, se utilizará el correspondiente Nomenclátor Oficial de la prestación farmacéutica del SNS correspondiente al mes de la dispensación, con los precios actualizados, facilitado al CGCOF por el Ministerio de Sanidad.
2.3 Confección de las facturas.
Los CCOOFF, teniendo en cuenta tanto las recetas en papel como las dispensaciones electrónicas, confeccionarán mensualmente las facturas que servirán como documento para la formalización del pago. En las facturas generales e individuales, la información de la facturación de las dispensaciones realizadas a través de receta electrónica, se presentará separada del resto de la información de las recetas de papel, pero con la misma estructura, epígrafes y datos.
2.4 Período de facturación.
La facturación comprenderá períodos mensuales y cada Colegio Oficial de Farmacéuticos velará para que los plazos de cierre de la facturación, se ajusten preferentemente al último día del mes, o el siguiente hábil si aquel fuese festivo, garantizando el cierre conjunto para todas las modalidades de dispensación.
2.5 Clases de facturas.
Se confeccionarán tres clases de facturas:
1. Factura individual por Oficina de Farmacia (Modelo 2).
2. Factura resumen de todas las Oficinas de Farmacia del ámbito territorial (Modelo 3).
3. Factura resumen general (Modelo 4).
2.5.1 Factura individual por cada Oficina de Farmacia. Se confeccionarán facturas individuales por separado para cada uno de los siguientes contingentes:
– Recetas ordinarias (TSI001, 002, 003, 004, 005).
– Recetas electrónicas (TSI001, 002, 003, 004, 005).
– Accidentes de trabajo.
– Campañas sanitarias y síndrome tóxico.
Y dentro de cada contingente, una factura para cada uno de los siguientes grupos de facturación:
1. Recetas de medicamentos con cupón precinto sin visado.
2. Recetas de productos sanitarios con cupón precinto sin visado.
3. Recetas de fórmulas y varios (provistas de etiqueta autoadhesiva o sello) y de medicamentos con cupón precinto y visado, así como productos sin cupón precinto y con visado.
4. Recetas de productos sanitarios (efectos y accesorios) con cupón precinto y visado.
5. Recetas de productos dietéticos financiables con cupón precinto y visado.
En las facturas individuales por farmacias (Modelo 2), se relacionarán todas las recetas, consignando la clave del cupón-precinto o código de etiqueta autoadhesiva o sello, en su caso, y el importe a P.V.P. (IVA), así como las sumas por cada dos paquetes de veinticinco recetas. El número de paquete será incluido en la factura, anteponiéndose al listado de la serie de recetas que comprenda aquél. Se señalarán los medicamentos y productos sanitarios de aportación reducida a que se refiere la normativa vigente con un asterisco impreso en la posición anterior a la primera cifra de la clave del producto.
Al final de cada factura individual se consignará el número de recetas Facturadas su importe a P.V.P. (IVA), la suma de las aportaciones y el líquido resultante. Para cada ciudad autónoma, se corregirá el importe final a P.V.P. (IPSI), aplicando la cantidad que en cada momento corresponda en función del régimen impositivo vigente y las especiales características de estos territorios, según el criterio de la Administración Tributaria.
2.5.2 Factura resumen de todas las farmacias del ámbito territorial. Los CCOOFF recogerán los totales de las facturas individuales en una factura resumen territorial que incluye todas las oficinas de farmacia, según el formato que figura adjunto (Modelo 3), y confeccionarán una factura resumen por cada régimen y tipo de receta.
2.5.3 Factura resumen general con todos los grupos de facturación. Con el total de la factura resumen territorial, se confeccionará la factura general (Modelo 4), detallando el importe a P.V.P, aportación y líquido de las recetas, así como el número de envases, especificado el código TSI dentro de los grupos de facturación.
El INGESA, con los datos contenidos en esta factura, confeccionará mensualmente el parte estadístico de facturación para su preceptivo envío al Ministerio de Sanidad, según el modelo establecido al respecto para el conjunto del SNS. Cualquier variación del mismo, requerirá la correspondiente adaptación en la factura resumen general, debiendo ser notificado por el INGESA a los CCOOFF con la suficiente antelación.
3. Presentación de la facturación
3.1 Presentación de las recetas.
Los CCOOFF presentarán las recetas amparadas por las correspondientes facturas individuales de cada Oficina de Farmacia (Modelo 2), hasta el día 10 del mes siguiente al que corresponda la presentación de la factura, si el día 10 fuera inhábil se entenderá como día de entrega el siguiente día hábil.
La presentación de recetas se efectuará en la oficina que designen las Direcciones Territoriales del INGESA y en la que se verificará, en presencia de la representación del Colegio, que la documentación recibida es la facturada, levantándose las correspondientes actas de la recepción (Modelo 9) en las que constará la documentación recibida y el resultado de la verificación.
Se presentarán en cajas y por separado:
a) Recetas en papel con cupón precinto normalizado de medicamentos y productos sanitarios (efectos y accesorios), con y sin visado, sin diferenciar por tipo de aportación.
b) Recetas en papel de estupefacientes.
c) Recetas en papel de varios grupos.
d) Documentos de facturación (DF) de receta electrónica de medicamentos y productos sanitarios (efectos y accesorios), con y sin visado, sin diferenciar por tipo de aportación.
e) Documentos de facturación (DF) de receta electrónica de medicamentos estupefacientes.
3.1.1 Contenido de las cajas.
a) Recetas papel con cupón precinto normalizado de medicamentos y efectos y accesorios, con y sin visado, sin diferenciar por tipo de aportación. Se presentarán por separado para cada oficina de farmacia, en cajas especialmente acondicionadas para contener 500 a 1.000 recetas, unidas por grupos de 25 y de forma que no puedan desordenarse en relación con la factura. Podrán presentarse en una misma caja las recetas de varias oficinas de farmacia siempre que vayan identificadas las Oficinas de farmacia en el exterior y debidamente separadas las recetas de cada una de ellas en el interior de la caja.
Las cajas llevarán adherida la siguiente etiqueta:

b) Recetas papel de estupefacientes. Para posibilitar la conservación y el control de las recetas de estupefacientes conforme a lo dispuesto en el Real Decreto 1675/2012,de 14 de diciembre, las recetas oficiales de estupefacientes del INGESA se presentarán, en grupos de 25, separadas del resto de recetas de medicamentos y de otros grupos de facturación, en una caja de 500 o 1000 recetas, debidamente identificada como RECETAS DE ESTUPEFACIENTES y ordenadas por Oficina de Farmacia de forma que se identifique claramente el número de la Oficina de Farmacia a la que van referidas. En esta caja se incluirán tanto las recetas de medicamentos de fabricación industrial como las recetas de fórmulas magistrales con estupefacientes. Podrán presentarse en una misma caja las recetas de varias oficinas de farmacia siempre que vayan identificadas las Oficinas de farmacia en el exterior y debidamente separadas las recetas de cada una de ellas en el interior de la caja.
Las cajas llevarán adherida la siguiente etiqueta:

c) Recetas papel de varios grupos, sin diferenciar por tipo de aportación.
La receta de Campañas sanitarias, Síndrome Tóxico, Preparados individualizados antialérgicos, Vacunas bacterianas individualizadas, Fórmulas magistrales y Preparados oficinales, Productos dietéticos financiables, Productos sin cupón precinto y con visado de inspección, se presentarán por separado para cada Oficina de Farmacia, en cajas especialmente acondicionadas para contener 500 a 1.000 recetas, unidas por grupos de 25 y de forma que no puedan desordenarse en relación con la factura.
Podrán presentarse en una misma caja las recetas de varias oficinas de farmacia siempre que vayan identificadas las Oficinas de farmacia en el exterior y debidamente separadas las recetas de cada una de ellas en el interior de la caja.
Las cajas llevarán adherida la siguiente etiqueta:

d) Documentos de Facturación de recetas electrónicas.
En tanto se mantengan los cupones precintos como comprobantes de la dispensación estos se recogerán en los DF que se remitirán mensualmente por los Colegios Oficiales de Farmacéuticos de Ceuta y de Melilla a las respectivas Direcciones Territoriales, y ordenados correlativamente por su código en sobres y/o cajas correspondientes a cada oficina de farmacia, en grupos de 25, de forma que no puedan desordenarse en relación con la factura, en cada sobre y/o caja se incluirán los DF dispensados cada mes.
Las cajas llevarán adherida la siguiente etiqueta:

e) Documentos de Facturación de recetas electrónicas de estupefacientes. La etiqueta de las cajas con los DF de estupefacientes contendrá la siguiente información:

3.2 Presentación de las facturas.
Las facturas resumen (Modelos 3 y 4) se presentarán, en la Dirección Territorial del INGESA el día 10 del mes siguiente al que corresponde la facturación. Si el día 10 fuera inhábil, se entenderá como día de entrega el siguiente día hábil. Las facturas resumen mensual también se presentarán en formato Excel y se acompañarán del Informe de la Escala conjunta de deducciones previsto en el Real Decreto 1193/2011, de 19 de agosto, por el que se establece el procedimiento de aplicación de la escala conjunta de deducciones a la facturación mensual de cada oficina de farmacia (Modelo 5).
3.3 Presentación de los ficheros informáticos.
Los CCOOFF entregarán, los ficheros correspondientes, en las dependencias señaladas por las Direcciones Territoriales del INGESA a partir del día 10 del mes siguiente al que corresponda la facturación y hasta el día 20 del mismo. Si el día 20 fuera inhábil se entenderá como día de entrega el siguiente día hábil.
Para posibilitar al INGESA, de acuerdo con lo previsto en la normativa vigente, el envío de los datos de consumo de medicamentos y productos sanitarios en recetas oficiales al Ministerio de Sanidad, los CCOOFF presentarán además del fichero con todas las recetas facturadas incluyendo los productos dietoterápicos (IVA). Txt, otro fichero excluyendo dichos productos (IVA). Txt.
Devolución de los ficheros informáticos.
Con carácter previo al abono de la factura, el INGESA procederá a la comprobación de la información remitida por parte de los CCOOFF y los soportes informáticos generados en el proceso de facturación y analizará la calidad de la información contenida en los ficheros. El INGESA devolverán los que tengan deficiencias técnicas que impidan su tratamiento informático, y una explotación completa de la información, así como los que presenten diferencias con el total de la factura resumen (Total PVP y Líquido} superiores al 0,7 por diez mil y a 25 euros.
La devolución de los ficheros incorrectos, recibidos hasta el día 20, se efectuará hasta el día 30 del mismo mes. El fichero corregido, y si procediera nueva factura, se entregará por parte del Colegio, antes del día 5 del mes siguiente. Si se produjeran nuevas devoluciones, los ficheros deberán ser presentados correctamente y siempre antes del día fijado para la presentación de las recetas. La factura se pospondrá tantos días como el retraso se haya producido.
Si las Direcciones Territoriales del INGESA comprobaran en la facturación la falta de concordancia entre los datos referentes al médico y el número de receta, grabados en el fichero y los que consten en las correspondientes recetas, debidos a errores de digitación, se notificarán a la Comisión Central que podrá acordar, en caso de errores en tres facturaciones consecutivas o cinco alternas, devolver a los CCOOFF los mencionados soportes informáticos para subsanar los errores detectados, acompañándose de las correspondientes recetas.
3.4 Presentación de imágenes de las recetas y de los DF.
3.4.1 Los CCOOFF presentaran a las Direcciones Territoriales del INGESA los soportes electrónicos con las imágenes de las recetas junto con los originales de las recetas, que en el término previsto en el Punto 3.1 del presente anexo, se presentan hasta el día 10 del mes siguiente al que corresponde la presentación de la factura o el día siguiente hábil, si el día 10 fuera inhábil.
Los soportes electrónicos con las imágenes de las recetas se presentarán con un programa que permita su visualización.
La imagen digital de la receta no podrá suplir a la receta original a efectos de pago de la misma, salvo en el supuesto de disponer de la imagen digital pero no estar recibida la receta en caso de extravío o fuerza mayor, incluyendo robos o cualquier otro siniestro cuya responsabilidad no sea imputable a los CCOOFF, que deberá ser comunicado y acreditado a las Direcciones Territoriales del INGESA con la suficiente antelación. No obstante, la imagen digital de la receta podrá dar soporte a las Comisiones territoriales a efectos de devolución de recetas por estar incursas en cualquiera de las causas de nulidad recogidas en este Convenio.
3.4.2 Además de lo anteriormente expuesto, los CCOOFF, presentarán a las Direcciones Territoriales del INGESA los soportes electrónicos con las imágenes de los DF de las recetas electrónicas junto con los DF originales, que se ajustarán a lo anteriormente dispuesto para las imágenes de las recetas en formato papel. En cualquiera de los casos el proceso de digitalización cumplirá los requerimientos técnicos del INGESA para su posterior tratamiento.
Para la digitalización de los DF los CCOOFF realizaran los siguientes procesos:
a) Digitalización de los DF mensuales de facturación de las Oficinas de farmacia. Cada DF se digitalizará, uno por uno, conforme a una metodología que incluya control de calidad. El producto final será una copia fiel al original, posibilitando que en la edición digital se mantengan las características de los originales impresos
b) Se entregará al INGESA un DVD según estándar ISO9660 con la siguiente información:
– Los DF digitalizados: Se guardarán en formato TIFF Grupo IV ISO 12639 en blanco y negro a una resolución de 200 dpi (puntos por pulgada).
– Fichero en formato CSV: Contendrá una cabecera y una fila con la información correspondiente a cada DF digitalizado. Cada fila contendrá los siguientes campos: Código de la Ciudad, Código de Farmacia, Número de DF y Código de medicamento de la posición 1 a la 24. Se dejarán en blanco las posiciones que no tengan cupón precinto y se indicará la palabra error si la lectura de esa posición fuera errónea.
– Documento Word: Con la información del número de DF digitalizados.
3.4.3 El pago correspondiente a la digitalización de los DF se llevará a efecto en la facturación mensual correspondiente. Si se detectasen errores en la digitalización se procederá a la devolución de los soportes para su subsanación. Los CCOOFF enviaran mensualmente a las Direcciones Territoriales del INGESA un certificado de la veracidad de las imágenes digitalizadas con los correspondientes originales de las recetas y de los DF (modelo 13).
4. Revisión de la facturación
4.1 Revisión de las recetas.
Las Direcciones Territoriales comprobarán la facturación presentada por los CCOOFF y las diferencias por las causas de nulidad tipificadas en este Convenio que puedan surgir como resultado de esta comprobación, se determinarán a nivel de Oficina de Farmacia y se comunicarán al respectivo Colegio dentro de los cuatro meses siguientes a la ultimación de la entrega de recetas y de las facturas individuales. Excepcionalmente, se podrá prolongar dicho período, previo acuerdo de la Comisión Central de seguimiento, vigilancia y control.
Los CCOOFF dispondrán del mismo período de tiempo para poner en conocimiento de las correspondientes Direcciones Provinciales posibles errores detectados en la facturación.
4.2 Procedimiento de devolución.
A efectos de devolución, se diferenciarán las recetas y los DF como incursas en causa de nulidad absoluta, nulidad del margen de beneficio profesional, nulidad parcial, recetas subsanables y errores de facturación (Modelo 12).
4.2.1 Nulidad absoluta.
Las recetas y DF incursos en causa de nulidad absoluta, serán estampilladas con la leyenda «NULA», con la que se inutilizará tanto la receta y DF como los cupones-precinto, etiquetas autoadhesivas o sellos adheridos a la misma, así como los comprobantes de dispensación si los hubiera.
Los originales de las recetas y DF quedarán en poder del INGESA, enviándose fotocopia de anverso y reverso sellada y compulsada, al correspondiente Colegio Oficial de Farmacéuticos. Los CCOOFF podrán solicitar vista de los originales de dichas recetas y DF.
En este supuesto de nulidad de recetas y DF y si por algún farmacéutico titular de Oficina de Farmacia, en un plazo de 20 días, contado desde la devolución de las recetas al Colegio, se solicitase, a través del respectivo Colegio, a la Comisión Territorial, le serán devueltos los originales de sus recetas nulas, una vez hayan sido realizadas las comprobaciones necesarias por la Dirección Territorial del INGESA.
4.2.2 Nulidad del margen de beneficio profesional.
Las recetas y DF incursos en causa de nulidad del margen de beneficio profesional, serán estampilladas con la leyenda «NULA MARGEN», con la que se inutilizará tanto la receta y DF como los cupones-precinto, etiquetas autoadhesivas o sellos adheridos a la misma, así como los comprobantes de dispensación si los hubiera.
En las recetas incursas en este tipo de devolución, tanto de medicamentos, como de productos sanitarios y productos dietéticos financiables se descontará al PVP facturado según el Nomenclátor Oficial de la prestación farmacéutica del SNS, el margen de beneficio profesional legalmente establecido para las dispensaciones al público de medicamentos de uso humano. También se tendrá en cuenta minorar los importes correspondientes a los descuentos aplicados a la receta incursa en causa de nulidad del margen, calculados de la misma manera que en las incursas en nulidad total.
En el caso de devolución de recetas de fórmulas magistrales se descontará la parte correspondiente a los honorarios profesionales que se fijan en el punto 8-4.3 del anexo B. (Fijación de Honorarios profesionales).
Los originales de las recetas quedarán en poder del INGESA, enviándose fotocopia de anverso y reverso sellada y compulsada, al Colegio Oficial de Farmacéuticos correspondiente.
Los CCOOFF tendrán acceso a esta documentación y podrán solicitar vista de los originales de dichas recetas, que deberán ser conservadas en el caso de interponerse la oportuna reclamación hasta que haya adquirido firmeza tanto en vía administrativa como judicial.
4.2.3 Nulidad parcial.
Las recetas y DF incursas en causa de nulidad parcial, serán estampilladas con la leyenda «NULA PARCIAL», con la que se inutilizará tanto la receta como los cupones-precinto, etiquetas autoadhesivas o sellos adheridos a la misma, así como los comprobantes de dispensación si los hubiera.
Los originales de las recetas quedarán en poder del INGESA, enviándose fotocopia de anverso y reverso sellada y compulsada, al Colegio Oficial de Farmacéuticos correspondiente.
Los CCOOFF tendrán acceso a esta documentación y podrán solicitar vista de los originales de dichas recetas, que deberán ser conservadas en el caso de interponerse la oportuna reclamación hasta que haya adquirido firmeza tanto en vía administrativa como judicial.
4.2.4 Recetas subsanables.
En las recetas y DF incursos en causas de devolución subsanables y que, por tanto, puedan ser recuperables, se procederá de la siguiente forma:
Se descontará de la factura el líquido correspondiente a las recetas incursas en causas de devolución subsanables, y se entregarán los originales al Colegio Oficial de Farmacéuticos correspondiente con el sello «NULA PROVISIONAL», tanto en la receta como en el cupón- precinto, sello y comprobante de dispensación.
Todas las recetas y DF devueltos por causas subsanables, serán nuevamente entregadas en la Dirección Territorial acompañados de la copia del Modelo 6 remitido a la Oficina de Farmacia, inexcusablemente, para su comprobación, en el plazo máximo de 60 días, a partir de la fecha de la devolución de las recetas al Colegio, con independencia de que haya podido ser subsanada la causa que motivó la devolución.
Las recetas y DF con la incidencia subsanada, y una vez verificadas las mismas, se abonarán en la siguiente factura, quedando en poder de la Dirección Provincial los originales de las recetas. No se grabará de nuevo ninguna receta subsanable.
4.2.5 Errores de facturación.
En general, se considerará que existe un error de facturación cuando, para una misma receta, se produzca falta de coincidencia en alguno de los datos en los diferentes documentos de facturación (facturas, soporte informático del fichero general, DVD de imágenes y recetas y DF originales).
Cuando se produzca una nulidad absoluta originada por errores de facturación, correspondiendo a recetas o DF inexistentes o recetas o DF ya facturados, el INGESA comunicará al Colegio Oficial de Farmacéuticos correspondiente el resultado de sus investigaciones, teniendo éste acceso a la documentación correspondiente, pudiendo solicitar cualquier comprobación complementaria en la forma y plazos que se establecen para la tramitación del resto de las diferencias detectadas.
4.3 Tramitación de las diferencias detectadas.
La correspondiente Dirección Territorial comunicará las diferencias observadas al respectivo Colegio Oficial de Farmacéuticos, remitiéndole conjuntamente con las fotocopias de las recetas incursas en causa de nulidad absoluta, nulidad margen beneficio profesional o nulidad parcial los modelos 7 y 8 convenientemente cumplimentados, y los originales de las recetas subsanables.
Los CCOOFF podrán objetar las diferencias detectadas en el plazo máximo de 20 días a partir de su conocimiento, para lo cual designarán los representantes que estimen oportunos a fin de que, en unión de los correspondientes de la Dirección Territorial, efectúen la comprobación de las facturas y recetas y/o DF de la Oficina de Farmacia afectada, en el plazo máximo de diez días contados desde la presentación de tales objeciones.
Una vez transcurrido el plazo fijado, la correspondiente Dirección Territorial procederá a abonar o deducir de la próxima facturación que se les presente el importe correspondiente a las diferencias no objetadas. En las que existan discrepancias, se someterán a informe de la Comisión Territorial, que habrá de dictaminar en el plazo máximo de dos meses desde la comunicación de las mismas a la Comisión.
Si transcurrido el plazo no hubiera acuerdo entre las representaciones, se procederá a descontar las cantidades en litigio de la siguiente facturación, independientemente de que se eleve la discrepancia a la Comisión Central que emitirá su informe en el plazo de seis meses desde su recepción en la Secretaría de esta Comisión. En caso de sobrepasar este plazo, se abonarán los intereses legales fijados por la ley de Presupuestos Generales del Estado, de aplicación, cuando la resolución resulte favorable al farmacéutico, computados desde la fecha de retención de su importe.
Cuando el criterio defendido por los CCOOFF fuera aceptado en todo o en parte por la Comisión Central, la Dirección Territorial procederá a abonar las recetas en litigio en la siguiente facturación con los intereses correspondientes, si procede, según lo especificado en el párrafo anterior.
Las Direcciones Territoriales del INGESA conservarán las recetas y DF, ordenadas por farmacias, para efectuar las oportunas comprobaciones y al menos durante el plazo fijado en el punto 4.1.
En cuanto a las recetas objeto de litigio por haber sido apreciadas en ellas diferencias, serán conservadas por la Dirección Territorial hasta que se resuelva lo que corresponda.
En todas las comprobaciones a efectuar en relación con las recetas en que se hayan observado diferencias, podrán utilizarse los originales de las recetas devueltas que obrarán en poder de la Dirección Territorial.
Las Comisiones Territoriales de seguimiento, vigilancia y control remitirán los originales de las recetas y DF que deban ser estudiados por la Comisión Central, salvo en aquellos casos en que se trate de un número excesivo de recetas en los que será suficiente remitir una muestra representativa de las mismas.
4.4 Revisión del fichero de facturación.
El importe correspondiente a las dispensaciones de productos no incluidos en Nomenclátor, o a precio distinto al que figure en el Nomenclátor Oficial de Productos Farmacéuticos del SNS, una vez realizadas las comprobaciones informáticas pertinentes, se ajustará en la facturación correspondiente al mes siguiente, adjuntando en todo caso la Dirección Territorial fotocopia del listado de rechaces de las Oficinas de Farmacia incursas en éstos.
En los casos que sea necesario conocer la fecha de dispensación para determinar la procedencia o no de la devolución, podrá ser solicitada la presentación de fotocopia de la receta o recetas afectadas.
Cuando los rechaces se produzcan por diferente aportación a la legalmente establecida, podrá procederse al ajuste de las cantidades indebidamente facturadas, de igual forma que la establecida para los productos no incluidos en el citado Nomenclátor.
Relación de modelos de documentos contemplados en este anexo.
Modelo 1. Etiquetas adhesivas.
Modelo 2. Factura individual por Oficina de Farmacia.
Modelo 3. Factura resumen de todas las Oficinas de Farmacia del ámbito territorial.
Modelo 4. Factura resumen General por grupos de facturación.
Modelo 5. Informe resumen de deducciones del Real Decreto 1193/2011, de 19 de agosto, por el que se establece el procedimiento de aplicación de la escala conjunta de deducciones a la facturación mensual de cada oficina de farmacia.
Modelo 6. Diferencias en la facturación por Oficina de Farmacia.
Modelo 7. Diferencias en la facturación sometidas a la Comisión territorial.
Modelo 8. Diferencias en la facturación acordadas por la Comisión territorial.
Modelo 9. Acta de recepción de recetas y documentos de facturación (DF).
Modelo 10. Documento justificante de dispensación de receta electrónica.
Modelo 11. Documento justificante de dispensación de receta electrónica de estupefacientes.
Modelo 12. Claves de causas de las diferencias.
Modelo 13. Certificado veracidad de imágenes con documentos originales.



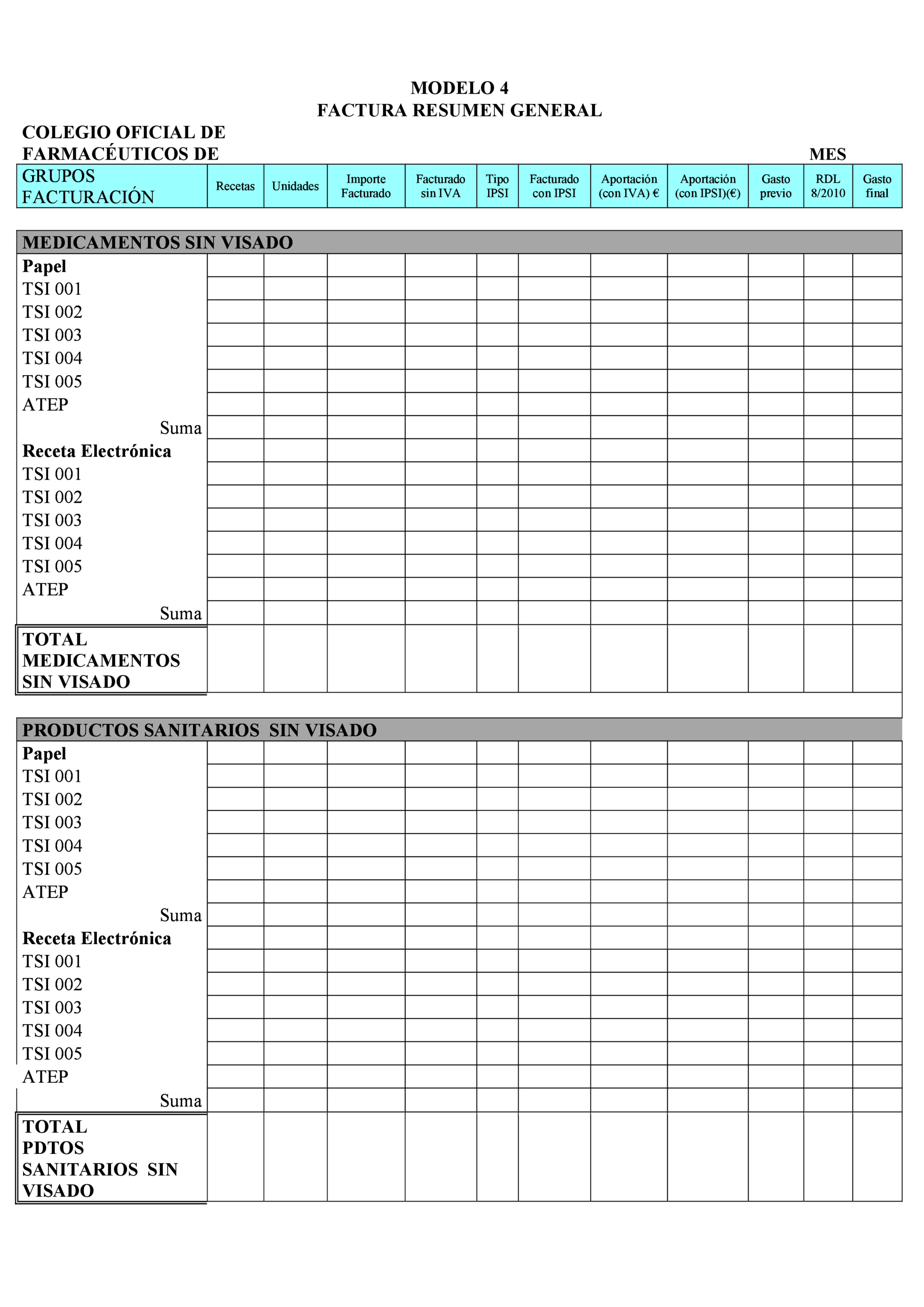








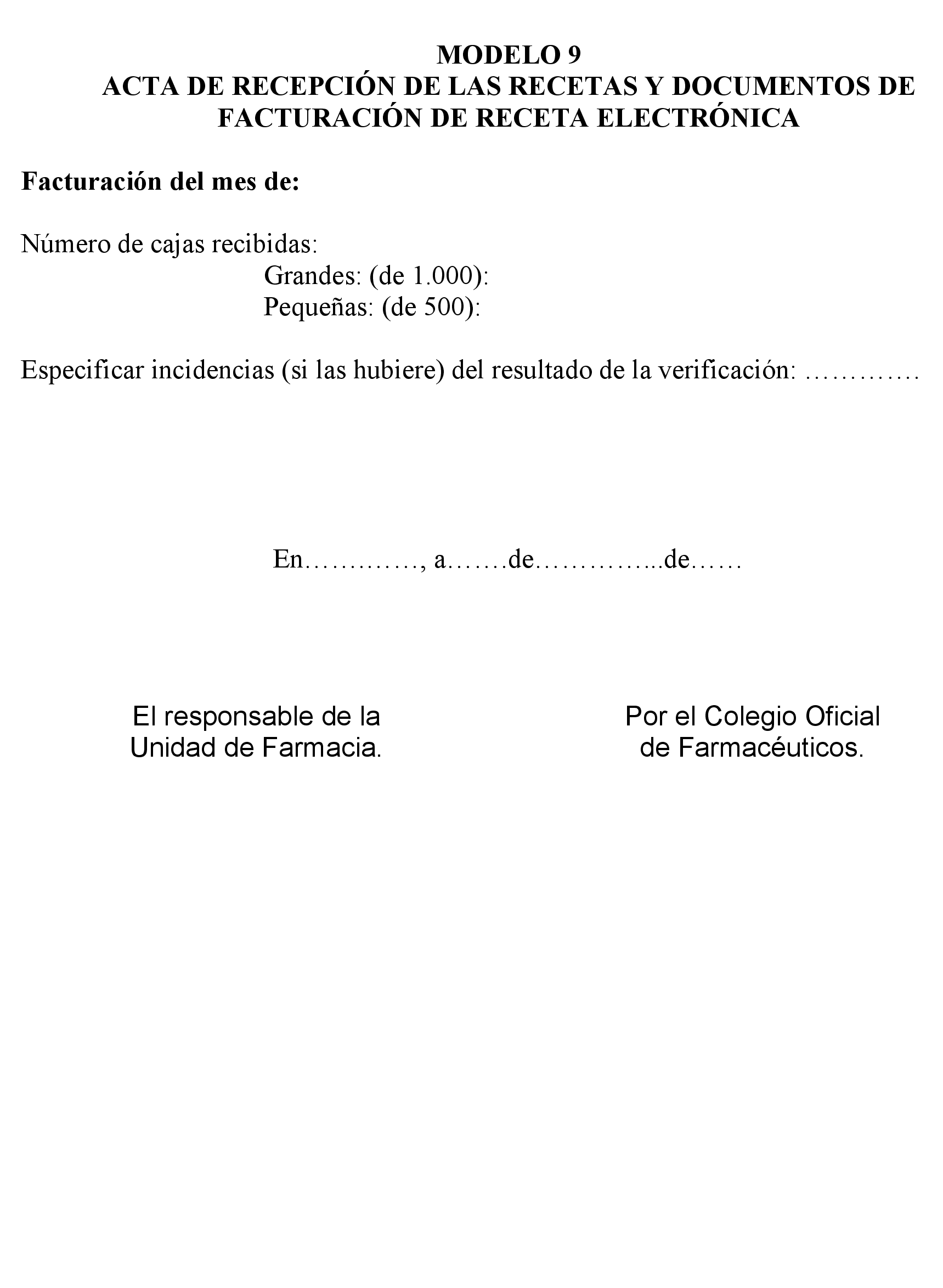




Las facturas resumen mensuales (anexos III y IV del anexo de facturación), se presentarán, en las Direcciones Territoriales del INGESA el día 10 del mes siguiente al que corresponda la facturación. Si dicho día 10 fuera inhábil, se entenderá como día de entrega el siguiente día hábil. Solamente, en casos excepcionales y plenamente justificados, se admitirán retrasos en su presentación, que lógicamente trascenderán en igual medida a su pago, ya que, de otra forma, estas facturas serán incluidas en el proceso del mes siguiente.
Los soportes informáticos, con las características que se señalan en el anexo C, se deberán presentar a partir del día 10 y hasta el día 20 del mes siguiente al que corresponda la facturación. Si el día 20 fuera inhábil, se entenderá como día de entrega el siguiente día hábil.
Si no se presentaran los soportes informáticos dentro de los plazos señalados en el anexo C, la fecha de pago del mes siguiente se retrasará en la misma medida.
Las Direcciones Territoriales del INGESA notificarán mensualmente, a la Tesorería General de la Seguridad Social el día de presentación de la factura mensual, y el documento contable con el importe de la misma, tras los ajustes por las diferencias contempladas en el punto 4.3 del anexo C.
La Tesorería General de la Seguridad Social, cursará órdenes de pago, hasta el día 20 inclusive de cada mes, para el abono a cada Colegio Oficial de su correspondiente factura, en la cuenta que previamente hubieran señalado éstos, siempre que se hayan recibido en tiempo y forma y resulten validados los correspondientes documentos presupuestarios.
Si el día 20 fuera inhábil, se cursará orden de pago el primer día hábil siguiente al día 20.
El pago de las facturas queda condicionado a la entrega de las recetas al INGESA y de los ficheros informáticos de facturación que constituyen los justificantes de pago.
Los soportes informáticos tienen la consideración de elemento técnico equivalente a la factura individual de cada Oficina de Farmacia e imprescindible para la comprobación de las facturas resumen (anexos III y IV) entregadas por los CCOOFF.
El pago de la factura resumen a que se refieren los apartados anteriores, se entenderá realizado como «liquidación provisional», estando, por tanto, a resultas de los importes que se obtengan del tratamiento y comprobación de la información, en la forma y condiciones dispuestas en el anexo de facturación, así como de la entrega de las recetas al INGESA.
En el caso de que los ficheros de facturación y/o facturas resumen sean devueltos por resultar con defectos técnicos o no validados entre sí, deberán ser reenviados en los plazos establecidos en el anexo C. En caso contrario, la fecha de pago del mes siguiente se pospondrá un mes y siempre que para dicha fecha se encuentren debidamente corregidos y validados.
Generalidades
La recogida y tratamiento de datos de carácter personal que se realicen en la ejecución de la prestación farmacéutica objeto de este Convenio, para el Concierto por el que se fijan las condiciones para la ejecución de la prestación farmacéutica a través de las oficinas de farmacia de Ceuta y Melilla, deberá adecuarse a la normativa vigente en materia de seguridad y protección de datos personales y, en concreto, en el Reglamento UE 2016/679 de 27 de abril de 2016 relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos y por el que se deroga la Directiva 95/46/CE (Reglamento general de protección de datos); la Ley Orgánica 3/2018, de 5 de diciembre, de Protección de Datos Personales y garantía de los derechos digitales y la Ley 41/2002, de 14 de noviembre, básica reguladora de la autonomía del paciente y de derechos y obligaciones en materia de información y documentación clínica.
1. Objeto del tratamiento
Mediante el presente anexo se regulan las obligaciones de INGESA, los CCOOFF, y el CGCOF como responsables del tratamiento de los datos de carácter personal necesarios para prestar el servicio de dispensación en las oficinas de farmacia de medicamentos financiados por el INGESA en virtud de este Convenio y su facturación. En este marco, los tratamientos de los datos del paciente, recogidos en la recetas, se limitarán a los tratamientos necesarios para poder cumplir con las funciones atribuidas por RD 1718/2010, de 17 de diciembre sobre receta médica y ordenes de dispensación, y resto de normativa de aplicación, como los procesos de facturación, el bloqueo de una determinada prescripción cuando se aprecie la existencia de error manifiesto en la prescripción, inadecuación de ésta a la medicación concomitante, alerta de seguridad reciente o cualquier otro motivo que pueda suponer un riesgo grave y evidente para la salud del paciente; la sustitución de medicamento o la interactuación en el sistema autonómico de salud con el médico prescriptor y resto del equipo multidisciplinar de salud.
2. Identificación de la información afectada
Para la ejecución de las prestaciones derivadas del cumplimiento del presente Convenio, las Partes accederán y tratarán la información personal, contenida en las recetas de los medicamentos, que se describe a continuación:
– Datos identificativos de pacientes (Códigos de identificación, nombre, apellidos, fecha de nacimiento, tipo de aportación)
– Información relativa a los medicamentos prescritos al paciente.
– Datos identificativos de médicos (Códigos de identificación, nombre y apellidos)
– Situaciones especiales requeridas para la facturación.
3. Obligaciones en materia de protección de datos
Las Partes y todo su personal se obligan a dar cumplimiento a las exigencias establecidas en la normativa vigente en materia de protección de datos, a título enunciativo.
– Utilizar los datos personales objeto de tratamiento, en el marco del presente Convenio y de las funciones y competencias que tienen atribuidas conforme a la normativa vigente.
– No comunicar los datos a terceras personas, salvo en los supuestos legalmente admisibles.
– Mantener el deber de secreto respecto a los datos de carácter personal a los que haya tenido acceso en virtud de este Convenio, incluso después de que finalice su objeto.
– Garantizar que las personas autorizadas para tratar datos personales se comprometan, de forma expresa y por escrito, a respetar la confidencialidad y a cumplir las medidas de seguridad correspondientes, de las que hay que informarles convenientemente.
Cuando las personas afectadas ejerzan los derechos en materia de protección de datos derivados de los tratamientos objeto del presente Convenio, las Partes se comprometen a colaborar para su adecuada atención.
4. Notificación de violaciones de la seguridad de los datos
Cada Parte notificará a la otra Parte sin dilación indebida, y en cualquier caso antes del plazo máximo de 24 horas, las violaciones de la seguridad de los datos personales a su cargo de las que tenga conocimiento, juntamente con toda la información relevante sobre la incidencia.
No será necesaria la notificación cuando sea improbable que dicha violación de la seguridad constituya un riesgo para los derechos y las libertades de las personas físicas. Si se dispone de ella se facilitará, como mínimo, la información siguiente:
– Descripción de la naturaleza de la violación de la seguridad de los datos personales, inclusive, cuando sea posible, las categorías y el número aproximado de interesados afectados, y las categorías y el número aproximado de registros de datos personales afectados.
– El nombre y los datos de contacto del delegado de protección de datos o de otro punto de contacto en el que pueda obtenerse más información.
– Descripción de las posibles consecuencias de la violación de la seguridad de los datos personales.
– Descripción de las medidas adoptadas o propuestas para poner remedio a la violación de la seguridad de los datos personales, incluyendo, si procede, las medidas adoptadas para mitigar los posibles efectos negativos.
Si no es posible facilitar la información simultáneamente, y en la medida en que no lo sea, la información se facilitará de manera gradual sin dilación indebida. Corresponderá, en cualquier caso, a la Parte que haya sufrido la violación de la seguridad de los datos su comunicación a la autoridad de Protección de Datos y al interesado.
En caso de ser preciso, las Partes colaborarán en la realización de las evaluaciones de impacto relativas a la protección de datos, cuando proceda, poniendo a disposición de las otras Partes toda la información necesaria para demostrar el cumplimiento de sus obligaciones. Los delegados de protección de datos son los siguientes:
Por INGESA: Subdirección General de Gestión Económica y de Recursos Humanos, Instituto Nacional de Gestión Sanitaria, Dirección: Calle Alcalá, 56, 28071 Madrid. Correo electrónico: direccion.ingesa@ingesa.sanidad.gob.es
Por el CGCOF: Departamento de Protección de Datos, Consejo General de Colegios Oficiales de Farmacéuticos, Dirección: Calle Villanueva, 11, 28001 Madrid. Correo electrónico: dpoprotecciondatos@redfarma.org
5. Ejercicio de derechos de los interesados
Los derechos de los interesados, reconocidos en los artículos 15 al 22 del Reglamento (UE) 2016/678 de 27 de abril de 2016 relativo a la protección de las personas físicas en lo que respecta al tratamiento de datos personales y a la libre circulación de estos datos, podrán ejercerse directamente o por medio de representante legal o voluntario. Los corresponsables acuerdan que los interesados podrán ejercer los derechos establecidos en la normativa de protección de datos personales, relativos a los tratamientos objeto de este acuerdo, ante cualquiera de los corresponsables.
Se podrán dirigir a:
– INGESA: direccion.ingesa@ingesa.sanidad.gob.es
– Consejo General de Colegios Oficiales de Farmacéuticos: congral@redfarma.org
– Colegio Oficial de Farmacéuticos de Ceuta: cofceuta@redfarma.org
– Colegio Oficial de Farmacéuticos de Melilla: cofmelilla@redfarma.org
Agencia Estatal Boletín Oficial del Estado
Avda. de Manoteras, 54 - 28050 Madrid